حُثعشلا حُطازقوَذلا حَزئاشجلا حَرىهوجلا
République Algérienne Démocratique et Populaire
ٍولعلا ثحثلاو ٍلاعلا نُلعرلا جراسو
Ministère de l’Enseignement Supérieur et de la Recherche Scientifique
ٌداىلا زصخل َوح ذُهشلا حعهاج
Université Echahid Hamma Lakhdar -El OUED
جاُحلاو حعُثطلا مىلع حُلم
Faculté des Sciences de la Nature et de la Vie
حَىلخلاو حُئشجلا اُجىلىُثلا نسق
Département de biologie Cellulaire et Moléculaire
MEMOIRE DE FIN D’ETUDE
En vue de l’obtention du diplôme de Master Académique en Sciences biologiques
Spécialité : Biochimie appliquée
THEME
Présentés Par : Melle CHAABANE Nadjah Mme LATRECHE Ouidad
Devant le jury composé de :
Président: Mr. SAADI Hamza M.A.A, Université d'El Oued Examinateur: Mme LAOUFI Hayatte M.A.A, Université d'El Oued Promoteur: Mme MEDILA Ifriquia M.C.A, Université d'El Oued
Année universitaire 2019/2020
Etude in vitro de l’activité biologique de
Daucus carota L.
اهلم ءاوسلأا ََلو بازذ يه مدا قلخ ٌٌذلا لله ذوحلا
اهُفاهو اًُذلا يه زُخ كاضر اهًُادو اهُصاق سفٌٌلا ئراتاَ اهققحذ هاهآ سفٌلل سُلف اهًُاعه ًوس اذف كاضرلاإ ٍلؤساَ لٌه جزظٌف اهُفاهو اًُذلا يه ٍل زُخ ٍلهأاَو هاقف نلعلل ٍىعذَ ٍحىلات َتر ةطاخ يه ًلع ملاسلاو جلاصلاو ًلعلأا لتر نسات أزقا الله هىسراَ ٌذُس يوحزلا حنئلاه لُلع دلص ىاىملاا زئاس ءاُضلا يزسو دعلط اول ادوشه دىجىلا ىازقلا حَارو َللإا ًوحتDédicace
Je dédie ce modeste travail à:
À la prunelle de mes yeux, la lumière de ma vie, l’homme de ma vie, mon exemple
éternel, mon soutien moral et source de joie et de bonheur, celui qui s’est toujours
sacrifié pour me voir réussir, que dieu te garde dans son vaste paradis ; à toi mon père
Hamed.
A la lumière de mes jours, la source de mes efforts, la flamme de mon cœur, la lumière à
mes yeux ma vie et mon bonheur, A ce bel ange qui fleurit les jardins du ciel sous ses
pieds, Oh mon Dieu, sauve ma mère, car elle est le paradis dans mon cœur ; maman
FRIDJET Hania.
A toutes mes cher frère : Khaled, Ali, Abdelmoneim et mes sœurs : Fatima, Zohra,
Samira, Ouahida, Siham, Kheira, Fadjra et leurs enfants.
À mes sœurs, qui n'ont pas donné naissance à ma mère, Oui, les copines ont été une
source de soutien pour moi tout au long de ce projet : HEZLA Naoual, AHMIM
Samia.
A tous mes chers amis.
A mes amies que j’ai vécu avec elles des beaux moments au cours de mon cursus à
l’université: Sara,Ouafa, Hadda, Sara, Mabrouka, Iman, Maroua, Achouak, Basma,
Afaf, Rahma, Hadjer, Loubnab.
A tous les étudiants de ma promotion de 2
émeannée master biochimie appliquée.
Sans oublier mon binôme: Ouidad.
A tous mes collégues au travail en particulier: DOUYEMI Attiya. Il m’a toujours
soutenu, oui, ami et frère, que dieu te garde.
Dédicace
C'est avec grande plaisir que je dédie ce modeste travail :
A l'être le plus cher de ma vie, ma mère.
A celui qui m'a fait de moi une femme, mon père.
À Mes chers Frères et Sœurs.
A Mon époux BEN AMOR Ammar et mon baby.
A tous mes amis de promotion de 2
émeannée Master Biochimie appliquée, toute
personne qui occupe une place dans mon cœur.
À tous les membres de ma famille et toute personne qui porte le nom Latreche, je
dédie ce travail à tous ceux qui ont participé à ma réussite surtout mon enseignant
LOTFI Oudini.
À Tous mes amis surtout Ma binôme CHAABANE Nadjah, OUINNISSI
Fatima, BADERDINE Maroua, GHARBI Imane.
Remerciements
Nous tenons à remercier en premier lieu ALLAH, le tout Puissant de nous avoir
donné courage, santé et patience pour achever ce travail.
Deuxièmement, après Dieu, nous exprimons notre gratitude à ceux qui ont été la
raison de notre existence dans ce monde à nos parents, qui sont notre source constante
de soutien, qui ont travaillé dur pour atteindre ce point de notre chemin de vie. Même
les remerciements ne leur suffisent pas pour faire valoir leurs droits.
À notre promotrice de mémoire, M
meMEDILA ifriqya,
maître de conférence A la
faculté des sciences de la nature et de la vie -Université d'El Oued,
pour qui nous a
fait l’honneur d’accepter la présidence de cette mémoire. Hommage respectueux
Nous tenons à remercier profondément GOUBI Sana et KHANOUFA Omar. En
particulier GOUBI,
membres du laboratoire de la faculté des sciences de la nature et
de la vie, Université Echahid HAMMA LAKHDAR, El-Oued., pour l'attention et
l’aide qu'elle a porté à ce travail, son support, votre gentillesse et ses encouragements.
Nous vous adressons nos profondes reconnaissances pour vos remarques et conseils en
vue d’améliorer ce manuscrit. Nos remerciements s’adressent aussi à tous les
travailleurs du laboratoire.
Un grand merci à toutes frères, sœurs, les amis et les personnes qui nous ont
apportées leurs soutiens et leurs aides ainsi qu’a toutes l’équipe ils nous ont aidés dans
le travail de laboratoire afin d’obtenir des bons résultats.
Nous tenons à remercier profondément a tous ceux qui ont contribué avec nous et
nous ont soutenus dans ce travail de loin ou de près.
Finalement, nous tenons à exprimer notre profonde gratitude, Université
Echahid HAMMA LAKHDAR, El-Oued., qui nous contenait jusqu’à ce que nous
atteignions ce point.
Résume
La plante de carotte est caractérisée par leur mode d’adaptation particulier à l’environnement. Certaines espèces possèdent des propriétés pharmacologiques qui leur confèrent un intérêt médicinal. En Algérie, on cherche à mieux connaître le patrimoine des espèces spontanées utilisées en médecine traditionnelle ainsi que leurs principes actifs. C’est dans ce contexte, l’objectif visé par notre étude consiste en l’étude phytochimique, et l’investigation des activités antioxydant et antibactérienne des trois extraits aqueux, éthanolïques et éthérique de partie aérienne (les graines) de plante de carotte, Daucus carota L. Les graines de cette plante ont subis une extraction par macération (l’eau, l’éthanol et l’éther) pour obtenir les extraits ; aqueux, éthanolique et éthérique. Le rendement d'extraction est d'environ 13.22%, 11.99% et 11.007% respectivement.
À travers cette étude, nous avons mis en évidence l’existence des flavonoïdes, des polyphénoles, des tanins, des alcaloïdes, des polytérpene et stérol dans cette plante. Les teneurs en polyphénols sont plus élevées dans l’extrait éthanolique (1024.6 ± 49.8 µg EAG/g ES) par rapport aux autres extraits aqueux et éthérique (1015.1 ± 10.9, 820.77 ± 12.33 µg EAG/g ES) respectivement. Cependant, les teneurs en flavonoïdes, sont très important dans cette espèce dans les différents extraits, le teneur le plus élevé est enregistré pour l’extrait éthanolique (858.95 ± 12.33 µg/mg ES) suivie par l’extrait aqueux (824.37 ± 3.05µg/mg ES) et l’extrait éthérique (655.55 ± 8.81µg/mg ES). L’activité antioxydante par la méthode de DPPH est plus importante pour l’extrait éthérique avec une valeur de IC50 de (41.677 ± 0.577 μg/ml) suivi par l’extrait
éthanolique (42.677 ± 1.528 μg/ml) et de l’extrait aqueux (85.00 ± 13.08 μg/ml). Ces trois extraits présentent une activité importante par rapport a l’acide ascorbique. En réduisant le fer (test de FRAP), c’est l’extrait éthanolique qui s’est révélé le plus actif (10.916 ± 0.219 mg/g ES) suivi par l’extrait aqueux (8.351 ± 0.225 mg/g ES) et l’extrait éthérique (7.6487 ± 0.894 mg/g ES). Le test de l’activité antibactérienne réalisé a montré que l’espèce Daucus carota L. n'a montré aucun effet antibactérien contre les souches bactériennes utilisése.
Mots clés: Daucus carota L., Extrait aqueux, Extrait éthanolique, Extrait éthérique, Activité antioxydante, Activité antibactérienne, Stress oxydatif, Métabolite secondaire.
Abstract
The carrot plant is characterized by their particular mode of adaptation to the environment. Some species have pharmacological properties, which make them of medicinal interest. In Algeria, we are trying to better understand the heritage of spontaneous species used in traditional medicine as well as their active ingredients. It is in this context the objective of our study consists of the phytochemical, antioxidant and antibacterial study of the three aqueous, ethanolic and ethereal extracts of the aerial part (the seeds) of the carrot plant. This is Daucus carota L., this plant has undergone an extraction by maceration in (water, ethanol and ether) to obtain the aqueous, ethanolic and ethereal extract. The extraction yield is approximately 13.22%, 11.99% and 11.007% respectively.
Through this study, we have demonstrated the existence of flavonoids, polyphenols, tannins, alkaloids, polyterpene and sterol in this plant. The polyphenol contents are higher in the ethanolic extract (1024.6 ± 49.8 µg EAG / g ES) compared to other aqueous and ethereal extracts (1015.1 ± 10.9, 820.77 ± 12.33 µg EAG / g ES) respectively. However, the flavonoid contents are very important in these species in the different extracts the higher content is recorded for the ethanolic extract (858.95 ± 12.33 µg / mg ES) followed by the aqueous extract (824.37 ± 3.05µg / mg ES) and (655.55 ± 8.81 µg / mg ES) for the ethereal extract. The antioxidant activity by the DPPH method is greater for the etheric extract with an IC50 value of 41.677 ± 0.577 μg / ml followed by the ethanolic extract (42.677 ± 1.528 μg / ml) and the aqueous extract (85.00 ± 13.08 μg / ml). These three extracts are very active compared to ascorbic acid. By reducing iron (FRAP test), it is the ethanolic extract which has been shown to be the most active in reducing iron (10.916 ± 0.219 mg / g ES) followed by the aqueous extract (8.351 ± 0.225 mg / g ES) and etheric extract (7.6487 ± 0.894 mg / g ES). The antibacterial activity test performed showed that Daucus carota L. species lacked the antibacterial effect against the bacterial strains used.
Keywords: Daucus carota L., Aqueous extract, ethanolic and ethereal, Antioxidant activity, Antibacterial activity, Oxidative stress, Secondary metabolite
صخله
زًٛخٚ سزجنا ثببَ ب ثار بٓهعجح تٛئأد ضئبظخ بٓن عإَلأا ضعب .تئٛبنا عي ؿٛكخنا ٙـ تطبخنا ّخمٚشط ٗنإ تـبضلإبب ٘ذٛهمخنا بطنا ٙـ تيذخخسًنا عإَلأا داشح مضـأ مكشب ىٓفَ ٌأ لٔبحَ ،شئازجنا ٙـ .تٛبط ةذئبـ ٍي بُخساسد ؾذْ ٌٕكخٚ ،قبٛسنا ازْ ٙـ .تنبعفنا بٓحبَٕكي نا ذ تساس تٛئبًٛٛكٕخٛفنا ٔ تٛطبشُنا نا دبضً ة لأن ةذسك هن ةدبضًنأ ثببٔشكًٛ لإأ ٙنَٕبزٚلإأ ٙئبًنا ثبظهخخسًهن زٚ ٛ ْٕ ازْ .سزجنا ثببَ ٍي )سٔزبنا( ٕ٘جنا ءزجهن ٘ش Daucus carota L. لان ثببُنا ازْ عضخ ذلٔ . صلاخخس عمُنا كٚشط ٍع ٙـ بًنا( ء لإأ لَٕبزٚلإأ شزٚ لٕظحهن ) خسًنا ٗهع لإأ ٙنَٕبزٚلإأ ٙئبًنا ضهخ ٚ دٔدشي ػهبٚ .٘شٛز صلاخخسلاا ٙنإح 13.22 ٔ ٪ 11.99 ٔ ٪ 11.007 ٪ .ٙنإخنا ٗهع ذَٕٕٚـلافنا ثببكشي دٕجٔ بُخبرأ تساسذنا ِزْ للاخ ٍي ثا لإُٛفٛنٕبنأ ث ٔ ثبَُٛبخنا همنأ ثاذٕٚ ٛنٕبنأ ُٛبشخ ثب لأشٛخسنأ ث ازْ ٙـ ثببُنا لإُٛفٛنٕبنا ثبٕٚخحي . ث ٗهعأ ( ٙنَٕبزٚلإا ضهخخسًنا ٙـ 1024.6 ± 49.8 واشؼٔشكٛي ا ضح ٍي ئـبكي ن كٛنبؽ / غ ضهخخسًنا ٍي )ؾبجنا أ تٛئبًنا ثبظهخخسًنبب تَسبمي ٚلإ تٚشٛز ( ٖشخلأا 1015.1 ± 10.9 ، 820.77 ± 12.33 واشؼٔشكٛي كٛنبؽنا ضًح ٍي / غ ضهخخسًنا ٍي )ؾبجنا ٗهع .ٙنإخنا عئ ،كنر ـلافنا ثبٕٚخحي ٌإـ ذَٕٕٚ ثا ٙـ اًذج تًٓي عُٕنا ازْ ٙـ ؿهخخي ذٛح ثبظهخخسًنا مٛجسح ىخٚ ٖٕخحي ٗهعأ ٙنَٕبزٚلإا ضهخخسًهن ( 858.95 ± 12.33 / ٍٛخٛسشٛكنا ٍي ئـبكي واشؼٔشكٛي ػي ضهخخسًنا ٍي ٙئبًنا ضهخخسًنبب بًعٕبخي )ؾبجنا ( 824.37 ± 3.05 ضهخخسًنا ٍي ػي / ٍٛخٛسشٛكنا ٍي ئـبكي واشؼٔشكٛي جنا ؾب ) ٔ ( 655.55 ± 8.81 / ٍٛخٛسشٛكنا ٍي ئـبكي واشؼٔشكٛي ػي ضهخخسًهن )ؾبجنا ضهخخسًنا ٍي ٘شٛزٚلإا . تمٚشط تطسإب ةذسكلأا ثادبضي طبشَ ٌٕكٚ سٔزجنا ظٛبزح ةشحنا ( DPPH ٘شٛرلأا ضهخخسًهن تبسُنبب شبكأ ) تًٛمب IC50 ػهبح ( 41.677 ± 0.577 مي / واشؼٔشكٛي ) ٚلإا ضهخخسًنبب بًعٕبخي ( ٙنَٕبز 42.677 ± 1.528 ٙئبًنا ضهخخسًنأ )مي / واشؼٔشكٛي ( 85.00 ± 13.08 ترلازنا ثبظهخخسًنا ِزْ .)مي / واشؼٔشكٛي طبشَ ثار اذج ىٓي سببخخا( ذٚذحنا مٛهمح كٚشط ٍع .كٛبسٕكسلأا ضًحب تَسبمي FRAP ،) ٙنَٕبزٚلإا ضهخخسًنا ٌأ جبر ذمـ ذٚذحنا مٛهمح ٙـ بًطبشَ شزكلأا ْٕ 10.916 ± 0.219 ػي / ؾبجنا ضهخخسًنا ٍي غ ٙئبًنا ضهخخسًنا ّٛهٚ 8.351 ± 0.225 ػي / غ ؾبجنا ضهخخسًنا ٍي ضهخخسًنأ ٘شٛزٚلإا 7.6487 ± 0.894 ػي / ؾبجنا ضهخخسًنا ٍي غ . بٚشٛخكبهن دبضًنا طبشُنا سببخخا شٓظأ ٌأ Daucus carota L ثلالاسنا ذض بٚشٛخكبهن دبضًنا شٛرأخنا ٗنإ شمخفح .تيذخخسًنا تٚشٛخكبنا خاولنلا حُحارفولا : ،سزجنا ضهخخسي ،ٙئبي ٙنَٕبزٚإ إٔ ٚ ٘شٛز ، طبشَ دبضي ةذسكلأن ، طبشَ دبضي بٚشٛخكبهن ، دبٓجلإا ٘ذسكأخنا ، نا لامخسً ب ثب نا َٕٚبز ت .Liste des abréviations
AlCl3 : Trichlorure d'aluminium EAq : Extrait aqueux
Cl: colure cm : centimètre
DMSO : Dimethyl sulfoxide
DPPH : 2,2-diphenyl-1-picrylhydrazyle
D.carota L.: Daucus carota L.
EtOH : Extrait hydro-alcoolique FeCl3: Chlorure de fer
FRAP: Ferric reducing antioxidant power
FV : Flavonoïdes H : Hydrogène H2O : eau
H2SO4 : Acide sulfurique HCl : Acide chlorhydrique IC 50 : Concentration inhibitrice 50 K: Potassium K3Fe : Ferricyanure de potassium M : molaire min : minute ml : millilitre Mo8O23 : Molybdénee Na: sodium Na2CO3 : Bicarbonate de sodium Nm : nanomètre
NS : différence Non Significative O2 : Oxygène
OH : hydroxyle
OMS : Organisation Mondiale de la Santé.
PEB : Poids de l’Extrait Brut PH : potentiel Hydrogène
PMV : Poids de matière végétale PP : Polyphénols
RL : Radical
SOD : Superoxide dismutase Tm : Température de
tr/min : Tour par minute UV : Ultraviolet
UV-Vis : UltraViolet-Visible. Vis : Visible
W8O23 : Oxydes bleus tungsténe °C : Degrés Celsius C
μg EAG/g MS : Microgramme d’équivalent d’acide gallique par gramme de extrait sec.
μg EQ/mg MS : Microgramme d’équivalent de quercétine par milligramme de extrait sec. μg EAA/mg MS : Microgramme d’équivalent d’acide ascorbique par millilitre de extrait.
mg EAA/µg MS : Milligramme d’équivalent d’acide ascorbique par gramme de extrait sec
Liste des figures
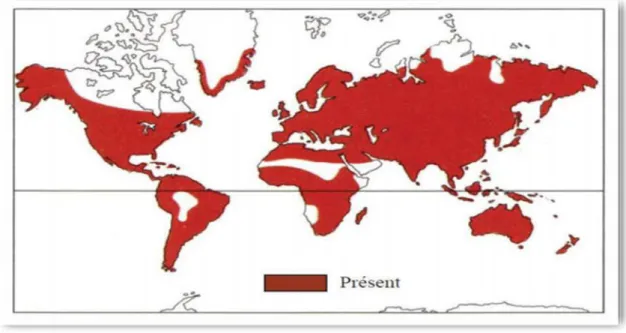
Figure 01: Répartition géographique mondiale des Apiaceae. ... 6
Figure 02: Les fleurs de Daucus carota.. ... 8
Figure 03: les graines de Daucus carota.. ... 9
Figure 04 : l’ombelle florale. ... 9
Figure 05: Structure de base des composés phénoliques. ... 14
Figure 06 : Différentes classes des composés phénoliques ... 15
Figure 07 : Structure de base des flavonoïdes ... 16
Figure 08: Structures chimiques des flavonoïdes. ... 16
Figure 09 : Structure chimique de quelques alcaloïdes. ... 17
Figure 10 : Structure générale de tanins condensés ... 19
Figure 11 : Structure générale de tanins hydrolysables. ... 19
Figure 12 : Structure chimique des coumarines. ... 22
Figure 13 : Structure de ramification des coumarines simples. ... 22
Figure 14 : Structure de ramification des coumarines complexes (A: 6,7 furocoumarines linéaire, B: 7,8 furocoumarines angulaire). ... 22
Figure 15: Classification des antioxydants. ... 26
Figure 16: Illustration de la méthode des aromatogrammes sur boîte de Pétri ... 29
Figure 17 : Les graines de l'espèce Daucus carota L. ... 32
Figure 18: Protocole de préparation de l'extrait aqueux, éthanol et éther de graines Daucus carota L... 35
Figure 19 : Protocole de dosage des polyphénols totaux ... 38
Figure 20 : Protocole de dosage des flavonoïdes. ... 39
Figure 21 : Mécanisme réactionnel intervenant lors du test DPPH• entre l’espèce radicalaire (DPPH•) et un antioxydant (AH). ... 40
Figure 22 : Protocole de dosage de l’activité antioxydants par le test DPPH. ... 41
Figure 23 : Réaction FRAP entre Fe3+-TPTZ et l’antioxydant. ... 41
Figure 24 : Protocole de détermination du pouvoir réducteur. ... 43
Figure 25 : Stérilisation les disques à L'autoclave. ... 45
Figure 26 : Protocole de détermination l’activité antibactérienne. ... 46 Figure 27 : Exemple sur le test phytochimiques des alcaloïdes et tanins des différents
Figure 28: Teneurs en polyphénols des différents extraits expérimentaux des graines
Daucus carota L... 51
Figure 29: Teneurs en flavonoïde des différents extraits expérimentaux des graines Daucus carota L... 52
Figure 30 : La décoloration de couleur violette qui vire vers le jaune de test de DPPH 53 Figure 31: IC50 de test DPPH des différents extraits expérimentaux des graines Daucus carota L.. ... 54
Figure 32: Teneurs en FRAP des différents extraits expérimentaux des graines Daucus carota L. ... 56
Figure 33: Courbe d’étalonnage pour le dosage des polyphénols. ... 85
Figure 33: Courbe d’étalonnage pour le dosage des flavonoïdes. ... 85
Figure 33: Courbe d’étalonnage pour le test de DPPH. ... 85
Liste des tableaux
Tableau 01 : Les noms de plante Daucus carota. ... 7 Tableau 02 : Classification systématique Daucus carota. ... 7 Tableau 03 : Différents composes de Daucus carota. ... 10 Tableau 04 : Rendement, couleur et aspect des extraits secs des graines Daucus carota
L. ... 49 Tableau 05 : Résultats des tests phytochimiques des trois extraits aqueux, éthanolique
et éthérique des graines Daucus carota L. ... 50 Tableau 06 : Teneurs en polyphénols (moyenne ± écart-type) dans les trois extraits
aqueux, éthanolïque et éthylique des graines Daucus carota L. ... 51 Tableau 07 : Teneurs en flavonoïdes (moyenne ± écart-type) dans les trois extraits
aqueux, éthanoïque et éthylique des graines Daucus carota L.. ... 52 Tableau 08: IC50 de l’extrait brut et l’acide ascorbique (moyenne ± écart-type) dans les
trois extraits aqueux, éthanoïque et éthylique des graines Daucus carota L. ... 54 Tableau 09 : L’activité réductrice du fer (moyenne ± écart-type) dans les trois extraits
aqueux, éthanolique et éthérique des graines Daucus carota L. ... 55 Tableau 10 : Etude de l’activité inhibitrice d’extraits de graine Daucus carota L. ... 57
Sommaire
Dédicace ... Remerciements ... Résume ... Liste des abréviations ... Liste des figures ... Liste des tableaux ... Sommaire ... Introduction générale ... 1-2
Première Partie : Etude Bibliographique Chapitre I : Généralité sur la plante étudiée
I.1.La famille des Apiaceae ... 5
I.2. Le plant Daucus carota ... 6
I.2.1. Le définitions et description botanique ... 6
I.2.2. Les noms de plante Daucus carota ... 7
I.2.3. Le répartition de Daucus carota ... 7
I.2.4. Le classification de la plante . ... 7
I.2.5. Le description morphologique et cycle de vie ... 8
I.2.6. Les composition chimique ... 10
I.2.7. L’utilisation traditionnelle de la plante ... 10
CHAPITRE II : Les métabolites secondaires et l'activité biologique I. Généralité sur les métabolites secondaires ... 13
I.1. Le définition des métabolites secondaires ... 13
I.2. Les classification des métabolites secondaires ... 13
I.2.1. Les composés phénoliques ... 13
I.2.2. Les flavonoïdes ... 16
I.2.3. Les alcaloïdes ... 17
I.2.4.Les tanins ... 18
I.2.5.Les huile essentielle ... 20
I.2.6. Les coumarines ... 21
II. Les activités biologiques ... 23
II.1. Les activités antioxydants... 23
II.1.2.Le stress oxydatif et les radicaux libres ... 23
II.1.3. L’activité antioxydante ... 25
II.1.3.1. L’antioxydants……….…25
II.1.3.1.1. Le classification des antioxydants………...……….25
II.2. L’activité antibactérienne ... 27
Deuxième partie: Etude expérimental CHAPITRE I : Matériels et Méthodes I.1 Les matériel... 32
I.1.1. Les matériel biologique ... 32
I.1.2. Les matériel de laboratoire ... 33
I.2. Les méthodes ... 34
I.2.1. Les préparation des différents extraits à partir des graines de Daucus carota L. (Extraction par macération) ... 34
I.2.2. Les tests phytochimiques ... 36
I.2.3. Les méthodes d’analyse quantitative de l'extraits ... 37
I.2.3.1. Les dosages de la composition phénolique……….…...37
I.2.4. L’évaluation de l’activité biologique ... 39
I.2.4.1. L’évaluation de l’activité antioxydants de l'extraits………..39
I.2.4.2. L’évaluation de l’activité antibactérienne de l'extraits………..43
I.2.5. Les analyses statistiques ... 47
CHAPITRE II : Résultats et discussion II.1. Résultats ... 49
II.1.1. Les rendements ... 49
II.1.2. Les tests phytochimiques ... 49
II.1.3. Les détermination des teneurs des composés phénoliques ... 50
II.1.4. L’évaluation de l’activité biologique... 53
II.1.4.1. L’évaluation de l’activité antioxydant de l'extraits…………..…………53
II.1.5.1. L’évaluation de l’activité antibactérienne de l’extraits ... 56
II. Discussion ... 58
Conclusion ... 63
Références bibliographique ... 66
Introduction générale
Depuis plusieurs années, l’utilisation des plantes médicinales ou des préparations à base des plantes connaît un succès croissant. Ainsi, d’après les estimations, 80% de la population mondiale dépend principalement de la médecine traditionnelle (OMS, 2012), (Jean et Jiri 1983). Elles jouent un rôle croissant dans la santé humaine. Environ 25% des médicaments d'ordonnances couramment utilisés proviennent de plantes médicinales traditionnellement utilisées (Chaouche et al., 2015).
En Algérie en général et au Sahara en particulier, l’état de la flore spontanée dans cette zone ainsi que les relations entre l’homme et les espèces végétales méritent une attention particulière. Certaines espèces possèdent des propriétés pharmacologiques qui leur confèrent un intérêt médicinal. Les plantes médicinales sont extrêmement nombreuses. En effet, les estimations indiquent que plus de 13000 espèces de plantes médicinales sont utilisées comme remèdes traditionnels par diverses cultures dans le monde entier (Chaouche et al., 2013). Ces plantes ont l’aptitude de synthétiser de nombreux composés appelés métabolites secondaires et constituent donc un immense réservoir de composés d’une grande diversité chimique, possédant un large éventail d’activités biologiques (Jean et Jiri, 1983). C’est le cas par exemple des polyphénols végétaux dont le principale qui sont largement utilisés en thérapeutique comme antimicrobiens, antioxydants et antihémolytiques. Avec d’autres catégories : les flavonoïdes, les huiles essentielles, les térpenoides et les alcaloïdes (Chaouche et al., 2015 et Yakhlef, 2010). L’étude de la chimie des plantes reste d’actualité malgré son ancienneté. Cela tient principalement du fait que le règne végétal représente une source d’une immense variété de molécules bioactives possédant un très large éventail d'activités biologiques (Ferrari, 2002).
Au cours des dernières années, des études sur les activités antioxydants des plantes médicinales ont augmenté de façon remarquable grâce à leur potentiel d’être utilisées en tant que sources d’antioxydants riches et naturelles (Chaouche et al., 2013, Hadduchi et al., 2014).
La thérapeutique des infections bactériennes se base principalement sur l’usage des antibiotiques produite du plant médicinal (Billing et Sherman, 1998). Les composes de plante qui portée cette activité telles que polyphénols notamment les flavonoïdes et les tannins sont reconnus par leur toxicité vis- à -vis des microorganismes (Cowan, 1999).
Introduction générale
2
médicine traditionnelle. Leurs modes d'utilisation, leurs indications dans diverses pathologies ainsi que les principes actifs sont étudiés depuis plusieurs années (Djebaili, 1984; Bouattoura, 1988; Maizak et al., 1993). Par ailleurs, on ne peut que se réjouir du fait que l’Algérie est un bon exemple de pays en développement qui a pris conscience de la richesse et de l’importance de sa médecine traditionnelle puisque tout en s’efforçant de moderniser son système de santé sur le modèle occidental, elle rend prioritaire l’étude des plantes médicinales par les laboratoires de recherche universitaires, dans le but de rationaliser leurs utilisations encore très répandues dans ce pays .
A la lumière de ces données, l’objectif principal de notre travail était la validation de certaines propriétés de la plante Daucus carota L., via l’étude phytochimique, et l’investigation des activités antioxydant et antibactérienne des trois extraits aqueux, éthanolïques et éthérique de partie aérienne (les graines) de plante Daucus carota L.
Cette étude a été divisée en deux parties. Dans une première partie, nous résumerons une étude bibliographique sur les connaissances botaniques et phytochimiques de l'espèce étudiée Daucus carota L. Cette partie comprend aussi des généralités sur les activités antioxydants et antibactériennes. La seconde décrit la partie expérimentale, avec une présentation des techniques d’extraction, les méthodes de dosage des composes phénoliques ainsi que les méthodes d’évaluation des activités biologiques. La troisième partie consiste en une analyse des résultats obtenus et une discussion qui mettra l’emphase sur leur signification. Enfin le manuscrit se termine par une conclusion générale.
Première Partie: Etude
Bibliographique
Chapitre I: Généralité sur la
plante étudiée
Chapitre 1 Généralité sur le plant étudié
I.1. La famille des Apiaceae
Cette famille regroupe près de 3000 espèces, réparties en 420 genres qui sont surtout présentes dans les régions tempérées et plus particulièrement dans l'hémisphère Nord, Elle est très homogène, facilement reconnaissable par ses inflorescences en embelles. Cependant, il est parfois difficile de distinguer les unes des autres (Sáenz Laín et al., 1981).
Cette famille riche en métabolites secondaires présente des intérêts économiques et médicinaux, comportant des coumarines, flavonoïdes, polyphénols, composés acétyléniques et des lactones sesquiterpéniques (Sáenz, 1981).
Caractères morphologiques généraux des Apiacées:
- sont généralement des herbes qui sont annuelles comme cerfeuil, bisannuelles comme la carotte ou, le plus souvent vivaces. L’appareil souterrain pérennant peut être une racine pivotante, un rhizome ou un tubercule.
- La tige est fistuleuse.
-Les feuilles sont alternes et isolées, munies à leurs bases d’une gaine très développée, et dépourvue de stipule. L'inflorescence typique des Apiacées, justement appelées ombellifères.
- Les fleurs, petites, à symétrie pentamère, sont le plus souvent blanches ou jaunâtres, quelquefois rougeâtres comme la fleur centrale de l'ombelle de carotte. L'ovaire porte deux styles qui s'élargissent à la base en un disque ou coussinet nectarifère (stylopode).
- Les fruits, secs, sont des schizocarpes (diakènes) qui se scindent en deux à maturité, chaque partie contenant une graine qui sont importants à observer pour la détermination des espèces (Mazzoni, 1999).
- Les genres se répartissent entre les divers continents, avec une prédominance pour le continent asiatique (265), Amérique (197), Europe (139), Afrique (126), Australie (36). (Meng-lan et al., 2005).
Chapitre 1 Généralité sur le plant étudié
6
Figure 01: Répartition géographique mondiale des Apiaceae (Meng-lan et al., 2005). La famille des Apiaceae occupe une place importante dans la flore Algérienne où elle est représentée par 56 genres, 130 espèces (dont 24 endémiques) et 26 sous espèces (Pujadas Salvà et al., 2003).
I.2. Le plante Daucus carota
I.2.1. Le définitions et description botanique
Le genre Daucus est plus répandu de la carotte, est une plante bisannuelle de climats tempérés, appartenant à la famille des Apiacées, anciennement appelée famille des Ombellifères. (Downie et Katz-Downie, 1996). Le genre Daucus est le plus étudié de cette famille comprend 22 espèces, parmi lesquelles Daucus carota est la plus répandue et indigène, commune en Europe (Reduron, 2007). A été rapporté est riche en métabolites secondaires tels que les flavonoïdes, les coumarines, les polyphénols , les huiles essentielles, les stérols et les tanins. (Reduron, 2007).
Les espèces qui appartiennent au genre Daucus possèdent des propriétés thérapeutiques, elles sont non seulement utilisées dans la médicine traditionnelle, mais aussi dans l’industrie alimentaire et pharmaceutique. (Bach et al., 1979)
Chapitre 1 Généralité sur le plant étudié
I.2.2. Les noms de plante Daucus carota
Synonyme : Daucus sativus, Daucus azoricus.
Tableau 01 : Les noms de plante Daucus carota.
Nom vernaculaire Zaroudia
Anglais Carrot
Français Carotte ou Dentelle de la reine Anne
Bambara Carotii
Sonrhai Carotto
Arabe سزج
I.2.3. Le répartition de Daucus carota
Cette plante est originaire d’Europe (Clotault, 2009); des sous-espèces sont cultivées dans le monde entier ainsi que la présence des ces plant au Moyen-Orient et en Afrique du Nord, (Banga, 1963 ; Clotault, 2009 ; Ferradji et al., 2010), en Algérie le genre Daucus est représenté par des espèces vivants dans les zones arides et incultes très répandues le long de la côte ouest Algérienne (Mazzoni et al., 1999). La récolte de racines et ses graines se fait dès la fin de l’été. Au Mali elle est cultivée dans toutes les régions.
Selon Foury et Pitrat (1994), la carotte est, de nos jours, un des légumes le plus largement cultivé et réparti dans toutes les zones climatique.
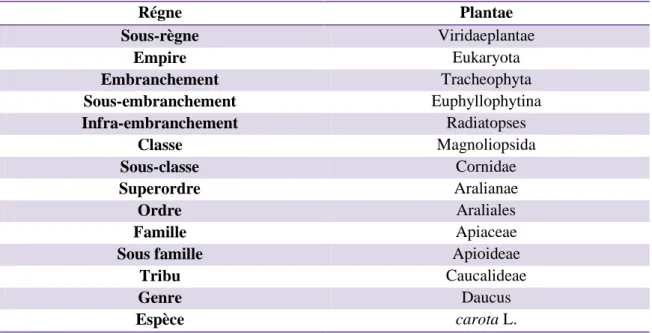
I.2.4. Le classification de la plante (Botineau, 2010).
Le plant Daucus carota est classé dans le tableau suivant :
Tableau 02 : Classification systématique Daucus carota.
Régne Plantae Sous-règne Viridaeplantae Empire Eukaryota Embranchement Tracheophyta Sous-embranchement Euphyllophytina Infra-embranchement Radiatopses Classe Magnoliopsida Sous-classe Cornidae Superordre Aralianae Ordre Araliales Famille Apiaceae
Chapitre 1 Généralité sur le plant étudié
8
I.2.5. Le description morphologique et cycle de vie
Le Plante: est une plante de taille moyenne (0,6 à 2 m au moment de la floraison). Nous la connaissons pour sa racine pivotante développée en organe de réserve, charnue, cassante, pigmentée (rarement blanche), agréable au goût et non ramifiée (en sol meuble, sans obstacle) (Reduron, 2007).
Les feuilles: Les feuilles sont minces, souvent mates, avec un pourtour triangulaire. Elles sont très divisées-pennées, à divisions écartées très allongées, étroites, linéaires ou lancéolées-linéaires (Reduron, 2007).
Les fleurs: Les inflorescences sont constituées de grandes ombelles composées de fleurs blanches jaunâtres, allogames et protandres1, regroupées en ombellules. Chaque fleur est constituée de cinq sépales, cinq pétales, cinq étamines et deux carpelles (Figure 02). (Tirilly et Bourgeois, 1999)..
Figure 02: Les fleurs de Daucus carota. (Bach et al., 1979).
Les graines: Le fruit (communément appelé graine de façon abusive) est un diakène albuminé de forme elliptique (Tirilly et Bourgeois, 1999). qui contiennent des flavonoïdes, les polyphénols et une huile essentielle dont l’asarone, de carotol, de pinènes, et de limonène, sesquiterpène, β-bisabolène. Les graines a contribué à la réduction du stress oxydatif et ont montré une réduction significative du taux de cholestérol total, de triglycérides et de HDL, VLDL (Singh et al., 2010).
Chapitre 1 Généralité sur le plant étudié
Figure 03: les graines de Daucus carota. (Photo original).
La floraison: est estivale ; la durée de cette floraison est de 7 à 10 jours pour une ombelle donnée, mais de 30 à 50 jours pour la plante entière (Rubatzky et al., 1999).
Figure 04 : l’ombelle florale (Rubatzky et al., 1999).
Récolte: Pour la carotte de primeur, la récolte intervient entre la mi-avril et le début mai. Pour la carotte de saison, qu'elle soit destinée au marché de frais ou à la transformation, la récolte se fait entre juin et mai de l'année suivante selon les régions. En région non exposée au gel, les racines sont arrachées au fur et à mesure des besoins (Truffaut, 1978).
Conservation: Les Carottes peuvent se conserver en terre, en recouvrant la planche de feuilles mortes à l'approche des grands froids. C'est même le meilleur
Chapitre 1 Généralité sur le plant étudié
10
On peut encore arracher les Carottes en novembre, et les conserver en silo ou en cave, de préférence enfouies dans du sable. La pourriture due au Sclérotinia sera évitée par désinfection ou chaulage de la cave à légumes (Truffaut, 1978).
I.2.6. Les composition chimique
Ont été mis en évidence la partie aérienne et la racine Daucus carota. Ces différents composent telles que les métabolites secondaires sont consignés dans le tableau 03.
Tableau 03 : Différents composes de Daucus carota.
Compose Référence
Eau
(Fokone, Edoun et al, 2013. et Maiani et al, 2009). Energie Protéines Lipides Glucides Fibres alimentaires Minéraux : Ca, Mg, P, Fe, Zn
Caroténoïdes Flavonoïdes Acide ascorbique
Anthocyanes
Les vitamines : vitamine A, C. L’asparagine
I.2.7. L’utilisation traditionnelle de la plante
Daucus carota est utilisée en médecine traditionnelle grâce à ses propriétés
hypolipidémique, antinoceptive et anti-inflammatoire, antioxydants.
P
lusieurs études épidémiologiques ont montré une corrélation négative entre la consommation de carotte et l’apparition de certains cancers, certaines maladies cardiovasculaires et les maladies liées au vieillissement comme la cataracte (Cao
et al., 1998 ; Koca et al., 2007).
Renforce l’action du foie, la sécrétion d’urines. La vitamine A contenue améliore la vision. La racine est un traitement des oxyures chez l’enfant. Les feuilles sont un bon diurétique, sont utilisées contre les cystites, soignent les troubles digestifs
Chapitre 1 Généralité sur le plant étudié
et atténuent les flatulences. Les graines stimulent les règles, les flatulences et soignent les troubles digestifs (Chevallier, 1996).
Plusieurs composants impliqués dans la protection contre le maladie cardiovasculaires comme la vitamine C, les flavonoïdes (Pool-Zobel et al., 1997; Van Den Berg et Van Vliet, 1998) et les caroténoïdes (Bub et al., 2000 ; Voutilainen et al., 2006).
De nombreux travaux scientifiques ont montré que les caroténoïdes contenus dans la plante de carotte participent dans la lutte contre le cancer des poumons, du sein et de la prostate, mais aussi des tumeurs de l’estomac, de l’intestin ou de l’oseophage (De Groot, 1998).
Deux études récentes ont montré que la consommation de la carotte augmentait la capacité antioxydante et le taux de la vitamine E dans le sang (Nicolle et al., 2003).
Du carotène et des oléorésines sont extraits de Daucus carota pour les industries pharmaceutiques et cosmétiques (Doré et Varoquaux, 2006).
CHAPITRE II: Les
métabolites secondaires et
l'activité biologique
CHAPITRE II Les métabolites secondaires et l'activité biologique
I. Généralité sur les métabolites secondaires
I.1. Le définition des métabolites secondaires
Les métabolites secondaires végétaux peuvent être définis comme des molécules indirectement essentielles à la vie des plantes, par opposition aux métabolites primaires (protéines, lipides et glucides). Ces métabolites secondaires interviennent dans la structure des plantes (lignines et tannins) mais également, elles exercent une action déterminante sur l’adaptation des plantes à leur environnement (Mansour, 2009).
Ils participent ainsi, d’une manière très efficace, dans la tolérance des végétaux à des stress variés : action anti-herbivore (menthe par exemple), inhibition des attaques pathogènes des bactéries et des champignons, prédation d’insectes, défense contre la sècheresse et lumière UV. Mais elles peuvent être anti-nutritives. Beaucoup de métabolites secondaires sont toxiques, ils sont alors stockés dans des vésicules spécifiques ou dans la vacuole (Sandrin, 2004).
D’un point de vue appliqué, ces molécules constituent la base des principes actifs que l’on retrouve chez les plantes médicinales (Mansour, 2009).
I.2. Les classification des métabolites secondaires
Il existe plusieurs classifications de nombreux botanistes et chacune a un principe et un point de vue différents. Et selon Mamadou, 2011 les métabolites secondaires sont caractéristiques des plantes supérieur. Ces métabolites secondaires sont repartis en trois grandes familles chimiques: les composés phénoliques, les terpénoides et les alcaloïdes. I.2.1. Les composés phénoliques
I.2.1.1
.
Le définition et structureLes poly-phénols sont des métabolites secondaires présents chez toutes les plantes vasculaires. (Lebham, 2005). Ils constituent un des groupes le plus nombreux et largement distribué des substances dans le royaume des végétaux avec plus de 8000 structures phénoliques présents dans tous les organes de la plante. Ils résultent biogénétiquement de deux voies synthétiques principales :
La voie shikimate et acétate (Lugasi et al., 2003).
L'élément structural de base est un noyau benzoïque auquel sont directement liés un ou plusieurs groupes hydroxyles, libres ou engagés dans une autre fonction chimique (éther, méthylique, ester, sucre...) (Bruneton, 1993).
CHAPITRE II Les métabolites secondaires et l'activité biologique
14
Figure 05: Structure de base des composés phénoliques (Vermerris et Nicholson, 2006).
Les composés phénoliques sont des molécules hydrosolubles présentes dans tous les végétaux. Ils ont divers effets sur la physiologie végétale de (part leurs actions anti- bactériennes et anti -fongiques. Ils participent à la pigmentation des fleurs, des légumes et de quelques fruits (raisins, agrumes, etc…). Certains d’entre eux sont responsables d’amertume et d’astringence (Adrian et Frangne, 1991 ; Milane, 2004).
Les fonctions principales attribuées à ces composés chez les végétaux sont la protection contre les pathogènes et les herbivores ainsi que la limitation des dommages dus aux radiations UV. Dans ce cas, ils agissent par effet d'écran et par effet anti oxydant (Lebham, 2005).
Les composés phénoliques (acides phénoliques, flavonoïdes simples et proanthocyanidines) forment le groupe des composés phyto-chimiques le plus important des plantes. (Beta et al., 2005).
I.2.1.2. Les classification des composés phénoliques
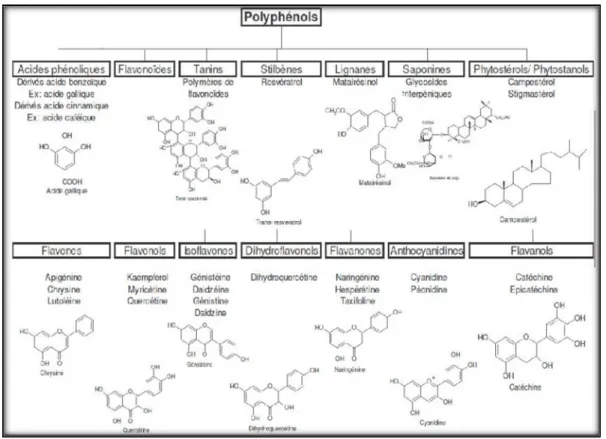
Il existe différentes classes de composés phénoliques, notamment : les acides phénoliques, les flavonoïdes, les tannins, les stilbènes, les lignanes, les saponines, les phytostérols ou bien phytostanols. Les plus importants sont : les acides phénols, les flavonoïdes et les tannins.
CHAPITRE II Les métabolites secondaires et l'activité biologique
Figure 06 : Différentes classes des composés phénoliques (Gervaise, 2004). Les acides phénoliques sont largement répandus chez les plantes. Ils dérivent principalement de l’acide benzoïque ou de l’acide cinnamique.
Les acides hydroxycinnamiques sont les acides phénoliques les plus largement distribués parmi les plantes. Le principal représentant de cette famille est l’acide caféique qui, par estérification avec l’acide quinique, est transformé en acide chlorogéniqe (Tapiero, 2006).
I.2.1.3. L’activités biologiques des polyphénols
Les poly-phénols sont associés à de nombreux processus physiologiques interviennent dans la qualité alimentaire, impliqués lorsque la plante est soumise à des blessures Mécaniques. La capacité d’une espèce végétale à résister à l’attaque des insectes et des microorganismes est souvent corrélée avec la teneur en composés phénoliques (Bahorun, 1997).
Ces composés montrent des activités anti-carcinogènes, anti-inflammatoires, antiathérogènes, anti-thrombotiques, analgésiques, antibactériens, antiviraux, anticancéreux (Babar et al., 2007), anti-allergènes, vasodilatateurs (Falleh et al., 2008)
CHAPITRE II Les métabolites secondaires et l'activité biologique
16 I.2.2. Les flavonoïdes
I.2.2.1. Le définition et structure
Le terme flavonoïdes désigne une très large gamme de dérivés naturels de benzo-Y-pyrane appartenant à la famille des polyphénols et très répondu dans les cellules photosynthétiques (Šhergert et al., 2005). Cette dénomination vient du mot latin flavus : jaune incluant les différents groupes dont les flavones, les flavonones, les isoflavones, les flavonols, les catéchines et les pigments roses, rouges, pourpres et bleus nommés anthocyanines (Alsalvar et al., 2005).
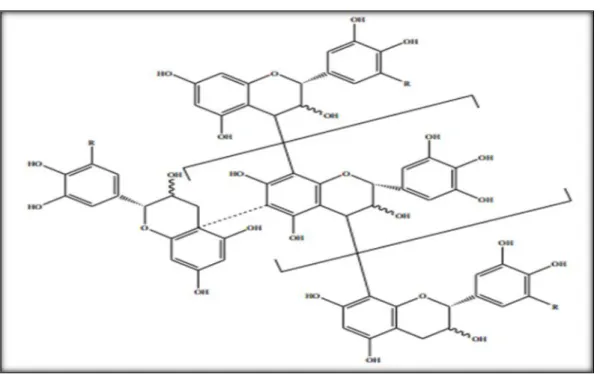
Ces substances se rencontrent à la fois sous forme libre ou sous forme de glycosides. Le squelette de base à quinzeatomes de carbone, est constitué de deux unités aromatiques (A et B), reliées par une chaîne de trois atomes de carbone (figure). Environ 9000 structures ont été identifiées (Martens et Mithöfer, 2005).
Les composés de chaque sous classe se distinguent par le nombre, la position et la nature des substituants (groupements hydroxyles, méthoxyles et autres) sur les deux cycles A et B et la chaîne intermédiaire illustré dans la figure (Pietta, 2000).
Les flavonoïdes peuvent être subdivisés en plusieurs classes dont les plus importantes sont: flavones, isoflavandiols, flavanols, flavondiols, aurones, chalcones, anthocyanins (Effendi et al., 2008) .
Figure 07 : Structure de base des flavonoïdes (Rice-Evans, 1999)
CHAPITRE II Les métabolites secondaires et l'activité biologique
I.2.2.2. Les activités biologiques des flavonoïdes
Les flavonoïdes sont largement connus et étudiées dans le domaine médicinal on leurs reconnait des activités antioxydants, anti-inflammatoires et anti-cancéreuses (Halliwell et al., 2005), activités antivirales, antispasmodiques, antitumorales, antiagrégation plaquettaires, antiallergiques, hypocholestérolémiantes, anti-hypertensives et antimicrobiennes (Ferradji, 2010) , ils assurant la protection des tissus contre les rayonnements solaires nocifs (Crozier et al., 1997; Stobieck et al., 2006). I.2.3. Les alcaloïdes
I.2.3.1. Le définition et structure
Les alcaloïdes sont des substances organique le plus souvent d’origine végétale, forment une grande famille de molécules chimiquement hétérogène, leurs caractéristiques communes sont la présence d’au moins un atome d’azote et leur forte activité biologique, l’atome d’azote accepte souvent un proton, ce qui leur confère un caractère légèrement basique en solution (d’où leur nom d’alcaloïde). Dans leur grande majorité, les alcaloïdes sont hétérocycliques, bien que quelque composé azoté aliphatique (non cyclique) comme la mescaline et la colchicine soient parfois classés dans les alcaloïdes (Sou thon et Buckingham, 1989 ; Cyril, 2001).
Figure 09 : Structure chimique de quelques alcaloïdes (Cyril, 2001). I.2.3.2. Le classification selon la structure chimique
Selon leur structure chimique et surtout leur structure moléculaires, on peut diviser les alcaloïdes en plusieurs groupes (Elbidi, 2016):
CHAPITRE II Les métabolites secondaires et l'activité biologique
18
Des phénylalanines: capasaicine du piment, colchicine du colchique.
Des alcaloïdes isoquinoléiques: morphine, ethylmorphine, codéine et papavérine contenus dans l’opium du pavot.
Des alcaloïdes quinoléiques: tige feuillée de la rue commune.
Des alcaloïdes pyridiques et pipéridiques: ricine du ricin, trigonelline du fenugrec.
Des alcaloïdes dérivés du tropane: scopolamine et atropine de la belladone. Des alcaloïdes stéroïdes: racine de vératre, douce-amère ou acontie (aconitine). I.2.3.3. Les activités biologiques des alcaloïdes
Les alcaloïdes provoquent chez l’Homme diverses réponses physiologiques par ce qu’ils interférent avec les neurotransmetteurs.. De la préhistoire jusqu’à nos jours, les alcaloïdes ou des extraits qui en renferment ont été utilises comme médicaments relaxants musculaires, analgésique et tranquillisants. Une action sur la circulation sanguine et améliore la circulation cérébrale avec une action antibiotique, antiparasitaire, antihelminthique à doses variées (Hopkins, 2003 ; Judd et al., 2002). I.2.4. Les tanins
I.2.4.1. Le définition et structure
Les tanins sont des composés phénoliques complexes, hydrosolubles ayant un poids moléculaire. Ces composés sont naturellement produits par les plantes et se caractérisent par leur facilité à se combiner aux protéines et sont formée d'unités répétitives monomériques qui varient par leurs centres asymétriques, leur degré d’oxydation. En générale, ils sont divisés en deux groupes : Les tanins condensés et les tanins hydrolysables (Meddelton et al., 1993 ; Harbone et al., 1983).
a)- Les tanins condensés
Les tanins condensés ce sont des produits de la polymèrisation de flavan-3-ols (cathéchines) et flavan-3,4-ols (leuco anthocyanidine), ces tanins sont largement répandus dans l'alimentation humaine. Il sont aussi désignés sous le nom de "tanins catéchiques" etne sont hydrolysables que dans des conditions fortement acides (Peronny et al., 2007).
CHAPITRE II Les métabolites secondaires et l'activité biologique
Figure 10: Structure générale de tanins condensés (Boubekri, 2014). b)- Les tanins hydrolysables
Les tanins hydrolysables sont des esters de glucides ou d'acide phénols, ou de dérivés d'acides phénols ; la molécule glucidique est en général du glucose, mais dans certains cas des polysaccharides. Ce groupe de tanins est caractéristique des Dicotylédones. Ils sont facilement hydrolysables par chimique ou enzymatique (Guigniard, 1996 ; Makkar, 2003).
CHAPITRE II Les métabolites secondaires et l'activité biologique
20 I.2.4.2. Les activités biologiques des tanins
Le rôle biologique des tanins est lié à sa propre protection contre les infections fongiques et bactériennes, les insectes et les animaux herbivores (Khanbabaee et Ree, 2001).
En outre, les tanins ont un très grand pouvoir, antiviral, anti-inflammatoire et une activité antimutagène. Les plantes riches en tanins sont utilisées dans les cas de rhume, de maux de gorge, les problèmes de sécrétions trop importantes, les infections internes ou externes, blessures, coupures et brûlures (Laamari et Mostefaoui, 2017).
Les tanins peuvent exercer des effets nutritionnels bénéfiques chez les ruminants qui en consomment des taux modérés. Plusieurs études suggèrent que la présence des tanins condensés à un seuil inférieur à 6% est avantageuse et induit une amélioration des performances animales, croissance et rendement en viande et en lait (Barry et al., 1986) ; aussi, La présence naturelle des tanins dans les différents pâturages protège les herbivores contre les ballonnements (Makkar, 2003).
I.2.5. Les huile essentielle I.2.5.1. Le définition
Les huiles essentielles sont des substances huileuses, volatiles et odorantes qui sont Sécrétées par les plantes aromatiques que l'on extrait par divers procédés dont l’entraînement À la vapeur d’eau et l’hydro distillation (Oakes, et al., 2001), par pressage ou incision des végétaux qui les contiennent. Elles se forment dans un grand nombre de plantes comme sous-produits du métabolisme secondaire (Angus et al., 1976). Elles sont très utilisées dans l'industrie des produits cosmétiques, pharmaceutiques et agro-alimentaire (Eckert et Knutson, 1993). Les huiles essentielles se retrouvent dans des glandes minuscules situées dans différentes parties de la plante aromatique : les feuilles, les fleurs, les fruits, les graines, l'écorce et pour certaines plantes dans les racines. Plus de 2000 espèces de plante sont riches en huiles essentielles ; elles sont reparties sur 60 familles dont les principaux sont: Lauraceae, Labiatea, Umbelliferae, rutaceae, Compositae, Myrtaceae et les Pinaceae, Apiécés …… (Castro
et al., 1994).Les huiles essentielles des plantes ont trouvé leur place en aromathérapie,
en pharmacie, en parfumerie, en cosmétique et dans la conservation des aliments. Leur utilisation est liée àleurs larges spectres d’activités biologiques reconnues (Jitaru et al., 1997).
CHAPITRE II Les métabolites secondaires et l'activité biologique
I.2.5.2. Le domaine d’utilisation des huiles essentielles a)- Pharmacie
Dans des préparations pharmaceutiques, les terpènes phénoliques, comme le thymol et le carvacrol, sont souvent utilisés comme antiseptiques, antibactériens, et anti fongique (Zambonelli et al., 2004).
b)- Cosmétique et parfumerie
L’utilisation des huiles essentielles dans les crèmes et les gels permet de préserver ses cosmétiques grâce à leurs activités antiseptiques, et antioxydants, tout en leur assurant leur odeur agréable (Vargas et al., 1999). Elles sont utilisées aussi dans l’industrie des produits de beauté, parfums, articles de toilette, et produits d’hygiène (Sparg et al., 2004).
c)-Aromathérapie
Les huiles essentielles sont utilisées en milieu clinique pour soigner les maladies inflammatoires telles que les rhumatismes, les allergies, ou l’arthrite et ainsi pour traiter certaines maladies internes et externes : infection d’origine bactérienne ou virale, trouble humorale ou nerveuse (Maruyama et al., 2005).
d)- Industrie agroalimentaire
En industrie alimentaire, le consommateur cherche toujours à avoir une conservation saine et de longue durée pour les produits consommés ainsi qu’une qualité organoleptique meilleure. Une technique pour réduire la prolifération des micro-organismes réside dans l’utilisation des huiles essentielles (Lachowicz et al., 1998) . I.2.6. Les coumarines
I.2.6.1. Le définition et structure
Les coumarines sont des molécules biologiquement actives, substances naturelles aromatiques, la coumarine est utilisée en parfumerie. son odeur se rapproche de la vanilline et du foin fraîchement coupé (Alilou, 2012). Les coumarines sont des composés phénoliques ayant an squelette de base en C6 – C3, mais ils possèdent un atome d'oxygène hétérocycle dans le cadre de l'unité C3, généralement hydroxylée en position 7,en 6 et 6,7,8 (Casley-Smith et al., 1993).
CHAPITRE II Les métabolites secondaires et l'activité biologique
22
Figure 12 : Structure chimique des coumarines ( Alilou, 2012) . I.2.6.2. Les classification des Coumarine (Dean, 1952 ; Späth, 1937).
a)- Coumarines simples: Les coumarines les plus répandues dans le règne végétal possèdent des substitutions (OH ou OCH3) en 6 et 7.
Figure 13 : Structure de ramification des coumarines simples.
b)-Coumarines complexes: On distingue les furocoumarines (ou furanocoumarines): 6,7 furocoumarines (linéaire)
7,8 furocoumarines (angulaire)
Figure 14 : Structure de ramification des coumarines complexes (A: 6,7 furocoumarines linéaire, B: 7,8 furocoumarines angulaire).
CHAPITRE II Les métabolites secondaires et l'activité biologique
I.2.6.3. Les propriétés pharmacologiques des coumarines
Les coumarines se révèlent être des composés immunostimulantes provoquent l’augmentation des lymphocytes T dans la circulation sanguine ( Havsteen, 2002).
l’activité antibactérienne : les coumarines sont efficaces contre les bactéries à Gram positif (Delporte et al., 1999) .
En 1957, O’ Neal et son équipe ont montré l’efficacité des coumarines pour bloquer Le cancer induit chimiquement par les radiations ultraviolettes. Ces molécules sont capables de prévenir la peroxydation des lipides membranaires et de capter les radicaux hydroxyles, superoxyde et peroxyles (Stefanova et al., 2007).
II. Les activités biologiques
II.1. Les activités antioxydants II. 1.1. Introduction
L'oxydation fait partie d'une réaction d'oxydo-réduction qui transfère des électrons d'une substance vers un agent oxydant. Cette réaction peut produire des radicaux libres qui entraînent des réactions en chaîne destructrices (Berra, 2015). la production de ces radicaux au niveau cellulaire est étroitement contrôlée par un énorme système de défense dit système antioxydant. Cependant, une surproduction de radicaux libres d'un côté et (ou) une déficience du système antioxydant de l'autre côté, conduira à une augmentation significative de la production de ces radicaux, qui submergent la défense antioxydante et imposent un stress oxydatif pour le système physiologique (Kebili, 2016).
II.1.2.Le stress oxydatif et les radicaux libres II.1.2.1. Le stress oxydatif
Le stress oxydatif est défini par la production excessive de molécules pro-oxydantes appelées radicaux libres, ou une insuffisance du mécanisme antioxydants. Le stress oxydant correspond à un déséquilibre entre génération d’espèces réactive de l’oxygène et les défenses antioxydants de l’organisme, en faveur des premiers (Haleng
et al., 2007).
La plupart des maladies induites par le stress oxydant apparaissent avec l’âge, car le vieillissement diminue les défenses antioxydants et augmente la production
CHAPITRE II Les métabolites secondaires et l'activité biologique
24 II.1.2.1.1. L’origine du stress oxydatif
La rupture d'équilibre entre le système pro-oxydant et antioxydant peut provenir d'une défaillance nutritionnelle ou de la carence en un ou plusieurs antioxydants apportés par la nutrition, comme les vitamines ou les oligo-éléments, présents en quantité limitée dans l'alimentation. La mauvaise adaptation peut résulter d'anomalies génétiques responsables d'un mauvais codage d'une protéine soit enzymatiquement antioxydant, soit synthétisant un antioxydant (comme la gamma glutamyl synthétase produisant le glutathion), soit régénérant un antioxydant. Généralement, le stress oxydant sera la résultante de plusieurs de ces facteurs et affecte un tissu ou un type cellulaire bien précis et non pas tout l'organisme (Favier, 2003).
II.1.2.1.2. Les conséquences du stress oxydatif
La production excessive de radicaux libres (RL) provoque des lésions directes de molécules biologiques (oxydation de l'ADN, des protéines, des lipides et des glucides), mais aussi des lésions secondaires dues au caractère cytotoxique et mutagène des métabolites libérés notamment lors de l'oxydation des lipides. L'organisme peut aussi réagir contre ces composés anormaux par production d'anticorps, qui malheureusement peuvent aussi être des auto-anticorps créant une troisième vague d'attaque chimique (Favier, 2003).
Le stress oxydatif est la principale cause de plusieurs maladies : cancer, cataracte, sclérose latérale amyotrophique, syndrome de détresse respiratoire aigu, œdème pulmonaire, vieillissement accéléré. Ainsi, le stress oxydatif est aussi un des facteurs potentialisant l’apparition de maladies plurifactorielles telles le diabète, l’Alzheimer, le rhumatisme et les maladies cardiovasculaires, etc. (Leverve et al., 2001).
II.1.2.2. Les radicaux libers
II.1.2.2.1. Le définition d’un radical libre
Un radical libre est une espèce chimique, atome ou molécule, contenant un électron ou plusieurs non apparié. Extrêmement instable, ce composé peut réagir avec les molécules les plus stables pour apparier son électron.
Les radicaux libres sont produits par divers mécanismes physiologiques car ils sont utiles pour l’organisme à dose raisonnable. Cette production physiologique est parfaitement maîtrisée par des systèmes de défense. Dans les circonstances normales, on dit que la balance antioxydants/ pro-oxydants est en équilibre (Favier, 2003).
CHAPITRE II Les métabolites secondaires et l'activité biologique
Dans des conditions normales elles sont générées en faible quantité et jouent un rôle de messagers secondaires capables notamment de régulier le phénomène de l’apoptose ou d’activer les facteurs de transcription (Haleng et al., 2007).
II.1.2.2.2. L’origine des radicaux libres
La production des espèces oxydantes est une conséquence inévitable du métabolisme aérobie. En effet, l’organisme a besoin d’O2 pour produire de l’énergie au cours des réactions dites de respiration oxydative. Cependant, une faible partie de l’oxygène échappe à sa réduction en eau au niveau de la mitochondrie, elle peut alors être à l’origine de la production de radicaux libres oxygénés (Chu et al., 2010).
Les autres sources de production de radicaux libres sont classées en deux catégories les sources endogènes ou les RL sont des produits des réactions de l’organisme, et les sources exogènes telque le tabagisme, les radiations UV, les médicaments, le réactif chimique, les solvants industriels et la pollution (Pastre, 2005). II.1.3.L’activité antioxydants
L’activité antioxydante est l’habilité d’un composé (dit antioxydant) à inhiber la dégradation oxydative d’un substrat telle que la peroxydation des lipides et des protéines (Pellegrini et al., 2003 ; Roginsky et Lissi, 2005). Cet antioxydant a pour rôle d'empêcher les RL d'atteindre leurs cibles biologiques, d'où leur fonction de protecteur chimique (Gardès-Albert et al., 2003).
II.1.3.1. L’antioxydants
Un antioxydant peut être définit comme toute substance capable, à concentration relativement faible, d’entrer en compétition avec d’autres substrats oxydables et ainsi retarder ou empêcher l’oxydation de ces substrats. Il doit être soluble dans les lipides, efficace et non toxique, n’entraine ni coloration, ni d’odeur, ni saveur indésirable, résistant aux processus technologiques, et stable dans le produit final (Estiki et Urooj. 2012).
CHAPITRE II Les métabolites secondaires et l'activité biologique
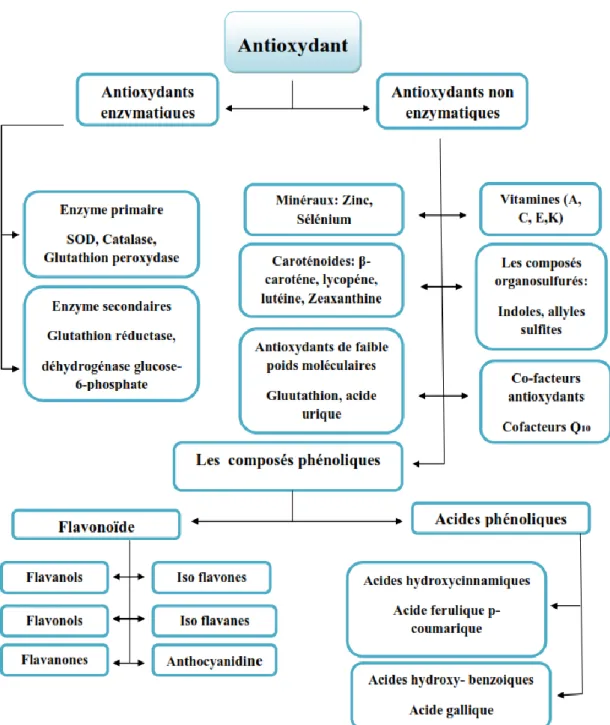
26 II.1.3.1.1. Le classification des antioxydants
Les antioxydants peuvent être classés selon leur mode d’action, leur localisation cellulaire et leur origine. On distingue deux grandes classes : Les antioxydants enzymatiques et non enzymatiques (Figure 15).
CHAPITRE II Les métabolites secondaires et l'activité biologique
I1.1.3.1.2. Les mécanismes d’action des antioxydants
Les mécanismes d’action des antioxydants sont divers, incluant le captage de l’oxygène singulier, la désactivation des radicaux par réaction d’addition covalente, la réduction de radicaux ou de peroxydes, la chélation des métaux de transition (Favier, 2006).
D’une manière générale, un antioxydant peut empêcher l’oxydation d’un autre substrat en s’oxydant lui-même plus rapidement que celui-ci. Un tel effet résulte d’une structure de donneurs d’atome d’hydrogène ou d’électrons souvent aromatiques cas de dérivés du phénol.
En plus leurs radicaux intermédiaires sont relativement stables du fait de la délocalisation par résonance et par manque de positions appropriées pour être attaqué par l’oxygène moléculaire. Les antioxydants sont en fait des agents de prévention, ils bloquent l’initiation en complexant les catalyseurs, en réagissant avec l’oxygène, ou des agents de terminaison capables de dévier ou de piéger les radicaux libres, ils agissent en formant des produits finis non radicalaires. D’autres en interrompant la réaction en chaine de peroxydation, en réagissant rapidement avec un radical d’acide gras avant que celui-ci ne puissent réagir avec un nouvel acide gras. Tandis que d’autres antioxydants absorbent l’énergie excédentaire de l’oxygène singlet pour la transformer en chaleur (Yaacoub, 2009 ; Hellal, 2011)
II.2. L’activité antibactérienne
Dès la naissance, l'homme se trouve en contact avec des micro-organismes qui vont progressivement coloniser son revêtement cutanéo-muqueux. Pour résister à ces microorganismes de nombreux moyens sont mis en jeu. On peut schématiquement en distinguer 3 groupes : les barrières anatomiques, les mécanismes de résistance naturelle (ou innés) et l'immunité acquise (Kaufmann, 1997). La thérapeutique des infections bactériennes se base principalement sur l’usage des antibiotiques. La prescription à grande échelle et parfois inappropriée de ces agents peut entraîner la sélection de souches multirésistantes d’où l’importance d’orienter les recherches vers la découverte de nouvelles voies qui constituent une source d’inspiration de nouveaux médicaments à base des plantes (Billing et Sherman, 1998). L'activité antibiotique correspondant à activité d'une molécule ou composé présent au sein d'un végétal qui inhibe le