Caractérisation préclinique de la réponse
pulmonaire à l’exposition à la cigarette
électronique
Mémoire
Ariane Lechasseur
Maîtrise en médecine expérimentale
Maître ès Sciences (M. Sc.)
Caractérisation préclinique de la réponse
pulmonaire à l’exposition à la cigarette
électronique
Mémoire
Ariane Lechasseur
Sous la direction de :
Mathieu Morissette, directeur de recherche
Caroline Duchaine, codirectrice de recherche
R
ÉSUMÉ
CONTEXTE : Le marché de la cigarette électronique a connu une importante hausse dans
les dernières années, principalement chez les fumeurs visant l’arrêt tabagique. Toutefois, les effets pulmonaires de l’inhalation de propylène glycol (PG) et de glycérol (Gly), principaux constituants du e-liquide utilisé dans les cigarettes électroniques, demeurent encore inconnus.
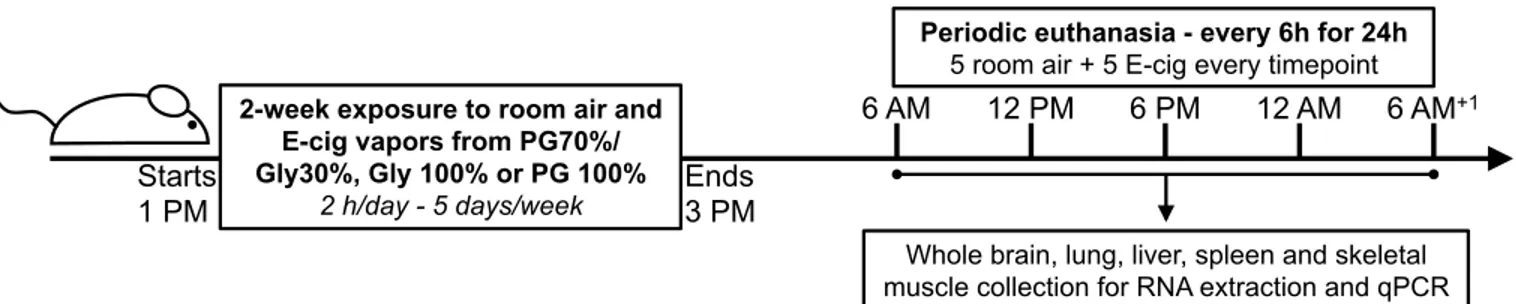
OBJECTIF : Investiguer les effets pulmonaires des vapeurs de cigarette électronique. MÉTHODES : Un système d’exposition de type « whole-body » a été mis au point. Jusqu’à
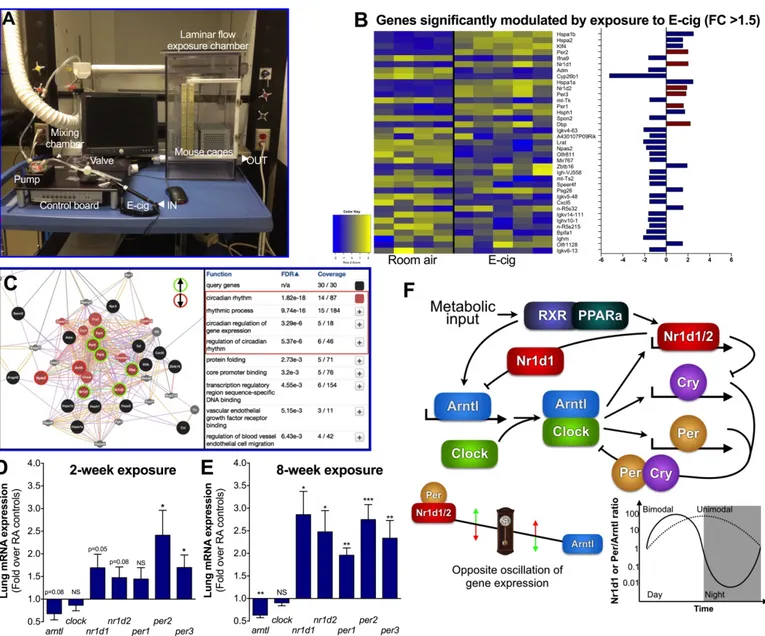
40 souris sont exposées 2 h/jour, 5 jours/semaine pour une période de 2 à 8 semaines. Le e-liquide est fabriqué au laboratoire, est composé de 30% de Gly et de 70% de PG, et ne contient ni nicotine ni saveurs. L’inflammation pulmonaire a été déterminée par cytologie des lavages broncho-alvéolaires. Les effets de la cigarette électronique sur le transcriptome pulmonaire ont été évalués à l’aide de puces d’expression génique. RÉSULTATS : L’exposition à la cigarette électronique n’entraine pas d’inflammation pulmonaire significative. Les analyses sur puces d’ADN montrent que la cigarette électronique a un impact sur les gènes impliqués dans la régulation du cycle circadien pulmonaire. Des analyses périodiques sur 24h montrent que la rythmicité de plusieurs gènes impliqués dans la régulation du cycle circadien est dérégulée par l’exposition à la cigarette électronique. On retrouve également ces perturbations dans le foie, le rein et le muscle squelettique, et dans une moindre mesure, dans le cerveau. L’exposition au Gly seul ou au PG seul indique que les deux composés sont responsables des changements observés au niveau systémique.
CONCLUSION : La cigarette électronique n’induit pas de réponse inflammatoire, mais
semble plutôt causer une perturbation du cycle circadien, tant au niveau pulmonaire que systémique. De plus amples recherches sont nécessaires afin de cerner les effets potentiels d’une perturbation circadienne induite par la cigarette électronique.
A
BSTRACT
RATIONALE. The market for electronic cigarettes has boomed in the past few years,
especially among smokers who desire to quit smoking. However, the pulmonary effects on propylene glycol (PG) and glycerol (Gly) inhalation have not been thoroughly investigated.
OBJECTIVE. To investigate the effects of vapour on the mouse lungs. METHODS. A
whole-body exposure automated system has been designed. Up-to 40 mice are exposed to electronic cigarette vapour, 2 hours/day, 5 days/week, from 2 and up to 8 weeks. E-liquid was fabricated in the laboratory, composed of 30% Gly and 70% PG, and without nicotine or flavor. Parameters of lung inflammation were assessed by cytology and ELISA in the bronchoalveolar lavage (BAL). Effects of electronic cigarette exposure on the pulmonary transcriptome were assessed using gene expression arrays RESULTS. Exposure to electronic cigarette alone does not cause pulmonary inflammation. Transcriptome analysis performed on lung tissue showed that electronic cigarette had a significant impact on genes responsible for regulating the pulmonary circadian cycle. Periodical sacrifices showed that the rhythmicity of key circadian genes was altered by electronic cigarette exposure. Expression of circadian genes in the liver is also altered, but the brain is less affected. Exposure to glycerol or propylene glycol alone indicated that glycerol was largely responsible for dysregulating the pulmonary circadian rhythm. It also showed that both compound had an impact on the liver and brain circadian rhythms. CONCLUSION. Electronic cigarette exposure does not appear to trigger lung inflammatory but rather seems to affect the lung circadian rhythmicity. Further research is required to investigate the possible effects of pulmonary circadian disruption by electronic cigarette.
T
ABLE DES MATIÈRES
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Liste des abréviations ... ix
Remerciements ... xii
Avant-propos ... xiii
Chapitre I : Revue de la littérature ... 1
1.1. La cigarette électronique ... 1
1.1.1. Utilisation de la cigarette électronique ... 1
1.1.2. Composantes et fonctionnement ... 2
1.1.3. Impact de la cigarette électronique sur la santé ... 3
1.1.3.1. Études in vitro ... 3
1.1.3.2. Études cliniques ... 6
1.1.3.3. Études in vivo ... 9
1.2. Le cycle circadien ... 12
1.2.1. Anatomie et régulation du cycle circadien ... 12
1.2.2. Composantes de l’horloge moléculaire ... 14
1.2.3. Implication du cycle circadien dans les processus biologiques ... 17
1.2.3.1. Rôle du cycle circadien dans les processus métaboliques ... 17
1.2.3.2. Rôle du cycle circadien dans la régulation de l’inflammation ... 19
1.2.3.3. Rôle du cycle circadien dans les pathologies pulmonaires ... 24
Chapitre II : Impact de la cigarette électronique sur le cycle circadien pulmonaire ... 28
2.1. Résumé ... 28
2.2. Title page ... 29
2.3. Abstract ... 31
2.4. Introduction ... 32
2.5. Methods ... 34
2.5.1. Mice and electronic cigarette vapors exposure ... 34
2.5.2. Periodic sacrifices over 24 hours ... 34
2.5.3. Tissue harvesting ... 35
2.5.4. Assessment of lung gene expression by microarray ... 36
2.5.6. Statistical Analysis ... 37
2.6. Results ... 38
2.6.1. Electronic cigarette-mediated exposure to propylene glycol and glycerol vapors rapidly affects the pulmonary expression of genes involved in circadian rhythm central regulation ... 38
2.6.2. Both propylene glycol and glycerol affect pulmonary expression of genes involved in circadian rhythm central regulation ... 39
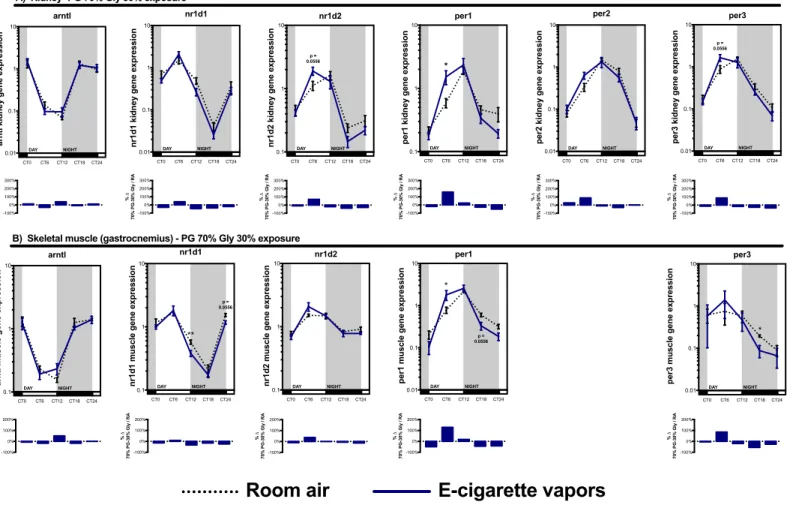
2.6.3. Electronic cigarette-mediated vapors of propylene glycol and glycerol affect the expression of circadian rhythm central regulatory genes in the brain, liver, skeletal muscle and kidney ... 39
2.6.4. Systemic expression of hspa1a and hspa1b, widely expressed rhythmic heat shock proteins, is affected by electronic cigarette vapors ... 40
2.7. Discussion ... 41
2.8. References ... 44
2.9. Figure legends ... 48
2.10. Supplementary data ... 50
Chapitre III : Conclusions et perspectives ... 64
3.1. Discussion ... 64
3.2. Forces et limites de l’étude ... 70
3.3. Perspectives ... 72
3.4. Conclusion générale ... 74
L
ISTE DES TABLEAUX
L
ISTE DES FIGURES
Figure 1.1 : Représentation schématique de la cigarette électronique. ... 2 Figure 1.2 : Régulation autonomique et endocrine du cycle circadien. ... 13 Figure 1.3 : Représentation schématique d’un cycle d’expression complet d’un gène du cycle circadien. ... 14 Figure 1.4 : Composantes moléculaires impliquées dans la régulation du cycle circadien. . 15 Figure 1.5 : Impact d’une perturbation métabolique sur le cycle d’expression des gènes du cycle circadien ... 18 Figure 1.6 : Régulation temporelle de l’inflammation par le cycle circadien. ... 21 Figure 2.1: Exposure to electronic cigarette vapors of propylene glycol and glycerol affects circadian rhythm regulatory genes in the lungs. ... 52 Figure 2.2: Periodic euthanasia protocol used to assess the impact of electronic cigarette vapors on circadian rhythmicity. ... 53 Figure 2.3: Both propylene glycol and glycerol vapors from electronic cigarette impact circadian rhythm regulatory genes. ... 54 Figure 2.4: Electronic cigarette vapors impact the expression of circadian rhythm regulatory genes in the brain and liver. ... 55 Figure 2.5: Electronic cigarette vapors impact the expression of circadian rhythm regulatory genes in the kidney and skeletal muscle ... 56 Figure 2.6: Electronic cigarette vapors impact the circadian rhythmicity of hspa1a and
hspa1b in various organs. ... 57 Supplementary Figure 1: Exposure to electronic cigarette vapors of propylene glycol and glycerol do not induced lung inflammation. ... 58 Supplementary Figure 2: Electronic cigarette vapors from propylene glycol or glycerol alone impact the expression of circadian rhythm regulatory genes in the brain. ... 59 Supplementary Figure 3: Electronic cigarette vapors from propylene glycol or glycerol alone impact the expression of circadian rhythm regulatory genes in the liver. ... 60 Supplementary Figure 4: Electronic cigarette vapors from propylene glycol or glycerol alone impact the expression of circadian rhythm regulatory genes in the kidney. ... 61 Supplementary Figure 5: Electronic cigarette vapors from propylene glycol or glycerol alone impact the expression of circadian rhythm regulatory genes in the skeletal muscle. ... 62 Figure 3.1 : Rôle du glycérol et du propylène glycol dans la voie de la gluconéogenèse. ... 66
L
ISTE DES ABRÉVIATIONS
ACTH Adrenocorticotropic hormone, adrénocorticotrophine
AMPK Adenosine monophosphate-activated protein kinase
ARNTL Aryl hydrocarbon receptor nuclear translocator-like protein 1 (aussi appelé
BMAL1 ; brain and muscle arnt-like protein-1) BAL / LBA Bronchoalveolar lavage / Lavage broncho-alvéolaire
CAT Chronic obstructive pulmonary disease assessment test
CCL2 Chemokine (C-C motif) ligand 2 (aussi appelé monocyte chemoattractant
protein 1 (MCP-1))
CD11b Cluster differentiation 11 b (aussi appelé Integrin alpha M)
CD66c Cluster differentiation 66 c
Cdna Complementary deoxyribonucleic acid
CK1δ/ϵ Casein kinase delta/epsilon
CLOCK Circadian locomotor outpout cycles kaput
CREBH Cyclic AMP-responsive element binding protein, hepatocyte specific
CRTC2 CREB-regulated transcription coavtivator 2
CRY1 Cryptochrome 1
CRY2 Cryptochrome 2
CT Cycle time
CXCL1 C-X-C motif chemokine 1
CXCL8 C-X-C motif chemokine 8 (aussi appelé interleukine 8)
DEP Débit expiratoire de pointe
E-box Enhancer box/domain
FEF25 Flux expiratoire forcé à 25% de la capacité expiratoire
Foxo1 Forkhead box O1
G6PC Glucose-6-phosphatase
GLY Glycérol / Glycerol
GR Glucocorticoid receptor
HAT Histone acetyltransferases
HNF-4α Hepatocyte nuclear factor 4α)
HPA Hypothalamic-pituitary axis, axe hypothalamo-pituito-surrénalien
Hspa1a Heat shock 70 kda protein 1
Hspa1b Heat shock 70kda protein 1B
HUEVC Human umbilical vein endothelial cell
ICAM-1 Intercellular Adhesion Molecule 1
IgE Immunoglobuline E IL-13 Interleukine-13 IL-4 Interleukine-4 IL-5 Interleukine-5 kDa Kilodalton LDH Lactate déhydrogénase LPS Lipopolysaccharide MMP-9 Matrix metallopeptidase 9
MPOC Maladie pulmonaire obstructive chronique
NAD+ Nicotinamide adénine dinucléotide oxydée
NAMPT Nicotinamide phosphoribosyltransférase
NK cells Natural killer cells
NK-κb Nuclear factor kappa-light-chain-enhancer of activated B cells
NOD Nucleotid-binding Oligomerization Domain
NR1D1 Nuclear receptor subfamily 1/group D/member 1 (aussi appelé REV-ERB α)
NR1D2 Nuclear receptor subfamily 1/group D/member 2 (aussi appelé REV-ERB β)
PAMP Pathogen associated molecular pattern
PBS Phosphate-buffered saline
PCK1 Phosphoenolpyruvate carboxykinase
PER1 Period 1
PER2 Period 2
PER3 Period 3
PG Propylène glycol / Propylene glycol
PGC-1α Peroxisome proliferator-activated receptor-γ coactivator-1α
PPAR Peroxisome proliferator-activated receptor
qPCR Quantitative polymerase chain reaction
RAR Retinoic acid receptor
RORE Retinoic acid-related orphan receptor response element
Rorα Retinoic acid-related orphan receptor α
Rorβ Retinoic acid-related orphan receptor β
Rorγ Retinoic acid-related orphan receptor γ
ROS Reactive oxygen species
Rplp0 60S acidic ribosomal protein P0 coding gene
SCN Suprachiasmatic nucleus, noyau suprachiasmatique.
SIRT1 Sirtuin-1
SNS Système nerveux sympathique
STAT3 Signal transducer and activator of transcription 3
TLR4 Toll-like receptor 4
TREM-1 Triggering receptor expressed on myeloid cells 1
UV Ultraviolet
VEMS Volume maximal expiré pendant la première seconde d'une expiration forcée
ZT Zeitgeber α Alpha β Beta γ Gamma δ Delta ϵ Epsilon µl Microliter µm Micromolar
R
EMERCIEMENTS
Je tiens à remercier d’abord mon père, qui par son soutien incroyable, a su me donner la motivation de poursuivre mes études. C’est grâce à l’éducation que tu m’as donnée que je suis la fille que je suis aujourd’hui. Je travaille très fort pour que tu sois fière de moi et, promis, un jour, je vais te cloner.
Je voudrais ensuite remercier mon directeur de recherche, Mathieu Morissette. Merci de m’avoir donné la chance de faire une maitrise dans ton équipe. Merci pour tes conseils judicieux, ton encadrement et ton enthousiasme qui ont grandement participé à la réussite de ma maitrise. En espérant que la suite soit aussi plaisante ! Merci également à ma codirectrice de recherche Caroline Duchaine. Mon projet n’aurait pas pu prendre place sans ton aide avec la conception du système d’exposition.
Je remercie également tous mes collègues du Centre de recherche de l’Institut de cardiologie et de pneumologie de Québec, tout particulièrement mes professionnelles de recherche exceptionnelles, Marie-Josée Beaulieu, Marie-Ève Paré et Sophie Aubin. Merci d’être toujours là pour m’aider au pied levé et d’écouter mes constantes péripéties. Merci aussi à Dany Patoine, grâce à qui j’ai pu réussir l’optimisation de mes expériences tout en restant saine d’esprit. Presque.
Merci à mes merveilleux amis, principalement Anne-Sophie, Carole-Ann et Camille. Nos soirées de l’amitié et diverses occasions festives ont fait en sorte d’égayer le quotidien et de faire passer les dernières années beaucoup trop rapidement ! Je voudrais terminer en remerciant mon amoureux Pierre-Luc. Merci de me suivre dans toutes mes aventures, et en espérant que les prochaines années en apportent encore tout plein !
A
VANT
-
PROPOS
Ce projet a été conçu par Mathieu C Morissette et moi-même, et représente les premiers résultats sur le sujet dans mon laboratoire de recherche, et même au Québec. De plus, les travaux effectués dans la cadre de ma maitrise seront publiés dans un premier article scientifique en tant que premier auteur (Chapitre II). La publication est intitulée : ‘Exposure
to electronic cigarette vapors affects pulmonary and systemic expression of circadian molecular clock genes’ et a été accepté dans le Physiological Reports, par Ariane Lechasseur,
Jean-Christophe Bérubé, Éric Jubinville, Joanie Routhier, Mélanie Hamel-Auger, Sophie
Aubin, Marie-Ève Paré, Yohan Bossé, Caroline Duchaineand Mathieu C Morissette. Ma
contribution à cet article a été majeure, puisque j’ai exposé quotidiennement les animaux aux vapeurs de cigarette électronique, conjointement avec Sophie Aubin. J’ai également généré la majorité des résultats présentés dans l’article. En effet, j’ai procédé aux sacrifices périodiques des animaux, avec la contribution de Éric Jubinville et de Mélanie Hamel-Auger, ainsi que Joanie Routhier et Marie-Ève Paré pour les extractions d’ARN. Jean-Christophe Bérubé a réalisé les analyses bio-informatiques de comparaison de transcriptome pulmonaire de souris contrôles et exposées aux vapeurs de cigarette électronique. Caroline Duchaine a participé à la conception du système d’exposition à la cigarette électronique.
Le temps ! Le temps ! Mais qu’est-ce que le temps ?
C
HAPITRE
I :
R
EVUE DE LA LITTÉRATURE
En 2015, on estimait le nombre de fumeurs à plus de 1,1 milliard mondialement. Au Canada, près de 15% des individus âgés de plus de 15 ans seraient fumeurs (World-Health-Statistics, 2016). Le tabagisme cause près de 500 000 morts chaque année aux États-Unis (Surgeon-General, 2014). En effet, le tabagisme est la cause de plusieurs maladies respiratoires, dont la maladie pulmonaire obstructive chronique (MPOC) et est un facteur aggravant pour l’asthme ainsi que de la fibrose pulmonaire idiopathique. Le tabagisme joue également un rôle dans l’avènement de plusieurs maladies cardiovasculaires ou neurodégénératives et favorise le développement d’une multitude de types de cancers (Surgeon-General, 2014).
1.1. La cigarette électronique
1.1.1. Utilisation de la cigarette électronique
Afin de lutter contre le tabagisme, plusieurs méthodes d’arrêt ont été développées, la plus récente d’entre elles étant la cigarette électronique. Le marché de la cigarette électronique a connu une forte hausse dans les dernières années, et ce, malgré l’interdiction canadienne de vendre des cigarettes électroniques contenant du e-liquide avec de la nicotine. Cependant, il est toléré de vendre la cigarette électronique séparément du e-liquide contenant ou non de la nicotine (Santé-Canada; Shiplo, Czoli, & Hammond, 2015). Au Québec, comme pour le tabac, il est interdit de consommer la cigarette électronique à moins de neuf mètres des lieux publics et terrasses (Santé-et-Services-sociaux-Québec, 2015).
Perçue par ses utilisateurs comme plus saine et plus sécuritaire que la cigarette de tabac traditionnelle (Camenga et al., 2015; Farsalinos, Romagna, & Voudris, 2015), elle est populaire auprès d’un nombre croissant d’utilisateurs. Selon une étude canadienne menée en
2013, 8,5% des répondants âgés de plus de 15 ans, représentant 2,5 millions de Canadiens, rapportent avoir essayé la cigarette électronique. Parmi ceux-ci, 64% étaient des fumeurs de cigarettes de tabac, 16% étaient des ex-fumeurs et 21% n’avaient jamais fumé le tabac, montrant bien le large spectre d’utilisateurs (Reid, Rynard, Czoli, & Hammond, 2015). Bien que promus comme un outil novateur permettant l’arrêt tabagique, son efficacité à cette fin reste encore à démontrer (Malas et al., 2016). Même si plusieurs études ont montré une relation positive entre la cigarette électronique et l’arrêt tabagique, certaines études récentes ont plutôt montré que celle-ci n’aiderait pas la cessation tabagique (Bullen et al., 2013; Malas et al., 2016; Manzoli et al., 2015). En effet, un arrêt tabagique par l’utilisation de cigarette électronique n’améliorerait pas les fonctions pulmonaires ni les symptômes cliniques associés au statut tabagique comme l’épuration mucociliaire, la toux et la dyspnée (Cibella et al., 2016; Kumral et al., 2016). On a même montré que son utilisation par des non-fumeurs favoriserait leur initiation au tabagisme (Barrington-Trimis et al., 2016). Davantage d’études sont nécessaires afin de suivre l’impact de la cigarette électronique sur la cessation tabagique.
1.1.2. Composantes et fonctionnement
Les ressemblances entre la cigarette de tabac et la cigarette électronique sont très certainement ce qui rend cette dernière aussi populaire. Son mode de fonctionnement simple permet d’aérosoliser la nicotine sans qu’il n’y ait de combustion. Lorsque l’utilisateur inhale, le microprocesseur active l’élément chauffant alimenté par une batterie. L’élément chauffant chauffe le liquide contenu dans la cartouche, appelé e-liquide, et mène à la formation d’aérosols et de vapeurs (Figure 1.1.). Le e-liquide est quant à lui composé de deux
Gaze
Air Vapeurs
Batterie
principaux solvants, le propylène glycol et le glycérol, qui permettent respectivement de solubiliser la nicotine et les saveurs ainsi que de produire les vapeurs émises par la cigarette électronique (Brown & Cheng, 2014). On retrouve commercialement du e-liquide contenant différentes concentrations nicotine allant de 0 mg/ml à 19 mg/ml (Goniewicz, Kuma, Gawrin, Knysak, & Kosmider, 2013). Il existe également plus de 7000 saveurs de e-liquide telles que : tabac, menthol, café, divers fruits, Piña Colada, ou encore aux gaufres (Grana, Benowitz, & Glantz, 2014; Jensen, Strongin, & Peyton, 2017).
1.1.3. Impact de la cigarette électronique sur la santé
Dû à la nouveauté du produit, peu d’études se sont attardées à détailler les effets de la cigarette électronique sur la santé. Les études les plus pertinentes dans le domaine à ce jour sont détaillées ci-dessous.
1.1.3.1. Études in vitro
Certaines études ont voulu comparer les effets de la cigarette électronique à ceux de la cigarette de tabac au niveau de la mortalité cellulaire. En exposant une lignée de cellules épithéliales humaines aux vapeurs de cigarette électronique ou à la fumée de cigarette traditionnelle, il a été démontré que la cigarette électronique induit entre 70% et 90% moins de mortalité cellulaire que la fumée de cigarette traditionnelle, dépendamment des différentes concentrations de e-liquide utilisées (Azzopardi et al., 2016). Une autre étude a indiqué que les vapeurs de cigarette électronique entrainent l’augmentation de la mortalité cellulaire, un changement dans la morphologie cellulaire et un relâchement de cytokines pro-inflammatoires par les kératinocytes et les cellules épithéliales pulmonaires humaines. Encore une fois, ces dommages sont moindres que ceux causés par la fumée de cigarette, et sont principalement induits par la nicotine et les saveurs contenues dans le e-liquide
(Cervellati et al., 2014). Anderson et al. ont quant à eux utilisé un modèle de cellules endothéliales humaines isolées des veines du cordon ombilical (HUVEC) et exposées à des extraits de vapeurs de cigarette électronique ou de cigarette de tabac. Ils ont pu démontrer que la cigarette électronique induit moins de mort cellulaire et de génération d’espèces oxygénées réactives (ROS) que la cigarette de tabac (Anderson, Majeste, Hanus, & Wang, 2016). Ces études in vitro suggèrent donc que, comparativement au tabac, la cigarette électronique induirait moins de mortalité cellulaire que le tabac, et ce, auprès de plusieurs types cellulaires. D’autres se sont plutôt intéressés à l’effet potentiellement cytotoxique d’une exposition à la cigarette électronique seule. Une étude a montré que l’exposition de kératinocytes buccaux humains aux vapeurs de cigarette électronique entraine une augmentation de la production de ROS (Ji et al., 2016). En utilisant un modèle de cellules épithéliales gingivales humaines exposées aux vapeurs de cigarette électronique, Rouabhia et al. ont pu montrer que celles-ci altèrent la morphologie cellulaire des cellules, augmentent le relâchement de lactate déshydrogénase (LDH), un marqueur d’intégrité membranaire, et activent la voie apoptotique de la caspase-3 (Rouabhia et al., 2016). Ensemble, ces résultats suggèrent un effet potentiellement cytotoxique d’une exposition aux vapeurs de cigarette électronique auprès de plusieurs types cellulaires.
Différents groupes de recherche se sont attardés à l’impact de la cigarette électronique sur l’activation de processus inflammatoires. Une étude utilisant un modèle de cellules épithéliales bronchiques humaines exposées aux vapeurs de cigarette électronique a démontré une altération des fonctions ciliaires et de la production de cytokines par ces cellules, favorisant un environnement pro-inflammatoire (Garcia-Arcos et al., 2016). Toutefois, ces résultats sont uniquement observés lorsque les cellules sont exposées aux vapeurs de cigarette électronique contenant de fortes doses de nicotine, suggérant un impact de la nicotine plutôt que des vapeurs de cigarette électronique en soi. Higham et al. se sont intéressés à l’impact de la cigarette électronique sur les neutrophiles, puisque le nombre de
ces cellules inflammatoires augmente en condition tabagique et dans la MPOC. Ils ont pu démontrer que l’exposition à un extrait de cigarette électronique induit une augmentation de l’activation des neutrophiles, caractérisée par une augmentation de CD11b et de CD66b, ainsi qu’une augmentation de la migration des neutrophiles, caractérisée par une augmentation des niveaux de MMP-9 et CXCL8 (Higham et al., 2016). Un groupe de recherche s’est également intéressé à l’impact de la cigarette électronique en contexte d’infection bactérienne en utilisant des modèles de kératinocytes et de pneumocytes de type II humains exposés à un extrait de cigarette électronique puis cultivés en présence de la bactérie Staphylococcus
aureus. Ils ont pu établir que l’extrait induit une diminution de l’activité antimicrobienne des
kératinocytes, une augmentation de la mort cellulaire et une augmentation de production de cytokines pro-inflammatoires. L’exposition à la cigarette électronique a également eu un impact négatif direct sur la croissance de Staphylococcus aureus, mais stimule la production de biofilm, tout en augmentant son hydrophobicité et son adhésion aux kératinocytes, ce qui promeut ainsi son pouvoir de colonisation (J. H. Hwang et al., 2016). En somme, les vapeurs de cigarette électronique semblent avoir un impact au niveau de la réponse inflammatoire, en stimulant la production de cytokine pro-inflammatoire, en modulant la réponse des neutrophiles et en impactant la capacité de colonisation des bactéries.
Bien que les modèles in vitro permettent d’exposer une variété de types cellulaires aux vapeurs de cigarette électronique et de générer des données rapides, ils comportent plusieurs lacunes dans le contexte de caractérisation des effets de la cigarette électronique. En effet, les modèles in vivo ou cliniques, contrairement aux modèles in vitro, permettent d’évaluer l’impact des vapeurs de cigarette électronique au niveau de la santé respiratoire, tant au niveau des fonctions respiratoires qu’au niveau de l’inflammation globale. De plus, s’agissant d’un domaine d’étude récent, il serait beaucoup plus intéressant d’évaluer l’impact de la cigarette électronique dans un modèle complexe comme l’animal ou l’humain. De cette façon, il serait possible d’obtenir une vue d’ensemble de ses effets dans un système qui
comprend l’interaction entre plusieurs types cellulaires retrouvés au niveau pulmonaire, mais également au niveau systémique. Pour ces raisons, la suite de ce mémoire détaillera davantage les modèles animaux et les études cliniques portées sur les impacts de la cigarette électronique au niveau de la santé pulmonaire. De même, l’étude réalisée dans le cadre de ce mémoire, présenté au Chapitre II, utilise un modèle murin d’exposition aux vapeurs de cigarette électronique.
1.1.3.2. Études cliniques
Quelques études se sont intéressées aux effets pulmonaires de l’inhalation de vapeurs de cigarette électronique chez l’humain. Une étude a documenté l’impact de l’utilisation de cigarette électronique chez les patients souffrant de la MPOC, en évaluant plusieurs paramètres de fonctions pulmonaires, de qualité de vie ou encore de cas d’exacerbations entre des sujets contrôles qui ne fument que la cigarette de tabac, comparativmenet à des sujets qui utilisent quotidiennement la cigarette électronique. En réalisant un suivi sur une période de 12 et 24 mois, ils ont mis en évidence que les utilisateurs de cigarette électronique réduisent considérablement leur nombre de cigarettes fumées, passant de 20 à 5 cigarettes par jour après 12 mois. En comparaison, les sujets contrôles maintiennent leur consommation de cigarettes à 20 par jour tout au long du suivi de 24 mois. Ils ont également montré que l’utilisation de la cigarette électronique permet de réduire le score CAT (Chronic Obstructive
Pulmonary Disease Assessment Test), indiquant une amélioration de la qualité de vie. Les
patients utilisant la cigarette électronique voient également leur nombre d’exacerbations diminuer et augmentent leur distance parcourue au test de marche de six minutes, montrant encore une fois l’augmentation de leur état fonctionnel. Au niveau des fonctions pulmonaires, les sujets MPOC utilisant la cigarette électronique ont vu leur VEMS augmenter d’un volume moyen de 39 ml, comparativement aux sujets du groupe contrôle qui ont diminué leur VEMS
de 12 ml en moyenne. Ces résultats indiquent une réduction de la broncho-constriction, ce qui suggère un ralentissement du déclin des fonctions respiratoires (Polosa et al., 2016).
Une autre étude, réalisée chez des sujets jeunes (39.3 ± 12.6 ans) fumeurs (19 paquets-années en moyenne) et non-fumeurs, une exposition aiguë de 5 minutes aux vapeurs de cigarette électronique ne contenant pas de nicotine induit une diminution : du volume maximal expiré pendant la première seconde d'une expiration forcée (VEMS), du flux expiratoire forcé à 25% de la capacité expiratoire (FEF25) et du débit expiratoire de pointe (DEP). Chez les non-fumeurs, seule une diminution du VEMS et du FEF25 est observée. Cela suggère qu’une exposition aiguë à la cigarette électronique entraine un effet broncho-constricteur (Ferrari et al., 2015). Toutefois, le temps très court d’exposition aux vapeurs de cigarette électronique ne permet pas de tirer des conclusions tangibles en ce qui a trait à leur impact sur les fonctions pulmonaires. Chez une cohorte de jeunes non-fumeurs (20-40 ans), sains ou asthmatiques, Boulay et al. ont également évalué l’impact d’une exposition aigüe d’une heure à des vapeurs de cigarette électronique, sans saveurs et sans nicotine. Comparativement à la cigarette électronique placebo, une telle exposition aux vapeurs de cigarette électronique n’induisait pas de changement dans les fonctions pulmonaires et symptômes respiratoires, tant chez les sujets que les sujets asthmatiques (Boulay, Henry, Bosse, Boulet, & Morissette, 2017).
Flouris et al. ont voulu évaluer l’impact de l’inhalation active de cigarette électronique chez les fumeurs de cigarette de tabac. Pour cela, les sujets pouvaient utiliser la cigarette électronique ad libitum pour une durée de une heure, avec une concentration de nicotine contenue dans le e-liquide ajustée pour leur consommation normale de cigarette de tabac. Le groupe de recherche a également voulu investiguer l’impact d’une exposition passive aux vapeurs de cigarette électronique. Pour cela, des sujets non-fumeurs étaient
électronique et d’un flux d’air constant de 4L/min. Ils ont pu montrer qu’une exposition, active ou passive, à la cigarette électronique n’affecte pas significativement les fonctions pulmonaires comparativement aux sujets exposés à l’air ambiant (Flouris et al., 2013).
Dans une récente étude, des sujets fumeurs, non-fumeurs et utilisant la cigarette électronique ont été recrutés, et les sujets fumeurs utilisant également la cigarette électronique ont été exclus de l’étude. À partir de biopsies de cellules épithéliales nasales, ils ont pu déterminer que 358 gènes sont différentiellement exprimés entre les sujets utilisateurs de cigarette électronique et non-fumeurs, dont l’expression de 53 de ces gènes est communément dérégulée chez les fumeurs. Ils ont donc pu mettre en évidence quatre voies signalétiques qui sont communément dérégulées avec le tabac suivant une exposition aux vapeurs de cigarette électronique, soit les voies d’interactions cytokine-cytokine, d’apoptose, des récepteurs de type Toll et des récepteurs de type NOD. Ce jeu de données permet de dresser un portrait très exhaustif des impacts génétiques de la cigarette électronique et de son impact sur les processus inflammatoires. Toutefois, les sujets utilisant la cigarette électronique recrutés dans cette étude étant majoritairement des ex-fumeurs, il est possible que l’impact observé soit dû au statut tabagique des sujets. Il serait donc intéressant d’évaluer l’impact de la cigarette électronique sur les voies de signalisation chez des sujets dont le statut tabagique est inexistant (Martin et al., 2016).
Compte tenu de l’hétérogénéité des populations étudiées dans ces différentes études, il est difficile de dresser un portrait exact des impacts pulmonaires de la cigarette électronique. Le temps très court d’exposition aux vapeurs de cigarette électronique pour la majorité des études et l’ajout ou non de nicotine et de saveurs dans le e-liquide pourraient expliquer les résultats contradictoires obtenus concernant son impact sur les fonctions pulmonaires des sujets. Il est donc nécessaire d’évaluer l’impact de l’utilisation à long terme de la cigarette électronique, tant chez des sujets sains que chez des sujets fumeurs de cigarette
de tabac, représentant la plus grande proportion d’utilisateurs de cigarette électronique. Il serait également essentiel de comparer l’impact des vapeurs de cigarette électronique avec ou sans nicotine, afin de cerner les effets du véhicule de la nicotine.
La cigarette électronique étant un produit nouveau sur le marché, il est important d’évaluer son impact sur les fonctions physiologiques de façon exhaustive. Les modèles animaux contribuent largement à cette fin, étant plus rapides et moins couteux que les études de cohortes. La prochaine section veillera à détailler les récentes études qui se sont attardées à investiguer les effets de la cigarette électronique sur les processus pulmonaires et inflammatoires.
1.1.3.3. Études in vivo
Jusqu’à maintenant, peu d’études ont été réalisées chez l’animal afin d’évaluer les effets de l’inhalation des vapeurs de cigarette électronique. Un groupe de recherche a exposé des souris A/J durant quatre mois aux vapeurs de cigarette électronique contenant de 0 ou 18 mg/ml de nicotine. Ils ont ainsi montré l’induction d’une hyperactivité des voies respiratoires ainsi qu’une augmentation de la production de mucus et de cytokines pro-inflammatoires suivant une exposition aux vapeurs de cigarette électronique contenant de la nicotine. Toutefois, aucun changement dans ces paramètres n’a été observé chez les souris exposées aux vapeurs de cigarette électronique sans nicotine comparativement au groupe exposé à l’air ambiant, indiquant un effet de la nicotine seulement (Garcia-Arcos et al., 2016). Une autre étude a évalué l’impact des vapeurs de cigarette électronique sur les processus immunologiques innés. Utilisant un modèle de souris CD-1 exposées quatre semaines aux vapeurs de cigarette électronique contenant 24 mg/ml de nicotine, ils ont montré qu’une telle exposition n’entraine pas le recrutement de cellules inflammatoires dans le lavage
broncho-alvéolaire. On retrouve par contre une augmentation de la production de cytokines pro-inflammatoires, telles que les cytokines CXCL1 et TREM-1, toutes deux impliquées dans la réponse médiée par les neutrophiles. Toutefois, en absence de souris exposées aux vapeurs de cigarette électronique sans nicotine, il est difficile de discerner les impacts du e-liquide en soit de l’impact de la nicotine sur ces paramètres (J. H. Hwang et al., 2016). Une récente étude a utilisé un modèle d’exposition de souris pendant huit semaines aux vapeurs de cigarette électronique, utilisant des e-liquides aromatisés au tabac, composés de 100% de propylène glycol ou de 100% glycérol, et contenant 0 ou 12 mg/ml de nicotine. Ils ont donc pu illustrer qu’une exposition prolongée aux vapeurs de cigarette électronique induisait une diminution des fonctions pulmonaires des voies distales. Ils ont également observé une augmentation de la réactivité bronchique à la métacholine suivant une exposition au glycérol, indépendamment de la concentration de nicotine. Ces résultats suggèrent qu’une exposition aux vapeurs de cigarette électronique peut induire une altération dans les fonctions pulmonaires (Larcombe et al., 2017). Il serait intéressant d’investiguer ce phénomène dans un modèle d’exposition plus chronique afin de vérifier si les fonctions pulmonaires déclinent encore davantage dans le temps.
Il existe présentement une multitude de modèles animaux et de types de système d’exposition, ce qui rend les conclusions des études présentées difficilement interprétables et comparables. En effet, la quasi-totalité de ces études utilise des e-liquides contenant des concentrations différentes de nicotine. Or, la nicotine peut avoir un effet anti-inflammatoire dans plusieurs modèles animaux de maladies inflammatoires (Lakhan & Kirchgessner, 2011; Wang et al., 2003; Wei et al., 2015; Wu et al., 2014). Les études présentées ont également utilisé des e-liquides contenant différentes saveurs, dont les composantes peuvent également avoir des effets cellulaires (Lerner et al., 2016). Comme pour les études cliniques, il est donc difficile de discerner les effets du propylène glycol et du glycérol de ceux de la nicotine et des saveurs sur les processus pulmonaires.
Le but de notre étude était donc de cerner les effets pulmonaires de la cigarette électronique en utilisant un modèle d’exposition aux vapeurs de cigarette électronique en utilisant un e-liquide sans nicotine et sans saveur. De cette façon, nous avons isolé les effets de l’inhalation de propylène glycol et de glycérol des effets de la nicotine et des différentes saveurs. Les conclusions de nos recherches sont présentées dans le Chapitre II de ce mémoire. Puisque nous avons déterminé que l’exposition aux vapeurs de cigarette électronique entraine une perturbation au niveau de l’expression des gènes impliqués dans la régulation du cycle circadien pulmonaire, le fonctionnement du cycle circadien, son implication dans les processus métaboliques et les conséquences engendrées par sa dérégulation sont présentées dans la section 1.2.
Éléments importants à retenir sur la cigarette électronique
® La cigarette électronique est un produit récent et très populaire auprès des fumeurs et des jeunes.
® Plusieurs modèles de cigarettes électroniques sont disponibles commercialement. Il existe également une multitude de concentrations de nicotine et de saveurs contenues dans le e-liquide.
® Des études in vitro ont montré que les vapeurs de cigarette électronique ont un effet
potentiellement cytotoxique, bien que celui-ci soit moindre que celui du tabac.
® Des études in vitro et chez l’animal suggèrent un effet pro-inflammatoire de la cigarette électronique, avec un impact tant sur les cellules immunitaires que sur les capacités d’infection d’un pathogène.
® Les études cliniques, menées sur des petites cohortes, souvent composées de fumeurs et avec une exposition aiguë aux vapeurs de cigarette électronique, montrent un impact minime de celle-ci sur les fonctions pulmonaires des sujets
1.2. Le cycle circadien
Le terme cycle circadien, provenant du latin circa (environ) et dies (jour), établi en 1959 par Dr Franz Halberg, permet de décrire les phénomènes dont les oscillations biologiques se produisent en synchronisme avec la rotation de la Terre (F. Halberg, Halberg, Barnum, & Bittner, 1959). Considéré comme un processus adaptatif permettant d’anticiper les variations environnementales (Dunlap, Loros, & DeCoursey, 2004), il est retrouvé chez la majorité des eucaryotes. L’horloge circadienne permet d’optimiser le métabolisme et l’expression génique de l’organisme en fonction des cycles jour-nuit (Altman, 2016). De cette façon, tous les processus biologiques présents chez les mammifères ont des cycles d’une période de 24 heures, par exemple les cycles du sommeil, la température corporelle, la sécrétion d’hormones, différentes voies métaboliques et les fonctions pulmonaires (Bechtold, Gibbs, & Loudon, 2010).
1.2.1. Anatomie et régulation du cycle circadien
Il existe un rythme circadien dans chaque organe et même chaque cellule (Altman, 2016). Chez les mammifères, plusieurs gènes voient leur expression régulée par le cycle circadien. En effet, 50% des ARN codant pour des protéines et 30% des ARN non codants observent des oscillations d’expression dans le temps. Dû à leur relation en lien étroit avec le métabolisme de l’organisme, certains organes sont très fortement contrôlés par le cycle circadien, parmi lesquels on retrouve le foie, les reins et le poumon, avec respectivement 16%, 13% et 12% de leurs gènes qui oscillent dans le temps. Toutefois, seulement 10 gènes oscillent communément dans tous les types cellulaires, parmi lesquels se trouvent ceux qui composent le mécanisme de régulation du cycle circadien (Zhang, Lahens, Ballance, Hughes, & Hogenesch, 2014).
Chez les mammifères, le noyau suprachiasmatique, situé dans l’hypothalamus, orchestre le rythme circadien central en réagissant aux influx lumineux de l’environnement qui lui sont transmis par des neurones très spécialisés via le tractus rétinohypothalamique (Figure 1.2) (Bechtold et al., 2010). Des signaux non lumineux (e.g. l’apport en nourriture, la température ou encore l’exercice physique) peuvent être également transmis au noyau suprachiasmatique et permettent un ajustement fin du rythme circadien, particulièrement au niveau des organes périphériques (Logan & Sarkar, 2012; Rosenwasser, 2009). Le noyau suprachiasmatique intègre ces différents signaux, aussi appelés Zeitgeber. Ce terme allemand a été établi par le Dr Jürgen Aschoff et signifie « donneur de temps » ou synchronisateur (Aschoff, 1965). Le noyau suprachiasmatique permet donc la coordination des rythmes circadiens centraux et de ceux des autres parties du cerveau et des autres organes par voie neuronale ou endocrine. La régulation endocrine se fait via l’axe hypothalamo-pituito-surrénalien (HPA) et le relâchement d’adrénocorticotrophine (ACTH) par la glande
Figure 1.2 : Régulation autonomique et endocrine du cycle circadien.
Tiré et adapté de (Scheiermann, Kunisaki, & Frenette, 2013)
Rein Moelle osseuse Foie Rate
Horloge centrale du SCN Oscillations des organes périphériques Glucocorticoïdes Noradrénaline Adrénaline Glandes Surrénales ACTH Glucocorticoïdes SNS Cerveau Tractus rétinohypothalamique Œil Lumière
pituitaire, en collaboration avec le système nerveux sympathique (SNS). Cela permet la régulation de la sécrétion d’hormones (glucocorticoïdes, adrénaline, noradrénaline) par les glandes surrénales, hormones qui auront un rôle effecteur dans divers processus métaboliques et inflammatoires [Révisé par : (Dibner, Schibler, & Albrecht, 2010; Dickmeis, 2009; Scheiermann et al., 2013)].
Les organes périphériques peuvent avoir des rythmes circadiens qui sont indépendants de celui du noyau suprachiasmatique (Aktar et al., 2002). La régulation fine du cycle circadien par le noyau suprachiasmatique joue un rôle clé dans la synchronisation de plusieurs voies métaboliques et inflammatoires, processus qui seront détaillés dans la section 1.2.3.
1.2.2. Composantes de l’horloge moléculaire
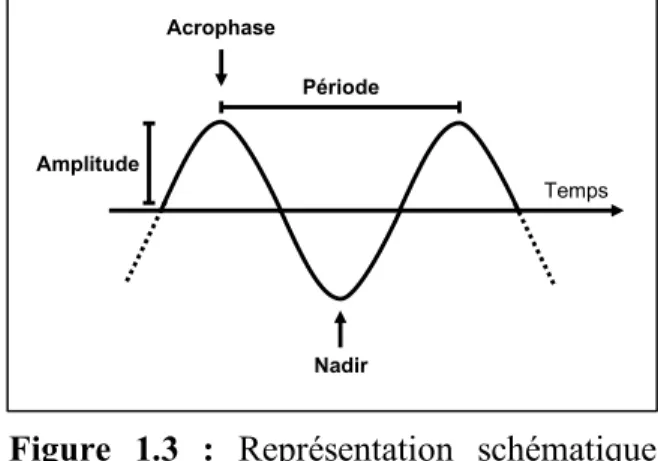
Au niveau moléculaire, le cyclecircadien est composé de plusieurs boucles de rétrocontrôle de transcription et de traduction qui permettent au cycle d’osciller de façon autonome sur une période de 24 heures (Figure 1.4) (Shearman et al., 2000). Les trois gènes period Per1, Per2 et Per3, ainsi que les deux gènes cryptochromes Cry1 et Cry2 sont au cœur de ce mécanisme. La transcription de ces gènes est enclenchée
grâce au dimère des protéines ARNTL et CLOCK qui se lient à la région promotrice (E-box) des gènes Per1/2/3 et Cry1/2, stimulant ainsi leur expression. Les protéines PER et CRY
Amplitude
Période Acrophase
Nadir
Temps
Figure 1.3 : Représentation schématique
d’un cycle d’expression complet d’un gène du cycle circadien.
s’accumulent dans le cytoplasme de la cellule et forment un complexe avec les kinases CK1δ et CKϵ (H. L. Lee, Chen, Lee, Yoo, & Lee, 2009). Transloqué dans le noyau, ce complexe s’associe à l’hétérodimère ARNTL-CLOCK, inhibant ainsi leur propre transcription. À l’acrophase, les protéines PER et CRY sont phosphorylées respectivement par les kinases CK1δ/ϵ et AMPK, ce qui induit leur dégradation par le protéasome. Cette diminution des niveaux de PER et CRY permet l’initiation d’un nouveau cycle de transcription et de traduction. [Révisé par : (Altman, 2016; Asher & Schibler, 2011; Bass & Takahashi, 2010; Bechtold et al., 2010)].
Il existe également une boucle secondaire impliquant les gènes Nr1d1 et Nr1d2, codant pour les récepteurs nucléaires NR1D1 et NR1D2 (Figure 1.4) (Preitner, Damiola, Molina, Albrecht, & Shibler, 2002). Suivant leur translocation, les protéines NR1D1 et NR1D2 se lient au domaine RORE présent sur la région promotrice de Arntl, et inhibent son expression et celle de CLOCK. Le domaine RORE se lie également aux récepteurs RORα,
NR1D1/2 E-box RORα,β E-box CRY1,2 E-box NAMPT E-box PER1,2,3 E-box NR1D1/2 RORs Régulation de l’inflammation CRY PER AMPK CRY P PER P Dégradation CK1δ/ϵ CRY P PER P NAMPT NAD+ SIRT1 SIRT1 NR1D1/2 ARNTL RORE Métabolisme Régulation post-transcriptionnelle CK1δ/ϵ ARNTL CLOCK RORs
RORβ et RORγ qui, contrairement à NR1D1 et NR1D2, stimulent la transcription de Arntl. Bien que la boucle de rétrocontrôle formée par les récepteurs NR1D1/2 et RORs ne soit pas essentielle au fonctionnement du cycle circadien, elle rend son mécanisme plus stable en permettant l’expression de gènes circadiens à l’antiphase de ceux régulés par la boucle formée de PER et CRY(Preitner et al., 2002). [Révisé par : (Altman, 2016; Asher & Schibler, 2011; Bass & Takahashi, 2010; Bechtold et al., 2010)]
Les modifications post-traductionnelles des protéines du cycle circadien affectent leur stabilité, leur activité et leur localisation (Albrecht, 2012). Au cours de la journée, il y a phosphorylation cyclique de différentes protéines, ce qui permet la régulation fine de l’expression des protéines impliquées dans le cycle circadien (Grimaldi, Nakahata, Masubuchi, & Sassone-Corsi, 2009; Hirayama et al., 2007; Nakahata et al., 2008). Par exemple, la phosphorylation rythmique de CLOCK entraine sa dimérisation avec ARNTL, sa translocation dans le noyau ainsi que sa dégradation, ce qui a pour effet de moduler l’expression des autres gènes impliqués dans le cycle (Akashi & Nishida, 2000; Allada & Meissner, 2005; Hamilton & Kay, 2008; Kondratov, Kondratova, Gorbacheva, Vykhovanets, & Antoch, 2006; C. Lee, Etchegaray, Cagampang, Loudon, & Reppert, 2001). La phosphorylation de PER2 et CRY2 régule également leur translocation via la formation d’un complexe avec la kinase CK1δ/ϵ, ce qui permet encore une fois de contrôler leur niveau d’expression (H. L. Lee et al., 2009). L’acétylation joue également un rôle important dans la régulation temporelle de l’expression des gènes du cycle circadien. En effet, on a démontré que la protéine CLOCK possédait une activité histone acétyltransférase (HAT) intrinsèque, qui est essentielle au maintien du rythme circadien (Doi, Hirayama, & Sassone-Corsi, 2006). La protéine Sirtuin 1 (SIRT1) joue un rôle majeur dans les niveaux d’acétylation. En effet, il a été montré que les niveaux de SIRT1 oscillent dans le temps, permettant ainsi l’acétylation rythmique de ARNLT et PER2, régulant ainsi les niveaux d’expression de ces protéines dans le temps (Sundar, Yao, Sellix, & Rahman, 2015).
Le cycle circadien est donc une machinerie d’expression génique capable de s’autoréguler par des boucles de rétrocontrôle et de modifications post-traductionnelles, lui conférant une capacité adaptative aux changements environnementaux. Ces mécanismes le rendent tout particulièrement apte à moduler les processus métaboliques et immunitaires en réponse aux changements dans les heures de sommeil, aux variations dans les heures d’apport alimentaire et aux changements environnementaux auxquels l’organisme est soumis.
1.2.3. Implication du cycle circadien dans les processus biologiques
Le cycle circadien a une relation bidirectionnelle avec plusieurs processus biologiques, le rendant ainsi ubiquitaire. Les sections suivantes porteront sur son rôle dans les processus métaboliques et inflammatoires, ainsi que sur les impacts d’une dérégulation du cycle circadien sur ces processus.
1.2.3.1. Rôle du cycle circadien dans les processus métaboliques
Pour les organes métaboliques tels que le cœur, les reins, le foie, le pancréas, les tissus adipeux et le tractus gastro-intestinal, le signal circadien le plus important est sans aucun doute l’apport en nourriture (Damiola et al., 2000; Hoogerwerf et al., 2007; Zvonic et al., 2006). Une composante essentielle au maintien de l’homéostasie des nutriments est la synchronisation des cycles d’activité et de repos, des rythmes d’alimentation et de l’utilisation et le stockage de l’énergie avec les cycles jour/nuit qui s’étalent sur une période de 24 heures. On retrouve donc une régulation temporelle de nombreux processus métaboliques, par exemple la synthèse et la dégradation protéique, le métabolisme du glucose, la synthèse et l’élimination du cholestérol ou encore la synthèse de divers récepteurs nucléaires, ligand et cofacteurs (Panda et al., 2002). Au cours de la journée, on observe un changement dans les niveaux d’acides rétinoïques, d’hèmes, ou encore d’acides gras. On
observe également des variations dans les niveaux de divers récepteurs, par exemple les récepteurs de glucocorticoïdes (GR), les récepteurs d’acide rétinoïque (RAR), ou encore les récepteurs nucléaires PPARs. Cette oscillation dans le temps de la concentration de ces différents ligands et récepteurs influence l’expression de Arntl, ce qui mène à des rythmes circadiens locaux propres à chaque cellule, et donc à chaque organe. (Bass & Takahashi, 2010). Les glucocorticoïdes jouent également un rôle central dans la régulation du métabolisme par le cycle circadien. En effet, le récepteur
du glucocorticoïde se lie au promoteur de PER2, ce qui module la production de leptine, hormone inhibant la faim et la tolérance au glucose (So, Bernal, Phillsbury, Yamamoto, & Feldman, 2009).
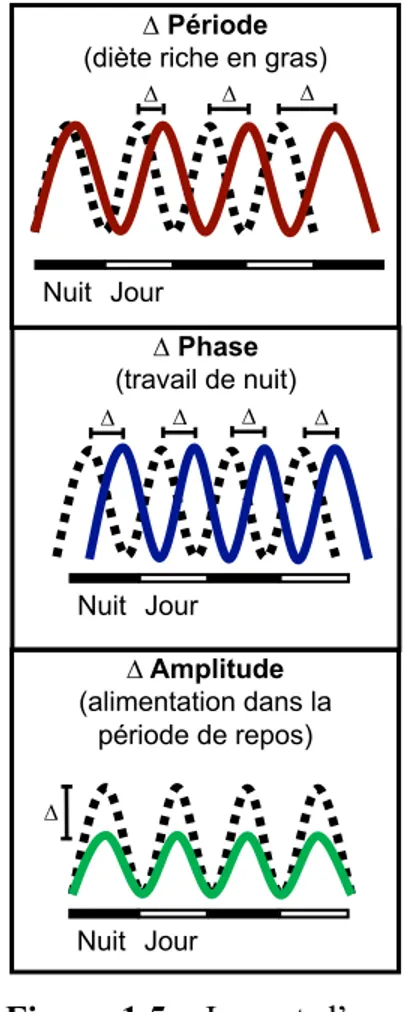
Une perturbation du cycle circadien peut avoir un impact majeur sur la régulation métabolique. On a également montré que les souris déficientes pour le gène
Clock (ClockΔ19) développent une hypertriglycéridémie et une hypercholestérolémie et sont plus susceptibles au développement de l’obésité suite à l’administration d’une diète riche en gras (Turek et al., 2005). Le métabolisme du glucose est également régulé par le cycle circadien. En effet, les cellules β du pancréas produisent l’insuline de façon cyclique sur une période de 24 heures (Peschke & Peschke, 1998). Il est connu qu’un trouble alimentaire peut affecter le cycle d’expression des gènes du cycle circadien. En effet, un apport en nourriture lors de la période de repos entraine une désynchronisation entre le cycle circadien central du noyau suprachiasmatique et celui des organes
Nuit Jour
∆ Période
(diète riche en gras)
∆ Amplitude (alimentation dans la période de repos) Nuit Jour ∆ Phase (travail de nuit) Nuit Jour ∆ ∆ ∆ ∆ ∆ ∆ ∆ ∆
Figure 1.5 : Impact d’une
perturbation métabolique sur le cycle d’expression
des gènes du cycle
périphériques (Damiola et al., 2000; Hoogerwerf et al., 2007; Mukherji et al., 2015), dont ceux des tissus adipeux (Zvonic et al., 2006). Les souris ayant une telle alimentation, dite restreinte dans le temps, présentent un syndrome métabolique, ce qui peut mener au diabète, une hypertriglycéridémie et une hypercholestérolémie (Mukherji et al., 2015). Une diète riche en gras entraine également une perturbation du niveau du cycle circadien. Les souris recevant une telle alimentation ont des niveaux d’activité et d’alimentation plus élevés dans la période de repos contrairement aux souris ayant une alimentation normale. Ces souris ont également une perturbation de l’expression des gènes de la régulation du cycle circadien dans le tissu adipeux et le foie, sans que ces changements soient observés dans l’hypothalamus. Une étude clinique menée par le groupe « Québec en forme » a également montré une corrélation entre un indice de masse corporelle élevé et un faible nombre d’heures de sommeil (Chaput, Brunet, & Tremblay, 2006). Ensemble, ces résultats montrent le rôle crucial de l’alimentation sur le cycle circadien (Kohsaka et al., 2007).
Dû à la relation bidirectionnelle entre le cycle circadien et l’alimentation, une perturbation dans le cycle circadien de même qu’un apport en nourriture à un moment anormal de la journée peuvent causer un désalignement entre les cycles circadiens central et périphérique. Ce phénomène pourrait expliquer le déclenchement et la progression de troubles métaboliques tels que l’obésité, le diabète et les troubles de sommeil.
1.2.3.2. Rôle du cycle circadien dans la régulation de l’inflammation
Dès le début des années 60, on a pu observer qu’il existait une oscillation dans le temps de la capacité de la défense antibactérienne chez les souris auxquelles a été administrée de façon intrapéritonéale l’endotoxine de la bactérie Escherichia coli (F. Halberg, Johnson, Brown, & Bittner, 1960). Depuis, plusieurs études ont permis de comprendre l’implication du cycle circadien dans différentes réponses inflammatoires.
L’horloge centrale du noyau suprachiasmatique, par son contrôle rythmique sur les régulateurs autonomiques et endocrines, joue un rôle capital dans la régulation du système immunitaire (Logan & Sarkar, 2012). Le noyau suprachiasmatique possède des projections axonales dans le noyau paraventriculaire, section du cerveau également située dans l’hypothalamus. Le noyau paraventriculaire contrôle les influx noradrénergiques qui entrainent le relâchement de norépinephrine par la rate. Cela a pour effet de moduler l’activité de plusieurs cellules immunitaires, dont les cellules NK, cellules importantes dans l’immunité innée et dans l’immunosurveillance de cellules cancéreuses (Logan et al., 2011). Le recrutement des neutrophiles dans les muscles squelettiques est également dépendant des signaux noradrénergiques, qui induisent une expression rythmique de molécules d’adhésion ICAM-1 par les cellules endothéliales du muscle. Cela module la migration des neutrophiles au site d’inflammation, avec une adhérence accrue aux vaisseaux sanguins au début de la période active de la souris (Scheiermann et al., 2012).
La régulation hormonale du noyau suprachiasmatique influence également la régulation de l’inflammation. La libération d’ACTH par le noyau suprachiasmatique stimule la production de glucocorticoïdes par les glandes surrénales (Dickmeis, 2009). Les glucocorticoïdes ont des propriétés anti-inflammatoires et peuvent réguler la production de cytokines et le trafic des leucocytes (Coutinho & Chapman, 2011; Dickmeis, 2009). Il a également été démontré que les glucocorticoïdes jouent un rôle majeur dans le contrôle de la réaction inflammatoire suite à une infection bactérienne (Gibbs et al., 2014).
Les médiateurs de l’immunité innée sont aussi influencés par le cycle circadien. Chez l’humain et la souris, les niveaux de lymphocytes sanguins oscillent en fonction de la période de la journée (Ackermann et al., 2012; Besedovsky, Dimitrov, Born, & Lange, 2016; Oishi et al., 2006; Pelegri et al., 2002). On retrouve un nombre de lymphocytes plus élevé pendant la période de repos, soit la nuit pour l’humain et le jour pour les rongeurs. D’autres cellules de l’immunité innée, comme les granulocytes, les monocytes et les cellules NK, sont aussi présentes de façon cyclique.
La quasi-totalité des récepteurs impliqués dans les processus d’immunosurveillance par les systèmes immunitaires inné et acquis active des facteurs de transcription de la voie NF-κB. La voie activée de NF-κB se lie à la séquence consensus de plusieurs promoteurs de gènes qui stimulent la prolifération, la survie et la différenciation cellulaire. Elle favorise également la production de cytokines pro-inflammatoires, ce qui la rend critique dans la
Figure 1.6 : Régulation temporelle de l’inflammation par le cycle circadien.
Tiré et adapté de (Curtis, Bellet, Sassone-Corsi, & O'Neill, 2014) Inactive Active ZT12 ZT15 ZT18 ZT21 ZT0 ZT3 ZT6 ZT9 Plus grande induction de cytokines proinflammatoires par le LPS (ZT12) Système immunitaire près à contrer une attaque Réparation et régénération par le système immunitaire Apogée des leucocytes dans les tissus (ZT13) Réduction de la mortalité par le LPS (ZT18) Augmentation de l’élimination de Salmonella (ZT16) Faible capacité de l’élimination de Salmonella (ZT4) Apogée des leucocytes sanguins (ZT5) Augmentation de capacité de clairance L. monocytogenes (ZT8) Plus petite induction de cytokines proinflammatoires par le LPS (ZT0) Augmentation de la mortalité par le LPS (ZT10)
réponse de l’hôte contre un pathogène. Bien qu’elle soit bénéfique en contexte d’infection, une activation constitutive de la voie NF-κB entraine des dommages tissulaires ou encore l’activation d’oncogènes (Ruland, 2011). Le cycle circadien permet la régulation temporelle de l’activation de la voie NF-κB, et donc des gènes en aval de celle-ci. Cette modulation passe par l’action d’un complexe créé par CLOCK et la sous-unité phosphorylée de p65 de κB (Spengler et al., 2012). La protéine RORα bloque également la translocation de NF-κB, bloquant ainsi la sécrétion de cytokines pro-inflammatoires (Delerive et al., 2001; Dzhagalov, Zhang, & He, 2004).
Le cycle circadien est également impliqué dans la modulation de la réponse inflammatoire. On retrouve une plus grande réponse pro-inflammatoire au début de la période active de l’organisme (Gibbs et al., 2012), caractérisée par un plus grand nombre de granulocytes, monocytes ou encore cellules NK (Ackermann et al., 2012). La protéine NR1D1 joue un rôle prépondérant dans le contrôle de la réponse inflammatoire. En effet, la délétion du gène nr1d1 dans les cellules épithéliales bronchiques induit une perte de la production temporelle de cytokines. L’activation de ce gène entraine une augmentation de l’inflammation lorsque les cellules épithéliales sont stimulées avec du lipopolysaccharide (LPS) (Gibbs et al., 2012). Par leur liaison à son promoteur, NR1D1 et RORα permettent une régulation de CCL2, chimiokine chargée de recruter les monocytes au site d’inflammation (Sato et al., 2014). L’activité des monocytes et des macrophages est primordiale dans la défense de l’hôte. Une régulation temporelle de leur activité est donc déterminante, ce qui explique que 8% des gènes du macrophage oscillent dans le temps (Keller et al., 2009). Plusieurs de ces gènes sont impliqués dans les voies activées par les récepteurs TLR4, récepteur impliqué dans la reconnaissance du motif moléculaire associé aux pathogènes (PAMP) spécifiques du LPS des bactéries (Keller et al., 2009). On a également montré que la capacité de phagocytose des macrophages fluctue en fonction du temps, et qu’elle est plus efficace dans la période active (Hayashi, Shimba, & Tezuka, 2007). Ces mécanismes
permettent d’augmenter l’immunosurveillance afin de préparer l’organisme à faire face aux antigènes auquel il sera confronté durant la période active.
Une perturbation du cycle circadien causée par un décalage horaire expérimental (Castanon-Cervantes et al., 2010) ou des conditions de noirceur constante (Marpegan, Bekinschtein, Costas, & Golombek, 2005) cause une augmentation de l’inflammation et de la mortalité induites par le LPS. De plus, chez la souris, une perturbation dans le cycle circadien des cellules épithéliales bronchiques induit une perturbation de la sécrétion rythmique de glucocorticoïdes. Cela cause une augmentation de la sensibilité au LPS, particulièrement au ZT12, période correspondant à la juxtaposition de la période active et de repos (Gibbs et al., 2014), montrant bien une régulation temporelle de la réponse inflammatoire contre les bactéries. Par exemple, la réponse inflammatoire contre une infection à Salmonella est plus importante dans la période active (Bellet et al., 2013), ce qui coïncide avec une présence accrue de leucocytes circulants précédemment décrite (Scheiermann et al., 2013). Le cycle circadien et la régulation de l’inflammation ont une relation bidirectionnelle. En effet, une mutation dans le gène clock induit une altération de l’expression de médiateurs pro-inflammatoires, ce qui cause une exacerbation de l’inflammation causée par le LPS (Gibbs et al., 2014), ou une incapacité à éliminer une infection bactérienne (Bellet et al., 2013). Inversement, une infection bactérienne affecte la période et l’amplitude de l’expression des gènes du cycle circadien. (Bellet et al., 2013; Gibbs et al., 2014).
Encore une fois, il existe une relation bidirectionnelle entre le cycle circadien et la régulation de l’inflammation, cruciale dans la défense de l’hôte contre les pathogènes. Une perturbation dans cette relation mène à une exacerbation de l’inflammation, qui peut être à l’origine de plusieurs pathologies. La prochaine section s’intéressera à l’impact d’une dérégulation du cycle circadien dans le développement de pathologies pulmonaires.
1.2.3.3. Rôle du cycle circadien dans les pathologies pulmonaires
Au niveau pulmonaire, on retrouve plusieurs gènes qui observent des cycles d’expression tout au long de la journée (Zhang et al., 2014), dont les gènes régulateurs du cycle circadien (Oishi, Sakamoto, Okada, Nagase, & Ishida, 1998a, 1998b). On retrouve également des gènes codant pour des protéines de la matrice extracellulaire, des protéines impliquées dans la signalisation cellulaire, des enzymes impliqués dans les processus métaboliques ou encore des gènes connus pour être dérégulés en contexte pathologique (Sukumaran, Jusko, Dubois, & Almon, 2011).
Chez l’humain et la souris, la régulation de l’inflammation par le cycle circadien pulmonaire joue un rôle essentiel dans la défense de l’hôte, le poumon étant l’organe le plus en contact avec l’environnement extérieur de l’organisme (Evans & Davidson, 2013; Gibbs et al., 2009; Gibbs et al., 2014; Hadden, Soldin, & Massaro, 2012; Haspel et al., 2014; J. W. Hwang, Sundar, Yao, Sellix, & Rahman, 2014; Pekovic-Vaughan et al., 2014; Sundar, Ahmad, et al., 2015). On retrouve notamment un cycle circadien très robuste dans les cellules épithéliales bronchiques, ce qui lui permet d’orchestrer la réponse inflammatoire en fonction de moment de la journée (Gibbs et al., 2009). Une perturbation dans le cycle circadien pulmonaire causée par un décalage horaire ou encore des quarts de travail de nuit peut entrainer une altération des fonctions pulmonaires, menant au développement et au maintien de pathologies pulmonaires (Hadden et al., 2012). Par exemple, les souris dont le gène arntl est supprimé ont des fonctions pulmonaires altérées. Chez ces souris, on observe alors une augmentation de la résistance et de l’élastance ainsi qu’une diminution de la compliance des voies aériennes, caractéristiques ressemblant à celles obtenues dans un contexte profibrotique (Sundar, Ahmad, et al., 2015).
Le cycle circadien joue un rôle important dans la sévérité de l’asthme. Certains patients asthmatiques voient leur qualité de sommeil grandement diminuée en raison de leurs fréquentes exacerbations, entrainant ainsi des perturbations dans le cycle circadien pulmonaire. Les patients entrent alors dans un cercle vicieux d’exacerbations liées au manque de sommeil, ce qui détériore leur qualité de vie (Levin et al., 2014; Lewis, 2001). Aussi, un des traitements les plus fréquents dans l’asthme est l’administration de corticostéroïdes inhalés, aussi appelés glucocorticoïdes. Or, la régulation du cycle circadien des cellules bronchique est modulée par les niveaux de glucocorticoïdes contrôlés par l’axe hypothalamo-pituito-surrénalien médiée par le noyau suprachiasmatique. Ainsi, une perturbation du cycle circadien pulmonaire induite par une qualité de sommeil réduite combiné à un apport en glucocorticoïde exogène induit une exacerbation de la réponse à l’allergène (Gibbs et al., 2009; Gibbs et al., 2014). Ici encore, le cycle circadien a une relation bidirectionnelle avec la régulation de l’inflammation dans l’asthme. La protéine RORα permet la modulation de la réponse à l’allergène. En effet, les souris ayant une délétion du gène Rorα présentent une diminution de l’inflammation, caractérisée par une diminution de cellules inflammatoires dans le lavage broncho-alvéolaire (LBA) suivant l’administration d’ovalbumine, de même qu’une réduction de la production de cytokines pro-inflammatoires normalement retrouvées en contexte d’asthme allergique, telles que l’IL-13, l’éotaxine, IL-4 et l’IL-5, ainsi qu’une augmentation de la production d’IgE (Jaradat et al., 2006).
On observe également cette relation bidirectionnelle entre le cycle circadien et la réponse à la fumée de tabac. Comme pour les patients asthmatiques, les patients qui souffrent de la MPOC ont une faible qualité de sommeil, une diminution générale du temps de sommeil, une augmentation des périodes de réveil après l’endormissement, et une diminution de la période de sommeil paradoxal (Parish, 2009). Cette diminution de qualité de sommeil est corrélée avec plusieurs symptômes des sujets MPOC, dont plusieurs syndromes respiratoires (toux, production de mucus, respiration sifflante), une désaturation nocturne en
oxygène ainsi qu’une hypercapnie (Lewis, 2001). Chez la souris, une exposition aiguë à la fumée de cigarette réduit considérablement l’amplitude et la période des gènes régulateurs du cycle circadien dans le poumon et le cerveau (J. W. Hwang et al., 2014). On observe également une augmentation de l’inflammation induite par le tabac suivant une délétion spécifique du gène Arntl dans les cellules épithéliales, montrant encore une fois le rôle capital du cycle circadien des cellules épithéliales dans la régulation de l’inflammation. Les mécanismes de modulation du cycle circadien par le tabac impliquent la déacétylase SIRT1 (Sundar, Yao, et al., 2015). En effet, la fumée de cigarette cause une diminution des niveaux de SIRT1, ce qui induit une augmentation de l’acétylation ARNTL, et donc une réduction de son expression (J. W. Hwang et al., 2014). Cela a pour conséquence d’augmenter l’expression de Per2, gène majeur impliqué dans les boucles de rétrocontrôle du cycle circadien (Yao & Rahman, 2012). En clinique, on observe des taux de SIRT1 diminués dans les macrophages et les cellules épithéliales alvéolaires de fumeurs. Cette augmentation est encore plus marquée chez les sujets MPOC, suggérant un rôle central pour SIRT1 dans la pathogenèse de cette maladie (Rajendrasozhan, Yang, Kinnula, & Rahman, 2008).
Une perturbation du cycle circadien est donc une partie importante de la réponse aux agents infectieux et dans la réponse inflammatoire de plusieurs pathologies pulmonaires. La cigarette électronique, en entrainant une perturbation du cycle circadien, pourrait donc augmenter la susceptibilité aux infections. Elle pourrait également causer une augmentation dans l’intensité de l’inflammation causée en contexte tabagique ou encore en contexte d’infection bactérienne.