Relation entre le diméthylsulfure (DMS), les structures
hydrographiques et la glace de mer dans la baie de
Baffin
Mémoire
Joanie St-Onge
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Relation entre le diméthylsulfure (DMS), les
structures hydrographiques et la glace de mer dans
la baie de Baffin
Mémoire
Joanie St-Onge
Sous la direction de :
Guillaume Massé, directeur de recherche
Jean-Éric Tremblay, codirecteur de recherche
Résumé
Les concentrations de diméthylsulfure (DMS) à la surface de l’eau ont été déterminées dans la baie de Baffin et dans l'archipel Arctique canadien au cours des étés 2017 (juillet-août) et 2018 (juillet). Plus de 3500 mesures de DMS ont été obtenues à l’aide d’un spectromètre de masse couplé à une trappe cryogénique et une membrane d’échanges gazeux (ACT-MIMS). Ces dernières ont été réalisées parallèlement à des mesures continues de la salinité, la température, la fluorescence (proxy pour la Chlorophyll a (Chl a)) et du rayonnement photosynthétiquement actif (PAR), ainsi que des mesures discrètes de diméthylsulfoniopropionate (DMSP). Les concentrations de DMS ont variées de 2 ordres de grandeur allant de 0.2 à 43.0 nmol L-1 en 2017 et de 1.6 à 55.0 nmol L-1 en 2018. Des points chauds de fortes concentrations de DMS (> 10 nmol L-1) ont été observés en association avec
des fronts hydrographiques importants, ainsi que dans des eaux côtières à forte productivité. Dans les eaux libres du nord de la baie de Baffin, un gradient longitudinal des concentrations de DMS (croissant d'ouest en est, entre 1.0 nmol L-1 et 11.2 nmol L-1) était positivement
corrélé avec les mesures de salinité, de température de surface et de Chl a. Ces résultats suggèrent que la dynamique du DMS est intimement liée aux propriétés physicochimiques et à la signature biologique des masses d'eau dans ce secteur. Des cas de forte concentration de DMS ont été observés à la lisière de la banquise de première année, renforçant le rôle de plus en plus reconnu de la glace de mer dans le cycle du DMS marin. Dans le nord de la mer du Labrador et du détroit de Davis, les concentrations de DMS en eaux libres ont présenté des différences jour-nuit de 2 ordres de grandeur avec des concentrations plus élevées la nuit, plus faibles le jour et des minimums à midi. Bien qu’il soit possible que ces résultats aient été influencés par d’autres facteurs, les concentrations de DMS ont diminué linéairement avec l’augmentation du rayonnement photosynthétiquement actif (PAR) en 2017 ainsi qu'en 2018. Ces résultats suggèrent que, dans certaines régions, les concentrations de DMS peuvent être caractérisées par des variations importantes (> 10 nmol L-1) et rapides (< 24 h) qui seraient négligées par l’interpolation des données, où les données in situ sont manquantes. La présence de points chauds localisés de DMS démontre le potentiel d'utilisation d'instruments automatisés à haute résolution tels que l’ACT-MIMS afin de résoudre la distribution spatiale du DMS et contribuer à l'amélioration de la précision des prédictions des modèles d'émission du DMS.
Abstract
Sea surface dimethylsulfide (DMS) concentrations were determined in Baffin Bay and parts of the Canadian Arctic Archipelago during the summers of 2017 (July-August) and 2018 (July). More than 3500 DMS measurements were obtained using a mass spectrometer coupled with a cryogenic trap and a gaseous exchange membrane (ACT-MIMS). These measurements were performed alongside continuous quantification of sea surface salinity (SSS), sea surface temperature (SST), fluorescence (proxy for Chlorophyll a (Chl a)), photosynthetically active radiation (PAR) and discrete measurements of dimethylsulfoniopropionate (DMSP). Concentrations of DMS varied over 2 orders of magnitude, from ca. 0.2 to 43.0 nmol L-1 in 2017, and from ca. 1.6 to 55.0 nmol L-1 in 2018. Surface water DMS hotspots (> 10 nmol L-1) were observed in association with hydrographic frontal structures, as well as in high productivity coastal waters. In the open water of northern Baffin Bay, an increasing west-to-east gradient of DMS concentrations was positively correlated with SSS, SST and Chl a, suggesting that upper ocean dynamics of DMS are linked to the physicochemical properties and biological signature of water masses in this sector. High DMS concentrations were observed at the ice-edge of ponded first-year ice providing further evidence to the increasingly recognized role sea ice plays in the cycling of marine DMS. In the northern Labrador Sea and Davis Strait, DMS exhibited day-night trends of 2 orders of magnitude with highest concentrations at night and midday minimums. Although it is possible these results were influenced by other factors, concentrations of DMS decreased with increasing PAR in 2017 as well as in 2018. These results suggest that, in some regions, DMS concentrations may be characterized by large (> 10 nmol L-1) and rapid (< 24 h)
variations that would be neglected by data interpolation where in situ data are still sparse. The presence of localized DMS hotspots demonstrates the potential of using high-resolution automated instruments such as the ACT-MIMS to resolve the spatial distribution of DMS and contribute to the improvement of the accuracy of DMS emission model predictions.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des tableaux ... vi
Liste des figures ... vii
Liste des abréviations, sigles, acronymes ... ix
Remerciements ... xi
Avant-propos ... xii
Introduction générale ... 1
Les changements au sein de l’environnement arctique... 1
Le DMS dans un contexte de changement global ... 1
Synthèse du DMSP, précurseur du DMS ... 3
Rôles physiologiques du DMSP ... 4
Les sources de DMS ... 6
Les puits de DMS ... 7
Objectifs ... 8
Chapitre 1 Dimethylsulfide (DMS) hotspots linked to hydrographic frontal structures and sea ice in Baffin Bay ... 10
1.1 Résumé ... 10
1.2 Abstract ... 11
1.2. Introduction ... 13
1.3. Methods ... 15
1.3.1 Physiography of the study area ... 15
1.3.2 Underway sampling method ... 16
1.3.3 Ancillary data ... 18
1.3.4 Software, satellite images and statistical analyses ... 19
1.4. Results ... 20
1.4.2 Algal fluorescence ... 21
1.4.3 Surface concentrations of DMS and DMSPt... 21
1.4.4 Correlation with ancillary oceanographic variables ... 23
1.5. Discussion ... 24
1.5.1 General spatial distribution of DMS concentrations ... 24
1.5.2 Regional variability of DMS in northern Baffin Bay ... 25
1.5.3 Influence of a hydrographic front in Hudson Strait ... 26
1.5.4 DMS and sea ice-edges ... 28
1.5.5 Day-night differences in DMS and DMSPt ... 29
1.6. Conclusion ... 31
1.7. Acknowledgments ... 32
Conclusion générale ... 33
Liste des tableaux
Table 1. Summary of DMS and DMSPt concentrations in 2017 and 2018 ... 37
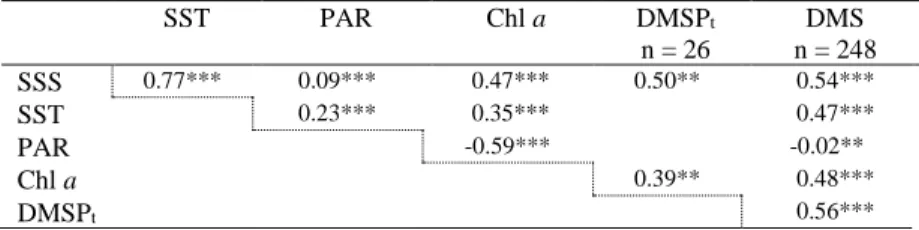
Table 2. Spearman’s rank coefficients of correlation (rs) between SST, SSS, SIC, PAR, Chl
a, DMSPt and DMS concentrations in 2017 (a) for the whole survey, (b) for northern
Labrador Sea and Davis Strait only (same region as in 2018), (c) and in 2018 for the whole survey. p-value ˂ 0.001***, p < 0.01, p < 0.05* ... 37 Table 3.Spearman’s rank coefficients of correlation (rs) between SST, SSS, PAR, Chl a,
DMSPt and DMS concentrations for the longitudinal gradient in Baffin Bay. p-value
˂ 0.001***, p < 0.01**, p < 0.05* ... 38 Table 4. Spearman’s rank coefficients of correlation (rs) between SST, SSS, SIC, PAR, Chl
a, DMSPt and DMS concentrations in Hudson Strait. p-value ˂ 0.001***, p < 0.01**,
p < 0.05* ... 38 Table 5. Spearman’s rank coefficients of correlation (rs) between SST, SSS, SIC, PAR, Chl
a, DMSPt and DMS concentrations for the day-night variations described as (a) D1,
Liste des figures
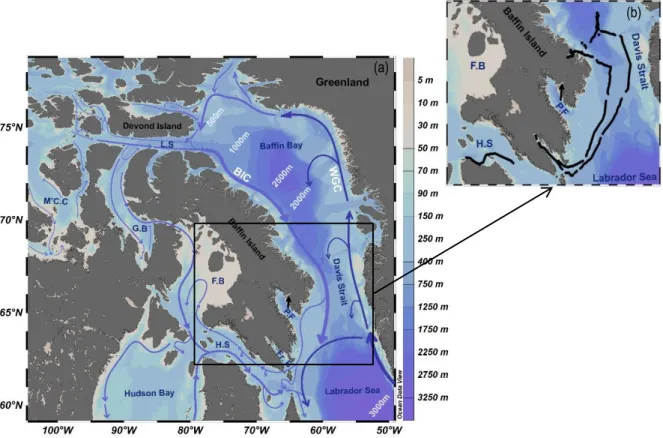
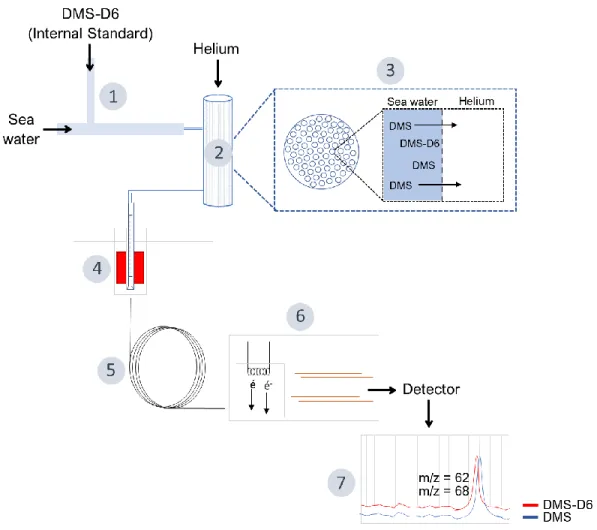
Figure 1. Map of the ship’s cruise track (black line) in (a) 2017 and (b) 2018. Bathymetric map from GEBCO (2014) subsampled at 2x2 grid. General circulation adapted from Curry et al., 2011. L.S: Lancaster Sound, M’C.C: M’Clintock Channel, G.B: Gulf of Boothia, F.B: Foxe Basin, H.S: Hudson Strait, P.F: Pangnirtung Fjord, WGC: West Greenland Current, BIC: Baffin Island Current... 39 Figure 2.1. General scheme of the underway sampling method based on the use of an automated cryogenic trap membrane inlet mass spectrometer (ACT-MIMS). A standard solution of DMS-D6 is supplied to the seawater line (1). Seawater circulates
inside the fibers while their outside is continuously flushed with Ultra High Purity (UHP) Grade helium (2). DMS diffuses through the semi-permeable membrane (3). The sample is concentrated using a cryogenic trap at -90 °C (4). The heating of the trap at 180 °C releases the gaseous DMS loaded onto the resin into the GC column (5). The molecules are ionized by the mass spectrometer and separated according to their mass-to-charge ratio (6). DMS and DMS-d6 were measured by detecting ions
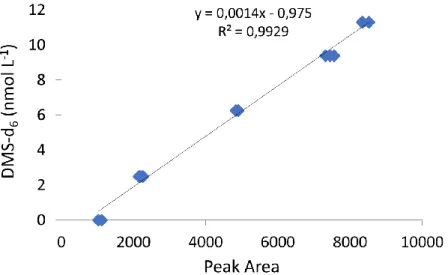
with a mass-to-charge ratio of 62 and 68, respectively (7) ... 40 Figure 2.2. Example of a calibration curve (DMS-d6 as a function of peak area) obtained
during the 2018 expedition (2017-08-03) using deuterated DMS (DMS-d6, [(CD3)2S])
standard solution diluted from frozen stock solutions (2.5 mmol L-1) ... 41
Figure 2.3. LabVIEW program designed for the automation of the analytical sequence including flow rates, modules and data extraction from the GC-MS, the thermosalinograph, the fluorometer and the GPS ... 42 Figure 3.1. Spatial distribution of (a) SSS, (b) SST, (c) SIC, (d) Chl a, (e) DMSPt and (f)
DMS along the cruise track in 2017 ... 43 Figure 3.2. Spatial distribution of (a) SSS, (b) SST, (c) SIC, (d) Chl a, (e) DMSPt and (f)
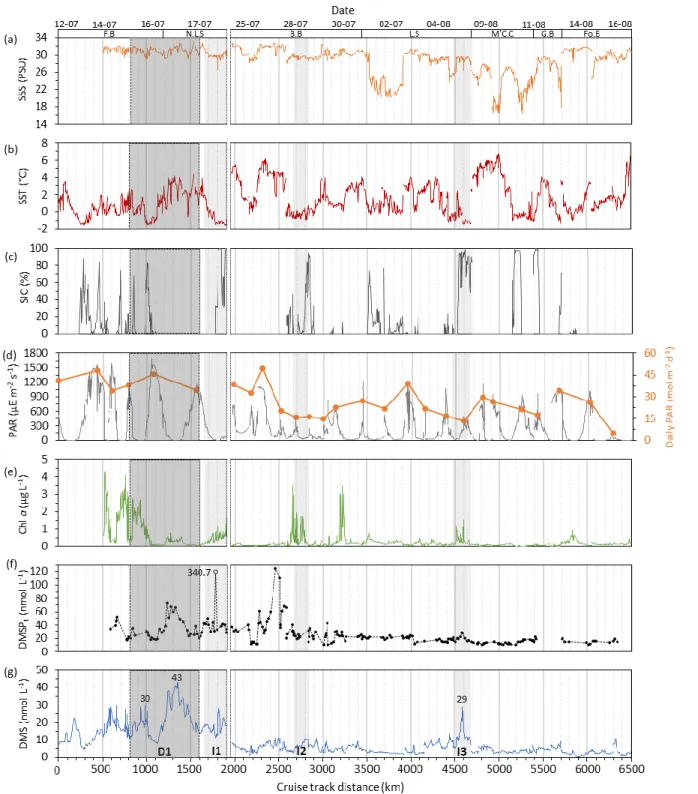
DMS along the cruise track in 2018 ... 44 Figure 4.1. Variability of (a) SSS, (b) SST, (c) SIC, (d) PAR and daily PAR, (e) Chl a, (f) DMSPt and (g) DMS concentrations as a function of cruise track distance in 2017.
Light grey shaded areas represent variations of DMS (> 5 nmol L-1) at the ice edge
(SIC > 50%) referred as I1, I2 and I3 and depicted in Figure 7(a,b,c). Dark grey shaded area represents the 48-h day-night variations referred to as D1 and depicted in Figure 9(a). F.B: Frobisher Bay, N.L.S: northern Labrador Sea, B.B: Baffin Bay, L.S: Lancaster Sound, M’C.C: M’Clintock Channel, G.B: Gulf of Boothia, Fo.B: Foxe Basin. Note the high (off-scale) value of the open circle in (f) and the gap in the data between northern Labrador Sea and Baffin Bay ... 45
Figure 4.2. Variability of (a) SSS, (b) SST, (c) SIC, (d) PAR and daily PAR, (e) Chl a, (f) DMSPt and (g) DMS concentrations as a function of cruise track distance in 2018.
Light grey shaded area represents variations of DMS at the ice edge referred as I4 and depicted in Figure 7(d) and Figure 8. Dark grey shaded areas represent the 42-h and 24-h day-night variations referred as D2 and D3 and depicted in Figure 9(b,c). H.S: Hudson Strait, F.B: Frobisher Bay, N.L.S: northern Labrador Sea, C.B.I: Coast of Baffin Island. Note the high (off-scale) values of the open circles in (f) ... 46 Figure 5. Spatial distribution of (a) SSS, (b) SST, (c) Chl a, (d) DMSPt and (e) DMS
concentrations in northern Baffin Bay between 2017-07-23 and 2017-07-26 ... 47 Figure 6. Spatial distribution of (a) SSS, (b) SST, (c) Chl a and (d) DMS concentrations in Hudson Strait on 2018-07-11. ... 48 Figure 7. DMS, DMSPt, Chl a and SIC at the ice edge in (a), (b), (c) 2017 and in (d) 2018.
Note the high (off-scale) value of the open diamond in (a) ... 49 Figure 8. DMS concentration data superimposed on Copernicus Sentinel-2 data processed by ESA acquired near the coast of Baffin Island on 2018-08-06. Red line: 80% SIC, yellow line: 10% SIC ... 50 Figure 9. Time series of DMS, DMSPt, Chl a and PAR in the northern Labrador Sea and
Davis Strait in (a) July 2017 (b), (c) and July 2018 ... 51 Figure 10. Linear relationship (Model II regression) between DMS concentrations and PAR in the northern Labrador Sea and Davis Strait between (a) 15 and 2017-07-17 (b) and between 2018-07-14 and 2018-07-16 ... 52
Liste des abréviations, sigles, acronymes
ACT-MIMS Automated cryogenic trap membrane inlet mass spectrometer/ Spectromètre de masse automatisé à trappe cryogénique et membrane d’échanges gazeux AMSR2 Advanced Microwave Scanning Radiometer 2
BIC Baffin Island Current/ Courant de l'île de Baffin
CAA Canadian Arctic Archipelago/ Archipel Arctique canadien CCN/NCN Cloud condensation nuclei/ Noyaux de condensation de nuage Chl a Chlorophyll a / Chlorophylle a
CLAW Charlson-Lovelock-Andreae-Warren DMS Dimethylsulfide/ Diméthylsulfure DMSO Dimethylsulfoxide / Diméthylsulfoxyde
DMSP Dimethylsulfoniopropionate / Diméthylsulfoniopropionate
DMSPd Dissolved dimethylsulfoniopropionate/ Diméthylsulfoniopropionate dissous
DMSPt Total dimethylsulfoniopropionate/ Diméthylsulfoniopropionate total
DMS-d6 Deuterated dimethylsulfide/ Diméthylsulfure deutéré
FYI First year ice / Glace de première année
GC-MS Gas chromatography-mass spectrometry/ Chromatographie en phase gazeuse-spectrométrie de masse
GPS Global Positioning System/ Système de positionnement global H2SO4 Sulfuric acid/ Acide sulfurique
LOD Limit of detection/ Limite de détection MeSH Methanethiol/ Méthanethiol
MSA Methane sulfonic acid/ Acide méthanesulfonique
NaOH Sodium hydroxyde/ Hydroxyde de sodium
SIC Sea ice concentration/ Concentration de glace de mer SO2 Sulfur dioxide/ Dioxyde de soufre
SO42- Sulfate
SSS Sea surface salinity/ Salinité de l’eau de surface
SST Sea surface temperature/ Température de l’eau de surface UVA Ultraviolet A radiation/ Radiation ultraviolette A
UVB Ultraviolet B radiation/ Radiation ultraviolette B
WGC West Greenland Current/ Courant du Groenland occidental
rs Spearman’s rank coefficients of correlation/ Coefficient de corrélation de rang
de spearman
SD Standard error of the blanks/ Erreur type des blans
Remerciements
La réalisation de ce projet n’aurait pas été possible sans la précieuse contribution des membres de mon comité d’encadrement : Guillaume Massé, mon directeur de recherche, Jean-Éric Tremblay, mon codirecteur, Martine Lizotte et Maurice Levasseur.
J’aimerais d’abord remercier Maurice Levasseur, sans qui je n’aurais peut-être jamais découvert le fascinant domaine de l’océanographie. Ce fut une découverte révélatrice et un élément déclencheur de mon parcours. Je te serais éternellement reconnaissante pour cette passion que tu m’as transmise et pour cette opportunité qui a changé à tout jamais le cours de ma vie. Merci d’avoir partagé ton expertise et d’avoir cru en moi en me présentant à Guillaume Massé et Martine Lizotte.
Je voudrais remercier Guillaume Massé, mon directeur de recherche, pour sa supervision, ses judicieux conseils, mais surtout pour la confiance qu’il m’a accordé d’entamer à point ce projet, d’avoir pu l’explorer dans toutes ses possibilités et de m’avoir permis de laisser ma curiosité guider ce projet.
Un grand merci à Martine Lizotte, qui était présente dans toutes les étapes importantes de ce projet. Je n’aurais pu partager mes premières expériences en tant qu’océanographe avec une personne aussi merveilleuse. Ta patience, ta gentillesse ainsi que ta ténacité au travail m’ont profondément inspirée. Je te remercie infiniment pour ta considération, ton support constant et tout ce que tu m’as appris.
Ma sincère gratitude à tous ceux qui ont contribué à la réalisation de ce projet : Jean-Éric Tremblay, Michel Gosselin, Rachel Hussherr, Philippe Massicotte, Tim Papakyriakou, Eric Rehm et l’équipe d’Amundsen Science. Je remercie également les capitaines et l'équipage du Navire de la Garde Côtière canadienne (NGCC) Amundsen.
Enfin, je tiens également à souligner le soutien continu de mes parents qui m'ont épaulée, encouragée, mais surtout écoutée depuis le début de mon parcours universitaire. Je remercie tous ces amis découverts durant cette aventure.
Avant-propos
Ce mémoire est l’aboutissement d’un projet de recherche sous la direction de Guillaume Massé, professeur du département de biologie de l’Université Laval (Unité Mixte Internationale ULaval-CNRS Takuvik) et chargé de recherche (CNRS) codirigé par le professeur Jean-Éric Tremblay du département de biologie de l’Université Laval. Il comporte une introduction et une conclusion générale rédigées en français. Le corps du mémoire comporte un chapitre rédigé en anglais sous la forme d’un article scientifique précédé d’un résumé en français. Cet article, dont je suis première auteure, sera soumis à la revue scientifique Biogeosciences à l’hiver 2020. Les données de DMS et de DMSPt présentées
dans ce mémoire ont été obtenues lors de deux expéditions scientifiques à bord du brise-glace NGCC Amundsen durant le Leg 2b – ArcticNet/The W. Garfield Weston Foundation (13 juillet - 17 août 2017) ainsi que durant le Leg 2a – projet BriGHT de Sentinelle Nord /BaySys (5 - 13 juillet 2018) et le Leg 2b – École doctorale et projet BOND de Sentinelle Nord (13 - 24 juillet 2018). Pour l’installation de l’instrument d’analyse à bord du navire en 2017, j’ai eu l’aide de mon directeur, Guillaume Massé, et de Martine Lizotte, professionnelle de recherche au département de biologie de l’Université Laval dans le laboratoire du professeur Maurice Levasseur. Martine Lizotte m’a accompagné pour la mise en fonction de l’instrument et la collecte des échantillons sur le terrain en 2017 et en 2018. Certaines données présentées dans ce mémoire ont été fournies par des collaborateurs. Les données de salinité, de température des eaux de surface et de chlorophylle a ont été obtenues par l’équipe d’Amundsen Science. Les mesures de radiation photosynthétiquement actif ont été fournies par les professeurs Michel Gosselin de l’Institut des Sciences de la Mer de Rimouski (ISMER - Université du Québec à Rimouski) en 2017 et Tim Papakyriakou du département d’Environnement et de Géographie (Université du Manitoba à Winnipeg) en 2018. Les données de concentration de glace de mer ont été obtenues par Philippe Massicotte, professionnel de recherche au département de biologie de l’Université Laval dans le laboratoire du professeur Marcel Babin. Les images de données satellites de glace ont été obtenues avec l’aide d’Eric Rehm, assistant de recherche senior pour Takuvik (CERC-Université Laval) et professionnel de recherche dans le laboratoire du professeur Marcel Babin. Rachel Hussherr, auxiliaire de recherche (Université Laval), a contribué à l’analyse
des données de DMSPt. J’ai effectué la totalité du traitement des données obtenues et rédigé
l’entièreté de ce mémoire et de l’article scientifique. Ce mémoire comprend trois chapitres :
Introduction générale
Chapitre 1 - Dimethylsulfide (DMS) hotspots linked to hydrographic frontal structures and sea ice in Baffin Bay
Joanie St-Onge1, Lizotte, M.1, Massé, G.2, Tremblay, J-É.1, Levasseur, M.1, Gosselin, M.3, Massicotte, P.1
1Département de biologie, Québec-Océan, Université Laval, Québec, Québec, G1V
0A6, Canada
2Département de biologie, Unité mixte internationale Takuvik UL-CNRS,
Université Laval, Québec, Québec G1V 0A6, Canada
3Institut des sciences de la mer (ISMER), Université du Québec à Rimouski, 310
Allée des Ursulines, Rimouski,Québec G5L 3A1, Canada Conclusion générale
Les résultats de ce projet de recherche ont été présentés dans le cadre de congrès, de colloques, de réunions annuelles et d’activité de vulgarisation grand public sous la forme d’affiches scientifiques ou de présentations orales :
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte. High resolution measurements of marine dimethylsulfide in contrasting environments of the Canadian Arctic Archipelago (CAA). Présentation par affiche pour: Congrès ArcticChange, Centre des congrès de Québec, Québec, Canada, 11 au 15 décembre 2017.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte. Mesures à haute fréquence et en continu du DMS océanique dans l'archipel Arctique canadien. Présentation orale pour : Réunion annuelle BOND, Université Laval, Québec, Canada, 14 mars 2018. Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Fine-scale Variability in Oceanic Dimethylsulfide (DMS) Distribution Across Ice-covered and Ice-free Waters of the Canadian Arctic Archipelago in Summer. Présentation orale et par affiche pour : Réunion annuelle Sentinelle Nord 2018, Château Laurier et Manège militaire Voltigeurs de Québec, Québec, Canada, 27 au 30 août 2018.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Mesure à haute résolution d’un gaz climatiquement actif en Arctique : le DMS. Présentation orale pour : 2e édition Pinte Sentinelle Nord, District St-Joseph, Québec, Canada, 13 novembre 2018.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Variabilité à haute résolution de la distribution océanique du sulfure de diméthyle (DMS) dans les eaux couvertes et libres de glace de l’archipel Arctique canadien en été. Présentation par affiche pour : 3e journée de la science de l'Institut Nordique du Québec, INRS, Québec, Canada, 28 novembre 2018.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Use of Automated Systems for the Study of Oceanic Dimethylsulfide Dynamics in Ice-covered and Ice-free Waters of the Arctic. Présentation orale pour: Congrès ArcticNet, Shaw Center, Ottawa, Canada, 10 au 14 décembre 2018.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Sea surface dimethylsulfide (DMS) hotspots linked to sea ice dynamics and solar radiation in a fine-scale study of the Canadian Arctic Archipelago. Présentation par affiche pour: International Symposium on Sea Ice at the Interface, The Fort Garry Hotel, Winnipeg Manitoba, Canada, 19 au 23 août 2019.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Sea surface dimethylsulfide (DMS) hotspots linked to sea ice dynamics and solar radiation in a fine-scale study of the Canadian Arctic Archipelago. Présentation par affiche pour: Réunion annuelle Sentinelle Nord 2019, Centre des congrès et d’expositions de Lévis, Lévis, Canada, 27 au 30 août 2019 – Prix mention honorable.
Joanie St-Onge, G. Massé, J.-É. Tremblay, M. Levasseur, M. Lizotte, P. Massicotte, M. Gosselin. Dimethylsulfide (DMS) hotspots linked to hydrographic frontal structures and sea ice in Baffin Bay and the Canadian Arctic Archipelago. Présentation par affiche: Congrès ArcticNet 2019, Halifax Convention Center, Halifax, Nova Scotia, Canada, 2 au 5 décembre 2019.
Introduction générale
Les changements au sein de l’environnement arctique
Les relevés satellites modernes (depuis 1979) montrent une tendance à la baisse de l’étendue de la glace de mer Arctique avec des minimums de couverture de glace d’autant plus restreints vers la fin de la période estivale (Arrigo et al., 2008; Serreze et al., 2007; Stroeve et al., 2012). La nouvelle glace formée à l’hiver est de plus en plus dominée par de la glace de première année (Comiso et al. 2008). Cette glace est plus vulnérable à la période de fonte et les zones libres se développent de plus en plus tôt au cours de la saison (Lindsay et al., 2009). Une diminution plus rapide de la banquise et une augmentation de la présence de mares de fonte entraînent l’absorption d’une plus grande proportion des radiations solaires, ce qui, à son tour, accélère la fonte et le réchauffement de l’océan Arctique par la perte d’albédo des surfaces (Comiso et al., 2012). Le remplacement de la glace de mer pluriannuelle par une glace de première année avec davantage de mares de fonte facilite également la pénétration de la lumière à travers la glace, favorisant la productivité primaire et les efflorescences de phytoplancton sous la glace (Arrigo et al., 2008; Frey et al., 2011; Arrigo et al., 2012).
Le DMS dans un contexte de changement global
La réduction du couvert de glace en Arctique ainsi que l’augmentation potentielle de la productivité primaire pourraient avoir des répercussions importantes sur les flux atmosphériques de diméthylsulfure (DMS). Le DMS est un gaz d’origine biogénique dont les produits dérivés dans l’atmosphère sont climatiquement actifs. Sa présence dans la colonne d’eau est liée à la dégradation de son précurseur, le diméthylsulfoniopropionate (DMSP) qui est synthétisé par les algues pélagiques (Keller et al., 1989), mais également au sein de la glace de mer par les algues sympagiques (Levasseur et al., 1994). Les océans, sursaturés en DMS, représentent une source continue de ce gaz pour l'atmosphère. Une fois ventilé, le DMS peut être rapidement photooxydé en divers composés, principalement l’acide
méthanesulfonique (MSA), le dioxyde de soufre (SO2) et le sulfate particulaire (SO42-) qui
contribuent à alimenter le pool d’aérosols sulfatés (Bates et al., 1987; Andreae, 1990; Stefels et al., 2007). Ces aérosols jouent un rôle important dans le système climatique atmosphérique en modérant l’apport en énergie solaire et en influençant le bilan radiatif de la Terre (Bates et al., 1987; Charlson et al., 1987). Soit directement en rétrodiffusant les rayons solaires entrant (Bates et al., 1987), soit indirectement en augmentant l’albédo des nuages de basse altitude par la formation de noyaux de condensation de nuage (NCN) (Twomey, 1974; Charlson et al., 1987). Une densité élevée de NCN favorise la réflectivité des rayons lumineux vers l'atmosphère. Ces aérosols prolongent également la durée de vie des nuages en diminuant la taille des gouttelettes nuageuses (Albrecht, 1989).
En 1987, Charlson et ses collaborateurs ont énoncé l’hypothèse CLAW (Charlson, Lovelock, Andreae et Warren) qui implique les émissions de DMS dans une boucle de rétroaction climatique. Sous certaines conditions, le DMS agirait comme « refroidisseur du climat » dans une boucle de rétroaction négative à l’échelle planétaire et contribuerait à stabiliser le climat. Selon cette hypothèse, le réchauffement de la surface des océans induirait une augmentation de la production de DMS par le phytoplancton et donc une augmentation des émissions de DMS vers l’atmosphère. Indirectement, cela permettrait de diminuer la quantité de rayons solaires atteignant la surface en raison de l’augmentation de l’albédo des nuages. Des études récentes suggèrent que le DMS pourrait jouer un rôle important dans la formation de particules d’aérosols sulfatés au-dessus des océans, particulièrement dans les atmosphères peu polluées comme en Arctique durant l’été (Collins et al., 2017; Quinn et al., 2017; Croft et al., 2019; Abbatt et al., 2019). Il est cependant difficile de vérifier ou de modéliser cette hypothèse à l’échelle globale et donc impossible d’affirmer sans équivoque la validité de ce mécanisme de régulation climatique par le DMS (Quinn and Bates, 2011).
En raison du déclin rapide de la couverture de glace de mer, le rôle du DMS en Arctique pourrait devenir encore plus important (Levasseur et al., 2013). Certains modèles climatiques prévoient une augmentation des sources et de l’intensité des émissions océaniques de DMS en Arctique en lien avec la réduction de la couverture neigeuse, de l'étendue et de l'épaisseur de la glace de mer et de l'augmentation de la productivité primaire (Gabric et al., 2004; Gabric et al., 2005; Qu and Gabric, 2010; Humphries et al., 2012; Galí et al., 2018). Il a été suggéré
qu’une augmentation des émissions de DMS pourrait, dans une certaine mesure, compenser la diminution de l’albédo associée à la fonte de la banquise (Gabric et al., 2005; Cameron-Smith et al., 2011). La réduction de l’étendue de la banquise durant la période estivale favoriserait également la ventilation du DMS vers l’atmosphère en raison de l’augmentation de la surface d’échange eau-atmosphère (Gabric et al., 2003). Alors que la zone saisonnière libre de glace s’agrandit, les changements induits dans la circulation océanique pourraient également favoriser l’établissement de nouvelles espèces fortement productives de DMSP (Gabric et al., 2005). La progression vers le nord d'une espèce tempérée fortement productrice de DMSP (Emiliania huxleyi) a été observée au nord de la mer de Barents et dans le secteur pacifique de l’Arctique (Vance et al., 1998; Hegseth et al., 2008; Harada et al., 2012; Neukermanns et al., 2018, Oziel et al., 2020). Des espèces produisant des quantités importantes de DMSP pourraient donc s’établir de façon durable au sein des secteurs Atlantique et Pacifique de l’Arctique.
Synthèse du DMSP, précurseur du DMS
Un grand nombre de microalgues possède la capacité de synthétiser le DMSP. On différencie trois groupes de producteur en fonction de leurs concentrations intracellulaires. En général, les Dinophycées et les Haptophycées, telles que Phaeocystis sp. et Emiliania huxleyi, présentent des quotas intracellulaires de DMSP plus élevés, par opposition à des concentrations plus faibles chez les Bacillariophycées (diatomées) (Barnard et al., 1984; Turner et al., 1988; Keller et al., 1989; Kirst et al., 1991). Malgré leur quota intracellulaire plus faible, la contribution des diatomées au pool de DMSP et au budget des émissions de DMS peut être aussi importante que la contribution des espèces fortement productrices telles que Phaeocystis sp. en raison de leur forte biomasse (Matrai et Vernet, 1997). De fortes concentrations de DMSP ont été mesurées à la base de la glace, où les diatomées pennées étaient très abondantes (Kirst et al., 1991, Levasseur et al., 1994, Lee et al., 2001). Les diatomées ont tendance à avoir un taux maximal d’absorption de nutriments et de croissance supérieur aux autres groupes d’algues (Litchman et al., 2006). Bien que les environnements contrastés de l’Arctique hébergent une grande diversité d’assemblage de microalgues, Matrai et Vernet (1997) suggèrent que le stade physiologique des algues serait plus important que la
composition des espèces phytoplanctoniques pour moduler les concentrations de DMSP et la dynamique du DMS.
Rôles physiologiques du DMSP
D'autre part, des facteurs environnementaux tels que la température (Karsten et al., 1996; Sheets et Rhodes 1996), la salinité (Dickson et Kirst 1986, Niki et al., 2007), la disponibilité des nutriments (Stefels, 2000; Simó, 2001) et le rayonnement solaire (Sunda et al., 2007, Archer et al., 2009) peuvent également influencer la production de DMSP. La biosynthèse du DMSP serait impliquée dans diverses réponses physiologiques des algues pélagiques et sympagiques aux changements rapides de leur environnement (Simó, 2001). Ces fonctions permettraient aux cellules algales de faire face aux différents facteurs de stress environnementaux.
Réponses aux variations de salinité : En Arctique, le cycle de formation et de fonte de la banquise entraîne une importante variabilité de la salinité et de la température des eaux de surface. Ces fluctuations rapides de salinité favoriseraient l’exsudation du DMSP puisque celui-ci serait utilisé comme composé osmotique (Stefels, 2000; Niki et al., 2007). Afin de contrôler la pression à l'intérieur des cellules suite à un changement dans leur environnement (e.g variation de la salinité), les microalgues adopteraient un mécanisme de dilution ou de concentration de soluté leur permettant d’ajuster leur volume cellulaire afin de stabiliser les membranes et éviter les chocs osmotiques (Stefels, 2000). Ce mécanisme de dilution ou de concentration de solutés se ferait soit par transport actif d’ions, soit par accumulation ou dégradation de solutés organiques tels que le DMSP (Stefels, 2000).
Réponses aux variations de température : Le DMSP pourrait également avoir un rôle cryoprotecteur (Kirst et al., 1991). Sous forme particulaire (DMSPp), il permettrait de
stabiliser l'activité enzymatique des cellules à des conditions de basse température (Kirst et al., 1991). Cette fonction pourrait expliquer les fortes concentrations de DMSP observées aux hautes latitudes (Kirst et al., 1991) et à la base de la glace (Levasseur et al., 1994; Levasseur et al., 2013; Galindo et al., 2014).
Carence en nutriments : Une augmentation des concentrations de DMSPp a également été
observée en association avec des limitations en nutriments, particulièrement l’azote (Stefels, 2000; Simó, 2001). Dans ce cas, la production de DMSP serait impliquée dans un mécanisme de soupape servant de puits pour l'excès de soufre et de carbone permettant de régénérer de l'azote intracellulaire (Stefels, 2000; 2007). Le rééquilibre de la concentration de DMSP dans la cellule se ferait ensuite par dégradation ou libération du DMSP dans la colonne d’eau sous forme de DMSP dissous (DMSPd) ou de DMS.
Réponse au stress lumineux : La production de DMSP et ses produits de dégradation chez les algues serait possiblement liée à leur action en tant que piégeurs de radicaux libres (Sunda et al., 2002). Le clivage du DMSP induirait la synthèse d’une cascade de différents antioxydants qui permettraient de protéger différentes parties de la cellule contre le stress oxydatif néfaste provoqué par le rayonnement ultraviolet (Sunda et al., 2002). Les produits de dégradation du DMSP, le DMS et l'acrylate sont 20 à 60 fois plus réactifs aux radicaux hydroxydes que le DMSP (Sunda et al., 2002). Plusieurs études ont mis en évidence une relation positive entre la production de DMS et la dose d’irradiation solaire (Galí et al., 2011, 2013; Lizotte et al., 2012) ou encore entre la concentration intracellulaire de DMSP et l’intensité lumineuse (Karsten et al., 1990; Stefels, 2007). En Arctique, les algues croissant sous la glace et à l’intérieure de celle-ci peuvent subir des chocs lumineux importants lorsqu’elles sont transportées à la lisière de la glace. Au même titre qu’une variation importante de la salinité, une fluctuation rapide de l’intensité lumineuse due à la dynamique de la glace, stimulerait la production de DMSP (Vance et al., 2013).
Résistance à la prédation : La synthèse du DMSP pourrait également faire partie d’un mécanisme de défense chimique des cellules algales contre le broutage du zooplancton (Wolfe & Steinke, 1996).
Les sources de DMS
On considère deux mécanismes majeurs associés à la formation du DMS dans la colonne d’eau : (1) la dégradation enzymatique du DMSP particulaire (DMSPp) au sein de la cellule
algale et (2) la consommation du DMSPd par les communautés bactériennes suite à la
libération du DMSP intracellulaire dans la colonne d’eau (Kiene et al., 2000). La présence du DMS dans le milieu ambiant provient principalement du clivage du DMSP en DMS par l’activité intracellulaire et extracellulaire des enzymes DMSP-lyase (Wolfe & Steinke, 1996). Chez les algues phytoplanctoniques, le clivage du DMSP se fait directement à partir du DMSP intracellulaire (DMSPp) et produit une molécule de DMS, d’acrylate ainsi qu’un
proton (Stefels et al., 2007). Le DMSP peut également être relargué dans la colonne d’eau par les algues sous forme de DMSP dissous (DMSPd). La libération du DMSPcellulaire dans
la colonne d’eau peut être le résultat de plusieurs processus biologiques. Le DMSP peut être activement exsudé en cas de déstabilisation osmotique des cellules (Kirst et al., 1991; Matrai et Keller, 1994). Il peut également être relâché par lyse cellulaire à la suite d’attaques virales ou par l’autolyse des cellules phytoplanctoniques suite à la sénescence ou à des stress environnementaux importants (Malin et al., 1992; Kwint et Kramer, 1995; Hill et al., 1998). Il peut également être libéré suite au broutage des algues par le zooplancton (Dacey and Wakeham, 1986; Belviso et al., 1990; Wolfe et al., 1997).
La libération du DMSP dans la colonne d’eau contribue à la formation d'un pool de DMSPd.
Le DMSPd représente généralement une faible proportion du pool de DMSP total (DMSPt =
DMSPp + DMSPd) dû à la grande labilité du DMSPd et à l’assimilation rapide par les bactéries
(Kiene et Slezak, 2006; Royer et al., 2010). Le DMSPd représente un substrat labile important
pour les bactéries qui s’en servent comme source de carbone et de soufre (Kiene et al., 2000). Suite à la consommation du DMSPd par les bactéries, au moins deux voies de dégradation du
DMSPd existent. La déméthylation du DMSPd ou le clivage enzymatique du DMSPd en DMS
par l’enzyme DMSP-lyase des bactéries (Vila-Costa, 2006; Todd et al., 2007). La déméthylation bactérienne mène à la formation du méthanethiol (MeSH), précurseur de la synthèse des acides aminés sulfurés méthionine et cystéine (Kiene et al., 2000; Stefels et al., 2007). Sous faibles concentrations de DMSPd dans la colonne d’eau, la voie de déméthylation
(Kiene et al., 2000 ; Vila-Costa et al., 2006). Cette voie serait énergétiquement plus bénéfique pour les bactéries que la voie de la DMSP-lyase puisqu’elle éviterait la nécessité de réduire le soufre en sulfure (Kiene et al., 2000). Le DMSP est donc considéré comme un substrat d'une grande importance pour les communautés bactériennes. Le DMSP pourrait contribuer jusqu’à 15% de la demande totale de carbone et jusqu’à 100% de la demande en soufre des bactéries (Kiene et al., 2000; Simó et al., 2002). Lorsque les besoins en soufre des bactéries sont comblés, les bactéries peuvent utiliser l’acrylate comme source de carbone et rejeter le souffre dans le milieu sous forme de DMS à la suite du clivage du DMSP par l’enzyme DMSP-lyase (Vila-Costa, 2006; Todd et al., 2007). L’efficacité de la conversion du DMSPd
en DMS est donc dépendante de la demande en soufre des communautés bactériennes (Kiene et al., 2000). La conversion du DMSPd en DMS par les bactéries représente généralement
moins de 10% du DMSPd disponible dans la colonne d’eau, mais peut atteindre jusqu’à 50%
dans certaines conditions (Kiene et al., 2000).Le recyclage du DMSP par les communautés bactériennes est donc une composante importante du cycle du DMS (Kiene et al., 2000).
Les puits de DMS
L’importante labilité du DMS dans l’environnement peut être expliquée par plusieurs mécanismes de dégradation et de transformation. Les puits connus de DMS dans la colonne d’eau sont la consommation bactérienne (Kiene and Bates 1990), la photolyse, l’oxydation photochimique du DMS en sulfoxyde de diméthyle (DMSO) (Brimblecombe et Shooter, 1986) et la ventilation vers l’atmosphère (Liss and Slater, 1974; Bates et al., 1987). En plus d’être impliquées dans la production du DMS, les bactéries peuvent également consommer le DMS en tant que source de carbone (Kiene and Bates 1990; Wolfe et al., 1999; Vila-Costa et al., 2006). Il existerait un couplage important entre les concentrations de DMS dans la colonne d’eau et la consommation bactérienne de DMS (Kiene and Bates., 1990; Wolfe et al., 1999). Une production importante de DMS favoriserait la consommation de DMS par les bactéries (Kiene and Bates. 1990; Levasseur et al., 1996). En moyenne, 50 à 80% de la production du DMS pourrait être consommée biologiquement (Simó, 2004). La photolyse est aussi un puits important pour le DMS. Les longueurs d'ondes UVA / visibles peuvent conduire à la photooxydation du DMS en DMSO, alors que les longueurs d'ondes UVB
peuvent également conduire à la photolyse du DMS, mais ne produiraient pas de DMSO (Hatton, 2002). La ventilation du DMS vers l’atmosphère serait également un puits pour le DMS océanique, responsable d’environ 10% de la perte du DMS produit (Bates et al., 1994; Ledyard and Dacey 1996). Le flux de DMS vers l'atmosphère dépend de la concentration du DMS dans les eaux de surface, de la vitesse du vent et de la température de l’eau (Liss and Slater 1974; Nightingale et al., 2000).
Objectifs
Les processus régissant la concentration nette de DMS dans les eaux marines en Arctique sont d’autant plus complexes qu’ils impliquent un ensemble de facteurs physico-chimiques et biologiques interagissant entre eux et sensibles aux changements globaux. Il est de plus en plus évident que les points chauds de DMS liées à la glace de mer jouent un rôle important dans la formation des émissions de DMS dans l'Arctique. Ces points chauds comprennent les lisières de glace, la zone de glace marginale (Matrai et Vernet 1997; Galí et Simó, 2010; Levasseur, 2013; Lizotte et al., 2019) et des sources récemment reconnues telles que les étangs de fonte des glaces de première année (Mungall et al., 2016; Ghahremaninezhad et al., 2016; Gourdal et al., 2018; Abbatt et al., 2019). Ils dépendent également de facteurs comme le transport du DMS à travers la glace de mer (Gourdal et al., 2019). La quantité limitée de mesures DMS dans certaines régions de l'Arctique peut entraîner des incertitudes dans les estimations, car elles ne tiennent pas suffisamment compte de la variabilité des concentrations de DMS à petite échelle (Galí et al., 2018). Puisque les changements futurs dans la saisonnalité de la glace de mer arctique pourraient avoir des répercussions importantes sur les émissions atmosphériques de DMS, il est nécessaire d’élargir nos connaissances sur la dynamique et les sources naturelles de ce gaz, et ce particulièrement dans les régions relativement exemptes d’apports anthropiques d’aérosols sulfatés telles que l’Arctique en été. Des mesures in situ à haute résolution sont nécessaires pour évaluer la distribution des concentrations de DMS à l'échelle locale afin de fournir des données de base pour les modèles climatiques.
L'objectif de ce projet était d'étudier la distribution spatiale du DMS dans les eaux de surface de la baie de Baffin et une partie de l'archipel Arctique canadien en relation avec des paramètres biologiques et physicochimiques de l’environnement ainsi qu’avec la dynamique de la glace de mer. Plus particulièrement, les résultats de cette étude ont permis de confirmer l’hypothèse selon laquelle la distribution du DMS en Arctique est caractérisée par des variations rapides liées à des réponses physiologiques des algues, ainsi qu’à des patrons locaux liés à l’hydrographie. L’utilisation d’un système de mesure en continu à haute résolution a permis d’élargir la couverture spatiale du DMS en fournissant un nouvel ensemble de données pour les étés 2017 et 2018.
Chapitre 1 Dimethylsulfide (DMS) hotspots linked
to hydrographic frontal structures and sea ice in
Baffin Bay
Joanie St-Onge1, Lizotte, M.1, Massé, G.2, Tremblay, J-É.1, Levasseur, M.1, Gosselin, M.3, Massicotte, P.1
1Département de biologie, Québec-Océan, Université Laval, Québec, Québec, G1V
0A6, Canada
2Département de biologie, Unité mixte internationale Takuvik UL-CNRS,
Université Laval, Québec, Québec G1V 0A6, Canada
3Institut des sciences de la mer (ISMER), Université du Québec à Rimouski, 310
Allée des Ursulines, Rimouski,Québec G5L 3A1, Canada
1.1 Résumé
Les concentrations de diméthylsulfure (DMS) à la surface de l’eau ont été déterminées dans la baie de Baffin et dans l'archipel Arctique canadien au cours des étés 2017 (juillet-août) et 2018 (juillet). Plus de 3500 mesures de DMS ont été obtenues à l’aide d’un spectromètre de masse couplé à une trappe cryogénique et une membrane d’échanges gazeux (ACT-MIMS). Ces dernières ont été réalisées parallèlement à des mesures continues de la salinité, la température, la fluorescence (proxy pour la Chlorophyll a (Chl a)) et du rayonnement photosynthétiquement actif (PAR), ainsi que des mesures discrètes de diméthylsulfoniopropionate (DMSP). Les concentrations de DMS ont variées de 2 ordres de grandeur allant de 0.2 à 43.0 nmol L-1 en 2017 et de 1.6 à 55.0 nmol L-1 en 2018. Des points
chauds de fortes concentrations de DMS (> 10 nmol L-1) ont été observés en association avec des fronts hydrographiques importants, ainsi que dans des eaux côtières à forte productivité. Dans les eaux libres du nord de la baie de Baffin, un gradient longitudinal des concentrations de DMS (croissant d'ouest en est, entre 1.0 nmol L-1 et 11.2 nmol L-1) était positivement
corrélé avec les mesures de salinité, de température de surface et de Chl a. Ces résultats suggèrent que la dynamique du DMS est intimement liée aux propriétés physicochimiques et à la signature biologique des masses d'eau dans ce secteur. Des cas de forte concentration de DMS ont été observés à la lisière de la banquise de première année, renforçant le rôle de plus en plus reconnu de la glace de mer dans le cycle du DMS marin. Dans le nord de la mer du Labrador et du détroit de Davis, les concentrations de DMS en eaux libres ont présenté des différences jour-nuit de 2 ordres de grandeur avec des concentrations plus élevées la nuit, plus faibles le jour et des minimums à midi. Bien qu’il soit possible que ces résultats aient été influencés par d’autres facteurs, les concentrations de DMS ont diminué linéairement avec l’augmentation du rayonnement photosynthétiquement actif (PAR) en 2017 ainsi qu'en 2018. Ces résultats suggèrent que, dans certaines régions, les concentrations de DMS peuvent être caractérisées par des variations importantes (> 10 nmol L-1) et rapides (< 24 h) qui
seraient négligées par l’interpolation des données, où les données in situ sont manquantes. La présence de points chauds localisés de DMS démontre le potentiel d'utilisation d'instruments automatisés à haute résolution tels que l’ACT-MIMS afin de résoudre la distribution spatiale du DMS et contribuer à l'amélioration de la précision des prédictions des modèles d'émission du DMS.
1.2 Abstract
Sea surface dimethylsulfide (DMS) concentrations were determined in Baffin Bay and parts of the Canadian Arctic Archipelago during the summers of 2017 (July-August) and 2018 (July). More than 3500 DMS measurements were obtained using a mass spectrometer coupled with a cryogenic trap and a gaseous exchange membrane (ACT-MIMS). These measurements were performed alongside continuous quantification of sea surface salinity (SSS), sea surface temperature (SST), fluorescence (proxy for Chlorophyll a (Chl a)), photosynthetically active radiation (PAR) and discrete measurements of dimethylsulfoniopropionate (DMSP). Concentrations of DMS varied over 2 orders of magnitude, from ca. 0.2 to 43.0 nmol L-1 in 2017, and from ca. 1.6 to 55.0 nmol L-1 in 2018. Surface water DMS hotspots (> 10 nmol L-1) were observed in association with hydrographic frontal structures, as well as in high productivity coastal waters. In the open water of northern
Baffin Bay, an increasing west-to-east gradient of DMS concentrations was positively correlated with SSS, SST and Chl a, suggesting that upper ocean dynamics of DMS are linked to the physicochemical properties and biological signature of water masses in this sector. High DMS concentrations were observed at the ice-edge of ponded first-year ice providing further evidence to the increasingly recognized role sea ice plays in the cycling of marine DMS. In the northern Labrador Sea and Davis Strait, DMS exhibited day-night trends of 2 orders of magnitude with highest concentrations at night and midday minimums. Although it is possible these results were influenced by other factors, concentrations of DMS decreased with increasing PAR in 2017 as well as in 2018. These results suggest that, in some regions, DMS concentrations may be characterized by large (> 10 nmol L-1) and rapid (< 24 h) variations that would be neglected by data interpolation where in situ data are still sparse. The presence of localized DMS hotspots demonstrates the potential of using high-resolution automated instruments such as the ACT-MIMS to resolve the spatial distribution of DMS and contribute to the improvement of the accuracy of DMS emission model predictions.
1.2. Introduction
Arctic icescapes are changing due to rapid climate warming (IPCC, 2013). These changes have important implications for processes linked to sea ice dynamics, such as the timing and magnitude of primary production (Kahru et al., 2016). The replacement of multi-year sea ice by much thinner first-year ice that bears more melt ponds facilitates the penetration of light through the ice, promoting net primary productivity (Arrigo and van Dijken, 2015). It may also influence ocean-atmosphere transfers of heat, particles and gases such as dimethylsulfide (DMS). DMS is a climate active compound known as the primary source of reduced biogenic sulfur emitted from the ocean to the atmosphere (Andreae, 1990; Bates et al., 1992; Simó, 2001). Most of the DMS production is thought to be regulated by the enzymatic cleavage of intracellular DMSP by pelagic algae (Keller et al., 1989), and also within the sea ice by sympagic algae (Levasseur et al., 1994, Arrigo et al., 2010), or by the enzymatic cleavage of dissolved DMSP by bacteria following the release of DMSP in the water column (Galindo et al., 2015). The oceans, supersaturated in DMS, represent a continuous source of this gas for the atmosphere and contribute to feed the sulfate aerosol pool. These aerosols play an important role in the atmospheric climate system by moderating solar energy input and influencing the Earth's radiative balance (Bates et al., 1987, Charlson et al., 1987).
There is growing evidence that sea-ice related sources of DMS play a major role in shaping DMS emissions in the Arctic. These sources include ice edges, the marginal ice zone (Matrai et Vernet 1997; Galí and Simó, 2010; Levasseur, 2013; Lizotte et al., 2019) and recently recognized sources such as the melt ponds that form on first-year ice (Mungall et al., 2016; Ghahremaninezhad et al., 2016; Gourdal et al., 2018; Abbatt et al., 2019). DMS emission is also dependent on factors like the upward transport of DMS in sea ice (Gourdal et al., 2019). Some climate models indicate an increase in the magnitude and strength of oceanic DMS emissions in the Arctic due to reductions in snow cover and the extent and thickness of sea ice as well as a concomitant increase in primary productivity (Gabric et al., 2004, Gabric et al., 2005, Qu and Gabric, 2010, Humphries et al., 2012). The loss of ice cover during the summer period would also favor ventilation of DMS to the atmosphere due to the increase of the water-atmosphere exchange surface (Gabric et al., 2003). The influence of DMS
emissions on climate is even greater in regions with low anthropogenic inflows of sulfate aerosols, such as the Arctic in summer (Woodhouse et al., 2010; Chang et al., 2011).
Surface seawater DMS concentrations measured in the eastern Canadian Arctic during the NETCARE campaigns (July-August), revealed a much higher interquartile range (5.1 to 10.9 nmol L-1, maximum of 75 nmol L-1) than previous pan-Arctic measurements (0.9 to 5.9 nmol L-1, maximum of 26 nmol L-1) (Abbatt et al., 2019). These results show that the average concentration of surface DMS during summer in this region of the Arctic might be twice as high as other measurements made later in the year (Abbatt et al., 2019). The use of interpolated climatologies requires adequate information on their representativeness in space and time. The limited number of DMS measurements in certain regions of the Arctic can lead to uncertainties in estimates as they do not properly account for fine-scale variability and ice-related sources of DMS (Galí et al., 2018). This is particularly important for sparse, non-synoptic data, which comprise the bulk of oceanic in situ observations of DMS in the Arctic. Due to the fast-paced changes in icescapes and the complexity of interactions governing DMS concentrations in the Arctic, high-resolution in situ measurements are needed to assess the distribution of surface DMS concentrations at the local scale and generate an adequate validation basis for model outputs. The objective of this study was to investigate DMS distribution in surface waters of Baffin Bay and the Canadian Arctic Archipelago with respect to biological and physicochemical parameters as well as sea ice. The method is based on a membrane inlet mass spectrometry technique for continuous high-resolution measurement. This method has been proven in other parts of the world ocean (Tortell et al., 2005; Nemcek et al., 2008; Royer et al., 2016; Asher et al., 2017) but also in the Arctic (Jarníková et al., 2018). The results reported here expand the spatial coverage of the existing global surface seawater DMS database by providing a new dataset of DMS measurements in coastal and open ocean waters of the High Arctic in the summers of 2017 and 2018.
1.3. Methods
1.3.1 Physiography of the study area
DMS samples were collected at high frequency in the Canadian Arctic during the summers of 2017 (July-August) and 2018 (July) aboard the Canadian Coast Guard Ship (CCGS) Amundsen. Surface waters from the northern Labrador Sea, Davis Strait, Baffin Bay and the Canadian Arctic Archipelago (CAA) were sampled (Fig. 1a) in 2017 while in 2018 only the northern Labrador Sea and Davis Strait were re-visited (Fig. 1b).
Surface water mass composition and frontal mixing conditions can lead to differences in phytoplankton abundance and productivity (Tremblay et al., 2011) and lead to differences in DMS and DMSP concentrations (Uhlig et al., 2019). Water masses flowing through Baffin Bay and the CAA are represented in Figure 1 and discussed below. The broad geographic sector of Baffin Bay, as defined by Arrigo et al. (2008), comprises a large area of the Canadian Arctic Archipelago, a complex shelf of the Arctic Ocean consisting of many narrow and shallow channels connected by basins and separated by sills (Carmack, 2000; Melling, 2000). Water masses flowing through western Baffin Bay and the CAA have a predominantly Pacific origin (Jones et al., 2003). The main input of fresh Arctic water entering Baffin Bay is via three passages of the CAA: Lancaster Sound, Jones Sound and Nares Strait which feed the Baffin Island Current (BIC) flowing southward along the east coast of Baffin Island (Tang et al., 2004, Cuny et al., 2005). In the summer, a portion of the warmer, saltier water of the Irminger Sea reaches the southern end of Davis Strait around 66º 30'N as a continuation of the West Greenland Current (WGC) where the majority then turns southwest towards the Labrador Sea (Wu et al., 2012). In Baffin Bay, the WGC carries saltier and warmer water in southeastern Baffin Bay while colder and fresher water of the Arctic is prevalent in northwestern Baffin Bay along the east coast of Baffin Island (Bourke et al., 1989, Wu et al., 2012).
1.3.2 Underway sampling method
The underway sampling method for in situ DMS observations is based on the use of an automated cryogenic trap membrane inlet mass spectrometer (ACT-MIMS), a shipborne instrument that allows measurement of dissolved DMS in seawater every 10 minutes. See Figure 2.1 with annotations (1-9) for a general scheme of the instrument. At a cruising speed between 5 to 10 knots, the frequency of the measurements led to an effective spatial resolution (ESR) of 1.5 to 3 km and was calculated with the equation below, where v is the cruising speed and t the sampling time it takes for one sample.
ESR = v * t (Eq.1)
Broadly, the method consists of injecting an internal standard (isotopically labeled) in seawater prior to extraction via a semi-permeable membrane, concentrating the sample using a cryogenic trap and quantifying the DMS using a GC-MS (gas chromatography-mass spectrometry). The method is similar to other MIMS-like systems developed but involves the use of a cryogenic trap. This improved the detection limit of the method, although it decreased the sampling frequency. Another key feature of the method presented in this study is the use of isotopic internal standards which were used to improve analytical accuracy. First, seawater is continuously pumped into an overflow container by the ship's underway system (sampling depth ~ 7 m, 1800 mL min-1). The seawater line, equipped with a 20-mesh
strainer, is cleaned with Triton and water before each cruise and at the end of each leg. The overflow system is designed to reduce residence time and avoid temperature variations of the water being sampled. From the latter, seawater is supplied to the ACT-MIMS at a constant flow rate (40 mL min-1) controlled using a mass flow meter (mini CORI-FLOW M15 Bronkhorst). Deuterated DMS (Dimethylsulfide-d6, DMS-d6, [(CD3)2S]) standard solution
(500 nmol L-1 in Milli-Q water) is prepared every day from frozen stock solutions (2.5 mmol L-1) sealed in 1 mL glass vials. In order to avoid losses through ventilation, the solution is stored in an airtight bag (0.5 L Tedlar® gas sampling bags, Millipore Sigma). The Tedlar® bag (2-mil Dupont Tedlar® material for superior inertness and impermeability) is connected to the instrument via an airtight septum. The standard solution is continuously supplied to
the seawater line at a constant flow rate of 0.2 mL min-1 via a high-precision digital mass flow meter (mini CORI-FLOW Bronkhorst M12) to reach a final concentration of 2.5 nmol L-1 of isotopically labeled DMS (1). The gas permeation system (membrane) consists of a bundle of gas-permeable hollow silicone fibers (PermSelect®, PDMSXA-2500; 2500 cm2 surface area) inserted into an airtight housing. Seawater circulates inside the fibers while their outside is continuously flushed with Ultra High Purity (UHP) Grade helium (2). Internal pressures (~1 bar) are monitored using manometers and controlled by adjusting flow restrictors. DMS diffuses through the fibers of the semi-permeable membrane (3). The resulting gaseous sample is supplied to a cryogenic trap filled with TENAX adsorbent resin that concentrates the sample at 0°C at the injector of the GC column (model: Varian 3800 GC PFPD, Agilent Inc, oven: 60ºC, capillary column: DB-5ms, 60 m x 320 µm x 1µm, He: 1.5 mL min-1) (4). The cryogenic trap is cooled by an aluminum block fitted around the trap
with a cold finger (PolyScience IP-100). After 3 minutes, the trap is rapidly heated to 180°C and the gaseous DMS loaded onto the resin is eluted into the GC column. The capillary column separates the molecules in the sample based on their affinity with the stationary phase (5). The molecules are then ionized by the mass spectrometer (MS) and separated according to their specific mass-to-charge ratio (6). DMS and DMS-d6 were measured by detecting ions
with a mass-to-charge ratio of 62 and 68, respectively (7). The peak areas were retrieved with the MassHunter workstation software and converted to concentration using a calibration curve. Calibrations were performed on a weekly basis with an average R-squared regression coefficient of 0.99 (Fig. 2.2). The mean standard error of the internal standard was an average of 0.04 nmol L-1. The isotopic exchange of the deuterium atoms of DMS-d6 with hydrogen
atoms in water was tested by injecting the gas headspace of the stock solution directly in the GC injector and comparing the DMS-d6 and DMS value obtained. This represented a 2 %
enrichment in DMS concentration. This enrichment was corrected for each sample. The water lines and overflow system were cleaned with 5 % citric acid and Milli-Q water periodically during instrument maintenance. The working detection limit of the instrument is 0.2 nmol L
-1 and was calculated using the formula below, where LOD is the limit of detection, m is the
mean concentration of the blanks, and SD is the standard deviation of the blanks.
The analytical sequence (flow rates, modules and data extraction) is entirely automated and controlled using a purpose-built LabVIEW program (Studio BODs) (Fig. 2.3). This program also extracts and compiles the data generated by the ship's Global Positioning System (GPS), thermosalinograph and fluorometer systems so that each DMS measurement is geo-referenced and associated with a date/time stamp and its ancillary data.
Total DMSP (DMSPt) samples were collected every hour (ESR of around 9 km to 18 km) in
15-mL Falcon tubes, heated in the microwave until the first signs of boiling and acidified with 250 µL of H2SO4 (Kinsey and Kieber, 2016). Acid is used to oxidize the pre-existing
gaseous DMS present in the seawater (Shooter and Brimblecombe, 1989). The samples were stored in the dark at 4°C prior to analysis. 5 mL of DMSPt were diluted in 40-mL glass vials
with 3 mL of 5 M NaOH. The reaction with NaOH hydrolyzes DMSP into DMS. Samples were measured using a Teledyne Tekmar Atomx XYZ automated purge and trap system (U-shaped proprietary trap) coupled to a GC-MS (model GC Intuvo 9000-MS 5977B, Agilent Inc, oven: 60 ºC, capillary column: DB-5ms, 30 m x 250 µm x 0.25 µm, He: 1.0 mL min-1).
After 11 minutes, the trap was heated to 250°C and the samples eluted into the GC column at a flow rate of 300 mL min-1. Standards of DMSPt (100 nmol L-1) were prepared at the
beginning of the cruises and kept in the same storage conditions as the DMSPt samples. The
average concentration of the DMSPt standards was 100 ± 2 nmol L-1 suggesting that the
integrity of both standards and samples was kept between times of sampling and analysis. The working detection limit of this instrument is 0.9 nmol L-1 and was calculated using Equation 2.
1.3.3 Ancillary data
Sea surface salinity (SSS), sea surface temperature (SST) and in vivo fluorescence (proxy for Chl a) were obtained from the ship-board water monitoring system, consisting of an SBE 45 high-resolution thermosalinograph system and a WETStar fluorometer (https://doi.org/10.5884/12713). Fluorescence was colocalized and inter-compared with
CTD-rosette samples from a Seapoint chlorophyll fluorometer
the order of 0.1 µg/L. In 2017, incident downwelling photosynthetically active radiation (PAR) was recorded continuously at 10-minute intervals on the front deck of the ship using a LI-1000 data logger and a LI-COR LI190SA cosine-corrected flat sensor located ~ 9 m above the sea surface. In 2018, PAR was recorded continuously using a Kipp and Zonen PAR Lite sensor installed on the ship’s meteorological tower ~ 15 m above the sea surface. Data were recorded every minute but were averaged over a 10-minute interval. For each year, PAR data were paired with DMS measurements according to acquisition time. Sea ice concentrations data (SIC) were obtained from satellite imagery (AMSR2) at a resolution of
3.125 km. SIC file downloaded from
ftp://ftp-projects.cen.uni-hamburg.de/seaice/AMSR2/3.125km/. Additional sea ice information was obtained from the National Snow and Ice Center (NSIDC, https://doi.org/10.7265/N5K072F), using contiguous 360° cameras installed on the ship, and satellite images from Copernicus Sentinel-data (Sentinel-1 and Sentinel-2) (https://sentinel.esa.int/web/sentinel/). Sea ice concentration delimitation at 10 % and 80 % were obtained from the U.S National Ice Center (http://www.natice.noaa.gov/, NATICE) data archive.
1.3.4 Software, satellite images and statistical analyses
Surface distribution plots were produced with Ocean Data View version 5.1.5 and display original data (Schlitzer, R., Ocean Data View, odv.awi.de, 2018). Statistical analyses were computed using RStudio version 3.6.1 (http://www.rstudio.com) and the corrplot package (Taiyun W. and Viliam S., https://github.com/taiyun/corrplot, 2017). Normality of the data was determined with a Shapiro-Wilk test (p < 0.05). When normality could not be achieved uniformly through standard normalization methods, non-parametric Spearman’s rank correlation test (rs) with 0.001, 0.01 and 0.05 significance levels was used to assess
relationships between DMS and other variables. A non-parametric Mann-Whitney U test was used to determine the statistical differences between the two sampling years. Results from the Mann-Whitney U test concluded that the population medians are statistically different. Therefore, both years were computed individually. For each DMS measurements, the closest SIC pixel was extracted using the ncdf4 R package (David P, https://CRAN.R-project.org/package=ncdf4, 2019). Sea ice satellite images from Copernicus Sentinel-data
were processed using Google Earth Engine and Google Earth Pro version 7.3.2.
1.4. Results
1.4.1 Surface water hydrography and sea ice distributions
In 2017, SSS (in PSU) ranged from 16.3 to 32.8. The lowest SSS values (< 30) were measured throughout most of the M'Clintock Channel, the Gulf of Boothia, Eclipse Sound near Pond Inlet and in Lancaster Sound near the coast of Somerset Island (Fig. 3.1a). SST was highly variable, ranging from -1.6 to 6.7 °C (Fig. 3.1b). Based on NSIDC data (https://doi.org/10.7265/N5K072F), sea ice was present along the coast of Baffin Island and in Smith Sound in July 2017. The waterways of the entire region of the CAA were covered with sea ice, except in Foxe Basin and Lancaster Sound. In August 2017, most of the sea ice had melted along Baffin Island. Satellite images and sea ice concentration data confirm that the ship crossed vast areas of high sea ice concentrations (> 80%) northwest of Davis Strait near the coast of Baffin Island, in Smith Sound and west of Lancaster Sound in Barrow Strait. The images also revealed that sea ice was mainly present in the form of landfast ice and drifting ice floes.
In 2018, low salinity water (~17.1) was measured in North Pangnirtung Fjord (Fig. 1) of Baffin Island due to the release of glacial meltwaters and riverine inputs. Excluding these considerably fresher waters, the overall SSS ranged from 25.9 to 33.4 (Fig. 3.2a). Overall, SST ranged from -1.6 °C to 8.6 °C along the cruise track of the studied area. The coldest waters were measured at the outlet of Frobisher Bay and in northwestern Davis Strait (Fig. 3.2b). In Hudson Strait, water was colder and less saline (average of 0.4 °C and 29.3 PSU, respectively) whereas, on the east side, water was warmer and more saline (average of 2.3 °C and 32.3 PSU, respectively) (Fig.6a-b). The spatial distribution of sea ice concentration obtained from satellite data (AMSR2) showed high concentrations of sea ice (> 50%) near the coast of Baffin Island (Fig. 3.2c). As in 2017, satellite images revealed that sea ice was mainly in the form of ice floes breaking and detaching from consolidated landfast ice from the coast of Baffin Island (Fig. 8).
1.4.2 Algal fluorescence
During the 2017 cruise, surface concentrations of Chl a estimated from calibrated fluorescence data ranged from below the detection limit ˂ 0.03 μg L-1 to 4.4 μg L-1 with a range of 25th and 75th quartiles from 0.05 to 0.3 μg L-1 and maximum values in Frobisher Bay (Fig. 3.1d). In general, Chl a concentrations were less than 0.1 μg L-1 although values of 2-4 μg L-1 were measured in Smith Sound and at the western end of Lancaster Sound, where sea
ice was present and surface water temperatures were below zero.
In 2018, surface water Chl a ranged from 0.1 μg L-1 to 5.6 μg L-1 with maximum values measured in Hudson Strait and Frobisher Bay (Fig. 3.2d). Underneath the landfast ice near the coast of Baffin Island, Chl a was lower than 1.3 μg L-1, while in the fjord, concentrations ranged from 0.1 μg L-1 to 1 μg L-1.
1.4.3 Surface concentrations of DMS and DMSP
tIn 2017, concentrations of DMS ranged from 0.2 to 43.0 nmol L-1 with mean and median values of 8.2 and 5.4 nmol L-1, respectively. The standard deviation was 7.3 nmol L-1 with a range of 25th and 75th quartiles from 3.0 to 10.7 nmol L-1 (Table 1). Overall, concentrations of DMS were considerably higher in the northern Labrador Sea and Davis Strait (> 11 nmol L-1) than in the rest of the study area. In the former two regions, large DMS variations were observed in the course of 48 hours. These variations are noted in Figs. 4.1 (D1) and detailed in Fig. 9a. High concentrations of DMS were also measured at the edge of a large extent of landfast sea-ice (maximum of 28.8 nmol L-1) in Lancaster Sound near Resolute, (maximum
of 27.9 nmol L-1) near the coast of Baffin Island (maximum of 10.6 nmol L-1) and in Smith Sound. These ice-edge peaks are noted in Fig. 4.1 (I1-2-3) and explored in detail in Fig. 7a-b-c. In northern Baffin Bay, DMS concentrations (4.4 to 11.2 nmol L-1) were generally higher
in the warm and salty waters of the eastern side (east of longitude 72.032°W) than in the cooler and fresher waters of the central part of the region (1.0 to 6.6 nmol L-1) (Fig. 5e). The highest concentrations of DMSPt were also measured in the northern Labrador Sea, in