Université de Sherbrooke
Diabète gestationnel: insuline ou hypoglycémiants oraux? Étude pilote de la préférence des femmes et de l’influence du traitement sur la qualité de vie
Par Marieve Pellerin
Programmes de Sciences cliniques
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de maitre ès sciences (M.Sc.) en Sciences cliniques
Sherbrooke, Québec, Canada Novembre, 2015
Membres du jury d’évaluation
Jean-Luc Ardilouze, M.D., Ph.D., (directeur) Département de médecine, Université de Sherbrooke
Jean-Patrice Baillargeon, M.D., M.Sc., (évaluateur interne) Département de médecine, Université de Sherbrooke
Julie Robitaille, Ph.D., (évaluateur externe) École de nutrition, Faculté des Sciences agriculture et alimentation, Université Laval
RÉSUMÉ
Diabète gestationnel: insuline ou hypoglycémiants oraux? Étude pilote de la préférence des femmes et de l’influence du traitement sur la qualité de vie
Par Marieve Pellerin
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de maitre ès sciences (M.Sc.) en Sciences cliniques, Faculté de
médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
Introduction : Le débat sur l’utilisation des hypoglycémiants oraux (HGO) dans le traitement du diabète gestationnel (DG) perdure. Plusieurs études ont montré que la metformine et le glyburide sont deux alternatives acceptables en grossesse. Malgré tout, l’insuline reste le choix de première intention pour le traitement du DG lorsque la diète et l’exercice physique ne suffisent plus. Les principaux arguments en faveur des HGO sont la possibilité d’une meilleure observance du traitement et une meilleure qualité de vie (QDV). Cependant, les études sur la QDV chez les femmes atteintes de DG sont rares et d’autres études sur le HGO sont nécessaires pour valider leur efficacité et innocuité dans le traitement du DG.
Méthodes : Étude pilote; 73 patientes avec DG ont été randomisées au groupe HGO (metformine ± glyburide, et ajout d’insuline au besoin) ou au groupe insuline. L’objectif primaire est de comparer, entre les deux groupes, la préférence du traitement ainsi que plusieurs aspects de la QDV (état de santé général, bien-être général, satisfaction quant au traitement du diabète et dépression post-natale). Les objectifs secondaires étaient de comparer le contrôle glycémique maternel et les issues maternelles et néonatales.
Résultats : Des 73 femmes recrutées, 68 ont été incluses pour analyses. Dans le groupe HGO (n=34), 35,3% des participantes ont reçu de l’insuline. Plus de femmes dans le groupe HGO ont mentionné préférer recevoir le même traitement pour une prochaine grossesse (72.7% vs. 42,4%, p=0.01) si un traitement s’avérait nécessaire. Aucune différence n’est ressortie pour l’état de santé général, le bien-être général, la satisfaction quant au traitement et la dépression post-natale. Le taux moyen d’hypoglycémies maternelles (glycémie < 3.3 mmol/L) était supérieur dans le groupe HGO (0.8 vs. 0.1, p=0.008). Il n’y a eu aucune différence dans les autres complications maternelles et néonatales.
Conclusion : La QDV est similaire dans les deux groupes mais, si un traitement pharmacologique s’avérait nécessaire lors d’une prochaine grossesse, les femmes préfèreraient débuter par les HGO. L’utilisation des HGO n’était pas associée à une hausse cliniquement significative des complications maternelles et néonatales.
Mots clés : diabète gestationnel, hypoglycémiants oraux, qualité de vie, metformine, glyburide.
SUMMARY
Gestational diabetes: insulin or oral hypoglycemic agents? Pilot study on women treatment preference and its influence on quality of life.
Par Marieve Pellerin
Thesis presented at the Faculty of medicine and health sciences for the obtention of Master degree diploma maitre ès sciences (M.Sc.) in Health sciences, Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
Background: The use of oral hypoglycemic agents (OHA) in gestational diabetes mellitus (GDM) is still debated. Insulin remains the first line treatment after diet failure. We hypothesized that OHA allows for better quality of life (QOL) in women with GDM and that they prefer OHA to insulin therapy.
Methods: Pilot study; 73 women with GDM were randomly assigned to the OHA group (metformin ± glyburide ± supplementary insulin, as needed) or the insulin group. General health, well-being, and treatment satisfaction using established questionnaires (SF-36, Well-Being Questionnaire and Diabetes Treatment Satisfaction Questionnaire) were respectively assessed at randomization, 38 weeks, and postpartum. Treatment preference and depression were assessed 8 weeks postpartum using the MIG questionnaire and the Short-form Edinburgh Depression Scale. Our primary outcomes were 1) preference of treatment and 2) QOL. Secondary outcomes included maternal glycemic control (hypoglycemia defined as plasma glucose < 3.3 mmol/L), as well as gestational and neonatal complications.
Results: Analyses were performed in 68 women. In the OHA group (n=34), 35.3% women received insulin therapy. More women in the OHA group than in the insulin group preferred their assigned treatment for another pregnancy (72.7% vs. 42.4%, p < 0.01) if a treatment is needed. No statistical differences between groups were found for the 3 items of QOL, the depression score, and neonatal complications. The mean rate of maternal hypoglycemia was higher in the OHA group (0.8 vs. 0.1, p < 0.008). No statistical differences were found for other maternal and neonatal issues.
Conclusion: Women declared to prefer OHA to insulin for a subsequent pregnancy complicated by GDM. QOL was similar in both groups. Use of OHA was not associated to clinically significant differences in maternal and neonatal complications.
Keywords: gestational diabetes, oral hypoglycaemic agents, quality of life, metformin, glyburide
TABLE DES MATIÈRES
Résumé ... ii
Summary ... iii
Table des matières ... iv
Liste des figures ... viii
Liste des tableaux ... ix
Liste des abréviations ... x
Introduction ... 1
1.1 Introduction générale ... 1
1.2 Recension des écrits ... 1
1.2.1 Qu’est-ce que le diabète gestationnel ? ... 1
1.2.2 Contrôle de l’hyperglycémie ... 2 1.2.3 Dépistage ... 3 1.2.4 Thérapie nutritionnelle ... 6 1.2.5 Exercice physique ... 7 1.2.6 Insuline ... 9 1.2.7 Hypoglycémiants oraux ... 10 1.2.7.1 Metformine ... 11 1.2.7.2 Glyburide ... 14
1.2.7.3 Échec des HGO ... 17
1.2.8 Qualité de vie ... 18 1.3 Hypothèse/problématique ... 21 1.3.1 Objectifs ... 22 Matériel et méthodes ... 24 2.1 Dispositif de recherche ... 24 2.2 Population à l’étude ... 24 2.2.1 Critères d’inclusion ... 24 2.2.2 Critères d’exclusion ... 24 2.3 Stratégies de recrutement ... 25
2.4 Déroulement de l’étude et collecte des données ... 25
2.4.2 Première visite (V1) ... 26
2.4.3 Randomisation ... 26
2.4.4 Deuxième visite (V2) ... 26
2.4.5 Accouchement ... 27
2.4.6 Visite post-partum (V3) ... 27
2.5 Recueil des données d’accouchement et néonatales ... 27
2.6 Interventions ... 27
2.6.1 Traitement à l’insuline ... 27
2.6.2 Traitement aux HGO ... 28
2.6.2.1 Metformine ... 28 2.6.2.2 Glyburide ... 28 2.6.2.3 Ajout d’insuline ... 29 2.7 Variables dépendantes ... 29 2.7.1 Préférence du traitement ... 29 2.7.2 Qualité de vie ... 29 2.7.3 Complications maternelles ... 30 2.7.3.1 Hypoglycémie ... 30 2.7.3.2 Césarienne ... 30
2.7.3.3 Tension artérielle et protéinurie ... 30
2.7.3.4 Accouchement prématuré ... 31 2.7.4 Complications néonatales ... 31 2.7.4.1 Âge gestationnel ... 31 2.7.4.2 Poids de naissance ... 35 2.7.4.3 Hypoglycémie ... 35 2.7.4.4 Hyperbilirubinémie ... 35 2.7.4.5 Hypocalcémie ... 36 2.7.4.6 Polycythémie ... 37
2.7.4.7 Séjour à l’unité des soins intensifs néonataux ... 37
2.7.4.8 Syndrome de détresse respiratoire ... 37
2.7.4.9 Anomalies congénitales ... 37
2.8 Variables intermédiaires ... 38
2.8.1 Histoire personnelle ... 38
2.8.1.1 Âge maternel ... 38
2.8.1.2 Histoire médicale ... 38
2.8.1.3 Histoire obstétricale antérieure ... 38
2.8.1.4 Histoire obstétricale actuelle ... 38
2.8.1.5 Médication (posologie/jour) ... 39
2.8.1.6 Poids corporel (pré-grossesse et per-grossesse) ... 39
2.8.1.7 Taille ... 39
2.6.1.8 Indice de masse corporelle ... 39
2.8.2 Laboratoires ... 39
2.8.2.1 Bilan hépatique ... 39
2.8.2.2 Créatinine ... 39
2.8.2.3 Formule sanguine complète ... 40
2.8.2.4 Hémoglobine glyquée ... 40
2.8.2.5 Carnet des glycémies ... 40
2.9 Questionnaires de la qualité de vie ... 40
2.9.1 Préférence du traitement ... 40 2.9.2 SF-36 ... 41 2.9.3 W-B12 ... 42 2.7.4 DTSQ ... 42 2.7.5 EPDS ... 43 2.10 Taille de l’échantillon ... 45 2.11 Analyses statistiques ... 45 2.12 Considérations éthiques ... 47 Résultats ... 48 3.1 Données démographiques ... 48 3.2 Objectif primaire ... 49 3.2.1 Préférence du traitement ... 49 3.2.2 Qualité de vie ... 52 3.3 Objectifs secondaires ... 57
3.3.1 Contrôle glycémique ... 57 3.3.2 Complications maternelles ... 60 3.3.3 Complications néonatales ... 61 3.3.4 Surveillance maternelle ... 62 Discussion ... 63 4.1 Objectif primaire ... 63 4.1.1 Préférence du traitement ... 63 4.1.2 Qualité de vie ... 65 4.2 Objectifs secondaires ... 67 4.2.1 Contrôle glycémique ... 67 4.2.2 Complications maternelles ... 69 4.2.3 Complications néonatales ... 71
4.3 Forces et faiblesses de l’étude ... 73
4.3.1 Forces de l’étude ... 73
4.3.2 Faiblesses de l’étude ... 74
Conclusion ... 76
Remerciements ... 77
LISTE DES FIGURES
LISTE DES TABLEAUX
Tableau 1 Classification des troubles hypertensifs de la grossesse ... 32
Tableau 2 Liste des états indésirables de la prééclampsie ... 34
Tableau 3 Données démographiques ... 49
Tableau 4 Préférence du traitement ... 51
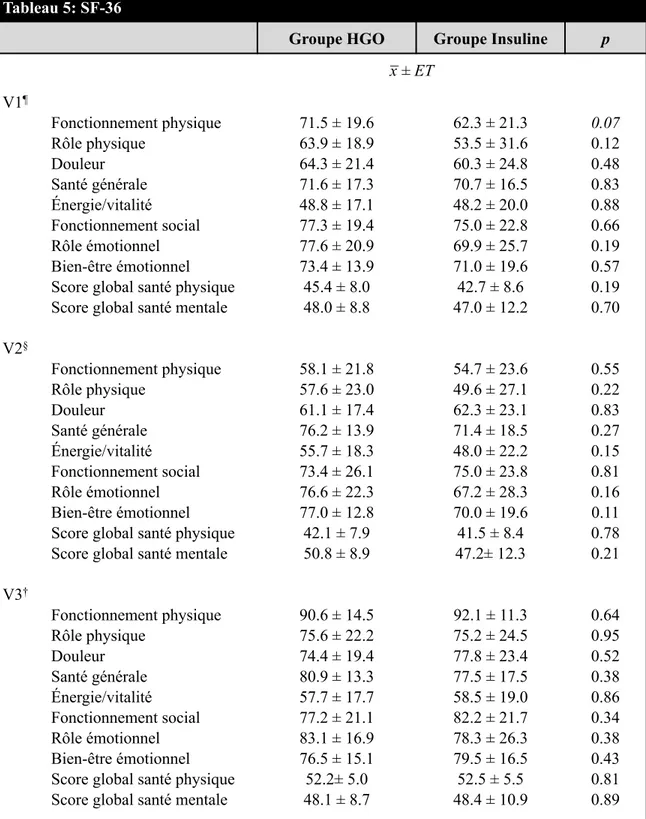
Tableau 5 SF-36 ... 53
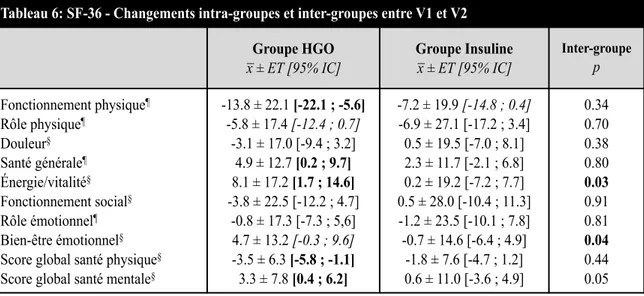
Tableau 6 SF-36 – Changements intra-groupes et inter-groupes entre V1 et V2 ... 54
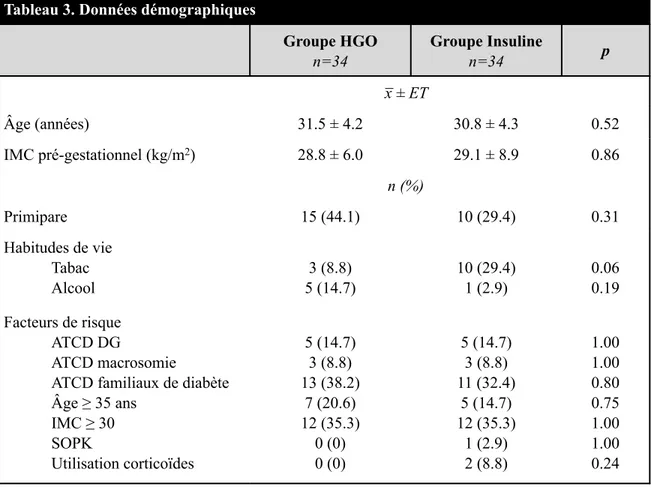
Tableau 7 W-B12 ... 55
Tableau 8 W-B12 – Changements intra-groupes et inter-groupes entre V1 et V2 ... 55
Tableau 9 DTSQ ... 56
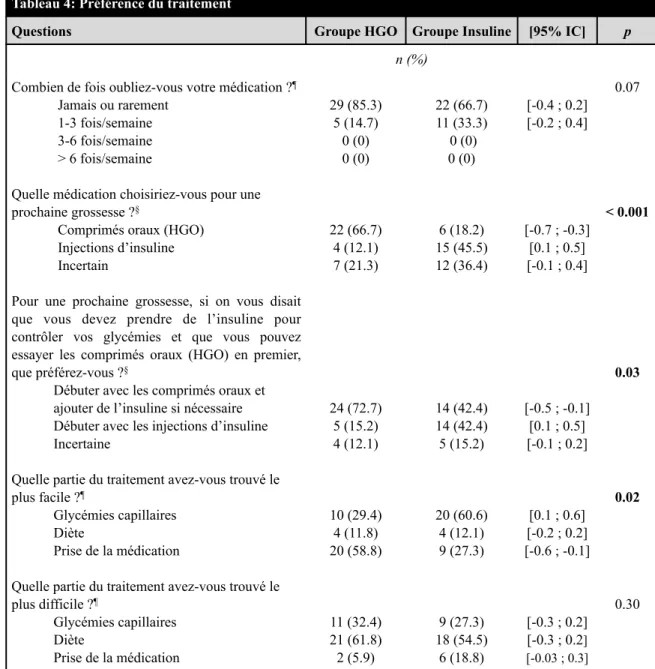
Tableau 10 EPDS ... 57
Tableau 11 Médication ... 58
Tableau 12 Contrôle glycémique ... 59
Tableau 13 Complications maternelles ... 60
Tableau 14 Complications néonatales ... 61
Tableau 15 Données maternelles V1 ... 62
LISTE DES ABRÉVIATIONS
ADA Association Américaine du Diabète (American Diabetes Association) ACD Association Canadienne du Diabète (Canadian Diabetes Association) ACHOIS Australian Carbohydrate Intolerance Study in Pregnant Women
ACOG American College of Obstetricians and Gynecologists
ADDQOL Audit of Diabetes-dependent Quality of Life
ALP Phosphatase alcaline (alcaline phosphatase) ALT Alanine aminotransférase
AST Aspartate aminotransférase
CHUS Centre hospitalier universitaire de Sherbrooke
CIV Communication inter-ventriculaire (interventricular communication) DDM Date des dernières menstruations (late menstrual period)
DEXA Absorption biphotonique à rayons X (dual energy X-ray absoptiometry) DG Diabète gestationnel (gestationnal diabetes)
DT2 Diabète de type 2 (type 2 diabetes)
DTSQ Diabetes Treatment Satisfaction Questionnaire
EPDS Edinburgh Postnatal Depression Scale
ERC Essai clinique randomisé (randomized clinical trial) HAD Hospital Anxiety and Depression Scale
HAPO Hyperglycemia and Adverse Pregnancy Outcome Study
HbA1c Hémoglobine glyquée (glycosylated hemoglobin) HGO Hypoglycémiants oraux (oral hypoglycaemic agents)
HGPO Hyperglycémie provoquée orale (glucose tolerance test – 75g) HTG Hypertension gestationnelle (gestational hypertension)
IADPSG International Association of Diabetes and Pregnancy Study Groups
IDA Irritability, Depression And Anxiety Scale
IGF Insuline-like growth factor
IGFBP Insuline-like growth factor binding proteins
IMC Indice de masse corporelle (body mass index)
LGA Large pour l’âge gestationnel (large for gestational age) MDMQ The multidimensional mood state questionnaire
MIG Metformin in Gestational Diabetes
MIG-TOFU Metformin in Gestational Diabetes - The Offspring Follow-up MMH Maladie des membranes hyalines (hyaline membrane disease) QDV Qualité de vie (quality of life)
RCIU Retard de croissance intra-utérin (intrauterine growth restriction) STAI Spielberger State-Trait Anxiety Inventory
SF-36 Questionnaire court d’étude de la santé (Short-form 36 Health Survey) SOGC Société des obstétriciens et gynécologues du Canada (The Society of
Obstetrician and Gynaecologists of Canada)
SOPK Syndrome des ovaires polykystiques (polycystic ovary syndrome) SGA Petit poids pour l’âge gestationnel (small for gestational age) TA Tension artérielle (arterial tension)
TTG Test de tolérance au glucose (glucose tolerance test – 50g)
USIN Unité des soins intensifs néonataux (neonatal intensive care unit) W-B12 Well-Being Questionnaire 12
INTRODUCTION
1.1 Introduction générale
Le débat sur les hypoglycémiants oraux (HGO) pour le traitement du diabète gestationnel (DG) perdure alors que l’utilisation des HGO est de plus en plus courante pour le traitement du diabète en grossesse. Il nous semble logique de penser que les femmes utilisatrices d’HGO pour le contrôle de leur diabète auront une meilleure qualité de vie (QDV) que celles qui se piquent à l’insuline. Il est donc surprenant de constater qu’il existe peu ou pas d’étude ayant abordé le sujet.
Le but de ce projet de maitrise est donc d’évaluer la QDV des femmes atteintes de DG traitées par insuline ou HGO et de savoir quel type de traitement elles préfèrent. Ce travail repose sur une étude pilote d’un essai clinique randomisé (ECR) qui veut aussi montrer que l’utilisation d’une association d’HGO, le glyburide et la metformine, est aussi efficace que l’insuline pour le traitement du DG (ECR de phase 3).
1.2 Recension des écrits
1.2.1 Qu’est-ce que le diabète gestationnel?
Le DG est un état d’hyperglycémie découvert pour la première fois lors de la grossesse (American Diabetes Association, 2014). Cet état d’intolérance au glucose est amplifié en partie par les divers changements hormonaux de la gestation, mais également par une certaine insuffisance des cellules bêta du pancréas (Buchanan et al. 2007). Le DG a été décrit pour la première fois dès le 19ème siècle mais en 1962, O’Sullivan a remarqué que chez la mère cette condition était reliée au risque de développer un diabète de type 2 (DT2) à long terme (O’Sullivan et Mahan 1964; O’Sullivan 1991).
La prévalence du DG est très variable selon les études, variant entre 1 et 14% chez les caucasiennes (American Diabetes Association, 2014) et jusqu’à 18% chez la population autochtone (Canadian Diabetes Association, 2008). Les nouveaux critères de dépistage de l’International Association of Diabetes and Pregnancy Study Groups (IADPSG) ont eu un
impact majeur sur la prévalence (Metzger et al., 2010). Elle a augmenté de 50% dans toutes les ethnies (Wery et al. 2013).
Le DG est associé à plusieurs complications maternelles et fœtales. Pour le nouveau-né, la macrosomie accompagnée de traumatismes tels que les fractures, les paralysies du plexus brachial ou d’asphyxie, les complications métaboliques telles que l’hypoglycémie, l’hyperbilirubinémie et l’hypocalcémie ainsi que la détresse respiratoire sont les conditions les plus à craindre (Metzger et al., 2008). À long terme, le DG maternel est associé à un risque plus élevé pour l’enfant de développer une obésité, un syndrome métabolique voire même un DT2 (Thompson et al., 2013). Chez la mère, celle-ci est davantage à risque de développer une hypertension gestationnelle associée ou non à une protéinurie (prééclampsie), avec ou sans critères adverses pouvant être néfastes pour la mère et le fœtus (Stotland et al., 2004). Il y a également un taux plus élevé de césariennes, d’accouchements vaginaux instrumentés, ainsi qu’un risque majeur de DT2 à long terme (Jovanovic et Pettitt, 2001; Agarwal et Punnose, 2004). Il est donc primordial de prévenir les complications par le dépistage et assurer le traitement adéquat de cette condition.
1.2.2 Contrôle de l’hyperglycémie
Jusqu’à récemment, l’utilité du contrôle glycémique dans le DG était mise en doute. L’étude randomisée ACHOIS (Australian Carbohydrate Intolerance Study in Pregnant
Women) a évalué l’effet de ce traitement. Dans ACHOIS, le traitement associait prise en
charge, bonnes habitudes alimentaires, exercice physique et insulinothérapie si nécessaire (Crowther et al., 2005). Quatre-cent-quatre-vingt-dix femmes ont été randomisées dans le groupe intervention et 510 femmes dans le groupe routine. Les résultats ont démontré que le nombre de sujets à traiter (number needed to treat - NNT) pour prévenir une issue périnatale sérieuse (mort périnatale, dystocie de l’épaule et fractures) était de seulement 34, un résultat impressionnant. Une particularité importante de cette étude était que les femmes inclues n’avaient qu’une simple intolérance au glucose, soit une glycémie à jeun normale et une glycémie entre 7.8 et 11.1 mmol/L à 2h lors d’une hyperglycémie provoquée orale (HGPO) de 75g de glucose. Les cas de DG francs étaient exclus.
Le niveau acceptable de glycémie durant la grossesse n’a jamais été clairement défini. L’étude HAPO (Hyperglycemia and Adverse Pregnancy Outcomes), publiée en 2008, montre qu’il existe un continuum entre la glycémie au cours de l’HGPO pratiquée entre 24 et 32 semaines de gestation et les issues défavorables, mais n’établit pas spécifiquement un seuil glycémique problématique (Metzger et al., 2008). En 2011, une revue systématique chez des femmes enceintes sans DG a établi des valeurs moyennes de glucose plasmatique à partir de 11 études; les taux suggérés, à jeun, 1 h et 2 h postprandiales, sont de 3.9 ± 0.4 mmol/L, de 6.1 ± 0.7 mmol/L et de 5.5 ± 0.6 mmol/L respectivement (Hernandez et al, 2011).
Cependant, plusieurs études ont montré de bons résultats obstétricaux avec des cibles glycémiques bien supérieures à ces moyennes : ≤ 5.3 mmol/L à jeun, ≤ 7.8 mmol/L 1h postprandiale et ≤ 6.7 mmol/L 2h postprandiales (Langer et al., 1989; Langer et al., 1991; De Veciana et al., 1995; Rey et al., 1996; Landon et al., 2009). Ces objectifs glycémiques sont les cibles établies pour le suivi du DG chez les femmes canadiennes par un consensus d'experts de l’Association Canadienne du Diabète (ACD) (Landon et al., 2009; Thompson
et al., 2013).
1.2.3 Dépistage
Les lignes directrices actuelles au Canada pour le dépistage du DG recommandent un dépistage universel entre la 24e et 28e semaine de grossesse, délaissant le dépistage basé sur les facteurs de risque uniquement (Thompson et al., 2013). En effet, ce type de dépistage montre une faible sensibilité et spécificité pour le diagnostic du DG (Thompson et al., 2013). Toutefois, au 1er trimestre, il est recommandé de dépister le DG chez une femme ayant un ou plusieurs des facteurs de risque suivants: DG antérieur, âge ≥ 35 ans, IMC ≥ 30, antécédent de macrosomie (> 4 kg), histoire familiale de diabète, membre d’une population à risque, syndrome des ovaires polykystiques (SOPK), hirsutisme, acanthosis
nigricans ou prise de glucocorticoïdes.
Avant la publication des principales études randomisées portant sur le traitement des états hyperglycémiques de grossesse (Crowther et al., 2005; Landon et al., 2009), les effets
bénéfiques reliés au traitement n’étaient pas clairement démontrés. Les résultats de ces études militaient en faveur du dépistage du DG. L’étude HAPO a tenté de montrer un lien entre l’hyperglycémie de grossesse (définie par une HGPO) et les effets indésirables, néonataux et maternels, et si un seuil d’hyperglycémie pouvait être établi. Certaines issues défavorables telles que le poids de naissance supérieur au 90e percentile et le taux de peptide-C au cordon supérieur au 90e percentile étaient fortement liées au niveau glycémique maternel. Le taux d’accouchements prématurés, de dystocies de l’épaule ou traumas de naissance, d’hyperbilirubinémies et de prééclampsies était également relié au niveau glycémique maternel mais aucun seuil spécifique n’a été clairement démontré.
En 2010, le comité consensuel de IADPSG s’est penché sur la question des seuils glycémiques en utilisant les données de l’étude HAPO. En utilisant les rapports de cotes (OR) des quatre issues primaires de l’étude (poids de naissance supérieur au 90e percentile, taux de césariennes primaire, taux d’hypoglycémies néonatales et taux de peptide-C au cordon supérieur au 90e percentile) atteignant 1.75, les auteurs ont défini les seuils glycémiques de l’HGPO-75g (Metzger et al., 2010). En appliquant ces nouvelles cibles (≥ 5.1 mmol/L à jeun, ≥ 10.0 mmol/L à 1h et ≥ 8.5 mmol/L à 2h) à la population de femmes dans l’étude HAPO, l’incidence de DG s’élevait à 17.8%. Une seule valeur supérieure à l’une des cibles ci-dessus était nécessaire pour porter le diagnostic de DG.
En 2013, le comité d’experts de l’ACD a revu les directives cliniques pour le dépistage du DG et propose deux approches différentes (Thompson et al., 2013):
1) Diagnostic séquentiel. Il suggère d’abord un test de tolérance au glucose de 50g (TTG) suivi, si la valeur à 1h lors du TTG est entre 7.8 et 11.0 mmol/L, d’une HGPO-75g pour faire ou non un diagnostic de DG. Les valeurs de glycémie au cours de l’HGPO demeurent sensiblement les mêmes depuis 2008, soit ≥ 5.3 mmol/L à jeun, ≥ 10.6 mmol/L à 1h et ≥ 9.0 mmol/L à 2h (≥ 8,9 mmol/L en 2008) et correspondent à un OR de 2.0 d’issues défavorables. La grande différence est l’abolition du terme intolérance au glucose; un diagnostic de DG est posé dès qu’une valeur de glycémie est supérieure aux cibles ci-dessus. Toutefois, si la valeur à 1h lors du TTG est supérieure à 11.1 mmol/L, un diagnostic de DG est
immédiatement posé sans avoir à procéder au second test. L’ACD suggère préférentiellement ce dépistage, sachant qu’il existe toujours une controverse sur le dépistage idéal et qu’à l’heure actuelle, il n’existe pas d’unique seuil prédisant les issues défavorables de grossesse.
2) Dépistage et diagnostic en une seule étape. Il s’agit d’une HGPO-75g avec les cibles de IADPSG (≥ 5.1 mmol/L à jeun, ≥ 10.0 mmol/L à 1h et ≥ 8.5 mmol/L à 2h). Une seule valeur supérieure à l’une des cibles est nécessaire pour porter le diagnostic de DG.
Au CHUS, un comité multidisciplinaire, le Comité régional de diabète et grossesse, a été formé en 2006 afin d'évaluer les normes de dépistage du DG. Des recommandations ont été émises, incluant la possibilité de faire un diagnostic de DG de la façon suivante : faire un TTG et si ≥ 7.2 mmol/L (OMS, 2006; American Diabetes Association, 2007), faire des glycémies capillaires, sans changer la diète, pendant 7 jours 4 fois par jour. Le but était d’éviter de pratiquer des HGPO-75g. Les patientes doivent effectuer des glycémies capillaires à jeun et deux heures après chaque repas pendant une semaine. Si quatre glycémies sur sept sont supérieures ou égales aux cibles établies par l’ACD (5.3 mmol/L à jeun et 6.7 mmol/L 2h postprandiales), à un ou plusieurs moments de la journée, le diagnostic d’hyperglycémie de grossesse est posé (Constant et al., 2008). Une diète est instaurée pour une période de deux semaines. Lorsque la thérapie nutritionnelle et l’exercice ne suffisent pas pour atteindre les objectifs glycémiques, un traitement pharmacologique est nécessaire.
La prévalence du DG varie considérablement et tend à augmenter drastiquement depuis la dernière décennie de par l’apparition de nouveaux critères, en particulier ceux de l’IADPSG. Tous ces critères sont éminemment discutables. La glycémie est très variable durant la journée (Aparicio et al., 1998). Quelques études ont démontré une variation circadienne des résultats du TTG ou de l’HGPO : des glycémies plus élevées en après-midi. Les patientes peuvent donc être hyperglycémiques au moment du test, mais pas à un autre moment. De même, les résultats peuvent varier d’une semaine à l’autre (Sacks et al., 1999; Aparicio et al., 1998).
1.2.4 Thérapie nutritionnelle
En 1996, une méta-analyse (Cochrane Database Review. Walkinshaw, 1996) notait seulement quatre études de l’effet de la diète sur les complications néonatales. Ces études comprenaient un faible échantillonnage (300 sujets et moins) et des diètes très variables. Aucune conclusion n’a pu être tirée de cette méta-analyse. Une étude prospective (Reader
et al., 2006) a été réalisée aux États-Unis et comparait l’application des guides de pratique
de l’American Diabetes Association (ADA) à une diète conventionnelle. Sur un total de 261 participantes, il y a eu une diminution significative de l’utilisation de l’insuline dans le groupe guide de pratique (24.6 %) comparativement au groupe standard (31.7 %). Il y avait également une tendance à la baisse de l’hémoglobine glyquée (HbA1c) et des naissances prématurées. Depuis, quelques analyses ont été menées pour évaluer l’efficacité de la diète sur la réduction des complications maternelles (prééclampsie, gain pondéral excessif, nécessité de césarienne ou d’insulinothérapie, et dystocie de l’épaule) et néonatales (macrosomies et hypoglycémies) dont une en 2013. On peut en conclure que la thérapie nutritionnelle est efficace pour réduire les complications maternelles et néonatales (Thomaz de Lima et al., 2013). Toutefois, cinq études seulement étaient incluses dans cette méta-analyse, dont celle de Reader et al. en 2006.
Lors d’un nouveau diagnostic de DG, il est impératif qu’une patiente soit évaluée par une nutritionniste afin d’aider à maintenir un état euglycémique, de s’assurer d’un gain pondéral adéquat et d’une diète ayant un apport nutritionnel suffisant. Le gain de poids recommandé en grossesse dépend fortement de l’indice de masse corporelle (IMC) avant la grossesse. Pour un IMC < 18.5 kg/m2 (insuffisant), le gain pondéral suggéré est de 28 à 40 livres (12.7 à 18.2 kg); pour un IMC entre 18,5 et 24,9 kg/m2 (normal), le gain suggéré est de 25 à 35 livres (11.4 à 15.9 kg); pour un IMC entre 25 et 29,9 kg/m2 (surpoids), le gain est de 15 à 25 livres (6.8 à 11,4 kg) et pour un IMC ≥ 30 kg/m2 (obésité), le gain pondéral suggéré est de 11 à 20 livres (5 à 9.1 kg) (Rasmussen et al. 2009).
Les grandes associations sur le diabète recommandent un plan alimentaire basé sur la restriction modérée en glucides, répartis en trois repas par jour et trois collations, dont une au coucher afin d’aider au maintien des glycémies. Les diètes hypocaloriques sont à
proscrire, car elles aboutissent en un gain de poids insuffisant et un état de cétose pouvant être nocive pour la mère et le fœtus (Thompson et al., 2013).
1.2.5 Exercice physique
Traditionnellement, il était déconseillé aux femmes enceintes d’entreprendre un programme d’exercice, car il était réputé pour avoir des effets défavorables chez le fœtus. Des craintes existaient concernant l’hyperthermie provoquée et le risque potentiel de tératogénicité, de diminution de l’apport en oxygène et des nutriments pouvant causer une hypoxie ou un retard de croissance intra-utérin (RCIU). Les avortements spontanés au premier trimestre ainsi que les complications au troisième trimestre faisaient aussi partie des risques reliés à l’exercice physique durant la grossesse (Shangold, 1989; Wolfe et al., 1989).
Bien sûr, d’autres études ont démontré le contraire (Wolfe et Mottola, 2000; Mottola, 2007) et des lignes de conduite ont été créées et révisées afin d’inclure un programme d’exercice progressif chez les femmes enceintes dont la grossesse ne comporte aucune contre-indication (Kochan-Vintinnier et al., 1999; Davies et al., 2003; Wolfe et Davies, 2003). Les sociétés scientifiques comme la Société des Obstétriciens et Gynécologues du Canada (SOCG) recommandent pour les femmes enceintes, n’ayant aucune contre-indication à l’exercice, une séance de 30 minutes par jour d’intensité modérée au moins quatre fois par semaines. (Davies et al., 2003). Depuis 2003, la SOGC n’a pas revu ses lignes de conduite sur l’exercice physique et la grossesse. L’American College of Obstetricians and
Gynecologists (ACOG) a publié en 2002 (ACOG, 2002) les mêmes recommandations que
la SOGC qu’il a reconduites en 2009.
L’activité physique a été démontrée bénéfique chez les individus avec diabète. L’exercice améliore le contrôle glycémique, diminue la résistance à l’insuline, réduit le risque cardiovasculaire et contribue au contrôle du poids et améliore le bien-être (Reader, 2007). La plupart des études sur l’exercice physique et les femmes enceintes démontrent principalement une réduction du risque de développer un DG (Oken et al., 2006; Chasan-Taber et al. 2008).
Une revue exhaustive de la littérature publiée par Filhol et al. en 2014 a montré que l’exercice physique en grossesse est bénéfique, autant pour la mère que le fœtus. L’exercice aide à maintenir la fonction cardio-respiratoire et musculaire, limite la prise de poids, favorise un temps d’accouchement plus court, réduit le risque de prééclampsie, de DG, de DT2 à long terme et les symptômes dépressifs (Filhol et al., 2014). Une méta-analyse sur l’exercice et le DG a été publiée en juin de cette année. Une équipe espagnole a analysé 13 études, incluant au total 2 873 femmes. Ils ont évalué spécifiquement le risque de DG et le gain pondéral maternel. Ils ont conclu que l’exercice physique modéré réduisait le risque de DG et diminuait le gain pondéral tout en étant très sécuritaire pour la mère et son fœtus (Sanabria-Martinez et al., 2015).
Très peu d’études ont regardé spécifiquement l’effet de l’exercice physique sur les complications néonatales. Le Cochrane Database Review a effectué une méta-analyse sur l’exercice physique et les femmes enceintes atteintes de DG (Ceysens, 2006). Cette étude avait comme objectif d’évaluer l’effet de l’exercice sur la morbidité maternelle et fœtale, le taux de prescription d’insuline et le contrôle glycémique. Seulement quatre études ont été retenues, pour un total de 114 femmes. L’intervention était menée au troisième trimestre, sur une période de six semaines en moyenne. Il n’y a eu aucune différence quant aux complications néonatales et la prescription d’insuline mais les données étaient insuffisantes pour recommander ou exclure l’exercice chez les femmes avec DG. Une revue publiée par van Poppel et al. en 2014 suggère que l’activité physique débutée avant ou pendant la grossesse a une influence positive sur la glycémie maternelle et la résistance à l’insuline, réduisant ainsi le risque de DG. De plus, l’instauration de l’exercice physique chez les femmes déjà atteintes de DG améliore le contrôle glycémique. Cependant, les effets directs de l’activité physique sur les issues néonatales ne sont pas clairs (van Poppel et al. 2014).
Il est donc raisonnable d’encourager l’exercice physique chez les femmes enceintes déjà actives avant leur grossesse.
1.2.6 Insuline
La crainte principale concernant l’utilisation d’agents pharmacologiques pour traiter une condition médicale en grossesse est l’effet tératogénique. L’effet tératogène des drogues, lors de la grossesse est surtout présent dans les huit premières semaines, période où s'effectuent l’embryogenèse et l’organogenèse. Les études menées en Afrique du Sud dans les années 60 l’ont bien démontré (Coetzee 2007). C’est durant cette période que la vulnérabilité aux substances toxiques, agents infectieux ou autres est maximale, alors qu'après la 8e semaine, soit la période fœtale, la vulnérabilité est sensiblement plus faible (Embryologie humaine, 2007).
L’insuline est le principal agent pharmacologique utilisé dans le traitement du DG. L’insuline permet un bon contrôle glycémique sans qu’il y ait passage placentaire (Nicholson et al., 2009) vue la taille de la molécule : près de 6 000 daltons (Evain-Brion et Malassiné, 2010). Cependant, il existe certaines réserves concernant son utilisation et le risque de malformations congénitales. Des études ont démontré que les anticorps formés contre l’insuline humaine injectée traversent le placenta (Gamson et al., 2004). Par ailleurs, l’utilisation grandissante d'analogues d’insuline à action rapide et longue durée depuis plusieurs années a alimenté ces craintes. Une étude basée sur le modèle de perfusion ex vivo a évalué le passage de l’insuline lispro à travers le placenta (Boskovic, 2003). Les concentrations fœtales d’insuline étaient largement inférieures au niveau minimal de quantification lorsque la concentration maternelle était équivalente au pic maximal d’une injection sous-cutanée de 26 unités chez un sujet sain; ces concentrations ne représentaient pas un danger pour le fœtus.
Il existe plusieurs études cliniques sur les insulines analogues ultrarapides aspart et lispro qui tendent à montrer un meilleur contrôle glycémique, une meilleure observance et moins d’épisodes d’hypoglycémies comparativement à l’insuline humaine (Gamson et al., 2004; Di Cianni et al., 2007). Deux études semblent montrer une diminution du risque de macrosomie avec l’insuline aspart ou lispro comparativement à l’insuline humaine (Di Cianni et al., 2007; Nor Azlin et al., 2007).
Récemment, le problème des insulines analogues à longue action a également été soulevé. Quelques études de cas ont été rapportées (Woolderink et al., 2005; Dolci et al., 2005; Di Cianni et al., 2005; Graves et al., 2006), dont une comprenant 33 patientes (10 avec un diabète de type 1 et 22 avec un DG) ayant pris la glargine durant leur grossesse (Price et al., 2007). Aucune différence entre ce groupe et le groupe témoin n’a été notée en termes de poids, d’âge gestationnel à la naissance et de complications néonatales. Une revue canadienne a d'autre part démontré qu’il n’existait pas de traitement supérieur pour le contrôle glycémique et les hypoglycémies entre les analogues et humaines, rapides ou à longue action (Singh et al., 2009).
La plus récente méta-analyse a été publiée en avril 2015 et avait comme objectif d’évaluer l’innocuité de quatre analogues de l’insuline (aspart, lispro, glargine et detemir). Les auteurs ont retenu 24 études pour un total de 3 734 femmes avec diabète pré-gestationnel et DG. Ils ont conclu que, par comparaison avec l’insuline régulière, l’utilisation de la lispro était associée à des risques plus faibles d’hyperbilirubinémies chez le nouveau-né (RR 0.63 [95% IC : 0.44-0.90]) et d’hypoglycémies maternelles (RR 0.33 [95% IC : 0.12-0.89]). En revanche, ils ont trouvé une augmentation de l’incidence des gros poids de naissance (large
for gestational age - LGA) (RR 1.42 [95% IC : 1.20-1.69]). Les taux de césariennes et de
macrosomies étaient similaires entre les insulines aspart et régulière.
Pour ce qui est des insulines longues durée, le poids de naissance, le taux d’hypoglycémies maternelles sévères, de syndromes de détresse respiratoire et d’admissions à l’unité de soins intensifs néonataux (USIN) étaient identiques quand on comparait les insulines NPH et glargine. Le taux de LGA, de macrosomies et d’hypoglycémies néonatales étaient aussi comparables entre l’insuline NPH et detemir (Lv et al. 2015).
1.2.7 Hypoglycémiants oraux
L’insuline est le traitement préconisé en DG lors de l’échec de la diète et de l’exercice. Très efficace pour le contrôle de la glycémie maternelle, elle requiert cependant un bon enseignement et une certaine dextérité pour assurer une prise adéquate. Outre les hypoglycémies potentielles, elle peut causer beaucoup de craintes et d’anxiété. Les HGO
sont une alternative facile d’utilisation pour faciliter le contrôle glycémique chez certains patients (Maymone et al., 2011). Les risques de malformations fœtales et d’hypoglycémies sévères ont toujours été les principaux arguments contre leur utilisation, mais ces arguments semblent s’estomper depuis quelques années avec le nombre croissant d’études sur le sujet (Kelley et al, 2015). Nous avons soumis un article de revue à ce sujet (Pellerin
et al., submitted). Nous y discutons les raisons de la réticence pour les essais cliniques en
grossesse, dont la principale crainte étant le risque d’anomalies congénitales. Les malformations congénitales sont d’origine inconnue dans la moitié des cas (Stevenson et Hall., 2006). Il a surtout été démontré qu’elles étaient dues, en présence de diabète, à des DT2 préexistants ou au mauvais contrôle glycémique à la conception (Gedeon et Koren, 2006).
Les HGO ont l’avantage d’une utilisation plus facile et plus abordable (Poolsup et al.2014). La metformine et le glyburide, les deux molécules les plus étudiées à ce jour, représentent des alternatives acceptables dans le traitement du DG. Les autres HGO sont déconseillés durant la grossesse, les données actuelles étant insuffisantes pour recommander leur utilisation (Holt et Lambert, 2014).
1.2.7.1 Metformine
La metformine est un hypoglycémiant oral de la famille des biguanides. Son rôle consiste surtout à diminuer la néoglucogenèse hépatique, mais aussi à diminuer la résistance à l’insuline et à augmenter l’utilisation périphérique du glucose. Elle est utilisée en première intention dans le traitement du DT2, seule ou en association avec d'autres HGO. La metformine a une excrétion rénale. En grossesse, le taux de filtration glomérulaire augmente de façon considérable, soit de l’ordre de 40%, ce qui favorise une excrétion plus rapide (Hughes et al., 2006).
La crainte principale entourant la metformine est liée à son passage transplacentaire. En effet, la concentration fœtale peut atteindre la moitié de la concentration maternelle (Lautatzis et al., 2013). Toutefois, les études animales ont bien démontré qu’il n’existait aucun risque tératogène chez le rat et le lapin, et ce avec l’utilisation de doses pouvant
atteindre deux à six fois la concentration maximale recommandée chez l’humain (Lautatzis
et al., 2013).
Les premières études sur l’innocuité de la metformine ont été effectuées chez les femmes atteintes du SOPK, condition prédisposant grandement au développement du DG. Plusieurs études rétrospectives ont examiné l’effet de la metformine au premier trimestre, et certaines pendant toute la grossesse. Ces études ont rapporté une diminution du taux d’avortements spontanés au premier trimestre sans augmentation du taux de malformations congénitales (Kovo et al., 2006; Bolton et al., 2009). L’utilisation de la metformine lors du 2e et 3e trimestre est également associée à un taux réduit d’hypoglycémies néonatales (Helmuth et
al., 2000 ; Jacubowicz et al., 2002). Quelques études de cohorte non randomisées ont rapporté un taux plus élevé de prééclampsie et de mortalité périnatale dans le groupe metformine comparativement aux groupes insuline et sulfonylurée. Toutefois, en examinant les caractéristiques des groupes, l’âge moyen dans le groupe metformine était de 32 ans et l’IMC de 31.2 kg/m2, contrairement aux deux autres groupes (insuline: 29 ans, IMC 24.8 kg/m2 et sulfonylurée: 28 ans, IMC 22.8 kg/m2) (Hellmuth et al., 2000).
La question de la cause réelle de ces prééclampsies se pose, sachant que l’âge maternel avancé et l’obésité sont deux importants facteurs de risque pour le développement d’issues de grossesse défavorables. Le SOPK semble être, en soit, associé à un risque accru de prééclampsie (Bruyneel et al. 2014). L’explication la plus plausible réside dans une dysfonction du ratio IGF-1/IGFBP-1, tous deux intervenant dans la croissance fœtale et le développement placentaire, ce qui crée un défaut dans l’envahissement trophoblastique lors de l’implantation (Bruyneel et al. 2014).
Cependant, les études sont contradictoires en ce qui concerne le risque augmenté de prééclampsie lors de l’utilisation de la metformine. Certaines semblent démontrer une réduction du risque (Glueck et al., 2002 ; Glueck et al. 2004 ; Salvesen et al. 2007) tandis que d’autres ne démontrent aucune différence entre le groupe metformine et le groupe placebo (Vanky et al, 2012 ; Glueck et al. 2013). Plusieurs études prospectives ont également démontré la réduction du taux d’avortements spontanés et l’absence d’effet
tératogène de la metformine (Glueck et al., 2002; Glueck et al., 2004; De Leo et al., 2011; Glueck et al., 2013).
La principale étude randomisée comparant la metformine à l’insuline fut celle de Janet Rowan en 2008 (la MIG study - Metformine in Gestational diabetes). Cette étude randomisée, contrôlée et ouverte est la plus importante à ce jour. Elle fut menée sur 751 femmes atteintes de DG entre 20 et 33 semaines de grossesse. L’issue principale était un composite néonatal englobant les hypoglycémies, la détresse respiratoire, l’hyperbilirubinémie nécessitant de la photothérapie, les traumatismes néonataux à la naissance, l’APGAR à 5 minutes inférieur à 7 et la prématurité (< 37 semaines). Les objectifs secondaires étaient les suivants: mesures anthropométriques néonatales, contrôle glycémique maternel, complications hypertensives maternelles, tolérance au glucose post-partum et acceptabilité du traitement. Les résultats n’ont montré aucune différence significative pour le composite néonatal : 32.0 % dans le groupe metformine contre 32.2% dans le groupe insuline (RR 0.99 [95% IC : 0.80-1.23]) mais une réduction des hypoglycémies néonatales dans le groupe metformine (3.3% vs 8.1%, p=0.008) et un taux supérieur d’accouchements prématurés dans ce même groupe (12.1% vs 7.6%, p=0.04). Pour les objectifs secondaires, aucune différence n'a été décelée dans le contrôle glycémique maternel, le taux de complications hypertensives ou de diabète post-partum. Mais dans le groupe metformine, le gain pondéral était moindre et une plus grande perte de poids était observée entre l’entrée à l’étude et la visite post-partum (Rowan et al., 2008).
Rowan a évalué les enfants exposés in utero à la metformine à l’âge de deux ans (MIG –
The Offspring Follow-up - MIG-TOFU). Les enfants du groupe metformine présentaient
des mesures de gras sous-cutané plus élevées à certains endroits (mi-bras) sans toutefois présenter de différence dans le gras corporel général mesuré par bioimpédance et par absoprtion biophotonique à rayon X (dual energy X-ray absoptiometry – DEXA). Ces résultats ont été interprétés comme le signe d'une moindre accumulation de gras viscéral, une hypothèse que les auteurs espèrent vérifier à l’avenir (Rowan et al., 2011).
Pour les femmes qui ne sont pas observantes au traitement du diabète ou qui refusent l’insuline, une thérapie à la metformine peut être tentée comme alternative pour le contrôle glycémique. L’usage de cet agent doit cependant être discuté avec les patientes (Thompson
et al. 2013).
En conclusion, la metformine est considérée aujourd’hui comme un agent acceptable, mais non totalement accepté, pour le remplacement de l’insuline dans le traitement du DG.
1.2.7.2 Glyburide
La première étude sur le passage du glyburide à travers le placenta a été effectuée par Elliot
et al. en 1994, étude qui comparait plusieurs sulfonylurés (Elliott et al., 1994). Le passage
des molécules de première génération, telles le tolbutamide (21.5%) et le chlorpropamide (11%), était supérieur à celui des sulfonylurés de deuxième génération, tels le glyburide (3.9%) et le glipizide (6.6%). Ce faible passage serait associé à une grande affinité pour les protéines et à une très courte demi-vie. L’ensemble contribuerait à diminuer le risque tératogène et les effets secondaires de ces agents chez le fœtus (Gedeon et Koren, 2006). S’il est démontré que le glyburide traverse, certes peu, la barrière placentaire, ses métabolites le font aussi, mais ceci a été peu analysé. Les données disponibles aujourd’hui montrent que ce passage transplacentaire semble ne pas avoir d’effet néfaste sur le nouveau-né (Hebert et al. 2009).
La principale étude prospective ayant évalué l’efficacité du glyburide en comparaison à l’insuline est celle de Oded Langer en 2000 (Langer et al., 2000). Quatre-cent-quatre femmes ont été recrutées et randomisées entre la 11e et la 33e semaine de gestation, 201 dans le groupe glyburide et 203 dans le groupe insuline. Cette étude n’a démontré aucune différence entre les deux thérapies, que ce soit pour le contrôle glycémique ou les complications périnatales. Un contrôle glycémique optimal, considéré comme une glycémie à jeun inférieure à 5.0 mmol/L et 2 h postprandiales inférieure à 6.7 mmol/L, a été atteint chez 82% des patientes dans le groupe glyburide et chez 88% dans le groupe insuline. Huit patientes sur 201 (4%) dans le groupe glyburide ont dû prendre de l’insuline. Un plus grand nombre d’hypoglycémies a par ailleurs été rapporté dans le groupe insuline (14% vs 4%)
mais aucune hypoglycémie majeure n'a été signalée. Les niveaux de glyburide dans le sang du cordon étaient indétectables. Une nouvelle analyse de cette étude (Langer et al., 2005) évaluant la relation entre la dose de glyburide, la sévérité du DG et les issues maternelles et fœtales, a démontré une efficacité identique du glyburide et de l’insuline, indépendamment de la sévérité du DG.
Quatre ans à peine après l’étude de Langer, le glyburide est devenu une première ligne de traitement du DG aux États-Unis. Plus de 13% des obstétricien-gynécologues américains débutaient directement par le glyburide lorsque la diète et l’exercice ne suffisaient plus au maintien de la glycémie (Gabbe et al., 2004).
Depuis les quinze dernières années, de nombreuses études ont été publiées sur le sujet. Une étude de cohorte rétrospective publiée en 2012 et incluant 10 682 femmes a évalué les issues périnatales défavorables comme le taux de travail prématuré, de macrosomies, de LGA, de morts in utero, d’admissions à l’USIN ainsi que le taux de césariennes chez les femmes enceintes atteintes de DG et traitées par glyburide ou insuline. Les femmes ont été traitées avec glyburide dans 19.4% des cas (n= 2 073) et avec insuline dans 80.6% des cas (n=8 609). Le groupe glyburide était associé à une légère hausse des admissions à l’USIN (OR 1.4 [95% IC : 1.07-1.64]) et de macrosomies (OR ajusté 1.29 [95% IC : 1.03-1.64]). Il n’y avait aucune différence pour les autres issues défavorables (Cheng et al. 2012).
La plus récente étude, la plus grande en nombre de sujets, comparant le glyburide à l’insuline est une étude de cohorte rétrospective incluant plus de 110 000 femmes avec un diagnostic de DG. Cette étude provient d’une base de données de réclamation d’assurances aux États-Unis, sur une période de plus de 11 ans. Neuf-mille-cent-soixante-treize femmes, soit 8.3%, ont été traitées avec du glyburide (n=4 982) ou de l’insuline (n=4 191). Les nouveau-nés exposés au glyburide avaient un risque légèrement accru d’admission à l’USIN (RR 1.41 [95% IC : 1.23-1.62]), de syndrome de détresse respiratoire (RR 1.63 [95% IC : 1.23-2.15]) et de LGA (RR 1.43 [95% IC : 1.16-1.76]). Toutefois, la durée à l’USIN n’a pas été évaluée. Il n’y avait aucune différence significative du taux
d’hypoglycémies néonatales, de traumas de naissance, de naissances prématurées, d’hyperbilirubinémies ou de césariennes (Castillo et al, 2015).
Poolsup en 2014 a fait une méta-analyse incluant 7 études qui comparait le glyburide à l’insuline (Poolsup et al., 2014). Elle suggérait une hausse du risque de macrosomies (RR 3.07 [95% IC : 1.14-8.23]) et d’hypoglycémies néonatales (RR 2.30 [95% IC : 1.28-4.11]) mais aucune différence sur le risque de LGA, de travail prématuré, de mortalité néonatale, d’anomalies congénitales et de petits poids de naissance (small for gestational age – SGA). Le taux d’issues maternelles, soit le risque de césariennes, de pré-éclampsies et d’hypoglycémies maternelles, était le même dans les deux groupes voire même une tendance vers une réduction du taux de césariennes et d’hypoglycémies maternelles dans le groupe glyburide. Le taux d’admission à l’USIN n’a pas été évalué dans cette étude.
La littérature récente persiste à être contradictoire dans les diverses issues maternelles et néonatales. Certaines démontrent une hausse très légère des admissions à l’USIN (RR 1.4) sans toutefois évaluée la durée du séjour, qui reste selon nous un indicateur plus significatif de la sévérité des soins. De plus, le glyburide semble être associé à un risque plus élevé de macrosomie et de LGA mais sans avoir de répercussion sur les issues d’accouchement (aucune différence sur le taux de césariennes, de traumas de naissance ou de mortalité néonatale). Concernant les hypoglycémies néonatales, les données actuelles sont contradictoires. Certains auteurs suggèrent une hausse du risque tandis que d’autres suggèrent une baisse.
Dans les dernières recommandations de l’ACD, il est dit que le glyburide est sécuritaire et efficace pour le contrôle du DG chez plus de 80% des patientes. Pour les femmes qui ne sont pas observantes au traitement du diabète ou qui refusent l’insuline, une thérapie au glyburide (ou à la metformine), peut être tentée comme alternative pour le contrôle glycémique. L’usage de ces agents doit cependant être discuté avec les patientes (Thompson et al. 2013).
En conclusion, le glyburide est considéré aujourd’hui comme un agent acceptable, mais non totalement accepté, pour le remplacement de l’insuline dans le traitement du DG. Malgré que le glyburide semble très sécuritaire et non associé à un risque tératogénique, nous convenons qu’il est primordial de faire d’autres ERC avec de plus grands échantillons afin de statuer sur la sécurité et l’innocuité.
1.2.7.3 Échec des HGO
L’échec des HGO est défini par la l’incapacité de contrôler adéquatement les glycémies selon les cibles établies et la nécessité d’introduire l’insuline. L’évaluation des facteurs contribuant à l’échec des HGO est difficile car le taux varie selon la population étudiée et la définition des cibles glycémiques.
Dans l’étude MIG, 46.3% des participantes du groupe expérimental ont dû recevoir un supplément d’insuline. Il a été conclu que le principal facteur était le poids pré-grossesse (Rowan et al., 2008).
Pour ce qui est de l’utilisation du glyburide, le taux d’échecs du contrôle glycémique varie entre 16 et 19%. Mais les valeurs visées sont très variables entre les études, de 5.0 à 5.6 mmol/L à jeun, de 7.2 à 8.6 mmol/L 1 h postprandiale et de 6.4 à 7.2 mmol/L 2 h postprandiales (Chmait et al., 2004; Conway et al., 2004; Kremer et Duff, 2004; Jacobson
et al. 2005; Kahn et al., 2006). Deux études rétrospectives effectuées principalement chez
une population hispanique ont démontré que les échecs du glyburide étaient dus à l’âge maternel avancé, à la précocité du diagnostic du DG (< 24 semaines), à la parité et à la glycémie à jeun, autant d’observations qui suggèrent un taux élevé de diabète préexistant, non connu avant grossesse (Chmait et al., 2004; Kahn et al., 2006).
Terminons en signalant que le glyburide et la metformine, s’ils ont été beaucoup étudiés et utilisés, ont toujours été testés en monothérapie. Il nous parait logique de penser que l’association de ces deux agents serait plus efficace, l’ajout de l’un venant pallier la défaillance de l’autre, chacun potentialisant les effets de l’autre. De ce fait, l’amélioration de la sensibilité à l’insuline et la réduction de la néoglucogénèse hépatique (metformine)
associée à l’augmentation de la production d’insuline par le pancréas (glyburide) favoriseront un meilleur contrôle du DG. Dans le traitement du DT2, ces deux molécules sont peu coûteuses, sécuritaires et réduisent le risque d'événements cardiovasculaires. La metformine n'est pas associée à une hausse des hypoglycémies et elle est reliée à une perte de poids voire une réduction de la masse adipeuse. Toutefois, plusieurs effets secondaires gastro-intestinaux comme les crampes, les ballonnements et la diarrhée sont à prévoir avec la prise de cet agent. Le glyburide, quant à lui, est associé à plus d'hypoglycémies et un gain pondéral (American Diabetes Association, 2015).
1.2.8 Qualité de vie
Aucune définition universelle n’est établie pour définir la QDV. Plusieurs auteurs ont proposé une définition, selon leur champ d’expertise. En effet, la QDV est devenu un domaine de recherche en croissance depuis les trois dernières décennies. Malgré l'absence de définition et d’outils communs, les auteurs s’entendent sur les dimensions essentielles que doit contenir le concept QDV. En premier lieu, la fonction, qu’elle soit physique, sociale ou individuelle, est essentielle. La perception de la santé mentale et physique est également une composante fondamentale, tout comme la vitalité, de la fonction cognitive et de la perception de la douleur(Luscombe, 2000; Maddigan et al., 2003; Chen et Kochen, 2005).
Une méta-analysea comparé l’effet de l’insuline à courte action et de l’insuline régulière sur le contrôle glycémique, les épisodes d’hypoglycémie, la QDV et les complications spécifiques du diabète (Plank et al., 2005). Sur onze études évaluant la QDV, 7 ont été retenues. Trois de ces études n’ont montré aucune différence tandis que les quatre autres ont montré une meilleure QDV chez le groupe insuline à courte action.
Les études sur la QDV et le DG sont rares, d’autant plus que l’on cherche des études comparant des femmes traitées avec insuline et/ou HGO. Pourtant, le principal argument incitant à l’utilisation des HGO est la possibilité d’une meilleure QDV et d’une meilleure observance du traitement par la mère durant sa grossesse. En effet, les HGO n’ont pas les inconvénients de l’insuline tels que la peur de l’injection, les doutes quant à
l’auto-administration, la complexité de l’ajustement et la crainte des hypoglycémies (Petrak et al., 2007).
Une des premières études prospectives ayant évalué la QDV chez les femmes enceintes atteintes de DG est l’étude ACHOIS (Crowther et al., 2005). Cette étude comparait deux groupes : le groupe intervention dans lequel les femmes étaient dépistées pour le DG, avait une diète, un suivi glycémique et un traitement d’insuline au besoin et le groupe routine dans lequel les femmes n’avaient pas accès au dépistage du DG. Les questionnaires utilisés étaient le 36-Item Short-Form Health Survey (SF-36), le Spielberger State-Trait Anxiety
Inventory (STAI) et le Edinburgh Postnatal Depression Scale (EPDS). Les participantes
ont complété les questionnaires six semaines après l’entrée à l’étude et trois mois post-partum. Sur un total de 1 000 participantes, 682 ont répondu pendant la grossesse et 573 en post-partum. Une tendance favorable est ressortie de l’étude pour le groupe intervention concernant l’état de santé en général (SF-36), ainsi qu’une diminution des dépressions post-natales chez ce même groupe (8% contre 17%). Une seconde étude menée en 2002 a tenté d’évaluer la QDV des femmes enceintes dépistées pour le DG (Rumbold et Crowther, 2002). Cette étude a comparé, après dépistage au 3e trimestre, le groupe dépisté positif pour le DG à celui dépisté négatif. Les auteurs ont utilisé le SF-36, le STAI et le EPDS en plus de recueillir qualitativement des informations auprès des participantes sur la perception de leur santé et celle de leur bébé. Les femmes dépistées positives avaient une moins bonne perception de leur santé que les femmes dépistées négatives (p<0.05) mais aucune différence n'a été notée en terme d’anxiété, de dépression et sur la perception de la santé de l’enfant.
L’étude MIG a également analysé l’acceptabilité du traitement chez les participantes de l’étude (Rowan et al., 2008). Le groupe metformine avait une meilleure acceptabilité du traitement. Les patientes avaient été questionnées en post-partum. Dans le groupe metformine, 76.4% ont répondu vouloir reprendre de la metformine lors d’une autre grossesse tandis que 27.2% des femmes du groupe insuline ont dit vouloir reprendre de l’insuline d’emblée pour le traitement d’un DG. Un plus grand nombre de femmes dans le groupe metformine (59% versus 35.3%) ont évalué la prise de la médication comme étant
la partie la plus facile du traitement. En contrepartie, un plus grand nombre de femmes dans le groupe insuline (27.2 versus 10.5%) ont évalué la prise de la médication comme étant la partie la plus difficile du traitement.
Une étude de cohorte observationnelle publiée en 2012 avait comme objectif d’explorer les inquiétudes, l’humeur, la QDV et la satisfaction quant au traitement du diabète chez les femmes avec DG traitées par diète ou par insuline. Les femmes ont dû répondre à quatre questions (faites maison) concernant leurs impressions sur le nouveau diagnostic de DG, leurs inquiétudes générales et spécifiques, leur motivation quant au traitement ainsi qu’à la modification des habitudes de vie. Elles ont reçu trois questionnaires validés dont le questionnaire sur la QDV de l’OMS (WHOQOL – BREF), distribué avant le traitement (24-28 semaines) ainsi qu’en phase tardive du traitement (36-40 semaines). Elles ont dû répondre également au questionnaire multidimensionnel sur l’humeur (MDMQ) avant le traitement, en phase précoce (28-30 semaines) et en phase tardive, et au questionnaire quant à la satisfaction du traitement du diabète (DTSQ) en phase précoce et tardive du traitement. Les conclusions étaient que l’état de santé du bébé était la principale inquiétude, mais constituait une grande motivation au traitement. La satisfaction du traitement et la dimension de bien-être étaient inférieures chez les femmes ayant reçu de l’insuline mais s’amélioraient au fur et à mesure que la grossesse progressait. Ceci s’expliquait par les réticences initiales face au traitement avec insuline qui s’atténuaient avec l’expérience (Trutnovsky et al. 2012).
Une des seules études ayant évalué la QDV chez les femmes avec DG et traitées par insuline et/ou HGO a été publiée en 2013. Deux questionnaires furent utilisés, le questionnaire sur la satisfaction quant au traitement du diabète (DTSQ) et le Audit of
Diabetes-dependent Quality of Life (ADDQOL), outil mesurant l’impact du diabète sur la
QDV. Trois groupes ont été comparés, metformine seule (n=68), insuline seule (n=32) et la combinaison metformine et insuline (n=28). Les participantes dans les groupes metformine seule et insuline seule ont exprimé une meilleure perception de leur QDV en comparaison au groupe traitement combiné. Le traitement à la metformine seule avait un meilleur impact
sur la QDV et était associé à une plus grande satisfaction quant au traitement du diabète (Latif et al., 2013).
1.3 Hypothèse/problématique
Bien qu’il existe peu d’études prospectives randomisées, les HGO semblent avoir une efficacité comparable à celle de l’insuline pour contrôler la glycémie des femmes atteintes de DG. Les HGO ont l’avantage d’être des comprimés oraux et n'ont donc pas les inconvénients de l’insuline qui, elle, doit être injectée.
Les HGO peuvent être utilisés au Canada en cas de refus absolu par la patiente de prendre de l’insuline, nous l’avons discuté. Les études disponibles montrent que le taux de malformations congénitales n’augmente pas avec l’utilisation de la metformine et du glyburide si ces médications sont employées après la période d’embryogénèse, et même pendant comme le montre l’utilisation de la metformine en continu chez les femmes avec SOPK. Les anomalies congénitales, qui sont rappelons-le, d’origine inconnue dans 50% des cas, sont habituellement liées à l’hyperglycémie à la conception et donc à un DT2 inconnu et très mal contrôlé avant la grossesse.
Les études sur la metformine sont rassurantes concernant les issues maternelles et fœtales. Les dernières études sur le glyburide, quoique contradictoires pour certaines issues néonatales, semblent associer son utilisation à une très légère hausse des admissions à l’USIN sans toutefois spécifier la durée du séjour, élément primordial pour l’évaluation de la sévérité. Le risque de macrosomie et de LGA semble également plus élevé sans être associé à une hausse du taux de césariennes, de traumas de naissance ou de mortalité néonatale. Somme toute, le glyburide reste une molécule très sécuritaire dont le risque tératogène a été écarté.
Les études sur la QDV des femmes enceintes avec DG sont rares. Une étude a comparé la QDV en utilisant divers questionnaires chez les femmes traitées soit par insuline ou par HGO, mais aucune avec une combinaison d’HGO.
La metformine et le glyburide sont des traitements hypoglycémiants alternatifs à l’insuline. Mais qu’en pensent les femmes qui, selon les recommandations actuelles, doivent s’injecter de l’insuline une à quatre fois par jour, en plus de la prise des glycémies capillaires, pour contrôler leur DG ? Sont-elles à l’aise avec ce traitement imposé ? Seraient-elles intéressées par une alternative efficace et présentant, a priori, moins de désavantages ? Il est temps d’évaluer et de comparer la QDV obtenue avec ces deux modes de traitement.
Notre hypothèse stipule que les femmes préfèrent les HGO à l’insuline et que la QDV des femmes enceintes avec DG et traitées par HGO est meilleure que celle des femmes traitées par insuline. Nous croyons que les HGO sont aussi efficaces que l’insuline pour atteindre un niveau de contrôle glycémique optimal, tout en étant sécuritaires.
1.3.1 Objectifs Objectif #1
L’objectif primaire de ce mémoire est de comparer, entre deux groupes (insuline ou HGO), la préférence du traitement et quatre composantes de la QDV (état de santé général, bien-être général, satisfaction quant au traitement du diabète, dépression post-natale) chez les femmes enceintes avec DG nécessitant un traitement pharmacologique hypoglycémiant suite à l’échec de la diète et de l’exercice.
Objectif #2
Comparer l’efficacité du traitement (insuline ou HGO) sur le contrôle glycémique.
Objectif #3
À titre exploratoire, comparer chez la mère les taux d’hypoglycémies inférieures à 3.3 mmol/L, de césariennes, de complications hypertensives et d’accouchements prématurés.
Objectif #4
À titre exploratoire, comparer chez les nouveau-nés, le poids de naissance, le taux de macrosomie, d’hypoglycémies inférieures à 2.6 mmol/L, de complications métaboliques, (hyperbilirubinémie, hypocalcémie et polycythémie), le nombre et la durée des séjours à
l’USIN, le taux de syndrome de détresse respiratoire, d’anomalies congénitales et de mortalité périnatale.
MATÉRIEL ET MÉTHODES
2.1 Dispositif de recherche
Il s’agit d’une étude pilote, expérimentale, prospective, randomisée et ouverte. Les volontaires ont été réparties au hasard dans le groupe expérimental ou témoin selon le traitement pharmacologique attribué, HGO (metformine ± glyburide, avec ajout d’insuline au besoin) ou insuline. Aucun groupe placebo n’a été inclus dans l’étude car il aurait été éthiquement inacceptable de laisser une participante avec DG sans traitement, surtout s’il est médicalement requis.
2.2 Population à l’étude
La population à l’étude est l’ensemble des femmes atteintes de DG de la population générale et nécessitant un traitement pharmacologique hypoglycémiant suite à l’échec de la diète et de l’exercice.
2.2.1 Critères d’inclusion
Femme enceinte, âge ≥ 18 ans, au moins 15 semaines de grossesse au moment du début du traitement pharmacologique (donc au-delà de la période d’embryogénèse); diagnostic de DG selon les critères de l’IADPSGpar HGOP-75g et/ou des glycémies capillaires (4/jour, pendant 7 jours) supérieures ou égales aux objectifs thérapeutiques de l’ACD (5.3 mmol/L à jeun et 6.7 mmol/L 2 h postprandiales) dans plus de 50% des cas pour la même période malgré la diète et l’exercice; aucune médication interférant avec le métabolisme du glucose; pouvant comprendre, parler, lire et écrire le français ou l’anglais; pouvant se déplacer pour les visites hebdomadaires à la Clinique d’endocrinologie de la grossesse du CHUS; avoir signé le formulaire de consentement.
2.2.2 Critères d’exclusion
Diabète préexistant, traitement actif par insuline ou HGO, allergie à l’un des composants du traitement, troubles hépatiques et hématologiques connus.


![Tableau 8: W-B12 - Changements intra-groupes et inter-groupes entre V1 et V2 Groupe HGO ¶ x̅ ± ET [95% IC] Groupe Insuline §x̅ ± ET [95% IC] Différence [95% IC] Inter-groupe p État affectif négatif](https://thumb-eu.123doks.com/thumbv2/123doknet/3013201.84629/67.918.157.809.795.960/tableau-changements-groupes-groupes-insuline-différence-affectif-négatif.webp)
![Tableau 10: EPDS Groupe HGO n=34 Groupe Insuline n=34 [95% IC] p x̅ ± ET EPDS 6.1 ± 3.9 4.9 ± 4.8 [-3.4 ; 0.9] 0.25 n (%) Suspicion de dépression PP Idées suicidaires 6 (17.6) 0 (0) 6 (17.6) 1 (2.9) [-0.2 ; 0.2] [-0.3 ; 0.9] 1.00 0.49 Tableau 11: Médicat](https://thumb-eu.123doks.com/thumbv2/123doknet/3013201.84629/68.918.139.795.690.999/tableau-groupe-insuline-suspicion-dépression-suicidaires-tableau-médicat.webp)