T
T
H
H
È
È
S
S
E
E
En vue de l’obtention duDOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l’Université Toulouse III – Paul Sabatier Discipline ou spécialité : Ecologie, biodiversité et évolution
_______________________________________
Présentée et soutenue par Franck JABOT Le 16 Novembre 2009
Marches aléatoires en forêt tropicale
Contribution à la théorie de la biodiversité
_______________________________________
JURY
Frédéric Austerlitz Chargé de recherche CNRS Rapporteur Jean-François Soussana Directeur de recherche INRA Rapporteur Jean-François Dhôte Chef département Recherche ONF Examinateur Sébastien Lavergne Chargé de recherche CNRS Examinateur Alain Pavé Professeur des Universités Examinateur
Jérôme Chave Directeur de recherche CNRS Directeur de thèse Christophe Thébaud Professeur des Universités Président du jury
________________________________________
Ecole doctorale : SEVABRemerciements
Les remerciements c'est mieux de vive voix, mais c'est une des parties les plus agréables dans la rédaction d'une thèse alors c’est parti !
Tout d’abord, merci à toi Jérôme pour avoir accepté d'encadrer ma thèse. Merci pour ta disponibilité, tes conseils et ton soutien. J’ai beaucoup appris à ton contact, tant scientifiquement qu’humainement. Merci pour tous ces moments partagés dans notre beau bureau bien rangé, c’est avec un picotement lacrymal que je m’apprête à le quitter, avant même que le hamac soit installé…
Merci aux membres du jury d’accepter d’examiner ma thèse. Merci à Frédéric Austerlitz et Jean-François Soussana, à qui incombe la lourde charge d’être rapporteurs, merci également à Jean-François Dhôte, Sébastien Lavergne et Alain Pavé, les examinateurs.
Merci à Christophe Thébaud, mon cher présidents (du jury et de la SFE). Ton éclairage et tes conseils ont considérablement enrichi ma réflexion tout au long de cette thèse, je t’en suis profondément reconnaissant.
Merci aux partenaires de footing de la première heure. Christophe tout d'abord, pour ton écoute, tes conseils et ton amitié sincère, c'est fou tout ce qu'on peut se raconter en courant ! Lounès pour tes blagues, toujours de bon goût. Sylvie et ta bonne humeur communicative.
Merci à Pierre-Jean bien sûr, pour les innombrables délires qui n'auraient pas eu lieu sans toi, les beer partys, les affiches beer party, les courses de la beer party, les cafés-réflexions beer party ! Ça aura été LEGEN... wait for it !
Merci aux aînées edbiennes : Natalia, Susana et Emmanuelle. Merci aux thésards edbiens, Mailyn et ta gentillesse constante, Juliane et ton humour décalé, Marion et ta félinité rare sur une piste de danse, Candida et ton étincelle de félicité, Elodie et ton atypisme rafraichissant, Charles pour ton charisme rayonnant, Aurélie, Chloé, Claire, Clément, Florent, Josselin, Juliette, Sarah et aussi Abel !
Merci aux assidus de la beer party, l'adorable Charlotte, le ténébreux Joris. Merci à Émilie pour ta jovialité et ... ton café ! Merci à Pierrick pour tes talents de chanteur et ta prose sulfureuse sur l'attractivité des deux sexes. Merci à Benoît, mon auditeur de recherche préféré ;-)
Merci aux membres de la confrérie des postdocs : Darin d'abord et tes cinq sens en alerte, Juli, Mario, le quasi-père Noël et Olivier le troussepinetteur !
Merci à Brigitte pour votre accueil et votre dévouement pour le bien commun. Merci à Philipp, Pascal et leurs mignonnes bactéries, à Emmanuelle C., message subliminal : l'ABC c'est ton avenir !!! Merci à Monique B. et tes conseils gastronomiques et à toutes les personnes du labo qui par leur disponibilité et leur bonne humeur font de ce laboratoire un endroit très agréable.
Merci à la bande du tennis, et pour faire transition à Jérémy, le membre honoraire du labo...Vince et la Nouille, Fralex, Benji, Lebowski, Ravi, Marion, Manue, Marielle, Greg, Miriam, Julien et Rémi. Vous allez tant me manquer.
Merci à ma famille pour m’avoir supporté avant et pendant ma thèse. Promis, je vais recommencer à parler d’autre chose ! Merci à ma petite Sarah, la plus adorable des filleules.
Enfin, merci à mes petits pains aux carrés de chocolat des milieux d’après-midi, et dans un autre registre, à ma ptite compote.
Résumé
Les forêts tropicales abritent une immense diversité d’arbres, y compris à de très petites échelles spatiales. Cette diversité défie l’idée selon laquelle, dans des conditions environnementales données, une espèce devrait être la mieux adaptée et exclure progressivement toutes les autres. Les écologues ont élaboré de nombreuses hypothèses pour expliquer le maintien d’une si grande diversité locale. Un facteur principal freine le test de ces hypothèses : l’absence de méthodes robustes permettant de relier les théories et connaissances sur la forêt tropicale aux données de terrain, afin de les comparer. Cette thèse vise donc à développer des tests plus puissants des hypothèses de coexistence d’espèces. Il y est mis en évidence l’impact des filtres environnementaux à l’échelle régionale, ainsi que locale sur la structure des communautés. Cela permet de rejeter, pour la première fois de manière rigoureuse, l’hypothèse de neutralité, qui vise à expliquer la coexistence locale d’espèces en supposant leur équivalence fonctionnelle. Cette observation nourrit le développement d’un nouveau modèle dynamique visant à décrire ce filtrage environnemental à partir de caractéristiques des espèces, comme leurs traits fonctionnels, et son application à des données de terrain y est discutée. Enfin, les liens évolutifs entre les espèces sont une information potentiellement riche sur leur manière de coexister. Dans cette optique, il est montré comment intégrer ces liens évolutifs dans le test de la théorie neutraliste de la biodiversité. Les modèles dynamiques étudiés au cours de cette thèse sont dénommés, en termes mathématiques, des marches aléatoires. Elles y sont analysées en grande partie grâce à une méthode statistique appelée Approximate Bayesian Computation, qui ouvre de nouvelles perspectives pour l’étude des modèles dynamiques en écologie.
Summary
Tropical forests contain a huge diversity of trees, even at small spatial scales. This diversity challenges the idea that, in given environmental conditions, one species should be better suited to this particular environment and progressively exclude all other species. Ecologists have proposed various hypotheses to explain diversity maintenance. One element prevents the test of these hypotheses: the lack of robust methods to link available theories and knowledge on tropical forests to field data, so as to compare different hypotheses. This thesis thus aims at developing more efficient tests of coexistence mechanisms. It is shown that environment filters tree communities at both the regional and local scales. This rejects, for the first time rigorously, the neutrality hypothesis, which aims at explaining species local coexistence in assuming their functional equivalence. This finding stimulates the development of a new dynamical model describing environmental filtering on the basis of species characteristics, such as functional traits. Applications to field data are discussed. Finally, evolutionary relationships among coexisting species contain potentially useful information on their ability to coexist. In this vein, it is shown how to integrate these evolutionary relationships in the test of the neutral theory of biodiversity. The dynamical models studied during this thesis are called, in mathematical terms, random walks. They have been mainly studied here thanks to a statistical technique called Approximate Bayesian Computation, which opens new perspectives for the study of dynamical models in ecology.
Préambule – Les grands motifs dans la diversité
forestière tropicale
Tout d'abord, quelques chiffres : les forêts tropicales humides couvrent 625 millions d'hectares, dont 45% en Amérique du Sud et Amérique Centrale, 30% en Afrique, 16% en Asie et 9% en Océanie1. Le terme plus général de « forêt tropicale » recouvre une réalité multiple, qui va des forêts sèches et décidues aux forêts de nuage d'altitude. Elles ont pour point commun, au-delà de leur caractéristique géographique, de contenir une énorme diversité biologique. Ainsi, un hectare de forêt en Guyane Française peut contenir plus d'espèces d'arbres (de 100 à 200) que toute la métropole (en guise de comparaison l'Inventaire Forestier National inventorie 43 espèces de feuillus et 27 espèces de conifères en métropole2). A l'heure actuelle, un peu moins de 1% des forêts primaires (ie. peu impactées par l'action de l'homme) sont détruites chaque année, principalement pour être converties en surface agricole. A ce rythme, il ne subsistera donc plus que quelques réserves fragmentées d'ici la fin du siècle. Les conséquences de cette destruction massive sont nombreuses. On peut citer la perte de biodiversité, l'érosion des sols qui peut mener en quelques années à leur quasi-stérilisation, et la plus que probable perturbation du climat à l'échelle régionale et mondiale. Le fonctionnement des forêts tropicales, tant du point de vue des dynamiques biologiques que des cycles biogéochimiques, est encore assez mal connu. Cependant, les conséquences immédiates de la déforestation sont suffisamment documentées et les risques à plus long terme suffisamment plausibles pour justifier une action forte et immédiate pour protéger ce biome, sans qu'il n'y ait besoin de mieux documenter son fonctionnement. L'étude du fonctionnement des forêts tropicales peut néanmoins permettre d'améliorer les stratégies de préservation de la biodiversité forestière et d'améliorer les prédictions des dynamiques forestières lors du prochain siècle.
Les compositions floristiques des forêts tropicales varient en fonction de l'altitude, du climat, du type de sol et de leur hydromorphie (Richards et al. 1996, Puig 2001). Les forêts plus arrosées ont généralement plus d'espèces comparées aux forêts plus sèches (Gentry 1988, ter Steege et al. 2003), du moins en Amérique du Sud (Parmentier et al. 2007). Certains types de sols très pauvres en nutriments et très drainés, comme les sables blancs, présentent des diversités plus faibles et une flore originale. La composition floristique des forêts tropicales est corrélée à l'environnement. Ainsi, deux parcelles présentant des climats et/ou topographies
1 Source : http://rainforests.mongabay.com/
similaires tendront à avoir des compositions floristiques proches (eg. Sabatier et al. 1997, Plotkin et al. 2000, Harms et al. 2001, Valencia et al. 2004). Par ailleurs, la répartition spatiale des espèces est agrégée, i.e. les individus appartenant à une même espèce ont tendance à être proches les uns des autres (Hubbell 1979, Condit et al. 2000). Cela peut être dû à un effet environnemental (présence d'un habitat favorable à une espèce), mais aussi à un effet de dispersion limitée : les graines d'un arbre tombent principalement à ses pieds et une faible fraction est dispersée à plus longue distance (Clark et al. 1999, Wright et al. 2005). A plus large échelle, les changements floristiques sont pour une part graduel, ce qui peut s'expliquer par la dispersion limitée des espèces (Condit et al. 2002), et pour une autre part abrupt, le long de forts gradients environnementaux (comme la richesse des sols près de la frontière Perou-Equateur cf Pitman et al. 2008).
Nos connaissances sur la diversité tropicale sont fondées sur deux types principaux de données : d'une part, des inventaires de parcelles de 1 ou quelques hectares et d'autre part des données d'herbiers qui permettent de connaître la présence d'une espèce à un point donné, sans caractérisation exhaustive de la communauté forestière qui l'entoure. L'immense majorité des espèces étant rares, il est difficile d'avoir une idée claire de la manière dont la diversité est structurée dans l'espace, hors mis pour les espèces abondantes (eg. Pitman et al. 2001, Condit et al. 2002, Pitman et al. 2008). Il existe pourtant une quantité non négligeable de données floristiques accumulées depuis le siècle dernier, qui contiennent potentiellement une information plus riche que ces quelques descriptions de tendance. L'analyse statistique de ces motifs pour comprendre le fonctionnement des communautés écologiques est une question de recherche relativement récente, qui a connu un développement conséquent au cours de la dernière décennie. Si la seule analyse de motifs a peu de chance de mettre en évidence des mécanismes écologiques précis, elle permet de faire un premier tri et d'aller vers une meilleure compréhension des systèmes écologiques (Levin 1992).
Une question centrale de l'écologie des communautés concerne la coexistence des espèces. Le principe d'exclusion compétitive prédit que dans un environnement donné constant, une espèce est meilleure compétitrice que toutes les autres et finira par les exclure toutes par compétition (Gause 1934). Ainsi, pour observer des espèces en coexistence, il faut invoquer l'action d'autres mécanismes qui contrebalancent la compétition entre espèces. De nombreuses théories visant à expliquer la coexistence d'un si grand nombre d'espèces en forêt tropicale ont été proposées (Wright 2002, cf introduction). Il est plus difficile cependant de déterminer lesquels de ces mécanismes postulés sont vraiment importants et dans quelles proportions. Le développement de nouvelles méthodes d'analyse des données floristiques est
donc potentiellement une source d'avancées importantes (McGill et al. 2007). La philosophie de cette thèse est d'aller du plus simple vers le compliqué, dans le but de déterminer quel type de données permet de répondre à quel type de question. Ainsi, un objet central de ma thèse est l'étude du modèle neutraliste de Hubbell (1997, 2001) qui postule que toutes les espèces sont fonctionnellement équivalentes et que la composition d'une communauté écologique est due au hasard et à la dispersion limitée. Cette théorie peut paraître à première vue complètement stupide : les arbres d'espèces différentes ne se ressemblent pas (tous) et ne se trouvent pas aux mêmes endroits. On verra cependant que cette théorie présente un intérêt scientifique considérable (Bell 2000, 2003), comparable à celui de la théorie neutraliste en génétique des populations (Leigh 2007).
Plan de la thèse
Dans l'introduction, nous partirons de la diversité phénotypique observable des arbres et montrerons qu'un examen plus fin révèle que cette formidable diversité des formes n'implique pas automatiquement une aussi grande diversité en terme de compétitivité des espèces en un lieu donné de forêt. Puis nous résumerons les théories sur les interactions entre les arbres et leur environnement abiotique et biotique et leurs influences sur la structuration des communautés. Enfin, la diversité actuelle provient de la diversification progressive de la flore tropicale, nous exposerons en quoi la prise en compte de cette dimension évolutive est une source d'information pour la compréhension des communautés contemporaines.
Dans le premier chapitre, nous explorerons dans quelle mesure les abondances relatives des espèces d'arbres indiquent l'action d'un filtrage par l'environnement pour sélectionner les espèces les mieux adaptées aux conditions locales. Deux méthodes développées au cours de cette thèse seront présentées. La première vise à étudier les différences floristiques dans un réseau de parcelles. La seconde vise à étudier la composition floristique locale, dans une parcelle unique. Ces deux travaux sont développés dans les manuscrits 1 et 2.
Dans le second chapitre, nous étudierons s'il est possible d'aller plus loin dans la description du filtrage exercé par l'environnement. Nous développerons à cet effet un nouveau modèle théorique où la compétitivité d'une espèce dépend de la valeur d'une de ses caractéristiques fonctionnelles, couramment appelées traits fonctionnels dans la littérature écologique. Le but ici n'est pas juste de mettre en évidence l’effet du filtrage par l'environnement et de le relier à des caractéristiques démographiques de la communauté, mais
d'identifier quelles propriétés des espèces leur confèrent localement un avantage compétitif qui expliquerait leur abondance. Ce travail est développé dans le manuscrit 3.
Dans le troisième chapitre, nous porterons notre attention sur les liens phylogénétiques entre les espèces d'une communauté. Un ensemble d'études au cours de la dernière décennie ont visé à analyser la structure phylogénétique des espèces qui coexistent dans les communautés (Vamosi et al. 2009). A ce jour, ces études ne sont pas reliées à des modèles explicitant comment différents mécanismes écologiques impactent la dynamique phylogénétique des communautés. Nous poserons les bases d'une telle approche en développant une méthode d'estimation des paramètres du modèle neutre de Hubbell à partir de la structure d'abondances et de la forme de l'arbre phylogénétique sous-tendant la communauté locale. Nous discuterons en quoi cette méthode ouvre la voie à une étude plus robuste des structures phylogénétiques des communautés. Ce travail est développé dans le manuscrit 4. Nous discuterons ensuite de manière plus large les limitations des études actuelles de la structure phylogénétique des communautés et évoquerons quelques pistes pour rebondir.
Lors de la discussion générale, nous discuterons les limites et perspectives des travaux menés au cours de cette thèse. Ce sera l'occasion de présenter brièvement l'intérêt très général des méthodes statistiques utilisées pendant cette thèse. Une synthèse sur ces méthodes sera développée dans le manuscrit 5.
Table des matières
Remerciements ... i
Résumé ... ii
Préambule – Les grands motifs dans la diversité forestière tropicale ... 1
Table des matières ... 5
Introduction – Fonctionnement d’un arbre, dynamique des communautés et évolution de la diversité ... 7
Partie 1 – Bases anatomiques et fonctionnelles d’un arbre et mesure de la diversité phénotypique associée... 8
1-Une analogie économique et la notion de stratégie écologique ... 8
2-La photosynthèse ... 9
3-Le captage des ressources et le transport des sèves ... 10
4-La résistance mécanique et biotique ... 14
5-Le cycle de vie d’un arbre... 15
6-Caractérisation fonctionnelle par la mesure des traits ... 16
7-La mesure des traits chez un arbre ... 17
8-Les axes de stratégie des plantes... 18
9-La différence entre stratégie fonctionnelle et niche écologique d’un individu... 19
Partie 2 – L’arbre dans son environnement et les mécanismes structurant la biodiversité forestière... 23
1-Les grands axes de stress/compétition chez les arbres... 23
2-Les facteurs de stress ... 23
3-La variabilité temporelle de l’environnement... 26
4-La dispersion limitée... 27
5-Conséquences en terme de dynamique des populations/communautés ... 27
6-Théorie neutraliste de la biodiversité ... 28
Partie 3 – L’évolution de la diversité et la mesure de la diversité phylogénétique... 31
1-L’origine de la diversité : de la mutation génétique à la diversité phylogénétique ... 31
2-Quelques éléments de biogéographie des forêts tropicales... 36
3-Le cas des forêts Néotropicales... 41
4-La diversification phénotypique et fonctionnelle ... 41
5-La diversification des niches écologiques... 44
Chapitre 1 – L’assemblage des communautés forestières tropicales : neutralité ou filtrage environnemental ? ... 49
1-Logique de l’étude de l’association entre composition floristique et environnement ... 50
2-Théorie neutraliste : estimation de paramètres et interprétation. Le filtrage environnemental à l’échelle régionale – manuscrit 1... 53
3-Théorie neutraliste : comparaison de modèles de biodiversité. Le filtrage environnemental à l’échelle locale – manuscrit 2 ... 59
Chapitre 2 – Peut-on caractériser le filtrage environnemental ? ... 65
1-De la classification des espèces à la notion d’axes de stratégies écologiques ... 66
2-Utilisation statistique des traits pour tester la présence de certains mécanismes de coexistence d’espèces... 67
3-Utilisation des traits dans un modèle de dynamique des communautés ... 67
Chapitre 3 – Rôle de l’histoire évolutive et biogéographique dans la structure de la
biodiversité ... 73
1-Modèle neutre, pool régional et phylogénie ... 74
2-Utiliser la topologie d’une phylogénie d’espèces en coexistence pour inférer la diversité régionale sous l’hypothèse de neutralité ... 75
3-Modèles de spéciation, biogéographie et origine de la diversité tropicale ... 77
4-Structure phylogénétique des communautés et tests de modèles de coexistence ... 81
Conclusion... 85
1-Bilan général ... 86
2-Limites de la modélisation des communautés et perspectives... 89
Bibliographie ... 91 Glossaire... 105 Manuscrits ... 109 Manuscrit 1... 111 Manuscrit 2... 127 Manuscrit 3... 161 Manuscrit 4... 207 Manuscrit 5... 231
Introduction –
Fonctionnement d’un arbre, dynamique des
communautés et évolution de la diversité
Il s'agit ici de donner au lecteur non spécialiste les bases pour la compréhension des enjeux et questions de ma thèse. Cette introduction est structurée en trois parties. Tout d'abord, nous rappellerons brièvement les grands mécanismes de fonctionnement d'un arbre en forêt tropicale. Cela permettra de comprendre en quoi les mesures couramment effectuées par les écologues sur ces arbres peuvent renseigner sur les stratégies écologiques de ces arbres. Puis nous verrons comment les interactions entre les arbres et leur environnement abiotique (pluviométrie, température, sol...) et biotique (autres arbres, herbivores, pathogènes, pollinisateurs, disperseurs...) peuvent influencer la structure des communautés forestières. Enfin, la diversité que l'on observe actuellement provient d'une diversification des espèces au cours des temps géologiques. Nous verrons en quoi la prise en compte de cette dimension évolutive dans l’étude de la diversité forestière peut apporter quelque chose à notre compréhension de la structure de cette biodiversité.
Introduction – Partie 1
Partie 1 – Bases anatomiques et fonctionnelles d’un arbre et
mesure de la diversité phénotypique associée
Idéalement, pour comprendre la réponse d'un arbre à différentes conditions environnementales, des expériences en conditions contrôlées sont souhaitables. Cela a été entrepris dans quelques rares cas en forêt tropicale, souvent sur un nombre limité d'espèces d'arbres. Mais une telle approche est lourde à mettre en œuvre et permet de caractériser les réponses de quelques espèces à un facteur environnemental isolé comme la sécheresse (Engelbrecht et al. 2007, Poorter et Markesteijn 2008) voire à un petit nombre de facteurs en interaction. De plus, cette approche est limitée aux premiers stades de la vie de l'arbre en raison de leur grande longévité. Par ailleurs, mesurer la réponse isolée d'un arbre à différentes conditions environnementales ne permet pas d'obtenir des informations sur la manière dont plusieurs arbres vont interagir, une composante potentiellement importante de la dynamique des communautés (ce que suggère l'étude de Wiegand et al. 2007).
Une approche alternative consiste à mesurer des caractéristiques phénotypiques des arbres, couramment appelés traits, directement sur le terrain (Cornelissen et al. 2003), dans l'espoir que ces traits « doux » contiendront une information suffisante pour comprendre les caractéristiques fonctionnelles (ou traits « durs ») des espèces, comme leur tolérance à l'ombre ou à la sécheresse (Lavorel et Garnier 2002). Par ailleurs ces traits pourraient contenir de l'information sur la façon dont différentes espèces interagissent (Stubbs et Wilson 2004).
Nous rappelons ici les grands principes du fonctionnement d'un arbre afin de comprendre les approches utilisées par les écologues pour appréhender la diversité fonctionnelle des arbres tropicaux via la mesure de certains traits. Pour une description détaillée de la physiologie des plantes, le lecteur peut consulter Raven et al. (2000) et Marschner (2008), et, pour une perspective plus écologique et synthétique sur les arbres tropicaux, Turner (2001).
1-Une analogie économique et la notion de stratégie écologique
Un arbre peut être vu comme une usine qui réalise un certain nombre de fonctions. Il doit puiser de l'eau et des nutriments via ses racines et les transporter vers les feuilles, où il capte le CO2 atmosphérique et le transforme en glucose grâce à l'énergie lumineuse qu'il
intercepte. Il utilise une part des ressources ainsi acquises pour survivre (ie réaliser son métabolisme de base) et investit le reste de ses ressources dans sa croissance et dans sa
Introduction – Partie 1
reproduction. Le terme de fonction est assez vague dans la littérature écologique. Ainsi, il peut faire référence soit à une machinerie de l'arbre, comme l'interception de la lumière soit à une caractéristique plus intégrée de l'arbre comme son degré d'adaptation à l'ombrage. Par conséquent le terme de stratégie fonctionnelle, c'est à dire la manière dont l'arbre réalise une fonction, peut lui aussi faire référence à différents niveaux d'intégration (eg. efficience d'utilisation de l'eau versus résistance à la sécheresse). Comme pour une usine, la survie et le développement à court, moyen et long terme d'un arbre dépendent des caractéristiques des différentes machineries de l'arbre et de sa stratégie en terme d'investissements. De même, les différents arbitrages effectués par l'arbre ont des coûts et bénéfices à différentes échelles de temps, qui dépendent de l'environnement naturel dans lequel l'arbre est installé (Bloom et al. 1985, Givnish 1986). Westoby et al. (2002) définissent le terme de stratégie écologique d'une plante comme la manière dont elle assure son gain en carbone pendant sa croissance et la transmission de ses gènes. Cette stratégie globale d'une plante peut se décliner en différents axes, potentiellement interdépendants (cf section 9). Un pré-requis pour appréhender les variations de stratégie parmi les arbres est donc de décrire les grands principes de leur fonctionnement. Le lecteur non intéressé peut se rendre directement à la section 6.
2-La photosynthèse
Une feuille est constituée de différentes couches : la cuticule, l'épiderme et le mésophylle, lui-même divisé en deux couches : le parenchyme pallissadique, aux cellules serrées et riches en chloroplastes et le mésophylle spongieux où les cellules sont baignées dans un réseau de lacunes (Fig. 1). La cuticule et l'épiderme de la face inférieure de la feuille présentent des ouvertures, les stomates, par où s'effectuent les échanges gazeux entre l'air et la feuille. C'est dans les cellules du parenchyme pallissadique qu'ont lieu les réactions de photosynthèse qui consistent à transformer CO2 et eau en glucose et oxygène.
L'efficacité de la photosynthèse augmente avec la capacité à capter la lumière, c'est à dire avec la densité surfacique des usines à photosynthèse. Cette densité dépend du nombre de chloroplastes, de leur contenu en chlorophylle et protéines catalysant la photosynthèse, notamment la Rubisco et de l'adéquation entre la proportion de ces différentes molécules et la stœchiométrie des réactions photosynthétiques (Warren et Adams 2004). Par ailleurs, l'efficacité de la photosynthèse dépend aussi de l'efficacité de la conduction du CO2 depuis
Introduction – Partie 1
stomatique et de la conductance interne de la feuille. La conductance stomatique est liée à la densité de stomates et à leur ouverture. La conductance interne de la feuille est, elle, en partie influencée par l'épaisseur des membranes cellulaires (Warren et Adams 2004). Enfin, l'ouverture stomatique augmente la perte d'eau des plantes par transpiration. Elle peut donc être d'autant plus grande, que la conductance hydraulique de l'arbre est importante (Sack et al. 2005). Cette conductance hydraulique de l'arbre dépend des résistances hydrauliques de chaque partie du réseau vasculaire dont la résistance foliaire qui compte pour au moins 30% de la résistance hydraulique totale. La résistance hydraulique foliaire dépend de l'architecture des veines dans la feuille et des propriétés membranaires des cellules notamment leur contenu en pores cellulaires permettant le passage de l'eau (Sack et Holbrook 2006, Cochard et al. 2007). Une même efficacité photosynthétique peut donc être réalisée de multiples façons dans une feuille, puisqu'elle dépend de plusieurs caractéristiques de l'arbre.
Fig. 1 : Schéma de l'anatomie d'une feuille3.
3-Le captage des ressources et le transport des sèves
L'eau (et les nutriments du sol) circule dans l'arbre depuis les racines vers les feuilles en passant par un ensemble vasculaire constitué des vaisseaux racinaires, des vaisseaux du tronc et des branches et des vaisseaux foliaires4. Ce faisant, l'eau doit contrebalancer les forces de gravité au cours de son ascension dans l'arbre. La théorie la plus consensuelle à ce jour pour expliquer cette montée de la sève brute s'appelle la théorie de la cohésion-tension
3 Source : wikipedia
4 Plus précisément, les gymnospermes conduisent l'eau dans des trachéides, alors que le xylème des angiospermes est composé d'un mélange de vaisseaux, de trachéides et de parenchyme de réserve. Nous appellerons ici indifféremment vaisseau tout élément conducteur de sève.
Introduction – Partie 1
(Dixon et Joly 1895, Raven et al. 2000, Tyree 2003, mais voir Zimmermann et al. 2004). Selon cette théorie, c'est l'évaporation de l'eau dans les feuilles qui constitue le moteur de cette circulation de l'eau depuis le sol vers le sommet de l'arbre. L'eau s'évapore dans les lacunes du mésophylle des feuilles et diminue le potentiel hydrique des cellules foliaires. Ce déficit en eau est comblé par le déplacement de l'eau depuis les cellules voisines. Le déficit hydrique se propage ainsi de cellule en cellule jusqu'à atteindre le réseau vasculaire foliaire où l'eau est aspirée. La tension produite par cette succion (vers le haut) et par le poids de la colonne d'eau (vers le bas) est contrebalancée par la cohésion des molécules d'eau (due aux forces de Van der Waals). La cohésion de la colonne d'eau dans les conduits du xylème peut être subitement rompue par la formation de bulles de gaz, c'est le phénomène de cavitation ou embolie (Fig. 2). Au-delà de 10m de hauteur, la pression de la sève est négative (ce qui équivaut à une tension si la colonne d'eau est vue comme un solide), la cavitation devrait donc se produire. Le maintien de la colonne d'eau à de telles pressions négatives implique que l'eau est dans un état métastable. C'est cette métastabilité de l'eau qui est au cœur de la récente controverse autour de la théorie de la cohésion-tension (Zimmermann et al. 2004).
Fig. 2 : Schéma pression-température de l'état physique de l'eau et phénomène de cavitation5.
La présence d'une bulle de gaz dans un vaisseau bloque la conduction de la sève dans ce vaisseau, jusqu'à la réparation de l'embolie, un phénomène encore mal compris (Sperry et al. 2003). La communication latérale entre vaisseaux via les ponctuations aréolées permet à la sève de trouver dans ce cas un chemin alternatif (Fig. 3). Par ailleurs, la bulle de gaz formée dans un vaisseau obstrué ne se propage généralement pas dans les vaisseaux contigus du fait
5 Source : wikipedia
Introduction – Partie 1
de la formation d'un ménisque au niveau des ponctuations aréolées qui bloque le passage de l'air. Cependant, si la différence de pression entre les deux faces de la ponctuation dépasse la tension superficielle du ménisque, la bulle de gaz peut traverser la membrane et l'embolie se propage.
Fig. 3 : Schéma de vaisseaux conducteurs de sèves6.
L'efficience du transport de l'eau dans le xylème dépend tout d'abord des dimensions des vaisseaux. Dans le cas idéal d'un cylindre à écoulement laminaire, la loi de Hagen-Poiseuille stipule que cette conductance est proportionnelle au diamètre à la puissance 4. Ainsi, un gros vaisseau a une meilleure conductance qu'un ensemble de petits vaisseaux formant une surface identique. Mais la conductance est également influencée par la structure des membranes de perforation à travers lesquelles l'eau passe d'un vaisseau à l'autre lors de son ascension. Ces membranes représentent de l'ordre de 50 % de la résistance hydraulique du xylème (Choat et al. 2008).
Le xylème doit également résister à des contraintes mécaniques très importantes lors des périodes de stress hydrique. La diminution de pression de l'eau dans les vaisseaux entraîne
Introduction – Partie 1
une compression des vaisseaux qui diminue fortement leur conductance (eg. Cochard et al. 2004). L'épaisseur des parois des vaisseaux contribue à leur résistance mécanique au stress hydrique et semble être un facteur important dans la résistance à la cavitation chez les arbres (Hacke et al. 2001). Par ailleurs, la structure des membranes de ponctuation (pits sur la Fig. 3) permet d’éviter la propagation des embolies lors de phénomènes de cavitation. Ainsi, les différents éléments de la structure du xylème ont un rôle dans la résistance au stress hydrique des arbres.
Enfin, la proportion d'éléments non conducteurs de sève est très variable d'une espèce à l'autre (Gartner et al. 2004), ce qui explique une faible corrélation entre la densité de bois, et l'efficience hydraulique et la résistance au stress hydrique des arbres (Westoby et Wright 2006, Chave et al. 2009). Ces éléments non conducteurs influencent également la capacitance du bois, c'est à dire sa faculté à stocker de l'eau dans ses tiges. Cette capacitance est d'autant plus importante que la densité des tissus non conducteurs est faible, ce qui permet de supporter des niveaux de transpiration plus importants que ne le permettrait la seule conductance hydraulique de l'arbre (Gartner et Meinzer 2005).
L'eau évaporée dans les feuilles est remplacée par l'eau puisée dans le sol au niveau des racines. L'eau rentre depuis le sol dans la racine si le potentiel hydrique des racines est plus faible que celui du sol. Ce potentiel dépend de la concentration de solutés dans l'eau des tissus racinaires. Plus celle-ci est grande, plus le potentiel hydrique des racines est faible et le captage d'eau important. A l'inverse, plus le sol est sec, plus son potentiel hydrique est faible et moins le transfert d'eau du sol vers les racines est important.
Le captage des sels minéraux du sol requiert lui de l'énergie. Il est en partie réalisé par les réseaux mycorhiziens qui colonisent les racines. Ces mycorhizes accroissent considérablement la surface d’échange, le volume du sol exploré et le captage de certains éléments, notamment le phosphore. Récemment, il a été montré que les mycorhizes jouaient également un rôle important pour l'absorption de l'eau (eg. Kyllo et al. 2003).
Un certain nombre de caractéristiques des racines peuvent influencer leurs propriétés de captage des ressources. La longueur spécifique des racines (égale à la longueur des racines divisée par leur masse) est positivement corrélée au taux d'absorption des ressources, au taux d'élongation des racines, mais est négativement corrélée à la résistance au stress hydrique et à l'efficience du transport racinaire de l'eau (Cornelissen et al. 2003). D'autres caractéristiques comme la distribution des profondeurs des racines ou la présence de nodules ou mycorhizes renseignent sur la stratégie de captage des ressources par les racines (Cornelissen et al. 2003). Cependant, la collecte d'information sur les racines des arbres tropicaux est extrêmement rare
Introduction – Partie 1
(Turner 2001), si bien que les variations de stratégies écologiques associées aux racines sont dans une grande mesure encore inconnues (mais voir Coomes et Grubb 2000).
Pour survivre, une plante a besoin de 17 éléments (Marschner 2008). Mais les principaux éléments limitant la croissance d'une plante sont, en dehors du carbone de la photosynthèse, l'azote et le phosphore (Chapin 1980). L'azote entre dans la constitution des nucléotides, des lipides membranaires et des acides aminés. Dans la feuille, 50 % de l'azote se situe dans les protéines photosynthétiques (Hikosaka et Terashima 1996), la concentration foliaire en azote est donc un bon indicateur (mais pas le seul) de la capacité photosynthétique maximale dans la feuille (Reich et al. 1998).
En forêt tropicale, le phosphore est considéré comme l'élément réellement limitant (Vitousek 1984, Coomes et Grubb 2000), excepté sur certains sols particulièrement pauvre en azote comme les caatingas (Coomes et Grubb 2000). Il a été proposé qu'un organisme à croissance rapide a une part plus élevée d'acides ribonucléiques (RNA) comparée à la part des protéines, afin de supporter une synthèse rapide de protéines. Les molécules de RNA étant plus riches en phosphore, comparées aux protéines riches en azote, il en découle qu'un organisme en croissance rapide devrait avoir un ratio phosphore/azote plus élevé (Elser et al. 1996). Cette idée a été rejetée récemment par l'étude de Matzek et Vitousek (2009).
4-La résistance mécanique et biotique
Un arbre doit également faire face à des contraintes mécaniques, notamment pour supporter le poids de sa canopée (Fournier et al. 1991) et résister au déracinement que la chute d'autres arbres ou le vent peuvent produire. Par ailleurs, il doit faire face à un certain nombre d'ennemis naturels que sont les herbivores et les parasites.
La plus grande densité du bois de cœur ou duramen, confère à l'arbre une meilleure résistance mécanique (Van Gelder et al. 2006, Chave et al. 2009). Et sa teneur en divers composés chimiques semble avoir un effet sur sa durabilité, mais les études à ce sujet sont fragmentaires (Chave et al. 2009).
Les taux d'herbivorie sont élevés dans les forêts tropicales, principalement du fait des insectes (Coley and Barone 1996). Les pathogènes sont également une forte cause de dommages aux feuilles (Coley and Barone 1996). Les feuilles jeunes sont les plus touchées, car elles ont une plus grande concentration en protéine que les feuilles matures. La perte de feuille a un fort coût pour la plante (eg. Marquis 1984). Ce coût peut lui être fatale, particulièrement pendant les premiers stades de développement. Les moyens de défense sont variés dans les feuilles, ils incluent les fibres (dureté accrue), les poils, l'inclusion de cristaux,
Introduction – Partie 1
la présence de gommes, de latex ou de résine, les composés chimiques volatiles ou non, ou encore les associations avec d’autres organismes, comme les fourmis (Turner 2001).
5-Le cycle de vie d’un arbre
Les arbres présentent une caractéristique importante : ils produisent des millions de graines, dont une infime partie donnera naissance à un arbre atteignant une maturité reproductive (Petit et Hampe 2006).
5-a-reproduction/dispersion/germination
S'il est généralement admis que la quantité de ressources qu'un arbre peut investir dans sa reproduction est corrélée à ses gains nets de ressources par photosynthèse (Harper et White 1974, Givnish 1988), la façon dont il investit ces ressources, elle, est très variable. La première source de variation est la taille des graines. Cette variation est colossale, elle s'étend sur plus de 11 ordres de grandeur (Moles et al. 2005). Pour une même quantité de ressources investies dans la reproduction, il y aura d'autant moins de graines qu'elles seront grosses. Produire un grand nombre de petites graines peut permettre de coloniser un grand nombre de sites. Mais les grosses graines ont plus de réserves pour démarrer leur premier stade de vie. Ce compromis sur la taille et le nombre des graines est l'un des exemples de ce que les écologues appellent le trade-off compétition – colonisation (Calcagno et al. 2006, Turnbull et al. 2008).
La seconde source de variation est la fréquence de la reproduction. Certaines espèces se reproduisent régulièrement alors que d'autres se reproduisent en masse irrégulièrement (mast fruiting). Si les évènements de fructification de masse sont généralement associés aux forêts tempérées (les glandées du chêne) ou aux forêts tropicale d'Asie du Sud-Est (notamment dans la famille des diptérocarpacées), des données récentes laissent penser que c'est un phénomène également important en Amazonie (Norden et al. 2007).
La troisième source de variation concerne le fruit lui-même. En forêt tropicale, une part très importante de la dispersion est assurée par les animaux (Turner 2001). Les types d'animaux attirés par les fruits des arbres est donc susceptible d'influer sur la dispersion des graines (Seidler et Plotkin 2006).
5-b-croissance et architecture d'un arbre
La croissance des arbres est régulée par un système hormonal complexe (Raven et al. 2000). On distingue deux types de croissance : la croissance primaire (croissance en hauteur du tronc, des branches et des racines) au niveau des méristèmes apicaux et la croissance secondaire (croissance en largeur) au niveau des méristèmes latéraux : le cambium qui produit
Introduction – Partie 1
les nouveaux vaisseaux du xylème, et du phloème et le phellogène qui produit le périderme qui les entoure. L'intensité de la croissance a un impact sur l'accès futur de l'arbre à la lumière, mais aussi sur l'énergie disponible pouvant être investie dans la reproduction. Une même quantité de croissance peut être répartie différemment entre la croissance en hauteur, en diamètre, dans la construction de nouvelles branches ou dans la croissance racinaire. Les arbitrages entre ces différents compartiments participe à la stratégie architecturale de l'arbre (Hallé et Oldeman 1970 cité dans Turner 2001) qui a un impact sur son acquisition de lumière, d'eau et de nutriments, mais aussi sur ses propriétés mécaniques globales. Hallé et al. (1978 cité dans Chave 1999) ont ainsi proposé une série de 23 modèles architecturaux pour classifier les différents types d'architecture rencontrée. Il n'y a pas de lien simple entre modèle architectural et stratégie écologique, deux arbres ayant des modèles architecturaux différents pouvant se ressembler plus que deux arbres suivant le même modèle. Le recours à des modélisations plus détaillées de l'architecture des arbres permet de mieux comprendre l'impact de cette architecture sur des caractéristiques fonctionnelles de l'arbre comme l'efficience de capture de la lumière (Pearcy et Yang 1996, Valladares et al. 2002, Pearcy et al. 2004). Enfin, une même « quantité volumique » de croissance peut avoir un coût énergétique variable selon la composition des tissus produits, notamment la densité du bois et la surface spécifique des feuilles (SLA).
5-c-mortalité
La première cause de mortalité des arbres est mécanique : presque la moitié des arbres meurent cassés par la chute d'arbres voisins ou du fait de leur propre déracinement (Van der Meer et al. 1994 cité dans Chave 1999, Van der Meer et Bongers 1996). Le reste de la mortalité des arbres s'explique du fait d'un ensoleillement, d'un apport d'eau ou d'un apport de nutriments insuffisants. Certains auteurs ont cherché à corréler les taux de mortalité de quelques espèces à leurs propriétés mécaniques (eg. Chao et al. 2008). Il semble que les arbres à faible densité de bois et à croissance lente ont une plus grande probabilité de mourir que les autres.
6-Caractérisation fonctionnelle par la mesure des traits
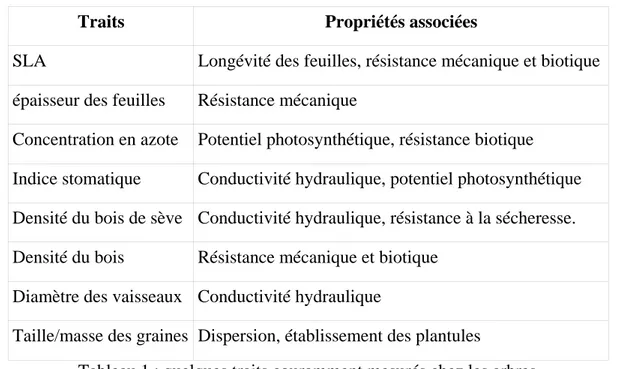
Pour comprendre l'efficacité avec laquelle un arbre réalise ses différentes fonctions et ses stratégies d'allocation des ressources, les écologues mesurent un certain nombre de caractéristiques des arbres, couramment appelées traits. Ces traits peuvent être des mesures morphologiques, comme la taille des vaisseaux conducteurs de sève, ou chimiques, comme la concentration en azote des feuilles (cf Tableau 1 pour quelques exemples de traits
Introduction – Partie 1
mesurés chez les arbres et Cornelissen et al. 2003 pour une liste plus exhaustive). Ces mesures sont généralement effectuées à un niveau « macroscopiques », c'est à dire au niveau d'un organe dans sa totalité comme une feuille ou une racine. Ces traits sont mesurés dans l'espoir d'identifier ceux qui soient de bons indicateurs de la stratégie écologique globale de la plante (Grime et al. 1997, Lavorel et Garnier 2002). En Guyane Française, une base de données des traits fonctionnels des arbres a été mise en place (Mariwenn, Ollivier et al. 2007). Elle est encore incomplète, mais continue à être alimentée.
Traits Propriétés associées
SLA Longévité des feuilles, résistance mécanique et biotique
épaisseur des feuilles Résistance mécanique
Concentration en azote Potentiel photosynthétique, résistance biotique
Indice stomatique Conductivité hydraulique, potentiel photosynthétique
Densité du bois de sève Conductivité hydraulique, résistance à la sécheresse.
Densité du bois Résistance mécanique et biotique
Diamètre des vaisseaux Conductivité hydraulique
Taille/masse des graines Dispersion, établissement des plantules
Tableau 1 : quelques traits couramment mesurés chez les arbres
7-La mesure des traits chez un arbre
La plupart des traits fonctionnels d'un arbre présentent une plasticité phénotypique importante. Par exemple, la masse surfacique d'une feuille peut varier du simple au double dans un même arbre, selon l'âge, la hauteur et l'ensoleillement de cette feuille (Poorter et al. 2009). Cela soulève trois problèmes pratiques. Le premier est de savoir s'il est pertinent d'attribuer à un arbre une unique valeur pour un trait au lieu de caractériser la distribution des valeurs de ce trait dans l'arbre et au cours de son ontogénie. Le second problème, supposant que le premier est résolu, est de savoir comment standardiser les mesures d'un trait pour qu'elles soient comparables d'un arbre à l'autre. Le troisième problème est de savoir à quel(s) stade(s) de développement un trait fonctionnel doit être mesuré.
Introduction – Partie 1
Le premier problème a reçu à ma connaissance assez peu d'attention de la part des écologues tropicaux. Certaines études ont étudié les variations de traits foliaires au sein d'une canopée (eg. Ellsworth et Reich 1993, Le Roux et al. 1999, Sinoquet et al. 2001), ou les variations de la taille des vaisseaux avec la hauteur (Weitz et al. 2006). Mais les études faites sur des communautés diversifiées d'arbres tropicaux ont ignoré ce soucis (eg. Kraft et al. 2008), un choix pragmatique lié à des contraintes budgétaires et en moyens humains. Une deuxième raison probable est que les cadres conceptuels pour utiliser les données de traits en écologie des communautés sont fondés sur une valeur unique de traits par individus (cf Chapitre 2).
Le second problème concernant la manière de standardiser la mesure des traits des arbres n'a pas non plus reçu de réponse à ma connaissance, hormis la recommandation de choisir des feuilles pleinement développées et de lumière pour les traits foliaires (Cornelissen et al. 2003). Ainsi, Kraft et al. (2008) ont choisi de mesurer des feuilles à des hauteurs constantes sur des arbres de sous-bois de moins de 5cm de diamètre, alors que Baraloto et al. (2009) ont collecté des feuilles de lumière sur des arbres matures et donc à différentes hauteurs et sur des individus de différentes statures.
Le troisième problème est lié à la question de savoir quels stades de vie des arbres sont les plus déterminants pour comprendre leur distribution et abondance. Est-il nécessaire de comprendre la dynamique complète de croissance et mortalité des arbres pour comprendre leur distribution, ou l'étude de quelques stades de vie est-elle suffisante, notamment les premiers stades de vie où est concentré l'essentiel de la mortalité des arbres (Petit et Hampe 2006) ? Quelques études se sont intéressées à ces questions de manière indirecte, notamment Thomas et Bazzaz (1999) et Poorter (2007). Il est cependant difficile de tirer des conclusions définitives de ces études du fait de leur nature très indirecte.
8-Les axes de stratégie des plantes
Si l'on met de côté ces problèmes méthodologiques et que l'on admet qu'il est possible d'attribuer à un arbre des valeurs uniques de traits qui caractérisent ses propriétés globales, que nous disent ces valeurs de traits ? De nombreux travaux visent à comprendre comment les traits des espèces sont reliés à leurs propriétés écologiques. A l'heure actuelle, quelques synthèses ont mis à jour des grands axes de stratégies écologiques des plantes associés à des ensembles de traits (Westoby et al. 2002, Wright et al. 2004, Westoby et Wright 2006). On peut dénombrer au moins quatre axes (Westoby et Wright 2006). Le premier est l'axe SLA-durée de vie des feuilles. Les espèces ayant des forts SLA ont tendance à un
Introduction – Partie 1
renouvellement rapide des feuilles (courte durée de vie) et une croissance rapide. Le deuxième axe est celui de la grosseur des graines représentant un compromis entre colonisation et établissement. Le troisième axe décrit le compromis entre hauteur à maturité et croissance juvénile rapide ou tolérance à l'ombre. Le quatrième axe est associé aux traits du bois et concerne les compromis entre efficience du transport de l'eau, résistance à la sécheresse et résistance mécanique et biotique (Westoby et Wright 2006, Chave et al. 2009). Enfin, d'autres axes potentiellement important concernant les racines sont encore mal compris (Westoby et Wright 2006).
9-La différence entre stratégie fonctionnelle et niche écologique d’un individu
Hutchinson (1957) a défini la niche écologique d'un organisme comme l'ensemble des conditions environnementales dans lesquelles un organisme peut survivre (ie. avoir un taux de croissance de population positif). Une définition alternative donnée par Elton (1927 cité dans Chase et Leibold 2003) considère la niche d'un individu comme son impact sur les autres organismes et l'environnement. Ces deux définitions peuvent être vues comme complémentaires (Chase et Leibold 2003). La vision d'Hutchinson de la niche est une façon commode de conceptualiser l'association entre environnement et distribution géographique des espèces (eg. Morin et Lechowicz 2008). Elle occupe donc souvent une place centrale en écologie des communautés pour réfléchir à la manière dont les attributs des espèces influent sur leur présence et abondance dans une communauté.
Si cette vision de l'assemblage des communautés centrée sur la niche et en particulier celle de Hutchinson, est remise en question par certains (eg. Hubbell 2001), comme nous le développerons dans la deuxième partie de l'introduction, elle sous-tend tout une partie des analyses réalisées à partir des traits en écologie des communautés, notamment les tests visant à détecter l'effet d'un filtrage par l'environnement sur la distribution des traits dans une communauté (cf Chapitre 2). Ces tests font souvent implicitement un raccourci en supposant l'équivalence entre position dans un espace de valeurs de traits (ou espace phénotypique) et position dans un espace de niches. Ce raisonnement peut paraître valide lorsque l'on s'intéresse aux habitudes alimentaires des animaux (eg. la taille et la forme du bec des pinsons de Darwin comme indicateurs de leur régime alimentaire), ou même chez les plantes, lorsqu'il s'agit de traits de résistance à un stress environnemental majeur, comme la résistance au gel. Dans ces cas, il peut exister une relation assez directe entre espace phénotypique et espace de
Introduction – Partie 1
niches. En forêt tropicale et plus généralement dans nombre de communautés végétales, la validité de cette hypothèse est beaucoup moins évidente.
En effet, les grands axes de stratégie fonctionnelle des plantes ne suffisent pas a priori à déterminer la niche écologique d'un individu. Connaître la manière dont un arbre gère la ressource en eau, optimise sa photosynthèse et résiste à différents stress mécaniques et biotiques, ne renseigne pas directement sur sa capacité à survivre et à se développer dans différentes conditions environnementales, ni sur son impact environnemental. Pour exemple, un axe de niche potentiellement très important chez les arbres tropicaux est la résistance à la sécheresse (Engelbrecht et al. 2007). Poorter et Markesteijn (2008) ont étudié expérimentalement la relation entre des traits morphologiques et la résistance à la sécheresse de plantules tropicales. Si l'on ne s'intéresse qu'aux espèces sempervirentes de cette étude, 20% seulement de la variation entre espèces dans leur résistance à la sécheresse a pu être expliquée à partir de leurs traits. Si l'on s'intéresse à des arbres à des stades de développement ultérieurs, cette relation entre traits et résistance à la sécheresse est susceptible d'être encore moins bonne. En effet, la résistance à la sécheresse est susceptible de dépendre d'innombrables facteurs, comme la conductivité hydraulique de toutes les parties de l'arbre, la capacité de stockage de l'eau, notamment dans le tronc, l'efficience d'utilisation de l'eau, le réseau racinaire et mycorhizien de l'arbre, la résistance mécanique aux stress induits dans les parois vasculaires par la sécheresse, les mécanismes de réparation des embolies, etc... Un autre exemple est celui de l'utilisation de la lumière. Connaître la capacité photosynthétique d'une feuille ne permet pas de connaître la capacité photosynthétique totale de l'arbre, et encore moins le gain net de carbone de cet arbre (Givnish 1988). Ainsi, des études ont montré qu'une même capacité à capter la lumière au niveau d'un individu pouvait être réalisée avec des architectures d'arbres et des propriétés foliaires très différentes (Valladares et al. 2002, Pearcy et al. 2004). Ces deux exemples soulignent que connaître chacun des composants fonctionnels ne suffit pas pour prédire directement leur effet cumulé. Cela nécessite de modéliser comment ces différents composants interagissent.
Plus généralement, passer d'un ensemble de stratégies à la niche écologique d'un arbre nécessite d'être capable d'intégrer les différentes facettes du fonctionnement et de la fitness d'un arbre, un enjeu majeur de l'écologie (Violle et al. 2007). Les différentes fonctions réalisées par un arbre sont inter-connectées, comme par exemple la capacité photosynthétique et l'efficience du transport hydraulique (Sack et al. 2005). Cette non-indépendance des différentes fonctions d'un arbre fait qu'il peut exister différentes façons d'arriver à la même fitness dans un environnement donné par le biais de compromis
Introduction – Partie 1
complexes entre différentes fonctions d'une plante. A ce sujet, les travaux de Marks sont exemplaires (Marks et Lechowicz 2006, Marks 2007). En étudiant une modélisation mécaniste très détaillée d'une plantule d'arbre en forêt tempérée, il montre qu'il existe de nombreuses combinaisons de traits très différentes menant à des fitness voisines dans un environnement donné (voir aussi Leimar 2001). Par ailleurs, il montre que la position d'une espèce dans l'espace phénotypique est susceptible de dépendre de contingences évolutives (ie. la position au sein d'une phylogénie) et que pour percevoir une association entre traits et environnement, il est nécessaire de considérer des traits très intégrés du fonctionnement d'une plante, comme la résistance à la sécheresse ou la tolérance à l'ombre.
Si relier les traits fonctionnels couramment mesurés en forêt tropicale et les niches Hutchinsoniennes semble un objectif très ambitieux et requerra probablement des années de recherche, il semble plus accessible de relier traits fonctionnels et niches au sens de Elton, c'est à dire l'impact d'une espèce sur l'environnement biotique et abiotique, comme sa stratégie d’acquisition et d’utilisation des ressources. Ainsi, la reconnaissance chez les plantes des grands axes de stratégie fonctionnelle (Westoby et Wright 2006) est une étape importante dans ce programme. Une autre difficulté apparaît cependant : si l'utilisation du concept de niches écologiques de Hutchinson est assez aisée en écologie des communautés pour comprendre les assemblages et la dynamique des espèces, l'utilisation du concept Eltonien de la niche est plus compliqué. En effet, comprendre l'impact des différentes espèces sur l'environnement et sur les autres espèces ne permet pas de comprendre immédiatement les assemblages d'espèces, bien que cela soit possible (eg. Tilman 1990). En particulier, des concepts simples tels que l'agrégation des niches des espèces produites par le filtrage environnemental (cf chapitre 2) ne sont plus valides, si l'on utilise la définition Eltonienne de la niche écologique. Il est alors plus naturel de penser la dynamique des communautés comme des assemblages dynamiques de stratégies fonctionnelles qui se partitionnent le temps et l'espace, et dont le succès dépend des stratégies des autres membres de la communauté, un cadre conceptuel qui rappelle celui de la théorie des jeux (Falster et Westoby 2003, McGill et Brown 2007). Pour aller dans cette voie, il est cependant nécessaire de développer de nouvelles méthodes d'analyses des distributions de traits dans les communautés (Vincent et Vincent 2009). Ce genre d’approches est d’autant plus compliqué que la dimension spatiale est souvent une donnée clé pour comprendre les interactions entre espèces (eg. Durrett et Levin 1994, Goreaud et al. 2002, Kerr et al. 2002).
Introduction – Partie 1
En conclusion de cette première partie, il est donc important de noter que la grande diversité morphologique parmi les arbres tropicaux ne se traduit pas forcément en une aussi grande diversité des stratégies fonctionnelles et encore moins en une grande diversité des niches écologiques (au sens de Hutchinson). Comprendre quels sont les traits déterminants et comment les intégrer en une mesure pertinente de la stratégie écologique voire de la niche écologique d'un arbre est de ce fait un champ de recherche encore très ouvert (Lambers et Poorter 1992, Westoby et al. 2002, Wright et al. 2004, Westoby et Wright 2006, Chave et al. 2009).
Introduction – Partie 2
Partie 2 – L’arbre dans son environnement et les mécanismes
structurant la biodiversité forestière
Nous avons vu dans la première partie de l'introduction que la diversité phénotypique n’implique pas nécessairement une aussi grande diversité fonctionnelle et encore moins à une grande diversité de niches écologiques au sens de Hutchinson. Nous rajoutons ici une étape supplémentaire dans cette limitation progressive des conséquences de la diversité des organismes, en parcourant les grandes lignes de la dynamique forestière à l'échelle de la communauté. La définition Hutchinsonienne de la niche peut être affinée pour distinguer la niche fondamentale d'un individu de sa niche réalisée. La niche fondamentale correspond à l'ensemble des conditions environnementales dans laquelle un organisme peut vivre en l'absence de compétition et prédation, la niche réalisée étant celle en présence de compétiteurs et ennemis naturels. Nous examinons dans cette partie les différents facteurs écologiques pouvant influencer la formation de niches distinctes chez les arbres tropicaux. Cela nous mènera à la question posée par Hubbell : est-ce que les différences observées entre les espèces ont réellement un impact sur la dynamique des communautés ?
1-Les grands axes de stress/compétition chez les arbres
Le principal facteur limitant la croissance et la survie des arbres est l'accès à la lumière (Turner 2001, Lloyd et Farquhar 2008). Un autre axe important de contrainte chez les arbres tropicaux est le stress hydrique. En effet, quelques études ont montré une augmentation de la mortalité des arbres tropicaux suite à des épisodes de sécheresse naturelle (Condit et al. 1995, Phillips et al. 2009) ou provoquée expérimentalement (Davidson et al. 2008, Brando et al. 2008). Enfin, une dernière contrainte concerne la limitation de l'accès aux nutriments, notamment le phosphore (mais aussi les composés azotés, notamment dans les forêts sur sables blancs ou les caatingas cf eg. Coomes and Grubb 1996).
2-Les facteurs de stress
2-a-environnement physique (ou abiotique)
L'environnement physique détermine les contraintes que subit un arbre. Ainsi, la pluviométrie et particulièrement la durée de la saison sèche en forêt tropicale contraignent fortement la composition floristique (Baltzer et al. 2007, Engelbrecht et al. 2007). La topographie est aussi un élément structurant important (Pascal et Pélissier 1996, Valencia et
Introduction – Partie 2
al. 2004). Elle peut en effet influer sur la disponibilité en eau du sol pendant les périodes sèches. Les épisodes d'inondation sont une autre composante du stress hydrique que peuvent rencontrer les arbres (Baraloto et al. 2007, Madelaine et al. 2007). Ainsi, en Guyane Française, nombre de noms vernaculaires distinguent les espèces de bas fond des espèces de haut de pente (eg. Yayamadou marécage versus Yayamadou montagne).
Le sol a un impact à la fois sur le stress hydrique via son niveau de drainage et sur le stress lié aux nutriments et composés toxiques comme l'aluminium. Ainsi, la composition floristique des forêts tropicales change radicalement d'un type de sol à l'autre (Richards et al. 1996, Sabatier et al. 1997, Tuomisto et al. 2003, Svenning et al. 2004).
Les perturbations de type tornade ou glissement de terrain induisent enfin des stress mécaniques importants (Ogle et al. 2006, Uriarte et al. 2009).
2-b-environnement biotique direct
L'environnement biotique d'un arbre, c'est à dire l'ensemble des êtres vivants interagissant avec lui, induit pour cet arbre des stress directs et indirects. Parmi les stress directs, on peut citer tout d'abord la compétition pour les ressources que sont la lumière, l'eau et les nutriments (Coomes and Grubb 2000). Mais la présence d'arbres voisins n'a pas que des effets négatifs. En effet, il peut y avoir échange d'eau et de nutriments entre les arbres via des réseaux mycorhiziens (Selosse et al. 2006, McGuire 2007).
Par ailleurs, la chute d'arbres voisins, un chablis, a des effets multiples. Tout d'abord, il induit un stress mécanique potentiellement important (déracinement, décapitation, branches cassées). Puis, si l'arbre survit, le chablis procure un environnement lumineux plus propice (et un stress hydrique mécaniquement plus important).
Enfin, les arbres appartiennent à des réseaux d'interactions positives et négatives faisant intervenir d'autres êtres vivants. Parmi, les interactions négatives, l'herbivorie et les pathogènes exercent un rôle important. Ainsi, Fine et al. (2004) ont montré que c'était l'herbivorie, et pas la disponibilité en ressources, qui expliquait l'absence de certaines espèces des forêts sur sables blancs, très pauvres en nutriments. En effet, lorsque ces espèces sont protégées de l'herbivorie artificiellement, elles parviennent à survivre et croître sur sables blancs mieux que d'autres espèces présentes à l'état naturel sur ce type de sol. L'impact de l'herbivorie et des pathogènes sur une espèce donnée est susceptible de dépendre de la composition floristique avoisinante (voir section 2-c).
Parmi les interactions positives (autres que les mutualismes bactériens et mycorhiziens déjà mentionnés pour la capture d'éléments du sol), les interactions entre les arbres et les
Introduction – Partie 2
animaux pollinisateurs et/ou disperseurs de graines ont un rôle clé pour la dynamique de populations des espèces (Turner 2001). On peut également mentionner les bénéfices variés retirés par les plantes dans leur symbiose avec des champignons endophytes (Rodriguez et al. 2009)
2-c-environnement biotique indirect
La composition floristique du voisinage d'un arbre est également susceptible d'avoir des effets indirects au-delà de la simple compétition/facilitation entre arbres. Tout d'abord, la composition chimique de la litière, dans laquelle les arbres puisent une part très importante de leurs ressources est fortement influencé par la composition floristique locale (Townsend et al. 2008), ceci étant notamment dû à la variabilité intra et interspécifique d'une part dans l'accumulation de certains nutriments et d'autre part dans la vitesse de décomposition des feuilles et autres débris (Cornwell et al. 2008, Weedon et al. 2009). Par ailleurs, la composition floristique est susceptible d'avoir un impact sur l'attrait ou la répulsion des herbivores, pathogènes, pollinisateurs et disperseurs. Si les herbivores sont spécialistes d'une espèce et si un arbre de cette espèce est entouré d'un grand nombre de conspécifiques, il a une probabilité plus grande d'être confronté à de l'herbivorie, car ces herbivores sont davantage attirés par ce patch de nourriture riche en individus intéressants pour eux. De la même façon, la transmission des pathogènes augmente avec la densité des hôtes potentiels. Si ces hôtes potentiels appartiennent à une espèce unique, alors la densité de conspécifiques sera déterminante dans la probabilité qu'un arbre subisse une infection. Cet effet de la densité locale des conspécifiques est connu sous le nom de densité-dépendance négative ou effet Janzen-Connell (Janzen 1970, Connell 1971). C'est l’un des mécanismes les plus couramment invoqués pour expliquer le maintien d'une forte diversité sous les tropiques. De nombreuses études ont tenté de le mettre en évidence en forêt tropicale, soit par l'analyse de données de mortalité (Webb et Peart 1999, Harms et al. 2000, Freckleton et Lewis 2006, Wills et al. 2006), soit, plus rarement en tentant de décortiquer le mécanisme impliqué (eg. Bell et al. 2006). Plus généralement, les herbivores et pathogènes sont susceptibles d'être spécialistes non pas d'une espèce, mais d'un clade (Weiblen et al. 2006). Dans ce cas, c'est la proximité phylogénétique des individus constituant le voisinage d'un arbre qui influe sur sa susceptibilité à être confronté aux herbivores ou pathogènes. Peu d'études se sont intéressées à l'heure actuelle à cette densité-dépendance phylogénétique du fait de la faible résolution actuelle des hypothèses phylogénétiques chez les arbres tropicaux (mais voir Webb et al. 2006). De la même façon, des phénomènes de densité-dépendance phylogénétique peuvent
Introduction – Partie 2
avoir lieu lors de la pollinisation et de la dispersion des graines. Quelques études se sont intéressées à cette question (eg. Ronsted et al. 2005). Pour ces agents mutualistes et pour les herbivores non spécialistes, les effets induits par la composition floristique locale sont susceptibles de dépendre du réseau d'interactions dans son ensemble (Bascompte and Stouffer 2009) et non juste de la conspécificité ou de la proximité phylogénétique des individus par rapport à l'arbre focal.
3-La variabilité temporelle de l’environnement
L'environnement d'un individu n'est pas constant dans le temps. Il varie du fait de la croissance de l'individu et de la croissance de ses voisins, mais aussi du fait de la variabilité climatique annuelle (alternance saison humide, saison sèche) et interannuelle (eg. Condit et al. 2004, Phillips et al. 2009). Ainsi, des conditions environnementales favorisant certaines stratégies à un moment donné peuvent laisser place à des conditions favorisant d'autres stratégies. Cette variabilité environnementale temporelle doit également conduire à l'augmentation du nombre d'espèces pouvant s'installer dans un site donné. Ce mécanisme connu sous le nom de « effet de stockage » (Chesson 1985) nécessite des séries temporelles longues pour être mis en évidence, un type de données rare en forêt tropicale (mais voir Jones et Hubbell 2006).
Une autre source de variabilité temporelle est due aux perturbations, qu'elles soient d'origine physique comme les tornades (Ogle et al. 2006, Uriarte et al. 2009) ou biotique comme les chablis (Martinez-Ramos et al. 1988). Les théories de la dynamique forestière font largement appel à ces perturbations pour expliquer la coexistence d'espèces héliophiles (ou pionnières) et sciaphiles en forêt (Cordonnier 2004). Suite à un chablis, les espèces pionnières sont avantagées, puis, une fois que la croissance des arbres a refermé le trou formé dans la canopée par le chablis (Riéra et al. 1998), les espèces sciaphiles sont avantagées à leur tour. Ainsi, l'hypothèse des perturbations intermédiaires (Connell 1978) stipule que la diversité devrait être maximale pour des rythmes de perturbations intermédiaires : pour de faibles perturbations, les espèces sciaphiles devraient progressivement exclure les pionnières, le contraire se produisant pour de fortes perturbations. L'évaluation de cette hypothèse a présenté des résultats contrastés (Hubbell et al. 1999, Molino et Sabatier 2001, Sheil and Burslem 2003, Bongers et al. 2009). Cela tend à montrer que le taux de perturbation a un impact non négligeable sur la diversité locale des forêts tropicales, mais que ce n'est pas le seul facteur important à l'origine de cette diversité. Par ailleurs, cette vision de la dynamique