T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par Université Paul Sabatier - Toulouse 3 Discipline ou spécialité : Biomécanique
JURY
Dr Cécile Legallais DR CNRS HDR - Rapporteur
Pr Jean-Charles Le Huec PU-PH CHU Bordeaux - Rapporteur Pr Jean Puget PU-PH CHU Toulouse
Pr Jérôme Sales de Gauzy PU-PH CHU Toulouse Pr Pascal Swider Université Toulouse 3
Pr Eric Viguier HDR Ecole Nationale Vétérinaire de Lyon
Ecole doctorale : Mécanique, Energétique, Génie Civil, Procédés Unité de recherche : Laboratoire de Biomécanique
Directeur de Thèse : Pr Pascal Swider
Présentée et soutenue par Jean-Michel LAFFOSSE Docteur en Médecine, Chef de Clinique-Assistant CHU TOULOUSE
Le 1er Octobre 2008
Titre : Contribution à l'étude du transport convectif dans le segment vertébral scoliotique : mécanobiologie, micro-architecture
3
A Anne-Marie et Jean-François, mes parents,
A Céline, ma femme,
A Emmanuel, mon frère, Christine, sa femme et leurs enfants,
5
REMERCIEMENTS
Je tiens à remercier sincèrement :Madame le Docteur Cécile Legallais et Monsieur le Professeur Jean Charles Le Huec, pour avoir accepté d’être les rapporteurs de ce travail.
Messieurs le Professeur Eric Viguier, le Docteur Thierry Odent et Thibault Cachon pour leur accueil chaleureux au sein de l’Ecole Nationale Vétérinaire de Lyon et pour nous avoir permis de bénéficier de leur expertise mais également d’avoir accepté que nous travaillions sur leur modèle animal.
Monsieur le Professeur Jérôme Sales de Gauzy, du Service de Chirurgie Orthopédique de l’Hôpital des Enfants de Toulouse, pour ses conseils toujours avisés et plein de bon sens.
Monsieur le Professeur Pascal Swider, du Laboratoire de Biomécanique de l’Hôpital Purpan à Toulouse, pour l’ensemble de son aide, si précieuse afin de mener à bien l’ensemble de ce travail.
Monsieur le Professeur Jean Puget, du Service de Chirurgie Orthopédique du CHU Toulouse Rangueil, pour son soutien moral et matériel, au quotidien, durant ces longs mois.
Merci également à Monsieur le Professeur André Autefage, Mlle Sophie Palierne et Mlle Hélène Autefage, de l'Ecole Nationale Vétérinaire de Toulouse pour nous avoir permis de bénéficier gracieusement de leurs locaux, de leur matériel, mais également de leurs conseils.
Merci à Monsieur le Professeur Jean-Philippe Cahuzac, du Service de Chirurgie Orthopédique de l’Hôpital des Enfants de Toulouse, car vous savez toujours faire éclore dans notre esprit la curiosité qui nous aide à avancer.
6
Merci à Monsieur le Docteur Franck Accadbled, du Service de Chirurgie Orthopédique de l’Hôpital des Enfants de Toulouse, pour ton soutien permanent, même à distance…
Merci à Monsieur le Docteur Charles Kinkpe, du Service de Chirurgie Orthopédique de l’Hôpital des Enfants de Toulouse, pour ton aide indispensable au cours l’analyse histologique.
Merci à Madame le Docteur Anne Gomez-Brouchet et à Madame le Professeur Marie-Bernadette Delisle, du Laboratoire d’Anatomo-Cyto-Pathologie du CHU de Toulouse Rangueil, pour nous avoir permis de mener à bien l’analyse histologique.
Merci à Hendy Abdoul du Service d’épidémiologie clinique du CH Necker – Enfants Malades de Paris pour leur collaboration au cours de l’analyse statistique de ce travail.
Merci à Dominique Ambard, Jérome Briot, Erik Estivalèzes, du Laboratoire de Biomécanique de l’Hôpital Purpan à Toulouse. Merci pour votre collaboration, votre aide et vos conseils.
Merci à Jérôme et Alain, du Laboratoire de Chirurgie Expérimentale du CHU de Toulouse Purpan, pour nous avoir accueillis avec tant de gentillesse et de disponibilité.
Merci au Dr Arnaud Beck et au personnel de l’Institut de Médecine et Physiologie Spatiale de l’Hôpital Rangueil pour leur aide et pour nous avoir permis de disposer gracieusement de leurs locaux.
Enfin, merci à l’ensemble de ma famille, ma femme, Céline et mes amis pour leur soutien et leurs encouragements permanents.
7
Doctorat de l'Université de Toulouse
Délivré par : Université Paul Sabatier - Toulouse 3
Ecole doctorale : Mécanique, Energétique, Génie Civil, Procédés Spécialité : Biomécanique
Date de soutenance : 1er Octobre 2008
8
TABLE DES MATIERES
Pages
Liste des Abréviations 11
Résumé / Mots-clés 14
Abstract / Key-words 15
Introduction et Objectifs 17
1. Chapitre 1 : Contexte général – Analyse bibliographique 1.1. Vertèbre et disque intervertébral
1.1.1. Embryologie et croissance normale
1.1.2. Anatomie microscopique et structure histologique 1.1.3. Maturation, vieillissement et dégénérescence 1.1.4. Fonction et biomécanique "normale"
1.1.5. Physiopathologie : contraintes mécaniques et DIV / CEP 1.2. Le transport convectif dans le segment vertébral
1.2.1. Comportement d'un milieu poreux élastique 1.2.2. Transport convectif et CEP
1.2.3. Evolution de la perméabilité macroscopique du CEP 1.2.4. Etude quantitative du transport convectif
1.3. Synthèse 23 24 24 28 32 36 38 40 40 43 46 50 51
9
2. Chapitre 2 : Description de l’approche expérimentale
2.1. Considérations concernant le modèle de scoliose animal
2.1.1. Rappels et analyse bibliographiques des modèles animaux de déformation rachidienne et de scoliose Modèle animal de scoliose développé par l’ENV de Lyon
2.1.2. Cahier des charges du modèle animal
2.1.3. Caractéristique du modèle porcin (ENV Lyon) 2.1.3.1. Mise au point du modèle
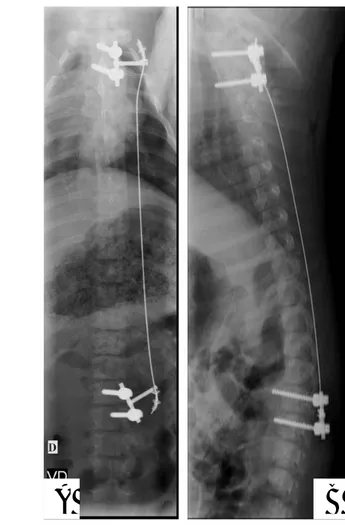
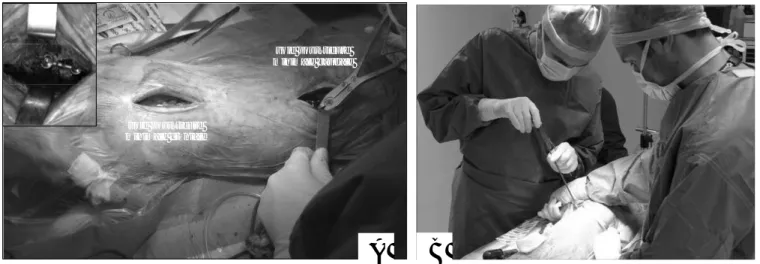
2.1.3.2. Instrumentation du modèle de scoliose et procédure chirurgicale
2.1.3.3. Quantification de la déformation scoliotique
2.2. Mesure de la perméabilité macroscopique des plateaux vertébraux 2.2.1. Méthodes de mesure de la perméabilité des tissus biologiques 2.2.2. Méthode de mesure de la perméabilité utilisée dans notre étude
2.2.2.1. Conservation des échantillons
2.2.2.2. Mesure des perméabilités macroscopiques 2.3. Analyse de la micro-architecture osseuse
2.3.1. Analyse par micro – TDM
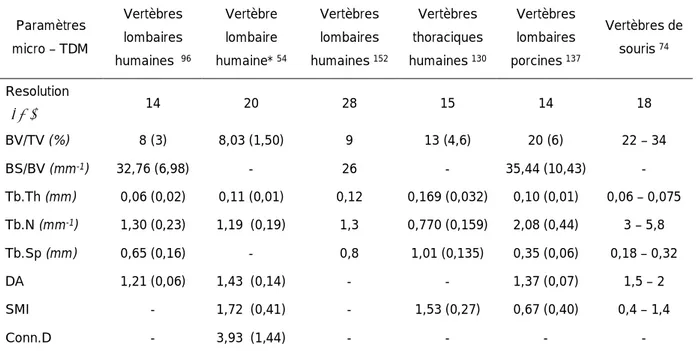
2.3.2. Données analysées en micro – TDM : principes et définitions 2.3.3. Corrélations entre micro – TDM et histologie et biomécanique 2.3.4. Etudes micro – TDM vertébrales
2.4. Conclusion 53 54 54 58 60 60 61 64 67 67 69 69 70 77 77 79 82 83 86
3. Chapitre 3 : Etude 1 : modèle d’épiphysiodèse asymétrique 3.1. Introduction et hypothèse de travail
3.2. Matériel et Méthode :
3.2.1. Modèle animal et prélèvement des échantillons : 3.2.2. Mesure de la perméabilité macroscopique :
3.2.3. Analyse de la micro-architecture osseuse par µTDM 3.2.4. Paramètres histomorphométriques 3.2.5. Analyse statistique 87 88 89 89 92 92 94 95
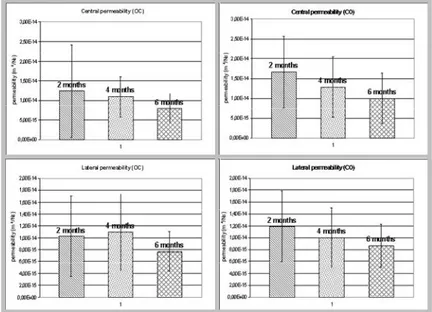
10 3.3. Résultats 3.3.1. Déformations macroscopiques 3.3.2. Perméabilités macroscopiques 3.3.3. Paramètres micro-architecturaux 3.3.4. Paramètres histomorphométriques 3.4. Discussion et Conclusion 95 95 96 100 107 111
4. Chapitre 4 : Etude 2 : modèle expérimental animal de scoliose : 4.1. Introduction et hypothèse
4.2. Matériel et Méthodes
4.2.1. Modèle animal et prélèvement des échantillons 4.2.2. Techniques expérimentales & statistiques 4.3. Résultats
4.3.1. Déformations macroscopiques du rachis 4.3.2. Perméabilités macroscopiques
4.3.3. Micro-architecture osseuse de l'os sous-chondral : micro – TDM 4.3.4. Micro-architecture du plateau : analyse histomorphométrique 4.3.5. Corrélations statistiques entre les paramètres de convection et
de micro-architecture 4.4. Discussion et Conclusion 117 118 119 119 122 125 125 126 132 140 143 146
Conclusion générale et Perspectives 153
Annexes 157
Références bibliographiques 183
Les travaux présentés ici ont été réalisés conformément aux textes réglementaires relatifs à la protection et l’utilisation des animaux à des fins expérimentales.
11
LISTE DES ABREVIATIONS
µ-TDM micro-tomodensitométrie 3D tridimensionnel(le)
AF annulus fibrosus
BS/BV Bone Surface / Bone Volume = Specific Bone Surface BV/TV Bone Volume / Total Volume = Fraction volumique d'os CC cartilage de croissance
CEP cartilage end-plate Conn.D Index de connectivité
CT Computed Tomography = Tomodensitométrie DA Degree of Anisotropy = Degré d'anisotropie DIV disque inter-vertébral
DMO Densité Minérale Osseuse DMSO DiMéthyl SulfOxyde
ENV Ecole Nationale Vétérinaire
IRM Image par Résonance Magnétique MEF Modélisation en éléments finis MIL Mean Intercept Length
NP nucleus pulposus
Pg Protéoglycanes
PMMA PolyMéthylMétacrylate PV plateau(x) vertébral(aux) ROI Region Of Interest
sens CD sens de mesure du corps vertébral vers le disque ou flow-in sens DC sens de mesure du disque vers le corps vertébral ou flow-out SMI Structure Model Index
Tb.N Mean Trabecular Number = nombre moyen de travées Tb.Sp Mean Trabecular Separation
Tb.Th Mean Trabecular Thickness
TDM Tomodensitométrie
13
14
TITRE : Contribution à l'étude du transport convectif dans le segment vertébral
scoliotique : mécanobiologie, micro-architecture et perméabilité des plateaux vertébraux
RESUME :
Le plateau vertébral (PV) constitue une zone d’échanges entre le réseau vasculaire et le disque intervertébral (DIV) sous la forme de transports convectifs qui garantissent l'homéostasie du DIV. Le PV est le siège d’une maturation physiologique et d'un remodelage pathologique initiés par les stimuli mécaniques et les phénomènes de transport. Ce travail contribue à l'analyse de la dégénérescence discale des pathologies rachidiennes et notamment scoliotiques.
Dans un premier temps, une épiphysiodèse sur modèle animal porcin a permis de quantifier l'influence des contraintes de compression asymétrique sur les propriétés convectives du plateau vertébral. La perméabilité macroscopique a diminué de manière dans les zones de contraintes maximales. Ces modifications ont été associées à des modifications locales de la micro-architecture de l’os sous-chondral. Dans un second temps, nous avons confirmé les interactions entre les déformations du rachis et les paramètres convectifs et architecturaux sur un modèle animal porcin de scoliose. Les perturbations mécano-biologiques, altération de la perméabilité et remodelage du réseau osseux trabéculaire sous-chondral, ont été identifiés dans les zones sommitales et plus particulièrement dans la concavité de la courbure.
MOTS CLES : biomécanique, transport convectif, perméabilité, scoliose, disque
intervertébral
NOM ET ADRESSE DU LABORATOIRE : Laboratoire de Biomécanique, CHU
15
TITLE: Study of convective transport in scoliotic vertebral segment: mechanobiology,
micro-architecture and permeability of vertebral end-plate.
ABSTRACT:
The vertebral end-plate (VEP) is a zone of exchanges between vascular network and disc (IVD) through convective transport that maintain IVD homeostasia. Physiological maturation and pathological remodelling of VEP might be initiated by mechanical stimuli and transport phenomena. This work contributed to the analysis of disc degeneration in pathology of spine and in particular in scoliosis.
First, an epiphysiodesis in porcine animal model allowed quantifying the role of asymetric compressive stresses on convective properties of VEP. The macroscopic permeability decreased in zones of maximum strain. These modifications were associated with local modifications of subchondral micro-architecture. Then, we confirmed interactions between spine deformation, convective parameters and end-plate micro-architecture in a porcine animal model of global scoliosis. The mechanobiological modifications, alteration of permeability and remodelling of subchondral network, were mainly detected in the summit zones and in the concavity of the curvature.
KEYWORDS: Biomechanics; convective transport; permeability; scoliosis;
intervertebral disc
LABORATORY ADDRESS: Biomechanics Laboratory, Purpan University Hospital,
17
18
INTRODUCTION ET OBJECTIFS
Les plateaux vertébraux (PV) sont des éléments complexes et évolutifs. Leur structure est composite et associe chez l’animal successivement, le cartilage articulaire hyalin (encore appelé cartilage end-plate, CEP), l’os sous-chondral et le cartilage de croissance. Le plateau constitue la zone de liaison entre le corps vertébral, constitué d’os spongieux et le disque intervertébral (DIV), constitué d'un squelette solide saturé par une solution aqueuse. La matrice solide du DIV est essentiellement composée de fibres de collagène et d’agrégats de protéoglycanes (Pg), dont les proportions varient suivant les différentes régions du disque intervertébral. Les cellules, chondrocytes et fibroblastes, participent à son homéostasie en synthétisant (ou en dégradant) les fibres de collagène et les chaînes de protéoglycanes. La structure des PV est évolutive dans le temps et ce de manière physiologique avec la croissance 2,48 et le vieillissement ; mais elle peut également être le siège de remaniements pathologiques 147 qui peuvent agir comme un véritable vieillissement accéléré. Ces modifications constituent alors une véritable « dégénérescence du CEP » avec l’apparition de calcifications et de modifications de la structure architecturale des plateaux vertébraux. Ces remaniements peuvent retentir sur la diffusion des éléments nutritifs du disque intervertébral puis aboutir à la mort cellulaire avec comme conséquence une véritable dégénérescence discale plus ou moins rapide 59,99,119,129 qui va se traduire au niveau mécanique, par l’incapacité pour le disque intervertébral à redistribuer aux plateaux vertébraux adjacents les contraintes qu’il subit.
Les plateaux vertébraux constituent donc des zones d’échange privilégiées entre le secteur vasculaire et le disque intervertébral. Le maintien de ces échanges est nécessaire à l’homéostasie discale afin que ce dernier puisse remplir son rôle mécanique dans la statique et la dynamique rachidienne. Les solutés dissous vont être transportés dans et à travers la matrice de l’annulus fibrosus (AF) et du nucleus pulposus (NP) par un mécanisme passif de diffusion moléculaire (phénomène qui demeure relativement lent) mais également par un mécanisme actif de convection
19
61,67,76,143. L'activité physique et notamment la station debout qui alterne avec les phases de repos vont entraîner des cycles de chargement et de déchargement mécanique du disque. Cette alternance va générer une circulation de fluide entre le disque intervertébral et les corps vertébraux par effet de pompage. Ce mécanisme constitue le vecteur principal de transport de nutriments vers le disque intervertébral et d’élimination de déchet à partir de ce dernier. Cette voie nutritive est cependant précaire 124,147 et elle peut être l’objet de perturbations secondaires à des modifications histologiques des plateaux vertébraux. Nachemson 99 fut le premier à faire le lien entre la perméabilité des plateaux vertébraux et la dégénérescence discale en mettant en évidence une diminution marquée du pH au niveau de disques intervertébraux présentant des signes radiographiques dégénératifs. Cette augmentation de concentration en ions hydrogène signe une altération de l’oxygénation au niveau du disque et donc de la diffusion des nutriments vers le DIV. Fergusson et coll. 52 et Sélard et coll. 124 ont confirmé cette hypothèse en montrant qu’une diminution de la perméabilité des cartilage end-plate (CEP) perturbait les transports moléculaires aussi bien par diffusion que par convection.
Les premiers modèles développés pour décrire le comportement du disque intervertébral ont été basés sur l’hypothèse d’un comportement purement élastique ou viscoélastique. Ces approches ont rencontré leurs limites lorsqu'il s'est agi de décrire les phénomènes convectifs associés aux mouvements de fluide au sein du segment vertébral. D’autres modèles ont été par la suite développés et ont considéré le disque comme une structure poroélastique ce qui a permis d’intégrer les mouvements de fluide interstitiel. Ces modèles ont permis de mieux prévoir la réponse du DIV aux stimuli mécaniques et les phénomènes de couplage induits avec le fluide. Néanmoins, d’autres éléments que le tissu discal interviennent dans les mouvements et les échanges liquidiens. Des auteurs 69 ont montré que les conditions aux limites vis à vis des fluides, c’est-à-dire les propriétés des PV et les parois externes de l’annulus fibrosus (AF), avaient une influence significative sur le comportement du segment. La périphérie de l’AF est une voie d’apport de nutriments mais celle-ci est minoritaire ; les échanges s’effectuant principalement au travers des PV 30,120,124.
20
A notre connaissance, il n’y a qu’une seule étude 147 qui ait relié l’existence d’une déformation rachidienne et scoliotique aux troubles de la perméabilité des plateaux vertébraux. Urban et coll. 147 ont mis en évidence une diminution de la perméabilité du CEP sous la forme d’une moindre diffusion in vivo du protoxyde d’azote dans le disque intervertébral dans la convexité de la courbure de scolioses neuromusculaires. Cette diminution a été reliée à la présence radiographique de calcifications au niveau du CEP dans la convexité de la courbure. Il n’y a pas d’étude expérimentale qui ait étudié l’influence de l’application de contrainte en compression sur la perméabilité des plateaux vertébraux ni sur leur microarchitecture locale.
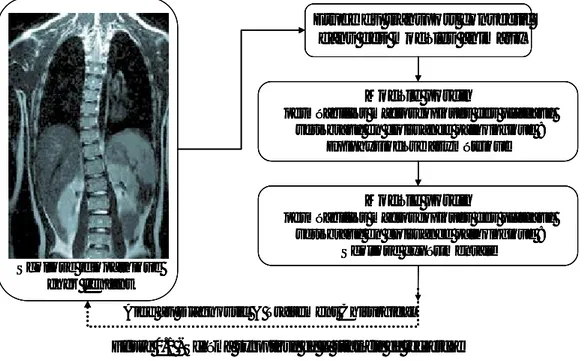
L’hypothèse centrale de notre projet de travail a consisté à supposer que la modification de nutrition et d’homéostasie des disques intervertébraux peut être associée à une perturbation du transport convectif au niveau du plateau vertébral et le schéma synoptique de la Figure 0.1 permet de résumer la stratégie mise en place. Nous pensons que la perméabilité macroscopique du plateau vertébral peut être un point clé de la boucle de contrôle mécano-biologique du rachis, ce paramètre physique permettant d'établir un lien entre les trois éléments suivants : les sollicitations mécaniques pathologiques, les remaniements histologiques des plateaux vertébraux et l’apparition d’anomalies biochimiques discales pouvant aller jusqu'à la dégénérescence.
Etude du transport convectif dans des modèles animaux
Scoliose idiopathique chez l'enfant
Figure 0.1 - Schéma synoptique de la stratégie de recherche Aide au Diagnostic & Traitement Chirurgical
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Epiphysiodèse asymétrique
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Scoliose expérimentale Etude du transport convectif
dans des modèles animaux
Scoliose idiopathique chez l'enfant
Figure 0.1 - Schéma synoptique de la stratégie de recherche Aide au Diagnostic & Traitement Chirurgical
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Epiphysiodèse asymétrique
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Scoliose expérimentale Etude du transport convectif
dans des modèles animaux Etude du transport convectif
dans des modèles animaux
Scoliose idiopathique chez l'enfant Scoliose idiopathique
chez l'enfant
Figure 0.1 - Schéma synoptique de la stratégie de recherche Aide au Diagnostic & Traitement Chirurgical
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Epiphysiodèse asymétrique Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Epiphysiodèse asymétrique
Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Scoliose expérimentale Modèle porcin
perméabilités macroscopiques des plateaux vertébraux en croissance pathologique :
Scoliose expérimentale
21
Nous pouvons observer que le point initial de la démarche est l'enfant possédant un trouble de croissance, mais il est prématuré de développer des études quantitatives à partir des données cliniques. Dans ce cas, une approche parallèle sur modèle animal a été développée. Cette stratégie, progressive dans sa complexité, devrait permettre, à terme, d'obtenir des conclusions plus robustes transposables chez l'enfant scoliotique.
Dans le chapitre 1, le contexte général de ce travail est explicité dans une analyse bibliographique. Celle-ci est consacrée à une description anatomique, biologique et fonctionnelle du DIV ainsi qu’à une analyse des travaux de la littérature concernant le transport convectif dans le segment vertébral et plus particulièrement, la perméabilité des tissus biologiques.
Plusieurs facteurs sont susceptibles de modifier la perméabilité du plateau vertébral, et parmi ceux-ci les stimuli mécaniques ont été privilégiés. Dans le chapitre 2 de ce travail de recherche, nous avons mis en place une approche mixte théorique et expérimentale permettant de quantifier les interactions entre les déformations pathologiques d'un segment vertébral et les modifications des perméabilités macroscopiques du plateau, la micro-architecture osseuse et la topologie histologique. Ce travail s'est appuyé sur un modèle animal porcin développé en collaboration avec l’Ecole Nationale Vétérinaire de Lyon (Pr Eric Viguier, Dr Thierry Odent et Thibault Cachon).
Les chapitres 3 et 4 ont été consacrés à l’étude expérimentale proprement dite. Elle a été menée sur un modèle animal porcin en croissance. Nous y avons analysé l'influence de sollicitations pathologiques générées, dans une première étude par une épiphysiodèse vertébrale asymétrique, et dans une deuxième étude par une scoliose d'ensemble. L'ensemble des techniques précédemment développées a été appliqué. Nous avons analysé les conséquences d'une dissymétrie localisée d'effort de compression sur la perméabilité et sur la microarchitecture osseuse. Dans la première étude, le travail a été mené au niveau d’un segment intervertébral unique constitué d'un disque intervertébral et des deux
22
plateaux vertébraux adjacents pour lesquels la localisation centrale ou périphérique et le sens d’écoulement sont privilégiés. Dans la deuxième étude, la même expérimentation a été menée au niveau d’une scoliose d’ensemble. Ce travail expérimental est complété par un modèle analytique de convection du fluide au sein du plateau vertébral.
En dernier lieu, une synthèse des résultats obtenus est présentée, ainsi que des perspectives de développement concernant les aspects scientifiques et cliniques de l'étude dans le cadre général des recherches interdisciplinaires Sciences / Santé.
23
24
1. CHAPITRE 1 : ANALYSE BIBLIOGRAPHIQUE – CONTEXTE
GENERAL :
Le contexte général du travail de recherche est explicité dans cette première partie. Les descriptions anatomique, biologique et fonctionnelle du disque intervertébral et du cartilage end-plate s'appuient sur une analyse bibliographique. Le transport convectif dans le segment vertébral est étudié avec un intérêt particulier concernant le rôle des contraintes mécaniques sur l'évolution des perméabilités macroscopiques des tissus biologiques.
1.1.
Vertèbre et disque intervertébral :
1.1.1. Embryologie et croissance normale 41,47 :
Le développement du DIV et des vertèbres adjacentes débutent très tôt durant la vie intra-utérine et sont étroitement liés. Au dix-septième jour de vie, l’ectoblaste va s’invaginer pour former le tube neural à l’origine de la moelle épinière tandis que le mésoblaste s’épaissit, puis se segmente pour former les sclérotomes qui migrent de part et d’autre de la notochorde. Chaque sclérotome va ensuite se cliver horizontalement. La partie crâniale à l’origine du disque, fusionnant à la partie caudale du sclérotome sus-jacent à l’origine du corps vertébral (Figure 1.1, page suivante). La notochorde va régresser au sein des corps vertébraux lors de leur différenciation cartilagineuse puis osseuse (Figure 1.2, page suivante). Au sein du disque, elle s’expand dans un premier temps pour former un amas cellulaire ovalaire, le nucleus pulposus. Le disque péri-notochordal mésenchymateux (futur annulus fibrosus) se différencie en deux zones : une zone périphérique fibreuse faite de fibroblastes et de fibres de collagène et une zone centrale plus lâche. Chez le nouveau-né, à terme, on peut retrouver deux structures distinctes : au centre, le nucleus pulposus (NP) et l’annulus fibrosus (AF) en périphérie, fait de lamelles compactes.
25
La maturation post-natale se traduit par la disparition des vestiges chordaux et la transformation du nucleus pulposus en fibrocartilage à mesure qu’il se charge en fibres de collagène. Chez l’adulte, vers l’âge de 30 ans, le nucleus pulposus est solide, fibreux et n’est plus démarqué aussi clairement de l’anulus fibrosus. La croissance des vertèbres débute dès le 3ème mois in utero pour se terminer vers la 25ème année de vie (Figure 1.3). Elle va se faire dans 2 directions, en hauteur et en largeur par ossification enchondrale sous l’influence d’un pédicule vasculaire pénétrant le mur vertébral antérieur à l’origine d’une lacune vasculaire (Figure 1.4).
Fig 1.1 : La vertèbre est une structure inter-segmentaire
A : Migration du sclérotome. B : Condensation mésenchymateuse. C : Organisation inter segmentaire. D : Morphogénèse du disque. E : Structure vertébrale définitive.
1. Chorde. 2. Somite. 3. Dermatome. 4. Myotome. 5 Artère inter segmentaire. 6. Nerf spinal. 7. Disque intervertébral. 8. Corps vertébral. (d’après JM. Clavert : Chirurgie et Orthopédie du Rachis,
Sauramps) Corps Vertébral Disque CEP CEP Corps Vertébral
Fig 1.2 : Régression chordale et formation du NP (d’après Diméglio et Bonnel. Le rachis en croissance, Springer)
Fig 1.3 : Disque et vertèbre chez le nouveau-né (d’après Diméglio et Bonnel, Le rachis en croissance, Springer)
Fig 1.4 : Lacunes vasculaires (d’après Diméglio et Bonnel, Le rachis en croissance, Springer)
26
Les vertèbres ont une croissance différentielle ; l’activité des cartilages de croissance croît du segment cervical au segment lombaire. Le phénomène d’ossification débute très tôt vers la 7ème semaine du développement pour se terminer à la fin de la croissance. Elle se fait progressivement par transformation des zones cartilagineuses. On retrouve 3 zones d’ossification pour chaque vertèbre : 1 point d’ossification volumineux par corps vertébral et 1 point d’ossification par hémi-arc postérieur. Ces 3 centres primaires sont retrouvés à la naissance. Durant la 1ère année de vie, les 2 hémi-arcs postérieurs fusionnent et entre 3 et 6 ans, l’arc postérieur fusionne avec le corps vertébral. La séparation entre corps vertébral et arc postérieur est matérialisée par le cartilage neurocentral, nécessaire à l’adaptation du canal vertébral à la taille de la moelle épinière, qui disparaît entre l’âge de 9 et 12 ans selon les études. On dénombre 5 centres d’ossification secondaires : 1 pour le processus épineux, 1 pour chaque processus transverse et 1 plaque par plateau vertébral. En fin de croissance, les disques représentent 1/4 de la hauteur totale du rachis cervical et du rachis dorsal, et 1/3 de la hauteur du rachis lombaire.
Les caractéristiques quantitatives de la croissance rachidienne de l’enfant ont été particulièrement étudiées par Dimeglio et Winter 47 (Figure 1.5). Des facteurs d’ordre génétique, neurologique, endocrinien, métabolique et autres interviennent sur la croissance normale et pathologique du rachis. Le développement du rachis est également directement lié aux contraintes mécaniques auxquelles il est soumis et la verticalisation est nécessaire à une anatomie normale 48. Il a été observé une hauteur plus importante des corps vertébraux et un diamètre antéro-postérieur diminué chez des enfants grabataires ainsi que des disques intervertébraux d’une épaisseur moindre et des nucleus piulposus hypotrophiques 68.
Fig 1.5 : Règle de croissance de Winter. Chaque ensemble vertèbre + disque contribue en croissance à 2.5 % en région thoracique et 3.5 % en région lombaire (mesurées en taille assise). Longueur T1-S1=60% taille assise (d’après Diméglio et Bonnel, Le rachis en croissance, Springer)
27
Plusieurs lois régissent le jeu hiérarchisé des cartilages de croissance :
- 1ère loi - Epiphyse première : la plus forte croissance est générée au lieu d'apparition de la première épiphyse. Et l’épiphyse qui présente le plus fort potentiel de croissance s’ossifie en premier.
- 2ème loi - Equilibre : les cartilages de croissance de la chondro-épiphyse se marquent mutuellement.
- 3ème loi - Fusion précoce : l’atteinte d’un cartilage de croissance remet en cause le comportement des autres cartilages de croissance.
- 4ème loi - Synchronisation : la croissance synchronisée des différentes épiphyses est essentielle pour l'équilibre de développement.
Les contraintes mécaniques appliquées sur la chondro-épiphyse ont des consé-quences sur la croissance. Ce remodelage de la croissance est basé sur la loi de Hueter-Wolkman 70 (Figure 1.6) qui suppose qu'une contrainte mécanique trop importante va entraîner un défaut de croissance alors qu’une contrainte trop faible va entraîner une libération de la
croissance 133. Ce phénomène pourrait être la cause de l’auto-aggravation d’une déformation scoliotique avec un excès de contrainte sur les zones de croissance dans la concavité et une libération de la croissance dans la convexité 148. Ceci pourrait donc contribuer à la justification des modifications anatomiques vertébrales observées dans les déformations scoliotiques.
Fig 1.6 : Dissymétrie des contraintes : modulation de la croissance et modifications de l’anatomie vertébrale
28
1.1.2. Anatomie microscopique et structure histologique :
Le disque intervertébral :
Le disque est constitué du nucleus pulposus (NP) au centre et de l’annulus fibrosus (AF) en périphérie (Figure 1.7). Il est en contact direct avec le cartilage articulaire hyalin des plateaux vertébraux. Le NP qui est composé à 80% d’eau représente environ 50% du volume du disque intervertébral adulte. Sa matrice extra-cellulaire est faite de collagène (20% du poids sec) et de protéoglycanes (50% du poids sec) qui
confèrent au disque son caractère hydrophile sous forme de gel visqueux aux propriétés hydrostatiques. L’AF est formé de 7 à 15 lamelles concentriques entre lesquelles sont enchâssées cellules et matrice 116. Il est composé à 60 – 70 % d’eau, de collagène (65 – 70 % du poids sec) et de protéoglycanes (10 – 20 %) concentrés dans sa partie interne 116. Les protéoglycanes de la matrice discale forment des agrégats. D’une espèce à l’autre, cette organisation structurale est remarquablement conservée 40,43,58,85,117,150. A partir de la 3ème – 4ème décennie, on observe des modifications de la composition du disque et surtout du NP, où le contenu en eau chute de 80 – 90 % à 70 % 116. Le NP devient alors progressivement fibreux, moins élastique et moins hydraté. Le contenu en collagène augmente, le contenu en protéoglycanes diminue. La cellularité du disque intervertébral humain est faible, en moyenne 5800 cellules/mm3 avec une distribution hétérogène où les cellules se concentrent à proximité des sources de nutriments, c'est-à-dire à proximité du cartilage des plateaux vertébraux 90,116.
Fig 1.7 : coupe horizontale d’un DIV chez un homme sain de 17 ans. Le nucleus (2) est au centre, entouré par l’annulus fibrosus (1) (d’après rachisonline.org)
29
Le cartilage end-plate :
A l’interface du disque et du corps vertébral, on décrit les "plaques d’extrémité" qui ont un rôle majeur dans la structure et la composition du disque, notamment en permettant le maintien du niveau d’hydratation du disque 48. Ils vont éviter la hernie du disque à l’intérieur du corps vertébral en absorbant la pression développée d’un côté par le disque et de l’autre par la vertèbre lorsque le rachis est mis en charge 93. On parle dans la plupart des études de "cartilage end-plate" (CEP). Ses fonctions biologiques et mécaniques sont sous-tendues par une architecture complexe qui, comme celles du disque évolue avec sa maturation et son vieillissement. Stricto
sensu, le CEP est une fine couche de cartilage hyalin correspondant au cartilage
articulaire vertébral. Cependant, le CEP est souvent assimilé à la succession de ce même cartilage hyalin associé l’os sous-chondral et au cartilage de croissance. L’épaisseur du cartilage hyalin est variable 93,120, en moyenne de 0,60 mm chez l’homme, elle est d’environ 1 mm en périphérie en regard de l’anulus fibrosus et elle diminue en regard du nucleus pulposus. Ceci est à l’origine d’une dépression du CEP, la "stress-bearing zone" de Schmorl 48. Elle augmente de T12 – L1 à L3 – L4 pour ensuite être constante. Il n’y a pas de différence significative d’épaisseur du CEP entre le plateau supérieur et inférieur sauf chez le chez sujet jeune où le plateau cranial semble plus épais 120. Le cartilage hyalin est constitué de fibres de collagène orientées horizontalement et parallèles entre elles qui semblent cheminer à partir du disque pour se poursuivre dans le cartilage alors qu’il existe une séparation très nette entre le cartilage et l’os vertébral. Ainsi, autant on peut décrire des connections directes entre cartilage et disque, autant le cartilage et l’os du corps vertébral sont complètement séparés 93. Au niveau de la partie externe du disque, il y a des traces basophiles discontinues signant la
présence d’une couche de cartilage calcifié entre os vertébral et disque. Dans la région du nucleus pulposus, cette couche de cartilage calcifié est très mince voire indiscernable (Figure 1.8). Les cellules, majoritairement des chondrocytes,
Vaisseau sanguin Nucleus pulposus Annulus fibrosus Disque intervertébral Cartilage End-Plate CEP calcifié Os sous chondral Vaisseau sanguin Nucleus pulposus Annulus fibrosus Disque intervertébral Cartilage End-Plate CEP calcifié Os sous chondral Vaisseau sanguin Nucleus pulposus Annulus fibrosus Disque intervertébral Cartilage End-Plate CEP calcifié Os sous chondral
Fig 1.8 : Représentation de l’histologie normale (d’après Robert et coll.)
30
sont distribuées de manière homogène dans l’épaisseur du cartilage, mais sans une organisation en strates comme on peut le voir au niveau du cartilage articulaire 93. La densité cellulaire est plus importante en regard du nucleus qu’en regard de l’anulus 21. L’aspect est identique entre le plateau crânial et caudal 93.
On retrouve les même éléments constituant le cartilage des plateaux vertébraux et le cartilage articulaire. Il n’y a pas de différence significative entre le plateau crânial et le plateau caudal ni entre les différentes vertèbres de L1 à S1. La matrice du CEP est composée d’un gel de protéoglycanes hydraté, renforcé d’un réseau de fibres de collagène 93 et associé à d’autres substances inorganiques et organiques. Les protéoglycanes au niveau du cartilage end-plate, nucleus pulposus, anulus fibrosus et cartilage articulaire ont la même structure de base et une composition chimique semblable. Les fibres de collagène ont un diamètre de 300 à 800 Ä avec des lacunes encore plus grandes ; c’est le gel eau- protéoglycanes avec des pores très petits de 20 à 50 Ä qui gouverne la porosité du milieu. Les molécules de protéoglycanes sont chargées négativement, ce qui confère une charge nette négative responsable d’une part des équilibres ioniques entre le cartilage et l’environnement et d’autre part de la « pression de gonflement » du cartilage 91. Le contenu biochimique au niveau du cartilage end-plate (CEP) varie en fonction de la localisation. On retrouve une diminution de son contenu en collagène et une augmentation de son contenu en protéoglycanes et en eau de la périphérie du plateau vers le centre en regard du nucleus pulposus. Le même profil vertical s’observe au niveau du CEP lorsque l’on se dirige de l’interface os-CEP vers l’interface CEP-disque. La composition biochimique du CEP est importante pour le maintien de l’intégrité du disque 10,11,67,93,109,120,121,147; notamment les protéoglycanes qui jouent un rôle important dans la régulation des échanges vers l’intérieur et l’extérieur du disque. Ainsi, quand la quantité de protéoglycanes du CEP diminue, il en est de même pour le nucleus pulposus.
Il existe un lit capillaire complexe au niveau de l’interface os-CEP 20,43,60; les terminaisons capillaires sont discoïdes et sessiles et viennent au contact du cartilage (Figure 1.9, page suivante). De plus, on retrouve des zones de contact direct entre la moelle osseuse et le CEP 43 (Figure 2.10) qui constituent des zones de diffusion et
31 de convection privilégiées.
Ces terminaisons capillaires ainsi que ces zones de contact direct sont plus nombreuses dans la région centrale du plateau (en regard du nucleus pulposus) qu’à la périphérie (en regard de l’anulus fibrosus) 30,99,120,145. A la partie la plus externe, le réseau est moins riche voire inexistant par endroit avec des terminaisons moins nombreuses et plus grêles 43. Oki et coll. 104 ont étudié la morphologie des bourgeons vasculaires en microscopie électronique au contact des cartilage end-plate (CEP). Pour eux, le nombre de vaisseaux en regard du nucleus pulposus n’est pas plus important qu’en regard de l’anulus fibrosus interne, mais ils présentent plusieurs boucles (comme un ressort), alors qu’en regard de l’ anulus fibrosus, ils ne font qu’une seul boucle offrant ainsi une surface d'échange moins importante. Gruber et coll. 60 ont réalisé une étude par micro – TDM de l’architecture du réseau capillaire au niveau des CEP. Ce dernier apparaît comme un réseau très complexe avec de nombreuses inter-connections. Cette étude confirme également le caractère avasculaire du disque par l’absence de pénétration de capillaire au sein du disque mais aussi la présence d’une couche calcifiée au niveau des CEP entre les capillaires et le disque qui peut agir comme une barrière aux phénomènes de convection – diffusion.
Fig 1.9 : Terminaisons capillaires au contact du CEP (flèche)
(d’après Holm et coll.)
Fig 1.10 : Contact direct espace
médullaire (A) – CEP (B) (d’après
Nachemson et coll.)
32
1.1.3. Maturation, vieillissement et dégénérescence :
L’histologie et la composition du disque inter-vertébral et du cartilage end-plate évoluent avec l’âge 20,48 et subissent après la naissance une maturation progressive jusqu’à l’âge adulte. Débute ensuite une dégénérescence en particulier au niveau lombaire, d’intensité variable selon les sujets.
Le cartilage end-plate d’un nouveau né est composé d’une plaque de croissance et d’un cartilage articulaire hyalin bordant le disque intervertébral (Figure 1.11a). Le cartilage de croissance est caractérisé par des colonnes parallèles de cellules prolifératrices et hypertrophiques tandis que le cartilage articulaire est composé de chondrocytes fusiformes dispersés dans la
matrice. Chez l’homme, les deux couches cartilagineuses composant les CEP (cartilage articulaire hyalin et cartilage de croissance) sont juxtaposées. Elles sont accolées de manière très intime sans interposition de tissu osseux (Figure 1.11a et 1.11b) 41,47,48 ce qui constitue une relative singularité dans le règne animal. Cette particularité explique également que le CEP correspond pour certains au seul cartilage hyalin et pour d’autres à la juxtaposition de ce cartilage avec l’os sous-chondral et le cartilage de croissance. Ainsi, les CEP ont dans notre espèce, en plus des fonctions mécaniques et biologiques des plateaux vertébraux, une fonction de croissance où il assure la croissance en hauteur de la vertèbre. La croissance en largeur étant principalement le fruit d’une ossification enchondrale.
Fig 1.11 Evolution de la structure du CEP avec l’âge. A : cartilage articulaire (CEP), B : os sous-chondral, NP : nucleus pulposus, G : cartilage de croissance. (Grossissement x 50) (d’après Bernick et coll.)
PAS NAg
Fig 1.11a : nouveau-né Fig. 1.11b : 10ans NAg PAS
Fig 1.11d : 35 ans NAg PAS
Fig 1.11e : 65 ans NAg PAS
PAS NAg
Fig 1.11a : nouveau-né
PAS NAg
Fig 1.11a : nouveau-né Fig. 1.11b : 10ans NAg PAS Fig. 1.11b : 10ans NAg PAS Fig 1.11d : 35 ans NAg PAS Fig 1.11d : 35 ans NAg PAS
Fig 1.11e : 65 ans NAg PAS
Fig 1.11e : 65 ans NAg PAS
33
Chez les modèles animaux étudiés 2,31, il existe une couche d’os spongieux plus ou moins épaisse qui sépare le cartilage end-plate de la plaque de croissance (Figure 1.12). Cette dernière est disposée parallèlement à la surface du plateau vertébral et va être à l’origine de la croissance en hauteur de la vertèbre. Nous avions montré sur un modèle ovin, dans un travail non publié, que l’épaisseur globale du cartilage end-plate et des 3 couches qui le composent (cartilage articulaire hyalin, os sous-chondral et plaque de croissance) était plus faible au centre, en regard du nucleus pulposus qu’à la périphérie, en regard de l’ anulus fibrosus.
A la naissance, la densité cellulaire des chondrocytes augmente. A l’âge de 10 ans, l’épaisseur du cartilage de croissance diminue (Figure 1.11b) pour être calcifié à 18 ans, avec une diminution du nombre de cellules qui prennent une disposition irrégulière (Figure 1.11c). Après 45 ans, ce cartilage calcifié est ossifié. L’épaisseur du cartilage end-plate diminue avec l’âge et subit également des phénomènes de résorption tandis qu’il est remplacé par du
tissu osseux 93 (Figures 1.11d et 1.11e). Au début, le cartilage end-plate est constitué d’une couche aplatie et régulière de cartilage hyalin, progressivement apparaissent des protrusions d’os sous-chondral d’abord isolées puis plus nombreuses à l’origine d’une couche ondulée continue. In fine, se forme une couche d’os sclérotique 10 et le cartilage end-plate est réduit après 65 ans à une mince couche de cartilage au
Fig 1.13 : Minéralisation progressive du CEP (d’après Bernick et Caillet)
CEP CEP CC CC CC DIV Os sous-chon dral
Fig 1.12 : Coupe histologique d’un plateau vertébral qui montre la juxtaposition des couches : disque intervertébral (DIV), Cartilage End-Plate (CEP), Os sous-chondral et Cartilage de croissance (CC) (d’après Laffosse et coll.)
34
contact du disque intervertébral 26 (Figures 1.13 et 1.14, page suivante).
La composition biochimique du cartilage end-plate (CEP) et du disque inter-vertébral évolue avec l’âge parallèlement à ces modifications structurales 25. La densité minérale au niveau du CEP augmente avec l’âge 58 tandis que la dégénérescence discale est caractérisée par une diminution des protéoglycanes agrégés et une augmentation des métalloprotéases lysant le lien protéique qui unit et stabilise l’acide hyaluronique au corps du protéoglycane 75. Il s’ensuit une perturbation du système osmotique discal et par conséquent une perte en eau et en éléments nutritifs. Cette déshydratation s’accompagne de mouvements discaux excessifs entraînant des microfissures qui augmenteraient la concentration discale en collagène. De nombreuses études ont suggéré une corrélation positive entre les remaniements des CEP avec la dégénérescence discale 10,57,58,60,109,120,121,147. Gruber et coll. 58 ont pu montrer sur un modèle animal que les CEP voyaient leur densité minérale augmenter avec le vieillissement de l’animal. Cela correspond aux calcifications qui apparaissent avec l’âge objectivées par micro – TDM 60. Cette même équipe de recherche 57 a démontré dans un travail récent la corrélation étroite qu’il existe entre l’augmentation de la densité minérale qui constitue le vieillissement des CEP avec l’augmentation du pourcentage de cellules mortes au sein de l’annulus fibrosus aussi bien dans sa partie interne qu’externe. Pye et coll. 114 ont montré la corrélation étroite qui existe entre la sclérose des CEP et le pincement discal qui est le reflet macroscopique de sa dégénérescence avec une diminution de son hydratation et de sa hauteur.
Fig 1.14a : Interdigitations osseuses au sein du CEP
Fig 1.14b : Couche ondulée d’os à l’interface du CEP
Fig 1.14 : Calcification progressive de l’interface os-CEP (d’après Aoki et coll.)
Fig 1.14c : Couche continue d’os sclérotique ayant remplacé le cartilage
35
La vascularisation au niveau des cartilage end-plate évolue également avec l’âge 10,20,42,48,60,77,93,123. Au début, de fins vaisseaux pénètrent le CEP pour sa nutrition ainsi que celle du disque intervertébral et du corps vertébral en plein développement. Ces vaisseaux vont persister durant le développement et la croissance du disque, puis ils vont diminuer en nombre principalement à la périphérie du disque jusqu’à la maturité où le disque devient avasculaire. Malgré son caractère avasculaire et sa faible cellularité, le disque intervertébral est un organe vivant, siège d’un métabolisme actif. Il nécessite donc des échanges avec l’extérieur pour l’apport de nutriments et le rejet de déchets ; ceux-ci vont se faire par deux grandes voies 30,67,76,91,99,144,145. D’une part, par l’intermédiaire de capillaires sanguins, sous la forme de bourgeons vasculaires au contact du CEP 120 assurant la nutrition des cellules de la partie interne de l’ anulus fibrosus et du nucleus pulposus 147. D’autre part, par l’intermédiaire de vaisseaux sanguins retrouvés en nombre important à la face externe de l’anneau qui permettent la nutrition des cellules de la partie externe de l’ anulus fibrosus 147 (Figure 1.15).
Avec l’âge, il y a une obstruction progressive des vaisseaux sous-chondraux des plateaux vertébraux. Chez le jeune, ces canaux nourriciers et les espaces osseux sont remplis de moelle, de tissu fibreux lâche et d’éléments myéloïdes. Après 45 ans, ils sont progressivement occlus par du collagène, du tissu fibreux et des calcifications. Ceci va avoir des effets délétères sur les échanges entre le secteur vasculaire et le disque intervertébral, notamment une diminution de la perméabilité aux nutriments, un plus haut taux de lactates en rapport avec une diminution du
Fig 1.15 : Les deux voies d’apport nutritives du disque (d’après Holm et coll.)
36
métabolisme aérobie accompagné d’une chute du pH pouvant ainsi être à l’origine de perturbations métaboliques avec dégénérescence discale du fait de la mort cellulaire et relargage local d’enzymes de dégradation. Benneker et coll. 20 ont démontré une corrélation entre la concentration en bourgeons vasculaires en regard du cartilage end-plate (CEP) et le grade de dégénérescence discale ainsi que la concentration discale en protéoglycanes. Ils ont ainsi suggéré les effets négatifs sur l’apport en nutriments de bourgeons capillaires de petite taille mais également d’un nombre plus faible de bourgeons capillaires comme cela est le cas chez les sujets plus âgés (Figure 1.16). Auparavant, Rajasekaran et coll. 115 avait montré, par une étude IRM in vivo, l’importance de la qualité de la vascularisation des CEP sur la diffusion vers le disque intervertébral des éléments dissous et l’influence péjoratives de lésions du CEP sur la diffusion.
1.1.4. Fonction et biomécanique "normale" :
Sur le plan mécanique, le disque intervertébral constitue l’élément essentiel du segment mobile rachidien. Il participe à la cohésion intervertébrale et maintient un espace déformable entre les corps vertébraux facilitant les mouvements du rachis en redistribuant les contraintes dans les 3 dimensions de l’espace. Quant au cartilage end-plate, il empêche la protrusion du nucleus pulposus dans l’os spongieux du corps vertébral 93 tout en protégeant le disque intervertébral de la pénétration de substance qui pourrait favoriser la dégradation du disque. Il participe également à l'équilibre des pressions dans le disque lors du chargement du rachis 9. La résistance mécanique du CEP et du plateau vertébral n’est pas homogène. Des tests d’indentation 56 ont montré que, au niveau du rachis lombaire, le centre du plateau
Fig 1.16: Vue en microscopie
électronique des bourgeons vasculaires au contact du CEP. (A) à l’age de 30 ans et (B) à l’age de 80 ans (vue de la face discale d’un CEP). (d’après Benneker et coll.)
37
vertébral était moins résistant que la périphérie. Les zones les plus résistantes étant les zones postéro-latérales en regard des pédicules. Le plateau crânial est également moins résistant que le plateau caudal, ce qui est une des raisons avancées expliquant la prédominance des fractures à ce niveau. Un disque intervertébral et les deux corps vertébraux adjacents constituent un segment rachidien que l’on peut considérer comme une unité spinale fonctionnelle (Figure 1.17).
Le comportement biomécanique de cette unité est non linéaire du fait de la composition et de la structure complexes de la matrice du disque intervertébral et de son état d’hydratation qui possède ainsi des propriétés visco-poro-élastiques 78. L’hydratation du disque intervertébral varie selon la charge à laquelle il est soumis. Ainsi, les échanges liquidiens jouent un rôle majeur dans le comportement mécanique du disque intervertébral 71. Après une nuit de repos, les activités de la vie quotidienne entraînent une augmentation de la pression intra-discale du fait de la gravité et surtout du fait des contractions des masses musculaires para-vertébrales. Il en résulte une fuite d’eau du nucleus pulposus et donc une augmentation de la concentration en protéoglycanes du disque intervertébral. La concentration discale en protéoglycanes est à l’origine d’une "pression de gonflement" qui va générer un appel d’eau par des phénomènes osmotiques jusqu’à ce qu’un nouvel équilibre soit atteint. In vivo, une période de repos ou « de déchargement » de 7 à 24 heures est nécessaire au disque intervertébral pour retrouver son contenu hydrique 88 et sa hauteur. Les principales voies par lesquelles l’eau est retenue dans le disque sont donc : la pression osmotique exercée par les molécules dissoutes au sein du disque
Fig 1.17 : Rachis lombaire et unité spinale fonctionnelle (Functional Spinal Unit = FSU) (d’après rachisonline.org)
38
et la pression d’imbibition exercée par le gel de protéoglycanes. Cette teneur en eau n’est pas uniforme, elle est de 60 – 75 % au niveau de l’ anulus fibrosus et de 70 – 90% au niveau du nucleus pulposus de disques d’homme jeune 40,62, tandis qu’elle diminue d’environ 10% au niveau des disques dégénérés et ce d’autant plus que la dégénérescence est avancée. Cette diminution en eau affecte l’élasticité du disque et ses capacités à redistribuer efficacement aux vertèbres adjacentes les efforts qu’il subit 40. La mesure de la pression intra-discale in vivo a été initiée par Nachemson dans les années 1960 98 puis confirmée et précisée plus récemment par Wilke et coll. 151. La pression chez un sujet adulte allongé est de l’ordre de 0,08 MPa, et de 0,50 MPa pour un sujet assis ou debout au repos 35.
1.1.5. Physiopathologie : contraintes mécaniques et DIV / CEP :
Dans le domaine nutritionnel, le cartilage end-plate (CEP) constitue une zone d’échange important et de régulation forte. Il représente la principale voie d’apport de nutriments du corps vertébral vers le disque intervertébral. Si cette voie est altérée, la mort cellulaire du nucleus pulposus est programmée. Parallèlement, la perméabilité du CEP prévient la fuite de protéoglycanes de faible poids moléculaire et contrôle l’élimination de catabolites et autres produits de dégradation de la matrice du disque intervertébral. Inversement, le CEP évite l’intrusion au sein de disque de substances pouvant précipiter sa dégénérescence 39.
L’âge est la cause principale de la dégénérescence des CEP 21, cependant, l’application d’une contrainte mécanique constitue un facteur déterminant soit directement par les lésions qu’elle entraîne, soit indirectement par l’apoptose ou mort cellulaire au sein du CEP 11,84,85. Des contraintes mécaniques importantes notamment en compression cyclique, peuvent être à l’origine de lésions irréversibles du CEP à type de fissuration. Ces lésions favorisent la dégénérescence discale 39,66. Cinotti et coll. 39 ont démontré macroscopiquement et histologiquement sur un modèle porcin les effets de lésions à type de perforation du CEP. Ces lésions, si elles sont multiples, provoquent une dégénérescence du disque et particulièrement du NP par intrusion de substance activant des métalloprotéases et par fuite de
39
protéoglycanes à l’extérieur du disque. Des lésions pénétrantes plus graves peuvent être associées à l’apparition d’infiltrats inflammatoires pouvant participer à la dégénérescence discale 66. De plus, les processus de "cicatrisation" du CEP peuvent aboutir à l’apparition de calcifications localisées qui constituent autant de barrières à la convection – diffusion. Des lésions discales à type de fissures radiaires ou horizontales induites perturbent la mécanique du segment intervertébral 139. Les contraintes sont alors modifiées localement. Ceci peut provoquer des lésions du CEP qui peuvent elles même favoriser la survenue et le développement d’une dégénérescence et de lésions discales plus graves.
D’autres travaux ont analysé l’influence des contraintes mécaniques sur l’activité cellulaire des CEP et des disques intervertébraux. La mise en compression chronique d’un disque intervertébral provoque une désorganisation discale 85 mais est également associée à une accélération de la mort des cellules du nucleus pulposus 142. Les cultures cellulaires issues de CEP sont sensibles à la pression qui induit une apoptose 11 et modifie le profil de synthèse protéique. Ces constatations ont été confirmées par des modèles animaux. Braun et coll. 29 ont développé un modèle expérimental de scoliose chez la chèvre. Après 15 semaines, l’analyse biochimique a retrouvé une diminution de la concentration en protéoglycanes dans le nucleus pulposus et une diminution de la concentration globale en hydroxyproline au sein des disques intervertébraux scoliotiques par rapport aux disques intervertébraux sains. Des anomalies discales analogues en terme de dégénérescence 142 ont été également retrouvées lors de la sollicitation mécanique à type de compression chronique de disques intervertébraux chez le lapin. Plusieurs équipes de recherche 6,8,23,37,49,132,153 ont confirmé ces résultats chez l’homme par l’existence d’altérations biochimiques, une moindre activité cellulaire, l’existence d’une activité apoptotique plus marquée ou d’une dégénérescence discale dans le cadre de pathologies rachidiennes telles que les scolioses idiopathiques ou secondaires. L’activité de synthèse au niveau du disque intervertébral et du CEP est ainsi significativement différente au niveau de rachis scoliotiques par rapport aux rachis normaux 8. Le contenu hydrique, en collagène total et en protéoglycanes est diminué au niveau des disques intervertébraux. Le contenu protéique total est quant à lui comparable, ce qui démontre un profil de synthèse perturbé. Des résultats comparables : chute du
40
contenu en eau, en protéoglycanes et en collagène et augmentation du taux protéique, ont également été enregistrés au niveau des CEP scoliotiques. Antoniou et coll. 8 ont démontré une activité de synthèse augmentée au niveau de la convexité de la courbure. Ceci est en accord, selon eux, avec la loi de Hueter-Volkman 70 qui établit un lien entre une croissance stimulée par les efforts de distraction et un effet réducteur dans les zones de compression. Le caractère asymétrique des troubles est important à noter. Ils prédominent à l’endroit où les forces en compression sont les plus importantes. Braun et coll. 29 ont trouvé, lors de l’étude des disques intervertébraux apicaux de scoliose, une diminution en protéoglycanes et une augmentation en hydroxyproline au sein de l'annulus fibrosus situé dans la concavité par rapport à l’AF situé dans la convexité de la courbure. A l’opposé, d’autres auteurs 23,146 ont retrouvé un moindre métabolisme dans la convexité sous la forme d’un nombre de cellules viables plus faible dans la convexité que dans la concavité et la concentration de lactates est supérieure dans la convexité 23.
1.2.
Le transport convectif dans le segment vertébral :
1.2.1. Comportement d'un milieu poreux élastique :
Relation contrainte, déformation, pression de fluide :
Le milieu poreux élastique déformable peut être modélisé par la superposition spatio-temporelle d'une matrice solide poreuse et d'un fluide la saturant (Figure 1.18) 24,42.
=
+
contrainte effective dans le domaine solide pression p dans le domaine fluide
contrainte effective nulle dans le domaine solide pression p dans le domaine fluide
contrainte effective dans le domaine solide pression nulle dans le domaine fluide
=
+
contrainte effective dans le domaine solide pression p dans le domaine fluide
contrainte effective nulle dans le domaine solide pression p dans le domaine fluide
contrainte effective dans le domaine solide pression nulle dans le domaine fluide
=
+
contrainte effective dans le domaine solide pression p dans le domaine fluide
contrainte effective nulle dans le domaine solide pression p dans le domaine fluide
contrainte effective dans le domaine solide pression nulle dans le domaine fluide
=
+
contrainte effective dans le domaine solide pression p dans le domaine fluide
contrainte effective nulle dans le domaine solide pression p dans le domaine fluide
contrainte effective dans le domaine solide pression nulle dans le domaine fluide
Fig 1.18 : Superposition des états de comportement mécanique.
41
La mise en équation de chaque état (non développée ici) et leur superposition, permettent de mettre en place la loi de comportement d'un élément de volume macroscopique du milieu poreux. Comme le montre l'équation (1), le champ de contraintes total résulte d'une combinaison linéaire entre les déformations observables de la partie solide (squelette poreux) et la pression p du fluide. Les paramètres E, , K sont les propriétés mécaniques du milieu poreux : module d'élasticité (E), coefficient de Poisson () et coefficient de compressibilité (K). Cette relation peut être écrite sous la forme (2) qui permet de faire apparaître le coefficient de Biot noté b, G étant le module de cisaillement.
0 0 0 0 0 0 I 0 1 I 1 2 1 1 s E E K tr p K
(1) 0 0 2 0 2 3 I I G K tr G b p
(2)Sous l'hypothèse d'incompressibilité de la matrice solide, le coefficient Ks tend vers l'infini et par conséquent b tend vers 1. Cette hypothèse est souvent utilisée pour la modélisation des structures biologiques et implique que le milieu poreux se déforme sous l'action des gradients de pression.
Relation débit, pression de fluide, perméabilité :
La loi de comportement reliant la vitesse de filtration qf dans un milieu poreux
saturé au gradient de pression p, est la loi empirique de Darcy exprimée par la relation (3). Le coefficient est la perméabilité intrinsèque ou spécifique (en m2) et est la viscosité du fluide (en Pa.s). On peut définir également la perméabilité relative
(en m4/Ns). grad f q p
(3)La perméabilité est une propriété intrinsèque du milieu poreux et elle est donc par définition indépendante des propriétés du fluide et du procédé de mesure.
42
Ce paramètre est principalement dépendant des caractéristiques géométriques du squelette poreux dont les paramètres les plus représentatifs peuvent être résumés à la porosité, le type et la topologie de leurs connexions (tortuosité équivalente unidimensionnelle). Le développement de modèles prédictifs de perméabilité à partir de la connaissance de la topologie des pores demeure un problème scientifique ouvert 50.
Dans le cas des applications au tissu osseux, on peut relever assez peu de travaux dans ce domaine. On peut noter toutefois certains résultats intéressants et notamment ceux de Arramon et al. 12 établissant une loi empirique basée sur la porosité instantanée locale et reprenant l'approche de Carman-Kozeny basée sur des modèles capillaires 33. La mesure de la porosité et de la perméabilité d'échantillons osseux (humains) a permis d'établir la loi de comportement (4) qui est visualisée Figure 1.19. Ici la loi est établie en fonction de la fraction solide s du
milieu poreux (s=1-f); f étant la fraction fluide correspondant à la porosité saturée
par le fluide.
4 2 10 B A S
avec S323
939
21340
31010
4288
5 (4) et A = 2,6 10-5 , B = 4,67Fig 1.19 : Modèle perméabilité / fraction solide