104
I. INTRODUCTION :
L’anesthésie fait appel à de nombreux postes budgétaires distincts qu’il est quelquefois difficile de regrouper. On peut citer le salaire du personnel (médecins, infirmiers et aides-soignants), le coût des examens complémentaires, le coût du monitorage (amortissement du matériel), le coût des dispositifs médicaux à usage unique, le coût des agents pharmaceutiques et des produits sanguins, et même le coût de séjour. Etant donné que ces aspects sont pris en charge par le budget de la décence, le présent travail ne traite que la consommation en anesthésiques généraux [111].
L’hôpital militaire d’instruction Mohammed V de Rabat, est un hôpital général renommé internationalement, c’est aussi le premier SEGMA au Maroc (système d’état géré de manière autonome) de point de vue rentabilité. Il possède un plateau technique innovant (AIVOC, …).
L’hôpital militaire d’instruction de Rabat possède un bloc opératoire renfermant 16 salles opératoires, qui est subdivisé en 3 parties :
le bloc opératoire septique. le bloc opératoire aseptique. le bloc opératoire des urgences.
105
L’augmentation de l’activité de cet hôpital dont le nombre de lits s’élève à 750, ainsi que l’avènement de nouveaux produits anesthésiques généraux, en règle générale plus chers que leurs prédécesseurs, nous amène à réaliser cette étude pharmacoéconomique dont les objectifs sont :
La détermination du budget médicamenteux de l’hôpital militaire d’instruction Mohamed V.
La détermination la part des anesthésiques généraux dans ce budget médicamenteux.
La discussion de l’état de consommation de chaque classe d’anesthésiques généraux.
La formulation de propositions pour les décideurs dans le but d’améliorer et de rationaliser les dépenses en matière de la consommation en anesthésiques généraux.
Le service de pharmacie hospitalière est la plateforme tournante de l’hôpital, en plus des aspects cliniques le service de pharmacie hospitalière joue un rôle très important dans la rationalisation des dépenses en produits pharmaceutiques.
106
II. MATRIEL ET METHODES :
a-
Type de l’étude :C’est une étude pharmacoéconomique de type minimisation des coûts générés par la consommation hospitalière en matière des médicaments de l’anesthésie générale.
b- Perspective retenue dans l’étude :
Il est important de préciser le point de vue selon lequel se place cette étude. Ainsi le présent travail est réalisé selon une perspective hospitalière et plus particulièrement celle de la comptabilité matière et financière hospitalière.
c- L’horizon temporel :
Cette étude de minimisation des coûts, compare une série prospective de 2007 à une série rétrospective de l’année 2006.
d- Méthode de collecte des données :
Dans cette étude de coût, nous avons recensé les médicaments utilisés au cours de l'anesthésie générale, ainsi que leurs coûts, et que nous avons regroupé en quatre catégories pour faciliter la lecture des résultats ;
Catégorie 1 : les anesthésiques généraux intraveineux. Catégorie 2 : les anesthésiques généraux inhalatoire. Catégorie 3 : les antalgiques opioïdes.
Catégorie 4 : les curares.
La collection de ces coûts a été réalisée, pour les deux séries rétrospective et prospective où nous avons utilisé les fiches comptables du logiciel de gestion de stocks AXYA – STOCK qui ont été consulté entre 01/01/2007 et 31/12/2007.
107
Pour les produits stupéfiants, telle que les opioïdes, on a utilisé le registre des stupéfiants.
Dans cette étude on va rechercher « les coûts directs » qui sont directement imputable à la consommation des médicaments de l’anesthésie générale, ces coûts sont présentés en PH c’est à dire prix hospitaliers.
III. RESULTATS :
1. La part des médicaments de l’anesthésie générale dans le budget médicamenteux :
Le budget médicamenteux de l’hôpital militaire d’instruction de Rabat s’élevait à 31 245 487.00 Dirhams en 2006. Ce budget était de 39 358 657.00 Dirhams pour l’année 2007.
Le total de la consommation en médicaments de l’anesthésie générale, pour l’année 2006, était de 5 166 623.16 Dirhams. Ce qui représente 16.53% de la dépense en médicament pour cette année.
Pour l’année 2007 cette consommation s’élève à 2 788 380.70 Dirhams, ce qui représente 7.08 % des dépenses en médicament pour cette année.
108
Figure 20: Part des anesthésiques généraux dans le budget médicamenteux.
2. consommation de chaque catégorie d’anesthésiques
généraux :
Tableau XII : Répartition de la consommation des anesthésiques généraux pour les années 2006 et 2007 :
2006 2007 Catégorie consommation en DH/année pourcentage de consommation consommation en DH/année pourcentage de consommation Les curares 1 597 294.10 30.92 % 410 268.80 14.71 % Les antalgiques opioïdes 946 423.95 18.31% 513 515.94 18.42 % Les anesthésiques inhalatoires 989 900.56 19.16 % 1 064 836.96 38.19 % Les anesthésiques intraveineux 1 633 004.55 31.60 % 799 759.00 28.68 %
109
Figure 21 : Répartition de la consommation des anesthésiques généraux:
Le graphique de la figure 22 ainsi que le tableau XI montrent l’importance de la régression en matière de la consommation générale des anesthésiques généraux.
Pour l’année 2006, la consommation des anesthésiques intraveineux ainsi que celle des curares étaient les plus importantes avec un pourcentage à peu prêt égale, tan disque que la consommation des antalgiques opioïdes et celle des anesthésiques inhalatoires restaient basses avec un pourcentage équivalent.
L’année 2007 a connu une régression de la consommation globale en anesthésiques généraux, mais on assiste à une élévation du pourcentage de consommation des anesthésiques inhalatoires qui est de 38.19 %, contre une baisse du pourcentage de la consommation en curares qui arrive à 14.71 %, pareil pour les anesthésiques intraveineux dont le pourcentage de consommation
110
a baissé jusqu’à 28.68 %. Les antalgiques morphiniques gardent le même pourcentage, par rapport à l’année 2006, qui tourne au tour de 18 %.
a) Etat de consommation en anesthésiques généraux intraveineux :
Comme c’est illustré sur le tableau XII, la consommation du Propofol DIPRIVAN® 200 mg a baissé de 49.18 % de l’année 2006 à 2007, mais elle reste toujours importante, et occupe la première place dans le classement en consommation des anesthésiques intraveineux, avec un pourcentage qui avoisine 45 % pour les deux années 2006 et 2007.
Le pourcentage de consommation de en Midazolam HYPNOVEL® vient en deuxième lieu après le propofol, avec un pourcentage en consommation des AG intraveineux de 24.64 % pour l’année 2006 et de 39.95 % pour l’année 2007. Cette consommation a subit une baisse de 20.59 % de l’année 2006 à 2007.
En troisième position vient le thiopental PENTHIOBARBITAL® 1g, dont le pourcentage de consommation en AG intraveineux est de 13.24 % pour 2006, et de 4.52 % en 2007. Cette consommation a été marquée par une baisse très importante de l’ordre de 83.28 % entre ces deux années.
L’étomidate HYPNOMIDATE®
2 mg représente 11.69 % de la consommation en anesthésiques intraveineux de l’année 2006, et 3.84 % en 2007. Cette consommation a subit une baisse importante de 83.88 % entres ces deux années.
111
Tableau XIII : consommation en anesthésiques généraux intraveineux :
2006 2007 Consommation en DH/année Pourcentage de consommation Consommation en DH/année Pourcentage de consommation Diprivan 200 mg 721 031.65 44.16 % 366 412,80 45.82 %
Diprivan 500 mg néant néant 8 960,00 1.12 %
Gamma-OH 649.80 0.04 % néant Néant
Hypnovel 5mg 402 331.65 24.64 % 319 473,00 39.95 %
Hypnomidate 2 mg 190 861.95 11.69 % 30 756.00 3.84 %
Ketalar 50 mg 33 804.00 2.07 % 2 880,00 0.36 %
Ketalar 100 mg 59 400.00 3.64 % néant néant
Narcozep 1 mg 7 089.48 0.43 % néant néant
Penthiobarbital 0.5g 1 545.50 0.09 % 35 125,00 4.39 %
Penthiobarbital 1 g 216 290.52 13.24 % 36 153,00 4.52 %
112
113
b) Consommation en anesthésique généraux inhalatoires :
L’halothane (HALOTHANE®
250 ml) était l’anesthésique inhalatoire le plus utilisé en 2006 avec un pourcentage de consommation de 52.91 %, suivie du sévoflurane (SEVORANE® 250 ml) dont la consommation est arrivée à 36.45 %, l’isoflurane (FORENE®
100 ml) et l’enflurane (ETHRANE® 250 ml) ont des pourcentages respectives de 8.07 % et 2.75 %.
En 2007, le pourcentage de consommation en halothane a baissé pour arriver à 7.80 % de la consommation des inhalatoire, en contre partie on assiste à une augmentation de l’utilisation du sevorane pour arriver à 46.34 %, l’isoflurane (FORENE®
250 ml), nouvellement introduits comme agent inhalatoire, vient en deuxième lieu avec un pourcentage de 40.57 %.
Tableau XIV : Etat de consommation des anesthésiques généraux inhalatoire :
2006 2007 Consommation en DH/année Pourcentage de consommation Consommation en DH/année Pourcentage de consommation
Ethrane 250 ml 25 440.00 2.57 % néant néant
Forene 100 ml 79 945.20 8.07 % 56 314.72 5.29 %
Forene 250 ml néant néant 432000.00 40.57 %
Halothane 523 687.36 52.91 % 83 082.24 7.80 %
Sevorane 360 828.00 36.45 % 493 440.00 46.34 %
114
Figure 23 : Etat de consommation des anesthésiques généraux inhalatoire.
c) Consommation en antalgiques opioïdes :
Comme le montre la figure 24 le fentanyl représente l’antalgique opioïde le plus utilisé pour les deux années 2006 et 2007 avec pourcentage qui est à peu prêt 95 %.
Pour l’année 2006, l’alfentanyl et sufentanyl représentent le reste de la consommation en matière des anesthésiques intraveineux avec des pourcentages équivalents.
Pour l’année 2007, le sufentanyl n’est plus utilisé. L’alfentanyl représente le reste de la consommation en antalgiques opioïdes de cette année.
115
Tableau XV : Consommation des antalgiques opioïdes :
Figure 24 : Etat de consommation des antalgiques opioïdes.
2006 2007 Consommation en DH/année Pourcentage de consommation Consommation en DH/année Pourcentage de consommation Alfentanyl 22 842.75 2.41% 24 663.30 4.81 % Fentanyl 901 337.20 95.24% 488 852.64 95.19 %
116
d) Consommation en matière des curares :
Le tableau XV, ainsi que le graphique de la figure 26 montrent l’importance de la baisse en consommation des curares entre l’année 2006 et 2007.
Tableau XVI : Etat de la consommation en curares :
2006 2007 Consommation en DH/année Pourcentage de consommation Consommation en DH/année Pourcentage de consommation Suxaméthonium (CELOCURINE® 100 mg inj) 134.85 0.03 % 6 528.00 1.60 % Rocuronium (ESMERON® 50 mg/5 ml inj) néant néant 141 450.00 34.47 % Mivacurium (MIVACRON® 20 mg/10 mg inj) 174 627.61 10.93 % néant néant Vécuronium (NORCURON® 4 mg inj) 7 260.00 0.45 % 118 831.68 28.96 % Vécuronium (NORCURON® 10 mg inj) 975 407.64 61.06 % 85 140.00 20.75 % Pancuronium (PAVULAN® 4 mg inj) 174 596.40 10.93 % 36 153.00 8.82 % Atracuronium (TRACURIUM® 50 mg/ 5 ml) 265 267.60 16.60 % 22 166.80 5.40 %
117
Figure 25 : Etat de la consommation en curares.
En 2006, le NORCURON® 10 mg représentait 61,06 % de la consommation en curares pour cette année, suivi du TRACURIUM® avec 16.60 %, la troisième place est partagée entre le MIVACRAN® et le PAVULAN® avec un pourcentage égale de 10.93 %.
En 2007 cette consommation a été répartie comme suis : ESMERON® 34,47 %, suivie du NORCURON® 4 mg avec 28,96 %, puis le NORCURON® 10 mg avec 20.75 %.
118
IV. DISCUSSION :
En chirurgie l'anesthésie générale avec intubation trachéale et ventilation artificielle est de pratique courante. Cette anesthésie est fondée, en générale, sur une balance entre l'analgésie et l'hypnose, qui doivent assurer un sommeil et l'absence totale de mémorisation d'événements, ainsi qu'une analgésie per-opératoire. Cette dernière va permettre de supprimer des événements hémodynamiques ou respiratoires secondaires aux stimulations nociceptives chirurgicales. Il faut rappeler que dans certains types de chirurgies, les événements hémodynamiques sont mal supportés [112]. L’intubation est réalisé grâce aux différents types de curares dont le choix dépend de la duré de la chirurgie.
Or, le nombre important des protocoles anesthésiques, qui dépendent du terrain (patient) et du type de la chirurgie, ainsi que de nombreuses modifications dans les protocoles médicamenteux d'anesthésie observées ces dernières années, rendent difficile l’étude pharmacoéconomique des AG.
Ainsi le présent travail vient mettre la lumière sur la consommation en médicament de l’anesthésie générale au niveau de l’hôpital militaire d’instruction de Rabat, sans discuter les dépenses en matière du protoxyde d’azote, qui est utilisé comme anesthésique inhalatoire mais dont la gestion ne dépend pas de la pharmacie hospitalière, ni les dépenses des adjuvants de l’anesthésie générale, les produits de réanimation (l’éphédrine l’atropine…), et les médicaments utilisés en postopératoire (la morphine, paracétamol injectable, etc.).
119
L’hôpital militaire d’instruction Mohammed V de Rabat, a connu une augmentation de son activité générale, due à l’accroissement des conventions qui lient cet établissement avec certains organismes de prévoyance sociale, ce qui explique l’augmentation du budget médicamenteux de 20.61 % entre l’année 2006 et 2007.
Le total de la consommation en médicaments de l’anesthésie générale, pour l’année 2006, représente 16.53% de la dépense pharmaceutique pour cette année. Cette valeur concorde à peu prêt avec le résultat d’une étude réalisée en France qui précise que la part du médicament dans une anesthésie se situe aux alentours de 20% [113].
Pour l’année 2007 cette consommation représente 7.08 % des dépenses en médicament pour cette année, ce qui est comparable aux dépenses de médicaments de l'anesthésie qui représentent 5 % du budget de la pharmacie de l'hôpital universitaire Dupuytren de Limoges en France [114].
D’après les résultats des consommations en anesthésiques généraux des deux années 2006 et 2007, qui sont respectivement 5 166 623.16 DH et 2 788 380.70 DH, on réalise une économie de 2 318 242.46 DH, donc on assiste à une baisse énorme au niveau de cette dépense équivalente à 46%.
Cette baisse peu être expliqué par les efforts fait part tous le corps médicale que ce soit anesthésistes ou pharmaciens pour rationnaliser l’usage de ces
120
produits crucials à toute acte chirurgicale, et ceci grâce à plusieurs stratégie qu’on va citer au fur et à mesure de la discussion.
a) Etat de consommation en anesthésiques généraux intraveineux :
A partir du graphique de la figure 22 la consommation générale en AG intraveineux pour l’année 2007 représente la moitié de celle de l’année 2006. Donc on assiste à une tendance à baisser la consommation des AG intraveineux est ceci est remarquable quand on revoie les résultats de la consommation détaillé de cette catégorie d’AG.
A l’intérieur du poste budgétaire pharmaceutique des AG intraveineux, c’est la consommation de propofol DIPRIVAN® 200 mg qui représente la part la plus importante avec un pourcentage de 44,16 % en 2006 et de 45,82 % en 2007.
Cette valeur élevée n’engendre pas un surcoût non justifiable du fait qu’il donne une rapidité et une bonne qualité du réveil, associés à un effet antiémétique qui en font un agent particulièrement adapté à la pratique ambulatoire et à l'anesthésie des patients âgés. La reproductibilité de la relation dose-effet et la possibilité de maintenir une ventilation spontanée adéquate sont particulièrement intéressantes pour les gestes pratiqués " en dehors du bloc opératoire " mais aussi pour la sédation de complément de l'anesthésie locorégionale. Ses effets hémodynamiques peuvent être facilement prévenus ou corrigés s'il n'est pas administré à des patients hypovolémiques ou ayant une fonction cardiovasculaire précaire [20].
121
Même si son prix est supérieur d’un facteur de 2,3 par rapport au thiopental, les qualités du propofol en font le successeur tout désigné du thiopental en tant qu'agent d'induction IV de référence [20].
En 2007, l’hôpital militaire d’instruction de Rabat a introduit une nouvelle présentation du propofol DIPRIVAN® 500 mg dont le prix de revient est plus cher que le DIPRIVAN® 200 mg. La forme 500 mg a été vite abandonnée ce qui explique sa consommation très basse.
Dans cette même classe des AG intraveineux on remarque qu’il y a eu une diminution de la consommation en thiopental PENTHIOBARBITAL® 1g de l’année 2006 à 2007 de 83,28 %. Cette diminution en pourcentage de consommation en AG intraveineux pour l’année 2007 peut être expliquée par son remplacement progressif par le propofol injectable 200 mg.
Une autre étude réalisée à Casablanca en 2001 dont le but était d'évaluer la qualité de la technique anesthésique pour sismothérapie en comparant deux produits anesthésiques: propofol versus thiopental. Cette étude a montré que la qualité de la technique anesthésique est excellente pour les deux groupes (délai d'action rapide, narcose profonde, relâchement musculaire satisfaisant), le réveil postanesthésique est de meilleure qualité avec un délai de réveil inférieur à 10 mn dans les deux groupes, et les patients quittent la salle de soins postinterventionnelles (SSPI) dans l'heure qui suit. Les effets secondaires sont
122
essentiellement à type d'irritation veineuse et d'hypotension artérielle surtout avec le groupe propofol [115].
Le midazolam HYPNOVEL® représentait 24,64 % de la consommation en AG intraveineux de 2006 et 39,95 % en 2007, ce produit est important en prémédication et présente un coût intéressant avoisinant les 10 DH. Il remplace avantageusement le diazépam et le flunitrazépam dans la prévention des troubles psychodysleptiques dus à la kétamine. Par ailleurs il est administré par voie intranasale, rectale ou sublinguale, c’est un agent de prémédication rapide et d’action courte surtout chez l’enfant.
L’étomidate HYPNOMIDATE® 2 mg représente 11.69 % de la consommation en anesthésiques généraux intraveineux de l’année 2006, et 3.84 % en 2007. Cette consommation a subit une baisse importante de 83.88 % entres ces deux année. Ceci peu être expliquer par son remplacement progressive par le DIPRIVAN® 200 mg, car contrairement à ce dernier l’étomidate présente certains défauts telle que ; son effet antianalgésique, comme pour le thiopental, donc il doit être pratiquement toujours associé à un morphinique et un mélange de N2O-O2, son effet épileptogène, les vomissements et nausées postopératoire qu’il induit et aussi son effet dépresseur sur la fonction corticosurrénalienne.
La Kétamine est un anesthésique général très intéressant, que l’hôpital militaire d’instruction Mohamed V de Rabat importe de l’étranger, c’est un produit qui coûte environ 18 DH (prix hospitalier) pour l’ampoule injectable
123
KETALAR® 50 mg, et représente le produit idéal chez les grands brûlés. Ces patients ont besoin d’une analgésie puissante et sont souvent hypovolémiques.
Ce produit a été importé en 2006 sous deux présentation ; KETALAR® 50 mg et KETALAR® 100 mg qui représentaient respectivement 2,07 % et 3,64 % de la consommation des AG intraveineux de cette année. En 2007 l’hôpital militaire d’instruction de Rabat n’importer que le KETALAR®
50 mg qui représentait 0,36 % de la consommation des AG intraveineux pour cette année. Cette faible consommation peut être expliquée par la faible activité du service des brulés.
La kétamine est un agent anesthésique dont les propriétés pharmacologiques, les différentes voies d'administration, la possibilité de réaliser des gestes invasifs en préservant la ventilation spontanée et le faible coût en font un agent de choix en milieu tropical. Les effets secondaires psychodysleptiques peuvent être prévenus par l'association à du midazolam ou du propofol, et l'hypersécrétion salivaire par de l'atropine. Ces dernières années, du fait de ses propriétés antihyperalgésiques, la kétamine est utilisée dans l'analgésie post-opératoire à des doses dix fois moins importantes que celles utilisées en anesthésie. [116]
Le flunitrazépam NARCOZEP® représentait 0,43 % de la consommation en anesthésique intraveineux de l’année 2006. En 2007 l’hôpital militaire d’instruction a cessé de l’utiliser pour l’induction d’anesthésie en raison de sa durée d'action extrêmement longue et par conséquence un prolongement de la durée de séjour du patient au niveau de la Salle de Soins Postinterventionnelles, donc il engendre un surcoût.
124
Pareil pour le GAMMA-OH est aussi abandonné en 2007 car il n’a pas un grand intérêt en anesthésie.
b) Consommation en anesthésique généraux inhalatoires :
La consommation générale en AG inhalatoire a passé de 989 900.56 DH pour 2006 à 1 064 836.96 DH pour 2007, donc une élévation de cette consommation de 7.03 % entre ces deux années.
Quand on compare d’une part la consommation en AG intraveineux pour les deux années 2006 et 2007 et d’autre part celle des inhalatoire pour les mêmes années, en remarque qu’il y a une baisse important de 51.02 % pour la consommation en intraveineux et une légère augmentation de 7.03 % pour les inhalatoire. Donc il y a une tendance à diminuer la consommation en AG intraveineux contre une augmentation d’utilisation des AG inhalatoires, dans les effets sont importants sur la baisse du budget médicamenteux destiné aux anesthésiques généraux.
Il a été démontré que l’utilisation des nouveaux AVH (anesthésiques volatils halogénés) ne génère pas un surcoût médicamenteux periopératoire significatif lorsque l’administration se fait à faible débit de gaz frais. Par contre, dans tous les cas l’anesthésie générale utilisant des AVH coûte moins cher que l’anesthésie générale par voie intraveineuse utilisant du propofol [117, 118]
. Ceci est confirmé par une étude réalisée par Boussalem A, Volot F, Musat A, Wilkening M. au CHU de Dijon, qui présume que le coût moyen d’une anesthésie générale utilisant le sévoflurane est inferieur d’un tiers à celui d’une anesthésie générale utilisant le propofol [119].
125
Dans notre étude ; l’enflurane (ETHRANE® 250 ml), utilisé en 2006 avec un pourcentage de 2.57 %, et abandonné en 2007 du fait que c’est un produit qui coûte (800 DH/flacon de 250 ml), donc plus chère que l’halothane (avec un facteur de 2.35), l’isoflurane (FORENE® 100 ml) (avec un facteur de 1.6), et dont les qualités pharmacocinétiques et pharmacodynamiques ne sont pas supérieur à ces dernier.
La consommation en halothane a connu une baisse importante de 84.13 % entre l’année 2006 et 2007, contre une augmentation accru de 26.87 % en consommation du sévorane. Ceci engendre un surcoût mais qui peut être justifiable car :
Premièrement comparés à l’isoflurane et l’halothane, le sévorane est essentiellement caractérisé par une cinétique plus rapide.
Deuxièmement l’halothane est contre indiqué chez les patients à risque majoré d’hypertension intracrânienne. L’isoflurane, et le sévoflurane préserve l’autorégulation en réponse aux variations de pression de perfusion contrairement à l’halothane. Le sévorane n’induit pas une vasodilatation coronaire aussi marquée que l’isoflurane et ne semblent pas induire de vol coronaire ; raison qui contre indique l’isoflurane chez les patients au réseau coronaire très pathologique particulièrement si une dysfonction ventriculaire est associée.
Troisièmement l’halothane est suspect d’une importante toxicité hépatique résultant de réactions immunologiques, l’isoflurane la présente à un degré moins important.
126
Dernièrement le FLUOTHANE® a été retiré du marcher international.
L’année 2007 à connu aussi une introduction d’une nouvelle présentation d’isoflurane : FORENE®
250 ml dont le coût dépasse 1900 DH/flacon de 250 ml, cette dernière présente un surcoût non justifiable du fait que la présentation utilisée en 2006 : FORENE 100ml revient beaucoup moins chère (502.80 DH/flacon de 100 ml).
c) Consommation en antalgiques opioïdes :
Cette consommation à connu une régression de 51.01 % de l’année 2006 à l’année 2007.
En 2006 trois produit était utilisés ; le fentanyl avec un pourcentage de 95.24 % ; suivi de l’alfentanyl et le sufentanyl dont les pourcentages respectives sont 2.41 % et 2.35 %.
En 2007 le fentanyl reste toujours le plus utilisé avec 95.19 % de la consommation en opioïdes, mais dont le nombre d’unité consommée a baissé de 45.76 %. Cette année a connu aussi l’arrêt d’usage du sufentanyl au niveau de l’hôpital militaire d’instruction Rabat, ce qui laisse l’alfentanyl représenter le reste de la consommation en opioïdes pour cette année.
Le fentanyl est un morphinomimétique très puissant qui provoque une analgésie chirurgicale environ 50 à 100 fois supérieure à celle de la morphine, c’est aussi le moins cher (18.64 DH/ampoule injectable de 10 ml) de cette catégorie, donc c’est un produit qui préserve la balance coût
127
- efficacité, ainsi il peut être considéré comme un produit de référence par rapport aux opioïdes utilisés mais aussi aux produits qui pourrait être introduit dans le future (Rémifentanil par exemple).
L’alfentanil possède une action rapide, brève et une puissance analgésique 7 fois moindre que celle du fentanyl, ainsi qu’un début d'action très rapide (¼ du fentanyl) ; une durée d'action très courte (1/3 du fentanyl), son coût est le plus chère de ces trois produits (34.35 DH/ampoule injectable de 10 ml).
Le sufentanil est un morphinomimétique très puissant 7 à 10 fois plus puissant que le fentanyl chez l'homme. Il présente une marge de sécurité plus élevée que celle du fentanyl et de la morphine. Par voie intraveineuse, le délai d'action est court, l'accumulation limitée, et l'élimination rapide des sites tissulaires de stockage permettent un réveil rapide. Son coût (26.80 DH/ampoule injectable de 1ml) revient donc plus cher que l’alfentanil.
d) Consommation en matière des curares :
D’après le tableau XI ainsi que le graphique de la figure 21 on remarque qu’il y a eu une baisse importante en consommation des curares entre l’année 2006 et 2007 avec un taux avoisinant les 75 %.
Au niveau de ce même poste budgétaire pharmaceutique ; le curare le plus utilisé en 2006 était le vécuronium NORCURON® 10 mg avec un totale de 975407,64 DH et un pourcentage de 61,06 %. Cette même consommation a chuté pour arriver en 2007 à 85140 DH soit un pourcentage de 20,75 % en consommation des curares pour cette année. Ceci peut être expliqué par le remplacement progressive du NORCURON® 10 mg par le NORCURON® 4 mg
128
mais surtout par le rocuronium ESMERON® qui est introduit en 2007 et représente 34,47 % de la consommation en curare pour cette année.
Le rocuronium est un curare de durée d’action intermédiaire tous comme le l’atracurium et le vécuronium, sa puissance est environ cinq à huit fois moins que celle de ce dernier. Son prix d’achat est plus cher que celui du vécuronium mais reste moins cher que l’atracurium.
L’atracurium TRACURIUM®
vient en 4ème place dans l’échelle de classement des curares à durée d’action intermédiaire selon la consommation pour l’année 2007, alors qu’il occupait la 2ème
place dans la même échelle pour l’année 2006. Cette régression de l’utilisation de ce produit génère une économie pour l’hôpital du fait que ce produit coûte 73 DH alors que le vécuronium coûte 29 DH. De point de vue puissance le vécuronium est le plus puissant de cette catégorie ; pour l’atracurium la durée d'action totale au niveau du pouce est d'une trentaine de minutes à la dose de 200 μg/kg, alors que pour le vécuronium la durée d'action clinique à l'adducteur du pouce est de 30 à 40 minutes, après injection d'un bolus de 100 μg/kg. [92]
Dans la catégorie des curares de courte durée d’action on trouve le mivacurium MIVACRON® ; curare non dépolarisant qui a été utilisé qu’en 2006 avec un pourcentage en consommation des curares de avoisinant les 10,93 %. On trouve aussi dans cette même catégorie le suxaméthonium CELOCURINE® qui a été utilisé en 2006 avec un taux très bas de 135,85 DH et en 2007 avec un taux de 6528 DH ce qui nous donne une régression en consommation entre ces deux années avoisinant les 98 %, donc pour cette catégorie il y a remplacement
129
du mivacurium (72,19 DH) par suxaméthonium dont le prix est trois fois moins cher que ce dernier.
Dans la catégorie des curares de longue durée d’action on a le pancuronium PAVULAN® qui vient en quatrième place dans le classement des curares selon le pourcentage de consommation pour les deux années 2006 et 2007. Son utilisation en 2006 était plus importante que celle de l’année 2007. Sa consommation est modulée par la fréquence des actes chirurgicaux nécessitant une curarisation de longue durée du fait que sa durée d'action totale d'une dose de 70 μg/kg est de 99 minutes [92]
130
Il est admis que l'anesthésie générale associe, à des degrés divers, anxiolyse, amnésie, sédation, hypnose, analgésie et myorelaxation. Les principales familles d'agents employés pour obtenir ces états sont les hypnotiques, les analgésiques morphiniques et les curares [1]. Donc l'anesthésie ainsi que la réanimation font appel à de nombreux médicaments de plus en plus
performants, en règle générale plus chers que leurs prédécesseurs et qui sont à l'origine d'une augmentation des dépenses pharmaceutiques des hôpitaux. Ces dépenses doivent donc être évaluées et optimisées autant que possible, c’est dans ce cadre que vient la pharmacoéconomie ; branche de la recherche évaluative qui cherche à identifier, mesurer et évaluer les traitements
pharmacologiques [2].
Le présent travail vient mettre la lumière sur l’étude pharmacoéconomique des anesthésiques généraux à l’hôpital militaire d’instruction de Rabat dont les objectifs sont :
La présentation des dépenses de l’hôpital militaire d’instruction de RABAT en matière d’anesthésiques généraux.
La discussion de l'attitude des anesthésistes en exercice au regard de l’utilisation des anesthésiques généraux.
La formulation de propositions pour les décideurs dans le but d’améliorer et de rationaliser les dépenses en matière de la consommation de ces médicaments.
Ce travail rappelle aussi les propriétés pharmacothérapeutiques des
anesthésiques généraux et surtout sur leurs caractères pharmacocinétiques et pharmacodynamiques dont la connaissance est importante pour la pratique
131
quotidienne des anesthésistes mais aussi pour la prévention des conséquences délétères du surdosage et de ses effets indésirables.
A. Définition de l’anesthésie : [3, 4]
On entend par anesthésie l’abolition de toutes les sensibilités périphériques, qu’elles soient tactiles, kinesthésiques, douloureuses ou thermiques.
L’anesthésie s’efforce avant tout de permettre la réalisation d’interventions sur l’intégrité du corps sans douleur. Il s’agit aussi bien d’interventions
chirurgicales classiques que de gestes peu invasifs, ainsi que certaines démarches de diagnostiques invasives et de plus en plus souvent de gestes thérapeutiques à l’aide de techniques d’imagerie.
1- L’anesthésie générale : [3, 5]
C’est une diminution réversible, induite pharmacologiquement, de la fonction du système nerveux central avec abolition sensorielle complète permettant la réalisation de gestes chirurgicaux, diagnostiques ou interventionnels. C’est le synonyme de narcose, et elle comprend l’anesthésie de tout le corps et s’accompagne toujours d’une abolition ou, au moins, d’une diminution de la conscience.
Pour sa réalisation on dispose d’agents anesthésiques inhalatoires (administrés par voie pulmonaire) et d’agents injectables par voie intraveineuse, tous deux ayant comme cible d’action le système nerveux central.
Il y a aussi la notion d’anesthésie balancée qui est la combinaison de l’anesthésie inhalatoire et intraveineuse.
132 2- Anesthésie locale : [6 - 8]
Une anesthésie dite "locale" est pratiquée par injection dans les tissus opérés d'un produit anesthésique locale. Le patient reste conscient mais ne ressent pas la douleur de l'intervention.
Les anesthésique locaux (AL) agissent au niveau de la face interne de la membrane cellulaire du neurone périphérique (mais aussi des cellules excitables du système nerveux central et du cœur) où ils bloquent le canal sodique en entraînant une diminution de l’amplitude du potentiel d’action, une diminution de la vitesse de dépolarisation et une augmentation de la durée de la période réfractaire. À partir d’une certaine concentration de l’AL, la
membrane devient totalement inexcitable.
C’est la première famille pour laquelle ont été développées les relations entre la structure chimique et l’activité des molécules.
Les AL sont des bases faibles constituées de trois parties : un pôle lipophile (noyau aromatique), un pôle hydrophile (dérivé aminé) et une chaîne
intermédiaire porteuse d’une liaison ester ou amide. Les composés esters sont très rapidement métabolisés dans le sérum par l’intermédiaire de
cholinestérases. Leur métabolisme produit de l’acide para-amino-benzoïque à fort pouvoir allergisant. Ils sont donc actuellement très peu utilisés. Les
composés amides ont un métabolisme plus lent au niveau des microsomes hépatiques (cytochrome P450).
133 3- Anesthésie loco-régionale : [3]
Limitée à certaines parties du corps pendant que la conscience et la ventilation sont maintenues. On distingue deux types d’anesthésies locorégionales, au cours desquelles on applique des médicaments particuliers, les anesthésiques locaux, non pas par voie systémique, mais au contact des structures nerveuses, afin d’en abolir sélectivement la stimulation et la conduction :
a- Anesthésie médullaire ou « bloc central » où l’anesthésique local est administré à proximité de la moelle (rachianesthésie, anesthésie péridurale, caudale).
b- Le bloc périphérique qui est réalisé par administration de l’anesthésique local à proximité des nerfs (plexiques, tronculaires…).
4- Anesthésie combinée : [5]
Dans certaines circonstances, l’anesthésie générale et locorégionale peuvent être avantageusement associées ; ainsi on parle d’anesthésie combinée. Ce type d’anesthésie doit être distingué de l’anesthésie balancée qui utilise une association d’anesthésiques intraveineux (en général pour l’induction) et inhalatoire (pour l’entretien).
Cette technique d’anesthésie permet de diminuer la « profondeur » de l'anesthésie générale, réduit le stress chirurgical grâce à l'anesthésie
locorégionale et donne d’une part un confort de qualité, tant pour le chirurgien que pour le malade, et d’autre part une diminution de la durée de la ventilation mécanique, et donc diminution de risque de complications respiratoires
134
B. Rappel physiologique sur la douleur: [5-14]
D’après l’IASP (International Association for the Study of Pain) la douleur est « une sensation désagréable et une expérience émotionnelle en réponse à une atteinte tissulaire réelle ou potentielle ou décrite en ces termes ». La douleur est une sensation dont la perception peut être modulée en fonction de la situation psychologique de l’individu, mais aussi en fonction de
l’environnement dans lequel il se situe, au sens le plus large du terme (affectif, socioculturel, ethnologique, religieux...).
La douleur est donc une expérience s’articulant autour de quatre composantes fondamentales :
(1) sensori-discriminative ; (2) affective et émotionnelle ;
(3) cognitive ; (4) comportementale.
En s’intéressant à la première composante sensori-discriminative de la douleur, selon Sherrington, neurophysiologiste anglais de la fin du XIXème siècle, a créé le terme de « nociception » qui caractérisait des stimulations sensorielles de haute intensité, celles qui étaient « susceptibles de remettre en cause l’intégrité physique de l’organisme ».
Les nerfs périphériques assurent la transmission centripète et centrifuge de trois types d’informations qui sont relatives à la somesthésie, la motricité somatique et le système végétatif. Les messages nociceptifs sont générés au niveau des terminaisons libres amyéliniques, par la libération locale de substances algogènes (histamine, sérotonine, prostaglandines, leucotriènes, ions H+ et K+ ...) constituant des arborisations plexiformes dans les tissus cutanés, musculaires et articulaires.
135
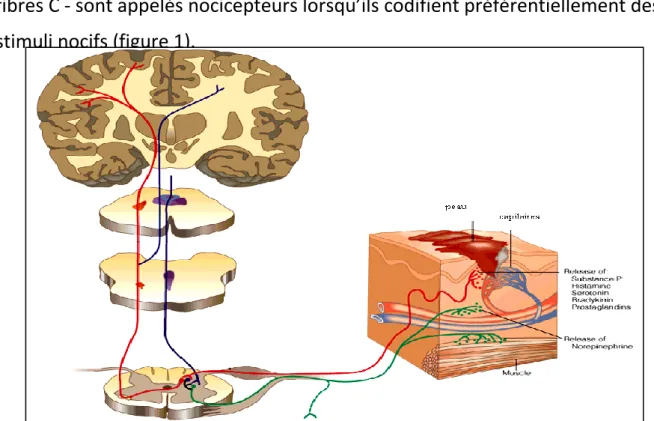
Les messages sont ensuite véhiculés par des fibres nerveuses périphériques qui, rassemblées au sein des nerfs, envoient leurs messages vers la moelle épinière où s’effectue le premier relais. Ces protoneurones à terminaisons libres dont les fibres sont faiblement myélinisées – fibres Aδ - ou amyéliniques - fibres C - sont appelés nocicepteurs lorsqu’ils codifient préférentiellement des stimuli nocifs (figure 1).
Figure 1 : Circuit de la douleur.
La très grande majorité des fibres afférentes primaires atteignent le système nerveux central par les racines rachidiennes postérieures ou leurs équivalents au niveau des nerfs crâniens.
Les fibres Aβ qui acheminent les informations tactiles et proprioceptives, envoient leurs axones en partie vers la substance grise médullaire de la corne postérieure (couches III à V mais centré sur IV) dont les terminaisons sont
136
étalées sur plusieurs segments et en partie via les cordons postérieurs vers les noyaux correspondants situés dans la partie caudale du bulbe (figure 2).
Les fibres Aδ et C quant à elles se divisent en une branche ascendante et une branche descendante qui émettent des collatérales vers la corne postérieure de la moelle sur quelques segments adjacents. On y constate une convergence anatomique des afférences nociceptives cutanées, musculaires et viscérales dans les couches I et V (Figure 2), on constate également une forte dispersion rostrocaudale des afférences.
Figure 2 : Schéma des projections centrales des fibres cutanées. [5] Les neurones de la couche I (neurones nociceptifs spécifiques) et les neurones de la couche V (neurones nociceptifs non spécifiques ou neurones convergents) donnent ensuite naissance :
a) au faisceau néo-spino-thalamique et au faisceau paléo-spino-thalamique dont les fibres décussent au niveau de la commissure grise antérieure et cheminent dans le quadrant antéro-latéral de la moëlle.
137 b) au faisceau spino-réticulaire
c) au faisceau spino-ponto-encéphalique
Le stimulus nociceptif atteint le thalamus par l'intermédiaire du faisceau spino-thalamique. C'est à ce niveau que la douleur est reconnue en tant que telle (identification de la douleur). Du thalamus partent des connexions avec le cortex et une dérivation avec le système limbique, ce dernier est situé entre le cerveau et le tronc cérébral, il confère à la douleur sont caractère émotionnel (douleur affective). Les projections corticales, dans le gyrus postcentralis,
permettent la localisation de la douleur, sa perception consciente et le « vécu » de la douleur.
En dehors du thalamus, les stimuli nociceptifs traversent la substance réticulée pour se diriger par des voies controlatérales, vers des noyaux moteurs du tronc cérébral et l’hypothalamus. Au niveau de la substance réticulée, les stimuli nociceptifs afférents induisent une augmentation de la vigilance.
Les voies efférentes, issues des noyaux moteurs du tronc cérébral, sont à l’origine des réflexes physiologiques de fuite et des réactions de défense liés à la douleur.
Les réactions végétatives à la douleur sont initiées depuis l’hypothalamus, en empruntant également des connexions efférentes. Ceci entraîne l’activation du système sympathique ainsi on a une augmentation de la pression artérielle, de la fréquence cardiaque, de la fréquence respiratoire, une sudation, une dilatation de la pupille … il s’ensuit une augmentation significative des besoins énergétiques et une consommation en oxygène de l’organisme « réaction de stress ».
138
Les effets principaux de l’anesthésie générale sont l’hypnose ; l’analgésie et la relaxation musculaire. Ces effets sont obtenus par action sur différentes parties du système nerveux central.
1- Effet hypnotique : [3]
Jusqu’à présent, il n’existe pas d’explication neurobiologique ou
neurophysiologique à l’origine de la conscience dans les réseaux neuronaux. Il est cependant acquis qu’elle n’est pas un état en soi, clairement relié à un seul centre cérébral bien délimité. La conscience se développe donc à partir
d’interactions spécifiques entre différents centres cérébraux et pourrait être considérée comme la résultante d’un équilibre entre influx sous cortical et réponse corticale.
Le sommeil est la conséquence de l’arrêt direct ou indirect de l’activité du cortex. Deux types de sommeil sont a distingués :
Le sommeil physiologique (sommeil nocturne). Le sommeil induit artificiellement (hypnose).
L’hypnose correspond à un phénomène naturel, à un état modifié de conscience naturelle qui se produit dans notre vie quotidienne, lorsque notre attention « se déconnecte » et s’évade [15].
139
L’effet hypnotique indirect provient d’une inhibition des voies afférentes des noyaux médians de la formation réticulée, structure qui s’étend comme un réseau neuronal à travers tout les troncs cérébraux et qui régule entre autre l’état d’activité corticale et par conséquent le niveau de l’éveil et de la vigilance (système réticulé ascendant activateur : SRAA). C’est la formation réticulée qui génère le cycle éveil-sommeil physiologique. La destruction de la formation réticulée, par exemple lors d’un traumatisme, entraîne la perte de conscience (coma). Les agents sédatifs, hypnotiques et anesthésiques agissent sur ce système, en interrompant, à des niveaux d’expression différents, la conduction des stimulations d’éveil ascendantes (désafférentation). A la différence du sommeil physiologique, les hypnotiques et les anesthésiques peuvent aussi entraîner une abolition de la conscience par un effet direct sur le cortex. La période de sommeil artificiel est accompagnée, en général, une amnésie du fait que les stimuli externes n’atteignent plus la conscience et ne peuvent donc plus être mémorisés. L’amnésie devrait donc faire partie intégrante de
l’anesthésie.
2- Effet analgésique : [3]
Le système extrêmement complexe de génération et d’intégration de la douleur explique que la seule abolition de la conscience ne suffit pas pour obtenir une analgésie cliniquement satisfaisante, c’est-à-dire inhibant également les réactions à la douleur. Seuls des médicaments agissants sur l’intégration de la douleur par le système nerveux central peuvent engendrer une analgésie adéquate caractérisée par la notion « d’analgésie somatique ». Son mécanisme peut être global comme c’est le cas les anesthésiques généraux ou sélectif, par action sur les mécanismes de contrôle des voies nociceptives (les opioïdes).
140 3- effet myorelaxant : [3]
Brièvement le relâchement dit « central » est le relâchement du muscle squelettique induit par des anesthésiques provient surtout de l’inhibition des centres moteurs supérieurs et des ganglions du tronc qui interviennent dans le tonus musculaire, mais également par inhibition des voies médullaires
ascendantes de la motricité, donc on a une diminution du tonus musculaire et une inhibition des réflexes poly-synaptiques.
Cet effet est remarqué essentiellement chez les benzodiazépines sédatives en tant qu’effet secondaire, par contre le mécanisme des agents dit
myorelaxants spécifiques n’est pas central mais périphérique, par inhibition de la transmission neuromusculaire par action sélective sur les récepteurs situés au niveau de la plaque motrice.
L’avantage de ces agents myorelaxants est de permettre une relaxation complète sans nécessiter l’obtention d’un stade profond d’anesthésie,
réduisant ainsi les effets secondaires et les risques cardio-circulatoire. En raison des mécanismes d’action différents, la combinaison d’anesthésiques à
relâchement central, et de myorelaxants périphériques permet d’obtenir une potentialisation de leurs effets.
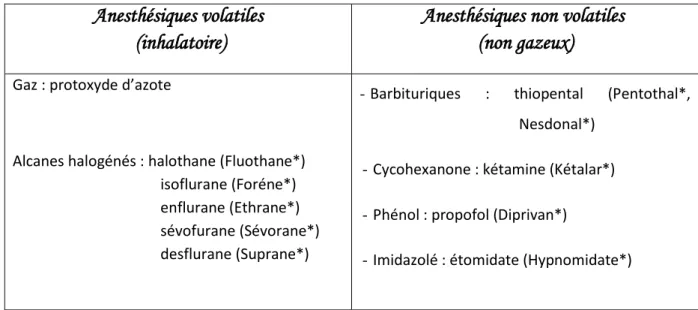
141 I. Classifications : [16]
La classification des anesthésiques généraux, par opposition aux anesthésiques locaux, se caractérise par la grande diversité chimique des produits utilisés, comme le montre le (tableau I), ceci rend difficile l’utilisation d’une
classification chimique des anesthésiques généraux.
Tableau I : Classification chimique des anesthésiques généraux.
Anesthésiques volatiles (inhalatoire)
Anesthésiques non volatiles (non gazeux)
Gaz : protoxyde d’azote
Alcanes halogénés : halothane (Fluothane*) isoflurane (Foréne*) enflurane (Ethrane*) sévofurane (Sévorane*) desflurane (Suprane*)
- Barbituriques : thiopental (Pentothal*, Nesdonal*)
- Cycohexanone : kétamine (Kétalar*) - Phénol : propofol (Diprivan*)
- Imidazolé : étomidate (Hypnomidate*)
Néanmoins il existe d’autres classifications qui sont plus maniables ; dont la classification galénique qui nous permet de distinguer : les anesthésiques généraux volatiles administrés par inhalation, et les intraveineux qui sont administrés par voie parentérale.
Enfin il y a la classification cinétique qui a une grande importance dans le domaine de la chirurgie du fait qu’elle classe les anesthésiques généraux selon la durée d’action et la rapidité du réveil (tableau II).
Tableau II : Classification cinétique des anesthésiques généraux.
DESTINATION DUREE D’ACTION
Thiopental 3 à 5 minutes [24]
142
Kétamine 5 à 10 minutes (pour la forme intraveineuse) [41]
Etomidate 4 à 6 minutes [61] Suxaméthonium 12 minutes [91] mivacurium 30 minutes [91] Vécuronium 30 à 40 minutes [91] Pancuronium 64 à 160 minutes [91] Fentanyl 30 minutes [88] sufentanyl 3 heurs [90]
II. Mécanisme d’action : [16]
Il n'est pas facile aujourd'hui d'expliquer l'effet d'anesthésie générale par un mécanisme d'action unique ou univoque. Plusieurs obstacles s'y opposent :
La diversité chimique des produits ; La faible affinité (ordre du millimolaire) ;
L’inaccessibilité aux études de binding en raison de constantes de dissociation trop rapides ;
L’excès de travaux expérimentaux recourant à des concentrations trop élevées de produits (doses supra-anesthésiantes) et obérant ainsi les analyses et interprétations sur les mécanismes d'action.
Mais, il est admis que les anesthésiques généraux agissent au niveau du système nerveux central en modulant la transmission synaptique, ceci peut être expliqué par deux théories :
1. Théorie biophysique :
[17, 18]Vers 1900, Meyer et Overton ont corrélé le pouvoir anesthésiant d’un agent à sa solubilité dans l’huile. Leur « théorie lipidique », selon laquelle les
143
anesthésiques perturbaient les membranes phospholipidiques neuronales, ceci a été admise pendant près de 80 ans avant d’être invalidée par les travaux de Franks et Lieb, qui ont montré que les perturbations des membranes produites par des concentrations cliniques d’anesthésiques pouvaient également l’être par des modifications de la température ambiante de moins de 1 °C (cas de fièvre) phénomène qui n'induit pas d'anesthésie.
2. Théorie biochimique :
[1, 5, 16, 19]Cette théorie est basée sur le fait que certains anesthésiques, essentiellement intraveineux, se fixent sur des récepteurs protéiques de la membrane ou des organelles, entraînant des effets directs sur le transport ionique transcellulaire, sur le métabolisme enzymatique intracellulaire, ou sur la fonction des
neurotransmetteurs.
Au niveau de la membrane cellulaire les zones de fixation peuvent être : La protéine cellulaire elle-même ;
Les modulateurs de la protéine cellulaire ; La membrane lipidique environnante ; Une combinaison de plusieurs sites.
La stimulation de certains récepteurs induit des effets spécifiques en fonction de leur type, de leur densité et de leur répartition dans le système nerveux central.
Les interactions avec des récepteurs expliqueraient ainsi les effets
anxiolytiques et sédatifs des benzodiazépines, l’effet hypnotique du propofol et de l’étomidate, mais aussi l’analgésie induite par les opioïdes, ainsi que certains effets de la kétamine. Plus de 30 types de ces récepteurs canaux sont impliqués dans les effets des anesthésiques, parmi ces récepteurs on peut citer :
144
a- Les récepteurs ionotropes au glutamate :
Les récepteurs de type NMDA sont sensibles aux effets inhibiteurs des alkanols et de la kétamine mais insensibles au pentobarbital. Les anesthésiques volatiles n'exercent qu'un faible effet sur ces récepteurs et doivent plutôt être
considérés comme des inhibiteurs du relargage du glutamate.
Figure 3 : Les récepteurs de type NMDA.
Il y a aussi les récepteurs de type AMPA et kaïnate qui sont fortement inhibés par l'éthanol et d'autres alcools à chaîne courte. L'enflurane, l'halothane et l'isoflurane inhibent la fonction des récepteurs Glu R3 et potentialisent celle des Glu R6.
b- Les récepteurs GABA-A :
Le rôle clé joué par le GABA dans l'induction d'une anesthésie est démontré depuis longtemps. Le pentobarbital et de nombreux autres AG potentialisent l'inhibition médiée par le GABA. Le THIP, analogue du GABA produit chez le rat
145
et la souris, analgésie et sédation, et ceci par action sur des récepteurs dit GABA-A, il s'agit d'un récepteur-canal, perméable préférentiellement aux ions Cl- et accessoirement aux ions Br-. Une particularité du récepteur GABA-A est d'être modulé allostériquement par d'autres récepteurs qui favorisent ou inhibent l'effet du GABA. Ces récepteurs sont situés auprès des sites de fixation du GABA. Il s'agit des récepteurs aux benzodiazépines, aux barbituriques à l’étomidate et à certains stéroïdes. Ces substances favorisent l'effet du GABA.
Figure 4 : récepteurs de type GABA-A.
Ce récepteur GABA-A est mis en état d'hyperactivité par des AG volatiles (isoflurane, enflurane, halothane) et non volatiles (propofol). Tous les AG, à l'exception de la kétamine, agissent sur la fonction du récepteur GABA-A. c- Les récepteurs à la glycine
En rappelant que les récepteurs à la glycine jouent au niveau de la moelle épinière le même rôle d'inhibition que les récepteurs GABA-A dans les
structures plus supérieures du système nerveux central et qu'il existe une forte homologie dans la séquence des acides aminés de ces deux récepteurs, il n'est
146
pas étonnant de constater que tous les AG potentialisent les courants glycinergiques.
d- Les récepteurs nicotiniques :
L'enflurane et l'isoflurane inhibent la fonction du récepteur nicotinique de l'acétylcholine (nACh-R) en diminuant le temps d'ouverture moyen du canal. Les barbituriques inhibent également la fonction du nACh-R ; les alcools à chaîne longue agissent par occlusion de la lumière du canal ionique. L'éthanol agit après fixation sur le domaine extracellulaire à N-terminal du récepteur nicotinique a7 (en conséquence il potentialise le récepteur sérotoninergique 5HT3).
e- Les récepteurs 5HT3
Ce récepteur à la sérotonine, couplé à un canal ionique, est surtout présent dans l'area postrema (déclencheur de nausées, vomissements). Sa fonction est amplifiée par l'éthanol, le butanol, l'halothane et l'isoflurane. Le propofol n'a strictement aucune action sur le 5HT3 (ce produit est moins inducteur de nausées).
III. Les différentes familles d’anesthésiques généraux :
A. Agents anesthésiques intraveineux : 1. Les barbituriques : [5]
Il ne reste plus qu’un seul barbiturique disponible en anesthésie générale qui est le thiopental (Nesdonal®). Il est caractérisé par une action rapide et brève, mais sans être le produit idéal, ses caractéristiques cliniques en fait le standard de l’induction anesthésique.
147
Au niveau de certaines synapses spécifiques, dans le système nerveux central, les barbituriques exercent deux types d'effets : ils facilitent ou augmentent les actions synaptiques des neurotransmetteurs inhibiteurs et bloquent les actions synaptiques des neurotransmetteurs excitateurs. Ils majorent
l'hyperpolarisation induite par le GABA en augmentant le temps d'ouverture et en diminuant la fréquence d'ouverture du canal au chlore.
148
1.1 THIOPENTAL 1 g ou 0.5 mg : [20-22]
Historiquement le thiopental a été l'une des premières substances
administrées chez l'homme pour l'anesthésie intraveineuse. Synthétisé entre 1930 et 1935, c'est l'homologue soufré du pentobarbital, ses premiers essais cliniques ont été réalisés par Pratt et coll. à Madison dans le Wisconsin et par Lundy à la Mayo Clinic en 1934 et 1936. L'avènement du thiopental a permis le véritable essor de l'anesthésie intraveineuse. Son utilisation a été marqué par des accidents graves durant la Seconde Guerre mondiale où le thiopental a été administré, lors de la catastrophe de Pearl Harbor en 1941, à des blessés très hypovolémiques et sans enrichissement des gaz en oxygène, d’une façon rapide et à de fortes doses, les conséquences ont alors été dramatiques avec collapsus et asphyxie.
1.1.1 Propriétés physicochimiques : [5, 23]
Le thiopental est un barbiturique soufré de poids moléculaire 130, possédant un cycle malonylurée qui résulte de la condensation d'une molécule d'urée et de l'acide malonique qui est un acide dicarboxylique.
149
Figure 5 : structure chimique du Thiopental sodique.
Le nom chimique du sel sodique est 5-éthyl-5-(1-méthylbutyl)-2-thiobarbiturate sodique, sa formule chimique brute est NaSC11H17O2N2. Le thiopental est
soluble dans l'eau, c'est un acide faible dont le pKa est de 7.6, la fraction non ionisée est de 61 % à pH 7,4 [5]. Il est possible d'obtenir des solutions de sels de sodium de thiopental pour un pH de 10,5.
Le thiopental est très liposoluble. La liposolubilité est le déterminant principal qui conditionne la diffusion des médicaments dans l'organisme et en particulier à travers la barrière hémato-encéphalique.
1.1.2 Pharmacocinétique : a) Distribution : [24]
La pharmacocinétique du thiopental répondant à un modèle à trois
compartiments. Le compartiment V1 correspond au secteur vasculaire et au groupe des tissus richement vascularisés, c'est-à-dire cerveau, cœur, rein, foie, tube digestif, glandes endocrines, le compartiment V2 au territoire cutané et musculaire et enfin le compartiment V3 au territoire des graisses et des tissus peu vascularisés.
Comme pour tous les agents très liposolubles, les concentrations s'équilibrent aussitôt entre le système nerveux central et le plasma, mais la décroissance plasmatique est rapide car le médicament va rapidement diffuser dans le compartiment V2, puis vient la diffusion vers le compartiment V3 qui est plus lente.
150
Les concentrations plasmatiques deviennent inférieures aux concentrations minimales efficaces pour induire la narcose avant la fin de la phase de distribution. Cette phase est terminée quand l'équilibre entre les différents tissus est atteint, c'est-à-dire entre 2 et 4 heures après l'injection intraveineuse. La demi-vie de distribution de 2 à 4 minutes qui rend compte de la brièveté du sommeil anesthésique. [5]
b) Métabolisme : [24]
Le thiopental est entièrement métabolisé dans le foie par le système des mono-oxygénases au niveau du cytochrome P450. Il s'agit essentiellement de réaction d'oxydation aboutissant à la formation d'acide thiobarbiturique qui est pharmacologiquement inactif. Une très faible fraction (2-3 %) du thiopental est désulfurée au niveau hépatique en pentobarbital de façon très lente. Ces
métabolites sont ensuite glycuroconjugués et éliminés dans les urines. c) Elimination et clairance : [24]
La décroissance plasmatique correspond exclusivement à la phase d'élimination dont le t½ß entre 10 et12 heures.
La demi-vie d'élimination est inversement proportionnelle à la clairance qui est de 1,6 à 4,3 ml/kg/mn, ce qui correspond à un coefficient d'extraction
hépatique entre 0,08 et 0,20. Cette faible valeur de l'extraction hépatique explique que l'élimination du thiopental soit indépendante du débit sanguin hépatique et soit dépendante du métabolisme et de la fraction libre.
151
La demi-vie d'élimination est directement proportionnelle au volume de distribution. Le volume total apparent de distribution est entre 1,3 et 3,3 l/kg, en raison de son importante liposolubilité.
152 1.1.3 Pharmacodynamie :
Le thiopental fait partie du groupe des agents anesthésiques intraveineux au délai d'action le plus court [24].
a) Effet sur le système nerveux central : [5, 24]
A partir d'une dose de 6 mg/kg, la perte de conscience est obtenue en 30 à 45 secondes, ce délai d'action court est à rapporter à la liposolubilité élevée du thiopental qui franchit très rapidement la barrière hémato-encéphalique. La durée de la narcose du thiopental est entre 3 et 5 minutes pour les doses habituelles entre 5 et 8 mg/kg, cette durée courte s'explique par la rapidité de la redistribution.
La perte de conscience ne s'accompagne d'aucune analgésie, au contraire, il a été démontré qu'à doses faibles (25 à 150 mg), le thiopental diminue le seuil de perception de la douleur.
Le thiopental possède une activité anticonvulsivante uniquement aux doses anesthésiques comme la plupart des autres barbituriques.
Il a aussi une action électroencéphalographique (EEG) dose-dépendante, qui peut aller jusqu’au silence électrique pour une concentration plasmatique de plus de 5 mg/dL, et s’accompagne d’une diminution de la consommation cérébrale d’oxygène, etdu débit sanguin cérébral (DSC).
b) Effet sur le système nerveux autonome : [17]
Le thiopental déprime la transmission synaptique neuro-neuronale dans les ganglions sympathiques, et il inhibe également les effets de l'acétylcholine au niveau de la synapse neuro-effectrice du système parasympathique.
c) actions cardiovasculaires : [5]
Le thiopental est responsable d’une veinodilatation, donc d’une baisse de la précharge et du débit cardiaque, et d’une tachycardie réactionnelle qui
153
entraîne une chute de la pression artérielle, accentuée chez les hypertendus, traités ou non. Celle-ci s’accompagne d’un effet inotrope négatif qui peut être délétère en cas de pathologie cardiaque.
d) Action ventilatoire : [24]
Le thiopental induit une dépression des centres respiratoires qui aboutit à une apnée fréquente aux doses anesthésiques, et se prolonge après le retour de la ventilation spontanée. L'apnée est fonction de la dose et de la vitesse
d'injection. On remarque ainsi des diminutions identiques des réponses à l'hypercapnie et à l'hypoxie. Les réflexes laryngés et surtout trachéaux sont conservés, sauf pour de fortes doses.
e) Autre effets : [24]
Le thiopental diminue la tonicité et la motilité gastro-intestinales, ainsi que la pression intraoculaire, mais il ne modifie pas les fonctions rénales ou
hépatiques, ni la réponse médullosurrénalienne au stress chirurgical. Le thiopental ne modifie pas la motricité utérine aux doses anesthésiques habituelles. Il peut être utilisé pour l’induction d’une césarienne sans risque pour le fœtus.
154
1.1.4 Utilisation du thiopental en anesthésie : a) Prémédication :
Les barbituriques sont de mauvais agents de prémédication. Ils n'ont pas d'effet anxiolytique.
b) Anesthésie : [25]
Le thiopental sodique reste l’agent d’induction de référence à la dose de 3 à 6 mg kg–1. Il n’est cependant pas utilisé comme agent d’entretien, car il entraîne des réveils trop retardés.
c) Posologie
Les doses d'induction habituelles sont de 5 à 7 mg/kg. L'administration doit être intraveineuse stricte. Chez l'adulte, la solution utilisée est de 2,5 % et, chez le nouveau-né, le nourrisson et le petit enfant, de 1 %. Le thiopental est
incompatible en solution avec certains myorelaxants (en particulier le
vécuronium) entraînant un précipité et une obstruction de la voie de perfusion. La voie intramusculaire reste une voie d'exception en raison de la douleur vive à l'injection et des risques d'abcès et de nécrose musculaire.
155
2. Les anesthésiques généraux non barbituriques : 2.1 PROPOFOL 200 mg/20 ml : [5]
C’est un anesthésique intraveineux récent, et le dernier agent hypnotique intraveineux mis à la disposition de la communauté anesthésique. C’est le résultat de recherches menées au début des années 70 sur les dérivés alkyls du groupe phénol qui avait démontré une activité hypnotique chez l'animal.
2.1.1 Propriétés physicochimiques : [26, 27]
Le propofol est le 2,6 di-isopropylphénol (Figure 7), C’est un dérivé phénolique, de poids moléculaire 178.27.
Figure 6: Structure chimique du propofol.
Le propofol pur se présente sous la forme d'un liquide clair ou
discrètement jaune paille, très peu soluble dans l'eau (coefficient octanol/eau de 15 pour un pH = 7,4) et avec un pKa dans l'eau de 11.
Le propofol se présente sous forme de solutions dans une émulsion lipidique à base d'huile de soja, de phosphatides d'oeuf et de glycérol (d'où sa
156
couleur lactée), à une concentration à 1 ou 2%. Le mélange ne contient ni conservateur, ni agent antimicrobien.
2.1.2 Pharmacocinétique : [28]
Le profil pharmacocinétique du propofol se décrit à l’aide d’un modèle ouvert à 3 compartiments. Après un bolus unique, chez un adulte, on assiste à une distribution rapide du sang aux tissus (t1/2α = 1.8 à 8.3 min), et une
clairance métabolique élevée (t1/2β = 34 à 66 min), et une élimination finale
lente des tissus mal irrigués (t1/2γ = 184 à 480 min). Le propofol se distribue
dans de grands volumes comme on peut s’attendre de tout anesthésique très lipophile (tableau II).
Tableau III : caractères pharmacocinétique du propofol selon l’âge et l’indication. [29] Caractéristiques pharmacocinétiques Volume distribution (litre) Clairance plasmatique (litre/min) T ½ gamma (en min)
Anesthésie chez le nourrisson 0,95/kg 0,049/kg 320 Anesthésie chez l’enfant 0,72/kg 0,03/kg 735 Anesthésie chez l’adulte 18,9 1,77 355 Sédation, réanimation : adulte 2,27 1 353
157
La disparition de l’effet anesthésique ou sédatif du propofol après un seul bolus intraveineux ou une perfusion de maintien dépend de la
redistribution importante du SNC aux autres tissus et de la clairance métabolique élevée.
Le propofol est surtout métabolisé par conjugaison dans le foie en métabolites inactifs qui sont excrétés par les riens. Environ 50% de la dose administrée se transforme en glucuronide de propofol et le reste est constitué de conjugés du 1- et 4-glucuronide et 4-sulfate de 2,6-diisopropyl-1,4-quinol.
La clairance totale du propofol de l’organisme varie entre 1.6 L/min et 2.3 L/min, une telle clairance dépasse les estimations du débit sanguin
hépatique, ce qui évoque un métabolisme extrahépatique. Le propofol se lie fortement aux protéines (97 à 99%).
2.1.3 Pharmacodynamie :
a) Actions sur le système nerveux central : [27, 29] Effet hypnotique et action sur les fonctions cérébrales :
Le propofol est un anesthésique général d'action rapide (délai d'environ 30 s), de courte durée et permettant un contrôle facile du niveau d'anesthésie et un réveil généralement rapide et de bonne qualité (4 à 6 min après
injections itératives, 20 min après administration continue). C’est un
hypnotique dénué d'effet analgésique. Il interagit au niveau du site GABA, mais à un niveau distinct de celui des benzodiazépines.
Effet sur l’hémodynamique cérébrale :[27]
Bien que l'effet direct sur la vascularisation cérébrale in vitro semble être une vasodilatation, le propofol possède une action vasoconstrictive in vivo







![Figure 2 : Schéma des projections centrales des fibres cutanées. [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/15051838.695421/33.892.115.778.407.756/figure-schéma-projections-centrales-fibres-cutanées.webp)