Université Mohammed V
Faculté de Médecine et de Pharmacie, Rabat
Centre d’Etudes Doctorales des Sciences de la Vie et de la Santé
ANNEE: 2017 THESE N°: 19/16 CSVS
THESE DE DOCTORAT
Présentée et soutenue publiquement le 18 Juillet 2017
Par Mme Zineb TARHDA
CARACTERISATION
STRUCTURALE
ET
FONCTIONNELLE
DES
INTERACTIONS
IMPLIQUANT
LE
RECEPTEUR
CD36
ET
LA
KINASE
FYN
DANS
L’ATHEROSCLEROSE :
CONCEPTION
PAR
MODELISATION
ET
CRIBLAGE
IN
SILICO
Formation doctorale: Biologie médicale, pathologie humaine et expérimentale et environnement
Jury
Pr. Rachid SAILE Faculté des Sciences Ben Msik, Casablanca Président Pr. Anass KETTANI Faculté des Sciences Ben Msik, Casablanca Rapporteur Pr. Jaouad HARTI Faculté de Médecine et de Pharmacie, Rabat Rapporteur Pr. Rachid JAOUDI Faculté de Médecine et de Pharmacie, Rabat Rapporteur Pr. Mhammed ANSAR Faculté de Médecine et de Pharmacie, Rabat Examinateur Pr. Azeddine IBRAHIMI Faculté de Médecine et de Pharmacie, Rabat Directeur de Thèse
Université Mohammed V
Faculté de Médecine et de Pharmacie, Rabat
Centre d’Etudes Doctorales des Sciences de la Vie et de la Santé Laboratoire de Biotechnologie Médicale « MedBiotech »
THESE DE DOCTORAT
Présentée et soutenue le : 18 Juillet 2017
Par
Mme Zineb TARHDA
Née le 10 Mai 1986 à Taza
Pour obtenir le grade de Doctorat
Spécialité : Biologie médicale, pathologie humaine et expérimentale et environnement
Composition du jury :
Pr. Rachid SAILE Faculté des Sciences Ben Msik, Casablanca Président Pr. Anass KETTANI Faculté des Sciences Ben Msik, Casablanca Rapporteur Pr. Jaouad HARTI Faculté de Médecine et de Pharmacie, Rabat Rapporteur Pr. Rachid JAOUDI Faculté de Médecine et de Pharmacie, Rabat Rapporteur Pr. Mhammed Ansar Faculté de Médecine et de Pharmacie, Rabat Examinateur Pr. Azeddine IBRAHIMI Faculté de Médecine et de Pharmacie, Rabat Directeur de Thèse
C
ARACTERISATION STRUCTURALE ET FONCTIONNELLE
DES INTERACTIONS IMPLIQUANT LE RECEPTEUR
CD36
ET
LA KINASE
F
YN DANS L
’
ATHEROSCLEROSE
:
Dédicace
Remerciements
Je tiens en premier lieu à remercier Professeur Azeddine IBRAHIMI, mon directeur de thèse, qui m’a fait confiance en acceptant d’encadrer cette thèse, m’a permis de découvrir une discipline nouvelle pour moi, et m’avoir permis de faire cette thèse parallèlement à mon travail.
Je remercie vivement Professeur Jamal Taoufik, le directeur du centre d’études doctorales, pour les efforts déployés ainsi que le suivi et la communication des informations.
Je tiens à présenter mes vifs remerciements aux professeurs du centre d’études doctorales pour les formations complémentaires qui nous ont offert.
Je remercie très sincèrement Docteur Aziz Yasri, qui m’a accueilli dans sa société, pour sa disponibilité et son encadrement durant mon stage, pour ses conseils et suggestions qui ont un apport considérable sur les résultats de mes études.
Je remercie profondément Professeur Rachid Sail d’avoir présidé ma soutenance de doctorat. J’adresse ma profonde reconnaissance à Professeur Anas KETTANI pour avoir accepté d’évaluer mon travail en tant que rapporteur de ma thèse, et pour sa collaboration.
Je remercie également Professeur Rachid JAOUDI et Professeur Jaouad ELHARTI d’avoir accepté de rapporter ce travail.
Je remercie Professeur Mhammed Ansar pour sa participation au jury de ma thèse en tant qu’examinateur.
4
Un grand merci à mes collègues Imane SABAOUNI et Oussama SEMLALI qui m’ont donné les notions de base de la Bioinformatique.
Je remercie profondément mon mari Badr AIT SYAD pour sa présence et son interminable soutien qui sont une immense source d’énergie et d’enthousiasme pour moi.
Un remerciement spécial à ma sœur Samira et mon frère Farid pour leur soutien moral et leur aide.
5
S
OMMAIRE
Liste des abréviations ……… 8
Liste des figures ……….. 11
Liste des tableaux et annexes ………. 15
Résumé ……… 16
Abstract………...…. 17
Introduction générale………... 19
Chapitre I. Généralité sur l’implication du récepteur CD36 dans la pathologie d’athérosclérose ………. ……… 20
1. Définition du récepteur CD36……….. 21
2. Les ligands et les sites de liaison du récepteur CD36 ……… 23
3. Le rôle de la CD36 dans le développement des pathologies cardiovasculaires……… 25
4. Le récepteur scavenger CD36 et la pathologie de l’athérosclérose ……….. 25
4.1.La pathologie de l’athérosclérose ………... 25
4.2.Le mécanisme de l’intervention de CD36 dans le développement de la pathologie athérothrombotique ………... 32
Chapitre II. Étude de l’inhibition du récepteur CD36 par un Antagoniste………. 38
1. Introduction ……… 39
2. Principe de la modélisation par homologie ………... 40
3. Étapes de la modélisation par homologie ………. 41
3.1.Détection d’un homologue et méthodes d’alignement ………... 41
3.2.Génération de modèle de structure 3D ………... 43
3.3.Validation du modèle en 3D prédit ………. 44
4. Prédiction de la structure 3D du récepteur CD36 ………... 47
4.1.Choix de Template ………... 47
4.2.Génération de la structure 3D de CD36 ………. 48
4.3.Validation de la structure 3D du récepteur CD36 ……… 49
6
5. Interaction entre le récepteur CD36 et un Antagoniste……… 54
5.1.Principe et méthode de l’amarrage moléculaire ………. 54
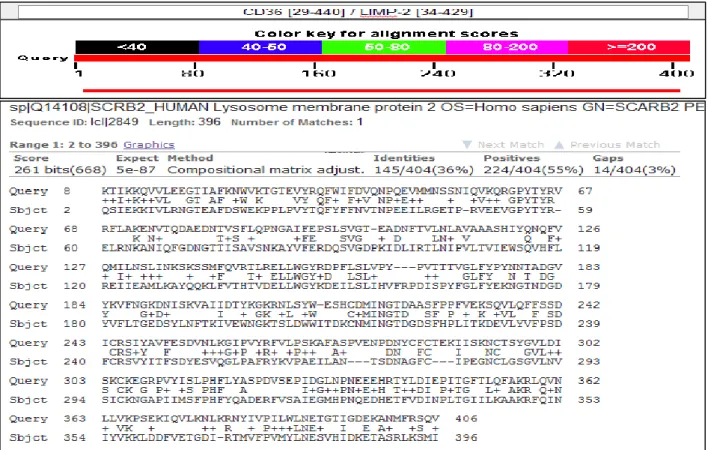
5.2.Étude de l’interaction CD36-AGLC ………... 56
5.2.1. Objectif de l’étude ……… 56
5.2.2. La méthodologie suivie pour l’étude de l’interaction CD36-AGLC ………… 56
5.2.3. Résultats et interprétation ………... 57
5.3.Étude de l’interaction CD36-SSO ………... 59
5.3.1 Généralités sur l’effet antagoniste de SSO sur le récepteur CD36 ………. 59
5.3.2 L’interaction entre la SSO et le récepteur CD36 ………. 61
5.3.3 L’interaction entre la CD36 et les analogues des AGLCs ……… 63
6. Conclusion ……….. 64
Chapitre III. Étude de l’inhibition de la voie de signalisation médiée par le récepteur CD36 via la kinase Fyn .……….…….. 65
1. Introduction ……….……. 66
2. Généralités sur la kinase Fyn ……….………. 66
2.1. Les tyrosines kinases ……….……… 66
2.2.La famille Src : Structure, Rôles physiologiques, et Implications pathologiques .. 67
2.3.La fonction catalytique des STKs ……….… 69
2.4.La kinase Fyn ……….. 71
3. Généralités sur l’inhibition des kinases ………..…. 73
3.1.Les inhibiteurs des kinases ………. 73
3.2.Exemples des inhibiteurs des kinases utilisées comme médicament …………...… 76
3.2.1. L’imatinib ………. 76
3.2.2. La Gefitinib ………... 77
3.3.Les inhibiteurs de Fyn kinase ……….. 77
4. Étude de l’inhibition de Fyn kinase ……….. 78
7
4.2.Étude de la relation structure-activité des inhibiteurs de la kinase Fyn ……….. 79
4.2.1. Principe de l’approche QSAR ……….. 79
a. Définition de l’approche QSAR ………... 79
b. La régression aux moindres carrés partiels (PLS) et l’analyse en composantes principales ………... 81
c. Les descripteurs moléculaires ………... 83
d. La validation du modèle QSAR ………. 91
4.2.2. Démarche de l’étude QSAR des inhibiteurs de la kinase Fyn………... 95
a. Collecte des inhibiteurs ……….. 95
b. Génération des modèles 2D-QSAR ……… 95
c. Validation des modèles 2D-QSAR ………. 96
4.3.Étude du pharmacophore des inhibiteurs de la kinase Fyn ………. 98
4.4.Prédiction de la structure 3D de la kinase Fyn en conformation DFG-out ……. 101
4.4.1. La modélisation par homologie de la structure 3D de la kinase Fyn …….... 101
4.4.2. La validation de la structure 3D de la kinase Fyn ……….. 102
4.4.3. Comparaison entre les deux conformations de la kinase Fyn ……… 103
4.5.Étude de l’interaction entre la kinase Fyn et ces inhibiteurs ……… 105
4.6.La validation du workflow ……….. 111
4.7.Conclusion ………. 112
Discussion et Perspectives ……….. 114
Références ……… 120
Annexes ……… 129
8
Liste des abréviations
2D-QSAR: Two-dimensional Quantitative Structure Activity Relationship 3D: Tridimensionnelle
ACV: Accident cérébro-vasculaire AGLC: Acide gras à longue chaine ApoB-100: Apolipoproteine B-100 APP: Amyloidprecursorprotein ATP: Adénosine triphosphate βA : β-amyloïde
BLAST: Basic Local Alignment search Tool CAP: Analyse en composantesprincipales CD36: Cluster of differentiation 36
CLESH-1: CD36 LIMP II Emp structural homology-1 CRP: Protéine C-réactive
DFG: Asparagine-Phénylalanine-Glutamate EP-CD36: Partie extracellulaire de CD36 EGF: Epidermal Growth Factor
FABP-H: Human Muscle Fatty Acid Binding Protein FAT: Fatty acid translocase
FDA: Food and drug Administration GP88: Progranulin
HDL: High density lipoprotein
HRD : Histidine-Arginine-Asparagine
IC50 : La moitié de concentration maximale d’inhibition
Il-4: Interleukine
JNK: c-Jun N-terminal kinase LDL: Low density lipoprotein
9
LIMP-2: Lysosome membrane protein 2 LMC: LeucémieMyéloïdeChronique LMO:Leave Many Out
LPS: Lipopolysaccharide
MAPK: Mitogen-activated protein kinase MCP-1: Monocyte chemotactic protein 1 M-CSF: Macrophage colony-stimulating factor MEKK2: Mitogen-activated protein kinase kinase 2 MIP: Macrophage inflammatoryprotein
MLR: Régressions multi-linéaires MMP-1: Matrix metalloproteinase-1 MOE: Molecular operating environment NHS: Esters- sulfo-N-succinimidyl NRTKs : Non-récepteurs tyrosine kinases PAP:Phénylamino pyrimidine
PC: Phosphatidylcholine PDB: Protein data bank PGE2: Prostaglandin E2 PGJ2: Prostaglandine Pks : protéines kinases PLox: Phospholipides oxides
PLS: Régression aux moindres carrés partiels
PPARγ: Peroxisome proliferator-activated receptor gamma PRR: Pattern recognition receptor
PS: Phosphatidyle serine
PSI-BLAST: Position Specific Iterative BLAST PTKs: Protéine à activité tyrosine kinase
10
RTKs : Récepteurs transmembranaire à activité tyrosine kinase RMSE: Root Mean-Squared Error
SCARB3: Scavenger receptor class B member 3 SFKs: FamilleSrc kinases
SR-A: Scavenger receptor A
SR-BI: Scavenger receptor class B member 1 SSO: Sulfo-N-succinimidylOléate
STKs:Src tyrosine kinases
TGF-β: Transforming growth factor beta TLR4: Toll-like 4
TNFα: Tumor necrosis factor alpha TSP1: Thrombospondine
VC: Validation croisée
11
Liste des figures
Figure1 : La localisation du gène CD36 au niveau du locus 7q21.11 dans le chromosome 7 et leur représentation schématique. La région 5’- non traduite (5’-UTR) se compose de l’exon Ia, Ib, Ic, Ie, If, II et une partie de l’exon III. L’autre partie de l'exon III, exons IV à XIII et une partie de l'exon XIV encodent la protéine CD36, tandis que le segment restant de l'exon XIV et l'exon XV forment la région 3’-non traduite (3' UTR).
Figure2 : La structure primaire de la protéine CD36 avec le domaine transmembranaire (en jaune orange), la région hydrophobique (en bleu clair), la région riche en proline (en bleu foncé), la localisation des sites de glycosylation et des cystéines.
Figure 3 : La représentation 3D du récepteur CD36 sur la membrane cellulaire. Le site CLESH et le site de liaison PfEMP-1 sont le site de liaison de la thrombospondine 1 et 2 (TSP-1 et TSP-2) et du Paludisme Falciparum respectivement. La région d’acide aminé 155-183 est pour la liaison de LDLox, les acides gras, l’héxareline, les anticorps monoclonaux et les neutrophiles apoptotiques.
Figure 4 : La structure d'une grande artère normale.
Figure 5 : Les principales étapes de la phase de strie lipidique. (a) Initiation de la lésion. (b) L’étape de l’inflammation. (c) La formation des cellules spumeuses.
Figure 6 : La formation de plaques fibreuses Figure 7 : Les lésions complexes et la thrombose.
Figure 8 : La structure de LDL. Leur noyau est composé principalement de triacylglycéride et des esters de cholestérol. Il est entouré par une monocouche phospholipidique. L’apolipoprotéine B-100 incorporée dans la couche phospholipidique confère des propriétés structurales et fonctionnelles de la molécule.
Figure 9 : Représentation schématique des différentes étapes de la formation des cellules spumeuses. 1. Pénétration et accumulation des LDL dans l'intima ; 2. Oxydation des LDL ; 3. Recrutement et diapédèse des monocytes-macrophages ; 4. Captation des LDL oxydées par les macrophages par l'intermédiaire des récepteurs scavenger et transformation des macrophages en cellules spumeuses.
Figure10 : Les différents mécanismes par lesquels la CD36 intervient dans le développement de l’athérosclérose.
Figure 11: L’interface du programme d’alignement BLAST
Figure 12 : La fenêtre de script du programme de Modeller 9.17 (la dernière version). Figure 13 : L’interface du programme Verify 3D.
12
Figure 14 : L’interface du programme PROCHECK. Figure 15 : L’interface du programme Errat.
Figure 16 : La structure 3D du récepteur LIMP-2 codée par 4F7B.
Figure 17 : Résultat de l’alignement entre la partie extracellulaire de la CD36 et LIMP-2. Figure 18 : La structure 3D prédite de l’EP-CD36
Figure 19 : Le graphe ‘Ramachandran Plot’ de validation de la structure 3D de CD36 Figure 20 : Le graphe Errat résulte de l’évaluation de la structure 3D de CD36.
Figure 21 : Le graphe de Verify 3D d’évaluation de la structure 3D de CD36. Figure 22 : L’interface du logiciel Autodocktools version 1.5.6.
Figure 23 : La fenêtre de script du programme Vina.
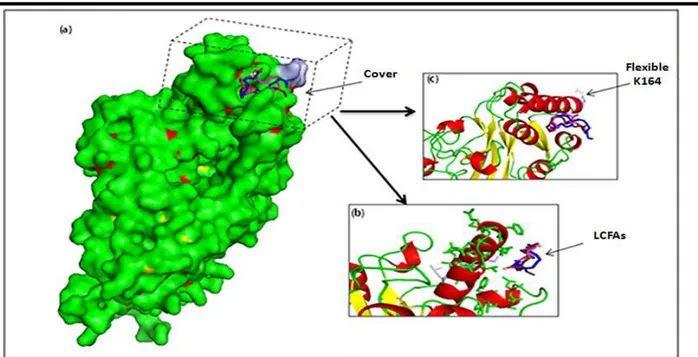
Figure 24 : La liaison entre les AGLCs et le récepteur CD36 en utilisant l’amarrage rigide et flexible. (a) La localisation des AGLCs sur le couvercle de CD36 entourée par une petite boîte. (b) L’affinité hydrophobique des AGLCs au couvercle de la CD36. (c) La simulation de l'interaction CD36-AGLCs en agissant sur la chaîne latérale de Lys-164.
Figure 25 : L'interaction entre les AGLCs et la CD36 avec flexibilité de résidus de leur portail. (a) La position des AGLCs lors de leur premier contact avec la CD36. (b) La pénétration des AGLCs dans le tunnel de la CD36. (c) La localisation des AGLCs dans la région inférieure de la CD36 adjacente à la membrane cytoplasmique.
Figure 26 : Représentation schématique de la réaction entre l’ester de sulfo-N-succinimidyle oléate avec l’acide aminé de la protéine membranaire. L’amide N-oléoyle de la protéine cible est formé conjointement avec le groupe sulfo-N-hydroxysuccinimidyl (NHS).
Figure 27 : (a) La localisation de la SSO sur le récepteur CD36 dans le cas de l’utilisation d’une petite boite qui entoure le couvercle et (b) dans le cas de l’utilisation d’une boite qui englobe tout le récepteur. Les résidus du couvercle de CD36 sont mis en mode flexible.
Figure 28 : Trois exemples d’interaction entre les analogues des AGLCs et le couvercle du récepteur CD36. (a) La mélinamide, contient l’amide de l’acide linoléique, s’interagit avec le couvercle de la CD36. (b) Le positionnement de la molécule N-[(1R)-1-Phenylethyl] hexadecanamide dans la poche produit par le couvercle. (c) La N-benzyloleamide contient de l’acide oléique s’interagit avec la poche du couvercle de la CD36.
Figure 29 : Schéma d’activation d’une protéine par la PK. Figure 30 : L’arbre phylogénétique de la famille Src. Figure 31 : Schéma du domaine structural de SFKs. Figure 32 : Le domaine catalytique de Src.
13
Figure 34 : Les modes de liaison des inhibiteurs des kinases. (a) Représentation schématique de site de liaison d’ATP divisé en sous-régions. (b) Représentation schématique de site de liaison allostérique.
Figure 35 : Le site de liaison de l’imatinib (STI-571, Glevic) sur le domaine kinase de l’ABL humain (code PDB : 2HYY). Les acides aminés en rouge représentent les résidus clés dans la fixation de l’imatinib sur l’ABL.
Figure 36 : Le site de liaison de gefitinib sur le domaine kinase de l’EGFR (code PDB : 2ITY). Les acides aminés en rouge représentent les résidus clés dans l’interaction gefitinib-EGFR.
Figure 37 : Schéma général de la stratégie QSAR.
Figure 38: Exemples de médicaments développés en utilisant différentes techniques de modélisation in silico.
Figure 39 : Schéma représentant les étapes de calcul des descripteurs à partir de la structure chimique des molécules pour générer un modèle QSAR.
Figure 40 : Les différentes étapes de validation d’un modèle QSAR.
Figure 41 : (a) Le graphe de la corrélation linéaire du modèle 1 de 2D-QSAR. (b) Le graphe de la corrélation linéaire du modèle 2 de 2D-QSAR.
Figure 42: (a) le modèle de pharmacophore ‘A’ du compose ‘OR0356’. (b) le modèle de pharmacophore ‘B’ de Dasatinib.
Figure 43 : (a) Les caractéristiques en commun entre les composés de la classe des inhibiteurs type II résulte de l’alignement flexible. (b) l’alignement flexible entre les composés de la classe des inhibiteurs type I.
Figure 44: La structure 3D de Fyn kinase. (a) Modèle prédit de Fyn kinase en conformation DFG-out. (b) Fyn kinase cristallisée en conformation DFG-in. Les cercles entourés en rouge représentent le site de liaison de Fyn kinase.
Figure 45 : La validation de modèle prédit par homologie de Fyn en conformation DFG-out. (a) Le graphe Ramachandran. (b) Le graphe d’analyse par Errat.
Figure 46 : Comparaison entre les deux conformations de la kinase Fyn. (a) Le site actif de la kinase Fyn en conformation DFG-out. (b) Le site actif de la kinase Fyn en conformation in. (c) La superposition de structure de la kinase Fyn en conformation in et DFG-out ; en vert, la kinase Fyn en conformation DFG-DFG-out, et en gris, la kinase Fyn en conformation DFG-in.
14
Figure 47: (a) La conformation active DFG-in de la kinase Fyn, ‘D1’ égale à 6.3 Å, ‘D2’ est
de 10.7 Å et ‘D3’ égale à 8.2 Å. (b) La conformation inactive de la kinase Fyn avec une ‘D3’
de 9.9 Å.
Figure 48: L’interaction entre la kinase Fyn et le compose OR0356. (a) Résultat de docking rigide de l’interaction Fyn - OR0356. (b) Résultat de docking flexible de l’interaction Fyn - OR0356.
Figure 49 : L’interaction entre la kinase Fyn et le composé 16118737. (a) et (b) Résultat de docking rigide de l’interaction Fyn-16118737. (c) Résultat de docking flexible de l’interaction Fyn - 16118737.
Figure 50 : L’interaction entre la kinase Fyn et le Dasatinib. (a) Résultat de docking rigide de l’interaction Fyn-dasatinib. (b) Résultat de docking flexible de l’interaction Fyn - dasatinib. Figure 51 : L’interaction entre la kinase Fyn et le composé 56649281. (a) Résultat du docking rigide de l’interaction Fyn-56649281. (b) Résultat de docking flexible de l’interaction Fyn - 56649281.
Figure 52 : L’interaction entre la kinase Fyn et le composé 11719421. (a) Résultat du docking rigide de l’interaction Fyn-11719421. (b) Résultat de docking flexible de l’interaction Fyn - 11719421.
Figure 53: (a) L’alignement flexible entre la molécule ‘KX2-391’ et le composé ‘OR0356’. (b) Le résultat de l’interaction entre la molécule ‘KX2-391’ et la kinase Fyn.
Figure 54 : Schéma récapitulatif des études réalisées pour inhiber la signalisation induite la pathologie de l’athérosclérose.
15
Liste des tableaux et annexes
Tableaux
Tableau 1 : Les différents descripteurs utilisés dans l'étude QSAR basés sur la dimension. Tableau 2 : Les paramètres structuraux utilisés dans le développement des modèles QSAR. Tableau 3 : Les descripteurs physicochimiques utilisés dans l’analyse QSAR.
Tableau 4 : Les paramètres thermodynamiques utilisés dans les modèles QSAR.
Tableau 5 : Les descripteurs électroniques utilisés dans la construction des modèles QSAR.
Annexes
Annexe 1 : Les molécules analogues aux acides gras à longue chaine utilisées dans l’étude d’interaction avec la CD36.
Annexe 2: Les descripteurs topologiques et leurs formes mathématiques.
Annexe 3: La structure et le code d’identité (Pubchem) des molécules de groupe 1 et groupe 2 Annexe 4 : Les descripteurs 2D et 3D sélectionnés en bleu sont les descripteurs utilisés dans les études QSAR.
Annexe 5 : La séquence de Fyn kinase de l’acide aminée 260 à 412 et qui incluse le site de liaison de l’ATP est corrélée à 79% avec le templete (1OIQ) et la séquence de Fyn kinase de 413 à 525 qui ne sont pas alignées.
16
Résumé
Cette thèse porte sur l’évaluation de nouvelle stratégie thérapeutique contre la pathologie de l’athérosclérose. Cette stratégie consiste à cibler et bloquer le récepteur scavanger CD36 qui joue un rôle significatif dans les différentes étapes de la progression des troubles athéro-thrombotiques. Nous avons, aussi, étudié l’effet de l’inhibition de la kinase Fyn, qui est un effecteur de la voie de signalisation du récepteur CD36, sur l’athérosclérose.
Dans une première partie, la thèse s’est concentrée sur la génération de la structure tridimensionnelle de la protéine CD36 pour étudier son interaction avec des molécules antagonistes par les méthodes de la modélisation moléculaire. Cette étude a permis d’obtenir les informations nécessaires sur le mode de fixation de ces antagonistes et de proposer d’autres structures capables de bloquer le récepteur CD36.
La deuxième partie de la thèse a consisté à évaluer l’effet inhibiteur des molécules inhibitrices, appartenant à la classe des inhibiteurs de type I et type II, sur la kinase Fyn. A cet effet, nous avons analysé la relation entre la structure de ces inhibiteurs et leurs activités par la méthode de QSAR (Quantitative Structure-Activity Relationship) et développé un modèle de structure tridimensionnelle de la kinase Fyn en conformation Asparagine-Phénylalanine-Glycine_out. La caractérisation de l’interaction entre la kinase Fyn et ces inhibiteurs et les modèles pharmacophores de ces inhibiteurs nous a permis de proposer des scaffolds d’autres molécules inhibitrices plus actif et sélectif de la kinase Fyn.
En conclusion, nos études ont permis de proposer une stratégie thérapeutique pour traiter la maladie de l’athérosclérose s’appuie sur la détermination des structures tridimensionnelles de la protéine CD36 et de la kinase Fyn, et la validation d’un workflow de sélection de nouvelles molécules inhibitrices à un effet anti-athérosclérotiques.
Mots clés : Le récepteur CD36, la kinase Fyn, l’athérosclérose, la modélisation moléculaire, l’approche QSAR.
17
Abstract
This thesis focuses on the evaluation of a new therapeutic strategy for atherosclerosis disease targeting and blocking the scavenger receptor CD36, which plays a significant role in the progression of atherothrombotic disorders. Moreover, we have studied the inhibition of Fyn kinase which is an effector of the CD36 receptor signaling pathway.
The first part of our research allocated to the generation of CD36 protein three-dimensional structure in order to study its interaction with antagonistic molecules using molecular modeling approaches. The results of this study provided us the necessary information on the antagonists of CD36 receptor and their binding mode allowing us to propose other molecules blocking the CD36 receptor.
In the second part of the thesis, we have evaluated the inhibitory effect of Fyn kinase inhibitors belonging to type I and type II classes. Thus, we have analyzed the relationship between the structure of these inhibitors and their activities using the Quantitative Structure-Activity Relationship (QSAR) method and developed a three-dimensional structure model of Fyn kinase in their Asparagine-Phenylalanine-Glycine_out (DFG_out) conformation.
The characterization of the interaction between Fyn kinase and their inhibitors and the pharmacophore models study, allowed us to propose a scaffold of other inhibitor which will more active and selective for Fyn kinase.
In conclusion, the therapeutic approach proposed in our thesis based on the determination of the three-dimensional structures of CD36 protein and Fyn kinase and the validation of a new workflow to select new molecules with an anti-atherosclerotic effect.
Keywords: CD36 receptor, Fyn kinase, atherosclerosis, molecular modeling, QSAR approach.
18
ةصلاخ
حبكو فادهتسا للاخ نم كلذو نييارشلا بلصت ضرم جلاعل ةديدج ةيجيتارتسإ مييقتب ةحورطلأا هذه متهت لبقتسملا ' .د.س 36 لخدتي يذلا' هلحارم عيمج يف ضارملأا نم عونلا اذه روطت يف . ,كلذل ةفاضلإاب انفدهتسا تاميزنلأا دحأ لبقتسملا نم ةراشلإا لقن يف ةيساسأ ربتعت يتلا ' .د.س 36 ' ةيلخلا لخاد ىلإ ,اهحبك ةيناكمإ ةساردل كلذو ةباصلإا ةلاح يف .'نيف' ميزنلأاب رملأا قلعتي يف ىلولأا ةلحرملا انزكر نيتوربلل داعبلأا ةيثلاثلا ةينبلا ءاشنإ ىلع ' .د.س 36 ' افتلا ةسارد فدهب اذه نيب متت يتلا تلاع عيمجب مامللإا نم انتنكم ةساردلا هذه ,يئيزجلا ميمصتلا قرط لامعتساب كلذو اهل ةحباكلا تائيزجلاو تلابقتسملا نم عونلا نيتورب و ةحباكلا تائيزجلا نيب طابترلاا قرطب ةقلعتملا تايثيحلا ' .د.س 36 ' ةينب حارتقا ىلع دعاست يتلاو تابكرم ةديدج ىلع ةرداق .يوقو ددحم لكشب لبقتسملا اذه فادهتسا ثيح ,'نيف' ميزنلأا ىلع يناثلاو لولأا اهيعونب ةحباكلا تائيزجلا ريثأت مييقت ىلع انزكر لمعلا اذه نم يناثلا ءزجلا يف ضرغلا اذهل ةصصخم ةروطتم ةبراقم لضفب اهطاشن و ةحباكلا تائيزجلا ةينب نيب ةقلاعلا انسرد امك جذومن انأشنأ ا نبل ةي .ميزنلأا اذه فيصوت لعافتلا نيب ةلمعتسملا تاطبثملاو'نيف'ميزنلأا جذامنلا ءاشنإو ةصاخلا ةيئاودلا نم ةعومجم انل مدق تاطبثملا كلتل .'نيف' ميزنلأل ةيئاقتناو اطاشن رثكأ ةحباك تائيزجل لكيه حارتقلا ةمزلالا ةلاعفلا تامولعملا نأ ربتعن ريخلأا يفو ا عومجم ثاحبلأ يف ةزجنملا للك دق ةحورطلأا هذه راطإ ت تاينبلا ديدحت نم انكمت اننلأ حاجنلاب اهفادهتسا ةسارد نم اننكم يذلا ءيشلا ينايرشلا بلصتلا ضرم روطت يف يساسأ رود اهل ةمهم تانيتوربل ةيئزجلا ةيئايميك تابكرمب ةريبك ةيمهأ اهل تناك اهل انلصوت يتلا جئاتنلا نأ امك , يف ناديم ا جذومن ةباثمب ربتعت اهنلأ يملعلا ثحبل لوعفم اهل ةديدج تابكرم ةساردل ب ةباصلإا ةلاح يف يجلاع .نييارشلا بلصت تاملك ثحبلا : لا تلابقتسم .د.س' 36 'ميزنلأاو ' نيف و ' بلصت .يئيزجلا ميمصتلا و نييارشلا19
Introduction générale
Dans le cadre de cette thèse, nous avons mis au point une nouvelle approche thérapeutique pour attaquer les troubles athéro-thrombotiques. Cette approche consiste à réaliser des études en mettant en application les méthodes de modélisation prédictives.
Ainsi, ce travail est peut-être considéré comme un processus modèle pour la découverte de nouvelles molécules de la thérapie ciblée surtout qu’il permet à développer de nouveaux médicaments de la manière la plus efficace et la moins couteuse possible.
Les méthodes de modélisation prédictives exploitées dans cette thèse sont sophistiquées et représentent deux grands axes de conception de molécules par modélisation, la conception basée sur la structure des récepteurs et la conception basée sur la structure des ligands.
Concernant le premier axe, on a utilisé la méthode de construction des protéines par homologie et celle de l’amarrage moléculaire. Pour le deuxième axe, on a travaillé par les outils statistiques et les descripteurs chimiques permettant de construire des modèles quantitatifs des relations structure-activité de molécules biologiquement actives.
Ces modèles vont être utiles pour prédire l’activité biologique de composés, guider la synthèse de nouvelles molécules sans avoir à les réaliser et analyser des familles entières de composés.
Le premier chapitre de cette thèse est consacré à la clarification des mécanismes moléculaires par lequel le récepteur scavenger CD36 intervient dans le développement de la pathologie d’athérosclérose.
Le chapitre suivant est intéressé par l’étude de l’inhibition de récepteur CD36 en utilisant des molécules antagonistes et qui sont analogues aux acides gras à longue chaine.
Le troisième chapitre présente une étude de l’inhibition de la kinase Fyn qui fait partie de la voie de signalisation médiée par le récepteur CD36.
20
Etape1: Génération du modèle QSAR
Etude de la relation structure-activité des molécules ayant une activité biologique (agoniste/ou antagoniste) dans le but de: - Déterminer les caractéristiques
physicochimiques de ces molécules; - et prédire l’activité biologique de nouvelles molécules.
Etape 2: Génération de la structure 3D du récepteur
En absence de la structure 3D du récepteur on la produit grâce aux méthodes de la
modélisation par homologie.
Etape 3: Etude du complexe (Antagoniste-Récepteur)
L’approche de l’amarrage moléculaire permet l’étude de l’interaction entre les molécules à effet antagoniste (ou agoniste)
21
Etape1: Génération du modèle QSAR
Etude de la relation structure-activité des molécules ayant une activité biologique (activateur/ ou inhibiteur) dans le but de: - Déterminer les caractéristiques
physicochimiques de ces molécules; - et prédire l’activité biologique de nouvelles molécules.
Etape 2: Génération de la structure 3D de kinase
En absence de la structure 3D de kinase on la produit grâce aux méthodes de la modélisation
par homologie.
Dans le cas des kinases, on s’intéresse par la structure en conformation DFG-in et la
structure en conformation DFG-out.
Etape 3: Etude du complexe (composant-kinase)
L’approche de l’amarrage moléculaire permet l’étude de l’interaction entre les molécules ( inhibitrices/ou activatrices ) et
22
Chapitre I.
Généralités sur l’implication du récepteur
CD36 dans la pathologie d’athérosclérose
23
I. Généralités sur l’implication du récepteur CD36 dans la pathologie d’athérosclérose
1. Définition du récepteur CD36
La glycoprotéine membranaire CD36 (Cluster of Differentiation 36), connue aussi sous le nom de récepteur scavanger, la glycoprotéine IIIb, la glycoprotéine IV, FAT/CD36, SCARB3, GP88, est exprimée sur la surface de la plupart des cellules du système cardiovasculaire telles que les plaquettes, les mégacaryocytes, les monocytes, les cellules endothéliales microvasculaires, les cellules musculaires lisses et les cardiomyocytes
(1, 2, 3, 4).
Le récepteur CD36 appartient à la famille des récepteurs scavangers classe B qui comprend le récepteur scavanger classe B de type I (SR-BI), le récepteur de l’absorption sélective de l’ester de cholestérol, et la protéine membranaire lysosomiale intégrale (LIMP-2) 1.
Figure1 : La localisation du gène CD36 au niveau du locus 7q11.2 dans le chromosome 7 et leur représentation schématique. La région 5’- non traduite (5’-UTR) se compose de l’exon Ia, Ib, Ic, Ie, If, l’exon II et une partie de l’exon III. L’autre partie de l'exon III, exons IV à XIII et une partie de l'exon XIV encodent la protéine CD36, tandis que le segment restant de l'exon XIV et l'exon XV forment la région 3’-non traduite (3' UTR).
24
Le gène humain du récepteur CD36 se localise sur le chromosome 7(7q11.2)5 , il code pour 15 exons. Les exons 1, 2, les premiers 89 nucléotides de l'exon 3 ainsi qu’une partie de l’exon 14 et l’exon 15 sont non codants. Le reste de l'exon 3 code pour le domaine N-terminale cytoplasmique et transmembranaire. Les régions C-N-terminale cytoplasmique et transmembranaire sont codées par l'autre partie de l’exon 14. Le domaine extracellulaire est codé par 10 exons. L'épissage alternatif des régions non traduites donne lieu à au moins deux types d'ARNm. Figure 1 ci-dessus présente la localisation du gène CD36 sur le chromosome
humain et leur composition.
La protéine CD36 est constituée d’une chaîne peptidique de 472 acides aminés avec un poids moléculaire de 80-90 kDa qui varie en fonction du degré de la glycosylation (3,4).
Le récepteur CD36 a une configuration en épingle à cheveux, contenant deux domaines cytoplasmiques N-terminal [2 - 7 aa] et C- terminal [462 - 472 aa], et deux domaines transmembranaires [8 - 29 aa] et [440 - 461 aa] séparés par une large boucle extracellulaire glycosylée [30 – 439 aa]. Cette partie extracellulaire se caractérise par 10 sites de glycosylation, comme elle est riche en proline et contient 6 des 10 cystéines trouvées dans la CD36 ce qui favorise la formation de trois ponts disulfures. Sa structure est similaire à celle du SR-BI et LIMP-2 humaine et rassemble à la structure de la protéine membranaire épithéliale de Drosophila(6,7, 8).
La figure 2 extraite de l’article « CD36 and macrophages in atherosclerosis » montre la représentation schématique détaillée de la structure primaire de la protéine CD36.
Figure2 : La structure primaire de la protéine CD36 avec le domaine transmembranaire (en jaune orange), la région hydrophobique (en bleu clair), la région riche en proline (en bleu foncé), la localisation des sites de glycosylation et des cystéines.
25
Le récepteur CD36 est multiligands ce qui lui rend multifonctionnel, il est impliqué dans des cas physiologiques et pathologiques y compris l’inhibition de l’angiogenése, les maladies cardiovasculaires telles que l’athérosclérose, l’hypertension artérielle, et l’hypertrophie cardiaque. Le CD36 joue un rôle crucial dans le cas des maladies métaboliques, l’exemple de la résistance à l’insuline et la dyslipidémie2.
Le CD36 des macrophages et d’autres cellules phagocytaires est impliqué aussi dans le cas du Malaria, en fixant les érythrocytes infectées par le parasite de Paludism-Falciparum9. Au niveau des microglies et des macrophages, la CD36 assure la liaison des β-amyloïdes ce qui cause une réponse inflammatoire induite la maladie d’Alzheimer et d’athérosclérose.
2. Les ligands et les sites de liaison du récepteur CD36
Les ligands du récepteur CD36 identifiés comprennent, comme il montre la figure 3, la thrombospondine (TSP1), les phospholipides oxydés (PLox), les lipoprotéines de basse densité oxydées (LDLox), l’hexaréline, et les acides gras à longue chaîne (AGLCs). Sur les macrophages et d'autres cellules phagocytaires le récepteur scavanger CD36 séquestre également les érythrocytes infectés par le parasite du paludisme ‘Plasmodium falciparum’(9,10). Autre ligand est reconnu par la CD36, c’est le peptide β-amyloïde, dont la
liaison se traduit par la production des cytokines pro-inflammatoires par l'activation de JNK et autres isoformes de MAPK11.
La TSP1 agit comme un ligand de CD36 au niveau des plaquettes, des fibroblastes, des cellules endothéliales et des cellules des muscles lisses (12,13,14,15). Quand elle est sécrétée par les plaquettes activées et d'autres cellules sanguines, elle se dépose sur les sites endommagés de la paroi des vaisseaux sanguins et dans les plaques d'athérosclérose (16,17,18). L’interaction entre la TSP1 et le récepteur CD36 au niveau des cellules endothéliales a un effet anti-angiogénique typique (19,20,21). Le site de liaison pour TSP1 est appelé le domaine CLESH-1 (CD36 LIMP II Emp structural homology-1), il se localise dans la séquence d'acides aminés [93-155], plus précisément dans les régions [93-120] et [139-155] (22,23,24,25).
Le transport des acides gras est régulé par la CD36 au niveau de différents types de cellules : les monocytes / macrophages (26,27), les cellules endothéliales microvasculaires28, les cardiomyocytes(29,30), les adipocytes, les cellules de muscle squelettique (31,32), les entérocytes 33, et les cellules de bourgeon du goût (34,35). La CD36 assure la liaison ainsi que l'absorption
des acides gras à longue chaîne, et donc le contrôle du métabolisme des acides gras (36,37,38).
Le site de liaison des acides gras à longue chaine proposé par les études est dans la région 127 à 279 de la boucle extracellulaire de la CD3639.
26
Figure 3 : La représentation 3D du récepteur CD36 sur la membrane cellulaire. Le site CLESH et le site de liaison PfEMP-1 sont le site de liaison de la thrombospondine 1 et 2 (TSP-1 et TSP-2) et du Paludisme Falciparum respectivement. La région d’acide aminé 155-183 est pour la liaison de LDLox, les acides gras, l’héxareline, les anticorps monoclonaux et les neutrophiles apoptotiques.
Une étude a montré que les PLox se fixent sur le récepteur CD36 dans le domaine de l’acide aminé 120 à 15540. Alors que, des données récentes montrent que le site de liaison de PLox
sur la CD36 est situé dans la séquence [157-171], tandis que les deux lysines à 164/166 sont indispensables pour cette interaction. Le récepteur scavanger CD36 se lie avec les lipoprotéines oxydées, particulièrement la LDLox, et favorise leur internalisation via la voie de l’endocytose (41,42,43,44). Le domaine du résidu 155 à 183 est le domaine fonctionnel
important de CD36 impliqué dans la fixation de la LDLox, dont la Lys 164/166 sont impliquées dans cette interaction45. Le CD36 des macrophages joue un rôle important dans leurs conversations en cellules spumeuses, en favorisant la liaison de la moitié de la LDLox26. Le domaine cytoplasmique C-terninal de CD36 avec 10 acides aminés contient un seul site de phosphorylation TIK (Thr-Ile-Lys).En revanche, le domaine N-terminal ne possède aucun site de phosphorylation46.
27
3. Le rôle de la CD36 dans le développement des pathologies cardiovasculaires Le récepteur CD36 a un rôle significatif dans différentes maladies cardiovasculaires. Cette implication est due à son pouvoir sur la fixation des lipides. Le transport des acides gras régulés par le récepteur de captage CD36 se produit dans divers types de cellules, y compris les monocytes / macrophages, les cellules endothéliales microvasculaires, les cardiomyocytes, les adipocytes et les cellules musculaires squelettiques.
En présence de l’hyperlipidémie, l’expression de la protéine CD36 peut jouer un rôle dans l’apparition de l’ischémie comme elle peut contribuer à une ischémie qui engendre par la suite l’infarctus du myocarde et l’accident vasculaire cérébral.
Les études ont montré que la carence en CD36 chez la population japonaise est en corrélation avec le développement de l'hypertension, de l'insulino-résistance et la concentration anormale de lipides plasmatiques. Les polymorphismes du gène CD36 ont également été corrélés avec une dyslipidémie et une concentration anormale des acides gras chez les populations caucasiennes.
4. Le récepteur scavenger CD36 et la pathologie de l’athérosclérose 4.1.La pathologie de l’athérosclérose
L’athérosclérose est le remaniement des artères de gros et de moyen calibre, il est responsable de la coronopathie et de l’accident cérébro-vasculaire (ACV).
Dans le cas normal, les artères se composent de trois couches morphologiquement distinctes montrées dans la figure 4.
L'intima, la couche la plus interne est délimitée par une monocouche de cellules endothéliales sur la face luminale et une feuille de fibres élastiques, la limitante élastique interne, sur le côté périphérique. L’intima est une région très mince et se compose de la matrice extracellulaire du tissu conjonctif, principalement des protéoglycanes et de collagène. Les médias, la couche intermédiaire, se composent de cellules musculaires lisses. L'adventice, la couche externe, se compose des tissus conjonctifs avec des fibroblastes et des cellules musculaires lisses entremêlées.
28
Figure 4 : La structure d'une grande artère normale.
En contrepartie, et dans le cas des lésions d’athérome, il y a l’apparition d’une chape fibreuse composée de cellules musculaires lisses et de la matrice extracellulaire, elle entoure un noyau nécrotique riche en lipide. Les plaques devenir de plus en plus complexes par la calcification, l’ulcération et l’hémorragie de petits vaisseaux. Les lésions peuvent se développer pour bloquer le flux sanguin par la formation d’une thrombose ou des caillots sanguins.
Les lésions d'athérome évoluent selon plusieurs stades : la strie lipidique est une phase précoce et réversible, la plaque athéromateuse simple puis la plaque compliquée qui explique l'expression clinique de la maladie.
- La strie lipidique, le premier stade de l'athérome, c’est une structure réversible, mais qui peut évoluer vers la plaque d'athérome. Ce stade est commencé par l’accumulation de la LDL dans la matrice sous-endothéliale, la LDL se diffuse passivement à travers les jonctions de la couche endothéliale et leur rétention due à l’interaction entre l’apolipoprotéine B de la LDL et les protéoglycanes de la matrice. La LDL connaît des modifications, y compris l’oxydation, la lipolyse, la protéolyse, et l’agrégation.
La strie lipidique est constituée de l'accumulation, dans l'intima, de cellules spumeuses. Il s’agit des macrophages ayant migrés dans l'intima et chargées de LDL oxydée. L'accumulation de cellules spumeuses réalise la strie lipidique, visible au niveau de l'endothélium comme une protrusion linéaire de l'endothélium, de couleur jaune. L’évolution de la phase de strie lipidique est détaillée dans la figure 5.
29
Figure 5 : Les principales étapes de la phase de strie lipidique. (a) Initiation de la lésion. (b) L’étape de l’inflammation. (c) La formation des cellules spumeuses.
30
Figure 6 : La formation de plaques fibreuses.
- La plaque athéromateuse simple, c'est une évolution de la strie lipidique, il s’agit d’un nodule fibrino-lipidique situé dans l'intima. Elle est constituée de deux parties : le centre lipidique contient des lipides, des macrophages, des lymphocytes T et des cellules musculaires lisses et la chape fibreuse, riche en fibres de collagène, des cellules musculaires lisses et la matrice extracellulaire. Le média de l'artère est normal à ce stade avec une destruction de la membrane élastique interne.
Ce stade est caractérisé par un remodelage artériel, qui correspond à une augmentation du diamètre de l'artère, permettant de préserver son calibre. C’est un mécanisme d’adaptation de l’artère qui retarde la survenue des sténoses. Malgré le phénomène de remodelage, la plaque d’athérome, comme il est montré dans la figure 6, entraîne progressivement une réduction du calibre de la lumière artérielle.
31
Figure 7 : Les lésions complexes et la thrombose.
- La plaque compliquée est une transformation d'une plaque simple, elle résulte de phénomènes inflammatoires locaux responsables, par l'intermédiaire d'une thrombose, des manifestations cliniques aiguës de l'athérome. L'évolution vers la complication (l’ulcération de la plaque, leur rupture et l’hémorragie intra-plaque) ne dépend pas seulement du volume de la plaque, mais de trois facteurs : la taille du noyau lipidique de la plaque, le degré d'inflammation locale (qui peut dégrader la chape fibreuse) et les modifications de la matrice extracellulaire (47, 48). La figure 7 représente le dernier stade de l’athérosclérose.
L’athérosclérose est considérée comme une maladie inflammatoire chronique qui touche la paroi du vaisseau sanguin. Cette conclusion est due à l’association de l’athérosclérose avec une abondance des biomarqueurs de la réaction inflammatoire tels que la Protéine C-réactive (CRP), la myéloperoxidase et les anticorps de la LDLox, la présence des leucocytes et des produits du système inflammatoire dans la plaque d’athérome et aussi l’absence de développement de l’athérosclérose chez des animaux sans monocytes qui jouent un rôle crucial dans la production des cytokines pro-inflammatoire par les cellules dérivées de lymphocyte T.
En effet, quand le LDL s'infiltre dans l'intima, il peut s’oxyder par les macrophages ou les cellules endothéliales. En outre, la CRP et le LDLox peuvent agir en synergie pour augmenter
32
les monocytes inflammatoires par la production de MCP-1, PGE2, et MMP-1 et attirer les monocytes circulants par la libération de MCP-149.
Vue le rôle crucial des niveaux élevés de LDL qui se contribuent à la pathogenèse de l'athérosclérose, plus particulièrement, il semble que l'oxydation des LDL soit le facteur déterminant de son athérogénicité50. On démontre dans la figure 8 ci-dessous la structure de LDL.
Figure 8 : La structure de LDL. Leur noyau est composé principalement de triacylglycéride et des esters de cholestérol. Il est entouré par une monocouche phospholipidique. L’apolipoprotéine B-100incorporé dans la couche phospholipidique confère des propriétés structurales et fonctionnelles de la molécule.
La lipoprotéine de basse densité, LDL (Low Density Lipoprotein), est une lipoprotéine avec une densité, par rapport à l’eau, entre 1,019 et 1,063 g/ml51 et une taille variable avec un
diamètre entre 15 et 25 nm. La LDL est produite par le foie à partir des lipoprotéines de très basse densité (VLDL ‘Very Low Density Lipoprotein’), elle porte des apolipoprotéines B-100, une monocouche de phospholipides, des triglycérides et des vitamines liposolubles antioxydantes (vitamine E et caroténoïdes).
Plus spécifiquement, les particules de LDL ont un noyau constitué d'environ 170 triglycérides et 1600 esters de cholestérol, et la monocouche de surface comprenant environ 700 molécules de phospholipides et une copie unique de l'apoB-10050. En outre, les particules de LDL
33
contiennent environ 600 molécules de cholestérol non estérifié, dont environ un tiers est situé dans le noyau et les deux tiers au niveau de la surface52. Il convient également de noter que quelques molécules de triglycéride et de l’ester de cholestérol pénètrent vers la surface. Les principaux composants de phospholipides sont la phosphatidylcholine (environ 450 molécules / particule de LDL) et la sphingomyéline(environ 185 molécules / particule de LDL).
Les particules de LDL contiennent également de lysophosphatidylcholine (environ 80 molécules / particule de LDL)50, la phosphatidyléthanolamine (environ 10 molécules / particule de LDL)53, le diacylglycérol (environ 7 molécules / particule de LDL)54, le céramide (environ 2 molécules / particule de LDL)55 et certains phosphatidylinositol56.
En plus des lipides, des particules de LDL transportent aussi des antioxydants lipophiles, tels que K-tocophérol (environ 6 molécules / particule de LDL) et des quantités infimes de Q-tocophérol, caroténoïdes, oxycaroténoïdes et ubiquinol-10 50.
Les LDL ayant un état dynamique, leur structure et leurs propriétés physiques dépendant de la composition lipidique ainsi que de la conformation de l'apoB-100.
Les LDL oxydées, plutôt que les LDL intactes, sont reconnues par les récepteurs piégeurs des macrophages et ainsi elles peuvent promouvoir la formation de cellules spumeuses. Les LDL oxydées, par leur action chimiotactique pour les monocytes, contribuent à la migration de ceux-ci dans l'espace endothélial. La figure 9 présente les étapes de formation des cellules spumeuses.
L'oxydation au niveau de la LDL conduit aux différents types de changement dans cette particule. La progression de l'oxydation conduit à la perte des molécules antioxydantes endogènes et des lipides polyinsaturées, ainsi que la formation de bases de Shiff entre les aldéhydes et les lysines de l'apoB-100 et l'hydrolyse de l'apoB-100 (examiné par Esterbauer)50. En outre, une large gamme de produits biologiquement actifs, tels que des peroxydes, aldéhydes, lysophosphatidylcholine et oxystérols, sont produites.
34
Figure 9 : Représentation schématique des différentes étapes de la formation des cellules spumeuses. 1. Pénétration et accumulation des LDL dans l'intima ; 2. Oxydation des LDL ; 3. Recrutement et diapédèse des monocytes-macrophages ; 4. Captation des LDL oxydées par les macrophages par l'intermédiaire des récepteurs scavenger et transformation des macrophages en cellules spumeuses.
Plus précisément, les lipides dans la particule de LDL ont été oxydés pour produire de grandes quantités des radicaux lipidiques et des hydroperoxydes lipidiques. Certaines molécules de phosphatidylcholine ont été transformées en lysophosphatidylcholine (via l’activité intrinsèque de la phospholipase A2) et des dimères lipidiques ont également été
formés. La décomposition des lipides oxydés donne naissance aux aldéhydes lipidiques, dont certaines interagissent avec apo B-100. L’oxydation conduit également à la fragmentation des apoB-10051.
4.2. Le mécanisme de l’intervention de CD36 dans le développement de la pathologie athérothrombotique
Le récepteur multi-ligands CD36 présent dans les plaquettes, les macrophages et les monocytes joue le rôle majeur pas seulement dans le développement de l’athérosclérose, mais aussi la thrombose.
Au niveau des macrophages et des monocytes, le CD36 est impliqué dans la formation des lésions d’athérosclérose par la liaison et l’endocytose de LDLox, suivie par la formation de cellules spumeuses.
35
Les monocytes génèrent par l’intermédiaire de la myéloperoxydase-hydrogenperoxide-nitrite (MPO-H2O2-NO2) des éléments d’azotes actifs impliqués dans la conversation des LDL en
NO2-LDL ayant une grande affinité pour la CD36 des macrophages comme elles peuvent
intervenir dans la formation des cellules spumeuses57.
La phosphatidylcholine oxydée (PCox) a une forte affinité au récepteur scavanger CD36 des macrophages, comme elle participe dans la reconnaissance des lipoprotéines oxydées par le CD36 et la formation des cellules spumeuses58.
Les macrophages sont également responsables de la phagocytose de plaquette ce qui mène à une activation pro-inflammatoire du macrophage et donc une déstabilisation de la plaque d’athérome59. La phagocytose des plaquettes a été considérée comme une source de lipide
pour la formation de cellules spumeuses, aussi la libération de protéine précurseur de l’amyloïde (APP) qui donne par la suite la β-amyloïde. L’interaction des plaquettes avec les plaques du collagène peut être suffisante pour la libération de l’APP60.
Dans tous les stades de lésion d’athérosclérose, les macrophages actifs sécrètent des cytokines inflammatoires et d'autres molécules qui contribuent à la progression de la lésion61. Par conséquent, les processus qui augmentent l'accumulation des macrophages dans les lésions peuvent favoriser le développement de la lésion, tandis que ceux qui diminuent l'accumulation de macrophages, tels que l'apoptose des macrophages associée à l’élimination phagocytaire peut retarder la progression de la lésion. Dans les lésions avancées, l'apoptose des macrophages n'est pas correctement couplée avec un jeu phagocytaire, mais elle est associée à un rôle néfaste: la plaque de nécrose(62,63).Les études indiquent que le récepteur scavenger SR-A et/ou CD36 des macrophages contribuent à l'apoptose et la nécrose dans les lésions de la plaque avancée64. Plusieurs ligands endogènes des récepteurs de reconnaissance de motifs moléculaires (PRR) s'accumulent dans les plaques d'athérosclérose et ont le potentiel de contribuer à l'apoptose des macrophages pendant le stress du réticulum endoplasmique comme les LDL modifiés, la β-amyloïde et la phosphatidylcholine oxydée, qui engagent les récepteurs scavenger tels que SR-A et CD36 (65,66).
In vivo et dans des conditions d’hyperlipidémie, le CD36 plaquettaire est considéré comme un capteur du stress oxydatif, un modulateur de la réactivité plaquettaire et un activateur de thrombose, car le stress oxydant induit la génération des lipides oxydés biologiquement actives comme la phosphatidylcholine oxydée (PCox), un des ligands de la CD36 participant dans le processus prothrombotique. Ainsi, les interactions de CD36 plaquettaire avec des
36
lipides oxydés endogènes spécifiques ont un rôle important dans l’association clinique entre la dyslipidémie, le stress oxydant, et le phénotype prothrombose67.
Les microparticules comprenant la phosphatidyle serine (PS) sont dérivées des cellules endothéliales après la lésion vasculaire. Elles se contribuent à la formation de la thrombose en se lient au récepteur CD3668.
Le récepteur CD36 a une relation critique avec la réaction inflammatoire qui caractérise l’athérosclérose, car l’expression de la CD36 est régulée par plusieurs facteurs y compris les médiateurs de l’inflammation, ce qui interprète la relation entre la réaction inflammatoire qui caractérise l’athérosclérose et le récepteur CD36. Au niveau des monocytes, le taux de transcription de la CD36 augmente par l’adhésion, M-CSF, les LDL natives et modifiées, le cholestérol et l’interleukine Il-4. En revanche, leur expression se diminue par les corticostéroïdes, la TGF-β, HDL et LPS ce qui confirme que l’expression de CD36 est corrélée avec la maturation des monocytes.
Le récepteur nucléaire d’hormone PPARγ est un régulateur de l’expression de CD36, le gène humain de CD36 au niveau de macrophage contient un site sensible au PPARγ. Ce dernier à plusieurs ligands, tels que les lipides dérivés de LDLox, l’acide 13-hydroxyoctadecadienoic (9-13 HODE), et la prostaglandine (PGJ2).
L’induction de l’expression de CD36 par Il-4 dans les macrophages est médiée par l’activation des lipoxygénases intracellulaires et la génération de PGJ2, le ligand de PPARγ. Le CD36 est négativement régulé par TGF- β en inactivant le PPARγ.
La stimulation de l’inflammation conduit à la production d’oxygène réactive et des métabolites d’azote, ce qui génère des épitopes sur la LDL (NO2-LDL) reconnus par la CD36,
cela permet l’internalisation des LDL modifiées, la génération des ligands intracellulaires de PPARγ, la translocation de complexe activateur transcriptionnel actif vers le noyau et l’activation des gènes cibles de PPARγ qui sont le gène de PPARγ et le gène de CD3640.
Plusieurs protéines s’accumulent dans la plaque d’athérome, telle que les apolipoprotéines, la β-amyloïde (βA), et α 1-antitripsine69 . La β-amyloïde est un peptide étroitement impliqué
dans les pathologies inflammatoires, le cas de l’athérosclérose et de l’Alzheimer. La lésion d’athérosclérose contient les peptides de βA, principalement le βA-4070. Les peptides βA
produit sur le site des lésions par les myocytes, les cellules endothéliales (71,72) ou de
plaquettes (73,74).
Les études révèlent un programme d'activation de macrophages initié par un ligand non-lipidique (β-amyloïde) qui se fixe sur la CD36 en favorisant des réponses inflammatoires75 .
37
Le récepteur CD36 est impliqué dans l’athérogenèse par l’élimination des fibres amyloïdes et l’activation de la cascade de signalisation induit l’inflammation vasculaire69
.
Quand la β-amyloïde se fixe sur la CD36 du macrophage, elle déclenche une cascade de signalisation pro-inflammatoire. La β-amyloïde induit la liaison de CD36 avec la tyrosine kinase Lyn, de la famille Src, suivi par l’activation d’une voie de transduction de signal fait intervenir un autre membre de la famille Src, Fyn kinase, p44/42 et MAP kinase. L’interruption de cette cascade de signalisation par des inhibiteurs chimiques aboutit à une inhibition de la réponse inflammatoire des macrophages à la β-amyloïde 75.
La réponse inflammatoire du macrophage à la β-amyloïde est traduit par la production de quelques médiateurs de l’inflammation y compris la TNFα, ROC, MIP-1, MIP-2, et MCP-1
75.
Les macrophages sont impliqués dans l’athérosclérose par la fixation et l’absorption de LDLox ce qui les rend des cellules spumeuses76.Il a été démontré que la transformation de macrophage en cellule spumeuse est assurée par une voie de signalisation intracellulaire déclenchée par l’interaction de LDLox avec le récepteur CD36 et fait intervenir des kinases de la famille JNK et Src. Le blocage pharmacologique in vitro et in vivo des kinases de la famille JNK ou Src a inhibé la formation de cellule spumeuse dépendante à la CD36. En outre, dans les macrophages, il y a une association directe entre le domaine intracellulaire C-terminal de CD36 et un complexe de signalisation contenant les kinases Lyn, MEKK277.
Steward et al. démontrent que la LDLox et β-amyloïde déclenchent une signalisation inflammatoire dans le cas de la pathologie d’athérosclérose et d’Alzheimer grâce à un hétérodimère des récepteurs Toll-Like 4 et 6 (TLR4, TLR6), l’assemblée de ces deux récepteurs est régulée par le récepteur scavenger CD36. Alors, les lipides athérogéniques ainsi que la β-amyloïde stimule la réponse inflammatoire par l’activation du complexe CD36-TLR4-TLR6 CD3678.
38
Figure10 : Les différents mécanismes par lesquels la CD36 intervient dans le développement de l’athérosclérose.
Le récepteur CD36 interagit avec les LDL modifiées (LDLox, LDL-NO2), la PLox ou bien les
plaquettes et favorise la transformation des macrophages en cellules spumeuses. Leur liaison avec la LDLox ou bien la β-amyloïde induit l’apoptose des macrophages ce qui provoque la nécrose de plaque. Le CD36 est un activateur de la production des médiateurs de l’inflammation athérosclérotique et ça se fait quand il fixe la LDLox et la β-amyloïde.
39
La PLox qui a le même site de liaison de LDLox sur la CD36 plaquettaire est considérée comme un agent prothrombotique.
On déduit que le récepteur scavenger CD36 joue un rôle significatif dans les différentes étapes de l’athérosclérose, il s’agit alors d’une molécule importante dans la progression de l’athérosclérose, comme il est illustré dans la figure 10.
De ce fait, en ciblant le récepteur CD36 ou bien leur voie de signalisation va être une nouvelle stratégie pour le traitement des troubles athéro-thrombotiques.
40
Chapitre II.
Étude de l’inhibition du récepteur CD36
par un Antagoniste
41
II. Étude de l’inhibition du récepteur CD36 par un Antagoniste 1. Introduction
Le rôle significatif du récepteur CD36 dans les différentes phases de l’athérosclérose fait de ce récepteur une cible thérapeutique, c’est la raison pour laquelle nous avons pensé à agir directement sur le récepteur CD36 et particulièrement sur sa partie extracellulaire qui comprend le site de liaison de LDLox. Cela nécessite la disponibilité de la structure tridimensionnelle (3D).
La structure 3D du récepteur scavenger CD36 n’a pas été déterminée expérimentalement par la résonnance magnétique nucléaire (RMN) ou par la cristallographie aux rayons X, et donc aucun fichier PDB de la protéine CD36 n’a été trouvé dans la base de données PDB lors de la période qu’on a commencé notre travail sur la structure de la CD36 (en 2011).
Alors, le manque d’une structure cristallisée de la protéine CD36, rend la compréhension de la relation structure-fonction de ce récepteur limitée. De ce fait, nous avons pensé à prédire la structure 3D du récepteur CD36 en se basant sur la méthode de modélisation par homologie. En raison de l’absence de structure d’une protéine qu’on peut utiliser comme modèle (template) pour prédire le récepteur CD36 en entier, on a décidé à modéliser juste la partie qui fixe les acides gras à longue chaîne, en proposant que ce fragment soit identique à la protéine Fatty acid binding protein (FABP) qui est spécifique pour la fixation des acides gras.
Effectivement, l’alignement de la protéine FABP avec le fragment de la CD36 spécifique pour la liaison des acides gras nous a confirmé la similarité importante entre eux, ce qui nous a encouragés à prédire la structure 3D de notre fragment. Les résultats de ce travail ont été publiés en Juin 2013 sous le titre : « Three Dimensional Structure Prediction of Fatty Acid Binding Site on Human Transmembrane Receptor CD36 » (voir la partie des publications).
Fin 2013, une équipe scientifique a réussi la résolution de la structure tridimensionnelle d’une protéine appartient à la même famille de la protéine CD36, il s’agit de la protéine lysosomale membranaire intégrale 2 (LIMP-2) qu’on a utilisé par la suite comme template pour générer la structure 3D de la partie extracellulaire du récepteur CD36.
42
Après l’étape de prédiction de la structure de la partie extracellulaire de CD36, nous avons déclenché l’étude de l’interaction de la protéine CD36 avec quelque acides gras à longue chaine (AGLCs) afin de connaître et comprendre le mécanisme de fixation des lipides sur ce récepteur et par la suite étudier l’effet antagoniste de la molécule Sulfo-N-Succinimidyl Oléate (SSO) et d’autres molécules analogues aux AGLCs sur la CD36. A noter que la première utilisation de SSO a été réalisée pour identifier le rôle de CD36 dans la liaison des AGLCs. Cette étude a été publié en Juin 2015 sous l’intitulé: “Insight into the mechanism of lipids binding and uptake by CD36 receptor” (voir la partie des publications).
2. Principe de la modélisation par homologie
La modélisation par homologie, connue aussi par la modélisation comparative de protéine, vise à construire un modèle d’une protéine en se basant sur leur séquence primaire d’acide aminés et d’une protéine homologue, le Template.
Historiquement, les méthodes de modélisation par homologie sont les plus anciennes, et la technique n’a que peu évolué depuis ces vingt dernières année79s. Cette méthode se base sur
le principe que des séquences, étant reliées du point de vue évolutif, possèdent un repliement tridimensionnel similaire80. Ainsi, une similarité de séquence suggère une similarité de repliement.
Partant de ce principe, la modélisation par homologie se déroule en quatre étapes principales(81,82):
• Identification, par leur séquence, de structures connues pouvant servir de matrice (Template);
• Alignement de la séquence à modéliser (Target) avec la structure matrice ;
• Modélisation des régions conservées, en utilisant la matrice, des boucles et chaînes latérales absentes de la matrice ;
• Raffinement et évaluation de la qualité du modèle produit.
La performance des méthodes de modélisation par homologie dépend directement du pourcentage d’identité de séquences qui partagent la cible et la matrice. Si plus de 50% de ces deux séquences sont identiques, les prédictions sont de très haute qualité, et, il a été montré que ces modèles sont aussi pertinents que des modèles RX à faible résolution83.