يملعلا ثحبلا و يلاعلا ميلعتلا ةرازو
République Algérienne Démocratique et Populaire
Ministère d’enseignement supérieur et de la recherche scientifique
ةعماج
يحي نب قيدصلا دمحم
-جيج
ل
Université Mohammed Seddik Ben Yahia – Jijel
Faculté des Sciences de Nature et de la Vie
Département: Biologie Moléculaire et Cellulaire
ةيلك
ةايحلاو ةعيبطلا مولع
مسق
ةيولخلا و ةيئيزجلا ايجولويبلا
Mémoire de fin d’études
En vue de l’obtention du diplôme : Master Académique en Biologie
Option : Pharmacologie Expérimentale
Thème
Membres de Jury Présenté par :
Effet neurotoxique chronique des pyréthrinoïdes
chez le rat
Présidente :
Mme .CHERBAL Asma
Examinateur : Dr. DERAI
Encadreur: Dr. KEBIECHE Mohamed
Co- encadreur : BEGHOUL Afafe
Benaziza Nadia
Chidekh Amina
Toureche Toufaha
Dédicace
Nous remercions en premier lieu
ALLAH
le tout puissant
pour toute la volonté et le courage qu’il nous’a donné pour
l’achèvement de cette mémoire, il a été et sera toujours à côté
de nos pour réussir à terminer n’importe quel travail.
Nous tenons à remercier tous ceux qui nous ont aidé de prés ou
de loin pour réaliser ce travail.
Nous ne serions bien sûr jamais arrivées là sans
l’aide et le soutien de nos familles.
Merci à nos parents pour avoir toujours cru en nous.
Merci de nous avoir soutenus dans cette voie, merci de votre
présence, de vos encouragements, de vos conseils, de vos
attentions constantes, merci pour tout. Nous espérons vous rendre
le bonheur que vous nous apportez.
Nous remercions vivement tous la famille de
Toureche, Chidekh ,Benaziza.
A tous nos chères meilleures amies en qui nous avons toujours
trouvé le soutien et le réconfort.
Merci à tous.
Amina
Nadia
Toufaha
Remerciements
Ce mémoire vient finaliser 5 ans de travail. Il marque un terme à cette expérience
professionnelle mais aussi personnelle qui n’aurait pas été réalisée sans le savoir et le
soutien de nombreuses personnes. Nous tenons ainsi à remercier en quelques lignes
tous ceux qui, de près ou de loin ont contribué à ce travail, en espérant n’oublier
personne et il faut trouver les mots justes. Nous allons essayer de faire de nos mieux.
Nous remercions tout d’abord
Allah
, le tout puissant et le maitre de l’univers qui
nous a donné la nécessaire, la forte volonté et la patience afin d’accomplir ce travail et
qui nous a toujours guidé vers le bon chemin.
Nos sincères remerciements vont particulièrement à : Monsieur
Dr. KEBIECHE
Mohamed
pour les conseils judicieux et constants qu’il nous a prodigués tout au
long de ce travail, pour sa disponibilité et son indulgence qui nous ont permis de mener
à bien cette étude, qu’il trouve ici l’expression de mes plus profonds respects et toutes
mes gratitudes.
Nous exprimons nos remerciements à Madame
Beghoul Afaf
notre
Co-encadreur, pour l'encadrement continu qu'elle nous a assuré lors de la réalisation de
cette étude.
Nous remercions qui a fait l’honneur Mme
CHERBEL Asma
de
présider ce jury.
Nous exprimons également nos remerciements à
Dr. DERAI
qui a accepté
d'examiner ce travail et consacré de son temps pour son évaluation.
Nous remercions tout particulièrement nos collègues de filière pharmacologie
expérimentale.
Merci à tous.
Amina
Nadia
Toufaha
Page
Liste des figures : . …. ... i
Liste des tableaux :……… ... iii
Liste des abréviations : ... iv
Introduction : ... 01
Partie I : Synthèse bibliographique
Chapitre I : Les pesticides……… 03
I. Généralités……… ... 03 II. Pyréthrinoide ……… ... 04 II.1. Généralités……….. 04 II.2. Classification……… ... ... 04 II.2.1. Deltaméthrine………. 05 II.2.1.1. Définition……… ... 05
II.2.1.2. Propriétés physicochimiques……… ... 05
II.2.1.3. Toxicocénitique et métabolisme……….. . 06
II.2.2. Bifenthrine ………. 07
II.2.2.1. Définition……… ... 07
II.2.2.2. Propriétés physicochimiques ………. . 07
II.2.2.3. Toxicocénitique et métabolisme………. . 08
III. Mode d’action des Pyréthrinoïdes……… ... 09
III.1. Effet sur les insectes……… ... 09
III.2. Effet sur l’homme……… ... 09
IV. Le stress oxydatif ……… . 10
IV.1. Définition……… ... 10
IV.2.2. Les cible des ROS……… . 11
IV.3.L’impacte du stress oxydatif………. 11
IV. 4. Les systèmes de défense ... ... 12
Chapitre II: Neuro-toxicité des pyréthrinoïdes……….. . 14
I. L’anatomie et la physiologie du cerveau………...14
I.1. Histologie……… ... 14
I.2. Anatomie et fonctionnements du SN ……… ... 14
I.3. Physiologie ……… ... 15
II. Le Stress oxydatif induit par les pyréthrinoïdes……… ... 15
III. Neuro-toxicité……….. 16
III.1. La maladie de parkinson ……… ... 16
III.2. La maladie d’ Alzheimer ……… 18
Partie II : Etude Expérimentale
I. Matériel et méthodes……….
21I.1. Matériel ……….. 21
I.1.1. Les animaux et conditions d’hébergement……….. 21
I.1.2. Choix et préparation des doses ……… ... 21
I.1.3. La préparation des solutions ……… ... 21
I.1. 4. Répartition et traitement des animaux ……… 21
I.1.5. Sacrifice des animaux et prélèvement du cerveau……… 22
II. Evaluation du stress oxydatif mitochondriale……… ... 22
II.1. Extraction des mitochondries du cerveau………. . 22
II.2. Préparation de la matrice mitochondriale ……… ... 23
II.3. Dosage des protéines par la méthode de Bradford (1976)……… ... 23
II.3.1. Principe ………... 23
II.3.2 Déroulement de dosage ……… ... 23
II.4. Mesure du gonflement mitochondrial « mitochondrial swelling »………….. . 23
II.5.1 Principe……… ... 24
II.5.2. Procédure………. 24
II. 6. Dosage du Malondialdéhyde (MDA) ……….. 25
II.6.1. Principe ……… 25
II.6.2. Procédure……….. 25
II.7. Mesure de l’activité enzymatique de la Glutathion S-Transférase (GST)……. 26
II.7.1. Principe ……… ... 26
II.7.2. Procédure ……… ... 26
II.8. Mesure de l’activité enzymatique de la catalase (CAT)……… ... 27
II.8.1. Principe……… ... 27
II.8.2 Procédure ……… ... 27
II.9. Analyse statistique……… . 27
II. Résultats et interprétation …...29
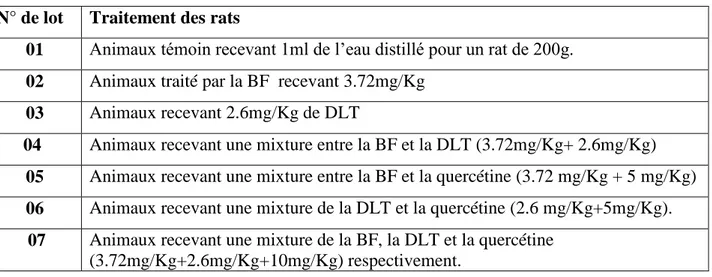
II.1. Evaluation de l’activité de GSH mitochondrial………... 29
II.1.1.L’effet de BF et la Co-administration de la BF et la Quercétine sur l’activité de GSH……… ... 29
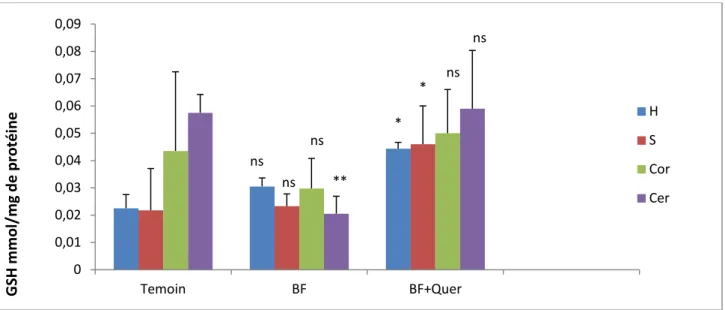
II.1. 2.L’effet de DLT et la Co-administration de la DLT et la Quercétine sur l’activité de GSH……… ... 30
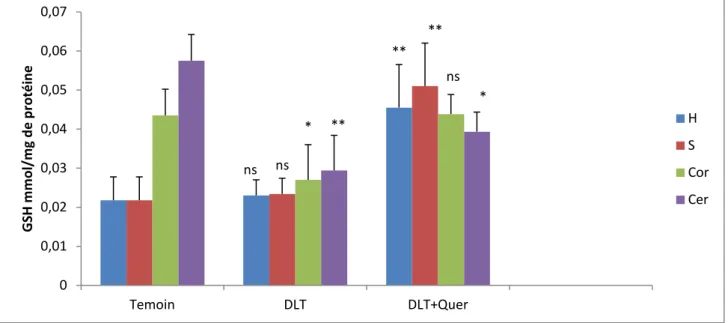
II.1.3.L’effet de la mixture des pyréthrinoïdes et la Co-administration de la mixture et la Quercétine sur l’activité de GSH……… ... 31
II.2. Evaluation de MDA mitochondrial……… ... 32
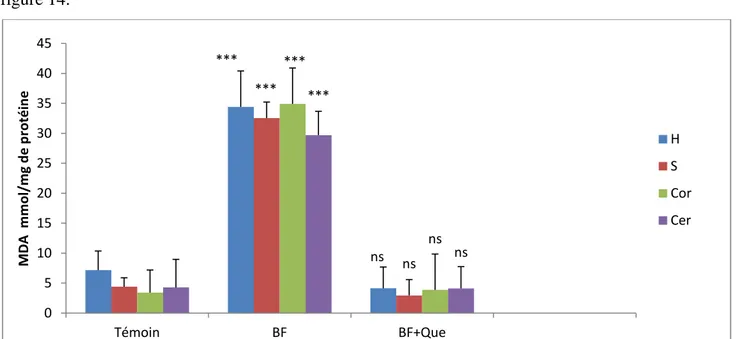
II.2. 1.L’effet de BF et la Co-administration de la BF et la Quercétine sur le taux de MDA mitochondrial……… ... 32
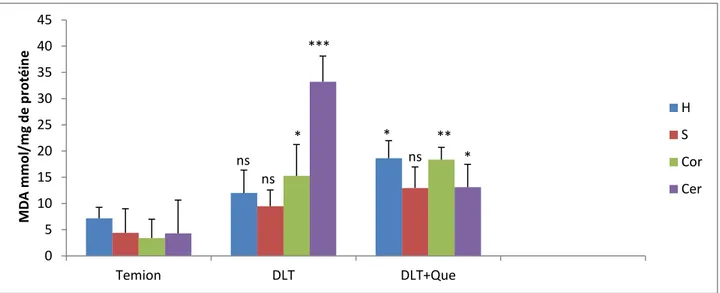
II.2.2.L’effet de DLT et de la quercétine sur le taux de MDA mitochondrial … ... 33
II.2.3.L’effet de la mixture de la mixture et de la mixture avec la quercétine sur le taux de MDA mitochondrial……… ... 34
II.3.Evaluation de l’activité de GST mitochondrial……… ... 35
II.3.1.1.L’effet de BF et la Co-administration de la BF et la Quercétine sur l’activité de GST……… ... 35
sur l’activité de GST……… ... 36
II.3.3. L’effet de la mixture des pyréthrinoïdes et la Co-administration de la mixture et la Quercétine sur l’activité du GST……… ... 37
II.4. Evaluation de l’activité de CAT mitochondrial………... 38
II.4.1.L’effet de BF et la Co-administration de la BF et la Quercétine sur l’activité de CAT……… ... 38
II.4.2.L’effet de DLT et la Co-administration de la DLT et la Quercétine sur l’activité de CAT……… ... 39
II.4.3. L’effet de la mixture des pyréthrinoïdes et la Co-administration de la mixture et la Quercétine sur l’activité de CAT……… ... 40
II.5. Mesure du gonflement mitochondrial……… ... 41
II.5.1.L’effet de la BF et de la quercétine sur le gonflement mitochondrial… ... 41
II.5.2.L’effet de la DLT et de la quercétine sur le gonflement mitochondrial… ... 42
II.5.3.L’effet de la mixture des pyréthrinoïdes et la Co-administration de la mixture et la Quercétine sur le gonflement mitochondrial…… ... 43
III. Discussion……… ... 44
Conclusion ... 49
Références bibliographiques ... .50 Annexes
i
Liste des figures
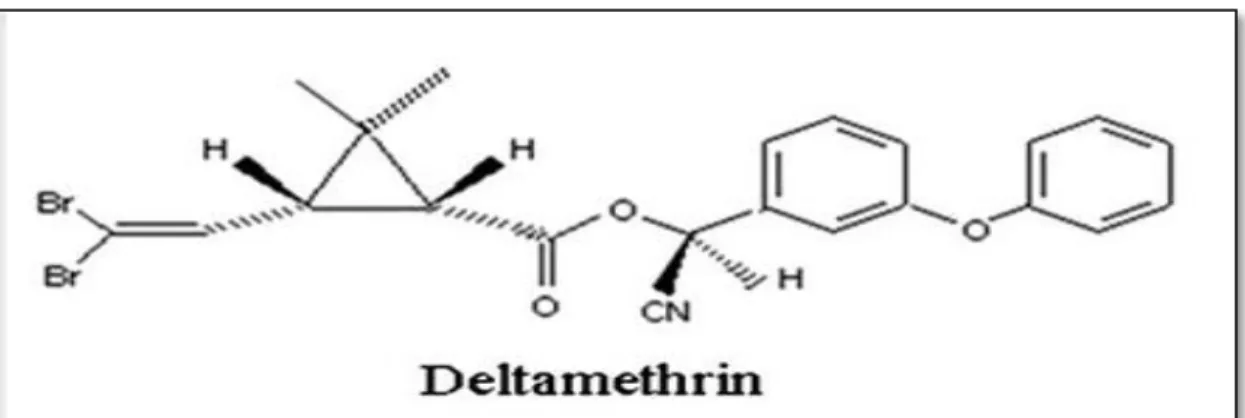
Figure 1: La structure chimique de la Deltaméthrine……… ... 06
Figure 2 : La structure chimique de la Bifenthrine…… ... 08
Figure 3: La balance d’homéostasie ... . 19
Figure 4 : La structure chimique de la quercétine……… ... . 13
Figure 5: Anatomie et grandes fonctions du cerveau……… ... 14
Figure 6: La transmission des signaux nerveux ... 15
Figure 7 : La biosynthèse de la dopamine……… ... ... . 17
Figure 8: Dégradation de la dopamine……… ... ... . 17
Figure 9 : Réaction de GSH avec DTNB……… ... ... . 24
Figure 10 : Réaction du MDA avec 2 TBA ... ... . 25
Figure 11 : La variation de taux de GSH mitochondriale sous l’effet de BF et la BF traité par la Quercétine dans les différentes régions du cerveau. ... . 29
Figure 12 : La variation du taux de GSH mitochondriale sous l’effet de DLT et la DLT traité par la Quercétine dans les différentes régions de cerveau. ... . 30
Figure 13: La variation de taux de GSH mitochondrial sous l’effet de la mixture et la Co-administration de la mixture et la quercétine dans les différentes régions du cerveau. ... . 31
Figure 14: La variation du taux de MDA mitochondrial sous l’effet de la BF et da la Co-administration de BF et la quercétine dans les différentes régions du cerveau ... . 32
Figure 15 : La variation du taux de MDA mitochondrial sous l’effet de la DLT et de la DLT avec la quercétine dans les différentes régions du cerveau. ... . 33
Figure 16 : La variation du taux de MDA mitochondrial sous l’effet de la mixture et de la mixture avec la quercétine dans les différentes régions du cerveau. ... . 34
ii
traité par la Quercétine dans les différentes régions du cerveau. ... . 35
Figure 18: La variation de l’activité de GST mitochondrial sous l’effet de DLT et la DLT
traité par la Quercétine dans les différentes régions du cerveau. ... . 36
Figure 19: La variation de l’activité de GST mitochondrial sous l’effet de la mixture et la
Co-administration de la mixture et la quercétine dans les différentes régions du cerveau ... . 37
Figure 20: La variation de l’activité de CAT mitochondriale sous l’effet de BF et la BF
traité par la Quercétine dans les différentes régions du cerveau. ... . 38
Figure 21: La variation de l’activité de CAT mitochondriale sous l’effet de DLT et la DLT
traité par la Quercétine dans les différentes régions du cerveau……… ... 39
Figure 22: La variation de l’activité de CAT mitochondriale sous l’effet de la mixture et la
Co-administration de la mixture et la quercétine dans les différentes régions du cerveau………40
Figure 23 : La variation du gonflement mitochondrial sous l’effet de la BF et de la
Co-administration de la BF et la Quercétine dans les différentes régions du cerveau……… . . 41
Figure 24: La variation du gonflement mitochondrial sous l’effet de la DLT et de la
Co-administration de la DLT et la Quercétine dans les différentes régions du cerveau. ... . 42
Figure 25: La variation du gonflement mitochondrial sous l’effet de la mixture et de la
iii
Liste des tableaux
Tableau 1: Classification des pyréthrinoïdes ... 4
Tableau 2: Propriétés physiques de la Deltaméthrine …. ... 5
Tableau 3 : Propriétés physiques de la Bifenthrine ... 7
Tableau 04:La DL50 et le DJA de la DLT et de la BF ………25
iv
Liste des abréviations
3-MT 3-méthoxytyramine 3-PBA 3-phenoxybenzoic acid ADH Alcool déshydrogénase ALDH L’aldéhyde déshydrogénase AND Acid Desoxyribo- Nuclear
Apaf-1 Apoptotic protease activating factor-1 APP Amyloid precursor protein
BBC Bleu Brillant de Coomassie
BF Bifenthrine
BSA Bovin Serum Albumin
CAT Catalase
CDNB Chlorodinitrobenzéne Chop Protéines chaperonnes ClO Acide hypochloreux
COMT Cathecol-O-methyl transférase Cu Cuivre
Cyt c Cytochrome c
DAT Transporteurs de dopamine
DBCA Cis-dibromovinyl-dimethylcyclopropane-carboxylic acid DDC Dopa décarboxylase
DLT Deltaméthrine
DO Densité optique
DOPAC Acide dihydroxyphénylacétique DOPAL 3,4-dihydroxyphenylacetaldehyde DOPET 3,4-dihydroxy-phényl éthanol DTNB 5-5’-dithiobis2-nitrobenzoïque
EDTA Acide Éthyléne Diamine Tétra-acétique FADD Fas Associated Death Domain
v GABA Gamma-aminobutyric acid
GPx Glutathion Peroxydase GR Glutathion réductase GSH Glutathion réduit GSSG Glutathion Oxydé
GST Glutathion -S- Transférase
H2O2 Peroxyde d’hydrogène (eau oxygénée) HVA Acide homovanillique
L-Dopa L- dihydroxy phenylalanine MA Maladie d’Alzheimer
MAO Mono-amine- oxydase MDA Malondialdéhyde MP Maladie de parkinson
NADPH Nicotinamide Adénine Dinucléotide Phosphate NFT Neurofibrillary tangles
NO° Monoxyde d’azote NO° Oxyde nitrique NOS NO synthase O° 2 Anion superoxyde OC Organochlorés OH° Le radical hydroxyl ONOO° Peroxynitrite OP Organophosphoré P450 Cytochromes P450 p53 Phosphoprotein of 53 KDa pH Potentiel d’hydrogène PKC Phosphokinases à calcium
PTP Permeability transition pore RE Réticulum endoplasmique RNS Reactive nitrogen Species ROO° Radical peroxyl
vi ROS Reactive oxygen species
Se Sélénium
SN Système nerveux
SNC Système nerveux central SNP Système nerveux périphérique SO Stress oxydatif
SOD Superoxyde dismutase TBA Thiobarbituric Acid
TBARS Thiobarbituric acid reactive substances TCA Acide Trichloroacétique
TEP Tetramethoxypropane TH Tyrosine hydroxylase TNF Timor nécrosais factor
TS Sucrose, Tris TSE Sucrose, Tris, EDTA
UI Unité internationale Zn Zinc
1
Introduction
A l’ère de la société de consommation et la demande incessante de la population mondiale en produits alimentaires, il est plus qu’indispensable de miser sur les grandes cultures et l’agriculture massive afin de répondre à cette exigence contemporaine de l’humanité. Cette demande ne peut être satisfaite avec les méthodes classiques de production agricole, ce qui a poussé les agriculteurs à opter pour l’intensification de la production des produits agricoles en assurant une large prise en charge phytosanitaire des cultures et l’utilisation intensive des pesticides afin d’augmenter la biomasse végétative et diminuer les vecteurs des différentes maladies, (Refaie et al., 2014).
Malheureusement, ces substances constituent un danger de toxicité permanente pourla santé de la population, ce qui a suscité une attention particulièreen toxicologie environnementale. En effet, ces polluantssont responsables de sérieux problèmes environnementaux en raison de leur large utilisation par les agriculteurs, leur persistance et leur bioaccumulation le long de la chaine trophique. De plus, plusieurs études ont montrél’implication de ces xénobiotiques dans la survenue de diverses pathologies, (Vendelac et Bacon, 1999). L’exposition aux pesticides peut se produire directement lors de leur production ou de leur utilisation professionnelle et que les personnes intoxiquées sont prises en charges parla médecine professionnelle ou les centre de détoxication spécialisés. Or, l’exposition de la population générale à ces toxiques, à de faiblesdoses via les
matrices biologiques, notamment alimentaires, reste sans étude d’impact sur l’organisme vivant, ce qui rend opaque la relation entre ces polluants et l’étiologie de certaines pathologies telles que les
maladies métaboliques, les maladies neurodégénératives, les atteintes de la fonction de la reproduction, les altérations neuro-développementales et les cancers, (Baldiet al., 2012).
Parmi les pesticides les plus utilisé en Algérie sont les pyréthrinoïdes de synthèse. Ces produits sont de plus en plus utilisés, puisque on enregistre que 30% des insecticides utilisés dans le monde sont des pyréthrinoïdes qui deviennent le choix préférédans plusieurs domaines agricoles, domestique et vétérinaires, de par leur potentiel insecticide élevé et leur tendance à se biodégrader plus rapidement dans l’environnement, (Iwanika et Borzechi, 2015).Comme tous les pesticides, ces produits chimiques ont une toxicité plus élevée grâce à leur nature lipophile cumulant souvent dans les tissus adipeux. Ils sont aussicapables de produire des espèces réactives de l’oxygène (ROS) pendant leur métabolisation, en altérant ainsi l’intégrité et la fonction de la cellule et ses organelles, particulièrement la mitochondrie qui produit plus de ROS susceptible d’engendrer un déséquilibre dans le statut redox causant par la suite des différentes altérations mitochondriales allant d’une
2
perturbation respiratoire jusqu’à l’apoptose ou la nécrose, (Ambolet-camoit et al., 2012 ; Hossin
et al., 2014).
Dans cette présente étude, notre travail est axé sur l’évaluation des effets neurotoxiques de Deltaméthrine et Bifenthrine administrés en chronique (6 mois) à des doses respectives de 3.72 mg/kg et 2.6 mg/kg, seuls et en mixture chez le rat Wistar Albinos. Par ailleurs, une attention est accordée à l’utilisation d’un composé phénolique, en l’occurrence la quercétine, qui possède un potentiel antioxydant et cytoprotecteur afin de prévenir les effets délétères de ces pyréthrinoides.
Chapitre I : Les pesticides
I. Généralités
Les pesticides sont des substances ou mélange de substances chimiques ou biologiques utilisées essentiellement comme étant insecticides, herbicides ou fongicides (Agrawal et Sharma, 2010 ;
Sanchez-Bayo et Goka, 2014). Ces pesticides sont également utilisés pour empêcher et/ou détruire
tous les parasites pouvant infecter le végétal. Par ailleurs, certains de ces pesticides sont considérés aussi comme régulateurs de croissance de plantes, défoliants, déshydratants ou encore agents
empêchant la chute prématurée du fruit et les substances appliquées aux récoltes avant ou après la moisson pour protéger le produit contre sa détérioration pendant le stockage et le transport,
(Agrawal et Sharma, 2010).
La population générale consomme annuellement presque trois billion Kilogrammes de pesticides, leur utilisation dans la production végétale dans le monde a augmenté
approximativement vingt fois entre 1960 et 2000 pour atteindre 4.7 milliards de tonnes en 2007,
(Hu et al., 2015).
Les pesticides sont principalement groupés soit :
Selon la cible visée de leur utilisation tels que les herbicides, les insecticides, les fongicides, les bactéricides, (Dutta et Sahu, 2013).
Selon les propriétés chimiques de ces pesticides, qui peuvent être classés en organochlorés
(OC), organophosphorés (OP), carbamates, dithiocarbamates et pyréthrinoïdes, (Tiwari
et Ansari, 2014).
Selon leur mécanisme d’action, tels que les neurotoxines (OC, OP et pyréthrinoïdes) ou encore les fumigènes de soufre, des dérivés d'urée et même des produits botaniques et biologiques ayant été également employées comme pesticides dans l'histoire humaine,
(Ye et al., 2013).
L’homme peut être exposé aux pesticides par différents modes :
L’exposition professionnelle aux pesticides concerne essentiellement les personnes manipulant
ces pesticides pendant leur production, leur transport et leur préparation et application de ces produits dans le lieu des cultures par différentes voies telles que l’inhalation et l'absorption
cutanée qui sont considérées comme itinéraires primaires des expositions aux pesticides dans les milieux culturels et industriels. Les expositions respiratoires se produisent habituellement en appliquant les pesticides fortement volatils, touchant particulièrement les travailleurs qui fonctionnent sans matériel de protection respiratoire (masque avec le filtre) ou dans un environnement clos et mal aéré, (Ye et al., 2013).L'absorption cutanée se produit par le contact
direct de la peau avec les pesticides ou à travers l'habillement et les outils souillés avec les résidus de pesticides, (Ye et al., 2013).
Exposition non professionnelle : L’ensemble de la population peut être exposé aux pesticides
à travers les matrices biologiques alimentaires, l’eau et l’air contaminés, (Ye et al., 2013).
II. Les pyréthrinoïdes
II.1. Généralités
Les pyréthrinoïdes, sont des insecticides de synthèse ayant un noyau structurel similaire aux pyréthrines, également leurs composants toxiques sont trouvés dans la fleur de la plante
Chrysanthemum cinerariae foliummais ; ces composants se dégradent moins rapidement dans
l’organisme (photosensibles dans l’environnement) et maintiennent donc leurs efficacité pendant une période de temps prolongée, (kaviraj et Gupta, 2014 ; Hossain et al., 2015 ).
Le terme « pyréthrines » est employé au pluriel parce qu’il désigne le mélange des six molécules formant l’extrait naturel (pyréthrine I, cinerine I, jasmoline I, sont des esters de l’acide chrisanthemique et perithrine II, cinerine II, jasmoline II), (Ban et al., 2010 ; Rehman et al., 2014).
II.2. Classification
Les pyréthrinoïdes sont classés en deux grands groupes: le type I et de type II, selon la structure chimique et la symptomatologie après la toxicité aiguë (tableau 01).
Pyréthrinoïdes de type I manquent d’un groupe alpha cyano avec le carbone de 3– phénoxybenzyl provoquent un «syndrome T» caractérisé par hyperexcitation,
incoordination et l'ensemble des tremblements du corps, (Hossain et al., 2014 ; Cao et al.,
2014 ; Scollon et al., 2015).
Alors que les Pyréthrinoïdes de type II ont un groupe alpha cyano avec un carbone provoquant un «syndrome CS» caractérisé par une salivation abondante, choréoathétose, hypersensibilité et paralysie, (Hossain et al., 2014 ; Cao et al., 2014 ; Scollon et al., 2015).
Tableau 01 : Classification des pyréthrinoïdes, (Gunay et al., 2010) .
Type I Type II Allerthrin Resmethrin Permethrin Bifenthrin Fenvalerate Cyhalothrin Cypermethrin Deltamethrin
Parmi les différents pyréthrinoïdes les plus répandus comme étant pesticides de synthèse utilisée, on cite :
II.2.1. Deltaméthrine (DLT)
II.2.1.1. Définition
DLT [(S)-α-cyano-3-phenoxybenzyl-(1R,cis)-2,2-dimethyl-3-(2,2-dibromovinyl-cyclopropane carboxylate] est l'un des pesticides synthétiques de type II des pyréthrinoïdes les plus couramment utilisés. Il est caractérisé par une forte activité contre un large spectre d'insectes nuisibles, (Huang
et al., 2014 ; Xiong et al., 2014).
II.2.1.2. Propriété physico-chimique
Propriété physique : Est une substance solide, blanche, inodore et presque insoluble dans l’eau
mais soluble dans de nombreux solvants organique tels que l’acétone, l’acétate d’éthyle, le xylène et le diméthyl sulfoxyde … (Rehman et al., 2014). Ses principaux caractères
physiques sont reportés dans le tableau 02.
Tableau 02 : Propriété physique de DLT, (Rehman et al., 2014) .
Masse molaire 505.2 g/mol
Point de fusion 98 à 102°c
Point d’ébullition ≥ 270°c
Densité 0.5
Pression de vapeur 1.24*106mm Hg
Propriété chimique : La DLT se dégrade Sous l’effet de rayonnement lumineux, en particulier l’irradiation solaire. Elle présente de nombreuse fonctions comme l’halogène, les doubles
liaisons, l’ester, le groupe nitrile, (figure 01), qui constituent des points d’attaque possible de la structure par des divers réactifs. La DLT présente une exceptionnelle stabilité aux acides,
Figure 01 : La structure chimique de la DLT (C22H19Br2NO3), (Hossain et Richardson, 2011
II.2.1.3. Toxicocénitique et métabolisme
La DLT est une molécule lipophile peut être absorbée par les différentes voies et est éliminée dans les urines et les fèces sous forme de métabolites résultant de son hydrolyse et de son oxydation dans l’organisme, (Bavoux et al., 2007) .
Chez l’homme
L’administration orale d’une dose unique de DLT chez des volontaires a permis de montrer que
le pic plasmatique apparait presque 2 heures après l’administration et reste détectable jusqu’à la 48ème heure. Elle est rapidement métabolisée au niveau hépatique avec formation d’acide 3-phénoxybenzoique (3-PBA) et d’acide décamétrique (ou acide
cis-3-(2,2dibromovinyl)-2,2-diméthyl-cyclopropane-1-carboxylique ou cis Br2 CA), (Iwanicka et Borzecki, 2015).
La DLT peut être éliminée soit sous forme de 3-PBA et cis-Br2CA, soit sous forme inchangée,
l’élimination urinaire représente presque 60 % de la dose absorbée ; tandis que l’élimination fécale est environ 10 à 26 %, leur demi-vie d’élimination varie entre 10 et 13,5 heures, (Bavoux et al.,
2007) .
Chez l’animal
La DLT est facilement absorbée par le tractus gastro- intestinal, avec un taux de 90% chez le rat. Par contre, son absorption respiratoire et dermatologique est faible, mais peut être augmentée en fonction du solvant organique. Les études chez le rat, la souris et la vache montrent qu’après ingestion de DLT, ce pesticide va être distribué avec concentration important dans les tissus adipeux grâce à leur lipophilie et presque 1.6 % de la dose administrée de ce pesticide sont sécrétés dans le lait, (Bavoux et al., 2007 ; fishel, 2014).
La DLT est métabolisée en composés non toxiques DBCA (cis-dibromovinyl-dimethyl-cyclopropane-carboxylic acid) et 3-PBA (3-phenoxy-benzoic acid) par oxydation, par hydrolyse de la fonction ester et par conversion du groupement cyano en thiocyanate. les métabolites oxydés sont ensuite sulfo-ou gluco-conjugués, facilitant ainsi leur élimination dans les urines, (Bavoux et al.,
2007 ; Starr et al., 2014).
II.2.2. Bifenthrine (BF)
II.2.2.1. Définition
La BF ((2-methyl-1,1-biphenyl-3-y1)-methyl-3-(2-chloro-3, 3, 3-trifluoro-1-propenyl)-2,2-dimethyl cyclopropanecarboxylate) est un insecticide de type I des pyréthrinoïdes utilisé pour détruire les insectes ravageurs dans l’agriculture, les mouches et les moustiques, (Mukherjee et al.,
2010 ; Chaudhari et Saxena, 2015) .
II.2.2.2. Propriété physico-chimique
Propriété physique : c’est une substance cireuse, beige, presque insoluble dans l’eau, soluble dans la plupart des solvants organique, (Beausoleil et al., 2009). Ses principales caractéristiques physiques sont indiquées dans le tableau 3.
Tableau 03 : Propriété physique de BF, (Beausoleil et al., 2009 ; Mukherjee et al., 2010).
Propriétés chimiques : La BF est stable dans l’eau dans une température de 25°c jusqu'à 50°c pendant deux années. Elle peut réagir avec des forts oxydants avec un risque d’incendie ou d’explosion, (figure 02), (Beausoleil et al., 2009).
Masse molaire 422.88 g/mol
Point de fusion 66-69°c
Point d’ébullition ≥ 285 °c
Solubilité dans l’eau 0.1 mg/l
Figure 02 : La structure chimique de la BF (C23H22ClF3O2), (Cao et al., 2014).
II.2.2.3. Toxicocénitique et métabolisme
Chez l’animal1. Absorption : La BF est bien absorbée par voie orale (environ 50%).l’absorption cutanée a été
relativement estimée à 12%, (Beausoleil et al., 2009) .
2. Distribution : Après administration d’une dose unique par voie orale de BF radio marquée au
C14, les concentrations plasmatiques prennent leur maximum entre 4-6 heures, puis ils sont
diminuées lentement avec des taux de radioactivité restant détectables (24 jusqu’à 48 heures). Et par l’administration répétée de BF radio-marquée au C14
pendant 70 jours se distribue dans le tissu adipeux, le pancréas, la peau, le foie, et les poumons et le plateau sanguin de la molécule est atteint après 21 jours. Les demi-vies d’élimination après arrêt du traitement sont d’environ 19 et 51 jours pour le foie et les tissus adipeux respectivement, et elle est également excrétée dans le lait maternel, (Beausoleil et al., 2009) .
3. Métabolisme : Après la dégradation de la BF par l’hydrolyse, on obtient deux métabolites:
4’-hydroxy Bifenthrin et benylphenoxy (acide, alcool ou aldehyde), (Mukherjee et al., 2010).
4. Elimination : La BF est éliminée particulièrement dans les fèces (66-83%), également dans
III. Mode d’action des Pyréthrinoïdes
III.1. Effet sur les insectes
Le mécanisme principal des pyréthrinoïdes est traduit par des effets neurotoxiques chez les insectes suite au changement de la cinétique d’ouverture des canaux sodiques
voltage-dépendants (Na+) : Soit de prolonger l’ouverture de ces derniers, soit de retarder leur inactivation
ce qui augmente la probabilité d'une action répétée, et augmenté l'excitabilité neuronale en conduisant finalement l’insecte à la mort par convulsions (paralysée flasque), (Wang et al.,
2015 ; Magby et Richardson, 2015 ).
III.2. Effet sur l’homme
De nombreux pesticides sont toxiques pour l’être humain. L'exposition aux pesticides peut conduit à diverses conditions pathologiques telles que :
La neuro-toxicité: Le stress du réticulum endoplasmique (RE) est un facteur important à la neuro-dégénérescence et le dysfonctionnement cognitif dans une variété de maladies, y compris la maladie d'Alzheimer (MA) et Parkinson (MP). Des études montrent que les pesticide surtout les pyréthrinoïdes provoquent le stress oxydatif (SO) soit dans le RE, soit dans la mitochondrie et provoquent ensuite l'apoptose, (Hossain et al., 2015).
L’hépato-toxicité: La structure et la fonction du foie sont touchées par le SO avec
augmentation de l'expression hépatique de cytokines pro-inflammatoires conduit finalement à hépato-stéatose, (Li et al., 2015).
Des études effectué sur l’exposition aux pesticides et les différentes pathologies ont montré qu’il y a une relation positive entre l’exposition au pesticides et :
Le cancer de l'estomac : le taux le plus élevé a été constaté dans des zones à niveaux
élevés de contamination de pesticide dans l'eau, (Bassil et al., 2007 ; Gunduz et al.,
2015). Le cancer du rein : cette association est non seulement dans les populations directement
exposées, mais aussi chez les enfants de parents exposés, avec un effet constant quand les
gens sont soumis à une exposition prolongée, (Bassil et al., 2007 ; Gunduz et al., 2015).
Le cancer du poumon : avec un risque élevé chez les femmes exposées aux pesticides, (Bassil et al., 2007 ; Gunduz et al., 2015).
IV. Le stress oxydatif
IV.1. Définition
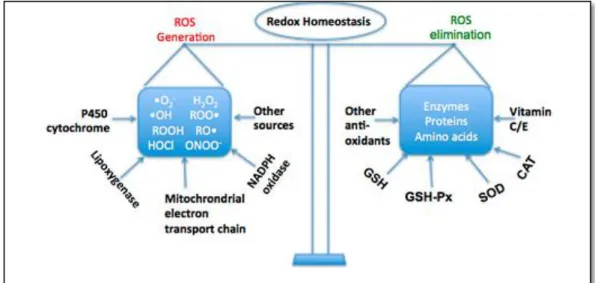
Il est communément défini comme un déséquilibre entre les systèmes oxydants et les capacités anti-oxydantes d’un organisme, d’une cellule ou d’un compartiment cellulaire : soit par augmentation de la production des ROS (Reactive Oxygen Species) ou RNS (Reactive nitrogen Species), soit par diminution des mécanismes de défense ou par les deux situation cumulées, (figure 03), (Kebieche et al., 2009 ; Agarwal et al., 2012 ; Ramriez et al., 2016).
Figure 03: La balance d’homéostasie, (Li et al., 2015).
IV.2. Les ROS
Les radicaux libres sont des espèces chimiques contenant des électrons dépareillés habituellement instables et fortement réactifs, ces espèces réactives ne sont pas nécessairement nuisibles à l’organisme sous des conditions physiologiques. En fait, les ROS sont indispensables dans l’organisme pour exécuter des fonctions physiologiques importantes. La génération des ROS est une activité normale de la vie aérobie, nécessaire à la manifestation des fonctions cellulaires telles que la transduction des voies de signalisation, la défense contre les micro-organismes envahissants, et l’expression des gènes à la promotion de la croissance ou de la mort cellulaire (par les mécanismes nécrotiques et/ou apoptotique), (Nathan et Cunningham-Bussel, 2013 ; Nita et
Grzybowski, 2016).
IV.2.1. Les sources des radicaux libres :
il y a plusieurs sources des ROS mais les plus importants sont : NADPH oxydase, la NO Synthase, les ions métalliques, le réticulum endoplasmique, la mitochondrie, (Nathan et Cunningham-Bussel, 2013).IV.2.2. Les cible des ROS :
Les attaques néfastes à partir de l'excès des ROS peuvent finalement conduire à la mort des cellules. Ces attaques privilégient trois cibles essentielles.
Les lipides : la peroxydation lipidique produit dans les secteurs où les chaînes latérales
polyinsaturées d'acide gras sont répandues. Ces chaînes réagissent avec de l'O2 et créent
le radical de pyroxyle qui peut capter les H+ des autres acides gras et créent une réaction continue pouvant donner le MDA et le pentane comme étant produits de la peroxydation lipidique, (Marı et al., 2010 ;Agrawel et al., 2012 ; Li et al., 2015).
Les protéines : les acides aminés aromatiques et soufrés sont les cibles les plus
endommagés. L’oxydation directe des chaînes latérales protéiques peut mener à la formation des groupes carbonyliques, (Marı et al., 2010 ;Agrawel et al., 2012 ; Li et al., 2015).
Les acides nucléiques oxydation d'ADN particulièrement l'ADN mitochondrial: L’attaque
des ROS due à la présence de l'O2° et provoquons des mutations et des cassures aux
différents niveau avec le manque de protection d'histone, et l'absence des mécanismes de réparation, (Marı et al., 2010 ;Agrawel et al., 2012 ; Li et al., 2015).
IV.3. L’impact du stress oxydative
Le stress oxydative joue un rôle important dans différents processus pathologique des systèmes ou des organes par le déclenchement de la mort cellulaire soit programmée soit par nécrose, (Lee
et al., 2015).
La nécroseest définie comme un processus de la mort cellulaire incontrôlée, violente et rapide,
causée par un stress physique ou chimique extrême. Ce processus est terminé par la rupture de la membrane plasmique et la libération du contenu de la cellule, ce qui déclenche une réaction
inflammatoire, (Guicciardi et al., 2013).
L’apoptose est un processus physiologique de la mort cellulaire programmé pour maintenir
l’homéostasie, l’élimination des cellules endommagées et la régulation immunitaire...etc,
(Guicciardi et al., 2013 ; Orangi et al., 2016).
Il existe deux voie principales de l’induction de l’apoptose : la voie extrinsèque (voie des récepteurs de mort), et la voie intrinsèque (voie mitochondriale ou par le RE), (El-Sayed et al.,
2016 ; Teocchi et D’souza-Li, 2016).
La voie extrinsèque : cette voie est déclenché par la fixation des ligands spécifiques (Fas L,
TNF-R1, APO-LL…) sur les récepteurs de la mort (Fas, TNF-R1, DR4, DR5 …) à la surface des cellules, (Lee et al., 2015). L’activation de ces récepteurs qui possèdent des régions appelées
domaine de mort (FADD et TRADD) qui interagit avec les pro-caspases 8 conduisant à la signalisation continue qui est initié par l’activation des caspases initiatrices caspase 8 qui à leur
tour activent les caspases effectrices 3, 7 et 6, enzymes hydrolysant les molécules protéiques dans la cellule en lui causant finalement la mort apoptotique, (Huang et al., 2015 ; Lee et al., 2015 ;
Teocchi et D’souza-Li, 2016 ).
L’activation des caspases 8 peut déclencher la voie intrinsèque par l’intermédiaire de la protéine BID de la famille Bcl-2, (Lee et al., 2015).
La voie intrinsèque : est induite par différents signaux de stress cellulaire tel que le stress mitochondrial où les ROS provoquent l’ouverture des canaux géants produisant gonflement
mitochondrial et la libération de Cyt c, ce dernier lié avec la caspase 9 et l’Apaf-1 formant un complexe appelé l’apoptosome, macromolécule nécessaire à l’activation des caspases effectrices
qui donnent également la mort cellulaire par apoptose, (Huang et al., 2015 ; Yu et al., 2015 ;
Teocchi et D’souza-Li, 2016).Les corps apoptotique est spontanément éliminé par
les macrophages par la phagocytose, (Guicciardi et al., 2013).
IV.4. Les systèmes de défense
Les antioxydants sont des extracteurs qui détoxifient l'excès des ROS en maintenant l'équilibre du statut redox du corps soit par inhibition directe de la production, la limitation de la propagation et la destruction des ROS, (Ishihara et al., 2015) .
Il y a deux types d'antioxydants : enzymatique et non-enzymatique:
Les antioxydants enzymatiques possèdent un centre métallique, qui leur donne la capacité de prendre différentes valences pendant le transfert des électrons aux molécules d'équilibre. Ils neutralisent l'excès des ROS et empêchent sa propagation dans la cellule et donc annulent ou
diminuent leurs dommages. Les enzymes endogènes antioxydant sont la SOD, CAT, GPx et GR,
(Agrawel et al., 2012 ); Ishihara et al., 2015).
Les antioxydants non enzymatiques dépendent essentiellement de l’alimentation et des
suppléments diététiques tels que la vitamine C, le GSH, la vitamine E, les oligoéléments (le Zn, le Se et le Cu), le béta carotène, le carotène et les flavonoïdes, (Agarwal et al., 2012 ; Zhou et al.,
Les flavonoïdes : Les flavonoïdes sont des composés phénoliques des végétaux, possèdent
des propriétés anti-oxydantes fortes, des activités biochimiques et pharmacologiques (El-Gerbed
et al., 2015 ; Zujko et al .,2015) ; parmi lesquels on peut citer la quercétine (3,3',4 ', 5,
7-pentahydroxyflavone), (Figure 04) qui se répand dans la nature et notamment dans les fruits, les légumes et les différentes plantes. Ce composé phénolique est pourvu d’une activité biologique
et pharmacologique importante pouvant être utilisé comme anti-inflammatoires, anti-athérosclérotique, antithrombotiques, anti-hypertensive,… (Ashar et Muthu, 2012 ; Kang et
al., 2013).
Figure 04: La structure chimique de la quercétine C15H10O7, (Dajas et al., 2015).
La pharmacocinétique de la quercétine
Après administration par voie orale chez les rats Wistar, environ 93.3% de la quercétine étaient
métabolisé dans l'intestin, avec seulement 3.1% métabolisé dans le foie et 5.3% sans changement. Le pourcentage d’absorption de la quercétine pouvant dépasser 59.1%, et est éliminée
essentiellement dans les urines, (Oliva et al., 2011 ;Li et al., 2016) .
Ce flavonoïde possède une activité biologique sur plusieurs aspects cellulaires à savoir : Son
action sur la modulation des facteurs de signalisation et de la transcription intracellulaire, ajouté à cela son effet sur l’augmentation de l'expression des protéines anti oxydantes et de la survie
cellulaire. Elle apparaît également comme molécule importante pour la protection neuronale. La quercétine est susceptible de régler aussi l'activité des kinases, par le changement de l'état
phosphorylatif de certaines molécules ciblées dans la communication cellulaire, (figure 06), (Dajas
14
I. Anatomie et la physiologie du cerveau
I.1. Histologie
Le système nerveux (SN) est l’ensemble des systèmes qui mettent le corps dans un état d’équilibre. Il est subdivisé en deux systèmes : centrale (SNC) et périphérique (SNP) ; il est
composé surtout de tissu nerveux, qui est très complexe et est constitué deux type de cellules : les neurones produisent, conduisent et transmettent les signaux ; et les gliocytes dont leurs rôle est la protection des neurones, (Vibert et al., 2005).
- Le SNC : C’est le centre de régulation et de communication de l’organisme, il est formé de l’encéphale et de la moelle épinière.
- Le SNP : c’est la ligne de communication entre le SNC et l’organisme, et est situé à l’extrémité de SNC. Il est formé principalement des nerfs (crâniens et spinaux) issus de l’encéphale et de la moelle épinière qui comprend deux types de voies, (Marieb, 2005).
- La voie sensitive (afférente): il transporte l’influx des récepteurs sensoriels (la peau,
les organes des sens du muscle squelettique) vers le SNC.
- La voie motrice (efférente) : cette voie renferme aussi deux parties : SN somatique (volontaire)
et SN végétatif (autonome) qui est subdivisé à son tour en SN sympathique et parasympathique, l’un est stimulé et l’autre inhibé, (Marieb, 2005).
I.2. Anatomie et fonctionnement du SN
L’essentiel des aspects anatomiques et physiologique est représenté dans la figure 5, où on constate les différentes fonctions neuronales en relation avec les différentes parties anatomiques du cerveau.
Figure 05 : Anatomie et grandes fonctions du cerveau, (Fein et Cardenas, 2015 ; Clarke et Adermark, 2015; Kubik et Philbert, 2015).
15 I.3. Physiologie
Le SN détecte les différentes stimulations (externe et interne) et réagit rapidement avec une très haute coordination ; les signaux électriques sont constitués des potentiels d’action qui se propagent rapidement le long des axones d’un neurone à l’autre ou d’un neurone à une cellule effectrice,
(Dong et al., 2015).
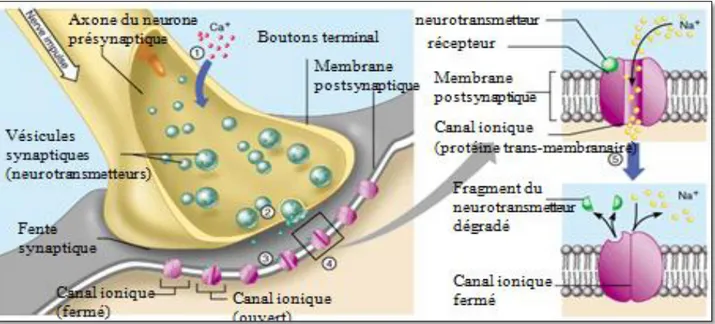
Au niveau des synapses, lorsque l’influx nerveux atteigne les terminaisons pré-synaptiques déclenchent des événements qui aboutissent à la libération d’un neurotransmetteur à travers la fente synaptique qui modifie la perméabilité de la membrane post-synaptique. Les canaux sodiques
voltage dépendants sont responsables de l’initiation et la propagation de ces potentiels d'action le long de l’axone, le canal de sodium forme un pore dans la membrane qui est hautement sélectif
pour les ions Na+.A l’état de repos, les canaux sodiques sont fermés. Lorsque la membrane est dépolarisée, les canaux sodiques sont ouverts, (Figure 06), (Dong et al., 2015).
Figure 06 : La transmission des signaux nerveux, (Marieb, 2005).
II. Le stress oxydatif induit par les pyréthrinoïdes
Des études épidémiologiques indiquent qu’il ya une association positive entre l’exposition aux pesticides et les maladies neuro-dégénératives en l’occurrence le Parkinson et l’Alzheimer, causées suite la générations des ROS tels que O2-, H2O2, OH°, (Hossain et al., 2015 ; Li et al., 2015 ; Elwan et al., 2016).D’autres études montrent que l’administration par voie orale des insecticides
provoque la mort neuronale dans le cortex, l’hippocampe et le striatum et induit ainsi le dysfonctionnement de la mémoire et de l’apprentissage, (GadElhak et al., 2010 ; Chin-Chan et
16
Le stress du réticulum endoplasmique (RE) est impliqué comme un contributeur significatif pour les maladies neuro-dégénératifs et les dysfonctionnements cognitifs. Dans le cas normal,
l’expression des protéines chaperonnes (chop) dans l’hippocampe est faible, mais dans le cas du stress au niveau du RE, il ya une augmentation de l’expression de ces protéines Chop, ces derniers ayant un effet inhibiteur sur l’expression des anti-apoptotique Bcl2 et un effet effecteur
sur les différentes molécules pro-apoptotiques DR5, TRB3 ……(Khalatbarry et al., 2015).
L‘exposition chronique au Deltaméthrine (DLT) à des très faibles doses induit l’augmentation des radicaux libres au niveau du RE donnant un stress oxydatif pro-apoptotique chez les neurones
via l’augmentation des produits de la peroxydation lipidique et la diminution de l’activité des enzymes anti oxydantes,(Hossaine et al.,2015 ; Li et al., 2015).
La DLT interagit avec les canaux Na+et prolonge leur ouverture. L’influx continue de Na+ augmente la concentration du Ca+ intracellulaire ce qui induit l’activation des calpaines et des protéines Chops simultanément, suivie par une cascades d’activation des caspases 12, 9 et 3 respectivement ce qui provoque la fragmentation d’ADN (indicateur de l’apoptose),(GadElhak et
al., 2010 ;He et al., 2012 ;Khalatbarry et al., 2015).
La DLT peut affecter le fonctionnement mitochondriale par l’altération de l’expression des Cyt c et p53 et induit l’apoptose des cellules neuronales, (GadElhak et al., 2010) Par l’augmentation de l’expression des pro-apoptotique (Bax) et la diminution de l’expression des anti-apoptotique (Bcl2) dans le striatum,(Khalatbarry et al., 2015 ; Li et al., 2015).
Des autres études montrent que l’exposition aux pesticides particulièrement Bifenthrine
provoque l’augmentation de taux de MDA et la diminution de l’activité des antioxydants GSH et des autres enzymes comme la SOD et la CAT donc la mort cellulaire, (Dar et al., 2013).
III. Neuro-toxicité
III.1. Maladie de Parkinson (MP)
Dans les conditions physiologiques, le contrôle de la motricité, la mémoire, l’apprentissage, l’attention et la motivation se fait par la sécrétion de plusieurs neurotransmetteurs comme le GABA (Gamma-aminobutyric acid), l’Acétyle Choline et la dopamine. Cette dernière est une catécholamine synthétisée à partir de la tyrosine (figure 07), par les neurones dopaminergique qui représentent seulement 0.3% des cellules du cerveau dans des zones très localisées de l’encéphale et plus particulièrement dans la substance noire (locus nigre),(Dias et al., 2014 ;
Fernàdez-Moriano et al., 2015).Le striatum et la dopamine sont les clés de l’apprentissage, (Clarke et Adermark, 2015).
17
Figure 07: La biosynthèse de la dopamine, (Meiser et al., 2013).
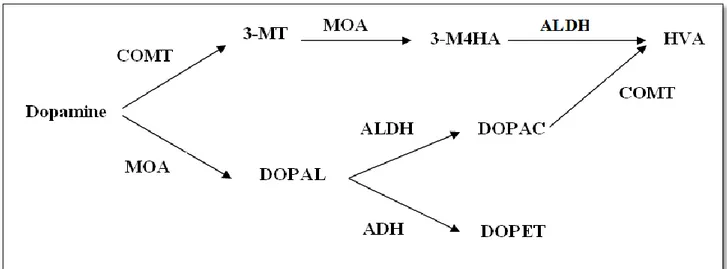
La dopamine est une molécule instable qui subit une auto-oxydation pour former la dopamine quinone ((3,4-dihydroxyphenylacetaldehyde) ou (DOPAL) et H2O2. Cette réaction est catalysée
par les métaux, l'oxygène ou des enzymes telles que la tyrosine hydroxylase, les monoamines oxydases (MAO A) localisées sur la membrane mitochondriale et l’enzyme de Cathecol-O-methyl transférase (COMT), dont le rôle est la régulation du taux de dopamine, (Dias et al., 2014).
Les métabolites de dopamine deviennent inactifs, soit par la réduction de dopamine en 3,4-dihydroxy-phényl éthanol (DOPET) par l’alcool déshydrogénase (ADH), soit par l’oxydation en acide carboxylique (acide 3,4- dihydroxyphénylacetique (DOPAC) par l’aldéhyde déshydrogénase (ALDH), (Figure 08), (Meiser et al., 2013).
Figure 08: Dégradation de la dopamine, (Meiser et al., 2013).
Dans le cas pathologique, la MP est la deuxième maladie neuro-dégénérative après l’Alzheimer et est un désordre progressif chronique caractérisé par une perte des neurones nigro-striataux de dopamine et la formation des inclusions intra neuronales nommées le Corp de Lewis (lewy bodies), (Fernàdez-Moriano et al., 2015 ; Chattopadhyaya et al., 2015 ; Elwan et al.,
2016).
La MP est caractérisée par une bradykinésie, une rigidité importante et des tremblements au repos(syndrome parkinsonien), (Franco et al., 2011 ;Chattopadhyaya et al., 2015 ; Chin-Chan et
al., 2015).La diminution de la synthèse ou de l’excrétion de la dopamine crée un déséquilibre entre
super-18
excitation et aussi une augmentation du contenu des neurones présynaptiques en dopamine se qui induit l’accumulation de leurs métabolites, (Clarke et Adermark, 2015).
Les mécanismes par lesquels les pyréthrinoïdes induisent la MP sont divers, (GadElhak et al.,
2010 ; Wang et al., 2013).D’abord, les pyréthrinoïdes augmentent la synthèse de dopamine dans
les neurones pré-synaptique donc le DOPAL et le H2O2 sont augmentés. Le DOPAL est un
inhibiteur du complexe I mitochondrial et provoque une altération dans la chaine respiratoire avec un excès de H2O2, ce qui provoque la mort des neurones, (Lotharius et Brundin, 2016 ; Elwan et
al., 2016).
Ensuite les Pyréthrinoïdes d’une part ; diminuent l’expression des transporteurs de dopamine
(DAT) ce qui réduit la recapture et augmente le temps de dopamine dans la fente synaptique , par inhibition des canaux sodiques post-synaptique; par conséquent on a le prolongement de la dépolarisation de la membrane, donc les molécules sont recapturées par les cellules gliales où elles se métabolisent en DOPAL et H2O2, ces produits entrent dans une réaction avec Fe2+ pour
former des réactifs plus toxiques tels que O°2 et le OH°,donc la perturbation des fonctions
des cellules gliales (GadElhak et al., 2010 ; Meiser et al., 2013 ; Elwan et al., 2016). Et d’autre part, les pyréthrinoïdes inhibent la biosynthèse de dopamine par la réduction de tyrosine
hydroxylase qui convertit la tyrosine en dopamine, (GadElhak et al., 2010 ; Li et al., 2015).
L’exposition aux pesticides ont été associés à un risque accru de développer la MP dans une population humaine par l’inhibition de l'activité de ALDH neuronal ce qui entraîne une
accumulation d'aldéhydes toxiques (DOPAL) qui conduisent à la mort des neurones dopaminergiques, (Fitzmaurice et al., 2014).
III.2. La maladie d’Alzheimer (MA)
La maladie d'Alzheimer (MA) est une affection neuro-dégénérative qui entraine un dommage progressif définitif et irréversible des cellules nerveuses, qui commence par la perte
de mémoire des évènements récents puis la perte des fonctions cognitives (aphasie , apraxie , agnosie ),(Bonda et al., 2015 ; Chin-Chan et al., 2015 ;Wang et al., 2016 ).
Physiopathologie :
Deux processus dégénératifs caractérisent la MA ; le premier est lié à l’accumulation de peptide β amyloïdes au niveau extracellulaire qui provoque la formation des plaques séniles (Gella et al .,
2009 ; Serrano-pozo et al., 2011; Forloni et al., 2013) ; le deuxième est au niveau intracellulaire,
19
Dans le cas normal, le précurseur de la protéine amyloïde (APP) est clivé par les sécrétases β et γ en peptide P3 non toxique, (Serrano- pozo et al., 2011 ; Butterfield et al., 2015 ; Tromutola et
al., 2016 ). La présence des plaques amyloïdes entraîne un dysfonctionnement des neurones
environnants, puis la mort neuronale par apoptose ou par nécrose, (Gella et al., 2009).
Les mécanismes par lesquels β amyloïdes génèrent les ROS sont ; d’une part la concentration la plus élevée de β amyloïdes en présence des ions Fe 3+
libèrent H2O2, et entraînent un SO sur
les neurones environnants, (Butterfield et al., 2015 ; Tromutola et al., 2016 ). Le H2O2 se
décompose selon la réaction de fenton :
Les radicaux libres vont enlever un atome d'hydrogène de la membrane des neurones, ce qui
forme des pores, ces derniers laissent pénétrer d'autres radicaux libres qui s'attaquent à l'ADN du neurone, entraînant la destruction des fonctions de la cellule. Après la rupture de la membrane,
les ions calcium et les fragments ß-amyloïdes vont également pénétrer et activer les phosphokinases à calcium (PKC) dont le rôle est d'éliminer la membrane neuronale endommagé. La PKC suractivée va éliminer des portions de membrane saines et accélérer le processus de destruction. Les radicaux libres et les fragments de β amyloïdes vont pénétrer en surnombre dans le corps du neurone, affectant son fonctionnement et contribuant à l'apoptose, (Butterfield et al., 2015 ; Chin-Chan et
al., 2015 ).
D'autre part, l’activation des cellules micro gliales génèrent le NO et O2, qui peut réagir entre eux
pour former ONOO° qui va accélérer la destruction des neurones, (Butterfield et al., 2015 ;
Chin-Chan et al., 2015 ).
La protéine Tau est une molécule associée avec les microtubules pour maintenir leur stabilisation.
Lorsque la protéine Tau est hyperphosphorylée ne peut pas s’attacher aux microtubules, et se conforment en paire de filaments hélicoïdaux pathologiques et s'accumulent en formant
des enchevêtrements neurofibrillaires, (Serrano- pozo et al., 2011). Les radicaux libres qui libèrent à partir des plaques amyloïdes, détériorent la paroi membranaire des axones et laissent ainsi pénétrer des ions calcium qui provoque l’hyper activation des Maps kinases chargées de contrôler la phosphorylation des protéines Tau. Les neurofibrilles compressent le neurone et provoquent une mort neuronale par apoptose, (Butterfield et al., 2015 ;Chin-Chan et al., 2015 ).
20
Le rôle des pesticides dans les altérations observées dans les fonctions cognitives et la MA
est suggéré à la base des études épidémiologiques. Les pesticides augmentent le taux de β amyloïdes par l’élévation de taux de l’App et la diminution de la dégradation de β amyloïdes,
21
I. Matériel et méthodes
I.1. Matériel
I.1.1. Les animaux et conditions d’hébergement
Cette étude a été réalisée en utilisant des rats Wistar Albinos femelles provenant de l’institut Pasteur d’alger. Les animaux pesant entre 170 et 260 g sont élevés dans 7 cages de 08 rats chacun. Ils ont libre accès à la nourriture standard (Crockette) et à l’eau. La température de l’animalerie est maintenue à (24 ± 1°C) avec une hygrométrie de 60 % et une photopériode de 12 heures sur 24h.
I.1.2. Choix et préparation des doses
Nous avons utilisé la Bifenthrine (BF) et la Deltaméthrine (DLT) sous leurs noms commerciaux respectifs Deltajet et Bifencuik en solo et en mixture. Selon la littérature documentée, il s’avèrent que les doses journalières admissibles (DJA) sont égale 1/50 DL50, (Bavoux et al., 2007 ;
Beausoleil et al., 2009) (tableau 4).
Tableau 04: La DL50 et le DJA de la DLT et de la BF, (Bavoux et al., 2007 ; Beausoleil et al., 2009).
I.1.3. La préparation des solutions
Nous avons préparé des solutions de ces deux pesticides en quantité suffisante pour une administration journalière pendant 5 mois de DLT et BF à des doses respectives de 2,6mg/kg 3,72 mg/Kg, de DLT, BF. La forme commerciale de deux pesticides est liquide, donc nous l’avons dilué dans l’eau distillée jusqu’à l’obtention des dose choisies comme nous avons indiqué précédemment. Par ailleurs, la quercétine a été également administrée pour un groupe préventif recevant les mêmes doses des pesticides. Nous avons dissoudre la poudre de la quercétine de dose 5 mg/Kg dans les même solutions des pesticides en solo et de dose 10 mg/Kg dans la mixture
I.1. 4. Répartition et traitement des animaux
Dans cette étude, les animaux sont répartis en 7 lots de 8 rats chacun. Le traitement est réalisé par l’administration des solutions préparées par gavage gastrique à l’aide d’une sonde fixée à une seringue et ce, quotidiennement pendant 6 mois, (tableau 5). Nous avons administré les solutions selon les poids des rats (1 ml pour un rat de 200 g)
Pyréthrinoïdes DL50 1/50(DL50)
DJA
DLT 130mg/kg 2,6mg/kg
22 Tableau 05 : Répartition et traitement des animaux.
N° de lot Traitement des rats
01 Animaux témoin recevant 1ml de l’eau distillé pour un rat de 200g. 02 Animaux traité par la BF recevant 3.72mg/Kg
03 Animaux recevant 2.6mg/Kg de DLT
04 Animaux recevant une mixture entre la BF et la DLT (3.72mg/Kg+ 2.6mg/Kg)
05 Animaux recevant une mixture entre la BF et la quercétine (3.72 mg/Kg + 5 mg/Kg)
06 Animaux recevant une mixture de la DLT et la quercétine (2.6 mg/Kg+5mg/Kg).
07 Animaux recevant une mixture de la BF, la DLT et la quercétine (3.72mg/Kg+2.6mg/Kg+10mg/Kg) respectivement.
I. 5. Sacrifice des animaux et extraction du cerveau
A la fin de la période d’administration, les animaux sont sacrifiés par décapitation, le cerveau est prélevé rapidement et subdivisé en 04 région : l’hippocampe, striatum, cortex et cervelet qui
constituent la source de suspensions mitochondriales nécessaires à l’évaluation de l’effet des pesticides et la quercétine sur le statut redox mitochondrial et l’intégrité membranaire des neuro- mitochondries .
II. Evaluation du stress oxydatif mitochondrial II.1. Extraction des mitochondries du cerveau
Chaque région du cerveau est immerger dans le tampon de TSE (250mM sucrose, 50mM tris, 0 .1mM EDTA, pH 7.2 à 4C°) et potérisé dans un Potter de DOUNCE avec 4.5 ml de TSE, ce qui permet la destruction des cellules et la libération des mitochondries. L’homogénat récupéré est ensuite centrifugé une première fois à 800g pendant 10 mn à 4°C (centrifugeuse Sigma 3-16 PK) permettant ainsi l’élimination des gros débris cellulaire. Le surnageant issu de cette centrifugation est centrifugé une deuxième fois à 8000g pendant 10 mn à 4°C, le culot obtenu est resuspendu dans 1.5 ml de TSE et centrifugé à 8000g pendant 10 mn. Le culot obtenu de cette dernière centrifugation est resuspendu dans 1.5µl du tampon TS (250mM sucrose, 50mM Tris base, pH 7.4) à 20°C pour obtenir la suspension mitochondriale utilisée pour la mesure du gonflement mitochondrial et ce, après le dosage des protéines par la méthode de Bradford (Sanders et al.,
23 II.2. Préparation de la matrice mitochondriale
La suspension mitochondriale est congelé-décongelé de 6 à 8 fois avec potérisation accrue et répétée, afin d’éclater les mitochondries dans une solution hypotonique (25Mm K2HPO4, 5Mm
MgCl2, PH= 7.2). Après centrifugation pendant 10 mn à 9600 rpm, le surnageant est utilisé comme
source d’enzyme.
II.3. Dosage des protéines du stroma mitochondrial
II.3.1. Principe
Cette méthode mesure la concentration protéique en utilisant le principe de la réaction entre les protéines et le bleu brillant de Coomassie (BBC) qui se lie avec les acides aminés aromatique et les résidus hydrophobes des acides aminés présent dans ces protéines. Une colorimétrie est susceptible de suivre le changement de l’absorbance proportionnellement à la quantité du colorant lié aux acides aminés indiquant ainsi la concentration en protéines dans l’échantillon.
II.3.2. Déroulement de dosage
Pour le dosage des protéines, 100µl de la suspension mitochondriale (100µl BSA pour la gamme
étalon) sont ajoutés à 4ml du réactif bleu brillant de comassie (BBC). Après agitation au vortex et incubation à température ambiante pendant 5 min, la lecture de l’absorbance est effectuée à 595
nm (Bradford 1976). La concentration des protéines est déduite à l’aide de la courbe d’étalonnage réalisé dans les mêmes conditions par la BSA (Bovin Serum Albumin).
II.4.Mesure du gonflement mitochondrial « mitochondrial-swelling »
L’intégrité et la perméabilité membranaire des mitochondries ont été évaluées selon la méthode de (Farhi, 2015). Brièvement, Le changement d’absorbance était mesuré à 540 nm et la diminution de l’absorbance indique l’augmentation du gonflement mitochondrial, ce qui est le résultat de la perte du potentiel membranaire mitochondrial et de l’ouverture de PTP (permeability transition pore) mitochondrial.
Le gonflement mitochondrial a été détecté par la mesure directe de l’absorbance à 540 nm de