HAL Id: tel-02304391
https://hal-normandie-univ.archives-ouvertes.fr/tel-02304391
Submitted on 3 Oct 2019
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
de la défense racinaire : Caractérisation moléculaire et
fonctionnelle chez deux légumineuses, Glycine max
(Merr.) L. et Pisum sativum (L.).
Marc Ropitaux
To cite this version:
Marc Ropitaux. Le Root Extracellular Trap (RET), un réseau au coeur de la défense racinaire : Caractérisation moléculaire et fonctionnelle chez deux légumineuses, Glycine max (Merr.) L. et Pisum sativum (L.).. Amélioration des plantes. Université de Rouen Normandie, 2018. Français. �tel-02304391�
THÈSE
Pour obtenir le diplôme de doctorat
SpécialitéASPECTS MOLECULAIRES ET CELLULAIRES DE LA BIOLOGIE – 4200006 Préparée au sein de l’Université de Rouen Normandie
Le Root Extracellular Trap (RET), un réseau au cœur de la défense
racinaire : Caractérisation moléculaire et fonctionnelle chez deux
légumineuses, Glycine max (Merr.) L. et Pisum sativum (L.).
Présentée et soutenue par
Marc ROPITAUX
Thèse dirigée par Pr. Azeddine Driouich, Laboratoire Glyco-MEV – EA 4358
Thèse soutenue publiquement le 30 Novembre 2018 devant le jury composé de
Mme Jacqueline Grima-Pettenati Directrice de recherche CNRS, Laboratoire de Recherche en Sciences
Végétales (LRSV - UMR 5546), Université de Toulouse Rapporteur Mme Sabine Carpin MCF-HDR, Laboratoire de Biologie des Ligneux et des Grandes Cultures (LBLGC - EA 1207), Université d’Orléans Rapporteur Mme Catherine Santaella Chargé de recherche CNRS, Lab Ecol Microb Rhizosphere Environ Ext
(LEMiRE – UMR 7265), Aix-Marseille Université Examinateur Mr. John Moore Senior researcher, Institute for Wine Biotechnology, Department of
Viticulture and Œnology, Stellenbosch University, South Africa Examinateur Mr. Jean-Claude Mollet PR, Laboratoire de Glycobiologie et Matrice Extracellulaire Végétale
(Glyco-MEV - EA 4358), Université de Rouen Normandie Examinateur Mr. Azeddine Driouich PR, Laboratoire de Glycobiologie et Matrice Extracellulaire Végétale
(Glyco-MEV - EA 4358), Université de Rouen Normandie Directeur de thèse Mme Isabelle Boulogne MCF, Laboratoire de Glycobiologie et Matrice Extracellulaire Végétale
(Glyco-MEV - EA 4358), Université de Rouen Normandie Co-encadrante Mme Sophie Bernard IE, Laboratoire de Glycobiologie et Matrice Extracellulaire Végétale
(Glyco-MEV - EA 4358), Université de Rouen Normandie Co-encadrante Mme Valérie Grimault
Directrice de recherche, Laboratoire de pathologie de la Station Nationale d’Essais de Semences (SNES), Groupe d'Etude et de contrôle
des Variétés Et des Semences (GEVES), Angers
Membre invité Mr. Eric Nguema-Ona Chef de projet, Centre international de l’innovation (CMI), Groupe
3
Aux amours de ma vie,
Louis et Coralie
5
« Je ne puis regarder une
feuille d’arbre sans être
écrasé par l’Univers »
Victor Hugo
7
REMERCIEMENTS
« Mon doctorat fut une aventure qui me permit de rendre l’invisible, visible. Ce voyage me fit découvrir deux choses sur l’infiniment petit : il est l’échelle de tous les possibles et en son
cœur réside la clé de bien des mystères ».
Je tiens tout d’abord à remercier mes rapporteurs Mme Jacqueline Grima-Pettenati, Directrice de recherche au CNRS de Toulouse, et Mme Sabine Carpin, Maître de conférences à l’Université d’Orléans, d’avoir accepté d’évaluer mon mémoire de thèse. Je remercie également tous les membres du jury, pour leur présence à cette soutenance de thèse et pour l’évaluation de mes travaux de recherche.
Ces travaux de recherche ont été réalisés à l’Université de Rouen au sein du laboratoire de recherche universitaire « Glycobiologie et Matrice Extracellulaire Végétale » (Glyco-MEV, UPRES-EA4358; http://www.univ-rouen.fr/Glyco-MEV/), co-fondé et co-dirigé par les Prs. Patrice Lerouge et Azeddine Driouich, dont je remercie l’accueil et la disponibilité. Je remercie également la nouvelle direction du laboratoire Glyco-MEV depuis le 1er janvier 2018, représentée par les Prs Jean-Claude Mollet et Muriel Bardor.
Ma thèse a été effectuée sous la direction du Pr. Azeddine Driouich et le co-encadrement des Dr. Isabelle Boulogne et Dr. Sophie Bernard, que je ne remercierai jamais assez pour cette thèse, leurs conseils et leurs soutiens. Je tiens à leur dire un grand MERCI pour cette aventure dont je pourrais faire un roman.
Je remercie la région Normandie via l’ancien GRR-VASI (Végétal Agronomie Sols Innovation), représenté maintenant par la Structure Fédérative de Recherche « Normandie Végétal » (FED4277), ainsi que l’Université de Rouen, pour leur soutien financier durant ma thèse. Je remercie également l’Ecole Doctorale Normande de Biologie Intégrative, Santé et Environnement (EdNBISE497) pour ses formations et conseils.
Je remercie Mr. Vincent Demange et Mr. Raphael Comte de la coopérative « la Dauphinoise » pour le tri et l’envoi des graines de soja. Je tiens également à remercier le Dr. Agnès Attard de l’institut Sophia Agrobiotech (INRA 1355-CNRS 7254) de Sophia Antipolis et le Dr. Christophe Gangueux du laboratoire AGHYLE d’UniLaSalle pour l’obtention des souches pathogènes.
J’adresse mes profonds remerciements aux membres du Laboratoire de Recherche en Sciences Végétales (LRSV - UMR 5546) de l’Université de Toulouse et spécialement à Mme
8
Jacqueline Grima-Pettenati, Mme Annabelle Dupas et Mme Nathalie Ladouce pour leur magnifique accueil et leur bel accent toulousain. Je ne peux oublier Mr. Alain Jauneau et Mr. Bruno Payré du Centre de Microscopie Électronique Appliqué à la Biologie (CMEAB), qui m’ont permis de m’adonner à la microscopie électronique à balayage et dont je remercie la gentillesse et les conseils.
Je tiens à exprimer toute ma gratitude à l’équipe de la plateforme PRIMACEN (Plate-Forme de Recherche en Imagerie Cellulaire de Normandie) et plus particulièrement à Ludovic Galas, Damien Schapman et Magalie Benard, qui n’ont jamais faibli devant mes questions et mes crises existentielles.
Je remercie infiniment le Pr. Muriel Bardor et le Pr. Patrice Lerouge pour m’avoir offert un monitorat en biochimie, afin de m’exercer au travail d’enseignant pendant deux années. Merci au Dr. Bruno Gugi, au Dr. Narimane Mati-Baouche et au Dr. Alain Marec pour avoir rendu cette expérience mémorable, et à mes préparatrices préférées, Pascale et Anne, pour l’avoir enrichie de rires et de fous rires.
Je tiens à exprimer toute ma reconnaissance aux Drs Maïté Vicré et Marie-Laure Follet-Gueye de m’avoir aidé et de m’avoir corrigé dans ce difficile exercice de la rédaction d’articles scientifiques.
Toute ma gratitude va aux Dr. Catherine Santaella, Dr. Eric Nguema-Ona, Pr. Pascal Favrel et Dr. Mathias Gallique pour avoir participer à mon Comité de Suivi Individuel (CSI) pendant deux années et d’avoir apporté, à chaque fois, conseils et perspectives.
À présent, je vais pouvoir libérer ma prose et charger en envolées lyriques ces remerciements.
Tout d’abord, ma reconnaissance éternelle va à l’ensemble des membres du laboratoire Glyco-MEV, car chacun d’entre eux ont fait de ce projet une réussite, par leurs sourires, leurs soutiens et leurs conseils.
Mes sincères remerciements vont à tous mes lecteurs (de grès ou de force) : Coralie Dupré (alias Chérie), Audrey Lafragette (alias Mémée), Carole Burel (alias la Maman du labo) et Édouard Quibel (alias Parrain), qui n’ont eu de cesse de chasser les fautes d’orthographes et de piéger celles d’accord.
Même si les mots restent faibles et superflus en comparaison à leur patience et à leurs sourires, je tiens à remercier tous les anciens doctorants, de la vieille école et les warriors (Marie (alias ma marraine la fée), Maxime, Yohana, Abdoul, Rim, Romain, Clément, Julie, Ferdousse et Alexis ; mais également les nouveaux, les bébés et les élus (Marie, Charlotte, Jérémy,
Pierre-9
Louis (alias Pilou), Coralie (alias la bretonne), Rodolphe et Mathilde. Faites survivre le mur des South Park !!!
Une pensée à ma petite Aline (alias Alinette) qui est dans la même galère… la fin de thèse, c’est dur. Merci pour les pauses clopes pour détendre le cerveau et t’inquiète, la fin est proche.
Un immense MERCI aux fumeuses où les discussions philosophiques et scientifiques se mélangent encore et encore (Gaëlle, Isa, Sophie, Angèlou, Aline).
Je tiens à faire pleins de bisous au bureau de l’association NormaDoc, des membres fondateurs (Nicolas, Auriane, Benji, Marie, Bérénice, Thomas et François), mais également aux nouveaux (Nicolas, Camille, Laetitia, Bérénice, Édouard, Hugo et Sarah) pour les soirées, les laser games et les très beaux JEDs. Ça a été un honneur et un privilège d’avoir été votre Président, puis votre Vice-Président.
Merci à Azeddine, mon directeur de thèse dont le ciel étoilé est une inspiration. Je tiens à lui exprimer toute ma gratitude pour son soutien, ses critiques et ses compliments tout au long de cette aventure et faire de moi, un chercheur.
À Isa et So qui n’ont jamais faibli devant mes envolées lyriques et face à une prose un peu trop abondante. Je ne pourrais oublier les « Mais tu veux en venir où ? », les « Toi et tes envolées lyriques » et « On n’est pas dans un roman ». Je ne les remercierai jamais assez d’avoir toujours été là quand les problèmes survenaient, d’avoir été un soutien tout au long de la thèse et de m’avoir aidé à devenir ce que je suis.
Mes pensées se tournent vers mes amis d’ici et d’ailleurs qui m’ont toujours soutenu, même sans vraiment savoir ce que je faisais. À mes Eudois et mes Eudoises qui m’ont permis de décompresser lorsque je n’en voyais pas le bout. À mes Rouennais et mes Rouennaises pour les bières et les cocktails qui m’ont bien changé les idées.
Enfin, milles mercis à ma famille dont le soutien inconditionnel n’a jamais faibli, même devant mes réflexions zoosporiques, mes BCs et mon RET. Merci à mes parents, Jacques et Nathalie, sans qui je n’aurais jamais été si loin. Merci Valentine, ma sœur, ma sister qui a toujours été intéressée par les petits pois et le soja.
Ma plus belle ode va aux amours de ma vie. Tout d’abord à mon cœur, ma chérie et mon chat, elle est un essentiel, une étoile dans la nuit qui m’a toujours soutenu, même si c’était également dur pour elle. Enfin, à mon fils, Louis, ma plus belle œuvre qui n’a eu de cesse de faire rire son papa encore et encore. Aucun mot n’est assez fort pour vous dire tout ce que je ressens pour vous.
11
PRÉAMBULE
Comment font les plantes et les hommes pour survivre à un environnement perpétuellement agressif où des espèces macroscopiques et microscopiques ne cessent de les attaquer ?
L’immunité en est peut-être la réponse.
Depuis quelques années, le modèle agricole français mute progressivement vers une agriculture durable et raisonnée, avec pour objectif l’amélioration de la sécurité alimentaire et la préservation de l'environnement. Dans le cadre des plans Ecophyto, de nouvelles réglementations ont vu le jour afin de retirer des substances actives jugées trop toxiques. Cette diminution des produits phytosanitaires conventionnels implique la mise en place et le développement d’une protection biologique intégrée des cultures. Dans ce contexte, il convient d’anticiper ces évolutions et donc de conduire des travaux de recherche. En effet, la compréhension et l’optimisation de l’immunité végétale permettraient d’identifier et de développer de nouvelles stratégies de protection des plantes.
Le laboratoire Glyco-MEV (Glycobiologie et Matrice Extracellulaire Végétale) travaille depuis plusieurs années dans le domaine de la glycobiologie végétale et de l’immunité racinaire. Cette thématique de recherche a permis de montrer que l'extrémité de la racine libère des cellules frontières qui influencent les propriétés fonctionnelles de la rhizosphère (Hawes et al., 2000; Vicré et al., 2005; Driouich et al., 2007) en y sécrétant de nombreux composés
Consommation de pesticides en France de 1990 à 2014.
Données de la FAO (Food and Agricultual Organization of the United Nations)
12
polysaccharidiques et protéiques (Wen et al., 2007a; b; Durand et al., 2009, Wen et al., 2009). Les cellules frontières et leurs sécrétions forment ainsi une structure défensive appelée « piège extracellulaire de racine (RET = Root Extracellular Trap) » par analogie au « piège extracellulaire des neutrophiles (NET = Neutrophil Extracellular Trap) » qui est connu pour être la première ligne de défense immunitaire chez les mammifères (Brinkmann et al., 2004, Driouich et al., 2013). Ce réseau moléculaire complexe a pour fonction d'attirer, de piéger et de détruire les agents pathogènes et ainsi limiter l’infection de la racine (Hawes et al., 2012, Driouich et al., 2013).
Mes travaux de thèse s'inscrivent dans ce contexte. Ils visent à étudier la caractérisation moléculaire et fonctionnelle du RET dans la défense de la racine, et sa réponse spécifique face aux attaques de pathogènes telluriques. Pour cela, nous avons utilisé les Fabacées, famille modèle, qui a permis la mise en évidence des cellules frontières et avancer le concept du RET (Hawes et Pueppke, 1986; Driouich et al., 2013).
Ce mémoire de thèse s’organise en cinq chapitres :
- Une « introduction générale » qui comportera six parties présentant l’état de l’art sur les Fabacées, la racine, les pathogènes racinaires, les moyens de défenses des plantes, les cellules frontières et le Root Extracellular Trap. Cette dernière partie sera présentée sous la forme d’une revue scientifique nommée « Root extracellular traps versus neutrophil extracellular traps, a
case of evolutionary biological convergence ? » soumise dans « Biological Reviews ». Ce
chapitre introductif sera achevé par la présentation des objectifs de ce projet et les différentes techniques utilisées afin de les atteindre.
- Un chapitre de « matériel et méthodes » qui présentera une description détaillée des matériels biologiques et des conditions expérimentales utilisés dans les analyses microscopiques et phytopathologiques. Cette partie comptera également une partie développement méthodologique mise en valeur dans les annexes 3 et 5.
- Le troisième chapitre, organisé en trois parties, traitera des « résultats » obtenus au cours de mes travaux de thèse. Une première partie dans laquelle seront présentés les travaux valorisés dans un article rapid report intitulé « Xyloglucan and cellulose form molecular cross-bridges
linking root border cells in pea » soumis dans « Molecular Plant ». Une seconde partie
regroupera les travaux présentés dans un article de recherche intitulé « Root border cells and
mucilage secretions of soybean : Microscopical characterization and role in the interaction with oomycete Phytophthora parasitica » soumis dans « New Phytologist ». Enfin, une
13
troisième partie exposera des résultats complémentaires prometteurs obtenus lors de mon projet de thèse.
- Un chapitre de « discussion » au sein duquel les résultats clés de ces travaux seront comparés aux données existantes de la littérature.
- Enfin, un dernier chapitre relatif aux « conclusions et perspectives » présentera les conclusions majeures de ce projet et les hypothèses proposées pour de prochains travaux.
15
TABLE DES MATIÈRES
TABLE DES ILLUSTRATIONS ... 19
LISTE DES ABREVIATIONS ... 23
INTRODUCTION GÉNÉRALE ... 25
I. Les Fabacées ... 27
1. Le pois (Pisum sativum (L.)) ... 27
2. Le soja (Glycine max (L.) Merr.) ... 29
3. Particularité des Fabacées ... 32
II. La face cachée des plantes : la racine... 33
III. Les stress biotiques des Fabacées ... 36
1. Les différents stress biotiques ... 37
2. Les oomycètes ... 37
3. Le cas de Phytophthora parasitica (Breda de Haan) ... 40
a. Le processus d’infection ... 41
b. L'infection précoce par Phytophthtora parasitica ... 43
4. Le cas d’Aphanomyces euteiches ... 45
a. Le processus infectieux... 45
b. L'infection précoce par Aphanomyces euteiches ... 47
IV. La défense racinaire des plantes et l'immunité végétale ... 48
1. La résistance passive ... 52
a. Une barrière physique constitutive : la paroi primaire cellulaire végétale ... 53
i. Composition et organisation de la paroi primaire ... 53
La cellulose ... 55
Les hémicelluloses ... 56
Les pectines ... 58
Les HRGPs (Hydroxyprolin Rich GlycoProteins) ... 61
ii. Lieu de biosynthèse des polysaccharides et glycoprotéines ... 64
2. La résistance active ... 66
a. La résistance non-spécifique ou PTI ... 66
b. Le remodelage pariétal ... 68
V. Entre la résistance constitutive et active : les cellules frontières ... 71
1. Les cellules frontières ... 71
2. L'origine des cellules frontières ... 74
16
b. La zone de production des cellules frontières ... 77
c. Les modifications pariétales ... 80
3. Les exsudats racinaires ... 83
a. Les composés de bas poids moléculaire ... 85
b. Les composés de haut poids moléculaire ... 86
4. Action des cellules frontières et des exsudats racinaires dans la défense ... 88
a. Activité des composés de bas poids moléculaire ... 90
b. Activité des composés de haut poids moléculaire ... 90
VI. Le modèle du Root Extracellular Trap (RET) ... 92
VII. Objectifs... 125
MATÉRIEL ET MÉTHODES ... 127
I. Matériel végétal ... 129
a. Stérilisation des graines ... 129
b. Culture in vitro ... 129
2. Culture in vitro de soja (Glycine max (Merr) L.) ... 130
II. Phytopathogènes ... 132
1. Phytophthora parasitica (Dastur) souche 310 ... 132
a. Culture in vitro ... 133
c. Cryoconservation ... 134
2. Aphanomyces euteiches souche RB84 ... 135
a. Culture in vitro ... 135
b. Production de zoospores ... 136
c. Entretien de la souche ... 137
III. Étude du RET du pois et du soja ... 137
2. Étude histologique et cytochimique des BCs ... 138
a. Film du détachement des BCs de pois et de soja ... 138
b. Morphotype et localisation des BCs ... 138
c. Viabilité des BCs ... 140
d. Lugol ... 141
3. Ultrastructures des BCs et du mucilage ... 142
a. Principe de la microscopie électronique à balayage laser ... 142
b. Méthode de cryo-préparation des échantillons en MEB ... 143
4. Etude cytochimique du mucilage ... 145
b. Coloration au rouge de ruthénium ... 145
c. Coloration au calcofluor ... 146
17
e. Coloration au Crystal Violet ... 147
f. Marquage au Sytox Green ... 147
5. Immunomarquage des BCs et du mucilage ... 148
a. Principe de la microscopie confocale à balayage laser (MCBL) ... 148
b. Immunomarquage ... 149
c. Tableau des anticorps ... 150
d. Développement méthodologique du double immunomarquage ... 150
IV. Interaction RET/pathogènes... 152
1. Infection du soja par A. euteiches ... 152
b. Détection d’A. euteiches ... 153
2. Infection précoce par A. euteiches et P. parasitica ... 153
3. Chimiotactisme ... 154 V. Analyses ... 155 1. Analyses statistiques ... 155 2. Analyses d’images ... 156 RÉSULTATS ... 157 I. Rapid report ... 159
II. Article de recherche ... 179
III. Résultats complémentaires ... 231
1. Caractérisation du RET du soja ... 231
a. Détection d’amidon au Lugol ... 231
b. Détection des pectines acides au Rouge de Ruthénium ... 232
c. Détection de l’ADN extracellulaire et des pectines acides au Crystal Violet ... 233
2. Détail de l’interaction RET / A. euteiches ... 234
a. Détection Aphanomyces euteiches par la WGA-FITC ... 234
b. Effet du RET de soja sur P. parasitica et A. euteiches ... 236
c. Tests de chimiotactisme ... 238 DISCUSSION ... 241 CONCLUSIONS ET PERSPECTIVES ... 251 ANNEXES ... 259 Annexe 1 ... 261 Annexe 2 ... 297 Annexe 3 ... 313 Annexe 4 ... 317 Annexe 5 ... 319 Annexe 6 ... 323
18
RÉFÉRENCES ... 363 CURRICULUM VITAE ... 409
19
TABLE DES ILLUSTRATIONS
FIGURE 1 :ORGANISATION DU POIS (PISUM SATIVUM (L.)). ... 28 FIGURE 2 :COMPOSITION MOYENNE DE LA GRAINE DE POIS, SURFACES D’EXPLOITATION DES CULTURES DE
POIS EN FRANCE ET PRODUCTION MONDIALE DE POIS. ... 29 FIGURE 3 :ORGANISATION DU SOJA (GLYCINE MAX (L.)MERR.). ... 30 FIGURE 4 :COMPOSITION MOYENNE DE LA GRAINE DE SOJA, SURFACES D’EXPLOITATION DES CULTURES DE
SOJA EN FRANCE ET PRODUCTION MONDIALE DE SOJA. ... 31 FIGURE 5 :REPRESENTATION DES NODULES DE POIS ET DE SOJA. ... 32 FIGURE 6 :REPRESENTATION DES SYSTEMES RACINAIRES FASCICULE ET PIVOTANT DE DEUX PLANTES
PRAIRIALES (D’APRES EICHHORN ET AL.,2013). ... 33 FIGURE 7 :REPRESENTATION SCHEMATIQUE DU SYSTEME RACINAIRE DE TYPE PIVOTANT (D’APRES BENFEY
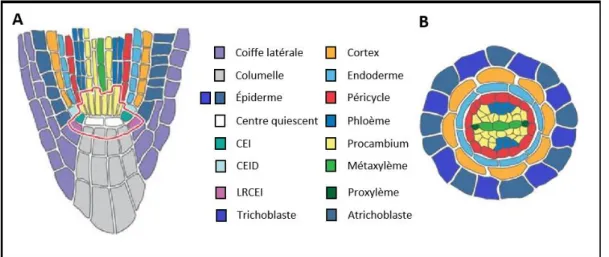
ET AL.,2010). ... 34 FIGURE 8 :REPRESENTATION SCHEMATIQUE DE COUPE DU MERISTEME APICAL RACINAIRE D'A. THALIANA
(D'APRES PETRICKA ET AL.,2012). ... 36 FIGURE 9 :REPRESENTATION DE L’ARBRE PHYLOGENETIQUE DES 5 REGNES APPARTENANT AU DOMAINE DES
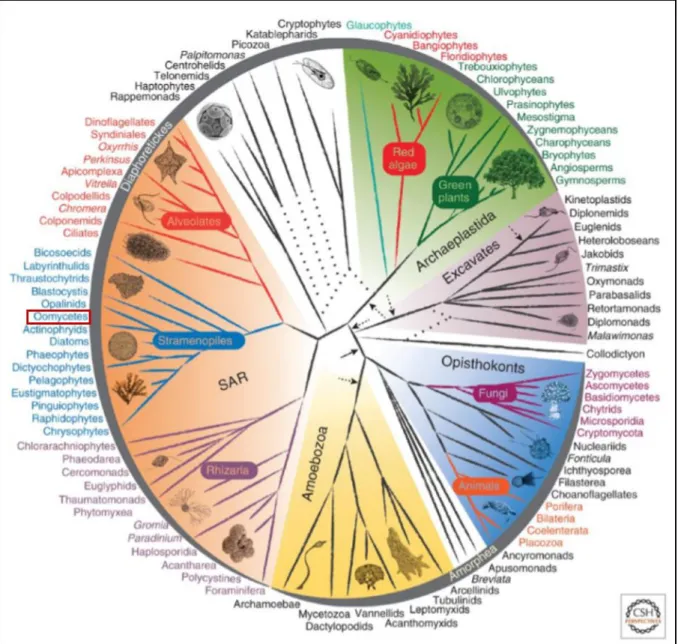
EUCARYOTES (BURKI,2014). ... 38 FIGURE 10 :CLASSIFICATION PHYLOGENETIQUE CONSENSUS DES OOMYCETES CLASSES DANS LE GROUPE DES
STRAMENOPILE ALVEOLATA RHIZARIA (SAR)(MCCARTHY ET FITZPATRICK,2017). ... 40 FIGURE 11 :SCHEMA DU CYCLE DE DEVELOPPEMENT MONOGENETIQUE HAPLOPHASIQUE DE PHYTOPHTHORA
PARASITICA (OOMYCOTA)(D’APRES JUDELSON ET BLANCO,2005;ATTARD ET AL.,2008;AGRIOS, 2012). ... 42 FIGURE 12 :OBSERVATIONS MICROSCOPIQUES DES ZOOSPORES ET STRUCTURES D’INFECTION DE P.
PARASITICA (D’APRES JUDELSON ET BLANCO,2005;ATTARD ET AL.,2008). ... 44 FIGURE 13 :SCHEMA DU CYCLE DE DEVELOPPEMENT MONOGENETIQUE HAPLOPHASIQUE D’APHANOMYCES
EUTEICHES (OOMYCOTA)(D’APRES GAULIN ET AL.,2007). ... 46 FIGURE 14 :RECAPITULATIF DU TYPE DE RELATION PLANTE / PATHOGENE. ... 48 FIGURE 15 :SCHEMA RECAPITULATIF DES RELATIONS COMPATIBLES ET INCOMPATIBLES ENTRE LES
CHAMPIGNONS DE TYPE OÏDIUMS ET LES PLANTES (LEPOIVRE,2003). ... 49 FIGURE 16 :SCHEMA GENERAL DES RELATIONS PARASITAIRES (LEPOIVRE,2003). ... 50 FIGURE 17 :MODELE EN ZIG-ZAG ILLUSTRANT LE SYSTEME IMMUNITAIRE VEGETAL ET LA COEVOLUTION
ENTRE LES PLANTES ET LES AGENTS PATHOGENES (JONES ET DANGL,2006). ... 52 FIGURE 18 :ÉVOLUTION DES MODELES PROPOSES POUR LA STRUCTURE DE LA PAROI CELLULAIRE VEGETALE.
... 54 FIGURE 19 :STRUCTURE D’UNE FIBRE DE CELLULOSE (D’APRES LEROUXEL ET AL.,2006 ET LA SOCIETE
CHIMIQUE DE FRANCE). ... 55 FIGURE 20 :ILLUSTRATION SCHEMATIQUE DE LA STRUCTURE DES HEMICELLULOSES PRESENTES DANS LA
PAROI CELLULAIRE VEGETALE (SCHELLER ET ULVSKOV,2010). ... 57 FIGURE 21 :REPRESENTATION SCHEMATIQUE DES PRINCIPAUX CONSTITUANTS DU RESEAU PECTIQUE
(HARHOLT ET AL.,2010). ... 59 FIGURE 22 :CHAINES LATERALES DU SQUELETTE DU RG-I(MOHNEN,2008). ... 60 FIGURE 23 :DIAGRAMME REPRESENTANT LES PROPORTIONS DES 9 GROUPES DE PROTEINES PARIETALES
CHEZ A. THALIANA (NGUYEN-KIM,2015). ... 61 FIGURE 24 :STRUCTURE DES ARABINOGALACTANE PROTEINES (AGPS)(NGUEMA-ONA ET AL.,2013B). ... 62 FIGURE 25 :STRUCTURE CLASSIQUE DES EXTENSINES COMPLEMENTEE DES ENZYMES RESPONSABLES DE
LEUR FORMATION (CASTILLEUX ET AL., ACCEPTE). ... 64 FIGURE 26 :STRUCTURE D’UN EMPILEMENT GOLGIEN DE CELLULES VEGETALES RACINAIRES DE LA
COLUMELLE. ... 65 FIGURE 27 :REPRESENTATION SCHEMATIQUE DE LA SIGNALISATION DE LA DEFENSE DES PLANTES (D’APRES
RAMIREZ-PRADO ET AL.,2018). ... 67 FIGURE 28 :MODELE ILLUSTRANT L'IMPACT DE L'ARABINISATION CHEZ A. THALIANA PAR L'OOMYCETE P.
20
FIGURE 29 :OBSERVATIONS DES CELLULES FRONTIERES ISOLEES LIBEREES DE LA RACINE DE POIS (P.
SATIVUM) EN MICROSCOPIE ELECTRONIQUE A TRANSMISSION (D’APRES CANNESAN ET AL.,2011). ... 72 FIGURE 30 :MODE DE DETACHEMENT DES CELLULES FRONTIERES OBSERVE PAR MICROSCOPIE PHOTONIQUE.
... 73 FIGURE 31 :REPRESENTATION SCHEMATIQUE DU RAM D’A. THALIANA ET DU DEVENIR DES INITIALES DU
CORTEX ET DE L’ENDODERME (D’APRES PAULUZZI ET AL.,2012). ... 75 FIGURE 32 :REPRESENTATION DES ROOT APICAL MERISTEM (RAM) DANS LES RACINES D'ANGIOSPERMES
DICOTYLEDONES (D’APRES GROOT ET AL.,2004). ... 76 FIGURE 33 :(A)REPRESENTATION DU RAM BASIQUE-OUVERT TRANSVERSAL DE FABACEES,FABALES
(OTVD=OPEN-TRANSVERSAL EUDICOTYLEDONE) ET (B,C ET D) LES COUPES ASSOCIEES (D’APRES
HEIMSCH ET SEAGO,2008). ... 77 FIGURE 34 :PRINCIPAUX ACTEURS MOLECULAIRES REGULANT LA DIFFERENCIATION DES DERIVEES DES
INITIALES CENTRALES DE COIFFE EN CELLULES DE LA COLUMELLE D’A. THALIANA (RAHNI ET AL., 2016). ... 79 FIGURE 35 :COLORATION HISTOCHIMIQUE DE L’APEX ET LES BLCS D’A. THALIANA WILD-TYPE (A ET D) ET
QUA1-1(B,C ET E)(D’APRES DURAND ET AL.,2009). ... 80 FIGURE 36 :DISTRIBUTION DES EPITOPES ASSOCIES A DES POLYSACCHARIDES ET GLYCOPROTEINES
DETECTES SUR DES COUPES DE RESINE SEMI-FINES D'UN APEX RACINAIRE DE POIS (P. SATIVUM)
(D’APRES MRAVEC ET AL.,2017). ... 81 FIGURE 37 :DISTRIBUTION DES EPITOPES ASSOCIES A DES POLYSACCHARIDES ET GLYCOPROTEINES
DETECTES SUR DES COUPES DE RESINE SEMI-FINES D'UN APEX RACINAIRE DE POIS (P. SATIVUM)
(D’APRES MRAVEC ET AL.,2017). ... 82 FIGURE 38 :DISTRIBUTION DES EPITOPES ASSOCIES A DES EXTENSINES DETECTES SUR DES COUPES DE RESINE
SEMI-FINES D'UN APEX RACINAIRE DE POIS (P. SATIVUM)(MRAVEC ET AL.,2017). ... 83 FIGURE 39 :OBSERVATIONS DES CELLULES DE LA COIFFE RACINAIRE DE LUZERNE (MEDICAGO SATIVA) EN
MICROSCOPIE ELECTRONIQUE A TRANSMISSION (D’APRES WANG ET AL.,2017). ... 84 FIGURE 40 :SCHEMATISATION DES POTENTIELS MECANISMES D'EXSUDATION RACINAIRE DES COMPOSES A
TRAVERS LA MEMBRANE CELLULAIRE VEGETALE (D’APRES BADRI ET VIVANCO,2009). ... 85 FIGURE 41 :VISUALISATION DU MUCILAGE DE POIS (P. SATIVUM) PAR UNE CONTRE-COLORATION A L’ENCRE
DE CHINE (D’APRES WEN ET AL.,2007A).(A)OBSERVATION DU MUCILAGE (TETE DE FLECHE) ENTOURANT DE L’APEX RACINAIRE ET LES BCS (FLECHES NOIRES).(B)OBSERVATION DU MUCILAGE AUTOUR D’UNE BC. ... 87 FIGURE 42 :EFFET D’A. EUTEICHES SUR LES BCS DE POIS (P. SATIVUM)(D’APRES CANNESAN ET AL.,2012). 89 FIGURE 43 :VISUALISATION DU MUCILAGE CONTRE LA COLORATION A L’ENCRE DE CHINE CHEZ LE POIS (P.
SATIVUM) EN REPONSE A DES STRESS BIOTIQUES (D’APRES DRIOUICH ET AL.,2013). ... 89 FIGURE 44 :MODELE DE FONCTIONNEMENT DU ROOT EXTRACELLULAIRE TRAP (RET)(D’APRES DRIOUICH
ET AL.,2013). ... 93 FIGURE 45 :REPRESENTATION PHOTOGRAPHIQUE ET SCHEMATIQUE DU DISPOSITIF DE CULTURE IN VITRO DE
POIS. ... 130
FIGURE 46 :REPRESENTATION DU DISPOSITIF DE STERILISATION DES GRAINES DE SOJA. ... 131 FIGURE 47 :REPRESENTATION PHOTOGRAPHIQUE ET SCHEMATIQUE DU DISPOSITIF DE CULTURE IN VITRO DE
SOJA. ... 132
FIGURE 48 :REPRESENTATION SCHEMATIQUE DU PROTOCOLE DE PRODUCTION DES ZOOSPORES DE P.
PARASITICA. ... 134 FIGURE 49 :PHOTOGRAPHIE DU SYSTEME COOL CELL DE CHEZ DUTSCHER. ... 135 FIGURE 50 :REPRESENTATION SCHEMATIQUE DU PROTOCOLE DE PRODUCTION DES ZOOSPORES D’A.
EUTEICHES. ... 136 FIGURE 51 :TECHNIQUE DE DISSECTION DE L’EXTREMITE RACINAIRE DE P. SATIVUM POUR UNE
CONSERVATION OPTIMALE DES BCS. ... 138 FIGURE 52 :REPRESENTATION SCHEMATIQUE DES DEPOTS DE LIQUIDE SUR LA LAME AVANT LA MISE EN
PLACE DE LA LAMELLE. ... 139 FIGURE 53 :TECHNIQUE DE PREPARATION DE L’EXTREMITE RACINAIRE DE P. SATIVUM POUR UNE
CONSERVATION OPTIMALE DES BCS. ... 140 FIGURE 54 :PHOTOGRAPHIE D’UNE CHAMBRE HUMIDE. ... 141
21
FIGURE 55 :SCHEMA DU PRINCIPE DE LA MICROSCOPIE ELECTRONIQUE A BALAYAGE (PAQUETON ET RUSTE, 2013). ... 142 FIGURE 56 :(A)MICROSCOPE ELECTRONIQUE A BALAYAGE A EFFET DE CHAMP ENVIRONNEMENTAL (MEB
ESEMQUANTA250FEG) ET (B) SA CHAMBRE DE CRYO-PREPARATION (CMEAB). ... 143 FIGURE 57 :DETAIL DU SUPPORT ET DE LA CUPULE DE CRYO-FIXATION A HAUTE PRESSION ET DU SYSTEME DE CRYO-FIXATION DANS L’AZOTE PATEUX (CMEAB). ... 144 FIGURE 58 :SCHEMA DU PRINCIPE D’UN MICROSCOPE CONFOCAL A BALAYAGE LASER. ... 149 FIGURE 59 :DISPOSITIF D’INFECTION DES PLANTULES DE POIS ET DE SOJA PAR A. EUTEICHES. ... 152 FIGURE 60 :DETAIL DU DISPOSITIF POUR LA DETECTION DU CHIMIOTACTISME. ... 155 FIGURE 61 :DETECTION DE L’AMIDON DANS LE CYTOPLASME DES DIFFERENTS MORPHOTYPES DE BCS CHEZ
LE SOJA. ... 232 FIGURE 62 :DETECTION DES PECTINES ACIDES DANS LA PAROI ET LE MUCILAGE DES BCS DE SOJA. ... 233 FIGURE 63 :DETECTION DES PECTINES ACIDES ET DE L’ADN EXTRACELLULAIRE DANS LE MUCILAGE DES
BCS DE SOJA. ... 234 FIGURE 64 :DETECTION DE L’INFECTION D’A. EUTEICHES APRES 2 JOURS D’INOCULATION CHEZ DES
PLANTULES DE POIS (A-D) ET DE SOJA (E-H). ... 235 FIGURE 65 :IMPACT DU MUCILAGE DE SOJA SUR LA COLONISATION RACINAIRE PAR P. PARASITICA ET A.
EUTEICHES OBSERVE AU MICROSCOPE INVERSE EN CHAMP CLAIR (LEICA DMI6000B, CAMERA DFC 450C). ... 237 FIGURE 66 :TESTS DE CHIMIOTACTISME D’A. EUTEICHES SUR DES BROYATS DE RACINE ET DES FRACTIONS DE
RET DE POIS ET DE SOJA. ... 239 FIGURE 67 :OBSERVATIONS DE BCS DE SOJA EN MICROSCOPIE ELECTRONIQUE A BALAYAGE A EFFET DE
CHAMP ENVIRONNEMENTAL (MEBESEMQUANTA250FEG). ... 313 FIGURE 68 :CRYOFRACTURE DE L’APEX RACINAIRE ET DU RET DE SOJA.... 315 FIGURE 69 :OBSERVATIONS MICROSCOPIQUES DU DOUBLE IMMUNOMARQUAGE SIMULTANE SUR LES BCS ET
LE MUCILAGE DE SOJA. ... 320 FIGURE 70 :REPRESENTATION SCHEMATIQUE DE L’ORDRE DE DEPOTS DES DIFFERENTS ANTICORPS LORS DU
DOUBLE IMMUNOMARQUAGE SEQUENTIEL. ... 321 FIGURE 71 :OBSERVATIONS MICROSCOPIQUES DU DOUBLE IMMUNOMARQUAGE SEQUENTIEL SUR LES BCS ET
LE MUCILAGE DE SOJA. ... 322 TABLEAU 1 : PRINCIPALES DIFFERENCE ENTRE LES OOMYCETES ET LES CHAMPIGNONS (D’APRES LATIJNHOUWERSETAL.,2003 ;JULESONETBLANCO,2005 ;ATTARDETAL,.2008 ;AGRIOS,2012 ;LALOUM, 2017).………39 TABLEAU2 :PRESENTATIONDESDIFFERENCESETSIMILITUDESENTRELERET,LENET,LESBIOFILMSBACTERIENS ETLESMUCILAGESDEGRAINES.……….255 TABLEAU 3 : RECAPITULATIF DES CONTROLES NEGATIFS ET POSITIFS UTILISES LORS DU DOUBLE IMMUNOMARQUAGESURLESRACINESDESOJA....319
23
LISTE DES ABREVIATIONS
A
α-L-arabinofuranose · α-L-araf
Acide 2-céto-3-désoxy-d-lyxo-heptulosarique · Dha acide galacturonique · GalA
Acide jasmonique · AJ Acide salicylique · AS ADN extracellulaire · ADNex ArabinoGalactane Protéines · AGPs Arabinosyltransférase · Ara-T Arabinoxylanes · AX
ATP Binding Cassette · ABC
B BCs · Border Cells β-D-galactopyranose · β-D-galp BEARSKIN 1 · BRN1 BEARSKIN 2 · BRN2 Border Cells · BCs Border-like cells · BLCs C CELLULASE 5 · CEL5 Centre Quiescent · CQ
CLAVATA3 / EMBRYO SURROUNDING REGION40 · CLE40
Coiffe racinaire · CR
CYCLING DOF (DNA-bindingOne zinc Finger) FACTOR 4 · CDF4, CDF4
D
Damage-Associated Molecular Pattern · DAMPs
E
EC · Encre de Chine
Effector-Triggered Immunity · ETI
Effector-Triggered Sensibility · ETS Extensines · EXTs
F
FDA · Fluorescein diacetate
Food and Agriculture Organization of United Nations ·
FAO Fucosyltransférase · Fu-T G Galactosyltransférase · Gal-T Glucuroarabinoxylanes · GAX Glucuronoarabinoxylanes · GAX Glucuronosyltransférase · GlcAT Glucuronoxylanes · GX
Glycobiologie et Matrice Extracellulaire Végétale ·
Glyco-MEV
GlycosylPhosphatidylInositol · GPI Glycosyltransférases · GTs
H
Homogalacturonanes · HGs
Hydroxyprolin Rich GlycoProteins · HRGPs
L
Local Acquired Resistance · LAR
M
MEB · Microscope Electronique à Balayage
Microbe-Associated Molecular Pattern · MAMPs,
MAMPs
Microscopie confocale à balayage laser · MCBL MS · Murashige and Skoog
N
Nematode-Associated Molecular Pattern · NAMPs
Neutrophil Extracellular Trap · NET NIN-LIKE PROTEIN7 · NPL7
O
Oligogalacturonnides · OGs
24 P
PAMP-Triggered Immunity · PTI
Pathogen-Associated Molecular Patterns · PAMPs,
PAMPs
Pathogenesis-Related · PR
Pattern Recognition Receptors · PRRs PBS · Phosphate Buffer Salin PDA · Potatoes Dextroxe Agar Pectine-méthylestérases · PMEs Phénylalanine Ammonia-Lyase · PAL
Plant growth-promoting rhizobacteria · PGPR Polygalacturonase · PGs
Powdery mildew resistant 4/Glucan synthase-like 5). ·
PMR4/GSL5
Prolyl-4-hydroxylases · P4Hs
Protéines riches en glycines · GRPs Protéines riches en proline · PRPs
R
Reactive Oxygen Species · ROS Réponse hypersensible · RH RET · Root Extracellular Trap réticulum endoplasmique · RE Rhamnogalacturonane de type I · RG-I Rhamnogalacturonane de type II · RG-II Rhamnose · Rha
ROOT CAP POLYGALACTURONANSE · RCPG
Root Extracellular Trap · RET RT · Room tempeture
S
SOMBRERO · SMB
Straménopiles, Alvéolates, Rhizaria · SAR
Systemic Acquired Resistance · SAR
U
United States Department Of Agriculture · USDA
W
WUSCHEL-RELATED HOMEOBOX 5 · WOX5, WOX5
X Xylogalacturonanes · XGA XYLOGLUCAN ENDOTRANSGLUCOSYLASE 5 · XTH5 Xyloglucane · XyG Z Zone d’élongation · ZE Zone de différenciation · ZD
25
INTRODUCTION
GÉNÉRALE
27
I. Les Fabacées
Les Fabacées (Fabaceae Lindl.) sont des eudicotylédones couramment appelées légumineuses (pour désigner des plantes dont le fruit est une gousse) ou papilionacées (pour désigner des fleurs irrégulières comportant cinq pétales inégaux ressemblant à un papillon en vol). Cette famille botanique cosmopolite s’étend des zones tempérées aux zones tropicales regroupant environ 17 800 espèces (Tison et de Foucault, 2014).
Les Fabacées sont des plantes d’intérêt agronomique majeur se plaçant à la seconde place des plantes cultivées après les céréales (Graham et Vance, 2003; Guéguen, 1999; Guéguen et
al., 2008). Parmi elles, on compte le soja, les haricots, les pois, le pois chiche, l’arachide, la
lentille, la luzerne, différents trèfles, les fèves, le caroubier, la réglisse… Comme les céréales, certains fruits et légumes-racines de Fabacées ont été des aliments de base pour l’homme pendant des millénaires et sont intimement liés à son évolution. En effet, certaines fèves, lentilles et pois font partie des premières espèces cultivées par l’Homme pour l’alimentation humaine et animale, il y a 8 000 ans de cela, dans le Croissant fertile en Mésopotamie. Divers ouvrages de toutes les époques référencent les cultures qui suivirent l’histoire des hommes (Théophraste dans « Histoire des plantes »).
1. Le pois (Pisum sativum (L.))
Le pois est une herbacée annuelle grimpante dont l'appareil aérien est une tige principale cylindrique et creuse. Les feuilles sont placées en position alternes et sont composées d’une à quatre paires de folioles qui sont opposées, sessiles et terminées par une vrille (permettant à la plante de s'accrocher à un support) (Fig. 1A et B). La base des feuilles est entourée par deux grandes stipules embrassantes, arrondies et crénelées à la base (Fig. 1C). Les fleurs, quant à elles, sont à symétrie bilatérale (zygomorphie) composées d’un étendard et de deux ailes de papillons (Fig. 1D). Après la fécondation souvent autogame, elles donneront naissance à des gousses, fruits secs à double zone de déhiscence qui contiennent des ovules campylotropes donnant à maturation des graines sphériques de type exalbuminées (Fig. 1E) (Tison et de Foucault, 2014).
28
Cette plante a un fort intérêt agronomique et économique en France et dans le monde (Fig. 2B et C). Sa valeur économique repose essentiellement sur la composition nutritionnelle de sa graine riche en glucides, protéines, vitamine C et lipides (Duranti et Gius, 1997; Grusak, 2002; Wang, 2003) (Fig. 2A). Le pois fournit plusieurs types d’aliments aux hommes et aux animaux : le pois sec, le pois frais, les jeunes pousses et les fourrages. Par exemple, le pois frais représente une production mondiale en 2016 s’élevant à plus de 19 millions de tonnes d’après les Nations Unis (données FAO = Food and Agriculture Organization of United Nations) dont les premiers producteurs sont la Chine, les États-Unis et l’Europe (Fig. 2C).
Figure 1 : Organisation du pois (Pisum sativum (L.)).
(A) Système aérien constitué des feuilles, fleurs et gousses (Source : depositphoto). (B) Feuille portant deux paires de folioles et finie par des vrilles (Source : depositphoto). (C) Stipules (Source : Forest and Kim Starr). (D) Fleur
29
2. Le soja (Glycine max (L.) Merr.)
Le soja est une herbacée annuelle pouvant être grimpante, rampante ou dressée selon ses variétés et qui serait originaire d’Asie de l’Est. Elle a pour particularité d’avoir un appareil aérien (tiges, feuilles et gousses) (Fig. 3A et B), recouvert de poils gris ou bruns (Fig. 3D et E). Les feuilles sont trifoliolées et les fleurs, de petites tailles, sont localisées sous les aisselles de celles-ci (Fig. 3C). Les fleurs sont à symétrie bilatérale (zygomorphie) formant des grappes
Figure 2 : Composition moyenne de la graine de pois, surfaces d’exploitation des cultures de pois en France
et production mondiale de pois.
(A) Composition moyenne de la graine de pois (Source : Terre Univia, 2015). (B) Surfaces d’exploitation de la culture de pois en hectares sur l’année 2014 (Source : GEVES). (C) Production mondiale de pois en tonne sur
30
blanches ou pourpres (Fig. 3D). Comme pour le pois, la fécondation est souvent autogame et donnera naissance à des gousses. Les graines ainsi obtenues sont elliptiques de type exalbuminées (Fig. 3E).
La graine de soja est également connue pour sa valeur nutritionnelle avec des apports en glucides, protéines, vitamines (A et B), lipides et sels minéraux (Duranti et Gius, 1997; Grusak, 2002; Wang et al., 2003). Elle peut être également une source de matière grasse (huile de soja) (Fig. 4A). Ainsi, elle entre dans la composition de nombreuses préparations liées à l’alimentation humaines (farines, tofu…) et animales. Cette plante a aussi un fort intérêt
Figure 3 :Organisation du soja (Glycine max (L.) Merr.).
(A) Système aérien constitué des feuilles, fleurs et gousses (Source : Naturemania). (B) Feuille trifoliée (Source : CanStockPhoto). (C) Grappes de fleurs (Source : kotehana.at.webry.info). (D) Fleur (Source : Guetty Images). (E) Gousse (fruit) contenant les graines (Source : fermedesaintemarthe).
31
agronomique en France et dans le monde (Fig. 4B et C) avec une production mondiale en 2016 s’élevant à plus de 334 millions de tonnes (données FAO). Les premiers producteurs sont les États-Unis, le Brésil, l’Argentine, la Chine et l’Inde (Fig. 4B).
Figure 4 :Composition moyenne de la graine de soja, surfaces d’exploitation des cultures de soja en France
et production mondiale de soja.
(A) Composition moyenne de la graine de soja (Source : Terre Univia, 2015). (B) Surfaces d’exploitation de la culture de soja en hectares sur l’année 2014 (Source : GEVES). (C) Production mondiale de soja en tonne sur
32
3. Particularité des Fabacées
Les Fabacées représentent également un fort intérêt écologique grâce à leur capacité à fournir aux sols des apports azotés importants (Cook, 1999 ; Journet et al., 2001). L’agriculture exploite cette particularité de puiser de l’azote à la fois dans le sol et l’air, afin d’apporter cet élément à des cultures qui en sont déficientes, notamment par des rotations de culture. Ceci est rendu possible grâce à la symbiose entre les Fabacées et des bactéries, notamment, du genre
Rhizobium (Fig. 5B). Ces bactéries sont fixatrices d’azote, et forment des nodosités au niveau du système racinaire caractérisées par des boursoufflures sur le rhizoderme (Crespi et Frugier, 2008) (Fig. 5A).
Cette coopération permet à la plante de recevoir des nitrogénases bactériennes capables de fixer l’azote atmosphérique (N2). Les bactéries reçoivent, en échange, des éléments essentiels comme la leghémoglobine, une hémoprotéine fixatrice de dioxygène présente chez les Fabacées (Brear et al., 2013). Au-delà de son intérêt écologique, ce type de symbiose racinaire représente aussi un intérêt agronomique en permettant une meilleure productivité et un meilleur rendement
Figure 5 : Représentation des
nodules de pois et de soja.
(A) Représentation schématique de la racine. Observation des nodules de pois et de soja sur la
surface racinaire (Source :
Philippot et al., 2013;
www.memoireonline.com). (B) Cryo-fracture d’un nodule en
microscopie électronique à
balayage (Source :
cloudschool.org). Échelle : 15 µm.
33
des cultures. La symbiose décrite ci-dessus met en évidence la complexité de la racine tout en la plaçant comme un organe essentiel à la croissance de la plante et à sa survie.
II. La face cachée des plantes : la racine
La racine est l’organe souterrain de la plante lui permettant de s’ancrer au sol, mais surtout d’assurer des fonctions vitales pour son développement, comme l’absorption de l’eau et de divers nutriments. Les racines peuvent être également le siège de stockage par l’accumulation de réserves de sucre (betterave sucrière) ou d’amidon (pomme de terre) ou un lieu de symbiose. Leur réseau peut atteindre une superficie de plusieurs centaines de mètres carrés (plus de 100 fois la surface du système aérien) (Eichhorn et al., 2013). Le système racinaire peut être de deux types : fasciculé pour les monocotylédones (Fig. 6A) ou pivotant essentiellement chez les eudicotylédones (Fig. 6B). Ainsi, l’appareil racinaire des Fabacées est constitué d’une racine principale primaire pivotante pouvant atteindre un mètre de profondeur sur laquelle naissent des racines secondaires et tertiaires (Fig. 6B) (Eichhorn et al., 2013).
Figure 6 : Représentation des systèmes racinaires fasciculé et pivotant de
deux plantes prairiales (d’après Eichhorn et al., 2013).
(A) Système fasciculé d’Aristida purpurea (L.), une monocotylédone. (B) Système pivotant de Liatris punctata (Hook), une eudicotylédone.
34
Les racines primaires possèdent une structure simple (Fig. 7) établie durant l'embryogénèse (Dolan et al., 1993), et qui est caractérisée par une série de 4 ou 5 zones de développement selon les auteurs. De la partie distale vers la partie proximale, on distingue la coiffe racinaire, la zone méristématique, la zone d’élongation (sans ou avec la zone de transition) et la zone de différenciation (Overvoorde et al., 2010) (Fig. 7A et C). Cette description de la morphologie racinaire a été très étudiée chez la plante modèle Arabidopsis thaliana (L.) Heynh.
Figure 7 :Représentation schématique du système racinaire de type pivotant (d’après Benfey et al.,
2010).
(A) Représentation générale du système racinaire pivotant. (B) Représentation schématique d’une coupe longitudinale de la zone d’émergence des racines secondaires (C) et de la racine primaire d’A. thaliana.
35
Le méristème apical racinaire (RAM = Root Apical Meristem) est la zone dont l’ensemble de la racine est issu (Fig. 8A). Cette zone est en perpétuelle division et peut être divisée en 2 "sous-zones" : les méristèmes distal et proximal. Le méristème distal, proche de l’apex, possède une activité mitotique importante. Le méristème proximal ou basal (Nieuwland et al., 2009) a une activité mitotique ralentie et une expansion cellulaire marquée par un élargissement et une spécialisation cellulaire (De Smet et al., 2007). Au-dessus, dans la partie proximale de cette zone se trouve le corps principal de la racine. Lors de l’arrêt des divisions, les cellules quittent la zone méristématique et entrent dans la zone d’élongation (ZE) où elles vont commencer à s'allonger (Fig. 7B). Actuellement, un débat tend à subdiviser la zone d’élongation en deux parties (Balǔska et al., 2004; Takatsuka et al., 2018). Une zone d’élongation jeune appelée zone de transition serait suivie d'une zone d’élongation plus âgée (Verbelen et al., 2006). La zone d’élongation est importante puisqu’elle est responsable du développement en longueur de la racine primaire. À la suite se trouve la zone de différenciation (ZD), comprenant les poils absorbants qui émergent des trichoblastes suivant une disposition bien précise : chaque trichoblaste se situe au-dessus de la jonction entre 2 cellules corticales. Par exemple, chez les racines primaires d’A. thaliana comme il y a 8 cellules corticales, il y a donc 8 trichoblastes et 10 à 14 atrichoblastes (Grierson et Schiefelbein, 2002; 2014) (Fig. 7C). Pour finir, cette zone de différenciation de la racine compte également la zone d’émergence des racines secondaires (Péret et al., 2009).
L’intérieur de la racine est formé de couches concentriques de tissus aux propriétés fonctionnelles spécifiques. De l'extérieur vers l'intérieur, on trouve l’épiderme, le cortex, l'endoderme, le péricycle et la stèle qui se situe au centre de la racine (Overvoorde et al., 2010) (Fig. 7B et C; Fig. 8A et B). Chez les jeunes racines d'A. thaliana, hormis la stèle, les différents tissus sont composés d'une seule couche de cellules. Toutefois, à d'autres stades de développement et chez d'autres espèces, le cortex et la stèle peuvent avoir un nombre de couches de cellules qui varie de manière importante.
36
Une dernière zone importante de la racine est la coiffe racinaire, qui se situe à l'extrémité proximale de la zone méristématique (Rost, 2011) et comprend la coiffe racinaire latérale et la columelle. Cette dernière est caractérisée par la présence de statocystes capables de capter la gravité. Ils permettent à la racine de percevoir la gravité et de l’orienter à l’aide de grains d’amidon (statolites) présents dans leur cytoplasme (Su et al., 2017). Les statocystes vont progressivement migrer vers l’extrémité de la coiffe racinaire au fil des divisions sous-jacentes, pour être libérés dans la rhizosphère et devenir des cellules frontières (Driouich et al., 2007), tout comme les cellules de la coiffe racinaire latérale.
La coiffe racinaire et les cellules frontières jouent un rôle primordial en assurant le rôle d’interface entre le sol et la racine grâce à leurs activités de sécrétion. Elles ont pour but de modeler la rhizosphère (Jones et al., 2009; Galloway et al., 2017), et de protéger la zone la plus importante de la racine, le RAM. Cette dernière structure de la racine sera abordée en détail dans ce manuscrit (cf : Introduction.V).
III. Les stress biotiques des Fabacées
Les Fabacées, comme d’autres familles botaniques, sont régulièrement sujettes à des maladies occasionnées par divers stress, d’origine abiotique (Le Gall et al., 2015) ou biotique. Toutefois, seuls les stress biotiques seront traités dans ce mémoire de thèse.
Figure 8 : Représentation schématique de coupe du méristème apical racinaire d'A. thaliana (d'après
Petricka et al., 2012).
(A) Représentation schématique d’une coupe longitudinale du méristème apical racinaire d’A. thaliana puis (B) d’une coupe transversale au niveau de la zone de différenciation.
37
1. Les différents stress biotiques
Les attaques subies par les Fabacées peuvent être à la fois bactériennes, virales, fongiques ou « oomycétiques ». Les exemples présentés ici ne concerneront que les maladies les plus surveillées chez le pois et le soja et pour lesquelles les moyens de lutte efficaces sont actuellement inexistants.
Les attaques bactériennes les plus connues chez les Fabacées sont la graisse bactérienne engendrée par Pseudomonas syringae pv. syringae (Martín-Sanz et al., 2013) et la galle feuillée provoquée par Rhodococcus fascians (Dhandapani et al., 2017). Les virus ont également une action importante dans certaines pertes de rendement à cause de la jaunisse du pois, engendrée par le Luteovirus BLRV (Bean leaf roll virus) et le nanisme du pois causé par le Carlavirus RCVMV (Red clover vein mosaic virus).
Toutefois, les maladies les plus délétères en terme de rendement sur la culture de pois protéagineux sont occasionnées par des agents fongiques tels que l’ascochytose (anciennement anthracnose) (Phoma medicaginis var. pinodella (L.K. Jones)), la pourriture grise (Botrytis
cinerea (Pers.)), la rouille (Uromyces pisi (Pers.)) et la fusariose basale (Fusarium solani f. sp. pisi (L.K. Jones)).
Les attaques racinaires peuvent être également causées par des oomycètes. Actuellement, l’oomycète causant le plus de dégâts au niveau du rendement et de la rentabilité du pois, est l’oomycète Aphanomyces euteiches responsable de la pourriture racinaire du pois (Persson et
al., 1997). Il est également reconnu comme inquiétant car les parcelles contaminées le restent
entre 10 à 20 ans (Djebali, 2008). Un autre oomycète tellurique notable est Phytophthora sojae responsable de la pourriture racinaire du soja (Hua et al., 2015).
2. Les oomycètes
Les oomycètes (syn. Peronosporomycetes) sont des microorganismes filamenteux aquatiques hétérotrophes dont l’appareil végétatif est morphologiquement proche du mycélium des champignons. Toutefois, leurs particularités biologiques, telles que la mobilité des spores et la paroi cellulosique, les ont rapidement rapprochés des microalgues brunes, telles que les diatomées (Beakes et al., 2012; Mélida et al., 2013; Fawke et al., 2015) (Fig. 9).
Des études phylogénétiques et biochimiques les ont définitivement séparés des champignons (Tableau 1) pour les rapprocher des algues unicellulaires (Money et al., 2004). Désormais, ils
38
sont classés dans le super groupe « SAR » (Straménopiles, Alvéolates, Rhizaria) (Fig. 9). Malgré cette proximité phylogénétique avec les microalgues, les oomycètes ont parfaitement su s’adapter à la vie terrestre s’étendant sur tous les continents, tout en étant bénéfiques ou pathogènes de vertébrés, de crustacés, d’insectes, mais aussi de plantes (Fig. 9) (McCarthy et Fitzpatrick, 2017).
Figure 9 :Représentation de l’arbre phylogénétique des 5 règnes appartenant au domaine des Eucaryotes
(Burki, 2014).
Les embranchements dont la position phylogénétique reste à confirmer sont représentés par des traits en pointillés. Encadré rouge : classe étudiée.
39
L’évolution en a fait des parasites très délétères, notamment chez les plantes dont les pertes économiques se comptent en milliards de dollars. À titre d’exemple, il a été estimé que
Phytophthora infestans (Mont.) causerait des pertes sur la culture de pomme de terre allant
jusqu’à 6,7 milliards de dollars par an (Derevnina et al., 2016). Phytophthora sojae (Kaufm. et Gerd.) engendrerait quant à lui des pertes allant jusqu’à 2 milliards de dollars sur la culture de soja (Tyler, 2007).
Les conséquences de ces oomycètes sont également sociales avec un impact significatif sur l’histoire de l’Homme. Nous pouvons rappeler le cas du mildiou (P. infestans) qui, en infectant la pomme de terre, déclencha la grande famine irlandaise de 1845. Indirectement, elle tua plus de 750 000 irlandais et provoqua l’émigration de plus de 2 millions d’autres. Du fait de leurs particularités phylogéniques, la lutte contre ces pathogènes est très difficile et les fongicides habituels n'ont aucune efficacité.
Tableau 1 :Principales différences entre les oomycètes et les champignons (d’après Latijnhouwers et al.,
40
3. Le cas de Phytophthora parasitica (Breda de Haan)
P. parasitica appartient à l’ordre des Peronosporales et à la famille des Peronosporacées
(Fig. 10). Cet oomycète est hémibiotrophe, formant un haustorium afin de récolter les éléments nutritifs dont il a besoin avant de tuer son organisme hôte (Attard et al., 2010). Le nom d’espèce
P. parasitica est fréquemment utilisé (Attard et al., 2008; Hu et al., 2008; Meng et al., 2014;
Farr et Rossman, 2017) et correspond à P. parasitica var. nicotianae décrit pour la première fois en Indonésie en 1896 par Breda de Haan chez le tabac (Nicotiana tabacum (L.)) (Rancé et
al., 1998).
P. parasitica s’est depuis répandu dans toutes les grandes régions productrices de tabac,
engendrant la pourriture racinaire et du collet. L’USDA (United States Department Of
Agriculture) a mis en évidence la capacité d’adaptation de ce phytopathogène, puisqu’il peut
attaquer une variété d’hôtes correspondant à plus de 900 espèces appartenant à plus de 90 familles botaniques dont 255 genres (Farr et Rossman, 2017), dont une multitude d’eudicotylédones et de céréales. Ce pathogène tellurique infecte de nombreuses herbacées, des
Figure 10 : Classification phylogénétique consensus des oomycètes classés dans le groupe des
41
plantes de grandes cultures et d’autres plantes d’intérêt mondial (Erwin et Ribeiro, 1996). Par exemple, il a pour hôte la tomate (Solanum lycopersicum L.) (Le Berre et al., 2008), le tabac (Galiana et al., 2005), mais également la plante modèle A. thaliana (Attard et al., 2010).
Les symptômes de la pourriture racinaire et du collet occasionnés par P. parasitica se manifestent rapidement. Par exemple, les symptômes apparaissent chez la tomate après 4 jours, alors que chez A. thaliana, ils ne surviennent qu’au bout de 7 jours (Attard et al., 2010). La mort des plantes survient rapidement après l’apparition des premiers symptômes. Chez la tomate, la mort survient en 7 jours et chez A. thaliana entre 15 et 20 jours (Le Berre et al., 2008; Attard et al., 2010). Généralement, les plantes touchées se flétrissent, les tiges s’effondrent, probablement dû au ramollissement du collet, tandis que le feuillage reste vert. Les racines et le collet sont les tissus les plus sévèrement touchés, présentant des lésions humides et molles avec un aspect pincé. Ces tissus se ramollissent et changent de couleur, passant progressivement d’un blanc pour les tissus sains, à une couleur brune foncée pour ceux infectés. Aux stades avancés, les racines latérales se délitent et le système racinaire entier finit par être détruit.
a. Le processus d’infection
P. parasitica est capable de mettre en place deux autres stratégies d’infection caractérisées
par une colonisation directe et indirecte, présentes dans son cycle de développement (Fig. 11). La colonisation directe intervient grâce à l’inoculum primaire à paroi épaisse que sont les oospores et les chlamydospores (Fig. 11). Les oospores diploïdes sont des unités de conservation issues de la reproduction sexuée, lui permettant de survivre plus de 6 années dans le sol et les plantes en décomposition (Weste, 1983; Weste, 1995). Les chlamydospores sont des spores de conservation végétative en cas de changements brusques des conditions de vie. En effet, elles ne se détachent pas du mycélium et restent plusieurs années dans les tissus végétaux en décomposition (Agrios, 2012).
42
Cependant, l’oomycète utilise principalement une colonisation indirecte issue d’une reproduction asexuée, augmentant la propagation horizontale. Typiquement, le mycélium se différencie en sporanges capables de libérer des centaines de zoospores biflagellées très mobiles et sans paroi (Powell, 1981). Ces unités de dissémination empruntent l’eau interstitielle présente dans les sols pour se déplacer et propager la maladie. Les mécanismes de taxie des zoospores de P. parasitica vers les racines sont mal connus, alors que les zoospores de P. sojae sont connues pour être attirées par les isoflavonoïdes du type daidzéine et génistéine exsudées par la racine (Morris et al., 1998). Un phénomène d’auto-agrégation a été observé chez P.
parasitica, une stratégie due à la signalisation chimique impliquant du calcium (Reid et al.,
1995) qui permettrait d'augmenter la probabilité d'infection (Tyler, 2007). En effet, les zoospores s’attireraient mutuellement afin de former des agrégations au niveau des zones d’intérêt (Attard et al., 2008).
F
E F
Figure 11 :Schéma du cycle de développement monogénétique haplophasique de Phytophthora parasitica
(Oomycota) (d’après Judelson et Blanco, 2005; Attard et al., 2008; Agrios, 2012).
La reproduction asexuée (sporulation) est une étape clé pour la dissémination du pathogène et passe par deux formes. Une forme de résistance représentée par les chlamydospores et une autre représentée par les sporanges. Ces structures peuvent germer directement au contact de la plante ou libérer une grande quantité de zoospores mobiles et flagellées pour atteindre la plante éloignée. Au contact de cette dernière, les zoospores s’enkystent et se fixent en sécrétant une substance collante pour enfin germer. Elles forment un appressorium facilitant la pénétration de l’hyphe d’infection dans la plante. Vert : type de reproduction et organes de pénétration; Orange : Cycle de reproduction sexuée; Bleu : Cycle de reproduction asexuée.
43
b. L'infection précoce par Phytophthtora parasitica
D’après plusieurs études, les zoospores (Fig. 12A) s'introduisent dans la plante par les zones d’élongation et de différenciation de la racine, mais peuvent également initier l’infection à la faveur de plaies. Une fois la racine atteinte, les zoospores passent d’un stade mobile à un stade fixe appelé kyste pour poursuivre leur cycle d’infection (Galiana et al., 2005 ; Attard et al., 2008) (Fig. 12B). Les kystes accumulés au niveau des zones d'infection vont produire un biofilm (ou mucilage) facilitant leur adhésion au rhizoderme de la racine hôte (Galiana et al., 2008; Larousse et al., 2014). Ce biofilm contiendrait de nombreuses molécules adhésives comme la protéine PcVsv1 (mucine) (Pananbières et al., 2005; Robold et Hardham, 2005).
Après une fixation d’une heure, les kystes forment un hyphe germinatif (Fig. 12) dont la germination le long du rhizoderme dépend d’un gradient de calcium (Attard et al., 2008; Zheng et Mackrill, 2016). L'étape suivante est la pénétration qui met en jeu une structure cellulaire appelée appressorium (Fig. 12D, E et F). Morphologiquement, l’appressorium est une
protubérance qui se forme à l’extrémité de l’hyphe germinatif (Fig. 12D, E et F). Il est induit par la faible teneur en nutriments, l’hydrophobie, la topographie de surface (Bircher et al., 1997a) et par la présence de calcium (Bircher et al., 1997b).
Des études de cet appressorium ont identifié des gènes codant pour de nombreuses protéines orthologues à celles connues pour être impliquées dans la pathogénicité. Elles ont également mis en évidence des enzymes de dégradation des parois cellulaires telles que des polygalacturonases, des hémicellulases et des cellulases (Judelson et Blanco, 2005; Kebdani et
al., 2010; Judelson, 2017), dont les stratégies d’inactivation génique ont montré leurs actions
(Avrova et al., 2008; Grenville-Briggs et al., 2010; Li et al., 2010). Ainsi, l’appressorium a pour rôle de dégrader la paroi afin de faciliter, par la suite, le passage d’un hyphe d’infection (Fig. 12F). Cet hyphe d'infection est hétérothallique (reproduction sexuée demandant l’interaction de deux thalles différents) et gagnera l’ensemble de la plante en passant entre les jonctions cellulaires. P. parasitica entamera sa phase biotrophe en produisant un haustorium similaire à celui des champignons (Attard et al., 2010). Ces structures intracellulaires se forment dans le cortex racinaire afin d’y puiser les éléments dont le pathogène a besoin. Par la suite, les haustoria sécrètent des protéines effectrices au motif RXLR (pour Arginine-[autres acides aminés]-Leucine, Arginine) qui initient la mort des cellules hôtes, permettant à l’oomycète d’entrer dans sa phase nécrotrophe (Bos et al., 2006; Whisson et al., 2007; Dou et al., 2008).
44
Enfin, les hyphes cœnocytiques formeront après quelques jours les appareils reproducteurs, nommés anthéridies et oogones. Dans ce processus de reproduction sexuée, l’anthéridie pénètre l'oogone via des tubes de fertilisation, qui fournissent les noyaux gamétiques mâles à l'oogone, ayant pour résultat la formation des oospores pour une nouvelle conservation (Judelson, 2007) (Fig. 11). Dès lors, l’oospore pourra germer d’un hyphe qui se différenciera rapidement en sporange contenant des zoospores, initiant un nouveau cycle d’infection.
Figure 12 : Observations microscopiques des zoospores et structures d’infection de P.
parasitica (d’après Judelson et Blanco, 2005; Attard et al., 2008).
(A) Zoospores, (B) kyste, (C) hyphe germinatif (M. Ropitaux, non-publié). (D et E) Observations en microscopie électronique à balayage de la formation de l’appressorium sur le rhizoderme (Judelson et Blanco, 2005). (F) Observation en microscopie photonique de l’ensemble des structures d’infection sur le rhizoderme de tomate (Attard et al., 2008). A : Appressorium; C : Cortex; Ce : Cellule épidermique; F : Flagelle; Hg : Hyphe germinatif; Hi : Hyphe d’infection; JA : Jeune appressorium; K : Kyste.
45
4. Le cas d’Aphanomyces euteiches
A. euteiches appartient à l’ordre des Saprolegniales et à la famille des Saprolegniacées
(Leclerc et al., 2000) (Fig. 9). Cet oomycète est un hémibiotrophe (Wicker, 2001) récoltant les éléments nutritifs dont il a besoin avant de tuer son organisme hôte (Franken et al., 2007).
A. euteiches a été décrit pour la première fois par Jones et Drechsler (1925) après une vaste
enquête menée en 1924, pour déterminer l'importance de diverses maladies du pois au Wisconsin (USA). Il est responsable de la pourriture racinaire du pois et représente le plus nuisible des pathogènes du sol sur le plan économique, et le plus dommageable pour cette culture (Jones et Linford, 1925). De plus, le spectre d’hôte d’A. euteiches est large, infectant de nombreuses plantes annuelles ou vivaces de la famille des Fabaceae, notamment le pois (Pisum
sativum (L.)), la luzerne (Medicago sativa (L.)), le haricot commun (Phaseolus vulgaris (L.)),
la fève (Vicia faba (L.)), le trèfle violet (Trifolium pratense (L.)) et le trèfle blanc (Trifolium
repens (L.)) (Malvick et al., 1998; Levenfors et Fatehi, 2004; Moussart et al., 2007).
Les premiers symptômes (communs à la plupart des espèces attaquées) commencent à apparaître sur les racines qui deviennent de couleur jaunâtre, puis prennent une teinte brune. A un stade plus avancé de l’infection, les symptômes apparaissent sur le collet qui prend une couleur brun pâle (Gaulin et al., 2007). Ensuite, la maladie progresse vers la partie aérienne provoquant la chlorose des cotylédons et la nécrose de l’épicotyle. Les plantes infectées qui arrivent au terme de leur cycle végétatif produisent un faible nombre de gousses contenant de petites graines. L’infection d’Aphanomyces spp. est d’autant plus grave qu'elle est associée à l’action de pathogènes opportunistes tels que Fusarium spp., Pythium spp. ou Phoma spp (Diéguez-Uribeondo et al., 2009).
a. Le processus infectieux
Dans son cycle de développement, A. euteiches peut mettre en place deux stratégies d’infection caractérisées par une colonisation directe ou indirecte (Fig. 13).
La colonisation directe vient de l’inoculum primaire (oospore) d’A. euteiches présent dans la rhizosphère pendant plus de 10 ans (Papavizas et Ayers, 1974). Ce sont des unités de conservation possédant une paroi leur permettant une résistance aux basses températures (-20 °C). Lors de conditions favorables, ces oospores vont germer pour entreprendre un nouveau