I
I
I
1
1
1
I
I
1
1
1
I
I
1
1
I
I
1
1
I
I
Œ"tiemmft
jq:vmi toui nous asesso!ns nos remerci£mems à qiL£j4H; a tow±
prissœm pow h votom;ti, h sœnti et h pa,tience qu'i[ nous a domé pour h
réaGsation de ce tmai[ quc nous epéro" êwe wtia.
1[ est qgréa6b a;u momm & présenier ce tmwai[ faÆresser nos
rerrwciermrtis à notme p"riotew tM!. ZJhzovfl fla qùiofissew œu
départemerït dè çérie ®es ®iocédés de rwriverstié de ]ije[ qiri a 6ien voru[u
&rigé ce tmwa;iE pour tow ses cornseib, ses emowagementi et h corrrection du
mœnw[ Q3+'i[ tqoiuwe ici reJÇpressiom de rwtffe pro!fbndè recormaissame.
gv7orus teno" à rei'rimcier égahm`rti MP Œowffwri S doctormi en
géri2derenrim:iwmeniet"rT(fie&:i'iœŒah.Ndoctomtenchi;miepourbws
dispo;iri6iRüés, aws œiÆès, conseib et encowage"iem au couÏs de h réafiuœrion
dè ce tmwœiL Q3}' eflès troumerïi ici nos rîespect:iuuses comsidêmtiorrLs.
No;w e3q?ri:rwns nos nemerci£mn;ti ct nos gra,titudès a;u mem6re &
juTyp"œwoiïœceptéd'e3(£amimeretdejugercetrwœi[
90ow rei'i'iuiçions tow as techriaiens et i:ngérriewrs de§ h6om±oimes de
Mqm.
fl.u risque de i'rie répéter, rLous eJq?rimons nos rift rerridcimm:Îs à
to:iuceu3cq:irino.inorïiœi&sdeprèsotudèbimpourhréaRuœiiondècetrwai[
u , , , + -+ + ,,,,-,-,,,,,,,,-,,,,,,,,,,,,,-+ , , Ç`
®éGA-n est œgréable au momertt de présemer ce ÛQwail d'adresser
mes dédicaces à :
Ma très chère mère, que je ne pourrœi remercier assez, pour
son soutien, sa compréhension, œmour, tendresse, et ses
sacrif ices, que Diewc lui of f ie la sq[nté.
Mon cher père pour ses sQpcrifices, pour mon bien Ôtre.
Mes chers firères : Nabï| Messœoud, Yœcine, Issœm, Younes.
Mes ch`eres sœuïs : DdlLa, Naüpb et belles soeurs : Lïua et
Bœrisa
Mes nièces et neveux que Dù?u lui offie tout ce qui esi beaeix
Ma promotion de master 2 et mes amis chacun à son nom
A ma coluegue Nœlla
A tous ce que j'œime et qui m'œiment et ceux qui o"t veïllé de
pq.ès ou de loin à l'ach`evemerit de ce trœiraïL
Rabiaâ
\\
\
\
\
\\
\\
\\
\\
\
\\
\
\\
\\
\
\\
\
\
\\
\\
\
\
\\
\\
\\
\\
Ll\\
\\
\\
\\
\
\\
3 ,,,, +-s+ ,,,,--,-s* + , , * , +-+ * , , + * .-,- +::-, , * ,-+ ,-*.-+`
I
Ü ,,,, * , + , , + , , , ` , , ` ,,,,,,-,, +.-,,,,-,, +. , , ÇL
I
I
®éGuaÆes
11 est œgréable œu momem de présenieg ce trQwaiL d'adresser
mes dédicaces à ..
Ma tries chère m`eqe, que je ne pourrai remercier assez, pour
son soutien, sa compréhension, amour, eendresse, et ses
sacrifices, que Diewc lul o!ffie h sœnié.
Mon cher père pour ses sacrifices, pour mon bien être.
Mes cheTs f t`eres Wohid et Ahmed que I)ieu lui odfte tout ce
qui est bea"
A ma collègue Ralriâa
Ma promotion de masteg 2 et mes qmis chacun à son nom
A tous ce que j'œime et qui m'aiment, et ceux qui ortt veulé de
près ou de loin à l'achèvemeni de ce trœipœü
Nœüa lnsœf
\\
\\
\\
\\
\\
\\
\\
\\
\\
\
\
\
\
\
\\
\\
\
\
\
\
\\
\\
\
\\
\
\\
\\
\\
\\
\\
\\
\
\J ,-,,, * , ++ ,,,, + , ++ ,,,,,, + -.,,- S+ +.++ .:+ . * *-+\
I
I
I
I
I
1
1
1
I
I
I
1
1
1
I
I
1
1
I
I
I
Résumél.es extraits natuels issu des végétaux contiennent une variété de molécules
biologiquement actives. Dans ce contexte nous avons tenté de développer un biocapteu qui permet de
détecter les métaAm louds présentamt dans L'eau, la présfflte ét`ide à pou objectif la caractérisation des
composés bioactifs (composés polyphénoliques) des différent§ extraits préparés à partir de l'écorce des
àcux planœs Punica granatum.L (la grensde) et Quercus suber (le gland de ®hêne üège). le\iis
quantifications ainsi que les réactions de complexation avec ces métaux.
L'analyse quditative de ces extraits par CCM a révélé la présence des polyphénols dans différcnts extraits , ce ci est confimé par une analyse quantitative basée su le dosage des
polyphénols totaux dont les deux extraits sont riches cn polyphénols, ainsi la quantification est complétée par l'IIPLC qui confime que les deux espèces sont riches en composés bioactifs, mais ils
I
1
1
I
I
I
I
I
1
1
1
I
1
1
I
1
1
I
I
I
I
Liste des abréviations
GLI) : Gland GRD : Grenade
UV : Ultra Violet IR : Infi.arouge
PM : Poids moléculaire
RMN : Résonance Magnétique nucléaire CCM : Chromatographie su couche mince
HPLC : Chromatographie liquide à haute performance
MeoH : Méthanol
AIC13 : Chlorure d'aluminium
Fecb : Trichlorue de fer
ACN : Acétonitrile nm : Nanomètre Hl : microlitre mv : millivolte g : Gramme H2S04 : Acide sulfirique
NH40H : Amoniaque
Na2C03 : Carbonate de sodium
t/min : tous par minute
Hcl : Acide chlorhydrique SDS : Sodium dodecyl sulfate
KBr : Bromu de potassium
PVC : polychlorure de vinyle DNP : Dinitrophénol
THF : Tétrahydrofi]rane
PBS : Sulfùre de plomb 11
BSA : Alumine de sérum bovin Cd : Cadmium
Rf : rapport ffontale
tR : temps de rétention
I
I
I
I
1
1
1
I
1
1
1
I
I
1
1
I
1
1
I
I
I
Figure 1-1 : Fruit dupw#!.ca grancirwm.£
Liste des figures
Figure 1-2 : Stnictue de base de punicalagins
Figure 1-3 : Structure de base de granatine A
Figure 14 : Structue de base de granatine 8
Figure I-S : Structure de l'acide gallique
Figure li : Gland de chêne liège
Fîgure 1-7 : Structure de base de vescalagine Figure 1* : Squelette de base des flavono.i.des Figure 1-9 : Structue de base des anthocyanes Figure 1-10 : Structue de base de l'acide éllagque
FiguLre 1-11 : Squelette de base de la catéchine
Figure 1-12 : Les flavono.i.des et leurs sites proposés pou la chélation des ions Métalliques
am+)
Figum 1-13 : Le spectre électromagnétique
Figure 1-14 : Représentation schématique du principe de fonctionnement d'un biocapteu ... 19
Figure 11-1 : Protocole d'extraction des polyphénols Figure 11-2 : Protocole de l'extraction des extraits bruts Figure 11-3 : Protocole de dosage des polyphénols totaux Figure 114 : Protocole de dosage des flavonoïdes
Figur€ 11-5 : Protocole de dosage des tannins
Figure lIÙ : Protocole de dosage des tannins condensés Figure 11-7 : Protocole de dosage des tannins hydrolysables
Figure lIÜ : Affiontement des phases aqueuses par les solvants
Figur€ 11-9 : Protocole d'extraction par affiontement Figure 111-1 : Comparaison de rendement des deux plantes
Figure m-2 : Composition physico-chimique de gland et de la grenade
Figure 111-3 : Spectre IR de l'extrait de gland Figure 1114 : Spectne IR de l'extrait de la grenade
21 24 25 26 27 28 28 28 31 35 38
44
44
Figure IV-l : Schéma du dispositif expérimental pou les mesures électrochimiques ... 47
Figure IV-2 : Schéma de la cellule électrochimique à trois électrodes.
Figure IV-3 : Montage expérimentale
FigureIV4:VoltammogrammeducoupleredoxFe(CN)64J3-del'électrodenue Figure IV-S : Circuit équivalent de Randles
I
I
I
I
1
1
1
I
I
1
1
I
1
1
1
1
1
1
1
I
I
Figure IV-6 : Diagramme d'impédance Nyguist Z pou une électrode fonctionnalisée par ŒVC +
Extrait) suite à l'injection de concentrations croissante du cadmium ... 51
Figure IV- 7 : Comparaison des coubes de calibration EIS pou les deux écorces
Figum IV-8 : Voltammogramme obtenu par mesue de SWV de l'électrode fonctionnalisée suite à
l.injection de concentrations croissantes des ions de Cd 2+
Figure IV- 9 : Réponses des deux capteurs en fonction de la concentration en ions Cd2+ ... 53 Figure IV-10 : Le mécanisme réactionnel de fixation des métaux louds avec les extraits ... 54
Figure VI-11 : Spectne IR de l'extrait de gland après complexation avœ le Cd
1
I
I
I
1
1
I
1
1
1
1
I
I
I
1
1
I
I
1
1
I
Liste des tablea"
Tableau 1-1 : Composition biochimique de P«»z.cag7i¢»ofzfm.£ Tableau 1-2 : I.es principales classes de composés phénoliques Tableau 111-1 : Représente le rendement des deux extraits
Tableau 111-2 : Métabolites secondaires mis en évidence au niveau de l'écorce de gland et de
la grenade
Tableau IH-3 : Dosage des polyphénoliques
Tableau H14 :Résultats de la CCM analytique
I
I
I
1
1
I
1
1
I
I
I
1
1
1
I
1
1
1
I
I
I
Introduction
1. Généralités sur ]es p]antes
Table des matières
Chapitre 1
Synthèse bibnographie
\.1 Le gre"üer .. punica granatumL
1.1.1 pw#i.ca granafwm.£ dans l'histoire 1.1.2 Description botanique
1.1.3 Classification botanique
1.1.4CompositionbiochimiqueduPz/»J.cag7.a»a/z/m.£
1.1.5Phytochimiedep«»z.cag7.cr»a/z/m.£
1.1.6 Ecorce de la grenade
1.2 Le Chêne liège. g«ehczü s«bcr
1. 2.1 Description de la plamte
1.2.2 Principales caractéristiques botaniques • Glamds primaires
• Glands secondaires
• Glandstardifs
1.2.3 Description botanique
1.2.4 Les tannins dans le chêne
1.3 Généralités sur les métabolites secondaires
1.3.1 Les polyphénols
1.3.2 Rôle et intérêt des composés phénoliques
1.3.3 Classe des polyphénols
1.3.3.1 Les flavono.i.des 1.3.3.2 Les amthocyames
/ Rôle des flavonoïdes dans les plantes
1.3.3.3 Les tannins
• Les tannins hydrolysables • Les tannins condensés
1.3.3.4 Les propriétés physico-chimiques des tannins
I
I
I
I
1
1
I
1
1
I
I
1
1
1
I
I
I
I
I
I
I
b. Liaisons aux protéines c. Répartition et localisation.
d. Réaction des comlexation avec les métaux
1.4 Méthodes et techriques de purificatÊon
1.4.1 La spectrophotométrie
1.4.2 Chromatographie sur couche mince
1.4.3 Chromatographie liquide de haute perfomance (rlpLC)
1.4.3.1 Appareillage
• Pompe
• Injecteu
• Colome
• Laphasenomale
• Laphase inverse
• Détecteu
1.4.4 La spectroscopie inffarouge IRa. I.e rayomement infiarouge
b. Principe de la technique
c. Spectre infiarouge
1.4.5 Généràlités su les biocapteurs.
Chapitre 11
Partie expérimentale
11. Méthodologie et techniques anabrtiques
11.1 Matériau végéta] 11.1.1 Récolte de l'échantillon 11. 1 .2 Macération et extraction 11.1.3 Filtration et Décantation 11.1.4 Evaporation
H.2 Tests phytochimiques
11.2.1 Réaction de caractérisation (Screening phytochimique)
I
I
I
I
1
1
I
I
I
I
I
I
I
I
I
1
1
I
I
I
I
b. Testes phytochimiques • Lestannins. • Tannins caté-chiques• Tannins galliques : Réaction de stiasny • Les flavono.i.des
• Les Anthocymes
11.3 Méthodes d'extraction et de dosage des composés phénoliques
11.3.1 Préparation de l'extrait brute Acétorique
11.3.2 Rendement d'extraction
11.3 .3 Détemination de la teneu en polyphénols
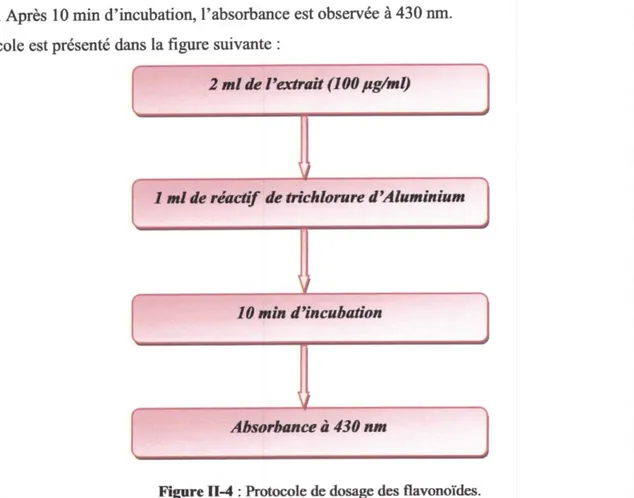
a. Dosage des composés phénoliques totaux
/ Principe
b. Dosage des flavonoi.des totaux
c. Dosage des tannins
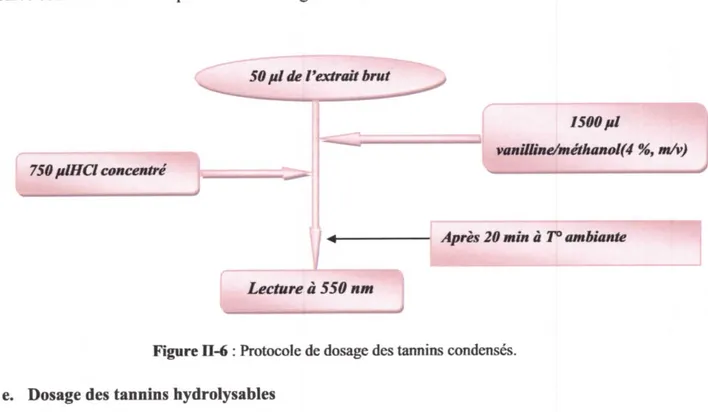
Principe
d. Dosage des tannins condensés e. Dosage des tanins hydrolysables 11.3.4 Extraction par les solvants
a. Affiontements : partitions entre solvants
• Affiontement avec l'éther du pétrole
• Affiontement avec l'éther diéthylique
• Affiontement avec l'acétate d'éthyle
22 22 23 23 23 23 23 24 24 26 26 26 27 27 28 29 29 30 30 30 30 30
• Affiontement avec le butanone (méthyl-éthyl-cétone oŒC)) et le butanol ... 31 11.3.5 Méthodes et techniques de purification
11.3.5.1 Chromatographie su couches minces (C.C.M)
/ Mode opératoire
• Prûaration de laphase stationnaire
• Préparation de la phase mobile
• Préparation des extraits
/ Mode opératoire
32 32 32 32 32 32 321
I
I
I
I
I
I
1
1
I
I
I
I
I
I
I
1
1
I
I
I
11.3.5.3 Caractérisation physico-chimiques des extraits par IR.
• Mode opératoire
m. Introduction
111.1 Rendement d'extraction • Expression des résultats
Chapitre 111 Résultats et discussions
111.2 Détemination de la teneur en pobphénols
• Expression des résultats
111. 3 Dosage des composés phéDoliques totaux
• Dosage des flavonoïdes • Dosagedestannins
• Dosage des tannins condensés • Dosage des tannins hydrolysables
111. 4 Quantirication des composés phénoliques des espèces étudiés
/ Inteprétation des résultats
111. 5 Amlyse chromatogræphique sur couche mince CCM
/ Expression des résultats
111. 6 Chromatogmphie nquide à haute perfomance
• Chromatographie liquide à haute perfomamce
111. 7 Caractérisation physico- chimiques des extraits par IR
/ Expression des résultats
111. 8 Conclusion
IV. Introduction
IV.l Tmnsducteur
Chapitre IV
Application capteur
I
1
1
1
I
1
1
I
I
I
I
1
1
1
1
I
I
I
I
I
I
IV.2 Préparation des é]ectrodes et constniction du capteur
IV.2.1 Nettoyage des électrodes
IV.2.2 Fonctionnalisation des électrodes
IV3 Camctérisation électrochimique de l'électrode Au/ Extmit pobrphénolique ... 47
IV.4Expression des résultats
IV.4.1 Caractérisations électrochimiques
IV.4.2 Efficacité de nettoyage des électrodes
IV.4.3 Sensibilité du capteu Au/Extrait
49
49 50 50
a. Etude la sensibilité du capteu AUÆxtrait vis-à-vis le cadmium par spectroscopie d'impédance
élœtrochimique
a. Caractérisation de l'électrode Or-extrait par voltamétrie à onde carrée SWV ... 52
IV.4. 4 Caractérisation physico-chimique par R • Expression des résultats
IV.4.5 Comparaison entre les deux extraits acétoniques
I
I
I
I
1
1
I
1
1
1
1
1
I
1
1
I
I
I
1
1
I
AnnexeAnnexe
Listedestableaux -Tableau 01 : Dosage des polyphénols totaux.Tableau 02: Dosage des flavono.i.des. Tableau 03: Dosage des tannins totaux. Tab]eau 04: Dosage des tannins condensés. Tableau 05: Dosage des tannins hydrolysables.
• Listedesfigures
-Flgure 01: Coube d'étalonnage de l'acide gallique. Figure 02: Couri)e d'étalonnage de La quercétine.
"gure 03 : Coube d'étalonnage de l'acide tannique.
Figure 04: Coube d'étalonnage de la catéchine.
Figure 05: Coube d'étalonnage de l 'acide tannique.
Fîgure 06: Révélation de la plaque de CCM (GRD) par la lampe UV à la longueu d'onde 254 nm. Figure 07: Révélation de la plaque de CCM (GRD) par la lampe UV à l'œil nu.
Hgure 08: Révélation de la plaque de CCM (GRD) par la lampe UV à la longueur d'onde 254 nm. Figure 09: Révélation de la plaque de CCM (GRD) par la lampe UV à l'œil nu.
Fïgure 10: Profil de Chromatogramme HPLC de l'acide tannique Figure 11 : Profil de Chromatogramme HPIC de l'acide gallique
Figure 12: Profil de Chromatogramme HPLC de la quercétine
Figure 13: Profil de Chromatogramme IPLC de la phase acétate d'éthyle (GLD)
Figure 14: Profil de Chromatogramme lIPLC de la phase éther d'éthylique (GID)
Flgure 15: Profil de Chromatogramme HPLC de la phase aqueuse de (GLD)
Fïgure 16: Profil de Chromatogramme HPLC de la phase Butanone (méthyl-éthyl-cétone (GLD) Hgure 17: Profil de Chromatogramme HPLC de la phase acétate d'éthyle du (GRD)
Fïgure 18: Profil de Chromatogramme HPLC de la phase Ether diéthylique (GRD)
Fïgure 19: Profil de Chromatogramme HPLC de la phase aqueuse (GRD)
I
I
I
1
1
I
1
1
I
I
I
I
1
1
1
I
1
1
I
I
I
hnoducüon
Inmduction
k pollution représente m sérietK problème pou l'enviromement à cause des rejets de
nombreux produits chimiques, dont des éléments métalliques rejetés par les industries, l'agriculture et
les cozmmûLd]és urbaines. La pollution des eaux par les élémcmts mœ métalliques est l'm des
problèmes actuels dont la gravité augmente avec le développement industriel. Contrairement au{
polluamts organiques susceptibles de se dégrader, les éléments traces métàlliques pewent être
nocifs pou tous les écosystèmes à cause de leurs stabilités et de leus persistances dans la nature.
Pou répondre à ces exigences léÉtimes, des recherches scientifiques complexes sont mises en
œuvre et leus efficacités sont intimement liées à la qualité des outils analytiques mis à leurs
disposition.
Les techniques analytiques traditionnelles disponibles actuellement pou le contiôle des
éléments tel que la chromatographie ou la spectrométrie, sont très exploitées en analyse pou
obtenir des rmseignements qualitatifs et quantitatifs su la œmposition élémcmtaire de l'eau.
L'atout majeu de ces techniques est leu haut degré de pécificité, de sélectivité et de sensibilité.
Müs me anàlyse paD des méthodes physico¢himiques exige m appareillage coûteux, ainsi qu'm
procédé de préparation et de mesure qui est long à réaliser. De plus, ce type d'analyse ne pemet
d'évaluer que la qmtité totale et la spéciation d'un polluant particulier, et ne dome que peu
d'informations su sa biodisponibilité ou sa toxicité potentielle.
Le développement d'm système de détection et de quantification des métaux louds, bon marché,
fiable, sensible, perfomant, utilisable su le temin et qui domertit des infomatio" su le niveau
de contamination d'm site, constiderait donc un apport précieu dans ce domaine. Au cous des
deu{ dernières décennies, plu5ieurs tests biolodques ont été développés pou évaluer la toxicité et
ou la biodisponibilité de diffërents composés. Pou combiner les avantages des tests bioloriques
avec la pécificité et la sensibilité d'me analyse physico¢himique, les efforts de la recherche en
biotechnologie se sont ciblés su le développement de biocapteus pemettant la défection des
qtmtités biodisponibles d'm polluant spécifique. Les biocapteurs sont construits de sorte que
l'orgarisme puisse capter un stress enviromemental et le traduire en un signal facilement
mesurable. Leu intérêt principal est qu'ils peme«ent d'évaluer la biodiponibilité du polluant,
avec me grande spécificité, données essentielles pou une analyse environnementale et pou la
mise en place de techniques de bioredressement.
C'est dms ce contexte que s'inscrit ce présent travtil, dont le but principal est le développement d'm
biocapteu à base des deu plantes le chêne liège et le grenadier. Ic choix de ces deux échantillo" est
bast su leus richesse cn composés polyphénoliques capable de détecter la présence des éléments
I
I
1
1
I
I
I
1
1
I
I
1
1
I
I
1
1
I
I
I
I
I-uaion
Ce tiavail comporoe quam chpitres:
q> Le premier chapitre est consacré pou les données bibliographiques su les plamtes ffisant
l'objet de ceiœ étude. Elle décrit aussi les diffërentes classes des composés phénoliques, leuis
répartitions et leurs rôles et intérêts biolodques, ainsi que les méthodes utilisées pou leurs
qmtifications.
q> I.e deuxième chapitie comprend l'expérimentation qui a été réàlisé au niveau de laboratoire,
l'extraction des composés polyphénoüques, l'analyse phytochimiques utilisé qui englobe le
dosage des phénols totam, l'analyse structurale des composés polyphénoliques par la
spectrophotométie (UV -Visible), CCM IIPLC et R
q> Le tmisième chapitre est me présentation des résultats obtenus, la discussion et les
perspectives.
q> Et le dernier chapitre est une application capœu pou la détection des éléments trace
métalliques, dans notre cas le Cadmium.
I
I
I
I
I
I
1
1
I
I
I
1
1
I
I
1
1
1
I
I
I
Chapitre 1
Syrïthèsebïbtiographie
'J
I
1
1
I
I
I
1
1
I
I
1
1
I
I
1
1
I
I
I
I
Çhqftr€ I
sy"tbèsç__P_ib_Ëpgræ_ftæI.Généralîtés stir les plantes
\.1 Le grens\dîer .. PunÈcagmnatum .L
I.1.1Jb»z.c4gnsmmm.£ dans ]'histoire
Le grenadier est un arbre fiuitier appartenant à la fbmille des Punicacés qui comprend trois
espèces différentes :Pw"i.caprofop#"!.ca, P#n!.ca n¢#¢ et Pwni.cagrfl!na"m, espèce la plus commune. Iæ
nom du genre, Pw»z.ca, a été l'appellation romaine de la ville de Carthage Œanlieue nord de la Tùnisie)
où poussaient les meilleurs grenadiers. Le grenadier est cultivé dçpuis la plus haute antiquité pou ses fiuits comestibles (les grenades) et pou les qualités omementales de ses grandes fleurs[ 1].
1.1.2 Description botarique
l.e grenadier est un petit abre à port arbustif des réÈons méditemnéennes qui peut atteindTe 6m de haut. Ses fleuis rouge vif mesurent 3 cm de diamètre. Ses fiuits, les grenades, contiennent en
moyenne 600 graines pulpeuses. I,a grenade est une grosse baie ronde, de la taille d'une grosse omnge,
à écorce dure et coriace, de couleu rouge ou jaune- beige, qui renfeme de nombreux pépins de couleu rose à rouge. Seuls ses pépins sont comestibles, soit environ la moitié du fiuit.
Dans chaque pépin, la graine est enrobée dtune pulpe gélatineuse de chair rouge transparente, sucrée
chez les variétés améliorées, sinon dlm goût plutôt âcre. 11 croît majoritairement dans toute la région méditerranéeme, de fàçon spontanée ou cultivée [ 1 ].
1.13 C]assification botaLnique
• Embranchement: Spermaphytes
• Sous-embranchement: Anriopemes
• Classe:Magnoliqpsida• Ordre:Myrtales
• Famil]e:Punicaceae• Œnre:Punica
• Epèce:Pe¢œjcœg7iaœammJL[ l ].Hgue 1-1 : Fruit de Æmz.cag7iaæamm.J
1.1.4 Compositîon biochimique du Jb.»z.cqgn¢»¢mm.J
P«»z.cag7iœ»œfz/m.£ est une bome source de protéines, fibres, sucres simples, oligo-éléments et
I
I
I
I
I
1
1
I
I
I
I
1
1
I
I
I
1 1I
I
I r\çÈ_019PËÏ!Ë:çl___________.___`_..~__..`___._.____._.__.^..._..._._.~.__._._.__~_____S_Ë¥l__±±£üiFIËO_g_I_9P!h_iè_rl\Tab]eau 1-1 : Composition biochimique de PzA»ùqgr"¢"Z, [ 1 ].
Organe végéta]
Composition chimiqueRéférences
Ecorce de fruit
• Flavono.i.des•Tannins•Acidespolyphénoliques. [2]Feuines
• Flavono.i.des•Tannins [2]Grains
• Acides gras insatués•Acidesgrassatués•Tannins•Stérol[2]
1.1.5 Phytochimie de Pzf»z.cœgrœ»œfz.mz,
Toutes les parties du fiuit du grenadier semblent avoir des propriétés thérapeutiques et certaines études rapportent que l'écorce, les racines, les feuilles et le tronc ont aussi des effets médicinaux bénéfiques. Des recherches actuelles semblent indiquer que les principaux constituants thérapeutiques du grenadier sont les éllagitannins (incluant les punicalagins), l'acide punique, les flavono.i.des, les anthocyanidines, les anthocyanines, les flavonols et les flavones [3].
OH
HO OH HO OH Figure 1.2 : Structune de base de Punicalagins [3].
1.1.6 Ecorce de ]a grenade
L'écorce du fiuit du grenadier est également appelée malicorium. 11 s'agit de la partie due du fiuit. Elle est généralement utilisée séchée, sous la forme de morceaux brunâtres ou vert rougeâtre à
I
I
I
I
I
1
1
I
I
I
I
I
1
1
I
I
1
1
I
I
I
Chœt]ifte l Synthèse bibliogrqphie
l'extérieu, ui peu verruqueux, brillants, jaunâdes sur la face intérieue concave, portant souvent
l'empreinte des graines qui y étaient appliquées [4].
L'écorce du fh]it contient deux importants acides hydroxybenzoi.ques, l'acide gallique et l'acide éllagique. Elle renferme également des acides hydroxycimamiques, des dérivés de flavones, des molécules de coloration jaune et des anthocyanidines, responsables de la couleu rouge des grenades. De nombreux éllagitannins sont aussi présents, tels que la punicaline, la
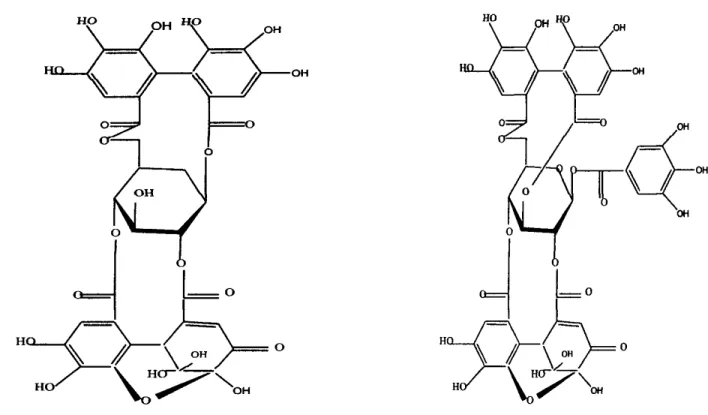
punicalagine, la granatine A et la granatine 8, ces tannins représentent jŒqu'à 28% de l'épideme
du fluit [5].
0
jŒLo jffl
H#7Œo H
Figure 1-3 : Structure de base de la granatine A.Figure 114 : Structure de base de granatine 8.
OH
Figure 1-5 : Structure de l'acide gallique [5].
CH
I
1
1
I
I
I
1
1
I
1
1
1
I
I
1
1
1
1
1
1
I
Chapine 1 Syrtthèse biblù)grqphie
I.2Le Chêneliège « g]rerczis szibc7. » 1. 2.lDescription de la p[ante
Le chêne est un arbre appartenant à la famille des fagacées, et un des arbres les plus caractéristiques du bassin méditerTanéen, de taille qui atteint une hauteu de 20 à 25 m. Son tronc est souvent tortueux et branchu. Sa cime est arrondie et son écorce est de couleur noire brunâtre ou noire, légèrement craquelée en petites plaques carrées, minces, sèches et souvent recourbées.
L'arbre de chêne est considéré comme ltun des arbres les plus significatifs et les plus magnifiques au monde. En tout il y a plus de 300 variétés de ces géants majestueux de forêt. Pami ces
variétés de chêne, il ya le chêne de liège (gciemc4s swbcr) et le chêne vert (gwercwsz./ex).Le plus
rare des chênes est le chêne de liège et est prétendu parce que c'est l'arbre qui est employé pou faire une majorité des lièges de bouteille les plus fms [7].
I.2.2Princip ales caractéristiqu es botaniques
1£ chêne-liège est un arbre de taille moyenne de 10 à 15 mètres, s'étalant en longueu. L'arbre présente un couvert léger laissant passer la lumière. A l'état isolé le tronc est couvert de grosses branches étalées, quand il vit en massif le tronc est plus droit et plus long [7].
n peut vivre jusqu'à 250 à 300 ans, mais les levée successives de liège diminue fortement cette remarquable longévité à environ 150 à 200 ans.
Le fiuit ou le gland du chêne-liège présente une fome et des dimensions très variables de 2 à 5 cm en longueu et 1 à 2 cm en largeu. La maturation des glands a lieu dans l'année de floraison.Les glands tombent en octobre et novembre, parfois jusqu'à janvier. I.a fructification commence dès 1'âge de 15 ans. Les bonnes glandées se répètent tous les 2 ou 3 ans. I.e gland mûrit en automne, ce qui donne lieu à trois récoltes distinctes :
q> Glands primaires: ce sont des glands de l'année précédente, qui mûrissent en sq)tembre-octobre. ns sont produits en petite quantité mais sont très gros.
9 Glands secondaires: ils sont produits en grosse quantité de novembre à décembre et leu
taille est moyeme.
b G]ands tardifs: qui tombent fin janvier.
Les rameaux de chêne-liège sont sinueux pubescents les premières années, puis bruns clairs et enfin entièrement subéreux. Dès qu'ils ont 3 ou 4 ans, les jeunes rameaux, en grossissant, font crevasser leu écorce. Plus les branches sont grosses plus les crevasses sont profondes.Elles peuvent s'élargir de 2 à 3 mm par ans, l'écorce est alors grise claire.Elle porte des taches de lichens, parfois de mousses : C'est l'écorce male [7].
I
I
I
I
1
1
I
I
I
I
I
1
1
I
1
1
I
I
I
I
I
Chal'ü,e 1 irihèse biblioqQmhie
I.2.4Description I]otanique
• Nom fi"çais : Œêne
• Nom amglais : Oak
- h fimille : Fagacées
• Sous fimille : QUŒcoidées
• Cme : Fagales
• Classe : Dicotylédones
1 Sous mbranchement : Angiospemes,
• Embmnchemcmt :Spemaphytes
• Geme :giferca4s szfberi8].Figure lL6 : Gland de chêne liège
l.2.5Les tannlns dans le chêne
Les tannins dans le chêne sont des tannins ellagiques : les ellagitannins monomérique
acyclique, comme les vescalagine et les castalagine. ns ont pou structure une chêne du glucose ouverte, estérifiée en position 4 et 6 par une unité hexàhydroxyteiphénole [9].
FïgDr€ 1-7 : Struct`me de base de vescalagine [10].
1.3 GénéraHtés sur les métaboHtes secondaires
Une des originalités majeues des végétaux réside dans leu capacité à produiredes substances
naturelles très diversifiées.
Les composés organiques des plantes sont divisés en deux catégories : la première, rçprésente
I
I
I
I
I
I
I
I
1
1
I
1
1
I
I
I
1
1
1
I
1
Chapiti_Ï |_ _ __ Syrtihèse bibliographÈe
reproduction des cellules incluant les acides nucléiques, les acides aminés, les oses, et les ljpides et connues sous le nom de métabolites primaires. La deuxième catégorie, sont les métabolftessecondaires, qui n'exercent pas de fonction directe au niveau des activités fondamentales de la plante.
D'après leu biosynthèse, les métabolites secondaires peuvent être divisés en trois classes :
• Phénols etpolyphénols ;
• Terpénoi.des et stéroi.des ;
• Alcalo.i.des[11].
I.3.1Les polyphénols
Les polyphénols ou composés phénoliques, sont des molécules spécifiques du règne végétal. Cette appellation générique désigne un vaste ensemble de substances aux stnictures variées qu'il est difficile de définir simplement. A L'heue actuelle, plus de 8000 molécules ont été isoLés et identifiés. Selon leurs caractéristiques structurales, ils se répartissent en une dizaine de classes chimiques, qui présentent toutes un point commun : la présence dans leu structure d'au moins un cycle aromatique à 6 carbones, lui-même porteur d'un nombre variable de fonctions hydroxyles (OH). Ces espèces sont des monomères, des polymères ou des complexes dont la masse moléculaire peut atteindre 9000.
Ils sont divisés en plusieus catégories : anthocyanes, coumarines, lignanes, flavono.i.des, tamins, quinones, acides phénols, xanthones et autres phloroglucinols où les flavono.i.des représentent le groupe le plus commun et largement distribué. La grande diversité structurale des composés phénoliques rend
difficile une présentation globale des méthodes quj pemettent leu extraction et leu isolement, des
processus mis en jeu au cours de leu biosynthèse, de leus propriétés physico-chimiques et
biologiques[12].
Les polyphénols sont présents partout dans les racines, les tiges, les fleurs, les feuilles de tous les végétaux. Les principales sources alimentaires sont les fiuits et légumes, les boissons (thé, café, jus
I
I
I
I
I
I
1
1
I
I
I
I
1
1
I
I
1
1
I
I
I
_____˱[±
==_---.---.---,----,---n"SftƱ--E-mt)lmL2:IcsprincipalesclassesdeconposésPhénoliques[12].
Squelette carboné
C]asseC6 Phénols simple
C6Tcl Acides phénolïques et composés dérivés
C6TC2 Acétophénone et acides phénylacétiques
C6-C3
Acides cimamiques, coumarincs, isocoumarines, chrmones
Cls Flavanols, flavonones, anthocyanines et anthoN; dinesC3o Biflavonyles
C6r Ci- C6
Benzophénones, xamthones et stilbéne-r'
CftcLO{14
Qüriones
•'-.:-ï
Cl8
Eftyanines
• .-j'`,
(C6{2h
Lignanes, Dimères ou oligomèrcs(C6{3L
LigDine, Polymères(Clsh
Tànnins, Condensé et hydrolysable13.2Rôle et intérêt des composés phéDolîques
Le rôle des composes phénoliques est maintenant reconnu dans différents aspects de la vie de la
plante et dans l'utilisation que frit lüomme des végétaux. ns peuvent en effet intervenir:
1 Dans certains aspects de la physiologie de la plante Oignification. régulation de la croissance, interactions moléculaircs avec certains microorgamismes symbiotiques ou
parasites...).
1 Dans les interactions des plantes avec leu environnement biologique et physique
(relations avec les bactéries, les champignons, les insectes, résistance aux UV), soit
directement dans la nature soit lors de la cotiservation après récolte de certains
végétau.
• Dans les critères de qualité (couleu, astringence, amertume, qualités nutritiomelles...)qui
orientent les choix de lnomme dans sa consommation des organes végétaux Œruits, légumes, tubercules.„) et des produits qui en dérivent par transfomation.
• Dans les variations de certaines caractéristiques des végétaux lors des traitements
technologiques ®réparation des jus de fiuits, des boissons fementent...) pendant iesqueis apparaissent fféquemment des brunissements enzymatiques qui modifient la qualité du produit
I
I
I
1
1
I
I
I
1
1
I
1
1
1
1
I
I
I
I
1
1
Chqpitre 1 Syrith`ese_bil)tiographie• Dans la protection de lTiomme vis-à-vis de certaines maladies en raison de leu
interaction possible avec de nombreuses enzymes et de leurs propriétés antioxydants[ 12]. I.3.3Classe des po]yphénols
1.3.3.1 Les flavonoïdes
Les flavono.i.des au sens large sont des pigments quasiment universels des végétaux.Structuralement, les flavono.i.des se répartissent en plusieurs classes de molécules, dont les plus importmtes sont les flavones, les flavonols, les flavanones, les dihydroflavonols, les isoflavones, les isoflavanones, les chalcones, les aurones et les anthocyanes. Ces diverses structures se rencontrent à la fois sous fome libre (aglycone) ou sous forme de glycosides. On les trouve, d'une manière très générale, dans toutes les plantes vasculaires, où ils peuvent être localisés dans divers organes : racines, tiges, bois, feuilles, fleuis et fiuits[13].
Les flavono.i.des appartiement à la fàmille des polyphénols : ce sont des moléculesAromatiquespolysubstituées ayant un rôle de métabolites secondaires chez lesplantes. La classe des flavono.i.des est l'ue des plus abondantes et à ce jou, plus de9000 structures naturelles ont
été isolées et caractérisées.
La structure d'un flavono.i.de s'organise toujous autou d'un squelette 1,3-diphénylpropane C6-C3-C6 (Figure 1-8), décrit par une nomenclature spécifique. I,esdeux cycles benzériques sont nommés cycle A et cycle 8. Le chaînon propyle C3 peutêtre complété par une fonction éther fomant ainsi un cycle
central, appelé cycle C[14].
0
Flgure 1-8: Squelette de base des flavonoïdes [14].
1.3.3.2 Les anthocyanes
Les anthocyanes constituent le plus grand et probablement le groupe le plus important de pigments naturels hydrosolubles. Ils appartiennent à un grand groupe de composés polyphénoliques nommé flavonoïdes, qui sont des métabolites secondaires synthétisés par les plantes. À ce jou, il y a eu plus de 635 andiocyanes identifiés dans la nature[14].
I
I
I
1
1
1
I
I
I
1
1
1
I
1
1
I
1
1
I
I
I
Chapitre 1_ Syn[ihèse bibLiogrqphle
Noyau phénol
OH
Figure 1-9 : Structure de base des anthocyanes [14].
/ Rôle des flavonoïdes dans les plantes
Dans les plantes, les flavono.i.des jouent un rôle important dans de nombreux processus bloJogïques tels que la pigmentation des f]eurs, des fhijts et légumes, pou attïrer les pol]inïsateuis et dissémjnateurs de graines, la protection contre les rayons ultraviolets (UV), la défense des plantes contre les micro-organismes et la gemination du pollen en agissant comme des molécules de
signalisation dans les interactions plantes-microorganismes[ 14].
1.3.3.3 Les tannins
Les tannins (ou tanins) sont des substances d'origine végétale qui ont lapropriété de
trmsforiner la peau fi.aîche en un matériau imputrescible, le cuir. Cette propriété de tannage provient de la création de liaisons entre les molécules de tannins et les fibres de collagène de la peau[9].
D'un point de vue biochimique, une première défmition a été proposée par Bate-Smith en 1973: « ce sont des composés phénoliques hydrosolubles ayant un poids moléculaire (PM) compris entre 500 et3000 qui présentent, à côté des réactions classiques des phénols, la propriété de précipiter les alcalo.i.des et d'autres protéines ». Même si cette définition reste valable, elle a été complétée grâce aux méthodes d.analyse récentes qui ont peimis d'éclaircir la structure de ces polyphénols.Ainsi, les tannins sont désormais définis comme des polyphénols de massemoléculaire allant jusqu'à 20 000
[15].
Selon leur structure biochimique, il est usuel de distinguer deux classes detannins : les tannins hydrolysables et les tannins condensés.
q> les tannins hydrolysables: ce sont des esters de glucose et d'acide gallique. ns sont d'abord caractérisés par le fait qu'ils peuvent être dégradés par l'hydrolyse chimique (enzymatique), dans les alcools et l'eau chaude. ns libèrent alors une partie non
I
I
I
I
1
1
I
1
1
1
I
1
1
1
I
1
1
I
1
1
I
Chapine 1±._ _ _ _ _ __ _ _ s)p-ihès€bibp9F¥±!±__
phénolique (souvent du glucose) et une partie phénolique qui peut être soit de l'acide
gallique, soit un dimère de ce même acide : l'acide éllagique[9].
0
Figure 1-10 : Structure de base de l'acide éllagique [9].
q> les tannins condensés: ce sont des oligomères ou des polymères de flavane-3 ol dérivésde la (+) catéchine ou de ses nombreux isomères.Ils ont la propriété de coaguler les protéines du derme, d'où leu utilisation dans le tannage des peaux [9].
OH
Figure 1-11 : Squelette de base de la catéchine [14].
1.3.3.4 Les i)ropriétés ptiysico+cliimiques des tannins
La structure chimique des tamins présente de nombreux groupementshydroxyles et
phénolïques qui leur conferent la propriété de fomer des complexes avec de nombreuses
macromolécules telles que des protéines et des hydrates de carbones, ou encore avec des ions métalliques.
a. Solubilité des tannins
IÆ solubilité des tannins dans l'eau dépend de leu poids moléculaire et de leu degré de polymérisation. Les tannins sontégalement solubles dans l'acétone et les alcools. C'est pour cette
I
I
I
I
I
I
I
1
1
I
I
I
1
1
I
I
I
I
I
I
I
Chapine 1
SynthèsebibliogTqphi_e_raison quel'extraction des tannins œt généralement réalisée par une solution acétone-.eau ouméthanol-eau.
b. Liaisons aux protéines
Les tamins se fixent à la quasi-totalité des protéines fomant ainsi descomplexes insolubles à pH physiologique ®H 7.4). En plus de fomer des liaisons directes avec des protéines, les tanrins établissent des « ponts » entre les protéines, ce qui entraîne leur précipitation.
Néanmoins, le degré de complexation des tannins avec les protéines dépend de la structure et de la configuration tidimensionnelle des deux molécules impliquées.
Concemant les tamins, un PM trop important et l'encombrement stérique associé, ne leurs pemet pas de se fixer aux protéines. La liaison aux protéines dépend également de lanature chimique (composition) des tannins
Enfin, la complexation des molécules de tannin et des protéines est étroitement dépendmte des
conditions du milieu, tels le pH, la température, la force ionique ou de la présence de molécules
compétitrices[15].
c. Répartition et localisation
Les tannins très répandus dans le règne végétal, sont particulièrement abondants dans certaines familles : Cupulifères, Polygonacées, Rosacées, Légumineuses, Myrtacées, Rubiacées. Ils peuvent exister dans divers organes : racines ou rhizomes (Ratanhia, Rhubarbe), écorce (Chêne, Quinquina), bois (Acacia à cachou). Cependant, on note une accumulation dans les écorces âgées et
les tissus d'origine pathologique [ 16].
d. Réaction des com]exation avec ]es métaux
Divers polyphénols abondants dans les plantes et dans l 'alimentation sont considéréscomme de bons chélateus des ions métalliquesLa complexation des ions métalliquespar les polyphénols induit typiquement un dépLacement bathochrome de leurs bandes d'absorption dans ie domaine UV-Visibie.
Les études menées par Van Acker et sescollaborateus su la chélation des ions du fer par certains flavonoïdes ont mis en évidence lessites essentiels pou la chélation des ions métalliques (Hgure 1-12) les groupes 3'-hydroxy et 4'-hydroxy du cycle 8, (ii) les groupes 3-hydroxy et 4-oxo ducycle C, (iii) les groupes 4-oxo et 5-hydroxy. Ainsi, la quercétine qui combine tous cessubstituants est un complexant métallique particulièrement efficace[ 16] .
I
I
I
I
1
1
I
I
1
1
1
I
I
1
1
I
I
1
1
1
I
ChQu)itre 1 Synf tè_se bibtiographie
H\
ËF!F±€
OH o \`````````` Meh-_Tg,,,,,,,,wÊ£o:"""`xù£m
OH Figure1-12:Lesflavono.i.desetleussitesproposéspoulachélationdesionsmétalliques(Mn+). L'interaction des polyphénols avec les ions des métaux de transition d'importancebiologique (fer, cuivre) est un phénomène aux répercussions multiples. Ces interactionspeuvent maintenir unepartie de leur activité antioxydante par l'intemédiaire de formation descomplexes inactifs. On outre,
les ions du fer et du cuivre sont suscçptibles d'amorcerl'oxydation à l'air des polyphénols.
Ce processus d'auto-oxydation dépend de multiplesparamètres tels que la concmtration de l'ion métallique et du polyphénol, la température, lçpH, la présence d'agents complexants .... etc[ 16].
1.4 Méthodes et techniques de purificatîon
Depuis l'invention de la chromatographie par le scientifique russe Tswetten 1903, cette techrique n'a cessé d'être améliorée. La chromatographie su colonne de gel de silice convient habituellement au fi.actionnement primaire d'un extrait brut. Par la suite, les fiactions peuvent être purifiées su colonne ®ar gravité) en utilisant un adsorbant approprié.
Diverses techniques permettent d'accroître la résolution, c'est le cas de la chromatographie liquide à
haute perfomance (IHLC). Cet appareillage, par un mode de détection non destructif (ex:UV), pemiet
la récupération de produits purifiés, lesquels peuvent ensuite être analysés par les techniques spectrométriques usuelles : RMN, IR, UV, etc. Ces mêmes composés purs peuvent alors être soumis
directement à des tests de bïoactivjté[ 17].
1.4.1 La spectrophotométrie
La spectrophotométrie est une méthode analytique quantitative qui consiste à mesurer
l'absorbance ou la densité optique d\me substance chimique donnée en solution. Plus cette espèce est concentrée plus elle absorbe la lumière dans les limites de proportionnalités énoncées par la loi
de Beer-Imbert.
I
I
I
1
1
I
1
1
I
1
1
I
1
1
1
I
I
I
I
I
I
ChaDitre 1 Synth?_se bibliogTqphie
La densité optique des solutions est déterminée par un spectrophotomètre préalablement
étalonné su la longueur d'onde d'absoption de l'espèce chimique à étudier. Lorsquüne lumière d'intensité lo passe à travers une solution, une partie de celle-ci est absorbée par le(s) soluté(s). L'intensité 1 de la lumière transmise est donc inférieue à lo[18].
1.4.2 Cl]romatographie sur couche mÉnce
La chromatographie est aujourd'hui, une méthode analytique largement utilisée pour la séparation, l'identification et éventuellement le dosage des constitumts chimiques dans des mélanges complexes (analyse qualitative et quantitative). Les facteus qui interviement dansle partage des molécules à séparer entre la phase statiomaire et la phase mobile sont: la solubilité dans un solvamt liquide, la taille (la fome), la polarité, la charge électrique et la présence de groupements d'atomes fomant des sites particuliers.
La chromatographie su couche mince (CCM) rçpose principalement sur des phénomènes d'adsorption ; la phase mobile est un solvant ou un mélange de solvants qui progresse le long d'me phase stationnaire (gel de silice, polyamide, cellulose...) fixée su une plaque de verre ou su feuille semi-rigide de matière plastique ou d'aluminium. Cette technique prise dans sa fome préparative est souvent utilisée en dernier lieu. En effet , lorsque le système de solvant ou l'éluant est bien choisi, cette technique utilisée sous sa fome préparative, est souvent très avantageuse car la transposition à partir de CCM analytiques est facile. Le procédé est rapide et peimet d'isoler des quantités de substances suffisantes pour des analyses de structure. Cette méthode pemet la plupart du temps d'obterir des produits purs [18].
1.43 CI]romatographie liqujde de l]aute perfomance aml.C)
I.a méthode de séparation qu'elle utilise fait appel aux mêmes éléments de base que
ceuxemployés pou la chromatographie classique su colonne, soit un ou plusieurs solvants et
unecolonne remplie avec une phase stationnaire, mais avec un appareillage plus sophistiqué. I.agrande différence par rapport à la chromatographie classique réside dans la duée d'élution. Cettevitesse est obtenue par l'application d'une pression élevée grâce à une pompe qui maintientconstant le débit de 1'éluant.Elle se distingue également de la chromatographie classique parl'utilisation d'un détecteu dont le message est enregistré puis exploité par un détecteu relié ausystème [ 19].
I
I
I
1
1
I
I
I
I
1
1
I
I
1
1
1
I
1
1
I
I
Chœpine 1 Synth_èse biblÈog'œphie _
1.43.1 Appareilhge
Les différentes parties constituant l'HPLC sont décrites ci-dessous:
1 Pompe : Lme pompe est alimentée à partir des pLusieurs flacons contenant des soLvants
depolaritésdifférentespemetd'effectuermeprogrammationdessolvantspouassurerunsystèmede
gradjent.
> En mode isocratique: 100% d`un mélange du même éluant tout au long de l'analyse,
> En mode gradient, la concentration des constituants du mélmge d'éluant varie en fonction du
temps.
• Injecteur w'est uie vume d`injection qui porte une boucle d'échantillonnage.
• Colonne : elle contient la phase statiomaire qui définit le type de chromatographie, soit en phase nomale soit en phase inverse.
1 Laphasenormale
Dans le cas d'une chromatographie en phase nomale, la silice est greffée par des groupements
polaires et l'éluant utilisé est apolaire.
• La phaseinverse
Dans le cŒ de la phase inverse, la sjlice est greffée par des chaines carbonées linaires (C8, Cis et l'éluant utilisé est polaire (ACN (acétonitrile), MeoH, H20).
• Détecteur : un détecteu UV-visible à longueu d'onde variable (190400 nm) quipemet
de détecter les différents composés contenu dans l'échantillon à analyser.
Notons qu'il est important que les produits à détecter portent un chromophore quiabsorbe dans cette plage de longueu d'onde[17].
1.4.4 La spectroscopie infrarouge IR
a. Le rayonnement infrarouge
Le rayonnement infiarouge (IR) fi]t découvert en 1800 par Frédéricwilhelm Hershel. Ces radiations localisées au-delà des longueurs d'ondedans le rouge, sont situées entre la région du spectre visible et des ondeshertziennes. Le domaine infi.arouge s'étend de O,8im à 1000 iim. n estarbitrairement divisé en 3 catégories, le proche infi-arouge (0,8 à 2,5iim) soitl25004000 cm-[), le moyen infirarouge (2,5 à 25[un soit 4000400 cm-]) etle lointain infi.arouge (25 à loooiim soit 400-10
cm-l)[20].
I
1
1
]
I
I
I
I
I
I
I
I
1
1
I
1
1
1
I
I
I
Chapine 1 Sy"thèse b_ïbüogrqphie
6x |O'2 io9Hz
(0) 3xio'9 3x|O`6 8xl0"
Rayons Rayons Ultmvlolet Visible Infrarouge Microondes Ondes Radio
Y X (transitions (transitions (transitions (transitions (Transitions
électroniques) électroniques) vibrationnelles) rotatiomelles) despin nucléaii.e '\
Longueur
d'onde (À,)
0,Oim lonm 400im ,7,Odnm ,,' .`, 50ph``` 30um
Nombre i 4ooo. ' 400J
d'onde (ü)
TR proche IR moyen nR lointain Figure 1-13 : Le spectre électromagnétique [20].
b. Principe de ]a technique
L'absorption d'un rayonnement inflarouge par une molécule provident de l'interaction dela composante électrique des ondes électromagnétiques incidentes avec les dipôlesélectrique des liaisons non symétrique. Elle conceme essentiellement les espèces moléculaires pou lesquelles les différences énergétiques entre les états de rotation et celles entre les états de vibration sont relativement £ribles. Elle requiert que le mouvement de vibration et de rotation de la molécule modifient son moment dipolaire. C'est uniquement dans ces conditions que le champ électrique altematif peut interagir avec la molécule et entrainer une modification de l'amplitude de l'un de ces mouvements.
c. Spectre infrarouge
Le spectre d'adsorption se présente sous forme d'un graphique portant la transition T en fonction de la longueur d'onde À exprimée en #m ou du nombre d'onde l/À noté y et exprimé en cm-]. La transmission est fiéquemment exprimée en pourcentage, elle est donné par le rapport : T = I / Io.
Elle est liée à l'absorbance A (densité optique) par la relation suivante :
A - lo8 (10 - €.].c
lo: intensité de la radiation incidente.
1: intensité de la radiation après absorption.
£ : Coefficient d'absorbance (coefficient d'extinction molaire).
I
I
I
I
1
1
I
1
1
I
I
I
1
1
1
I
I
I
I
I
I
9!g±cl---.--'-1 : 9!g±cl---.--'-1ongueu du trajet optique au travers du milieu absoibant, exprimé en cm.
c: concentration de la substance analysée en mol.dm-] [20].
Syn[thèse bililiogTœphie
I.4.S Généralités sur ]es biocapteurs
Les premiers biocapteurs, développés au début des années 1960 par clark et Lyons, sont des électrodes enzymatiques pemettant le dosage du glucose dans une solution biologique Depuis, les biocapteurs ont connu un développement considérable en raison de leurs nombreuses applications potentielles, que ce soit dans les domaines médical, agro-alimentaire ou du contrôle de l'enviromement.
Un biocapteur est un dispositif analytique conçu pour transformer un phénomène biochimique
en ui signal mesuable. n combine un composant biologique appelé biorécepteu et un transducteu
représentant le mode de détection.
Le principe de fonctionnement d'un biocapteur pemettant d`obtenir, à partir de l'espèce à détecter
dans un milieu échantillon, toute l'infomation utile à son évaluation. Cette domée poum être traitée, enregistrée, stockée pou une utilisation ultérieue. On distingue deux types de biocapteus
ç> Les biocapteurs d'affinité sont fondés su de simples interactions entre les espèces chimiques en solution et le biorécçpteu. La molécule à détecter n'est pas détruite.
q> Les biocapteus métaboliques reposent su une réaction spécifique entre l'espèce en solution et le biorécçpteur. La molécule recherchée est alors dégradée. La diminution de la concentration d\m réactif ou la fomation de produits est alors détectée.
Le biorécepteu est le premier maillon du biocapteu. 11 pemet d'identifier l'espèce àdétecter. En effet, l'élément biologique utilisé possède des sites particulièrement sélectifs. Lebiorécepteu assure ainsi la reconnaissance moléculaire de l'espèce à mesurer. En présencedu composé à doser, il doit foumir un effet physico-chimique détectable par le transducteur.
Le transducteu est l'élément physique qui sert à exploiter la modification biochimique du substrat par
le biorécçpteu pou la transfomer en signal électrique. Le transducteu assure la conversion d\m type
d'énergie en un autre. Le type de transducteur sera choisi en fonction des modifications biochimiques se produisant au niveau du biorécçpteur. Cette adéquation entre le transducteur et l'élément bioloaque peimettra d'obtenir un signal sensible, facilement exploitable et avec un minrium de
bruit de fond [21].
gyp_4è_Se__kŒÏ±ËË2_gi_P_h4±É± _ _ it'el. Biocapteur
•)'
M me ubstamces éLectroactivcs E]ectrodeTliernristorpHmèŒeCotbptcude photonDÎsposîtifpiézoé]ectriqtieÈ
Ë
r Enzyme Enthapieti=,txAnm
Tissus Changement i)H
OrEanite Lumière
a
ÊSlgnnÉ]ectrique Ë Immi]noréecpt€ur Variaüon de masse
1Bdi
Cliémoréœptcur
bîoréeept€u Si8nd TraBsdu€Oeu
Figure 1-14 : Rçprésentation schématique du principe de fonctionnement dlm biocapteu [21] .
I
1
1
I
1
1
I
I
I
1
1
I
I
I
1
1
I
I
I
I
I
Chapitre 11
Partie
Expérimentale
I
I
I
I
1
1
I
I
1
1
I
I
I
I
1
1
I
I
I
I
I
Chœpi„e 11
Po[rtie Epérime"hde
11. Méthodologie et techniquœ ana]ytiques
Ce chapitre définit l'ensemble des réactifs, matériels, et méthodes analytiques utilisés au
cours de ce travail.
La partie expérimentale a été réalisée en 5 étapes : I préparation des échantillons ;
1 Préparation des extraits des deux plantes ; • Testes phytochimiques su les extraits ;
• Dosage des composés phénoliques de ces extraits ; • Etude analytique par CCM et HPLC.
11.1 Matériau végétal
Nous avons travaillé sur deux plantes :
- Ecorce de la grenade (Pz/»7.cagrœ»œmm.£J
• Ecorce de gland de chêne liège(gwcrcws §wbcr/
H.1.l Récolte de l'échantillon
l.es glands de gwercws swber (chêne liège) sont prélevés à l'automne (octobre 2014) au niveau duparc national de Taza wilaya de Jijel, ensuite, les glands ont été coupé finement et stockés à l'abri de la lumière à température ambiante.
La collecte de l'écorce du fluit de Pw"i.cagm[m"m.£ a été effectuée au cours du mois d'octobre 2015.De la même façon, il a été séché et coupé finement, puis il est conservé à l'abri de l'humidité et de la lumière.
11.12 Macération et extraction
La macération est une opération qui consiste à laisser le matériau végétal en contact prolongé avec un solvant pou en extraire les principes actifs.
L'extraction peut être réalisée par l'eau, les alcools (méthanol et éthanol) ou un mélange eau-acétone. Seigler et al, en frisant l'extraction de quatre espèces d'acacia du Mexique et du Texas, ont montré que l'acétone, à 70% dans l'eau donne un meilleu rendement que l'eau ou le méthanol à 80%
[19].
La macération dans ce cas est basée sur l'utilisation de 100 ml de solvant acétone/eau (70/30 : V/V) pour 10 g d'écorce du gland et de la grenade en trois macérations successives de 24heures chacune. Pendant cette opération, il a fallu assurer l'obscurité pou éviter l'oxydation des polyphénols.
I
I
I
1
1
I
1
1
I
1
1
I
1
1
1
1
I
I
I
I
I
çbp±_e__I_I____________.________________________________________________P_g±:_e___ËmÉËm_e_"_Ë!s11.13 Fi]tration et Décantation
Après chaque macération, une filtration est appliquée su les mélanges (extrait + acétone/ eau)
avec le papier filtre. 300 ml de l'éther de pétrole ont été ajoutés dans le filtra obtenuespou extraire les impuetés (composés non phénoliques surtout les lipides).Les mélanges ont été décantés à l'aide de
deux ampoules à décmter afin de faciliter la récupération de notre phase acétone/eau.
11.1.4 Evaporation
Une autre étape était effectuée su les mélanges pou l'élimination du solvant (acétone/eau). On
parle d'évaporation qui ce frit à l'aide d'un évaporateu rotatif à 60°C et sous pression réduite pou
] 'élimination de 1 'acétone et de 1 'eau.
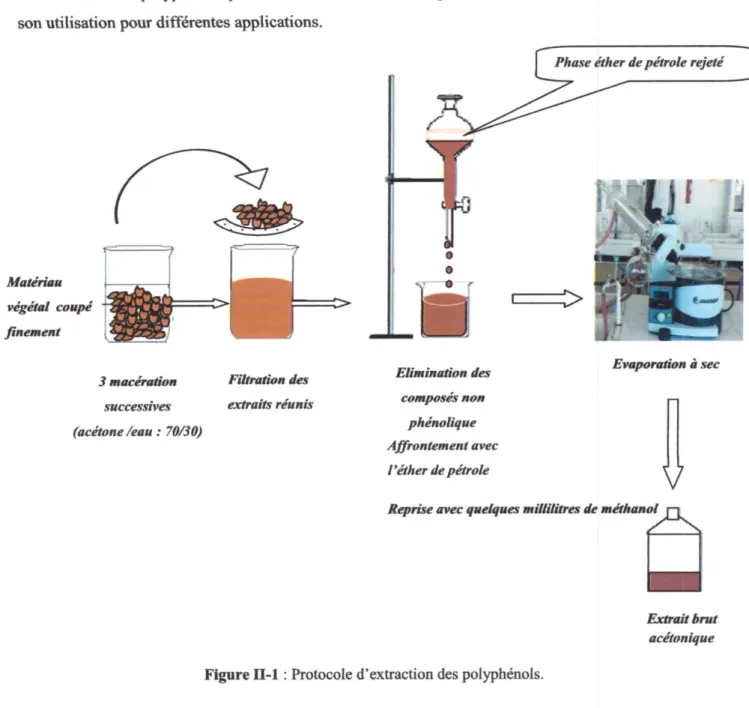
Les deux extraits polyphénoliques ont été conservés au réffigérateu à 4°C dans un flacon fimé jusqu'à son utilisation pour difiérentes applications.
MaΝ
végétoL coupé
fincmcst
Rii=E=
3 maeé.œiÈon Fibrœüot. des s.iceessi`zes extrœies réunËs
(qLcéœne /eotu .. 70RO)
E"irin dœ
composés non phénolique Af f ior.tement œvec l'édw de pétrole Ewqpomn à secÆp"„cq"*"-Œ&ffi
ELnœii bm œcétonique Figure n-l : Protocole d'exmction des polyphénols.I
I
1
1
I
I
I
I
1
1
I
I
I
I
I
I
I
I
I
I
I
Chapitw H_ _ _ PT± ExpérÈ"entale 11. 2 Tests phytochimiquesLa phytochimje ou chimie des végétaux est la science qui étudie la structure, le métabolisme et la fonction ainsi que les méthodes d'analyse de purification et d'extraction des substances naturelles
issues des plantes [13].
Le screening phytochimique est le moyen indispensable pou mettre en évidence la présence des groupes de familles chimiques présentes dans un échantillon donné. Toutefois, ce screening phytochimique ne renseigne pas sur la nature des molécules chimique.
Bien entendu, les tests de caractérisation phytochimiques présentent des imprécisions car ils sont basés en partie su l'analyse qualitative.
Les groupes phytochimiques sont nombreux, mais on peut citer les principaux®: les alcaloi.des, les polyphénols (flavono.i.des, anthocyanes, tannins), les saponines, les stéro.i.des, les coumarines,
les stérols, les terpènes, les hétérosides cardiotoniques,1es huiles essentielles...etc.
Le principe est, soit basé su la fomation des complexes insolubles utilisant des réactions de précipitations, soit sur la fomation de complexes colorés en utilisant des réactions de coloration [16].
11.2.1 Réaction de caractérisation (Screening phytochimique)
a. Solution à analyser : préparation de l'infusé à 5%
La préparation de l'extrait aqueux des écorces des plantesont été effectuée par la méthode d'infiision. On a projeté l'écorce des deux plantes coupées finement dans de l'eau bouillante contenue dans deux Erlenmayer de 250 ml, infiisées pendant 15 min sous agitation. Les échantillons ont ensuite
été filtrés (porosité de filtre : 0.22iim) et les filtrats sont complétés avec 100 ml de l'eau distillée et conservés à 4°C.
a. Tests phytocliimiques
Les deux extraits préparés ont frit l'objet de quelques tests phytochimiques afm de détecter la
présence ou l'absence de certaines familles chimiques. Pou cela nous avons réalisé su nos extraits certains tests qualitatifs.
• LestanDins
Dans un tube à essai, nous avons introduit 5 ml d'infiisé à 5% et ajouté 1 ml de solution aqueuse de Fec13 à 1%. En présence de tamins, il se développe une coloration : bleu-noire (tannins galliques), vert-noir (tannins catéchiques), noirâtre (mélange). Ces résultats ne suffisent pas et sont à confimer grâce aux révélateus spécifiques [22].
I
1
1
I
I
I
1
1
I
1
1
1
I
1
1
I
I
I
I
I
I
Chapine 11
Pœrtie Expérime"tie
I Tannins caté¢hiques
A 5 ml d'infi]sé à 5%, nous avons ajouté 5 ml d'Hcl concentré. L'ensemble a été porté à ébullition pendant 15 min pujs filtré su papier filtre. En présence de tannins catéchfques i] se fome
un précipité rouge soluble dans 1'alcool isoamélique[22].
1 Tannins ga]]iques : Réactîon de stiasny
A 30 ml d'infiisé à 5%, nous avons ajouté 15ml de réactif de Stiasny (10 ml de formol à 40% et 5 ml d'Hcl concentré), puis nous avons chauffé au bain marie à 90°C pendant 15 min environ. Après filtration, le filtrat a été saturé par 5 g d'acétate de sodium pulvérisé. Nous avons ensuite ajouté 1 ml goute à goute d'une solution de Fec13 à 1%. L'obtention d'un précipité montre la présence de tannins
gallique.
Nous avons filtré et saturer 10 ml du filtrat d'acétate de sodium en ajoutant quelques gouttes de Fec13 à 1%. Le développement d'une teinte bleu-noirâtre indique la présence de tannins ga]lique non précipité par le réactif de Stiasny[22].
• Les flavonol.de§
La présence ou l'absence des flavono.i.des dans un extrait peut être mis en évidence par un test simple est rapide appelé « réaction de Shinoda » [23].
Le test consiste à ajouter à 1 ml de chaque extrait quelques gouttes d'Hcl concentré (2N) et 0,5 g de magnésium métallique.Nous avons laissé agir 3 min tout en regardant le changement de couleu. La présence de flavonoïdes est confimée par la coloration rouge orangée rosée ou rouge violacé [24] .
• Les Anthocyanes
A l'infiision à 5% l'extrait a présenté une coloration plus ou moins foncée. Nous avons ajouté un acide (5ml de H2S04 à 10%) puis une base (N1140H). Si la coloration s'accentue par acidification, puis vire au bleu-violacé en mjlieu basique, cela pemet de conclue à la présence d'anthocyanes [22]. 11.3 Méthodes d'extraction et de dosage des composés phéno]iques
L'extraction des composés phénoliques à partir des pLantes est influencée par leur nature chimique, la méthode d'extraction employée, la duée et les conditions de stockage ainsi que la présence de substances interférentes.
Différents solvants peuvent être utilisés pour 1'extraction de ces composés.Naczk et Shahidi ont mentionné que l'extraction idéale des tannins condensés à partir des graines de colza est faite par de l'acétone aqueux (70%). le même résultat a été confirmé par Hong et al. et Hayouni et al.
Dans de nombreux travaux les acides phénols et les tannins ont été extraits par une mixture de méthanol-eau ou de méthanol-acétone-eau et à température ambiante [ 15].
![Figure 1.2 : Structune de base de Punicalagins [3].](https://thumb-eu.123doks.com/thumbv2/123doknet/14525705.722956/20.891.24.824.30.1196/figure-structune-de-base-de-punicalagins.webp)
![Figure 1-9 : Structure de base des anthocyanes [14].](https://thumb-eu.123doks.com/thumbv2/123doknet/14525705.722956/27.891.214.630.112.360/figure-structure-base-des-anthocyanes.webp)
![Figure 1-11 : Squelette de base de la catéchine [14].](https://thumb-eu.123doks.com/thumbv2/123doknet/14525705.722956/28.891.275.643.616.828/figure-squelette-base-catéchine.webp)
![Figure 1-13 : Le spectre électromagnétique [20].](https://thumb-eu.123doks.com/thumbv2/123doknet/14525705.722956/33.891.23.848.110.554/figure-le-spectre-électromagnétique.webp)
![Figure 1-14 : Rçprésentation schématique du principe de fonctionnement dlm biocapteu [21] .](https://thumb-eu.123doks.com/thumbv2/123doknet/14525705.722956/35.891.22.869.65.1242/figure-rçprésentation-schématique-principe-fonctionnement-dlm-biocapteu.webp)