HAL Id: tel-03008820
https://tel.archives-ouvertes.fr/tel-03008820
Submitted on 17 Nov 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Etude des mécanismes cellulaires et moléculaires des
leucémies pédiatriques à mauvais pronostic présentant la
fusion ETO2-GLIS2
Cecile Lopez
To cite this version:
Cecile Lopez. Etude des mécanismes cellulaires et moléculaires des leucémies pédiatriques à mauvais pronostic présentant la fusion ETO2-GLIS2. Hématologie. Université Paris Saclay (COmUE), 2018. Français. �NNT : 2018SACLS413�. �tel-03008820�
Etude des mécanismes cellulaires
et moléculaires des leucémies à
mauvais pronostic présentant la
fusion ETO2-GLIS2
Thèse de doctorat de l'Université Paris-Saclay Préparée à l’université Paris-Saclay
École doctorale n°582 cancérologie : biologie, médecine, santé (CBMS)
Spécialité de doctorat: Aspects moléculaires et cellulaires de la biologie
Thèse présentée et soutenue à Villejuif, le 16 novembre 2018, par
Cécile Lopez
Composition du Jury : Mr Thierry Jaffredo
Directeur de recherche, INSERM (U1156) Président Mme Véronique Maguer-satta
Directrice de recherche, INSERM (U1052) Rapporteur Mr Eric Delabesse
Professeur, Université de Toulouse Rapporteur Mme Marie-laure Arcangeli
Chargée de recherche, INSERM (UMR967) Examinateur Mme Leïla Maouche-chretien
Chargée de recherche, INSERM (U1163) Examinateur Mr Thomas Mercher
Directeur de recherche, INSERM (U1170) Directeur de thèse Mr Olivier Bernard
Directeur de recherche, INSERM (U1170) Co-directeur de thèse
NN T : 2 0 1 8 S A CL S 4 1 3
REMERCIEMENTS
Je tiens tout d’abord à remercier la Cancéropole Ile de France et la Fondation Recherche Médicale d’avoir financé cette thèse. Merci à Véronique Maguer-satta et Eric Delabesse d’avoir accepté d’évaluer ce travail, ainsi qu’à Marie-Laure Arcangeli, Leïla Maouche-Chretien et Thierry Jaffredo pour faire partie de mon jury de thèse.
À Thomas, mon directeur de thèse, je tiens à te remercier pour ces 9 années passées dans ton équipe. Merci pour les premières années en tant qu’ingénieur, j’ai adoré travailler avec toi, Clarisse, Vincianne, Paola et le reste de l’équipe. Tu m’as fait découvrir le monde de l’hématologie avec beaucoup de patience et de pédagogie. L’experte souris qui n’en avait jamais touché une à bien grandit. Merci aussi de m’avoir poussé plus loin, et notamment jusqu’à cette thèse. Tu m’as toujours chalengée et c’était très stimulant. J’ai adoré nos discussions scientifiques aussi. Et surtout merci d’avoir composé avec mon caractère, hum, doux et tellement facile à vivre …
À Olivier, mon deuxième directeur de thèse, merci de m’avoir permis de réaliser cette thèse au sein de ton équipe et pour tes conseils.
À Jurg Schwaller, en premier lieu je tiens à te remercier pour le modèle de la fusion ETO2-GLIS2 qui a été au cœur de ce travail et qui m’a permis de répondre à bon nombre de questions. Merci aussi pour tous les échanges que nous avons pu avoir et qui m’ont toujours beaucoup apporté. Et enfin, merci pour toutes les analyses d’histologies et de cytospins que j’ai pu t’envoyer (et il y en a eu des colis fedex !!!). Ton expertise a été d’une aide précieuse ! La recherche est une grande aventure prenante, passionnante et pas toujours évidente. Mais elle m’a permis de rencontrer des personnes incroyables au cours de ces 9 années : mon boubou (alias Clarisse), Vinciane, Paola, Laurianne (mon cerveau externe), Aline, Carrèle, Morgane, Elodie, Lucile, Claire, Enguerran, Damien, Dom et Olive merci pour tous ces moments partagés à la paillasse et ailleurs.
Merci à tous les membres de l’équipe Erythro-Méga-Lympho. À Sébastien, je te remercie pour ta disponibilité et toutes les discussions scientifiques que nous avons pu échanger avant ton départ pour le pays des kangourous.
À Zak, un énorme merci ! J’ai adoré (et j’adore encore !) maniper avec toi. Tu es toujours prête à aider tout le monde et c’est un vrai plaisir de t’avoir dans l’équipe. Merci pour ta bonne humeur, toute l’aide que tu m’as apportée et tous les bons moments partagés. Merci aussi pour tous les jeux de mot volontaire et involontaire qui ont mené à de cocasses situations et à de nombreux fous rires. Tu es quelqu’un de génial. :)
À Anouch (et Robert), ma chouchou, Madame Prout-Prout, ça a été un vrai plaisir de partager toutes ces pauses en ta compagnie, de te voir évoluer et grandir entre ton M2 et ta quatrième année de thèse. Tu es un petit rayon de soleil, ne change pas ! Plein de bisous et de bon courage pour la suite.
À Alex, Laetitia, Fabien, Julie et Muriel, merci pour tous ces moments passés avec vous. Les réunions d’équipes et repas sont rarement mornes et silencieux en votre compagnie. Et un énorme merci pour toute l’aide apportée : relecture, discussion, partage d’information, aide de manip mais aussi pour les bons moments : gâteaux, apéro et fous rires.
Aux bio-informaticiens, Kadija et Esteve (prononcé « Steba », aller comprendre…), qui ont énormément contribués à l’avancé des projets. Merci pour toute l’aide apportée. Kadija merci pour ta disponibilité et ta pédagogie. La compréhension de la bioinformatique sous ton aile a été précieuse !!!
Merci aux différents membres de l’unité U1170 avec une mention particulière pour véro. Ma véro, tellement de chose à te dire que je ne sais par où commencer. J’ai adoré partager le bureau avec toi pendant toutes ces années. Tu es toujours disponible et de bonne humeur. Merci pour tous tes conseils et tous ces moments inoubliables. Je nous reverrais toujours nous lançant « bille en tête » dans des analyses FACS alors qu’aucune de nous deux ne savais l’utiliser (merci à William et Philippe de nous avoir sauvées du naufrage !) ou encore en injectant des cellules à des souris qui n’étaient pas les nôtres… Vive l’isoflurane !
A Yann, merci pour toutes ces heures passées avec toi devant l’ARIA. Grâce à toi j’ai appris à compenser même avec de la Cherry, du PE (« P » « I » comme dirait ton amie M), du Pc7 et du PercP5.5 ! Finger in the nose !!! À Valou, Madame Super Formatrice IVIS ! Merci ! Toujours disponible pour répondre aux milles questions ou faire des tests au pied levé (pas toujours fructueux, la GFP ne se détecte pas dans les C57bl6 ! maintenant je le sais !). À Karine, tu m’auras finalement appris à mettre une blouse pour maniper… Merci à vous trois pour votre soutient, vos encouragements et toutes les discussions sur le perron de l’IGR (je ne regarde plus les chats, les chiens et les canards de la même façon).
À toute l’équipe du PFEP, merci pour le bien être apporté aux petites pensionnaires et pour votre aide.
À mes amis, (enfance, collège, lycée, FAC, colo…), merci à tous d’avoir été présent malgré mon « hibernage » de ces 4 dernières années. J’ai une chance folle de vous avoir auprès de moi et j’espère bien que l’on partagera encore longtemps les évènements importants (mariage, naissance…) et les non moins importants (soirée crêpe annuelle, soirée jeux, dégustation de vin…).
À ma famille, ma sœur, mon grand-père, ma mamie, mes tontons, tatas, cousines et pièces rapportées, merci pour tous ces moments passés en famille. Nous avons la chance d’avoir une famille unie et c’est toujours un plaisir de vous retrouver.
À mes neveux d’amour, j’ai eu la chance d’être tata deux fois pendant cette thèse et je ne saurais vous dire à quel point cela a été une joie immense (Sébastien pourra en témoigner). C’est un plaisir de vous voir grandir. Vous êtes mes rayons de soleil.
À mes parents, je tiens à vous remercier pour tout le soutien inconditionnel que vous m’avez apporté. Cette belle aventure n’aurait pas pu avoir lieu sans vous deux. Vous m’avez toujours épaulé et encouragé tout au long de ces 4 années (et bien plus encore) de la meilleur de façon. Merci pour tout. Je vous aime énormément.
En guise de préface, voici une discussion que j’ai eue avec mon grand-père sur mon orientation professionnelle…
TABLE DES MATIERES
INDEX DES FIGURES ET DES TABLEAUX ... 11
INTRODUCTION ... 14
I/ Hématopoïèse : ... 15
A/ Ontogenèse du système hématopoïétique : ... 15
1/ Les premières cellules hématopoïétiques dites « primitives » : ... 16
2/ Les cellules hématopoïétiques dites « définitives » transitoires : ... 17
3/ Les cellules souches hématopoïétiques HSC : ... 18
a/ Émergence des HSC : ... 18
b/ Amplification des HSC : ... 19
B/ Organisation de l’hématopoïèse adulte ... 20
1/ Caractéristiques cellulaires des cellules souches hématopoïétiques adultes ... 21
a/ Différenciation : ... 21
b/ Autorenouvellement : ... 22
c/ Quiescence : ... 23
2/ Modèles de hiérarchie hématopoïétique ... 23
a/ Modèle (pré)historique : ... 24
b/ Vers des modèles de continuum : ... 25
3/ Myélopoïèse : ... 28
a/ Monocyte et macrophage : ... 28
b/ Les cellules dendritiques : ... 29
4/ Mégacaryopoïèse : ... 30
a/ Généralités :... 30
b/ Origine des progéniteurs mégacaryocytaires ... 31
c/ Maturation des mégacaryocytes ... 32
d/ Différence fœtal et adulte ... 35
C/ Régulation de l’hématopoïèse : ... 36
1/ La niche hématopoïétique : ... 36
2/ Communication entre HSC et cellules de la niche : les voies de signalisation .... 38
a/ Contact cellule-cellule, exemple de la voie Notch : ... 39
b/ Facteur soluble et récepteur, exemple de la TPO :... 39
c/ Exemple de la voie Sonic Hedgehog ... 41
3/ Régulation transcriptionnelle : ... 41
a/ Facteur de transcription et complexe transcriptionnel ... 42
b/ Organisation chromatinienne ... 46
II/ Hémopathies malignes ... 51
A / Les leucémies aiguës myéloïdes : ... 51
1/ Classification des LAM ... 51
2/ Anomalies génétiques des LAM ... 52
a/ Types d’altérations génétiques ... 53
b/ Conséquences fonctionnelles des mutations ... 54
c/ Coopération oncogénique et évolution clonale ... 56
3/ Les cellules souches leucémiques ... 58
b/ Origine cellulaire ... 59
4/ Différence entre leucémies pédiatriques et leucémies de l’adulte ... 60
a/ Différence de répartition des sous-types de LAM et génétique ... 61
b/ Origine in utero des leucémies pédiatriques ... 62
B/ Les LAM-M7 pédiatriques ... 63
1/ Présentation clinique et traitements ... 64
2/ Génétique des LAM-M7 pédiatriques ... 65
a/ LAM-M7 associées aux trisomies 21 constitutionnelles ... 66
b/ LAM-M7 de novo ... 67
3/ Modélisation fonctionnelle des LAM-M7 ... 71
a/ LAM7 associées aux trisomies 21 constitutionnelles : ... 71
b/ Fusion OTT-MAL : ... 72 c/ Fusion NUP98-KDM5A :... 73 d/ Fusions MLL ou HOX : ... 73 3/ La fusion ETO2-GLIS2 ... 74 RESULTATS ... 78 CONTEXTE ET OBJECTIFS ... 79 ARTICLE 1 ... 86 ARTICLE 2 ... 112 DISCUSSION ... 158
LISTE DES ABREVIATIONS ... 170
ANNEXES ... 174
Pediatric Acute Megakaryoblastic Leukemia : Multitasking Fusion Proteins and Oncogenic Cooperations ... 174
Molecular pathways driven by ETO2-GLIS2 in aggressive pediatric leukemia ... 188 Leucémies à mégacaryoblastes de l’enfant : une affaire de complexes ... 192
INDEX DES FIGURES ET DES TABLEAUX
Figure 1: Apparition spatiale et temporelle des cellules hématopoïétiques pendant le
développement murin et humain. ... 16
Figure 2: Production des cellules hématopoïétiques au cours du développement embryonnaire murin. ... 17
Figure 3 : Représentation schématique du mécanisme EHT lors de la formation des HSC. .. 19
Figure 4: Les stades de différenciation des HSC. ... 21
Figure 5: Modèles de l’hématopoïèse. ... 25
Figure 6 : Évolution du modèle hématopoïétique. ... 27
Figure 7 : La mégacaryopoïèse ... 31
Figure 8 : Processus d’endomitose lors de la mégacaryopoïèse. ... 33
Figure 9 : Processus de mégacaryopoïèse. ... 34
Figure 10 : Différenciation hématopoïétique fœtale et adulte. ... 35
Figure 11 : Organisation spatiale des cellules dans la moelle osseuse. ... 37
Figure 12 : Voie de signalisation de la TPO. ... 40
Figure 13 : Activation de la transcription par les facteurs de transcriptions. ... 43
Figure 14 : Régulation de la transcription via les complexes transcriptionnels. ... 45
Figure 15 : Les différents niveaux de condensation de la chromatine. ... 46
Figure 16 : Régulation de la transcription par des modifications épigénétiques. ... 47
Figure 17 : Le complexe de cohésines est un régulateur-clé de la transcription et de la formation de boucle chromatinienne. ... 50
Figure 18 : Exemple d’évolution clonale de leucémie aiguë promyélocytaire (LAM-M3). ... 57
Figure 19 : Répartition des sous-groupes de LAM en fonction de l’âge. ... 61
Figure 20 : Modèle de transformation par la fusion TEL-AML1 chez des jumeaux. ... 63
Figure 21 : Survie Globale (OS) d’une cohorte française de LAM pédiatriques. ... 65
Figure 22 : Altérations génétiques entre les LAM-M7 pédiatriques et adultes. ... 65
Figure 23 : Développement leucémique des DS-LAM-M7. ... 67
Figure 24 : Mutations additionnelles des LAM-M7. ... 69
Figure 25 : Représentation schématique des gènes ETO2 et GLIS2 et des transcrits de fusion. ... 75
Figure 26 : Influence de l’ontogenèse hématopoïétique sur le phénotype des leucémies. .. 167
Tableau 1 : Combinaison de marqueurs de surface pour identifier les progéniteurs hématopoïétiques murins et humains. ... 26
Tableau 2 : Fréquence des altérations génétiques des LAM-M7 de novo. ... 68
I/ Hématopoïèse :
Le système sanguin est composé de cellules matures circulantes qui assurent certaines fonctions indispensables au bon fonctionnement de l’organisme incluant le transport de l’oxygène par les érythrocytes, la prévention des hémorragies par les plaquettes, ainsi que la lutte contre les infections par les cellules myéloïdes (monocytes/macrophages et neutrophiles) et les lymphocytes. Ces cellules matures ont une durée de vie généralement courte, il est donc nécessaire de les renouveler tout au long de la vie. Chez l’Homme entre
1010 et 1012 cellules sanguines sont produites par jour par un processus très régulé connu
sous le nom d’hématopoïèse.
Les différents travaux de James Till et Ernest McCulloch ont permis la découverte d’une cellule immature, appelée cellule souche hématopoïétique (HSC), présente dans la moelle osseuse et ayant la capacité de former les cellules matures composant le sang (1). Depuis, l’hématopoïèse est généralement décrite comme une hiérarchie avec au sommet les cellules souches hématopoïétiques (HSC) capables de maintenir la production des différentes cellules sanguines tout au long de la vie de l’individu.
A/ Ontogenèse du système hématopoïétique :
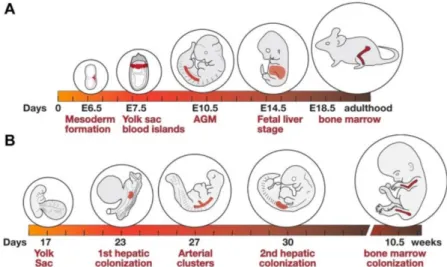
Les cellules hématopoïétiques apparaissent au cours de l’embryogenèse en plusieurs vagues spatiales (différents organes comme le sac vitellin, le foie ou encore la moelle osseuse) et temporelles (Figure 1). Par la suite, les HSC colonisent la moelle osseuse qui représente le siège de l'hématopoïèse chez l'adulte. L’hématopoïèse embryonnaire a principalement été étudiée dans des modèles animaux (murin, poisson zèbre…) à cause des difficultés d'accès aux étapes précoces du développement humain. Les observations obtenues dans le modèle murin seront principalement décrites ici.
Figure 1: Apparition spatiale et temporelle des cellules hématopoïétiques pendant le développement murin et humain.
Développement de l’hématopoïèse murine (A) et humaine (B). (Issue (2)).
1/ Les premières cellules hématopoïétiques dites « primitives » :
Les premières cellules sanguines sont détectées dans le sac vitellin au jour E7-7,5 du développement murin (Figure 2), avant l’apparition de la circulation sanguine qui a lieu à E8,5 (3). Les érythroblastes, les macrophages (3) et les mégacaryocytes (4) observés descendraient d’un progéniteur commun aux cellules endothéliales, l’« hémangioblaste » (5,6). Cette première vague hématopoïétique transitoire est également nommée
«primitive » Pour revue (7) car les cellules présentent des caractéristiques différentes des
cellules synthétisées lors de l’hématopoïèse adulte appelée « définitive ».
Ainsi, alors que les érythrocytes adultes sont énuclées, les érythroblastes primitifs
présentent un noyau et l’expression d’une hémoglobine fœtale (2) ; Pour revue (8).
Il est généralement admis que cette hématopoïèse primitive participe au développement de l’embryon en oxygénant et en phagocytant les cellules durant la formation des tissus par les érythrocytes et les macrophages, respectivement. Les mégacaryocytes assurent la production de plaquettes qui participent à l'homéostasie du système vasculaire sanguin. De plus, les macrophages participent à la protection l’embryon contre les infections.
Les cellules hématopoïétiques primitives sont amplifiées entre E7 et E8,25 et ne sont plus détectées vers E9.
2/ Les cellules hématopoïétiques dites « définitives » transitoires :
Chez l’embryon, une deuxième vague de cellules sanguines transitoires dérivant de progéniteurs érythro-myéloïde et lymphoïde est décrite avant l’émergence des cellules souches hématopoïétiques (HSC) qui présentent une capacité de reconstitution multipotente à long-terme.
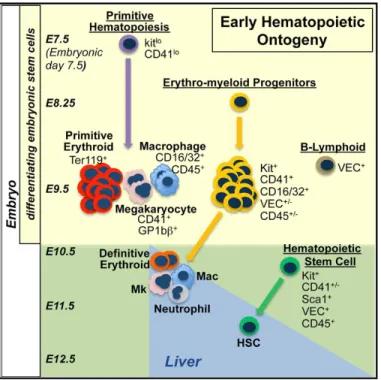
À un stade de développement précoce vers E8,25, les cellules de la lignée myéloïde dérivent d’un progéniteur bipotent EMP (Erythro-Myeloid Progeniteur) qui émerge dans le sac vitellin (3). Ce progéniteur prolifère puis migre dans le foie fœtal vers E10,5 pour produire les cellules matures érythrocytes, mégacaryocytes, et les différentes cellules myéloïdes (macrophages, neutrophiles, basophiles, éosinophiles). Les cellules EMP expriment les marqueurs de surface Kit, CD41 puis CD16/32 vers E9,5 (Figure 2, (9)).
Figure 2: Production des cellules hématopoïétiques au cours du développement embryonnaire murin.
Les premières cellules hématopoïétiques composées d’érythrocytes, de mégacaryocytes et de macrophages apparaissent au stade E7-7,5 dans le sac vitellin. Par la suite les progéniteurs EMP (Erythro-myeloid Progenitors) et lymphoïdes (B-Lymphoid) se développent vers E8,25-8,5 dans le sac vitellin et la région de l’AGM (Aorte-Gonade-Mésonéphros) avant la formation des HSC au stade E10,5. (Issue de (9)).
La greffe de ces progéniteurs EMP dans des souris hôtes irradiées, confirme la capacité de différenciation de ces progéniteurs vers les lignées myéloïdes et non vers les lignées lymphoïdes. Ces progéniteurs ne semblent pas posséder de potentiel de reconstitution à long terme dans ces analyses.
Une hypothèse récente suppose que les macrophages résidents des tissus de l’adulte proviennent des progéniteurs EMP du sac vitellin (10).
La lignée lymphoïde est observée entre les stades E8,5 et E9,5 du développement embryonnaire murin avec la présence des progéniteurs lymphoïdes dans le sac vitellin et la région AGM (Aorte-Gonade-Mésonéphros) (11–13).
Un progéniteur pouvant se différencier vers les lignées myéloïdes (granulocytes et monocytes) et lymphoïdes est aussi observé au stade E9,5 dans le sac vitellin (14).
La formation de ces cellules spécifiques du système immunitaire permet de protéger l’embryon des pathogènes.
3/ Les cellules souches hématopoïétiques HSC :
Les HSC sont définies par leur capacité de reconstitution hématopoïétique à long terme de toutes les cellules matures. Historiquement, les cellules de différents organes à différents temps gestationnels ont donc été testées pour leur capacité de reconstitution lors d'une greffe dans des animaux receveurs irradiés. Le développement d'anticorps spécifiquement dirigés contre des protéines de surface, utilisées comme marqueurs cellulaires, a permis la caractérisation phénotypique et fonctionnelle des HSC au cours du développement embryonnaire ainsi que chez l’adulte.
a/ Émergence des HSC :
Les premières cellules souches hématopoïétiques sont détectées au stade E10,5 dans des foyers de cellules hématopoïétiques attachés à l’endothélium de l’aorte de la région AGM (Figure 3, (15,16)). Comme dans le cas de l'hémangioblaste, les premières HSC définitives
dérivent de cellules endothéliales embryonnaires présentant un potentiel hémogénique, appelées les cellules endothéliales hémogéniques (HEC, hematopoietic endothelial cell). Seulement certaines cellules endothéliales formant l’aorte sont des HEC qui présentent des marqueurs endothéliaux (CD31) mais aussi hématopoïétiques (Sca1). Les HEC subissent une transition morphologique et moléculaire, passant d’une forme endothéliale aplatie à une cellule hématopoïétique ronde exprimant les marqueurs CD31+ Sca1+ Kit+ CD41+. Ce mécanisme de transition d’une cellule endothéliale vers une cellule hématopoïétique est
appelé EHT (Endothelium to Hematopoietic Transition) (17,18), pour revue (7) et est un
processus conservé entre les espèces (19–21).
Plusieurs foyers de cellules hématopoïétiques sont observés à E10,5 au niveau de l’aorte mais seulement quelques-uns semblent présenter des HSC fonctionnelles (22).
Figure 3 : Représentation schématique du mécanisme EHT lors de la formation des HSC.
Un sous-groupe de cellules endothéliales composant l’aorte, appelées cellules endothéliales hémogéniques (HE), peuvent subir un mécanisme de transdifférenciation pour former un foyer de cellules hématopoïétiques (IAHC) composé de cellules souches hématopoïétiques (HSC). (Issue de (7)).
Les HSC sont aussi détectées à E10,5 dans d’autres lieux comme le sac vitellin et le placenta avant leur apparition dans la circulation sanguine supposant qu’un mécanisme similaire a lieu dans différents territoires embryonnaires (23,24).
b/ Amplification des HSC :
Les HSC formées dans les différents sites colonisent ensuite le foie fœtal à partir de E11 et y prolifèrent entre E12 et E16 (25).
Vers E15,5 les HSC migrent vers la rate, qui est un organe hématopoïétique important chez la souris contrairement à l’Homme, pour s’y amplifier (26,27). A partir de E17,5 les HSC
sont aussi détectées dans la moelle osseuse où elles résideront tout le reste de la vie adulte
Pour revues (28,29).
Les HSC fœtales sont définies par leur capacité de prolifération importante (nécessaire pour la mise en place du système hématopoïétique adulte), contrairement aux HSC adultes qui assurent l’homéostasie. De même les HSC fœtales présentent un cycle cellulaire actif alors que les HSC adultes sont majoritairement quiescentes (30). Ces caractéristiques permettent une reconstitution de l’hématopoïèse plus rapide à partir des HSC fœtales lors de greffes compétitives (31,32). Ces capacités de prolifération sont modifiées entre 3 et 4 semaines après la naissance ou post greffe, une fois que le système hématopoïétique est mis en place, pour adopter les caractéristiques des HSC adultes (32).
Les HSC peuvent être enrichies par cytométrie en flux sur la base de l’absence de certains marqueurs de surface présents sur les cellules matures et de la présence d'une combinaison
d’autres marqueurs comme Sca1+ Kit+ CD45+ CD11b+ CD48- CD150+ Pour revue (33).
L’expression de certains marqueurs de surface comme CD11b et CD41, exprimés à la surface des HSC fœtales va être modifiée durant l’acquisition des caractéristiques des HSC adultes.
B/ Organisation de l’hématopoïèse adulte
La fonction de l’hématopoïèse adulte est la production en continu des cellules matures pour assurer le maintien de l’homéostasie à la fois dans des conditions normales ou de stress (ex: infections).
Historiquement, les cellules hématopoïétiques ont été classées en 4 groupes en fonction de leur capacité d’autorenouvellement, de prolifération et de leur état de différenciation: 1-les
HSC, cellules immatures ayant une capacité d’autorenouvellement importante mais une
prolifération faible, 2-les progéniteurs hématopoïétiques (HPC) ayant une capacité proliférative importante et pouvant se différencier vers plusieurs lignées différentes, 3-les
précurseurs, cellules immatures pouvant être identifiées sur leur morphologie et perdant
progressivement leurs capacités prolifératives pour donner les 4-cellules matures libérées
vision de l’hématopoïèse en organisation hiérarchique où la HSC se différencierait en HPC puis en précurseurs jusqu’aux cellules matures en une série d’étapes définies pour produire la grande quantité de cellules nécessaire par jour. Cette organisation est classiquement représentée sous la forme d’un « arbre hématopoïétique ».
1/ Caractéristiques cellulaires des cellules souches hématopoïétiques adultes
Les HSC sont des cellules peu nombreuses (chez la souris, environ 3-4 HSC pour 105 cellules
de la moelle osseuse, pour revue (35)) localisées dans la moelle osseuse, et présentant des caractéristiques particulières permettant leur maintien et leur différenciation (Figure 4). L’analyse des HSC est généralement observée dans des souris transplantées pour vérifier leur capacité d’autorenouvellement et de différenciation.
Figure 4: Les stades de différenciation des HSC.
Les HSC quiescentes (phase G0 du cycle cellulaire) peuvent être activées pour entrer dans le cycle cellulaire (phase G1/S/G2/M) et permettre l'autorenouvellement et la différenciation. (Issue de (36)).
a/ Différenciation :
La différenciation cellulaire est le processus de formation d’une cellule spécialisée à partir d’une cellule immature présentant le même matériel génétique.
Les HSC ont la capacité de se différencier vers toutes les cellules spécialisées du sang incluant les érythrocytes, les mégacaryocytes, les cellules myéloïdes (monocytes, macrophages, neutrophiles) et les lymphocytes. Les modèles de transplantation ainsi que de nouveaux modèles d’étude utilisant des souris transgéniques ont contribué à la compréhension du potentiel de différenciation des cellules souches hématopoïétiques. Les mécanismes moléculaires contrôlant la différenciation seront plus amplement détaillés par la suite.
b/ Autorenouvellement :
L’autorenouvellement, qui est la possibilité d’une cellule à se diviser en deux cellules filles dont au moins une conserve les propriétés de la cellule mère, est une caractéristique des cellules souches hématopoïétiques permettant de maintenir le pool des HSC constant. Deux types de divisions peuvent être à l'origine de l'autorenouvellement. Lors d'une division asymétrique, seulement une des 2 cellules filles conserve les caractéristiques de la cellule mère alors que la seconde se différencie. Lors d’une division symétrique, les 2 cellules filles obtenues peuvent présenter les mêmes caractéristiques que la cellule mère, conduisant ainsi à une amplification des HSC. Dans le cas d’une division symétrique où les 2 cellules filles obtenues s’engagent dans la différenciation, cela conduit à une diminution du nombre absolu de HSC.
Plusieurs cellules présentent des capacités d’autorenouvellement à plus ou moins long terme. Elles ont été classées en fonction de leur durée de reconstitution dans les souris hôtes: <6 mois (Short Term-HSC, ST-HSC), >6mois (Intermédiaire) et >12 mois (Long Term
HSC, LT-HSC) Pour revues (37,38).
Une étude a pu mettre en évidence la présence d’une population LT-HSC conservant le marqueur H2B-GFP in vivo sur une période de 22 mois. Cette population effectuerait 4 divisions symétriques pour amplifier le pool des LT-HSC avant d’entrer en phase de quiescence (39).
c/ Quiescence :
Le cycle cellulaire est caractérisé par 4 phases : l’interphase G1, la phase de synthèse S, l’interphase G2 puis la phase de mitose M. Les cellules peuvent sortir du cycle cellulaire et
entrer en phase G0 aussi appelée quiescence ou encore dormance Pour revue (36). En
utilisant l’expression du Ki67 (marqueur de prolifération) avec un intercalant de l’ADN (Dapi), il a été montré que 70% des HSC sont en phase G0 du cycle cellulaire (40).
La quiescence est une caractéristique importante des HSC, qui permet de réguler leur
nombre et de les protéger de l’acquisition de mutation Pour revue (41,42). Il a été montré
que la résistance des HSC aux agents antiprolifératifs comme le 5 Fluorouracil (5FU) est due
à cet état quiescent Pour revue (43).
Le cycle cellulaire est un mécanisme fortement régulé, de même que l’entrée ou la sortie en phase G0. Les cytokines sont des facteurs extrinsèques importants, dont certaines (SCF, TPO…) ont été impliquées dans le maintien de la phase quiescente des HSC (44). De même, plusieurs facteurs de transcription (PU.1, CEBPA) ont eux aussi été identifiés comme régulateurs de la quiescence des HSC. Le facteur de transcription PU.1, en régulant l’expression d’un certain nombre de régulateurs du cycle cellulaire (GFI1, E2F1, CDK1), influence le statut du cycle cellulaire des HSC. Effectivement, le modèle murin hypomorphe pour PU.1 présente une diminution de la quiescence des HSC. Le facteur CEBPA joue un rôle important sur le changement de statut prolifératif à quiescent observé entre le HSC fœtales
et les HSC adultes, notamment par la régulation du facteur Mycn (45), pour revue (36).
Il a été montré que les HSC quiescentes peuvent être rapidement activées en réponse à certains stimuli (inflammation, stimulation au G-CSF) puis retourner à leur état quiescent une fois l’homéostasie rétablie (40,46).
2/ Modèles de hiérarchie hématopoïétique
Les étapes d'engagement précoce des HSC vers les différentes lignées sont généralement étudiées au sein de la fraction de cellules négatives pour les marqueurs des lignées matures tel que Ter119 (marquant les érythrocytes), B220 (les lymphocytes B), CD3 (les
lymphocytes T), Gr1 et CD11b (les myéloïdes), appelée fraction "lineage-negative" (LIN-). L'utilisation de différents marqueurs de surface a permis de raffiner progressivement l'identification de populations enrichies en cellules souches, en progéniteurs ou en précurseurs. Il est apparu que le pool des HSC lui même est hétérogène sur le plan
fonctionnel et moléculaire Pour revues (47,48). L’utilisation de nouvelles technologies
comme le profil transcriptionnel à l’état unicellulaire, le profil chromatinien et le suivi de différenciation à l’état homéostatique permet maintenant de suggérer que la différenciation hématopoïétique est comparable à un continuum de progéniteurs hétérogènes ayant un potentiel de différenciation flexible pour répondre au besoin de l’organisme (39,49,50).
a/ Modèle (pré)historique :
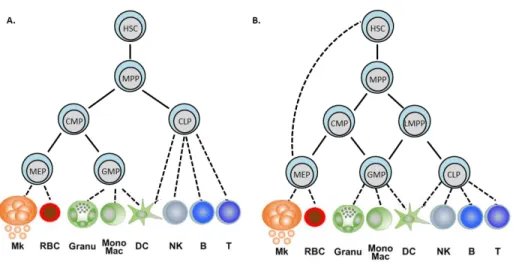
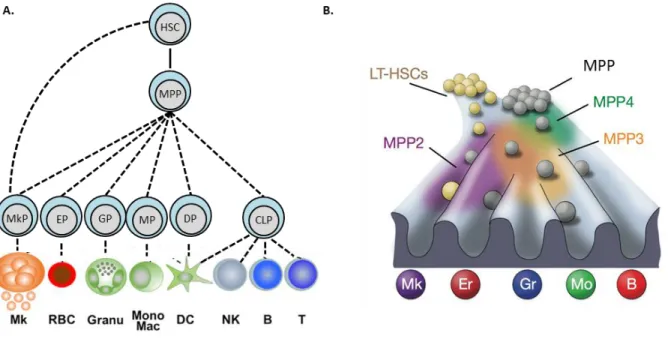
Les progéniteurs multipotents, présents dans la fraction LIN-Kit+Sca1+ (LSK) constituent 0,05% des cellules de la moelle. Ils sont enrichis en cellules souches et peuvent être divisés en 3 sous-populations : Les LT-HSC, les ST-HSC et les progéniteurs multipotents (MPP). Le système hématopoïétique est représenté comme une pyramide où les LT-HSC génèrent les ST-HSC qui à leur tour vont donner les MPP (51,52). Le premier modèle d’hématopoïèse décrit implique une première séparation entre les potentiels de différentiation lymphoïde (Lymphocytes B, T et NK) et myéloïde (monocyte, granulocyte, macrophage, érythrocyte et mégacaryocyte) avec la caractérisation des progéniteurs lymphoïdes communs (CLP)(53) et des progéniteurs myéloïdes communs (CMP)(54). Dans ce modèle, les CMP et CLP présents dans la fraction LIN-Sca1-Kit+ sont les premiers progéniteurs à présenter une capacité non-multipotente de différenciation. Par la suite, les CMP se différencient en progéniteurs granulocytaires et macrophagiques (GMP) formant les granulocytes, les monocytes et les macrophages, et en progéniteurs érythro-mégacaryocytaires (MEP) formant les érythrocytes et les progéniteurs mégacaryocytaires (MkP) conduisant aux plaquettes (Figure 5A).
Figure 5: Modèles de l’hématopoïèse.
A. Modèle hématopoïétique où la séparation des lignées myéloïdes et lymphoïdes s’effectue au niveau des progéniteurs communs CLP et CMP. (53,54).
B. Découverte du progéniteur LMPP présentant un potentiel myéloïde et lymphoïde sans capacité érythroïde-mégacaryocytaire. (55–57).
b/ Vers des modèles de continuum :
Par la suite, l'utilisation de marqueurs additionnels et d'autres tests fonctionnels ont conduit à remettre en question la proximité de certaines lignées. Par exemple, les cellules érythroïdes, mégacaryocytaires et myéloïdes ne semblent pas aussi proches les unes des autres. L’identification d’un progéniteur LMPP (55) présentant une capacité de différenciation à la fois lymphoïde et myéloïde (en CLP et GMP sans passer par le progéniteur CMP) avec une faible capacité de différenciation érythroïde et mégacaryocytaire (56)(Figure 5B) suggère une séparation précoce entre les lignées lymphoïdes/myéloïdes d'un côté et les lignées érythro/mégacaryocytaires d'un autre (57). Dans ce modèle, il a été proposé que les MEP dérivent directement des ST-HSC.
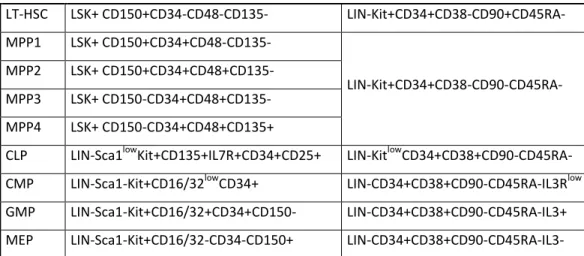
Au cours de la dernière décennie, le compartiment des LSK a été divisé en sous-populations sur la base de l’expression de marqueurs de surface : CD150, CD34, CD48 et CD135 (40) associé à une caractérisation fonctionnelle in vivo et in vitro. A ce jour, une nomenclature impliquant l'existence d'au moins 5 populations est largement utilisée pour réaliser les
analyses fonctionnelles. Ainsi, on peut identifier les HSC (LT-HSC), les MPP1 (ST-HSC), les MPP2, les MPP3 et les MPP4 (aussi appelés LMPP, (55)) (Tableau 1, (58)).
Tableau 1 : Combinaison de marqueurs de surface pour identifier les progéniteurs hématopoïétiques murins et humains.
Les HSC, MPP1-2 présentent une capacité de différenciation multipotente mais diffèrent sur leur capacité d’autorenouvellement/reconstitution à long-terme in vivo et de prolifération. Un biais de différenciation est observé pour les MPP3 vers la lignée myéloïde et pour les MPP4 vers la lignée lymphoïde.
Au cours des dernières années, les analyses fonctionnelles de "lineage-tracing" in vivo (49,59), de transplantation à l'état unicellulaire des HSC (60,61) ainsi que les caractérisations moléculaires à l’état unicellulaire (ex: transcriptome, (50,61,62)) tendent à montrer que l’engagement des HSC dans la différenciation vers une lignée se ferait de façon précoce et graduelle et serait associée à un continuum de capacités d’autorenouvellement,
de multipotence et de différenciation Pour revues (47,48).
Ainsi, la notion de bipotentialité des progéniteurs LIN-Sca1+Kit+ au sein des compartiments CMP, GMP et MEP a été remise en cause. En effet, les progéniteurs CMP semblent en fait être
Murin Humain LT-HSC LSK+ CD150+CD34-CD48-CD135- LIN-Kit+CD34+CD38-CD90+CD45RA- MPP1 LSK+ CD150+CD34+CD48-CD135- LIN-Kit+CD34+CD38-CD90-CD45RA- MPP2 LSK+ CD150+CD34+CD48+CD135- MPP3 LSK+ CD150-CD34+CD48+CD135- MPP4 LSK+ CD150-CD34+CD48+CD135+
CLP LIN-Sca1lowKit+CD135+IL7R+CD34+CD25+ LIN-KitlowCD34+CD38+CD90-CD45RA- CMP LIN-Sca1-Kit+CD16/32lowCD34+ LIN-CD34+CD38+CD90-CD45RA-IL3Rlow GMP LIN-Sca1-Kit+CD16/32+CD34+CD150- LIN-CD34+CD38+CD90-CD45RA-IL3+ MEP LIN-Sca1-Kit+CD16/32-CD34-CD150+ LIN-CD34+CD38+CD90-CD45RA-IL3-
une population hétérogène composée de progéniteurs déjà engagés vers une lignée (soit érythro-mégacaryocytaire soit myéloïde ; (50,62,63)). De même, les MEP définis dans le premier modèle présentent un programme transcriptionnel exclusivement érythroïde, suggérant qu'ils sont en très grande majorité composés des progéniteurs érythroïdes et non mégacaryocytaires (50). Ces différentes analyses ont suggéré que l’engagement vers une lignée se fait bien plus précocement qu’initialement proposé (Figure 6A).
Figure 6 : Évolution du modèle hématopoïétique.
A. La séparation entre les différentes lignées s’effectue plus précocement (50,62). Remise en cause des progéniteurs multipotents du compartiment des LIN-Sca1-Kit+ (CMP, MEP).
B. Ce modèle de différenciation hématopoïétique est basé sur le modèle de Waddington (1957). Le développement d’une cellule immature (HSC) peut être conceptuellement representé par une balle au sommet d’une montagne, qui va être déviée vers la gauche ou la droite (engagement vers une lignée) jusqu'à atteindre la vallée qui correspond aux cellules matures (D’après de (49)).
Le développement de modèles murins permettant de suivre la capacité de différenciation des HSC à l’état homéostatique a lui aussi grandement contribué à l’évolution du modèle hématopoïétique (49). Le progéniteur commun aux lignées monocytes et granuleux (GMP) a été confirmé dans ce modèle, en revanche le progéniteur commun aux érythrocytes et mégacaryocytes (MEP) n’a pas été identifié. Les progéniteurs MPP3 se différencient
principalement vers les lignées érythroïdes et myéloïdes alors que les MPP4 conservent une différenciation lympho-érythro-myéloïde. Les MPP2 semblent produire majoritairement la lignée mégacaryocytaire (63) et conserver une capacité multipotente restreinte. De plus, dans ce modèle une partie des LT-HSC se différencierait directement en progéniteur mégacaryocytaire sans passer par les différents intermédiaires du compartiment MPP (Figure 6B).
3/ Myélopoïèse :
Les cellules myéloïdes sont composées des granulocytes, monocytes, macrophages et cellules dendritiques jouant un rôle élémentaire dans l’immunité. Elles sont présentes dans la circulation sanguine, le système lymphatique, certains tissus et sont rapidement mobilisées par chimiotactisme sur un lieu endommagé ou infecté. A l’état non inflammatoire, elles participent au développement et à la réparation tissulaire. Toutes ces cellules dérivent d’un progéniteur commun (49,54). Une séparation entre les granulocytes et les autres cellules est observée avec les progéniteurs monocyte/macrophage et cellules dentritiques (MDP) et aux progéniteurs granulocytaires. Les progéniteurs MDP vont donner lieu aux progéniteurs monocytaires communs (cMoPs) et aux précurseurs communs des cellules dendritiques (CDP, (64)).
a/ Monocyte et macrophage :
La monopoïèse, régulée principalement par le facteur de transcription PU.1, et les cytokines M-CSF et IL34, permet la formation des monocytes. Une forte expression de PU.1 va activer les gènes spécifiques comme IRF8, KLF4, CD115 (récepteur au M-CSF) et inhiber les facteurs de transcription spécifiques d’autres lignées comme GATA1, GATA2 ou encore CEBPA. Les monocytes localisés dans la circulation sanguine jouent un rôle essentiel dans l’inflammation ainsi que la régulation du nombre de certains pathogènes. Ils peuvent infiltrer les tissus en traversant l’endothélium vasculaire et se différencier en macrophages. Monocytes et macrophages sont de grosses cellules arrondies présentant un noyau excentré
et des vacuoles dans le cytoplasme. Leur rôle est de phagocyter les débris cellulaires ainsi que les agents pathogènes. Ces cellules expriment les marqueurs Gr1+ F4/80+ (64).
La durée de vie d’un macrophage peut aller de plusieurs mois à plusieurs années.
b/ Les cellules dendritiques :
Les cellules dendritiques (DC) sont des cellules présentatrices d’antigènes permettant la mise en place de l’immunité adaptative. Elles sont présentes dans les différents tissus lymphoïdes tels la rate, les ganglions lymphatiques et la moelle osseuse.
La différenciation vers la lignée dendritique est dépendante des facteurs de transcription
PU.1, GFI1 et CBFB.
Les cellules dendritiques ont une durée de vie allant de 3 à 6 jours.
c/ Granulocytes :
Les granulocytes sont les cellules myéloïdes les plus représentées du système sanguin et sont composées des neutrophiles, basophiles et éosinophiles. Elles dérivent du progéniteur granulocyte/monocytaire commun (GMP) et expriment les marqueurs CD11b+ et Gr1+. La granulopoïèse est dépendante des facteurs de transcription PU.1, CEBPA, GATA2 et des cytokines GM-CSF et G-CSF.
Les neutrophiles, formés dans la moelle osseuse, sont attirés par les macrophages sur un lieu endommagé ou infecté pour aider à l’élimination du pathogène par phagocytose.
Les éosinophiles sont principalement localisés dans les tissus et participent à l’homéostasie tissulaire et immunitaire.
Les basophiles circulent dans le sang et jouent un rôle important dans la réponse inflammatoire et les réactions allergiques.
4/ Mégacaryopoïèse :
a/ Généralités :
La mégacaryopoïèse est le processus de synthèse des mégacaryocytes (Mk) à partir de la cellule souche hématopoïétique et qui se finit par la plaquettogenèse conduisant à la libération des plaquettes sanguines dans le sang circulant.
Les plaquettes sanguines sont de petites cellules (2 à 5 microns) anucléées présentes dans la circulation sanguine et qui proviennent de la fragmentation du cytoplasme des mégacaryocytes, cellules rares et polyploïdes présentes dans la moelle osseuse. Les plaquettes ont une durée de vie très courte (7 à 9 jours) et sont renouvelées chaque jour (10.000 nouvelles plaquettes par jour chez l’Homme) pour maintenir leur nombre constant. La diminution de leur nombre est appelée thrombopénie et engendre un risque élevé d’hémorragie tandis qu’une augmentation est appelée thrombocytose, pouvant provoquer des risques de thrombose (obstruction des vaisseaux sanguins). Elles jouent un rôle primordial dans divers processus biologiques comme l’homéostasie, la cicatrisation, l’angiogenèse, l’inflammation et l’immunité innée.
Lors d’un endommagement des vaisseaux sanguins, des cellules endothéliales induisent l'expression du facteur Von Willebrand qui est reconnu par les plaquettes via un complexe de glycoprotéines composé des molécules CD41, CD61 et CD42 présentes à leur surface. Cela permet ainsi la formation d'un agrégat plaquettaire qui participe à la réparation vasculaire indispensable pour l’homéostasie du système vasculaire.
Il a été démontré qu’en cas de thrombopénie, l’état inflammatoire peut engendrer des hémorragies et des chocs septiques augmentant le risque de mortalité (65,66).
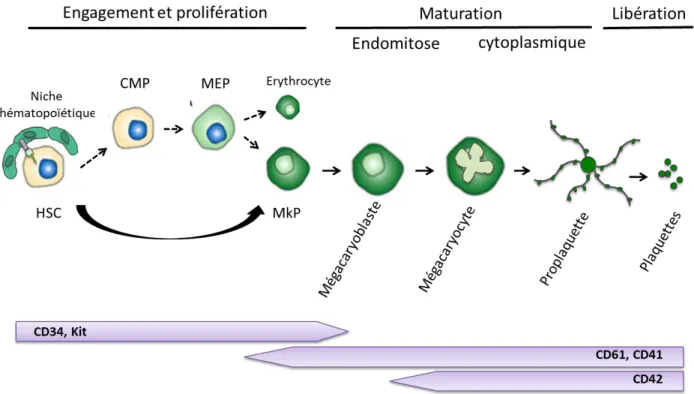
Il est donc primordial de maintenir un niveau constant de plaquettes à l’état homéostatique et de pouvoir rapidement restaurer l’homéostasie plaquettaire en cas de thrombopénie. La mégacaryopoïèse peut être schématiquement décrite en trois grandes étapes (Figure 7) : 1-engagement et prolifération des progéniteurs mégacaryocytaires
3-formation et libération des plaquettes dans la circulation sanguine.
Figure 7 : La mégacaryopoïèse
La mégacaryopoïèse est composée de 3 étapes : L’engagement d’une cellule souche hématopoiètique vers les progéniteurs mégacaryocytaires (MkP), la maturation (nucléaire et cytoplasmique) jusqu’à la libération des plaquettes dans la circulation sanguine.
b/ Origine des progéniteurs mégacaryocytaires
Notre compréhension de l'origine des progéniteurs mégacaryocytaires a fortement évolué depuis une 20aine d'années et reste l'objet d'intenses discussions. Dans le modèle historique impliquant des étapes discrètes d'engagement des HSC dans la différenciation, les progéniteurs mégacaryocytaires (MkP) dérivent des MEP qui eux-mêmes proviennent des CMP (54). Quelques années après, une étude a suggéré que les MEP dérivent directement des ST-HSC (56).
Par la suite, de nombreux facteurs communs au développement des HSC et des Mk ont été mis en évidence et incluent des récepteurs membranaires (ex : MPL, CD150, CD41), des voies de signalisation (ex : MPL, Notch) et des facteurs de transcriptions (ex : RUNX1, TAL1,
GATA2, GATA1) (56,57,67,68). Ces similarités moléculaires et phénotypiques ont conduit à l’hypothèse d’un lien directe entre les HSC et la lignée mégacaryocytaire.
L’équipe de Sanjuan-Pla a observé qu’une partie des LT-HSC (60%) expriment le marqueur Facteur Von Willebrand (vWF), une protéine impliquée dans l’agrégation des plaquettes et présente sur les mégacaryocytes (69). Ces LT-HSC vWF positives présentent une capacité de différenciation mégacaryocytaire, une capacité d’autorenouvellement à très long terme ainsi que la capacité de former toutes les lignées cellulaires contrairement aux HSC vWF négatives qui montrent un engagement préférentiel vers la lignée lymphoïde. La grande majorité des LT-HSC du foie fœtal au stade E14,5 (LSK+CD48-CD150+) expriment aussi le marqueur vWF. Il a été proposé que ces LT-HSC biaisées-Mk sont au sommet de la hiérarchie hématopoïétique (69). En effet l’analyse de l’hématopoïèse à l’état homéostatique a aussi confirmé qu’une partie des LT-HSC se différencient directement en progéniteur mégacaryocytaire et que ces HSC « engagées » conservent une capacité multipotente lors de transplantation dans des souris hôtes (49).
Une autre étude a montré qu’en cas de stress induit par des infections, certaines HSC présentant un biais de différentiation vers la lignée mégacaryocytaire vont très rapidement former des plaquettes sans passer par les différents intermédiaires MPP, CMP, MEP pour conserver leur nombre constant. Cette voie permet une production rapide et importante de plaquettes. Les SL-MkP contribuent faiblement à la mégacaryopoïèse à l’état homéostatique et semblent utilisés principalement en cas de besoin urgent (70).
Ainsi, la mégacaryopoïèse pourrait être une voie de différenciation native des HSC (49) qui pourrait avoir une origine dans le rôle essentiel de la mégacaryopoïèse au cours du développement embryonnaire précoce.
c/ Maturation des mégacaryocytes
Les progéniteurs mégacaryocytaires (MkP) expriment des marqueurs immatures LIN-, Kit+,
CD34low, CD150+ et des marqueurs plus spécifiques de la lignée Mk comme le CD41 et le
CD61. Ces progéniteurs sont des cellules diploïdes (2n) qui prolifèrent dans la moelle osseuse pour se renouveler de la même façon que les autres cellules hématopoïétiques. Les
MkP maturent en mégacaryoblastes qui vont devenir polyploïdes avec un contenu en ADN pouvant aller de 4n à 128n (ploïdie modale: 16n chez l’Homme et la souris) sous la forme d'un noyau polylobé.
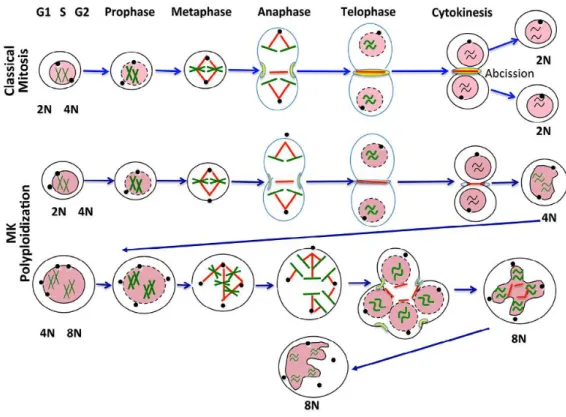
La polyploïdie des Mk résulte de cycles d’endomitose associés à un défaut de karyokinèse (pas de séparation des noyaux) et un défaut de cytokinèse (pas de séparation des 2 cellules filles) (Figure 8).
Figure 8 : Processus d’endomitose lors de la mégacaryopoïèse.
Le progéniteur mégacaryocytaire entre en mitose, il y a duplication du matériel génétique (passant de 2n à 4n), séparation des chromosomes aux 2 pôles de la cellule mais un défaut de karyokinèse (pas de séparation des noyaux) et un défaut de cytokinèse (pas de séparation des 2 cellules filles) entraînent la formation d’une cellule dont le matériel génétique est de 4n et dont le noyau forme 2 lobes. Cette étape de mitose incomplète peut se répéter jusqu'à former une cellule dont le matériel génétique atteint 128n. (Issue de (71))
Ainsi, dans les progéniteurs MkP qui entrent en endomitose, les chromosomes ségrégent aux 2 pôles de la cellule mais la formation de la membrane nucléaire est incomplète (observation de pont nucléoplasmique) ce qui engendre un noyau polylobé. La cytokinèse est également incomplète aboutissant à la formation d’une cellule où le matériel génétique a
doublé. La survenue de plusieurs cycles consécutifs de ce type génère des cellules
polyploïdes de grande taille pouvant aller jusqu'à 100uM (72,73), pour revue (71).
Au cours de cette maturation des récepteurs spécifiques de la lignée mégacaryocytaire sont exprimés à la surface des cellules comme la glycoprotéine CD42 (74), associée à une perte des marqueurs immatures comme le CD34 et Kit.
Le processus d’endomitose est accompagné d’une maturation cytoplasmique où le cytoplasme des cellules est déformé en de longues extensions appelées proplaquettes. Un mégacaryoblaste peut former entre 10 et 20 proplaquettes qui vont se fragmenter pour libérer les plaquettes dans la circulation sanguine en nombre suffisant pour le renouvellement homéostatique (Figure 9). La mégacaryopoïèse est un processus pouvant durer de 8 à 10 jours.
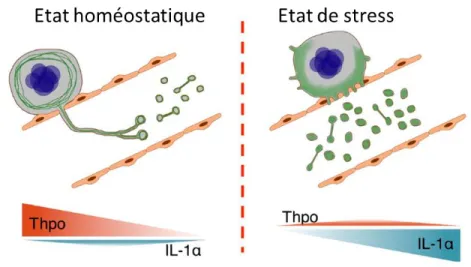
Figure 9 : Processus de mégacaryopoïèse.
La mégacaryopoïèse « classique » est caractérisée par la formation de proplaquettes et est dépendante de la thrombopoiétine (TPO). Ce mécanisme est mis en place à l’état homéostatique pour une production de plaquettes constante. La mégacaryopoïèse par rupture de la membrane est dépendant de l’IL-1a et est mis en place en période de stress. Ce dernier mécanisme produirait beaucoup plus de plaquettes pour répondre à une demande accrue. (Issue de (75)).
La thrombopoiétine (TPO) est une cytokine majeure de la mégacaryopoïèse, qui sera présentée plus en détail par la suite. La mégacaryopoïèse est aussi dépendante de facteurs de transcription, dont GATA1, impliqué dans la différentiation mégacaryocytaire et NFE2,
En cas de thrombopénie, un autre mécanisme est mis en place pour répondre au besoin rapide de plaquettes.
Ce mécanisme qui semble indépendant de la TPO et de la formation des proplaquettes, permet de produire un grand nombre de plaquettes fonctionnelles en peu de temps. Ce mécanisme régulé par l’interleukine 1a (IL1a) permet de modifier la stabilité membranaire du mégacaryoblaste et conduit à la formation de plaquettes, en nombre 20 fois supérieur par rapport au mécanisme classique (Figure 8), (75).
Un équilibre entre TPO et IL1a semble donc contrôler la mégacaryopoïèse et permettre une production en fonction d'un besoin de plaquettes à l'homéostasie ou en condition de stress.
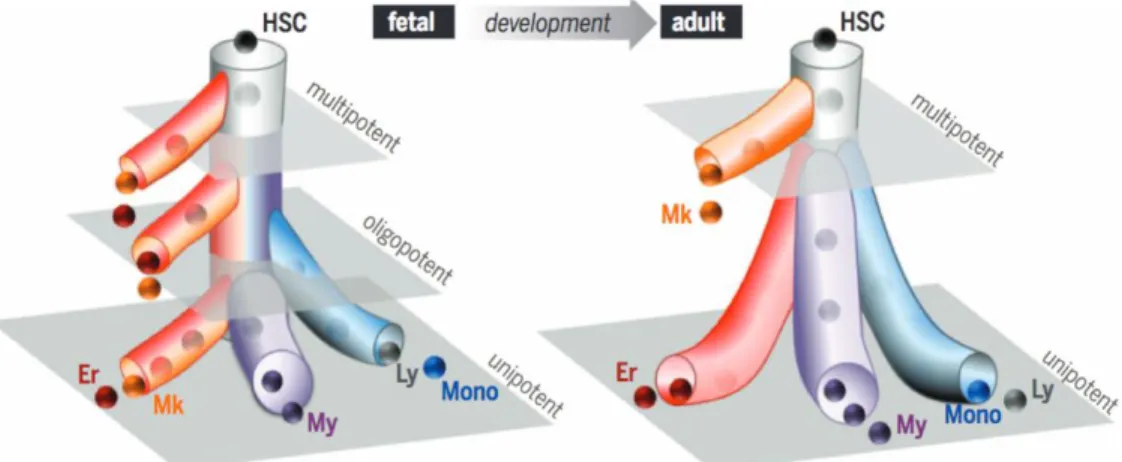
d/ Différence fœtal et adulte
Les Mk sont détectés très tôt au cours du développement, au stade E7,5 chez la souris, et les plaquettes sont observées dans la circulation sanguine vers E10,5. La mégacaryopoïèse diffère au cours de l’ontogenèse. Dans le foie fœtal, le potentiel mégacaryocytaire est observé à partir du compartiment des cellules souches et du compartiment des progéniteurs alors que chez l’adulte il dérive principalement du compartiment souche (Figure 10, (77)).
De plus certaines caractéristiques cellulaires et moléculaires diffèrent. Les Mk fœtaux sont de petite taille et ont une ploïdie moyenne moins élevée que la ploïdie des Mk adultes. Leur taille et ploïdie vont augmenter au cours des différents stades du développement pour atteindre les caractéristiques des Mk adultes vers l’âge de 4 ans chez l’Homme. La capacité proliférative des Mk fœtaux est largement supérieure aux Mk adultes, mais ils forment 3 fois moins de proplaquettes et donc de plaquettes (78). Ces caractéristiques peuvent être corrélées aux changements transcriptionnels observés au cours de l’ontogenèse mégacaryocytaire sur le cycle cellulaire, l’expression de facteurs de transcription (NFE2,
GATA1) et de régulateurs mégacaryocytaires spécifiques (influençant la maturation
mégacaryocytaire) (79).
C/ Régulation de l’hématopoïèse :
Le nombre des cellules souches hématopoïétiques résulte d'un équilibre entre quiescence, autorenouvellement et différentiation. L'équilibre entre ces propriétés varie en fonction du stade de développement et du besoin en cellules matures et est contrôlé par des facteurs extrinsèques (également appelés « niche hématopoïétique ») et intrinsèques.
1/ La niche hématopoïétique :
La niche hématopoïétique est composée de différentes cellules assurant des fonctions
régulatrices distinctes Pour revue (80).
Les avancées technologiques d’imagerie cellulaire ont permis de visualiser les HSC et leurs cellules avoisinantes dans la moelle osseuse. L’implication des cellules dans la régulation des HSC a ensuite été validée à l’aide de modèles d’inactivation conditionnelle permettant de cibler spécifiquement certaines populations entourant les HSC.
Les cellules périvasculaires ou péricytes, sont des cellules encerclant les vaisseaux sanguins.
LepR. Un groupe de péricytes exprimant fortement la cytokine CXCL12, appelées cellules CAR (CXCL12-abundant reticular) est fréquemment retrouvé près des cellules souches (81).
Les cellules de Schwann (82), les nerfs sympathiques, les ostéoclastes, les cellules endothéliales,
les macrophages, les neutrophiles, les lymphocytes T CD4+ et les mégacaryocytes font partie des cellules fréquemment retrouvées près des HSC et ont été associées à leur régulation
(83), pour revue (80).
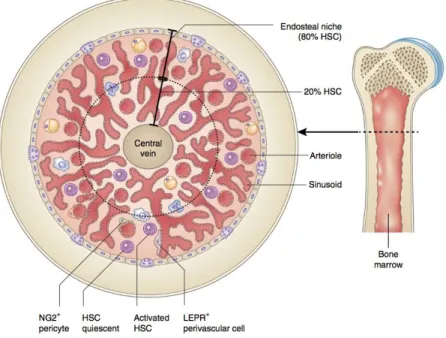
Différentes niches ont été observées dans la moelle osseuse adulte : la niche artériolaire où les HSC sont situées à proximité des artérioles et la niche sinusoïde, dont la composition cellulaire varie. La niche artériolaire présente des péricytes NG2+, des cellules de Schwann (82,84) ainsi que des nerfs sympathiques. La niche sinusoïde est composée de péricytes
LepR+ et de cellules CAR (Figure 11) Pour revues (80,85).
Figure 11 : Organisation spatiale des cellules dans la moelle osseuse.
Les cellules souches hématopoïétiques sont localisées dans la moelle osseuse dans différentes niches : la niche artériolaire composée des péricytes NG2+ et la niche sinusoïdale avec les péricytes LepR+ (Issue de (85)).
Ces deux niches joueraient un rôle différent sur la régulation des HSC. La niche artériolaire serait associée à la maintenance des HSC, en régulant notamment leur statut cellulaire (quiescentes) et leur mobilisation. En effet, la déplétion des péricytes NG2+ induit l’entrée en cycle des HSC ainsi que leur mobilisation réduisant ainsi leur capacité de repopulation à long terme (86).
Plus récemment, il a été montré que ces différentes niches étaient associées à différents sous-types de HSC. La niche sinusoïdale, composée aussi de mégacaryocytes, serait la niche préférentielle des cellules souches vWF+ (HSC qui présentent un biais vers la lignée mégacaryocytaire et myéloïde et pouvant redonner toutes les cellules (69) alors que la niche artériolaire régulerait les HSC vWF- (HSC associée aux lignées lymphoïdes)(87). Les cellules de la niche hématopoïétique vont sécréter des facteurs solubles ou interagir physiquement avec les cellules souches hématopoïétiques pour moduler l’expression des gènes et influencer leur devenir.
2/ Communication entre HSC et cellules de la niche : les voies de signalisation
De nombreuses voies de signalisation médient l'interaction des cellules hématopoïétiques avec leur environnement. Les voies de signalisation sont fréquemment activées par l’interaction entre deux protéines qui peuvent être un récepteur et son ligand. Ces ligands peuvent être des molécules transmembranaires, impliquant que l'activation de la voie de signalisation nécessite un contact entre 2 cellules comme pour la voie de signalisation Notch. D'autres sont des molécules solubles comme les cytokines. Les voies de signalisation impliquent généralement une succession d’intermédiaires et conduisent fréquemment à la modulation de l’expression des gènes.
a/ Contact cellule-cellule, exemple de la voie Notch :
La signalisation de la voie Notch nécessite l’interaction entre 2 cellules via un récepteur et son ligand, tous deux transmembranaires. Chez les mammifères il existe 4 récepteurs Notch, NOTCH1 à NOTCH4 et 5 ligands, Jagged1, Jagged2, Delta-like1, Delta-like2, Delta-like4. La partie extracellulaire du récepteur interagit avec son ligand, ce qui va entraîner une succession de modifications et de clivages de la partie intracellulaire de NOTCH permettant la libération du fragment NICD (Notch Intra Cellular Domain). Ce fragment va être transporté dans le noyau et interagir avec un complexe protéique incluant RBPJ et MAML1 pour moduler l’expression de ces gènes cibles (HES1, GATA2…). En absence d’activation de NOTCH, RBPJ interagit avec des co-represseurs comme SMRT, SHARP ou OTT1 pour inhiber leur expression.
La voie Notch a été impliquée dans l’établissement et le maintien des HSC au cours de l’ontogenèse hématopoïétique. Le ligand Jagged1, exprimé par les cellules endothéliales de la moelle osseuse, participe à l’autorenouvellement des HSC adultes à l’état homéostatique
mais aussi à leur capacité régénérative (88), pour revue (89).
La génération des HSC au cours de l’embryogenèse (au stade E10,5 chez la souris) ainsi que leur capacité multipotent est dépendante de la voie de signalisation Notch (90,91).
La voie Notch est aussi impliquée dans l’engagement hématopoïétique vers la lignée
lymphocytaire T Pour revue (92) et mégacaryocytaire (93).
b/ Facteur soluble et récepteur, exemple de la TPO :
Les cytokines sont des protéines produites par différentes cellules, pouvant agir sur plusieurs cellules cibles dont la cellule sécrétrice (action autocrine), localement (action paracrine) ou à distance (effet endocrine). Les cytokines peuvent avoir un effet redondant (exercer la même action biologique), agir en synergie ou encore avoir des effets antagonistes. Elles permettent la communication intercellulaire, sans contact entre les cellules via la fixation à un récepteur.
Des études récentes ont montré qu’une grande variété de cytokines pouvait agir sur les HSC tel SCF, TPO, CXCL12, CXCL4, TGFB, G-CSF…
La TPO est une cytokine largement impliquée dans la mégacaryopoïèse (engagement et prolifération des progéniteurs mégacaryocytaires et influençant leur ploïdie) mais aussi dans le maintien des HSC dans la moelle osseuse (94,95). Elle est synthétisée principalement par le foie et se fixe sur son récepteur MPL présent sur les HSC, les mégacaryocytes et les plaquettes. Le récepteur MPL ne possède pas d’activité kinase intrinsèque mais s'associe avec des tyrosines kinases dont la protéine JAK2. La TPO en se fixant à son récepteur MPL, entraîne sa dimérisation, un changement de conformation et le rapprochement des protéines JAK qui vont s’activer par transphosphorylation et phosphoryler les résidus tyrosines du récepteur. Cela conduit ensuite à l'induction de plusieurs voies de signalisation incluant: JAK/STAT, PI3K/AKT et ERK/MAPK (Figure 12).
Figure 12 : Voie de signalisation de la TPO.
La TPO en se fixant à son récepteur MPL entraîne sa dimérisation, un changement de conformation, le rapprochement des protéines JAK qui vont s’activer par transphosphorylation et phosphoryler les résidus tyrosines du récepteur. Plusieurs voies vont être activées : la voie JAK/STAT, PI3K/AKT et ERK/MAPK. (D’après (96)).
Exemple d’activation : la voie JAK/STAT. Il existe 4 membres de la famille JAK : JAK1 à 3 et TYK2. Ces tyrosines kinases sont associées à la partie cytoplasmique des récepteurs
membranaires sans activité kinase. Les protéines de la famille STAT (STAT1 à 6 dont STAT5a et STA5b) vont s’associer au récepteur phosphorylé et être phosphorylées par les protéines JAK. Leur phosphorylation entraîne leur dimérisation puis leur migration dans le noyau pour réguler l’expression de leurs gènes cibles (97).
La TPO induit l’activation de STAT3, STAT5a et STAT5b (98,99). STAT3 jouerait un rôle dans l’expansion des progéniteurs mégacaryoblastiques (96), tandis que STAT5a et b joueraient un rôle dans la formation des plaquettes, puisque les souris STAT5(a et b)-/- présentent une thrombopénie (100).
c/ Exemple de la voie Sonic Hedgehog
Une autre voie activée par des molécules secrétées est la voie Sonic Hedgehog qui joue un rôle au cours de l’embryogenèse en participant à la mise en place de différents tissus (tube neural, poumons, peau…). Cette voie a aussi été impliquée dans la régulation des cellules hématopoïétiques primitives via les protéines BMP dont BMP4 (101).
Il existe 3 ligands chez les vertébrés : Desert Hedgehog (DHH), Indian Hedgehog (IHH) et Sonic Hedgehog (SHH), et deux récepteurs : PTCH1 et SMOH.
En absence de ligand, PTCH1 réprime l’activité de SMOH. Lorsque que SHH se lie à PTCH1, cela induit l’internalisation du récepteur, la levée de la répression de SMOH et l’activation des facteurs de transcription de la famille GLI. Les facteurs GLI migrent alors dans le noyau pour réguler l’activité des gènes cibles de la voie (gènes HOX, BMP, BCL2, PDGFRA…).
In fine, cette voie participe à la prolifération et à la différenciation cellulaire. Elle est principalement active au cours du développement embryonnaire et réprimée dans les cellules adultes en dehors des progéniteurs immatures. Il a été montré que cette voie
participe au développement leucémique via une activation anormale Pour revue (102).
3/ Régulation transcriptionnelle :
La régulation transcriptionnelle de l’hématopoïèse implique plusieurs niveaux, incluant le niveau d'expression des facteurs de transcription, la régulation de leur activité par des
mécanismes post-traductionnels, mais également leur accessibilité à l'ADN contrôlée par l’organisation épigénétique de la chromatine.
a/ Facteur de transcription et complexe transcriptionnel
La découverte de l’activité ARN polymérase remonte aux débuts des années 1960, avec la première synthèse in vitro d’un brin d’ARN complémentaire à la matrice ADN, ce qui a initié la recherche de la régulation transcriptionnelle. La transcription des ARN messagers par l’ARN polymérase PolII nécessite qu'elle soit guidée sur le locus à transcrire par des facteurs de transcription liant spécifiquement l'ADN et nécessite également le recrutement
de facteurs généraux de la transcription Pour revue (103).
Les facteurs de transcription se fixent à des régions de l'ADN appelées promoteurs ou
"enhancers" Pour revue (104).
Les promoteurs sont les régions sur lesquelles la machinerie transcriptionnelle se fixe pour initier la transcription du gène. Elles sont généralement situées juste en amont du gène et permettent de définir le site d'initiation de la transcription ou Transcription Start Site (TSS). Les enhancers sont des régions régulatrices de la transcription qui influencent l’activité transcriptionnelle des promoteurs (Figure 13). Les enhancers peuvent être localisés à plusieurs dizaines (voir centaines) de kilobases des gènes/promoteurs ciblés (cette localisation varie en fonction du type cellulaire) et plusieurs enhancers peuvent réguler l'expression d'un seul gène. Les enhancers présentent généralement des sites de liaison de nombreux facteurs de transcription.
La différenciation des progéniteurs hématopoïétiques vers les différentes lignées est associée à l’activation de programmes transcriptionnels régulés par des facteurs ou combinaisons de facteurs de transcription spécifiques d’une lignée incluant, par exemple,
Figure 13 : Activation de la transcription par les facteurs de transcriptions.
Les facteurs de transcription, en se fixant sur leur site de liaison (promoteur, enhancer), vont recruter la machinerie transcriptionnelle et moduler l’expression des gènes. (Issue de (105))
Le facteur de transcription GATA1 appartient à une famille de 6 membres (incluant GATA2 et GATA3 également exprimé dans le système hématopoïétique) qui possèdent un domaine de liaison à l’ADN sur des séquences consensus de type (A/TGATAA/G) et un domaine de transactivation permettant la transcription de ces gènes cibles. GATA1 est essentiel pour la différenciation érythroïde, mégacaryocytaire et des éosinophiles. Pour la lignée mégacaryocytaire, il a été montré qu’une absence de GATA1 était associée à une prolifération des progéniteurs mégacaryocytaires dont la ploïdie est diminuée et présentant un défaut de formation des proplaquettes. Au niveau transcriptionnel, les gènes clés spécifiques de la lignée mégacaryocytaire comme NFE2, GP1bA (CD42b) et PF4 sont
fortement diminués en absence de GATA1 Pour revue (106).
Le facteur PU.1 (fréquemment appelé SPI1) est un facteur déterminant pour le développement de différentes lignées myéloïdes et lymphoïdes. Son niveau d’expression influence l’engagement vers une lignée par rapport à l’autre où une expression importante, intermédiaire ou faible est associée aux macrophages, lymphocytes B ou les cellules
érythroïdes et mégacaryocytaires respectivement Pour revue (107). De même, il a été
enhancer'
enhancer'