31
MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ 1969 – 1974 : Professeur Abdellatif BERBICH 1974 – 1981 : Professeur Bachir LAZRAK 1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI 1997 – 2003 : Professeur Abdelmajid BELMAHI 2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération
Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
DECEMBRE 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif Pathologie Chirurgicale
NOVEMBRE ET DECEMBRE 1985
Pr. BENSAID Younes Pathologie Chirurgicale
JANVIER, FEVRIER ET DECEMBRE 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
DECEMBRE 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
JANVIER ET NOVEMBRE 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
FEVRIER AVRIL JUILLET ET DECEMBRE 1991 Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des
Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir. du CEDOC +
DECEMBRE 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
MARS 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie
Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
MARS 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
MARS 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
DECEMBRE 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie
Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat
NOVEMBRE 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
NOVEMBRE 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
JANVIER 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne
NOVEMBRE 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
DECEMBRE 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie
Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d’EnfantsRabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
DECEMBRE 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique
Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie
Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
JANVIER 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie
Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique
Pr. EL KHORASSANI Mohamed Pédiatrie Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie
Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire
Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
JANVIER 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina * Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire. Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
DECEMBRE 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
OCTOBRE 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Directeur ERSSM Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHERKAOUI Naoual * Pharmacie galénique Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
DECEMBRE 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
MARS 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale
Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique
Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie
OCTOBRE 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie- Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
DECEMBRE 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
MAI 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUELALAA Khalil * Anesthésie Réanimation Pr. BENCHEBBA Driss * Traumatologie-orthopédie
Pr. DRISSI Mohamed * Anesthésie Réanimation
Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires FEVRIER 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie
Pr.AMOR Mourad Anesthésie Réanimation
Pr.AWAB Almahdi Anesthésie Réanimation
Pr.BELAYACHI Jihane Réanimation Médicale
Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique
Pr.BENSGHIR Mustapha * Anesthésie Réanimation
Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr.CHAIB Ali * Cardiologie
Pr.DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr.ECH-CHERIF EL KETTANI Najwa Radiologie
Pr.EL FATEMI NIZARE Neuro-chirurgie
Pr.EL GUERROUJ Hasnae Médecine Nucléaire
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation
Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique
Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique
Pr.ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale
MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Gynécologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Gynécologie-Obstétrique
AVRIL 2014
PROFESSEURS AGREGES :
DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
A mon très cher Père
Abderrahmane JERROUNDI
Celui qui a toujours été mon model dans cette vie, qui a toujours été là pour me
pousser à être la meilleure de ce que je suis.
Celui qui m’a appris que le savoir est la plus précieuse valeur à suivre.
Je te serai cher père reconnaissante toute ma vie, pour tout le mal que tu t’es
donné pour moi à chaque étape de ma vie, pour ta patience, ton amour et tes
sacrifices.
Rien au monde ne saurait exprimer toute ma gratitude et le respect que je porte
pour toi.
Ce titre de Docteur en Pharmacie, je te le dédie tout particulièrement.
Je t’aime papa.
A ma très chère Mère
Malika NAITI
Aucune dédicace au monde aussi éloquent soit-elle ne saura rendre toutes les
sacrifices qu’elle a consentis pour moi depuis ma naissance à ce jour.
Je t’aime Maman, tu es mon ange gardien à travers tes bénédictions et je te dois
A mon très cher frère
Mohammed JERROUNDI
Aucun mot ne saurait exprimer l’amour, le respect et la gratitude que j’ai pour toi.
À travers ces années, tu étais le bouclier qui me protège à chaque fois du mal, la
première personne qui me vient à l’esprit à l’heure du besoin, sans toi je ne serai jamais
arrivé où je suis maintenant.
Je te souhaite tout le bonheur et la réussite au monde, parce que tu mérites d’être
heureux
A ma très chère sœur
Rajae JERROUNDI
Ils disent qu’une sœur est une deuxième maman, pour moi c’est exactement le cas.
Même de loin, tu ne m’as jamais privé de ton amour ni ton affection, t’essayais
toujours de me rendre heureuse par tous les moyens.
Tu m’as toujours gardé proche et tu étais ma confidente à travers ces années.
Je souhaite de tout mon cœur que tu réaliseras tes rêves un jour, que je te verrai
épanouie et fière de toi-même, car sœur tu es magnifique et tu mérites le bonheur.
Ce succès est le nôtre.
Je t’adore ma chérie.
A ma très chère belle-sœur
Houda SALHI
Je te remercie pour ton soutien continu.
Je suis chanceuse de t’avoir à mes côtés.
Puisses-tu trouver dans son travail le témoin de mon amour et de mon affection.
A mes chers amis
Je ne peux trouver les mots justes et sincères pour vous exprimer mon affection et
mes pensées, vous êtes pour moi des frères et sœurs et des amis sur qui je peux
compter.
En témoignage de l’amitié qui nous uni et des souvenirs de tous les moments que
nous avons passé ensemble, je vous dédie ce travail et je vous souhaite une vie
Aux familles
JERROUNDI
NAITI
Veuillez trouver dans ce travail l’expression de mon respect
Le plus profond et mon affection la plus sincère.
A notre maître et président de thèse
Monsieur Rachid EL JAOUDI
Professeur de Toxicologie
Vous avez aimablement accepté de présider le jury de cette thèse, nous en sommes
touchés.
Nous vous exprimons notre grande admiration pour vos hautes qualités morales,
humaines et professionnelles.
Avec tout le respect que nous vous devons, veuillez trouver ici, l’expression de
notre profond respect et nos vifs remerciements.
A notre maître et rapporteur de thèse
Monsieur Azzedine IBRAHIMI
Professeur de Biologie Moléculaire
Je ne saurais exprimer ma reconnaissance pour votre implication personnelle dans
ce travail. Tous mes remerciements à vous pour votre confiance en moi en
m’octroyant ce sujet de thèse, pour votre constante disponibilité.
Malgré vos obligations professionnelles et familiales vous m’avez toujours
réservé un accueil chaleureux. C’est avec une joie
et un plaisir immense que j’exprime ma gratitude pour
tous vos efforts déployés pour la réalisation de ce travail. Merci
A notre maître et juge de thèse
Madame Mouna OUADGHIRI
Professeur de microbiologie et biologie moléculaire
Nous sommes sensibles à l’honneur que vous nous faites en acceptant de
participer au jury de notre thèse et très touchés par la gentillesse avec laquelle
vous nous avez toujours accueillis.
Puisse ce travail être pour nous, l’occasion de vous exprimer notre profond
respect et notre gratitude la plus sincère.
A notre maître et juge de thèse
Madame Laila HESSISEN
Professeur de Pédiatrie
Vous nous faites l’honneur d’accepter avec une très grande amabilité de siéger
parmi notre jury de thèse.
Veuillez accepter ce travail maître, en gage de notre grand respect et notre
profonde reconnaissance.
Liste
ABREVIATIONS :
ADN db : ADN double brin
AEG : Altération de l’Etat Général
ASCT : Greffe Autologue de Cellules Souches
CAR : Récepteurs Antigéniques Chimériques
CD 9 : Classe de Différenciation 19
Cmax : Concentration Maximale
CMH : Complexe Majeur d’Histocompatibilité
CPA : Cellules Présentatrices d’Antigènes
CR : Complete Response Reported
CRS : Syndrome de Relargage Cytokinique
EFS : Survie Sans Evènement
EMA : L'Agence Européenne des Médicaments
FDA : Food and Drug administration
HSCT/ GCSH : Greffe de Cellules Souches Hématopoïétiques
IHC : Immunohistochimie
LAB : Leucémie Aigue Biphénotypique
LAL r/r : Leucémie Aigüe Lymphoblastique récurrente ou réfractaire
LAL : Leucémie Aigue Lymphoblastique
LB : Lymphocyte B
Lh : Lymphocyte Helper
LT : lymphocyte T
NFS : Numération de Formule Sanguine
OMS : Organisation Mondiale de la santé
PK : Pharmacocinétique
RC : Rémission Complète
scFv : Single Chain Fragment Variable
SG : Survie Globale
TCR : Récepteur des Lymphocytes T
Liste
Liste de figures
Figure 1 : Chronologie montrant le développement de l'approche de la thérapie génique ...5 Figure 2 : Les indications traitées par les essais cliniques de thérapie génique ...6 Figure 3: Nombre d'essais cliniques de thérapie génique approuvés dans le monde entier entre 1989 et 2017 ...7 Figure 4:Stratégies de découverte de ligands-médicaments. Approche structurale et approche par criblage ... 11 Figure 5: Organisation génomique d'un vecteur dérivé à partir d'un virus adéno-associé (AAV). Le génome parental se compose principalement de réplicase codant pour le rep, le cap et les protéines structurelles. L’expression des protéines AAV est pilotée par les promoteurs p5, p19 et 40 et toutes les transcriptions partagent le même poly (A) ... 17 Figure 6 : Thérapie génique in-vivo et ex-vivo ... 19 Figure 7: Structure du récepteur de l'antigène chimérique (CAR) ... 32 Figure 8: Le processus de la thérapie par les cellules CAR-T ... 34 Figure 9: Les différentes générations des cellules CAR-T ... 36 Figure 10: Les principales sociétés développant des cellules CAR-T. ... 47 Figure 11: Schéma de l’hématopoïèse physiologiquement normale ... 51 Figure 12: Rôle des anomalies génétiques dans la leucémogénèse des LAL B (Mullighan CG. Hematology 2012) ... 53 Figure 13: Classification des leucémies aiguës lymphoblastiques selon l'OMS[61]. ... 55 Figure 14: L'index de pronostic international de la DLBCL [ ... 75 Figure 15: Schéma montrant les lignes de traitement du DLBCL ... 82 Figure 16: Les obstacles de l’immunité anti-tumorale dans les tumeurs malignes des cellules B et comment la technologie CAR pourrait les résoudre (A), et la représentation schématique d’une CAR (B)
Introduction
...1Partie 1 : Généralités sur la thérapie génique
...3 I. Histoire de la thérapie génique dans le domaine du cancer ...4 II. Thérapie génique en quelques chiffres ...6 1. Catégories de maladies ciblées par la thérapie génique ...6 2. Nombre d’essais cliniques en thérapie génique ...6 3. Progrès et tendances actuelles de thérapie génique ...8 III. Les techniques de traitement par la thérapie génique ...9 1. L’objectif thérapeutique du « gène médicament » : ...9 1.1. Les stratégies thérapeutiques en thérapie génique : ...9 1.2. Le « gène-médicament »... 11 1.2.1. Le « gène médicament » ... 12 1.2.2. La protéine-médicament : ... 12 1.2.3. Le ligand-médicament ... 12 2. Transfert du gène ... 13 2.1. Vecteurs non viraux... 14 2.2. Les vecteurs viraux ... 15 2.2.1. Les vecteurs rétroviraux ... 15 2.2.2. Les vecteurs lentiviraux ... 16 2.2.3. Les vecteurs adénoviraux... 16 2.2.4. Les adéno-associés (AAV) ... 17 2.2.5. Les baculovirus : ... 18 2.2.6. Les virus de l’herpès simplex (HSV) ... 18 2.2.7. Les poxvirus ... 19 3. Traitement par thérapie génique ex vivo, in vivo ... 19 3.1. Traitement par la thérapie génique ex vivo ... 20 3.1.1. Modification génétiques des cellules... 21 3.1.2. Le choix du vecteur ... 21 3.2. Le traitement par la thérapie génique in vivo ... 22IV. Limites de la thérapie génique ... 24 V. Les cellules CAR-T : ... 27 1. L’immunothérapie anti-tumorale ... 27 1.1. Effecteurs de l’immunité anti-tumorale... 28 1.1.1. Les LT-CD 8 dits cytotoxiques ... 28 1.1.2. Les LT-CD4 (auxiliaire ou « helper ») ... 28 1.2. Types de l’immunothérapie anti-tumorale : ... 29 2. Principe des cellules CAR-T ... 29 3. Mécanisme immunologique : ... 30 3.1. Les lymphocytes T cytotoxiques ... 30 3.2. Objectifs de la reprogrammation génétique ... 31 3.3. Structure et fonctionnement du récepteur antigénique chimérique ... 31 3.3.1. Structure générale: ... 31 3.3.2. Fonctionnement des CAR : ... 33 3.4. Pharmacocinétique des cellules CAR-T: ... 34 4. Les différentes générations de CARs ... 35 4.1. La 1ère génération : ... 36 4.2. La 2ème génération : ... 37 4.3. La 3ème génération : ... 37 4.4. 4ème génération : les TRUCKS ou « armored CARs » ... 38 4.5. Les CAR-T universelles : ... 38 4.6. Cellules CAR-T ciblées sur CD19 ... 38 5. Processus de fabrication des médicaments... 39 5.1. Approche autologue ... 39 5.2. Approche allogénique ... 40 6. La toxicité des cellules CAR-T : ... 40 6.1. Le syndrome de relargage cytokinique :... 40 6.2. Toxicités neurologiques : ... 43 6.3. Toxicité « On Target/Off Tumor » : Toxicité sur la tumeur cible / hors cible ... 44 7. Efficacité thérapeutique ... 45
8. Rôle des vecteurs : ... 45 9. Les principaux acteurs : ... 46
Partie 2 : Exemple de Tisagenlecleucel dans le traitement des leucémies
aigues lymphoblastiques
... 48I. Généralités : ... 50 II. Physiopathologie : ... 52 III. Classification des LAL ... 54 IV. Diagnostic ... 56 1. Aspect clinique : ... 56 2. Diagnostic biologique : ... 57 2.1. Hémogramme ... 57 2.2. Myélogramme : ... 58 2.3. Biopsie ostéo-médullaire ... 58 2.4. Etude cytochimique : ... 58 2.5. Immunophénotypage : ... 59 2.6. La cytogénétique : ... 59 2.7. Biologie moléculaire ... 60 2.8. Autres examens : ... 60 2.8.1. Bilan d'hémostase : ... 60 2.8.2. Bilan métabolique... 60 V. Prise en charge actuelle de la LAL :... 61 1. Chimiothérapie ... 61 1.1. Induction de la rémission : ... 62 1.2. La consolidation ... 63 1.3. Entretien ... 64 1.4. Maladie réfractaire/récidive ... 64 2. Allogreffe de cellules souches hématopoïétiques : ... 65 3. Radiothérapie ... 65 VI. Place de tisagenlecleucel dans la stratégie thérapeutique : ... 66 1. Importance de la chimiothérapie de conditionnement : ... 67
2. Efficacité : principaux résultats des essais cliniques: ... 68 3. Sécurité et tolérance: ... 69 VII. Population cible : ... 71
Partie 3 : Exemple de l’Axicabtagene Ciloleucel dans le traitement des
lymphomes non hodgkiniens à cellules B agressif
... 72I. Généralités : ... 74 II. Classification : ... 74 III. Pathologie ... 76 IV. Diagnostic : ... 77 1. Aspect clinique : ... 77 2. Diagnostic biologique ... 78 2.1. Immunophénotypage ... 78 2.2. Cytogénétique ... 80 V. Prise en charge actuelle : ... 81 VI. Place de l’axicabtagene ciloleucel dans la stratégie thérapeutique : ... 82 1. Efficacité / tolérance : ... 84 2. Sécurité : ... 85 VII. Population cible : ... 87
Conclusion
... 88Résumés
1
2
Selon l'Organisation Mondiale de la Santé (OMS), le cancer est une cause majeure de décès dans le monde, à l’origine de 18,1 millions de nouveaux cas et de 9,6 millions de décès en 2018; Avec 509,590 (2.8%) de nouveaux cas, 248.724 (2.6%) de décès pour les lymphomes non-hodgkinien, et 437,033 (2.4%) nouveaux cas, 309,006 (3.2 %) de décès pour les leucémies aigues lymphoblastiques [1].
Le traitement standard de ces deux dernieres consiste essentiellement en chimiothérapie, radiothérapie et en greffe de cellules souches, mais l'efficacité du traitement actuel reste limitée par leurs toxicités associées. Il est par conséquent nécessaire d’établir des approches thérapeutiques nouvelles.
La thérapie génique a révolutionné le 21ème siècle et bientôt, elle aura une influence importante sur de nombreux secteurs de notre vie. Les progrès dans ce domaine ont ouvert la possibilité de traitement pour de nombreuses maladies qui sont jusqu'ici incurables notamment le cancer. Dans un contexte global, elle implique la correction d'un défaut génétique en introduisant une version normale d'un gène défectueux ou manquant, corrigeant ainsi un trouble sous-jacent [2]. Elle se différencie des thérapies habituelles puisqu’elle ne se fonde pas sur la prise régulière d’un médicament mais sur l’injection ponctuelle d’un fragment d’ADN porté par un vecteur.
Ce travail détaillera en premier lieu les principes de la thérapie génique afin de présenter les stratégies nécessaires à la mise en place d’un traitement à la base de cette technique. Nous nous intéresserons ensuite particulièrement à l’utilisation des cellules CAR-T en détaillant leur principe et mécanisme immunologique. Dans un second temps nous analyserons la nature des deux produits issus de cette thérapie impliquée dans le traitement des leucémies aigues lymphoblastiques et des lymphomes non hodgkiniens. Nous nous intéresserons particulièrement à leur place dans la stratégie thérapeutique actuelle ainsi que leur efficacité.
3
Partie 1 :
Généralités sur
la thérapie génique
4
I. Histoire de la thérapie génique dans le domaine du cancer
Les traitements du cancer remontent au dix-huitième siècle, lorsque la chirurgie était le traitement principal des stades précoces du cancer et que les patients souffraient de récidives fréquentes.
Une fois la maladie propagée, les patients étaient traités avec des médicaments à base de plantes, de l'huile de ricin ou de l'arsenic. En 1895, la radiothérapie a été découverte, mais a abouti à peu de guérisons.
En 1943, la moutarde à l'azote était utilisée dans la prise en charge des patients atteints de lymphome et, en 1948, les antagonistes de l'acide folique entraînaient une rémission transitoire dans la leucémie infantile.
Les virus se sont également révélés efficaces pour lutter contre les tumeurs malignes chez les modèles animaux, puis chez l’homme en 1956. Les adénovirus en particulier ont fait l'objet d'études plus poussées chez l'homme, avec le développement ultérieur de la thérapie génique.
En 1987, l'immunothérapie a été introduite dans la prise en charge des patients cancéreux avec l'approbation ultérieure par la FDA (Food and Drugs Administration) des anticorps anti-rituximab dans le traitement des patients atteints de lymphome (1997).
La première expérience de thérapie génique approuvée par la FDA aux États-Unis a eu lieu en 1990 pour un patient atteint d'un trouble d'immunodéficience combiné sévère. Depuis lors, de nombreux essais cliniques ont été menés auprès de patients atteints de cancer; utilisant différentes approches en thérapie génique, avec des résultats positifs rapportés chez des patients atteints de leucémie lymphoïde chronique, de leucémie lymphocytaire aiguë, de tumeurs cérébrales, etc. [3]
En Aout 2017 la FDA a approuvé la toute première version du traitement ciblé de certains cancers et hémopathies issus de la thérapie CAR-T cell, le tisagenlecleucel (KYMRIAH®), ainsi qu’une autre molécule en octobre, l’axicabtagene ciloleucel (YESCARTA®).
5
Figure 1 : Chronologie montrant le développement de l'approche de la thérapie génique [2, 4].
• Découverte de la structure d'ADN
1953
• Proposition de l'approche de la thérapie génique
1966
• Utilisation des virus en tant que vecteurs pour le transfert de gène
1968
• Premier essai de thérapie génique
1990
• Approbation du premier virus oncotique
2005
• Premiers médicaments de thérapie géniques,mécanismes moléculaires et indications cliniques approvées
2008
• L'EMA a recommandé pour la première fois un produit de thérapie génique apprové par l'Union Européenne
2012
• approbation par la FDA de tisagenlecleucel et de l'axicabtagene ciloleucel
6
II. Thérapie génique en quelques chiffres
1. Catégories de maladies ciblées par la thérapie génique
La grande majorité (76,1%) des essais cliniques de thérapie génique menés à ce jour ont porté sur le cancer (65,0%) et les maladies monogéniques héréditaires (11,1%), ces dernières ayant obtenu les plus grands succès de la thérapie génique à ce jour[5].
Figure 2 : Les indications traitées par les essais cliniques de thérapie génique [5].
2. Nombre d’essais cliniques en thérapie génique
Le nombre d'essais initiés chaque année a tendance à baisser au cours des années suivant les déclarations d'événements indésirables graves, tels que 2003 et 2007, mais 2005, 2006 et 2008 ont été des années remarquables pour les essais de thérapie génique . Depuis l'année 2012, le nombre d'essais est en augmentation constante.
Les années les plus récentes tendent à être sous-représentées dans la base de données car il faut du temps pour la publication des articles, ce qui complique l'obtention d'informations sur les essais les plus récents. C'est le cas pour le nombre d'essais rapportés en 2016.[5]
7
0000
Figure 3: Nombre d'essais cliniques de thérapie génique approuvés dans le monde entier entre 1989 et 2017 [5].
8
3. Progrès et tendances actuelles de thérapie génique
Depuis la mise à jour en 2012, il y a eu 754 autres essais sur la thérapie génique initiés globalement. Une des thérapies hors concours a été dans l’immunothérapie du cancer, utilisant les cellules CAR-T pour cibler l’antigène de surface cellulaire associée à la tumeur.
Cette approche a reçu l’attention générale et rassemble le potentiel d'expansion et la persistance des lymphocytes T cytotoxiques avec la spécificité de l’anticorps monoclonal pour combattre les tumeurs, souvent là où d'autres traitements anticancéreux ont échoué.
Depuis le rapport sur le journal de la médecine de la Nouvelle-Angleterre en 2012, décrivant un patient en rémission complète à la suite d'une perfusion de cellules T autologues transduites, modifiées pour exprimer un CAR spécifique de l’antigène CD19 ; Plusieurs centaines de patients ont été traités dans le cadre de plusieurs essais avec cette modalité, des taux de rémission sans précédent étant observée chez les patients atteints de leucémie ou de lymphome, en particulier la leucémie aiguë lymphoblastique.
Le succès de l'application de ce traitement à la clinique a été mis en évidence par «l'immunothérapie», sélectionnée par les rédacteurs en chef de Science comme percée de l'année 2013.
Notamment, en mai 2017, Emily Whitehead, la première patiente pédiatrique traitée avec la thérapie cellulaire CAR-T à l’hopital des enfants de la Philadelphie,a marqué 5 ans en rémission, et le premier produit CAR-T, tisagenlecleucel, a également été approuvé par la FDA en 2017 [5].
9
III. Les techniques de traitement par la thérapie génique
1. L’objectif thérapeutique du « gène médicament » :
1.1. Les stratégies thérapeutiques en thérapie génique :
Afin de valoriser rapidement les génomes, il est important de découvrir le lien potentiel existant entre une maladie et un ou plusieurs gènes, responsables de cette affection ou impliqués dans ses manifestations indésirables [6].
La thérapie génique a pour objectif de soigner certaines maladies géniques le plus souvent rares et incurables en utilisant des acides nucléiques, c’est-à-dire des séquences d’ADN ou d’ARN
En fonction de la pathologie à traiter, cet objectif peut être atteint en utilisant différentes stratégies thérapeutiques :
La principale stratégie de thérapie génique consiste à délivrer aux cellules du patient un gène à action thérapeutique qui permettra de relayer la fonction du gène déficient ou de l’empêcher de s’exprimer si son rôle est néfaste pour l’individu ; L’ajout d’un gène fonctionnel pourra, quant à lui, aller directement remplacer le
gène défectueux à l’origine de la maladie ;
Il est également possible de modifier la lecture d’un gène altéré par une technique baptisée le « saut d’exon », réalisée en injectant des molécules capables de se fixer sur l’exon muté, qui correspond à la partie codante du gène responsable de la maladie.
Cela permet à la machinerie cellulaire du patient d’éviter de lire l’erreur présente sur l’exon et donc de contribuer à le soigner.
10
Pour parvenir aux objectifs désirés, les acides nucléiques à visée thérapeutiques utilisés par la thérapie génique peuvent être injectés directement dans les cellules de l’individu sous forme d’ADN nu, mais ils sont généralement transportés par un vecteur. Dans ce cas, le vecteur est responsable du transport du « gène-médicament » dans les cellules cibles du patient.
Afin de parvenir à ce résultat, il est important que ces systèmes de transfert de gènes soient sûrs, efficaces et capables d’exercer leur fonction dans des cellules qui ne se divisent pas, ils doivent également assurer la stabilité de l’expression du gène à action thérapeutique.
Parmi les différents types de vecteurs existants, les vecteurs viraux issus de virus modifiés représentent la référence et sont utilisés dans plus de 70% des essais cliniques menés actuellement.
Le principal avantage des virus repose sur leur capacité à franchir les barrières de protection qui dressent le corps humain lorsque celui-ci reconnait qu’un ADN étranger pénètre dans son génome.
Ils sont capables d’introduire efficacement le matériel génétique qu’ils transportent dans les cellules cibles qu’ils parviennent à infecter. C’est la raison pour laquelle les chercheurs ont eu l’idée de les utiliser pour transférer les gènes thérapeutiques dans les cellules des patients.
Dans le cadre de la thérapie génique, les virus utilisés sont préalablement modifiés en retirant, au sein de leur propre génome, les séquences nécessaires à leur réplication et à leur virulence, afin que ceux-ci ne présentent pas de danger pour le patient ou son environnement.
Pour fonctionner, la thérapie génique nécessite donc toujours la présence de plusieurs éléments : un « gène-médicament », un vecteur pour le transport et d’une cellule cible où le gène peut s’exprimer.
La modification génique peut ensuite se réaliser de façon in vivo (directement chez le patient) ou ex vivo (à l’extérieur du corps humain) ; Ces protocoles varient en fonction des indications et des objectifs thérapeutiques à atteindre.
11
Cependant, ils consistent toujours à modifier génétiquement les cellules de la personne atteinte de la maladie, de manière ex vivo ou in vivo et d’une façon pouvant être pérenne ou transitoire.
1.2. Le « gène-médicament »
Une fois la relation entre le gène, son produit (la protéine) et la maladie est établie, il s’agit de mettre en place une stratégie thérapeutique.
On distingue actuellement trois approches majeures : le gène-médicament, la protéine-médicament et le ligand-protéine-médicament :
Figure 4:Stratégies de découverte de ligands-médicaments. Approche structurale et approche par criblage [6].
12
1.2.1. Le « gène médicament »
Permet d’envisager de «réparer» un gène défectueux ou d’adjoindre dans les cellules un gène codant pour une protéine potentiellement thérapeutique : c’est l’approche par thérapie génique.
Le potentiel de cette stratégie est énorme mais des problèmes difficiles restent encore à résoudre, notamment en ce qui concerne la vectorisation et la biotolérance.
1.2.2. La protéine-médicament :
Dans le cas où le défaut génétique conduit à l’absence d’expression d’une protéine ou à son dysfonctionnement, Nous pouvons administrer la protéine fonctionnelle pour rétablir la réponse biologique.
Cette approche est bien établie comme le démontre l’usage courant de l’insuline ou de l’hormone de croissance.
La liste des protéines actuellement en cours d’étude clinique montre également le potentiel de cette stratégie. Son champ d’application reste cependant limité du fait de la faible biodisponibilité de ces molécules et de leur coût de production relativement élevé.
1.2.3. Le ligand-médicament
C’est la méthode la plus classique. Il s’agit de découvrir une molécule pouvant se lier (le ligand) à l’ADN, à l’ARN ou à la protéine cible de manière puissante et sélective, permettant ainsi d’en moduler la fonction selon les nécessités thérapeutiques. La plupart des médicaments existants fonctionnent selon ce principe.
Dans le contexte post-génomique, il y a deux voies : la conception rationnelle fondée sur la connaissance de la structure de la cible ; le criblage robotisé, systématique ou intelligemment ciblé.
L’approche rationnelle bénéficie de l’essor de la biologie structurale et des progrès de la modélisation moléculaire. De plus en plus souvent les structures tridimensionnelles (3D) des cibles sont accessibles et permettent la conception «sur mesure» de ligands adaptés grâce à des logiciels d’aide à la conception.
La créativité des chercheurs a conduit à l’émergence de nouveaux types de ligands tels que les molécules anti-sens, ou les protein nucleic acids(PNA), complémentaires des acides nucléiques endogènes.
13
Le potentiel thérapeutique de ces substances reste cependant à démontrer. La modélisation et les techniques de recherche de pharmacophores viennent parfois aider les chimistes à découvrir des molécules innovantes et présentant un intérêt thérapeutique [6].
2. Transfert du gène
La thérapie génique est sur le point de devenir une thérapie anti-tumorale de routine, avec le potentiel d’élever cette méthodologie en tant que traitement de première ligne pour les maladies cancéreuses [2].
La thérapie génique, qui se base sur le remplacement d'un gène défectueux résultant une protéine fonctionnelle de ce gène, est une approche bénéfique pour le traitement du cancer, en particulier par rapport à la chimiothérapie, qui manque souvent de sélectivité et qui peut entraîner une toxicité non spécifique [7].
Trois éléments entrent en jeu pour tout essai de thérapie génique quelle que soit la maladie:
Le gène thérapeutique encore appelé transgène, Le vecteur qui assure le transfert efficace du vecteur,
La cellule dans laquelle est ciblée l’expression du transgène. En outre, pour atteindre une efficacité thérapeutique, il faut :
Obtenir une expression durable, spécifique du transgène, Limiter les effets indésirables (cytotoxicité, inflammation…).
Il existe trois moyens principaux de transfert des gènes dans les cellules tumorales: les vecteurs non viraux, les vecteurs viraux et les véhicules à base de cellules.
Pour la plupart des tumeurs, une expression de gènes thérapeutiques à court terme peut suffire pour tuer les cellules tumorales. En outre l'élimination rapide des vecteurs viraux de la circulation sanguine a permis le développement de vecteurs synthétiques d'administration de gènes. Toutefois, porter l’ADN d’intérêt sur les dépôts métastasique distants reste un inconvénient majeur de ces approches.
14
Les vecteurs de libération de gènes non viraux sont généralement injectés localement. Bien qu'une injection locale soit bénéfique pour les tumeurs telles que le mélanome, les cancers de la tête et du cou ou le carcinome péritonéale; elle ne convient pas aux patients atteints de métastases hématogènes.
Les vecteurs viraux et non viraux doivent survivre dans le sang pour être arrêtés dans le tissu tumoral ciblé, se lier à des cellules spécifiques et ensuite pénétrer dans les cellules pour enfin atteindre le noyau [7].
2.1. Vecteurs non viraux
L'ADN plasmique, qui est principalement utilisé en thérapie génique non virale, est facilement dégradé par les nucléases. Par conséquent, certaines stratégies visant à réduire la taille et à prévenir la dégradation ont été développées.
Les agents les plus couramment utilisés pour la délivrance de gènes sont les lipides cationiques, le groupe de tête cationique des lipides se liant à l'ADN et la queue lipidique permettant l'effondrement du complexe ADN lipidique.
Les complexes ADN lipidiques cationiques (lipoplexes) (LPD / ADN) pénètrent dans la cellule cible par une voie endosomale. Cependant, l'efficacité d'expression du transgène est très faible avec les lipoplexes.
Il a été démontré que seule une très petite partie de l'ADN injecté par voie systémique pouvait atteindre le tissu tumoral [8].
Contrairement aux vecteurs viraux, les systèmes non viraux offrent divers avantages, tels qu'un risque de biosécurité réduit, une source de matériau étendue, une structure chimique contrôlable, une modification biofonctionnelle multiple, aucune limite de capacité et une production de forme simplifiée.
Plus important encore, les vecteurs non viraux sont capables de délivrer des composés synthétiques tels que le siRNA ou d'autres oligonucléotides comme l’ADNp [9].
15
2.2. Les vecteurs viraux
Ces dernières années, les applications des vecteurs viraux ont prouvés un effet remarquable et encourageant en thérapie génique. Des améliorations significatives dans l'ingénierie vectorielle, la vectorisation et la sécurité ont placé la thérapie virale à base de vecteurs à la pointe de la médecine moderne.
Des vecteurs viraux ont été utilisés pour le traitement de diverses maladies : métaboliques, cardiovasculaires, musculaires, hématologiques, ophtalmologiques et infectieuses ainsi que différents types de cancer.
Un développement récent dans le domaine de l'immunothérapie a fourni à la fois des approches préventives et thérapeutiques [10].
Les virus ont la capacité naturelle de transmettre les acides nucléiques de leur propre génome à des types de cellules spécifiques, y compris les cellules cancéreuses. Cette capacité rend ces véhicules de livraison de gènes attractifs et populaires.
Les rétrovirus, les adénovirus, les virus adéno-associés, le virus de l'herpès simplex, les poxvirus et les baculovirus sont couramment modifiés et utilisés comme vecteurs de thérapie génique dans le cancer. De plus, des systèmes de vecteurs viraux chimériques combinant les propriétés de deux types de virus ou plus sont également développés.
2.2.1. Les vecteurs rétroviraux
Les vecteurs rétroviraux dérivés de rétrovirus contiennent un ARN simple brin linéaire, d'environ 7 à 10 kb et possèdent une enveloppe lipidique. Les particules virales pénètrent dans les cellules exprimant des récepteurs appropriés pour les rétrovirus.
Après sa pénétration dans la cellule, la transcriptase inverse virale transcrit l'ARN du virus en ADN double brin et de la transcription de ce dernier résulte un complexe de pré-intégration de nucléoprotéines (PIC) en se liant avec des protéines cellulaires[11]. Le PIC migre vers le noyau et intègre ainsi le génome de l'hôte.
La capacité d'expression transgénique dans les cellules en division est un avantage des vecteurs rétroviraux, qui évite une expression indésirable dans les cellules non divisées des tissus environnants.
16
L'incorporation de gènes rétroviraux dans le génome de l'hôte fournit une expression à long terme des transgènes; Bien que cela soit avantageux, une incorporation non spécifique de l'ADN viral pourrait altérer la fonction du gène de l'hôte ou induire une expression aberrante d'un oncogène cellulaire.
Cependant, le risque d'oncogenèse par insertion observé lors de l'essai mené auprès de nourrissons X-SCID en 2003 a limité l'utilisation de systèmes de transfert de gènes rétroviraux chez l'homme.
La possibilité de générer des rétrovirus compétents pour la réplication constitue un autre problème de sécurité en ce qui concerne l'utilisation clinique de ces vecteurs[12].
2.2.2. Les vecteurs lentiviraux
Les vecteurs lentiviraux dérivés de rétrovirus peuvent provoquer une intégration stable du transgène dans le génome de l'hôte avec une expression génique à long terme.
La capacité de transduction à la fois de cellules en division ou non rend ces vecteurs plus appropriés et plus efficaces comme véhicule de transfert de gènes par rapport aux rétrovirus[12].
2.2.3. Les vecteurs adénoviraux
Les vecteurs adénoviraux sont largement utilisés pour introduire les gènes thérapeutiques dans les cellules tumorales, ils peuvent infecter un large éventail de types de cellules[13].
Les sérotypes d'adénovirus les plus largement utilisés pour développer des vecteurs dans les études de thérapie génique sur le cancer chez l'homme sont le type 5 (Ad5) et le type 2 (Ad2).
Ils ont une capacité d'environ 8 à 10 kb de gènes thérapeutiques avec des vecteurs de première génération allant jusqu'à 36 kpb. Cependant, parallèlement au potentiel immunogène, la vaste gamme de cellules hôtes contenant l'adénovirus limite son utilisation systémique dans les essais de thérapie génique sur le cancer chez l'homme.
Les stratégies de ciblage ont permis l'utilisation de vecteurs mais ils ne peuvent pas s'intégrer au génome cellulaire, exprimer le transgène de manière épisomique ou induire des mutations aléatoires.
17
Néanmoins, l'expression du transgène est limitée de 7 à 10 jours après l'infection, donc des administrations répétées du vecteur sont nécessaires pour obtenir des réponses durables[12].
2.2.4. Les adéno-associés (AAV)
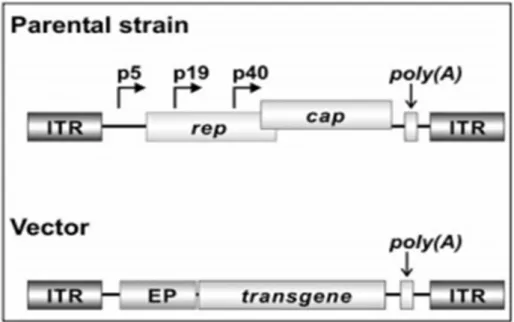
Les virus adéno-associés (AAV) sont des virus simples brin avec un ADN d'environ 4,7 kb [14]; Ils appartiennent à la famille des parvovirus et nécessitent un virus auxiliaire tel que l'adénovirus ou le virus de l'herpès pour leur réplication et libération de la cellule [15].
Ils peuvent infecter une grande variété de cellules indépendamment du cycle cellulaire, cette propriété fait d'AAV un vecteur approprié pour la thérapie génique du cancer.
Figure 5: Organisation génomique d'un vecteur dérivé à partir d'un virus adéno-associé (AAV). Le génome parental se compose principalement de réplicase codant pour le rep, le cap et les protéines structurelles. L’expression des protéines AAV est pilotée par les
18
En outre, contrairement aux adénovirus, ils induisent une faible réponse immunitaire lorsqu’ils infectent les cellules hôtes normales.
Un autre avantage des AAV par rapport aux adénovirus est leur capacité à intégrer le transgène à un endroit particulier du 19ème chromosome de cellules; Néanmoins, le principal inconvénient de l'AAV est sa capacité de chargement limitée d'environ 4 kpb de gènes thérapeutiques.
L'AAV pourrait transduire certains types de cellules. De ce fait, des stratégies de ciblage telles que la modification de protéines de capside virales, la liaison d'anticorps monoclonaux ou de protéines bispécifiques ont été développées pour améliorer l'efficacité des systèmes AAV en thérapie génique du cancer [16, 17].
2.2.5. Les baculovirus :
Les baculovirus sont des particules virales enveloppées avec un grand ADN double brin d'environ 80 à 180 kb. Ils infectent naturellement les cellules d'insectes et ne présente pas de maladies liées à l’homme.
Avec leur profil de sécurité élevé chez les humains, leur manipulation et production faciles. Ils semblent des véhicules de thérapie génique très utiles avec une très grande capacité de chargement d'environ 40 kb et de multiples inserts possibles[18].
Le nucléopolyhédrovirus multiples Autographa californica est le type de baculovirus le plus utilisé dans les études de thérapie génique. Ils peuvent facilement transduire des cellules de mammifère, y compris de nombreux types de cellules cancéreuses, et provoquer une expression élevée du transgène dans la cellule hôte [19].
2.2.6. Les virus de l’herpès simplex (HSV)
Le virus de l'herpès simplex (HSV) est un gros virus à ADN double brin avec environ 152 kb de génome; Il a un tropisme naturel pour les tissus nerveux et ne peut pas s'intégrer dans le génome de l'hôte [41].
Les vecteurs HSV peuvent être conçus en trois types différents: amplicons, vecteurs défectueux pour la réplication et vecteurs compétents pour la réplication [20].
En général, les vecteurs HSV compétents pour la réplication sont utilisés comme agents oncolytiques dans les études de thérapie génique du cancer.
19
2.2.7. Les poxvirus
Les poxvirus sont les premiers virus à être utilisés comme vecteurs de thérapie génique; Ils ont été utilisés dans la production in vitro de protéines et en tant que vaccins vivants.
Les formes atténuées de poxvirus ont été développées et utilisées dans le développement d'essais de vaccins génétiques contre le cancer; Les propriétés immunostimulantes des poxvirus en font des agents préférables pour induire une immunité contre les tumeurs [12].
3. Traitement par thérapie génique ex vivo, in vivo
Il existe deux grandes approches de thérapie génique (Figure 6). La première, dite ex vivo, consiste à modifier génétiquement des cellules in vitro, puis à greffer ces cellules dans l’organe cible.
La deuxième stratégie, dite in vivo, vise à introduire directement le gène thérapeutique dans les cellules du patient en injectant localement le vecteur dans l’organe (ou la partie de l’organe défectueux).
20
3.1. Traitement par la thérapie génique ex vivo
La stratégie ex vivo a été utilisée dans les premiers protocoles de thérapie génique des cellules en prolifération. Ses limites ont stimulé le développement de nouveaux vecteurs capables de transférer directement un gène dans les cellules quiescentes.
Une thérapie génique à médiation rétrovirale telle que lentivurus conduit à une intégration virale dans le génome de l'hôte. Elle peut donc provoquer des événements mutagènes pouvant entraîner une deuxième tumeur maligne[22].
En thérapie génique ex vivo, les cellules d'un patient sont prélevées, maintenues en culture pour introduire un gène thérapeutique dans les cellules, puis transplantées chez le patient.
Le rôle des cellules transplantées, qui sont génétiquement modifiées, est de délivrer un produit de gêne recombinant dans le corps du patient; Les cellules génétiquement modifiées ne sont pas obligées de reconstituer un organe ou un tissu particulier.
Par exemple, les hépatocytes génétiquement modifiés prélevés sur un lobe du foie peuvent être réinjectés dans n'importe quelle partie du foie des patients en thérapie génique ex vivo.
Le principal inconvénient de la thérapie génique ex vivo, est la nécessité de l’élimination et de la transplantation chirurgicale des cellules de l’organisme. Ces étapes chirurgicales sont très douloureuses.
Pourtant, la thérapie ex vivo présente plusieurs avantages par rapport à la thérapie génique in vivo :
Premièrement, l'efficacité du transfert de gènes dans les cellules ciblées est très élevée par rapport à la thérapie génique in vivo, car la délivrance des gènes est effectuée dans des conditions contrôlées et optimisées.
En outre, les cellules transduites peuvent être enrichies si le vecteur a un marqueur de gène sélectionnable.
Enfin, les effets secondaires immunologiques provoqués par les véhicules d’administration de gènes dans la thérapie génique in vivo sont minimisés dans la thérapie génique ex vivo [23].
![Figure 1 : Chronologie montrant le développement de l'approche de la thérapie génique [2, 4]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/43.892.117.789.228.707/figure-chronologie-montrant-développement-approche-thérapie-génique.webp)
![Figure 2 : Les indications traitées par les essais cliniques de thérapie génique [5].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/44.892.129.771.272.681/figure-indications-traitées-essais-cliniques-thérapie-génique.webp)
![Figure 3: Nombre d'essais cliniques de thérapie génique approuvés dans le monde entier entre 1989 et 2017 [5]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/45.892.207.675.140.733/figure-nombre-essais-cliniques-thérapie-génique-approuvés-entier.webp)
![Figure 4:Stratégies de découverte de ligands-médicaments. Approche structurale et approche par criblage [6]](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/49.892.123.773.394.902/figure-stratégies-découverte-médicaments-approche-structurale-approche-criblage.webp)
![Figure 6 : Thérapie génique in-vivo et ex-vivo[21].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/57.892.149.757.570.977/figure-thérapie-génique-in-vivo-et-ex-vivo.webp)
![Figure 7: Structure du récepteur de l'antigène chimérique (CAR) [42].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/70.892.123.776.507.906/figure-structure-récepteur-antigène-chimérique.webp)
![Figure 8: Le processus de la thérapie par les cellules CAR-T [45].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/72.892.203.696.116.439/figure-processus-thérapie-cellules.webp)
![Figure 9: Les différentes générations des cellules CAR-T [40].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/74.892.118.783.109.355/figure-générations-cellules.webp)
![Figure 10: Les principales sociétés développant des cellules CAR-T [60].](https://thumb-eu.123doks.com/thumbv2/123doknet/14393279.701510/85.892.39.862.282.675/figure-principales-sociétés-développant-cellules.webp)