HAL Id: tel-01146221
https://tel.archives-ouvertes.fr/tel-01146221
Submitted on 28 Apr 2015HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Implication de l’axe CX3CL1/CX3CR1 dans la
physiopathologie de la réaction aiguë du greffon contre
l’hôte en allogreffe de cellules souches hématopoïétiques
Eolia Davaine
To cite this version:
Eolia Davaine. Implication de l’axe CX3CL1/CX3CR1 dans la physiopathologie de la réaction aiguë du greffon contre l’hôte en allogreffe de cellules souches hématopoïétiques. Physiologie [q-bio.TO]. Université Pierre et Marie Curie - Paris VI, 2014. Français. �NNT : 2014PA066385�. �tel-01146221�
Université Pierre et Marie Curie
Implication de l'axe CX3CL1/CX3CR1 dans la
physiopathologie de la réaction aiguë du greffon contre
l'hôte en allogreffe de cellules souches hématopoïétiques
Thèse de doctorat en Sciences
Ecole doctorale Physiologie & PhysiopathologieEquipe 7 Centre de Recherche Saint-Antoine- Université Pierre et Marie Curie
Présentée et soutenue publiquement par
Eolia Brissot
le 27 Octobre 2014 devant un jury composé de :
Rapporteurs
Pr YAKOUB-AGHA Ibrahim Professeur des Universités, Lille Pr SAAS Philippe Professeur des Universités, Besançon
Examinateurs
Dr GAUGLER Béatrice Chargé de Recherche, INSERM, Besançon Dr GREGOIRE Marc Directeur de Recherche, INSERM, Nantes Pr LEGRAND Ollivier Professeur des Universités, Paris
Directeur de thèse
3
Sommaire
Introduction ... 7
Partie 1- L’allogreffe de cellules souches hématopoïétiques ... 9
1. Définition ... 9
2. Historique ... 9
3. Les étapes de l’allogreffe ... 14
4. Les indications ... 14
5. Les sources de greffon ... 16
6. Choix du donneur ... 16
6.1. Les donneurs vivants ... 17
6.2 Le sang de cordons placentaires ... 17
7. Le conditionnement ... 18
7.1. Le conditionnement myéloablatif : ... 18
7.2. Le conditionnement d’intensité réduite : ... 18
8. Réaction du greffon contre la leucémie ou contre la tumeur (GVL ou GVT) ... 19
9. Complications ... 19
9.1. Complications infectieuses ... 19
9.2. Complications liées à la toxicité du traitement ... 20
9.3. Les conflits immunologiques ... 21
Partie 2. La GVH aiguë ...24
1. Atteintes cliniques et descriptions histologiques ... 24
2. Physiopathologie ... 26
2.1. 1ère étape : activation des CPA ... 27
2.2. 2ème étape : activation des lymphocytes T du donneur ... 29
2.3. 3ème étape : phase effectrice induisant des lésions tissulaire ... 31
2.4. Implication de l’endothélium ... 32
3. Prophylaxie et traitement ... 33
3.1. Phase de traitement ... 33
3.2. Prophylaxie ... 34
4
3.4. Traitement de la GVHa réfractaire ou dépendante des corticostéroïdes ... 36
3.5. Approches émergentes ... 37
Partie 3- Les chémokines et leurs récepteurs ...40
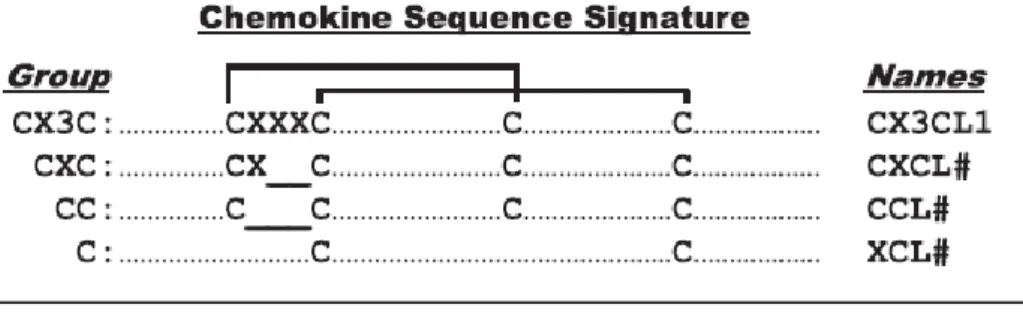
3.1. Généralités ... 40
3.2. Structure et classification ... 40
3.3. Le rôle des chémokines et leurs récepteurs dans la GVHa ... 44
3.4. La chémokine CX3CL1 (fractalkine) et son récepteur CX3CR1 ... 49
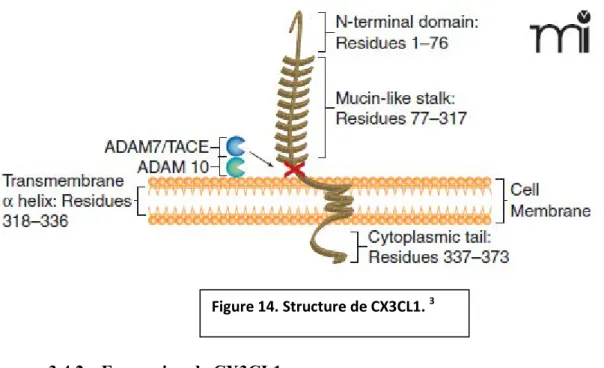
3.4.1. Structure de CXC3CL1 ... 49
3.4.2. Expression de CX3CL1 ... 50
3.4.3. Régulation de l’expression de CX3CL1 ... 50
3.4.4. Le récepteur de CX3CL1, CX3CR1 ... 52
3.4.5. Signalisation et fonctions induites par CX3CL1 ... 53
3.4.6. L’effet de l’invalidation des gènes codant pour CX3CL1 et son récepteur ... 55
3.4.7. Implications de l’axe CX3CL1/CX3CR1 dans différentes pathologies (Fig. 17) ... 56
Etude expérimentale ... 59
1. Présentation synthétique de l’étude ... 59
1.1. Justification et objectif ... 59
1.2. Méthodologie ... 59
1.3. Résultats ... 60
1.4. Discussion et conclusions ... 60
2. Article scientifique ... 63
Discussion générale et perspectives ... 92
Références ... 94
5
REMERCIEMENTS
Je tiens à remercier
Le Pr Yakoub-Agha et le Pr Saas qui me font un grand honneur en acceptant d’être rapporteurs de ce travail.
Le Pr Legrand pour avoir accepté de juger ce travail
Marc Grégoire pour m’avoir accueilli au sein de son laboratoire Béatrice Gaugler pour ses nombreux conseils au cours de mon travail
Le Pr Mohty pour son enseignement médical et scientifique, son extraordinaire dynamisme, sa conception visionnaire de la Médecine et de la Recherche
J’associe à ces remerciements tous les membres présents ou passés de l’équipe 4 de l’UMR 892 pour leur aide quotidienne scientifique et technique. Merci à Jihane, Virginie, Aline, Florent, Fabien, David, Delphine, Jean-Baptiste, Nicolas, Carole, Christophe Blanquart, Daniel Pouliquen et Jean-François Fonteneau.
Merci à mes Parents, mes Grands-Parents, ma Famille, Nicole et Alain. Merci à Adèle, Clara et Jimmy
6
Liste des Abréviations
allo-CSH: allogreffe de cellules souches hématopoïétiques
ANG2 : angiopoïétine 2 ATP : adénosine triphosphate CD : cellule dendritique
CMH : complexe majeur d’histocompatibilité CMV : cytomégalovirus
CPA : cellule présentatrice d’antigènes CSH: cellules souches hématopoïétiques CSP : Cellules Souches Périphériques DAMPs : damage-associated molecular patterns
DLI : injection des lymphocytes du donneur EBV : Epstein Barr Virus
Effet GVL : Effet du greffon contre la leucémie
Effet GVT : Effet du greffon contre la tumeur G-CSF: Granulocyte colony-stimulating factor
GVHD : réaction du greffon contre l’hôte GVHa : réaction aiguë du greffon contre l’hôte GVHc : réaction chronique du greffon contre l’hôte
HGF: facteur de croissance hépatocytaire HLA : Human Leucocyte Antigen
HUVEC : human umbilical vein endothelial cells IFN: Interféron
IL: Interleukine
JAK: Janus kinase
J0 : jour zéro de l'allogreffe
J50 : cinquantième jour après l'allogreffe J100 : Centième jour après la greffe KIR : killer inhibitor receptor
LAM : Leucémies Aigues Myéloïdes LLC : leucémie lymphoïde chronique LPS : lipopolysaccharide
MAPK : mitogen-activated protein kinase MEC : matrice extra-cellulaire
miHA : antigènes mineurs d’histocompatibilité MMF : mycophénolate mofétil
NF-ƘB : nuclear factor-kapa B
NIH: National Institute of Health NK: natural killer
NLC: nurse-like cells
PAMPs : pathogen-associated molecular patterns
RC: remission complete
SNP : polymorphismes nucléotidiques
TACE: TNF-α-converting enzyme
TCR: récepteur des lymphocytes T TLR: toll like receptor
T reg: Lymphocytes T régulateurs Tc : Lymphocytes T cytotoxiques
TH : Lymphocytes T auxiliaires ou effecteurs
7
8 L’allogreffe de cellules souches hématopoïétiques (CSH) est une immunothérapie efficace pour le traitement de nombreuses pathologies hématologiques malignes, les déficits immunitaires et les hémoglobinopathies sévères. De nombreux progrès ont été réalisés ces dernières décennies, en particulier en ce qui concerne la diversité des sources de CSH accessibles et l’apparition de conditionnements non myéloablatifs ou d’intensité réduite permettant de proposer l’allogreffe à des sujets plus âgés (au-delà de 50 ans) ou ayant des comorbidités. Cette thérapeutique s’est donc développée passant à quelques cas par an dans les années 80 à plus de 1500 allogreffe de CSH /an réalisées en France actuellement.
La complexité et le succès de l’allogreffe de CSH résultent de l’immunosuppression des cellules du système immunitaire du receveur par le conditionnement et de la reconstitution immunitaire à partir des cellules souches dérivées du greffon. Ce contexte conflictuel est à l’origine d’une complication majeure : la réaction du greffon contre l’hôte (GVHD). Cette affection peut être définie comme aiguë (survenant les premiers mois) (GVHa) ou chronique (GVHc), principale complication à moyen et long terme. La GVHD reste actuellement une cause majeure de mortalité post-allogreffe avec un taux mortalité pouvant atteindre 20% des patients allogreffés.
Les connaissances sur la physiopathologie de la GVHa ont fait d’importants progrès ces dernières décennies en particulier avec l’identification de biomarqueurs, du rôle central du système digestif dans ce phénomène, l’implication de l’endothélium et de certaines cytokines et chémokines. Ces importantes découvertes ne se sont pas encore traduites par un bénéfice direct en pratique quotidienne chez le patient allogreffé. La GVHa résultant d’une cascade de réactions immunologiques, nous avons décidé d’étudier de façon très précoce, soit au jour zéro (J0) de l’allo-CSH, 42 cytokines dans le sérum de 109 patients ayant reçu une allo-CSH avec un conditionnement d’intensité réduite, afin d’explorer les mécanismes potentiellement déclencheurs de la GVHa.
9
Partie 1- L’allogreffe de cellules souches hématopoïétiques
1.
Définition
L’allogreffe de cellules souches hématopoïétiques est une procédure thérapeutique complexe reconnue comme efficace et curative pour de nombreuses hémopathies. Le concept initial était celui de détruire la moelle osseuse du receveur (moelle pathologique) et de la reconstituer avec un greffon prélevé sur un donneur compatible.
Aujourd’hui, ce concept de remplacement de la moelle malade par une moelle saine a évolué même s’il reste le fondement de la thérapeutique de certains déficits immunitaires graves ou de certaines formes graves d’hémoglobinopathies ou d’autres maladies génétiques des cellules hématopoïétiques. En effet, la reconstitution hématopoïétique et immunitaire post-allogreffe s’accompagne d’une interaction entre le système immunitaire issu du greffon et les tissus du patient receveur. Ces interactions peuvent générer un conflit entre donneur et receveur, source à la fois d’un effet bénéfique (destruction des cellules tumorales effet : greffon contre maladie) et de complications (maladie du greffon contre l’hôte). L’allogreffe doit donc plutôt être perçue comme une thérapie cellulaire anti-tumorale, lorsqu’elle est utilisée dans la stratégie thérapeutique des hémopathies malignes.
2. Historique
- Les débuts de la greffe de cellules souches hématopoïétiques
Après l’explosion des bombes atomiques au Japon en 1945, le monde scientifique et médical a commencé à explorer l’effet de l’irradiation sur l’hématopoïèse constituant ainsi les prémices de l’allogreffe de cellules souches hématopoïétique. En étudiant les effets des irradiations létales dans le modèle murin, Jacobson et coll. (1949) découvrirent l’intérêt de protéger la rate et les fémurs des radiations, permettant ainsi une reconstitution hématologique. La rate et les fémurs contenaient du tissu hématopoïétique 10, 11. Un an plus
tard, Lorenz et coll. montraient que cet effet protecteur pouvait être créée par infusion de moelle osseuse par voie intra-veineuse 12. Au cours des cinq années suivantes, il fut montré
que les cellules de moelle osseuse issues de donneurs syngéniques permettaient de repeupler la moelle osseuse irradiée du receveur 13. Un animal recevant une système hématopoïétique
10 d’un autre animal après irradiation est alors appelé chimère 14. En 1958, six physiciens ont
développé une aplasie médullaire suite à un accident nucléaire en Yougoslavie. Mathé et coll. réalisèrent une infusion de moelle osseuse chez cinq de ces patients ayant permis une reconstitution, tout au moins transitoire, de l’hématopoïèse 15.
- Les premières tentatives d’allogreffe de CSH
En 1959, le premier cas de prise de greffe chez un patient atteint d’une leucémie avec un donneur syngénique fut décrit par Thomas et coll.16. Puis dans les années 1960, Beilby et coll.
rapportèrent le cas d’un patient atteint d’un lymphome de Hodgkin ayant été allogreffé avec un donneur non apparenté après injection d’une dose trop forte de chlorambucil. Il fut observé une reconstitution hématopoïétique partielle. Au total dans les années 1960, 19 cas d’allogreffe 17 ont été décrits, 13 sont décédés sans prise de greffe, deux ont une reprise autologue. Les quatre autres patients, greffés avec leur jumeau, montrèrent une prise du greffon temporaire. Tous cependant rechutèrent dans les trois mois.
La plupart des travaux de recherche ont été initialement réalisés par l’équipe d’E.D. Thomas à Seattle à partir d’expériences sur un modèle canin. Les deux problèmes majeurs associés à l’allogreffe furent le rejet du greffon et la maladie du greffon contre l’hôte ou GVHD (graft-versus-host disease) -initialement appelée « syndrome ou maladie secondaire ». Ces syndromes secondaires apparaissaient après prise de greffe et se caractérisaient par des diarrhées, une perte de poids, des lésions cutanées et une atteinte hépatique. En 1966, Billingham et coll. décrivirent les 3 critères nécessaires au développement d’une maladie du greffon contre l’hôte :
-le greffon doit contenir des cellules immunocompétentes
-il doit exister une incompatibilité antigénique entre l’hôte et le greffon
-et l’hôte ne peut pas mettre en place une réaction immunologique de rejet contre le greffon 18.
Cependant, en 1966, sur un total de 417 allogreffes, 3 succès prolongés seulement furent obtenus…8 Au vu de ces résultats décevants, de nombreuses équipes considérèrent
l’allogreffe de CSH comme un traitement sans avenir (Fig. 1) 19.
Figure 1 . Nombre d’allogreffes rapportées entre 1958 et 1968 par Bortin et coll.8
11 La découverte du système complexes majeurs d’histocompatibilité ou human leucocyte antigen (HLA) par J.Dausset fut un tournant décisif en allogreffe de CSH20 . A partir des années 1970, les équipes réalisèrent, dans le cadre du traitement des leucémies aiguës et des aplasies médullaires, des allogreffes de CSH avec un donneur familial dit « géno-identique ». L’utilisation du méthotrexate post-allogreffe permit d’améliorer la prise de greffe et de diminuer la GVHD 21. La ciclosporine a été introduite dans les années 80 et son association
avec le méthotrexate permit une réduction importante de la GVHD 22 (Fig.2).
- Historique de la réaction du greffon contre la leucémie ou tumeur (GvL ou GvT) L’existence d’un effet de la greffe contre la tumeur après allogreffe des CSH a été prédite dès 1956 sur la base d’expériences murines. Barnes et coll ont été les premiers à rapporter l’effet GVL en étudiant l’éradication des cellules leucémiques chez des souris irradiées ayant reçu un greffon allogénique et non syngénique 23. En 1981, le groupe de Seattle rapportait une
incidence de rechute réduite chez les patients ayant développé une GVH aiguë et/ou chronique. A partir des années 1980, plusieurs études montrèrent la corrélation entre la survenue de la GVH et une meilleure survie sans rechute. Alors que la survenue d’une GVHa n’était pas associée à une amélioration de la survie en raison d’une augmentation importante de la mortalité liée à la greffe, la survenue d’une GVHc était, quant à elle, associée à une augmentation de la survie24-26. D’autres études ont démontré une augmentation du risque de
rechute chez les patients ayant reçu une greffe syngénique, par comparaison avec ceux ayant reçu une greffe allogénique.
Le rôle prépondérant des cellules T du greffon dans l’effet GVL a été mis en évidence par la démonstration d’une augmentation du risque de rechute chez les patients recevant une greffe déplétée en lymphocytes T 27. Ces observations ont incité Kolb et coll. à transfuser des
lymphocytes du donneur (DLI) chez les patients ayant rechuté après allogreffe 28. Depuis,
l'effet anti-leucémique des DLI a été largement démontré permettant des régressions tumorales complètes, plus particulièrement dans la leucémie myéloïde chronique. L'utilisation avec succès de cette thérapeutique s'est accompagnée néanmoins de complications parfois graves telles que la GVHD 29.
12 - Des années 1980 à aujourd’hui
Dans les années 1980, on assiste à une augmentation rapide et importante du nombre d’allogreffes avec l’apparition de donneurs non apparentés et l’amélioration des techniques de cryo-préservation des greffons.
Les événements majeurs ayant contribué au développement de l’allogreffe sont :
- L’apparition de deux nouvelles sources de greffon : le sang de cordon placentaire et les cellules souches périphériques. En 1988 est réalisée la première greffe de sang de cordon chez un enfant atteint d’un syndrome de Fanconi par Gluckman et coll 30. L’utilisation de cette source de greffon a été élargie aux adultes à partir des années 2000. A partir de 1995, les études sur les cellules souches périphériques (CSP) obtenues par aphérèse après mobilisation par injection de facteur de croissance se sont développées. Actuellement, les CSP représentent la source principale de greffon (environ 75%).
- Le développement des conditionnements à intensité réduite permet de réaliser cette procédure chez des patients de plus de 50 ans ou présentant des co-morbidités.
Figure 2 . Histoire et évolution de l’allogreffe de CSH de 1957 à 2006
données du CIBMTR (Center from International Blood and Marrow Transplantation Research) Appelbaum et coll. N Engl J Med 2007 7
13 Grâce aux nouveaux conditionnements d’intensité réduite, à l’élargissement du type de greffon, à l’amélioration de la prise en charge des complications infectieuses et des soins de supports et à l’évolution des indications, le nombre d’allogreffes réalisées a augmenté de 37% depuis 2005 (Fig. 2). En 2010, l’association de l’EBMT (European Bone Marrow Transplantation) a rapporté plus de 13 000 allogreffes en 2010 6 dans 634 centres (Fig. 3).
Cependant, ce traitement reste une des thérapeutiques les plus lourdes en médecine. Parmi les enjeux actuels de l’allogreffe, deux points majeurs se dégagent : la compréhension des mécanismes immunologiques de la réaction du greffon contre la tumeur afin de diminuer la rechute et celle de la réaction du greffon contre l’hôte qui reste actuellement la principale cause de morbi-mortalité liée au traitement.
Figure3. Evolution du nombre de premières allogreffes en Europe entre 1990 à 2011
14
3. Les étapes de l’allogreffe
L’allogreffe de CSH peut être décrite en 4 grandes étapes :
1- Le conditionnement qui permet la destruction de l’hématopoïèse résiduelle et d’obtenir un état d’immunodépression de l’hôte pour éviter le rejet du greffon (Fig.4).
2- La transfusion des CSH correspondant traditionnellement au jour zéro J0. 3- La reconstitution hématologique. L’aplasie dure entre 12 et 30 jours.
4- La reconstitution immunologique qui peut nécessiter plusieurs mois voire plusieurs années.
4. Les indications
Initialement réservées aux leucémies aiguës et aplasies médullaires, les indications de l’allogreffe des CSH se sont peu à peu élargies à d’autres hémopathies malignes telles que les syndromes myélodysplasiques, certains syndromes myéloprolifératifs, les hémopathies lymphoïdes (lymphome, myélome, leucémie lymphoïde chronique…), des pathologies non malignes telles que les hémoglobinopathies (thalassémie β majeure, drépanocytose), des déficits immunitaires, certaines maladies métaboliques (la leucodystrophie, l’ostéopétrose). La réalisation d’allogreffes de CSH dans la prise en charge des tumeurs solides est rare et encore à l’état de recherche (57 cas en 2010). Les principales indications d’allogreffe de CSH établies sont les leucémies aiguës myéloïdes (LAM) de pronostic intermédiaire et défavorable en première rémission complète (RC1), les LAM en RC2 et RC3, les leucémies aiguës lymphoblastiques de haut risque en RC1, la myélofibrose primaire ou secondaire, les aplasies
15 médullaires selon l’âge et la réponse au traitement et les syndromes myélodysplasiques de risque élevé. Ces indications dépendent de l’âge et des co-morbidités du patient et de la disponibilité d’un greffon 31.
Les indications évoluent en fonction des évaluations de l’efficacité et de la toxicité de l’allogreffe, de l’arrivée de nouvelles thérapeutiques ciblées et du progrès de la biologie (en particulier la cytogénétique, la biologie moléculaire et la cytométrie en flux) (Fig 5 et 6).
Figure 5. Evolution des
indications d’allogreffes selon les pathologies
Rapport de l’EBMT 6
Figure 6. Indications d’allo-CSH en Europe en 2011 (1ère allo-CSH- EBMT) AML : leucémie aigüe myéloblastique ALL : leucémie aigüe lymphoblastique MDS/MPS : syndrome
myéloprolifératif/myélodysplasique CLL : leucémie lymphoïde chronique PCD : dyscrasie plasmocytaire HD : lymphome de Hodgkin NHL : lymphome non-hodgkinien Solid tumors : tumeur solide BMF : aplasie médullaire
Hemo/thal : hémoglobinoathies/thalassémie PID :déficit immunitaire primaire
IDM : AID :
16
5. Les sources de greffon
Il existe 3 sources de greffon possibles (Fig. 7) :
- La moelle osseuse prélevée sous anesthésie générale
- Les cellules souches périphériques. A l’état normal, en dehors de toute stimulation, la concentration sanguine en progéniteurs hématopoïétiques est extrêmement faible, ne permettant pas un recueil suffisant. Certains facteurs de croissance ou chimiothérapies permettent de mobiliser ces cellules souches médullaires dans le sang périphérique.
- Le sang de cordon ombilical
6. Choix du donneur
Le choix du greffon se fait en premier lieu sur la compatibilité des systèmes HLA du donneur et du receveur. Le système HLA regroupe un ensemble de plus de 200 gènes regroupés sur une région du bras court du chromosome 6 et qui, pour un certain nombre d’entre eux, sont impliqués dans la réponse immunitaire. Cette région est divisée en 3 parties, appelées HLA de classe I, II et III 32. Les gènes du système HLA ont pour caractéristique commune d’être
particulièrement polymorphes, exprimés de façon co-dominante et transmis à la descendance par haplotype complet.
Le système HLA de classe I est constitué d’une vingtaine de gènes. Il est exprimé par la majorité des cellules nucléées de l’organisme et par les plaquettes. Les loci A, B et C sont véritablement impliqués dans le fonctionnement du système immunitaire. La fonction
Figure 7. Répartition des sources de greffon chez les patients allogreffés en Europe en 1990 et 2011 (rapport de l’EBMT)
17 essentielle de ces molécules HLA classe I est de présenter en surface les antigènes provenant des pathogènes qui se répliquent dans le cytoplasme. Ces antigènes sont alors reconnus par les cellules T cytotoxiques CD8+. Le système HLA de classe II est exprimé par les cellules présentatrices d’antigène, principalement les macrophages, les cellules dendritiques, les lymphocytes B et les lymphocytes T activés. Les principaux loci sont DR, DQ et DP. Les molécules HLA classe II lient les peptides dérivés d’antigènes internalisés dans les compartiments endosomiques de la cellule. Ces antigènes sont alors reconnus par les lymphocytes T auxiliaires naïfs dans l’étape initiale des réponses immunitaires. Les lymphocytes T du receveur peuvent reconnaître les antigènes du donneur et provoquer un rejet de greffe. A l’inverse, les lymphocytes du donneur peuvent reconnaître les antigènes du receveur et entraîner une GVHD.
La sélection du donneur est donc capitale dans la réussite d’une greffe de CSH. On peut définir:
6.1. Les donneurs vivants o Les donneurs apparentés:
Génoidentiques: correspondant aux frères et soeurs avec une compatibilité HLA 10/10.
Haplo-identiques : correspondant aux parents ou aux « demi-frère ou sœur », le patient et le donneur sont donc semi-compatibles
o Non-apparentés : Dans 70% des cas, un donneur intra-familial n’existe pas, si bien qu’un donneur extra-familial doit être recherché dans une base mondiale de données appelée Bone Marrow Donors Worlwide (BMDW). Le greffon est prélevé chez un volontaire sain, inscrit sur un fichier. Le fichier international compte à présent plus de 18 millions de donneurs. Les chances de trouver un donneur sont de 30 à 40 %. En fait, il existe un déséquilibre de liaison des antigènes HLA dans la population qui rend la distribution des chances peu homogène. Pour certains patients on admet un certain degré d’incompatibilité (mismatch) HLA 9/10.
6.2 Le sang de cordons placentaires
18 Après la compatibilité HLA, d’autres facteurs rentrent en compte dans le choix du donneur tels que la richesse du greffon pour les unités de sang placentaires, le statut sérologique pour le cytomégalovirus, l’âge du donneur, le sexe du donneur (en évitant les donneurs féminins et allo-immunisés) et le groupe sanguin ABO rhésus.
7. Le conditionnement
Il existe deux grands types de conditionnement en allogreffe de CSH : le conditionnement myéloablatif et le conditionnement d’intensité réduite 31, 33.
7.1. Le conditionnement myéloablatif :
Le conditionnement dit myéloablatif conventionnel consiste à détruire, dans un premier temps, les cellules tumorales du receveur par une chimiothérapie et/ou une radiothérapie à forte intensité avant d’injecter les cellules souches saines d’un donneur. On a donc un effet myéloablatif et immunosuppresseur. La toxicité de ce type de conditionnement est importante (mucite, aplasie prolongée, maladie veino-occlusive…) rendant ce traitement inadapté aux personnes de plus de 50-55 ans et/ou ayant des comorbidités.
7.2. Le conditionnement d’intensité réduite :
Réduire l’intensité du conditionnement a pour principal objectif de diminuer la toxicité et donc la mortalité liées à la greffe ; l’effet anti-tumoral repose alors moins sur le conditionnement que sur l’effet GVL. Le conditionnement n’étant pas totalement myéloablatif, les cellules hématopoïétiques du receveur et du donneur cohabitent initialement, créant un chimérisme hématopoïétique. Il est maintenant bien démontré qu'un chimérisme mixte qui persiste est associé à une augmentation du risque de rechute chez les patients greffés. Il doit être converti en chimérisme complet du donneur, notamment par l’injection de lymphocytes du donneur (DLI) afin favoriser l’effet GVL.
Ces trois caractéristiques, à savoir la faible toxicité du conditionnement, la présence d’un chimérisme mixte transitoire et la myélo-suppression transitoire définissent les conditionnements à intensité réduite. Cette procédure a montré une réduction considérable de la morbidité à court terme et de la mortalité non liée à la rechute rendant cette thérapeutique accessible à des patients qui ne pouvaient en bénéficier auparavant.
19
8. Réaction du greffon contre la leucémie ou contre la tumeur (GVL ou
GVT)
Outre les cellules présentatrices d’antigènes, les cellules immunitaires impliquées dans l’effet GVL sont principalement les lymphocytes T CD4 et CD8 et les cellules NK. Les antigènes cibles sont principalement les antigènes mineurs d’histocompatibilité, et les peptides polymorphiques présentés par les molécules HLA des cellules du receveur. L’immunogénicité des antigènes mineurs d’histocompatibilité résulte le plus souvent d’un polymorphisme d’un ou de quelques nucléotides dans les gènes homologues du donneur ou du receveur 34. Lorsque
les lymphocytes T du donneur réagissent contre un antigène mineur d’histocompatibilité du receveur largement exprimé tant sur ses cellules hématopoïétiques que sur les cellules endothéliales, ils causent non seulement non seulement un effet de la greffe contre la tumeur mais également une GVH. En revanche, lorsque les lymphocytes T réagissent contre un antigène mineur d’histocompatibilité exprimé uniquement à la surface des cellules hématopoïétiques du receveur, ils induisent un effet de la greffe contre la tumeur, particulièrement dans le cadre des greffes haploidentiques chez les patients atteints de leucémie myéloïde aiguë dont les cellules n’exprimaient pas la molécule HLA-C nécessaire à l’engagement du récepteur inhibiteur (Killer Inhibitory Receptor [KIR]) des cellules NK du donneur . La production d’anticorps par les lymphocytes B a également été associée à un effet de la greffe contre la tumeur. Plus spécifiquement, la présence d’anticorps contre des gènes exprimés par le chromosome Y chez des patients chez des patients masculins ayant reçu une greffe d’un donneur féminin est associée à une diminution du risque de rechute et à une augmentation du risque de GVH chronique 35.
9. Complications
9.1. Complications infectieuses
Trois phases d’immunodépression entraînent une vulnérabilité spécifique vis-à-vis d’agents infectieux 36.
La première phase correspond à la période de neutropénie (polynucléaires neutrophiles inférieurs à 0,5 109/L) précédant la prise de greffe. Sa durée varie considérablement selon le type de conditionnement. Pendant cette période, le patient présente un déficit des fonctions phagocytaires. Il en résulte une susceptibilité accrue vis-à-vis des bactéries (bacilles gram
20 négatif et cocci gram positif) et des champignons (en particulier Aspergillus) présents dans la flore du tube digestif, sur la peau ou de l’environnement du patient.
La deuxième phase survient après la prise de greffe et se poursuit les 3 premiers mois. Les fonctions phagocytaires sont restaurées mais il existe un déficit de l’immunité à médiation cellulaire, qui peut être accru par la survenue de GVH. Cette immunodépression entraîne une sensibilité particulière vis-à-vis des virus, en particulier le cytomégalovirus (CMV). Les infections à Aspergillus ou Pneumocystis jiroveci sont également fréquentes pendant cette période en l’absence de prophylaxie.
La troisième phase survient après le troisième mois. Il existe un déficit de l’immunité cellulaire et humorale pouvant être exacerbé par une GVH chronique. Le CMV, le virus varicelle-zona, les virus respiratoires, l’Epstein-Barr Virus (EBV) -responsable du syndrome lymphoprolifératif post-transplantation lié à l’EBV- et les germes encapsulés sont autant de germes potentiellement pathogènes pour le patient allogreffé.
9.2. Complications liées à la toxicité du traitement - Complications d’origine endothéliale
o La maladie veino-occlusive également appelée syndrome d’obstruction sinusoïdale du foie se présente cliniquement sous la forme d’un ictère et d’une hépatomégalie douloureuse et d’une rétention hydro-sodée avec prise de poids. Sur le plan anatomo-pathologique, l’événement initiateur correspond à une altération de l’épithélium des sinusoïdes hépatiques par la chimiothérapie (alkylants principalement) 37. Des événements thrombotiques puis une occlusion des ces sinusoïdes peuvent aboutir à une hypertension portale. Cette complication survient entre 8 et 14% des cas avec un conditionnement myéloablatif et dans moins de 2% des cas avec un conditionnement atténué 38 .
o La microangiopathie thrombotique liée à l’allogreffe de CSH, la pneumopathie interstitielle diffuse
21 9.3. Les conflits immunologiques
9.3.1. Le rejet :
La prise de greffe est définie par le premier des trois jours consécutifs au cours desquels le taux de polynucléaires neutrophiles est supérieur ou égal à 0,5.109/L. Le rejet de greffe est
soit primaire soit secondaire après une prise de greffe initiale. Le rejet de greffe primaire est classiquement défini par une absence de prise de greffe 42 jours suivant la transplantation. Cette complication est rare. Les principaux facteurs de risque sont la faible richesse du greffon, les disparités HLA entre donneur et receveur, la présence chez le receveur d’un anticorps anti-HLA dirigé contre un antigène HLA présent chez le donneur, les greffes de fichier ou de sang de cordon, les greffes T-déplétées ainsi que les infections virales.
9.3.1. La maladie du greffon contre l’hôte (GVHD)
Elle correspond à une agression des organes du receveur par le système immunitaire et particulièrement les lymphocytes T du donneur. Fréquente, elle est à l’origine d’une morbidité et d’une mortalité non négligeables. Son mécanisme d’action et sa présentation clinique sont différents selon son caractère aigu ou chronique (Fig.8).
La GVH aiguë a été définie historiquement comme celle survenant dans les 100 premiers jours suivant l’allogreffe. La GVH chronique survient classiquement au-delà de 100 jours après la transplantation. Cependant, ces manifestations chroniques peuvent apparaître plus précocement ; inversement, des symptômes de GVH aiguë peuvent survenir au-delà de ce
Figure 8 . Cinétique de survenue de la GVH aigüe et de la GVH chronique
22 délai, notamment après réinjection de lymphocytes de donneur. En 2005, la conférence de consensus du NIH (National Institute of Health) a proposé que la définition de la GVH aiguë ou chronique soit fondée sur le type de manifestations cliniques plutôt que sur le moment de survenue par rapport à la greffe (Tableau I). Ainsi, à côté des GVH aiguës et chroniques classiques survenant dans les délais habituels avec des signes cliniques de type purement aigu ou chronique, certains patients présentent des GVH aiguës tardives , récidivantes, persistantes, et d’autres associent des signes de GVH chronique et aiguë, ce qui correspond à des formes de chevauchement.
La GVHa sera traitée dans la deuxième partie.
La GVH chronique est une pathologie de type allo-immun, secondaire à la reconnaissance de certains antigènes du receveur par les cellules immunocompétentes du donner. Elle survient chez 40 à 70% des patients après allogreffe de CSH dont elle représente la principale complication à moyen et court terme39. Les facteurs de risque de GVH chronique établis sont l’âge du patient (un patient âgé a plus de risque de développer une GVH chronique qu’un patient jeune), un antécédent de GVH aiguë, un donneur de sexe féminin avec un receveur de sexe masculin, l’existence d’un incompatibilité HLA, un donneur non-apparenté, l’infusion de lymphocytes du donneur, l’utilisation de CSP mobilisées par GCS-F (Granulocyte Colony Stimulating Factor) (en comparaison à la moelle osseuse) comme source du greffon40, 41. La
GVH chronique présente des similarités avec des maladies auto-immunes telles que la sclérodermie, le lupus érythémateux, le syndrome de Sjögren, la polyarthrite rhumatoïde, le lichen plan, la bronchiolite oblitérante ou encore la cirrhose biliaire primitive.
Les manifestations cliniques de la GVH chronique les plus fréquemment observées sont les atteintes cutanées (65 à 80%) buccales (48-72%), hépatiques (40-73%) et oculaires (18-47%). La médiane de survenue de la GVH chronique est de 6 mois après la greffe et la majorité des
23 cas se déclarent dans les 2 ans. La prévalence de la GVH chronique commence à diminuer à partir de 2-3 ans. Cependant, près de 20% des patients présentant des symptômes de GVH chronique nécessitent un traitement immunosuppresseur jusqu’à 5 ans après la greffe42.
La GVHD demeure un problème majeur en allo-CSH. Elle est, avec la rechute de la maladie, une des principales causes de mortalité post-allogreffe rapportée entre 15 et 20% selon les séries (Fig.9).
Figure 9. Causes de mortalité post-allogreffe (si donneur non-apparenté) 2010-2011. CIBMTR
24
Partie 2. La GVH aiguë
1. Atteintes cliniques et descriptions histologiques
Elle se produit chez 30 à 50 % des patients allogreffés. Les organes les plus souvent atteints sont la peau, le tube digestif et le foie. Au stade initial, la GVHa cutanée touche avec prédilection les faces palmaires des mains et des pieds. L’atteinte cutanée se présente sous la forme d’un rash cutané pouvant évoluer vers des bulles dans les formes les plus sévères. L’atteinte digestive comprend des nausées, des douleurs abdominales, une diarrhée aqueuse voire des rectorragies. La GVHa hépatique se manifeste par une cholestase. La sévérité de l’atteinte de la GVHa se cote du grade I pour les formes les plus légères au grade IV pour les formes les plus sévères (Tableaux II et III).
Tableau II- classification en stades de la GVHa
25 Sur le plan histologique, en cas d’atteinte cutanée, des cellules T alloréactives attaquent avec prédilection les assises épithéliales basales de l’épiderme, entraînant une apoptose des cellules malpighiennes basales, voire dans les formes les plus graves de l’ensemble de l’épiderme (Fig 10 et 11).
Les lésions histologiques sont identiques dans le grêle et le côlon : nombreuses aspects apoptotiques dans la partie basale des glandes muqueuses puis destruction étendue des glandes remplacées par un tissu de granulation peu dense contenant des macrophages et des lymphocytes.
L’atteinte hépatique se caractérise par une agression des cellules épithéliales biliaires des canaux intra-hépatiques de petit calibre et se traduit par une cholestase.
Figure 10. Lésions de GVH aigüe cutanée : plusieurs corps de nécrose
kératinocytaires au niveau de l’assise basale de l’épiderme (flèches), associés à quelques lymphocytes en exocytose satellites (astérix) coloration Hématéine-éosine-safran (HES), grossissement X200 (avec l’aimable autorisation du Dr Bossard, CHU Nantes)
Figure 11. Lésions de GVH aigüe colique : Corps de nécrose
apoptotique dans le fond des cryptes glandulaires de la muqueuse colique (flèches) coloration
Hématéine-éosine-safran (HES), grossissement X400 (avec l’aimable autorisation du Dr Bossard, CHU Nantes)
26
2.
Physiopathologie
Deux facteurs importants sont à considérer dans la physiopathologie de la GVHa : 1) une réaction inflammatoire exagérée médiée par les lymphocytes du donneur, lymphocytes qui réagissent de façon approprié dans un environnement étranger ; 2) les lésions, au niveau des tissus du receveur, dues à la pathologie sous-jacente, à des infections et/ou au conditionnement de l’allo-CSH. Les modèles murins ont été d’une grande importance dans l’identification de ce phénomène et les modèles canins ont permis, initialement, de développer des thérapeutiques prophylactiques de la GVHa43. Basée principalement sur ces
expériences fondamentales, la GVHa peut être résumée en 3 étapes principales :
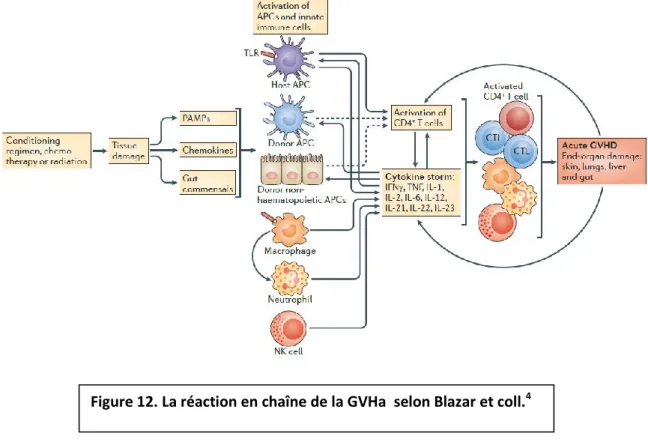
- (1) L’étape initiale de la GVHa est l’activation de cellules présentatrices d’antigènes (CPA) par les signaux de dangers exprimés par les lésions tissulaires (damage-associated molecular patterns, DAMPs) et / ou par des pathogènes (pathogen-associated molecular patterns, ou PAMPs ou lipopolysaccharide)4.
- (2) suivent l’activation, la prolifération, la différenciation et la migration des lymphocytes T du donneur.
- (3) ces lymphocytes T du donneur et autres effecteurs immuns induisent des lésions tissulaires.
Les cytokines inflammatoires qui recrutent et induisent la prolifération de cellules effectrices immunes supplémentaires, perpétuent le cycle de l’alloréactivité et de l’inflammation au niveau des tissus endommagés44.
27
2.1. 1ère étape : activation des CPA
La phase d’initiation implique de multiples cible et acteurs (Fig.12).
2.1.1. La disparité HLA
L’incompatibilité majeure HLA représente la principale cause de GVHa. L’identification d’un donneur HLA compatible n’étant pas possible pour chaque patient, de multiples études sur les incompatibilités HLA ont été réalisées. Plusieurs combinaisons d’incompatibilité HLA associées à un risque de GVHa sévère ont été identifiées45. Récemment, l’identification de
substitutions d’acides aminés au niveau de la pochette captant l’antigène des molécules HLA de classe I HLA-B et HLA-C a été associée à un risque élevé de développement de la GVHa46. Cette étude suggère de sélectionner un donneur non-apparenté en évitant les
substitutions d’acides aminés en position 99 et 116 de molécule HLA classe C et en position 9 de la molécule HLA classe B entre le receveur et le donneur. Les antigènes mineurs d’histocompatibilité (miHA) sont aussi impliqués dans la physiopathologie de la GVHa, en
28 particulier lors d’une allogreffe avec un donneur compatible apparenté. Une des différences de miHA les mieux étudiées implique les réponses immunes contre les antigènes du chromosome Y développées lors de la combinaison d’une donneuse et d’un receveur de sexe masculin, faisant préférer la sélection d’un donneur masculin. La présence de miHA sur des chromosomes autosomes a aussi été décrite comme facteur de risque de développement d’une GVHD47. Finalement, les différences de combinaisons entre les récepteurs inhibiteurs des
cellules NK (killer inhibitory receptor KIR) et les ligands des KIR entre le receveur et le donneur peuvent intervenir dans la physiopathologie de la GVHa ajoutant de la complexité à l’identification des déterminants antigéniques48, 49.
2.1.2. Déterminants non génétiques
Plusieurs déterminants non génétiques ont été identifiés, principalement des signaux de dangers, les DAMPs et/ou les PAMPs. Les DAMPS inclus les composants de la matrice extra-cellulaire (MEC), l’ATP et l’acide urique. L’héparine sulfate, composant de la MEC et agoniste du TLR4, peut promouvoir la réponse allo-immune des lymphocytes T. Elle est élevée dans la GVHa chez l’homme et dans les modèles murins, mais cette augmentation n’a pas été retrouvée au niveau des lésions tissulaires de GVH50. L’ATP relarguée par les cellules
« en apoptose » est capable d’induire une réaction inflammatoire. De plus la neutralisation de l’ATP ou de son récepteur au niveau des cellules du système immunitaire, P2X7R, entraîne
une diminution du développement de GVH dans des modèles expérimentaux51. L’acide urique
peut aussi agir tel un DAMP par la production IL-1β médiée par l’inflammasome NLRP352.
S’ajoutant aux signaux endogènes de dangers, les PAMPS associés aux infections virales et bactériennes participent au développement d’un milieu inflammatoire53. Cependant, certains PAMPS ne sont pas associés au développement de la GVHD. Ainsi, Hossain et al ont montré dans un modèle expérimentale de GVHD que la flagelline, composant des flagelles des bactéries et agoniste du TLR5, était associée à une diminution d’incidence de GVHD et participait à une meilleure reconstitution immunitaire54.
Les CPA capables de contribuer à la réaction de GVHD peuvent provenir de l’hôte ou du greffon. Ayant un rôle majeur dans l’initiation de la GVHD55, 56, les CPA du donneur
représentent une cible intéressante dans la prévention de la GVHD. Cependant, Li et al ont montré, sur un modèle animal, que la déplétion de cellules dendritiques, des cellules de Langerhans et des cellules B de l’hôte n’empêchait pas le développement de la GVHD. De
29 plus la déplétion des macrophages de l’hôte des organes lymphoïdes entraînait une exacerbation du développement de la GVHD, révélant un probable rôle protecteur57. Le rôle exact des différentes catégories de CPA restent donc à définir. Koyama et al ont montré un rôle majeur de CAP non-hématopoïétiques dans l’induction de la GVHD, avec une capacité 100 à 1000 fois supérieure aux CPA hématopoïétiques du donneur et du receveur.
2.2. 2ème étape : activation des lymphocytes T du donneur
L’activation des lymphocytes T requiert deux types de signaux de stimulation. Premièrement, le récepteur des lymphocytes T (TCR) doit être engagé et reconnaître les antigènes dans un contexte HLA. Récemment, une population de lymphocytes T exprimant un double TCR, résultant potentiellement de processus aléatoire durant la sélection thymique, a été identifiée avec une alloréactivité majeure dans la GVHD chez l’homme58. Secondairement, un signal de
co-stimulation par les CPA est nécessaire à l’activation des lymphocytes T qui acquièrent alors des fonctions effectrices. Plusieurs ligands/récepteurs de co-stimulation ont été décrits dans la physiopathologie de la GVHD, tels que B7/CD28/CTLA4, CD30/CD30L, CD40/CD40L, OX40/OX40L et ICOS/ICOS-L59. Après activation, ces lymphocytes T
prolifèrent et migrent en réponse à un milieu inflammatoire60 et à l’activation de leurs
récepteurs aux chémokines telles que CCR261, CCR562, CCR663 ou CCR764. L’expression de
ces récepteurs varie selon les différentes populations de lymphocytes T dans le sang périphérique modifiant le homing de ces lymphocytes T activés à différents tissus. Ainsi, une diminution du nombre de lymphocytes T CCR6+ a été observée chez les patients présentant une GVHa due au homing de ces lymphocytes CCR6+ au niveau des tissus cibles CCL2065.
De façon similaire, Avanzini et al ont montré une diminution de la proportion de lymphocytes T CD8+CD45RAβ7integrin+ chez les patients présentant une GVHa digestive66, bien qu’une
augmentation de lymphocytes T mémoires CD8+α4β7integrin+ a aussi été décrite au cours de la GVHa67. Les lymphocytes T naïfs du donneur ont un rôle majeur dans la physiopathologie de la GVHa68, 69. Les lymphocytes T mémoire sont moins alloréactifs et ne semblent pas, à un tel degré, initier les manifestations de GVHD70-72. Cependant, les lymphocytes T mémoire participent à la poursuite de la GVHD73.
D’autres types cellulaires participent à la réaction inflammatoire de la GVHa, tels que les polynucléaires neutrophiles (PNN), les cellules NKT, les cellules NK, les cellules dendritiques plasmacytoïdes. Les PNN sont produits rapidement après allogreffe et sont des
30 effecteurs secondaires dans la GVHa. Ils sont recrutés dans les organes cibles par des cytokines dont IL-874. Concernant les cellules NK, les études de bioluminescence ont montré une circulation et une prolifération similaire à ceux des lymphocytes T après infusion, bien que les cellules NK n’initiassent pas la GVHD dans ce modèle75. Le rôle des lymphocytes B est principalement décrit dans la pathogénèse de la GVH chronique76-79 ; quelques études ont
rapporté une diminution d’incidence de GVHa après des greffes B déplétées80, 81.
D’autres types cellulaires agissent tels des suppresseurs de GVHa, diminuant l’inflammation et promouvant l’immuno-tolérance. Plusieurs études ont montré l’efficacité des lymphocytes T régulateurs (Treg) dans la prévention et traitement de la GVHa82-84. Les mécanismes suppressifs de Treg sont multiples parmi lequels la diminution de l’expression du TLR585, 86. Une autre population de lymphocytes CD4+, les cellules Th9, a récemment été décrit dans un modèle murin de GVHa87 . Les cellules Th9 sécrètent de l’IL-9 et diminuent la sécrétion d’interféron gamma (IFNγ) réduisant la réaction de GVHa tout en préservant l’effet du greffon contre la maladie (GVT). Leur implication dans la GVHa chez l’homme n’a pas été décrite. Les cellules myéloïdes suppressives (MDSC) peuvent atténuer la GVHa par de multiples mécanismes88, 89. Plusieurs équipes ont décrit les cellules iNKT (invriant NKT)
comme facteur protecteur de développement de la GVHa90, 91.
L’activation des cellules immunitaires entraînent des cascades biochimiques intracellulaires induisant la transcription de gènes de nombreuses protéines, dont les chémokines, les cytokines et leurs récepteurs.
Les cellules Th1 et les cytokines associées (interféron γ, IL-1, IL-2, IL-6, IL-12 et TNFα) sont sécrétées en quantité importante pendant la GVHa.
- La production IL-2 par les lymphocytes T du donneur est une des cibles principales des thérapeutiques de la GVHa telles que la ciclosporine, le tacrolimus et certains anticorps. Cependant les données concernant le rôle de l’IL-2 sur les Tregs suggèrent que bloquer IL-2 peut aussi diminuer l’immuno-tolérance92, 93
- L’interféron γ (IFNγ) possède de multiples fonctions et peut amplifier ou réduire la GVH. Il peut accentuer ce phénomène en augmentant l’expression des molécules telles que les récepteurs des chémokines, les protéines du CMH, et les molécules d’adhérence. Il accentue aussi la sensibilité des macrophages et des monocytes aux stimuli tels que le LPS. L’IFNγ peut aussi amplifier la GVHa en endommageant
31 directement l’épithélium du tractus digestif ou cutané. A l’inverse, cette cytokine peut diminuer la GVH en accélérant le processus d’apoptose des lymphocytes T activés94. Plusieurs études ont montrée l’implication des cellules Th17, caractérisées par la production IL-17A, IL-17F, IL-21 et IL-22, dans la physiopathologie de la GVHa. Les études initiales ont rapporté que le manque de cellules du donneur de type Th17 favorisait la différenciation en Th1 et exacerbait la réaction de GVHa95. Le transfert adoptif de cellules polarisées in vitro Th17 entraînait l’apparition de GVHa léthale96, alors que la GVHa n’était pas modifiée quand
la différentiation Th17 était abrogée pat la délétion du gène codant pour le facteur de transcription RORγt spécifique aux cellules Th17. Ces données démontrent que les cellules Th17 sont importantes mais non indispensables pour induire une GVHa.
Récemment, plusieurs études ont montré l’implication de l’IL-22 dans la physiopathologie de la GVHa. Le déficit d’IL-22 chez le receveur entraîne une augmentation de l’apoptose des cryptes intestinales, une déplétion des cellules souches intestinales et une perte de l’intégrité de l’épithélium intestinal97. Couturier et al ont montré, dans un modèle murin d’allogreffe,
que le déficit de production d’IL-22 par les cellules T du donneur induisait une diminution de la sévérité de la GVHa tout en préservant l’effet du greffon contre la leucémie98.
2.3. 3ème étape : phase effectrice induisant des lésions tissulaire
Les lymphocytes T cytotoxiques, les cellules NK, les cellules NKT et macrophages entraînent alors des lésions tissulaires en réaction, correspondant à la phase effectrice99. Les lymphocytes T cytotoxiques utilisent principalement la voie Fas/FasL dans la GVH digestives et la voie perforine/granzymes dans la GVHa cutané et hépatique100, 101. Les chémokines dirigent la migration des lymphocytes T du donneur depuis les tissus lymphoïdes vers les organes cibles qui vont être lésés.
Les cellules T ont été les principales cellules étudiées dans la GVHD et la plupart des traitements prophylactiques ou curatifs ont pour but de diminuer l’activité de ces effecteurs. Durant la phase effectrice, le phénomène inflammatoire se majore rapidement induisant des lésions des tissus cibles. La cascade inflammatoire peut entraîner la sécrétion de biomarqueurs de la GVHa dans la circulation sanguine reflétant l’activation des cellules effectrices ainsi que les lésions tissulaires. Ces biomarqueurs tels que le CD30 sur les lymphocytes T activés102,
32 elafin (spécifique de la GVHa cutanée)103, regenerating islet-derived 3-alpha (REG3α,
spécifique de la GVH digestive)104, suppressor of tumorigenicity 2 (ST2, un membre de la famille des récepteurs de IL-1- fixant IL-33)105 peuvent même apparaître avant la survenue de signes cliniques et représentent de possibles facteur prédictifs de la gravité de la GVHa et de la réponse au traitement.
2.4. Implication de l’endothélium
Dans un modèle murin, des études ont montré que les cellules endothéliales pouvaient être une cible précoce de la réaction allogénique et qu’elles étaient détruites par un mécanisme d’apoptose médié par la ligation de Fas 106, 107. Ces lésions endothéliales n’étaient pas uniquement retrouvées dans les organes cibles classiques de la GVHa mais étaient retrouvées dans tous les organes étudiés. Ces données expérimentales étaient novatrices, puisque les cibles classiques de la GVHD aiguë sont les cellules épithéliales de la peau, du foie et du tube digestif. Ertault-Daneshpouy et al ont montré, chez l’homme, qu’il existait des atteintes endothéliales dans la GVHa digestive, et ces atteintes étaient corrélées à la sévérité de la GVHa touchant la microcirculation par une apoptose endothéliale, associée à des hémorragies péricapillaires dans les cas les plus sévères 108.
La très grande surface de l’endothélium en contact avec le flux sanguin a encouragé à rechercher des molécules spécifiques de l’endothélium endommagé relarguées dans le plasma. Plusieurs études ont montré une augmentation de molécules d’adhérence endothéliale (telle que ICAM-1) fortement exprimées après l’allo-CSH les molécules d’adhérence solubles (telle que la thrombomoduline) et les facteurs de croissance (le facteur de croissance hépatocytaire (HGF) et l’angiopoïétine 2 (ANG2)) dans la GVHa ou spécifiquement dans la GVHa réfractaire aux corticostéroïdes ont été étudiées 109-111. Récemment, Rachakonda et al
ont étudié sept polymorphismes nucléotidiques (SNP) de la thrombomoduline chez plus de 600 patients allogreffés112. Cette étude met en évidence le pouvoir prédictif des SNP de la
thrombomuduline concernant la mortalité liée à la GVHD mais pas la survenue de la GVHa. Ces résultats sont en faveur de l’implication des cellules endothéliales en particulier dans la GVHa réfractaire.
33
3. Prophylaxie et traitement
3.1. Phase de traitement
Plusieurs paramètres déterminent l’indication d’un traitement pour la GVHa, incluant l’histoire de la maladie et de l’allogreffe, les données de l’examen clinique et des analyses biologiques. Les manifestations cliniques les plus classiquement observées sont les atteintes cutanées (du rash maculo-papulaire aux lésions bulleuses), les atteintes digestives (nausées aux diarrhées sanglantes) et l’atteinte hépatique (cholestase). Bien que le système hématopoïétique, l’endothélium111, 113, les poumons ainsi que d’autres organes puissent être
atteints, le score actuellement utilisé de la GVHa ne prend en compte que les atteintes cutanées, digestives et hépatiques2. La GVHa peut être associée à une lymphopénie114, une hyperéosinophilie115 , une thrombopénie116 et une hypoalbuminémie114. L’examen histologique des biopsies a pour but de rechercher des signes de GVHa, principalement des corps apoptotiques, cependant non-pathognomonique de la GVHa et d’écarter d’autres diagnostics tels qu’une infection. L’intérêt par des techniques d’imagerie non invasives reste en cours d’évaluation117, 118. La décision de traitement est basée sur la sévérité des lésions. Le traitement systémique de première ligne est la corticothérapie.
Après institution du traitement, trois évolutions sont possibles : le phénomène inflammatoire de la GVHa est (i) complètement résolutif, (ii) partiellement résolutif cliniquement aboutissant à un état de « lésions persistantes » et (iii) réfractaire au traitement. Le mécanisme d’action des corticostéroïdes sur la GVHa n’est pas complètement élucidé, cependant leur effet lymphocytique et leur rôle dans l’altération des molécules d’adhérence sont impliqués dans leur efficacité contre la GVHa119. En cas de réponse à la corticothérapie, les signes
cliniques de la GVHa sont rapidement résolutifs avec une évolution concordante des biomarqueurs120. Une diminution du nombre de lymphocytes et de monocytes peut être
secondaire à la corticothérapie, cependant une leucopénie sévère (<200/mm3) et une réduction
majeure du nombre total de leucocytes pendant la corticothérapie sont associées à une diminution du taux de réponse de la première ligne de traitement121. Dans le cas d’une GVHa
sévère, il a été montré qu’il persistait une atteinte du système hématopoïétique et des fonctions immunologiques, de l’endothélium et, cela, associé à un risque plus élevé de mortalité 122. Chez une partie de ces patients, l’évolution se fait vers une GVH chronique. Le mécanisme faisant le lien entre un épisode de GVHa et de GVH chronique reste imparfaitement compris. L’incapacité des cellules NK d’éradiquer les lymphocytes T CD4+
34 activés de façon permanente par une stimulation antigénique est un des mécanismes avancés123.
La réponse de la GVHa est difficile à prédire à l’institution du traitement. Près de 50% des patients n’obtiennent pas de réponse complète lors de la première de ligne par corticothérapie124, et le temps de détermination de non-réponse à la corticothérapie est
primordial pour la mise en place d’un traitement de rattrapage. Les facteurs de risque de mauvaise réponse à la corticothérapie sont les GVH hyper-aiguës125, un greffon de sexe
féminin et un receveur de sexe masculin125 et certaines atteintes organiques124. Récemment,
Vander Lugt et al ont identifié le biomarqueur ST2, récepteur de l’IL-33126, qui est corrélé
avec le risque de résistance de la GVHa au traitement de première et ligne et au taux de mortalité105. Durant la phase inflammatoire d’une GVHa réfractaire d’autres biomarqueurs de
mort cellulaire peuvent être observés au niveau des cellules épithéliales127. La survie chez les
patients atteints de GVHa réfractaire à la corticothérapie est d’environ 15% à 2 ans125.
3.2. Prophylaxie
Sur la base d’études pré-cliniques sur des modèles canins, le méthotrexate (MTX) post-allogreffe fut la première drogue largement utilisée en clinique128, suivi par l’introduction de
la ciclosporine129. Le méthotrexate et la ciclosporine exercent une activité anti-proliférative
sur les lymphocytes T du donneur en interférant avec la synthèse des purines et sur la voie de transduction du signal calcium-dépendante du TCR.
De nos jours, le traitement prophylactique de la GVHa inclut 2 drogues : (i) un inhibiteur de la calcineurine et (ii) du méthotrexate ou du mycophenolate mofétil (MMF), ce dernier étant principalement utilisé dans les allogreffes à conditionnement réduit ou dans les allogreffes de sang de cordons placentaires130. Les corticostéroides ne sont habituellement pas utilisés en
prophylaxie en raison d’une efficacité non prouvée et de leur potentialisation du risque infectieux131. Il a aussi été montré une efficacité du siromilus, inhibiteur de mTOR, en prophylaxie et en traitement de la GVHa. Dans une étude de phase II, Pidala et al ont montré une diminution en terme d’incidence cumulative de GVHa au jour 100 de la greffe lors de l’utilisation de l’association sirolimus/tacrolimus au standard méthotrexate /tacrolimus132.
35 montré de différence significative concernant le critère principal qui était la survie sans GVHa à jour 114 après allo-CSH (Blood and Marrow Transplant Clinical Trials Network (BMT CTN) clinical trial 0402). De plus, une augmentation de maladies veino-occlusives a été observée lors de l’utilisation de l’association sirolimus/tacrolimus, en particulier après un conditionnement contenant du busulfan133.
Une autre approche prophylactique de la GVHa est la réalisation d’une allogreffe T déplétée avec, ex-vivo, une sélection des cellules CD34+ ou une déplétion des cellules CD3+ ou encore des lymphocytes T alpha-beta du greffon134 et, in vivo, l’utilisation de sérum
anti-lymphocytaire ou de l’alemtuzumab (anticorps anti-CD52). La sélection CD34+ des cellules de greffon permet une diminution majeure de la proportion de lymphocytes T mais ne les exclut pas totalement. Ce point est important dans les allogreffes haplo-identiques. Le cyclophosphamide après l’infusion du greffon est souvent utilisé dans ce type d’allogreffe, se basant sur son action lytique sur les lymphocytes T rapidement prolifératifs tout en épargnant les cellules souches et les Treg, possiblement due à une expression supérieure d’aldéhyde déshydrogénase dans les cellules souches et Treg 135. Cette manipulation in vivo du greffon
dans les allogreffes haplo-identiques permet d’obtenir une incidence cumulée de GVHa comparable à celle des allogreffes avec donneur génoidentique136, 137.
Une étude de phase I/II testant le maraviroc, un inhibiteur de CCR5 bloquant le chémoattraction des lymphocytes tout en préservant les fonctions effectrices, en prophylaxie de la GVHa, a montré une incidence faible de GVHa grade II-IV (15%) et l’absence de manifestation de GVHa digestive à 100 jours post-allogreffe chez 35 patients138. Les taux d’infections et de rechutes n’étaient pas significativement augmentés. Les injections de bortezomib, un immunomodulateur inhibant NF-ƘB, à J+1, +4 et +7 chez des patients ayant reçu une allogreffe de donneur non apparenté avec mismatch HLA en complément d’un traitement immunosuppresseur standard par tacrolimus et methotrexate , ont permis l’obtention d’un taux d’incidence cumulée de GVHa à J180 de 22%139. Finalement, Choi et
al ont montré dans une phase I/II que l’utilisation du vorinostat, utilisé pour ses effets tolérogènes sur les CPA et apoptotiques sur les lymphocytes T alloréactifs, donné 10 jours avant allogreffe jusqu’au jour 100 après allogreffe et associé un traitement par tacrolimus et MMF, permettait d’obtenir un taux de GVHa de grade II-IV de seulement 22% à J100140.
À l'heure actuelle, plusieurs essais de prophylaxie de la GVHa sont en cours, y compris l’association sirolimus, ciclosporine et MMF avant allogreffe non myéloablative
36 (NCT01251575), l'ustekinumab (IL-12/23 antagoniste) associé au tacrolimus et sirolimus (NCT01713400), le bortézomib associé à la ciclosporine et au méthotrexate chez des patients pédiatriques (NCT01926899), le vedotin brentuximab (ciblant CD30) en plus de tacrolimus et du méthotrexate pour allogreffe avec un donneur mismatch (NCT01700751), l'atorvastatine (NCT01665677), la déplétion des lymphocytes T CD45RA+ T(NCT01858740), la photophérèse extracorporelle (NCT01174940), la modification génique des lymphocytes T du donneur dans les allogreffes haplo-identiques (NCT01494103, NCT01744223), des Treg inductibles (NCT01634217), et la déplétion de lymphocytes T alpha-bêta (NCT01810120). En raison des multiples mécanismes impliqués dans la physiopathologie de la GVHa, on peut envisager qu’il existera différents standards selon le type de greffe réalisé.
3.3. Traitement initial de la GVHa
Le traitement de première ligne établi pour les patients nécessitant un traitement systémique est la corticothérapie à la dose journalière de 2 mg/kg141. Cependant une dose inférieure de
1mg/kg ne semble pas d’efficacité inférieure pour les GVHa de grade I/II142 permettant ainsi
d’éviter les effets secondaires de la corticothérapie. La détermination du statut de la réponse à la corticothérapie doit être réalisée dans les jours suivant l’initiation du traitement, de 7 à 10 jours en cas de non-réponse et même de 4-5 jours en cas de progression143. Alousi et al ont
testé dans l’étude BMT CTN 0302, en première ligne de traitement de la GVHa, l’association d’une des quatre drogues associées aux corticostéroïdes : l’etanercept, le MMF, la denileukin diftitox ou la pentostatine144. Dans cette étude, le taux de réponse complète à 28 jours de
traitement était de 60% pour le MMF, 26% pour l’etanercept, 53% pour la denileukin et 38% pour la pentostatine. Cependant, l’étude de phase III comparant corticostéroïdes plus MMF et corticostéroïdes plus placebo n’a pas permis de montrer un intérêt de l’ajout du MMF. De plus, l’utilisation du MMF était associée à plus d’épisode de leucopénies145. A l’heure actuelle, quelques études de phase I/II sont en cours telles qu’un essai testant le cannabidiol (NTC01596075), et pour les GVH grade III/IV un essai clinique testant un nouvel inhibiteur d’histone déacétylase LBH589 (NCT01111526).
37 La prise en charge de la GVHa réfractaire ou dépendante aux corticostéroïdes, qui aboutit à l’escalade du traitement immunosuppresseur, demeure un problème majeur pour la communauté de l’allogreffe. Il n’y a pas de traitement standard établi. Différents traitements sont utilisés tels que les inhibiteurs du TNF, le MMF, la pentostatin, la denileukin diftitox, des anti-récepteurs de l’IL-2, des anti-récepteurs de l’IL-6, des anti-CD20 ou anti-CD52 146. Plusieurs études ont rapporté l’utilisation de la photophérèse extracorporelle147 et l’injection
de cellules mésenchymateuses 148, 149. Les résultats restent cependant modestes avec des taux de réponse complète avoisinant les 20%. Les essais cliniques sur la GVH réfractaire actuellement en cours portent sur l’association du basiliximab et de l’infliximab (combinaison ciblant le récepteur de IL-2 et du TNFα , NCT01485055), le tocilizumab (ciblant le récepteur del’IL-6 , NCT01475162, NCT01757197), l’alpha-1 antitrypsine (NCT01523821, NCT01700036) et le brentuximab vedotin (NCT01596218).
3.5. Approches émergentes
De nouvelles approches thérapeutiques de la GVHa sont en cours de développement, principalement basées sur la meilleure connaissance sur le plan immunologique de la physiopathologie de la GVHa. Ces traitements incluent des molécules agissant sur une des étapes de la cascade de la GVHa, des thérapies à base de cytokines, ou des approches de thérapie cellulaire (infusions de Treg et autres populations) (Tableau IV).