HAL Id: tel-00521546
https://tel.archives-ouvertes.fr/tel-00521546
Submitted on 27 Sep 2010
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Dérégulation des activités chitinases : vers de nouvelles
perspectives de lutte contre les aphides
Julien Saguez
To cite this version:
Julien Saguez. Dérégulation des activités chitinases : vers de nouvelles perspectives de lutte contre les aphides. Sciences du Vivant [q-bio]. Université de Picardie Jules Verne, 2007. Français. �tel-00521546�
Université de Picardie Jules Verne
Faculté des Sciences – Ecole Doctorale Sciences et Santé
Thèse de Doctorat de l’Université de Picardie Jules Verne
Présentée parJulien SAGUEZ
Pour l’obtention du grade de Docteur
Dérégulation des activités chitinases :
vers de nouvelles perspectives de lutte contre les aphides
le 16 Février 2007
Jury :
M. M NICOLE, Directeur de Recherche à l’IRD Montpellier Rapporteur M. Y RAHBE, Directeur de Recherche à l’INRA Lyon Rapporteur M. E HAUBRUGE, Professeur à la Faculté de Gembloux Examinateur M. J-C LABERCHE, Professeur à l’Université de Picardie Co-directeur M. C VINCENT, Chercheur à Agriculture et agroalimentaire Canada Co-directeur M. P GIORDANENGO, Maître de conférences à l’Université de Picardie Directeur
Remerciements
Remerciements
Le programme POMRAV (Pommes de terres résistantes aux Ravageurs), dans lequel s'inscrit ce travail de thèse, n’aurait pu voir le jour sans le soutien financier du Fonds Social Européen, de la Région Picardie et du Comité Nord des Producteurs de Plants de Pommes de Terre. Il est également le fruit d’un partenariat avec Alternatech, la FREDON Picardie, le Service de Protection de Végétaux et Agriculture et agro-alimentaire Canada.
J’adresse mes remerciements aux Professeures SANGWAN et PREVOST pour leur accueil au sein de l’UPRES EA 3900 Biologie des Plantes et Contrôle des Insectes Ravageurs et du Laboratoire de Biologie des Entomophages. Un grand merci à Philippe GIORDANENGO, Charles VINCENT et Jean-Claude LABERCHE qui ont été mes « fils conducteurs » au cours de ce travail, pour la confiance qu’ils m’ont accordée en me confiant ce sujet, pour leur engagement scientifique, pour leur soutien rédactionnel et moral, pour les réflexions que nous avons eues sur le sujet et pour m’avoir permis de participer à plusieurs colloques internationaux. Ce fut un plaisir d’apprendre et de travailler à leurs côtés. Merci aux membres du jury qui ont accepté d’effectuer la critique de ce travail.
Je tiens à remercier celles et ceux qui m’ont accueilli dans leurs laboratoires, notamment les collègues de l’Unité EA 3900 mais aussi les membres (liégeois et non liégeois…) du Laboratoire d’entomologie fonctionnelle et évolutive de l’Université de Gembloux (Belgique). Que Anas Cherqui, Olivier Van Wuytwinskel et Frédéric Francis soient particulièrement remerciés pour m’avoir aidé à faire mes premiers pas dans leur domaine de prédilection, pour leurs conseils et leur investissement personnel.
Par crainte d’oublier de nommer certaines personnes, j’adresse mes remerciements à celles et ceux qui m’ont accompagné de près ou de loin jusqu’à aujourd’hui. J’ai une pensée pour celles et ceux qui m’ont donné le goût de la Biologie et surtout pour les personnes qui m’ont accompagné durant ces trois ans de thèse et qui m’ont permis de mener à bien ce travail en me faisant vivre des moments inoubliables. Je pense bien sûr à mes collègues de bureau présents au quotidien ou de passage, mes collègues du Labo pour les bons moments passés ensemble mais aussi à mes stagiaires qui ont contribué à l’avancée de ces travaux. Je n’oublierai pas mes amis de l’ED3C les membres des Conseils de Gestion et de l’Ecole Doctorale et le Président de l’UPJV, Georges FAURE.
Je terminerai en adressant un très grand merci à ma famille pour son soutien sans faille et de tous les instants.
Sommaire
Sommaire
Sommaire ... 3
Introduction ... 6
Synthèse bibliographique ... 9
1. La chitine ... 10 2. Les chitinases ... 11 2.1 Généralités... 12 2.2 Chitinases et microorganismes ... 12 2.3 Chitinases fongiques... 13 2.4 Chitinases végétales... 142.4.1 Chitinases végétales et développement... 14
2.4.2 Chitinases végétales et défense... 15
2.5 Chitinases animales ... 16
2.6 Insectes et chitinases... 16
2.6.1 Cuticule, chitinases et croissance des insectes... 16
2.6.2 Membrane péritrophique et chitinases ... 17
2.7 Chitinases et phytoprotection ... 19
3. Contrôle du métabolisme de la chitine ... 21
3.1 Inhibition des chitine synthases ... 21
3.2. Inhibiteurs de chitinases ... 22
3.2.1 L’allosamidine ... 22
3.2.2 Les styloguanidines... 24
3.2.3 Les cyclopentapeptides ... 24
3.2.4 Les dipeptides cycliques ... 25
3.2.5 La psammapline A ... 25
3.3 Importance de l’interaction entre inhibiteurs et site catalytique des chitinases ... 26
4. La Pomme de terre... 27
4.1 Taxonomie et botanique ... 27
4.2 Historique ... 27
4.3 Un légume d'importance économique ... 28
4.4 Maladies et ravageurs de la pomme de terre... 29
5. Les pucerons, des ravageurs de cultures... 31
5.1 Présentation ... 31
5.2 Biologie ... 31
5.3 Dégâts causés par les pucerons... 32
5.3.1 Dégâts directs... 32
5.3.2 Dégâts indirects ... 32
5.4 Lutte contre les pucerons... 33
Objectifs de l’étude ... 34
Chapitre 1 Impacts d’une stratégie « chitinase »
... 37
sur le puceron Myzus
persicae
Introduction... 38Discussion... 51
Chapitre 2 Stratégie « anti-chitinase » contre les aphides ... 54
Première partie
Pertinence de la stratégie « anti-chitinases »
Effet d’inhibiteurs de chitinases connus ... 55
Introduction... 56
Discussion... 62
Sommaire
Seconde partie
Vers de nouveaux inhibiteurs de chitinases
Purification et caractérisation des chitinases de pucerons ... 64
1. Introduction... 65
2. Matériel et méthodes... 67
2.1 Plantes et insectes ... 67
2.2 Purification des chitinases ... 67
2.3 Dosages protéique et enzymatique ... 67
2.4 Tests d’activité sur gel... 68
2.5 Inhibition des chitinases ... 68
2.6 Electrophorèses mono- et bi-dimensionnelles ... 68
3. Résultats... 69
3.1 Purification des chitinases ... 69
3.2 Inhibition de l’activité chitinolytique ... 70
3.3 Analyse de la protéine purifiée ... 70
4. Discussion... 71
Troisième partie
Identification de nouveaux oligosaccharides
aux propriétés aphicides ... 74
1. Introduction... 75
2. Matériel et Méthodes ... 76
3. Résultats... 77
4. Discussion... 78
Discussion générale... 80
Conclusions et Perspectives
Bibliographie
... 86
Annexes... 111
Annexe 1 : Dispositif expérimental de suivi in planta ... 112
Annexe 2 : Milieu artificiel pour l’élevage des pucerons... 113
Annexe 3 : Résultats de l’analyse en MALDI-TOF ... 114
Introduction
Introduction
Dès leur apparition sur Terre, et bien avant que l’Homme ne les domestique et ne les exploite, les plantes étaient la base de l’alimentation de nombreux herbivores et constituaient aussi des sources alimentaires indispensables au développement d’insectes phytophages. Les plantes servaient de substrat pour le développement de nombreux microorganismes bactériens, fongiques et viraux. Les attaques causées par les insectes et pathogènes ont nécessité des plantes qu’elles développent des mécanismes de résistance endogènes impliquant diverses voies métaboliques qui permettent de maintenir les populations à des taux suffisamment bas pour pérenniser les espèces végétales.
Parallèlement, les agresseurs ayant besoin des plantes pour s’alimenter, se développer et se reproduire, ont été contraints d'élaborer à leur tour des stratégies d’évitement ou de détoxification, pour s’adapter et contourner ces mécanismes de défenses. La régulation des mécanismes de défenses des plantes et les stratégies de résistance développées par les agresseurs caractérisent la co-évolution des espèces végétales et des espèces qu’elles hébergent. Quand l’Homme a commencé à cultiver les plantes, il a souhaité tirer le meilleur profit de ses cultures et a dû développer des méthodes de lutte contre les microorganismes (bactéries, champignons) pathogènes et les insectes phytophages, devenus des compétiteurs considérés comme ravageurs. Pendant des siècles, pour lutter contre les agresseurs, les agriculteurs ont pratiqué des rotations de cultures et utilisé divers produits naturels. Ce n’est qu’après la seconde guerre mondiale, que le recours aux produits phytosanitaires chimiques s’est généralisé (Regnault Roger, 2005).
La pomme de terre n’a pas échappé à ce phénomène. Elle est en effet l’une des productions végétales les plus cultivées à travers le monde et participe à l’alimentation quotidienne pour plus de 2 milliards de personnes. Dans le contexte économique français et régional, la pomme de terre est l’une des cultures majeures. Cible de nombreux pathogènes de nature fongique, bactérienne ou virale, la pomme de terre héberge également de nombreux nématodes et insectes ravageurs qui déprécient la qualité des tubercules et causent des pertes en rendements. Pour limiter la propagation de ces pathogènes et parasites et afin de toujours accroître la qualité et la quantité de leurs productions agricoles, les agriculteurs ont recours à l’application massive et parfois incontrôlée de produits phytosanitaires. En France, plus de 400 produits sont homologués pour traiter la pomme de terre (Base e-phy du Ministère de l’Agriculture et de la Pêche1). La prise de conscience des risques et méfaits de ces produits
1
http://e-phy.agriculture.gouv.fr/
Introduction
pour l’environnement (pollution des sols, de l’eau, …) et la santé humaine (cancers, maladies de peau, allergies, asthme, …) a conduit à la mise en place de directives et conventions visant à réduire l’utilisation de ces composés toxiques. Un réexamen de la Directive européenne 91/414 CE prévoit le retrait prochain de l’homologation de dizaines de pesticides. Les contraintes législatives se durcissent par de nouvelles règlementations relatives à l'homologation et à l'utilisation des substances chimiques en application des résolutions de la Convention de Stockholm de 2001 et de la Convention de Rotterdam entrée en vigueur en 2004. L'interdiction prochaine des traitements de désinfection des sols, le retrait du marché de plusieurs molécules actives, représentent certes des contraintes en phytoprotection, mais constituent également de réels enjeux technologiques, économiques et écologiques. Déjà plusieurs composés utilisés sur pommes de terre font l’objet d’une interdiction d’utilisation (Base e-phy). Les recherches actuelles doivent donc s’orienter vers l’élaboration de stratégies alternatives de lutte, basées sur l'utilisation des biotechnologies et/ou de biomolécules aux propriétés phytoprotectrices.
Parmi les composés impliqués dans les défenses des plantes en réponse à une attaque par un ravageur ou un pathogène, on trouve de nombreuses protéines dont beaucoup font parties des « pathogenesis-related proteins » (PR-P). Ce terme désigne « les protéines codées par la plante hôte mais induites lors de situations pathologiques ou associées » (Antoniw et al., 1980). Ainsi, toute protéine induite par la présence d’un organisme (parasite, nématode, insecte phytophage ou herbivore) ou par l’application de produits chimiques mimant l’effet d’une attaque, peut être considérée comme une PR-P. Décrites pour la première fois chez le tabac, puis généralisées à l’ensemble des végétaux, les PR-P sont classées en 11 familles multigéniques très variées (Tableau 1) dont quatre d’entre elles présentent des activités chitinases (Neuhaus, 1999; Schaefer et al., 2005). Les chitinases sont également produites par de nombreux organismes (bactéries, virus, champignons, animaux) et sont impliquées dans de nombreux processus nutritionnels et développementaux. Ces enzymes catalysent les réactions de dégradation des structures cuticulaires composées de chitine. L’absence de chitine dans le règne végétal et chez les vertébrés fait de cette molécule une cible d’intérêt dans le cadre du développement de nouveaux programmes de lutte contre les ravageurs et pathogènes des cultures. La dérégulation du métabolisme des chitinases par surexpression ou par inhibition des enzymes chitinolytiques constitue donc une voie d’intérêt pour développer de nouveaux programmes de lutte contre les ravageurs et pathogènes des cultures.
Tableau 1 : Classification des « pathogenesis-related proteins » (van Loon, 1999)
Famille de PR-P Propriétés / Fonctions
PR-1 Inconnues PR-2 β-1,3-glucanase
PR-3 Chitinases de types I, II, IV, V, VI, VII PR-4 Chitinases de types I, II
PR-5 Thaumatin-like PR-6 Inhibiteurs de protéases
PR-7 Endoprotéinases PR-8 Chitinases de type III
PR-9 Péroxydase PR-10 Ribonucléase-like PR-11 Chitinases de type I
Synthèse bibliographique
Synthèse bibliographique
1. La chitine
Avec au moins 10 gigatonnes synthétisées et dégradées chaque année dans la biosphère (Muzzarelli, 1999), la chitine est le second polysaccharide le plus représenté dans la nature après la cellulose. Elle fut isolée et décrite pour la première fois en 1823 par Odier à partir de cuticules d’insecte (Desbrières, 2002).
Absente du règne végétal, elle est une structure de soutien chez les champignons et les animaux. Chez les champignons où elle constitue 22 à 44% des parois cellulaires des hyphes mycéliens, la chitine est associée à des glycoprotéines (Muzzarelli, 1977; Ruiz-Herrera et Martinez-Espinoza, 1999). La synthèse de chitine est un processus ancestral de la cellule animale (Jeuniaux, 1963), c'est pourquoi le règne animal est le principal producteur de chitine. On la trouve chez les cnidaires, les brachiopodes, les pogonophores, les annélides. Elle est aussi présente à des teneurs variables (de quelques traces à 75%) dans les téguments de nombreux invertébrés tels les mollusques ou les nématodes. Ce polymère occupe une place majeure chez les arthropodes. Son association avec des protéines et des minéraux lui confère des propriétés de résistance et de flexibilité. Par sclérotisation ou minéralisation, ces complexes chitino-protéiques sont à l'origine de la mise en place des éléments exosquelettiques (cuticule, proctodeum, stomodeum, trachées) et de la membrane péritrophique des arthropodes. La coloration des cuticules provient en partie de la conjugaison de chitine avec des caroténoïdes (Muzzarelli, 1977).
La chitine est un homopolysaccharide composé d’unités N-acétyl-β-D-glucosamine liées entre elles par des liaisons glycosidiques (1→4). Sa structure est similaire à celle de la cellulose, mais diffère par la présence des groupements N-acétylés sur les carbones 2 des glucoses (Figure 1). La synthèse de la chitine implique de nombreuses enzymes. La phosphorylation et l’action d’isomérases permettent de transformer le glucose en D-fructose-6-phosphate qui, sous l’effet de transaminase, conduit à l’obtention de glucosamine. Cette molécule est ensuite transacétylée pour donner des unités N-acétyl-glucosamine phosphatées, dont l’association est réalisée par des chitine synthases à partir de l’uridine-diphosphate-N-acétylglucosamine.
Contrairement à la cellulose, dont une seule forme cristalline est décrite en conditions naturelles, la chitine est une substance polymorphe présentant trois formes cristallines. L'α chitine constituée de chaînes antiparallèles est la forme la plus stable et la plus abondante (Minke et Blackwell, 1978). On la trouve chez les arthropodes et les champignons. La
Synthèse bibliographique
β chitine, constituée de chaînes parallèles (Blackwell, 1969), a été décrite chez certains céphalopodes, des annélides polychètes, des pogonophores et quelques protozoaires. Enfin la γ chitine, mal connue, qui serait constituée de l'assemblage de deux macromolécules parallèles et d'une antiparallèle, n'est rapportée que dans les téguments des nymphes d'un coléoptère (Ptinus) (Rudall et Kenchington, 1973) et dans l'estomac d'un calmar (Loligo) (Ruiz-Herrera et Martinez-Espinoza, 1999).
Les polymères de chitine forment des microfibrilles qui sont stabilisées par des liaisons hydrogènes formées entre les groupes amines et carboxyles. L’arrangement des microfibres d’α chitine confère des propriétés de rigidité et de résistance mécanique alors que les microfibrilles de chitine de type β confèrent des propriétés de flexibilité. Ces propriétés influencent la répartition des différentes formes de chitine dans les structures cuticulaires. Ainsi, la forme α est principalement présente au niveau des cuticules, alors que la forme β est davantage localisée au niveau des membranes péritrophiques des arthropodes (Kenchington, 1976; Peters, 1992). Enfin, des formes non cristallines et transitoires de la chitine ont été mises en évidence chez les champignons (Vermeulen and Wessels, 1986).
2. Les chitinases
2.1 Généralités
Les enzymes chitininolytiques impliquées dans les processus de dégradation de la chitine sont nombreuses. Parmi elles, les chitinases sont des glycosides hydrolases, qui assurent la rupture des liaisons β-1,4 glycosidiques qui lient les carbones C1 et C4 de deux résidus N-acétylglucosamine consécutifs. On distingue généralement deux catégories de chitinases : les endo et les exochitinases. Les premières, également nommées poly [1,4-(N-acétyl-β-D-glucosaminide)] glycanohydrolases (EC 3.2.1.14) hydrolysent les liaisons internes des microfibrilles de chitine pour libérer des fragments de chitobiose, chitotriose et chitotétraose composés respectivement de deux, trois ou quatre unités N-acétylglucosamine. Les secondes, nommées exochitinases ou β-N-acétylhexosaminidases (EC 3.2.1.52), participent à la dégradation complète des fragments de chitine. Parmi ces exochitinases, les chitobiosidases libèrent des di-acétylchitobioses à partir des extrémités non-réductrices de la chitine (Jeuniaux, 1963) et les β-D-acétylglucosaminidases hydrolysent ces di-acétylchitobioses en monomères de N-acétylglucosamine (Cohen-Kupiec et Chet, 1998).
Synthèse bibliographique
Si la production de chitine est une propriété de certaines cellules animales et fongiques, les chitinases sont des enzymes que l’on retrouve chez l’ensemble des organismes vivants qu’ils soient procaryotes, eucaryotes ou de type viral. Les chitinases ont été regroupées en cinq classes qui constituent deux familles distinctes de glycosides hydrolases, en fonction de différents facteurs, parmi lesquels leur séquence N-terminale, leur localisation et leurs propriétés biochimiques (Henrissat et Davies, 2000; Patil et al., 2000). Les chitinases appartenant à la famille 18 rassemblent plus de 180 enzymes présentes chez les eucaryotes, les procaryotes et les virus, et réparties au sein des classes III et V. La famille 19 regroupe plus de 130 composés essentiellement d'origine végétale et formant les classes I, II et IV (Henrissat, 1999).
Le rôle des chitinases varie en fonction des organismes qui les produisent. Elles peuvent participer aux processus de nutrition, de croissance ou bien de défense. Les chitinases sont également impliquées dans certains mécanismes de pathogénicité.
2.2 Chitinases et microorganismes
Les chitinases sont présentes chez de nombreux microorganismes eux-mêmes dépourvus de chitine, mais pour lesquels la chitine constitue une source de nutriments. Ainsi, les bactéries chitinolytiques marines, d’eau douce ou du sol produisent des chitinases qui participent à la biodégradation et au recyclage des chitines produites annuellement dans leur écosystème respectif. Les chitinases bactériennes sont également impliquées dans des processus digestifs (Cohen-Kupiec et Chet, 1998; Patil et al., 2000). En effet, les bactéries du genre Streptomyces produisent des enzymes chitinolytiques qui, en modifiant la composition des structures chitineuses, favorisent leur adhésion au substrat et la pénétration de leur hôte (Charpentier et Percheron, 1983; Schrempf, 2001) au niveau des lésions formées sur l’exosquelette des Arthropodes. Certaines chitinases bactériennes facilitent également la dégradation de la chitine du puparium de certains insectes, favorisant ainsi l’émergence des adultes (Iverson et al., 1984). Les chitinases produites par les bactéries de la microflore intestinale de nombreux animaux (poissons, oiseaux, …) facilitent les processus de digestion des aliments composés de chitine.
Des gènes de chitinase ont également été identifiés dans le génome du baculovirus
Autographa californica, inféodé aux arthropodes (Hawtin et al., 1995). Chez ce baculovirus,
les chitinases jouent un rôle crucial dans les processus d’infection virale, plus particulièrement lors des phases de pénétration du virus dans l’organisme attaqué (Thomas et
Synthèse bibliographique
al., 2000; Saville et al., 2002). Cette chitinase virale entraîne même une liquéfaction des tissus du lépidoptère Trichoplusia ni infecté (Hawtin et al., 1997).
De nombreux protozoaires et métazoaires parasites des tractus digestifs présentent la capacité de synthétiser des chitinases. Parmi ces parasites, on trouve des filaires, des amibes, des trypanosomes, des plasmodiums (Huber et al., 1991). Chacun de ces microorganismes utilise la chitine et les chitinases différemment et spécifiquement selon le stade de son développement (Shahabuddin et Vinetz, 1999). Les chitinases produites par les procaryotes facilitent les processus de colonisation de leurs insectes hôtes qui leur servent de vecteurs.
2.3 Chitinases fongiques
Les chitinases fongiques possèdent de multiples fonctions. Comme les chitinases bactériennes, elles participent largement au métabolisme trophique et sont également impliquées dans le développement, la morphogenèse et lors d’interactions symbiotiques et d'infestations parasitaires (Cohen-Kupiec et Chet, 1998). La chitine est un composé des parois cellulaires des champignons filamenteux. Les chitinases sont donc produites à différents stades de leur croissance. Ainsi, les chitinases sont impliquées dans la séparation et la germination des spores. Chez les levures, les chitinases sont impliquées dans le bourgeonnement des cellules filles et leur séparation d’avec les cellules mères (Passonneau et Williams, 1953; Elango et al., 1982; Kuranda et Robbins, 1991). Les hyphes mycéliens possédant une structure rigide, les chitinases permettent de remodeler la chitine des parois fongiques lors de la croissance et du développement, mais aussi lors de stress hydriques (Gooday et al., 1992).
Les champignons pathogènes utilisent leurs chitinases pour faciliter leur pénétration dans l’hôte ou pour en exploiter les sucres et acides aminés issus de la dégradation des cuticules. C’est notamment le cas de champignons pathogènes des œufs de nématodes (Dackman et al., 1989), mais aussi des champignons entomopathogènes des genres
Beauveria, Metarhizium et Verticillium (El-Sayed et al., 1989; St. Léger et al., 1991).
Synthèse bibliographique
2.4 Chitinases végétales.
2.4.1 Chitinases végétales et développement
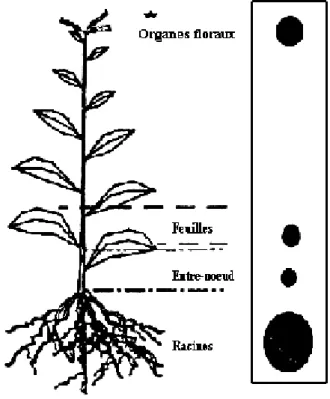
Bien que la présence de chitine n’ait jamais été mise en évidence chez les plantes, les chitinases végétales possèdent toutefois des substrats végétaux qui les impliquent dans de nombreux processus physiologiques (croissance, floraison, maturation des fruits). Les chitinases végétales peuvent être synthétisées dans certains organes ou durant différentes étapes des cycles végétatif ou reproductif de la plante (Figure 2). Ainsi, elles sont exprimées de façon constitutive dans de nombreux organes, tels que les feuilles (Ancillo et al., 1999), les fleurs (Wemmer et al., 1994; Takakura et al., 2000), les graines (van Hengel et al., 1998; Domon et al., 2000; Passarinho et al., 2001), les fruits (Peumans et al., 2002) et les racines (Passarinho et al., 2001; Showalter, 2001).
La découverte de glycoprotéines extracellulaires nommées arabinogalactanes a permis de mettre en évidence l’intervention des chitinases végétales dans la croissance des végétaux. Présents dans les racines, les feuilles, les tiges, les organes floraux et les graines (Fincher et al., 1983; Showalter, 2001), les arabinogalactanes contiennent des unités N-acétylglucosamine et des sites de liaison aux chitinases (Showalter, 2001). Les chitinases végétales interviendraient notamment dans les évènements précoces de l'embryogenèse et la germination des graines (De Jong et al., 1992; Jin-Zhuo et David, 1997; Krishnaveni et al., 1999; Helleboid et al., 2000; van Hengel et al., 2002), libérant des oligosaccharides à partir d’arabinogalactanes présents dans les tissus embryonnaires (Domon et al., 2000).
Au niveau racinaire, les chitinases végétales favorisent la pénétration des hyphes mycéliens et le développement des interactions symbiotiques avec des champignons mycorhiziens en hydrolysant la chitine fongique (Salzer et al., 2000). Plusieurs travaux rapportent la présence de résidus N-acétylglucosamine dans les parois secondaires de diverses espèces de plantes (Benhamou et Asselin, 1989). Ces composés seraient susceptibles d’agir en tant qu’éliciteurs dans des processus de reconnaissance entre végétaux et symbiotes. Ainsi, la dégradation de lipochitooligosaccharides (facteurs Nod) (Schmidt et al., 1993; Spaink et al., 1993) et de peptidoglycanes bactériens par les chitinases végétales favorisent les interactions entre des bactéries de type Rhizobium fixatrices d’azote et de nombreuses légumineuses (Staehelin et al., 1994; Goormachtig et al., 1998). Enfin, les plantes carnivores produisent des chitinases qui aident à la digestion de leurs proies (Gooday, 1990).
Synthèse bibliographique
2.4.2 Chitinases végétales et défense
Si les chitinases sont synthétisées de façon constitutive, leur présence dans les tissus végétaux a longtemps été justifiée par leurs interventions dans les mécanismes de défenses induits. La synthèse des chitinases végétales peut être induite en cas de stress biotique ou abiotique. Suite à l’attaque d’une plante par des phytophages ou des pathogènes, plusieurs phytohormones sont synthétisées, telles que l'éthylène (Enyedi et al., 1992), l'acide jasmonique (Creelman et Mullet, 1997) et l'acide salicylique (Lee et al., 1995) produites pour activer des cascades de signalisation susceptibles d'induire la synthèse de phénylpropanoïdes (Hahlbrock et Scheel, 1988; Dixon et Paiva, 1995), de phytoalexines (Smith, 1996; Hammerschmidt, 1999) et de "pathogenesis-related" protéines (PR-P), dont des chitinases (Graham et Sticklen, 1994; Krishnaveni et al., 1999; Robert et al., 2002).
Les chitinases végétales présentent essentiellement des propriétés antifongiques. Les activités chitinolytiques peuvent être augmentées d'un facteur 600 (van Hengel et al., 1998) suite à une attaque par un champignon pathogène. Les chitinases lysent la paroi des hyphes mycéliens et inhibent la germination des spores chez divers champignons tels que Alternaria,
Fusarium, Trichoderma et Rhizoctonia (Schlumbaum et al., 1986; Mauch et Staehelin, 1989;
Sela-Buurlage et al., 1993; Schickler et Chet, 1997; Taira et al., 2002). Les activités chitinolytiques ont une double fonction dans la réponse aux champignons pathogènes. Lors de la pénétration des champignons phytopathogènes dans le végétal, les chitinases libèrent des oligosaccharides fongiques qui constituent des éliciteurs (Collinge et al., 1993; De A. Gerhardt et al., 1997; Ito et al., 2005), renforçant indirectement les défenses des plantes. Par la suite, les chitinases vacuolaires limitent la propagation des champignons dans le végétal (Taira et al., 2002). Les chitinases végétales et les PR-P sont également induites suite à l’attaque par un ravageur.
2.5 Chitinases animales
Les chitinases ont été mises en évidence chez de nombreux animaux invertébrés et vertébrés, y compris chez les mammifères. De nombreuses chitinases sont impliquées dans des processus digestifs (Suzuki et al., 2002). Les chitinases salivaires de poulpe mais aussi les chitinases d’hyménoptères parasitoïdes et d’araignées facilitent la pénétration des cuticules de leurs hôtes ou proies (Mommsen, 1980; Krishnan et al., 1994; Jones et al., 1996). Dans le tractus alimentaire des poissons (Flach et al., 1992) des oiseaux (Jackson et al., 1992) et des
Synthèse bibliographique
mammifères insectivores, les chitinases dégradent la cuticule des proies ingérées. Les chitinases sont également impliquées dans des processus de défenses comme chez le turbot, où elles joueraient un rôle contre certains parasites tels que les microsporidies (Manson et al., 1992). Citons encore le cas de chitinases sériques et leucocytaires chez l’homme, sécrétées en grande quantité par les monocytes lors de leur différenciation en macrophages (Escott et Adams, 1995) chez des patients atteints de la maladie de Gaucher (Boot et al., 1995). Enfin, chez les animaux, les chitinases pourraient également jouer un rôle défensif contre certains champignons pathogènes (Leah et al., 1991; Boot et al., 1995; Gooday, 1999; Carlini et Grossi-de-Sa, 2002).
2.6 Insectes et chitinases
Chez les arthropodes et les insectes en particulier, la chitine est présente au niveau des cuticules et fréquemment dans la membrane péritrophique. Les enzymes chitinolytiques sont impliquées dans le déroulement de certaines fonctions vitales telles que les processus de morphogenèse, développementaux et digestifs et participent au remodelage de ces structures cuticulaires.
2.6.1 Cuticule, chitinases et croissance des insectes
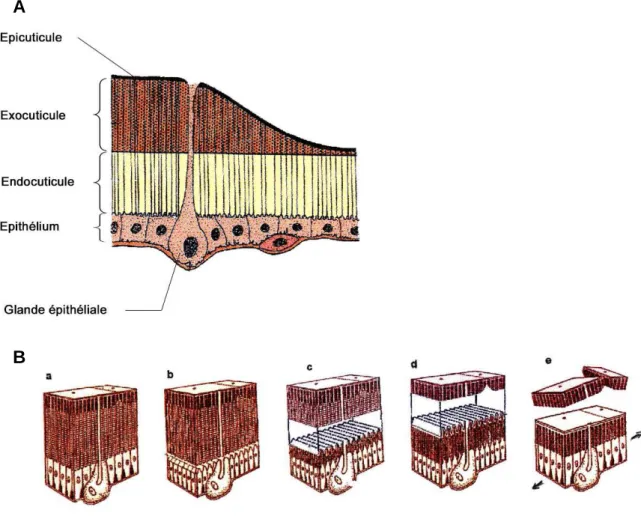
Les cuticules d’insectes sont composées d’un empilement de plusieurs couches protéiques et chitineuses. L’épicuticule, la couche la plus externe de la cuticule, est une fine membrane multicouches et pigmentée. Elle est dépourvue de chitine, mais composée d’une lipoprotéine, la cuticuline, et de cire. L’épicuticule recouvre une épaisse procuticule, elle-même constituée d’une exocuticule rigide et d’une endocuticule principalement composées de chitine et de protéines (Andersen, 1979), laquelle repose sur les cellules tégumentaires (Figure 3).
La rigidité de la cuticule implique une croissance larvaire ponctuée de mues, nécessaires à l’abandon de l’ancienne cuticule devenue trop étroite et à l’édification d’une nouvelle. Le processus de mue, de courte durée, est associé à de profondes modifications physiologiques et morphologiques.
Avant chaque mue, les cellules tégumentaires subissent de nombreuses mitoses qui permettent d’accroître la surface corporelle. Il se produit alors un processus de décollement de
Figure 3 : Structure de la cuticule (A) et processus de mue (B).
A
B
Synthèse bibliographique
l’ancienne cuticule nommé apolyse. L’épiderme se plisse et se détache de la cuticule, laissant apparaître un espace exuvial (Jeuniaux, 1963) dans lequel sont sécrétées de l’eau et des enzymes protéasiques et chitinolytiques. Ces enzymes, accumulées dans les fluides exuviaux, permettent de dégrader l’ancienne endocuticule et libèrent alors des acides aminés et de l’acétylglucosamine (Dziadik-Turner et al., 1981; Samuels et Reynolds, 1993; Samuels et Paterson, 1995; Reynolds et Samuels, 1996) qui sont en grande partie réabsorbés par l’épiderme et recyclés pour produire la nouvelle cuticule (Surholt, 1975; Kaznowski et al., 1986; Reynolds et Samuels, 1996). L’hydrolyse partielle de l’endocuticule provoque un amincissement de l’ancienne cuticule, notamment au niveau de lignes de déchirure caractérisées par une exocuticule plus fine. Les phases d’exuviation et l’extirpation débutent lorsque ces lignes de déchirure se rompent. L’abandon de l’ancienne cuticule permet le déplissement de la nouvelle cuticule qui se rigidifie, s’opacifie, se sclérifie et se pigmente.
L’expression des chitinases joue aussi un rôle crucial dans le développement post-embryonnaire des insectes. Les processus de mues sont sous le contrôle d’un dispositif hormonal complexe, et dépendent notamment de deux hormones principales : les hormones juvéniles et l’ecdysone qui permettent de réguler la synthèse et la dégradation de la chitine. La balance de ces hormones influence la nature larvaire ou imaginale des mues (Tsuzuki et al., 2001; Malausa et al., 2006) mais aussi l’induction de l’expression des gènes de chitinases (Koga et al., 1991; Takahashi et al., 2002).
2.6.2 Membrane péritrophique et chitinases
Le tube digestif des insectes est divisé en trois segments. Les portions antérieure et postérieure respectivement nommées stomodeum et proctodeum sont issues de l'invagination embryonnaire de cellules ectodermiques et subissent donc les mêmes phénomènes de mue que la cuticule. Le segment intermédiaire, l’intestin moyen ou mésentéron est d’origine endodermique et, contrairement au stomodeum et au proctodeum, n’est pas revêtu d’une cuticule. Toutefois, une couche extracellulaire mince, produite après l’ingestion d’aliments et nommée membrane péritrophique (Figure 4), permet d’isoler le bol alimentaire des cellules épithéliales mésentériques en délimitant un espace péritrophique entre la membrane et l'épithélium mésentérique (Chatton, 1932). La membrane péritrophique est constituée de chitine, de protéoglycanes et de nombreuses protéines, dont les péritrophines (Tellam, 1996; Tellam et al., 1999).
Synthèse bibliographique
Bien que différents types de membranes péritrophiques aient été décrits (Richards et Richards, 1977; Peters, 1992) on en distingue principalement deux types (Peters, 1992). La membrane péritrophique de type I est épaisse (entre 2 et 20 µm), constituée de chitine, protéoglycanes et péritrophines sécrétés par de nombreuses cellules de l'épithélium du mésentéron (Shen et Jacobs-Lorena, 1998) suite à la distension de l'épithélium intestinal qui se produit après une prise alimentaire (Richards et Richards, 1977). Cette membrane péritrophique de type I est synthétisée entièrement ou en partie par l'épithélium de l'intestin (Terra, 2001). Des précurseurs de la chitine seraient sécrétés par les cellules de l'épithélium, après quoi ils s'organiseraient en fibres liées les unes aux autres par l'intermédiaire de protéines (Tellam et al., 1999). Les processus de digestion ne sont pas affectés par la mise en place rapide de cette membrane (Terra, 2001). La membrane péritrophique de type II, plus fine (moins d'1 µm d'épaisseur), est synthétisée de façon continue par un organe spécialisé, le cardia, localisé à la jonction entre l'intestin antérieur et l'intestin moyen (Shen et Jacobs-Lorena, 1998). Présente chez de nombreux insectes indépendamment de la prise de nourriture, la membrane péritrophique serait incapable de se distendre suite à l'ingestion d'un repas (Terra, 2001).
Les membranes péritrophiques se mettent en place dans les trente minutes suivant la prise de nourriture (Shen et Jacobs-Lorena, 1998). Elles permettent de protéger les cellules épithéliales de l'intestin moyen contre les éventuelles abrasions causées par la nourriture. Les membranes péritrophiques faciliteraient également la digestion, en cloisonnant les enzymes digestives et la nourriture. En effet, le maillage créé par l'agencement des fibres de chitine et de péritrophines permet d'établir une sélectivité des éléments qui sont assimilés au niveau de l'épithélium digestif. Cette fonctionnalité permettrait également de jouer un rôle de barrière protectrice contre certaines toxines et macromolécules qui resteraient circonscrites dans le sac péritrophique sans endommager l'épithélium intestinal. Ce rôle préventif s'étendrait même jusqu'à une protection plus ou moins efficace contre une infection virale, bactérienne ou causée par tout autre pathogène (Lehane et al., 1997).
Outre leur intervention dans la dégradation de la membrane péritrophique, les chitinases joueraient un rôle dans la mise en place de la matrice péritrophique, en participant à la réorganisation des fibres de chitine (Merz et al., 1999). Les chitinases participeraient en outre à la dégradation de la membrane péritrophique après digestion. En effet, l’ajout d’un inhibiteur de chitinase dans l’alimentation des moustiques du genre Aedes induit la formation plus rapide et une dégradation plus tardive de la membrane péritrophique (Shahabuddin et al., 1993).
Synthèse bibliographique
2.7 Chitinases et phytoprotection
Comme nous l’avons vu précédemment, les chitinases sont à la fois impliquées dans les réactions de défenses des plantes et les processus de croissance des champignons pathogènes et des insectes. C’est pourquoi de nombreux gènes codant pour des chitinases d’origines diverses ont été clonés. L’expression de nombre d’entre eux induit des effets délétères vis-à-vis de microorganismes pathogènes. Avec le développement de la transgenèse, ces gènes ont été introduits dans des plantes génétiquement modifiées sous le contrôle de promoteurs constitutifs ou inductibles dans le but d’accroître leur résistance vis-à-vis des pathogènes et des ravageurs (Tableau 2). Broglie et al. (1991) furent les premiers à obtenir des lignées de tabac et de colza, exprimant une chitinase vacuolaire de haricot et capables de se développer dans des sols contaminés par Rhizoctonia solani en ralentissant l'apparition des symptômes. Depuis, de nombreux travaux ont montré que l'expression de chitinases d'origine végétale dans des plantes permettait de leur conférer une protection contre les pathogènes d'origine fongique, qu'il s'agisse de chitinases de tabac (Vierheilig et al., 1993; Rohini et Sankara Rao, 2001), de riz (Yamamoto et al., 2000; Datta et al., 2001; Kalpana et al., 2006), d'orge (Bornhoff et al., 2005) ou de haricot (Vellicce et al., 2006). Des activités antifongiques ont également été rapportées chez des plantes exprimant des chitinases recombinantes d'origine bactérienne (Carstens et al., 2003; Itho et al., 2003) et fongique (Terakawa et al., 1997; Lorito et al., 1998; Emani et al., 2003).
La transformation de plantes avec des gènes de chitinases bactériennes, fongiques ou végétales a rarement permis de conférer des résistances significatives contre les insectes. Ainsi, une résistance aux insectes a été mise en évidence chez des plants de tomates exprimant une chitinase bactérienne de Streptomyces albidoflavus qui augmente la résistance vis-à-vis du lépidoptère Trichoplusia ni (Gongora et al., 2001). L'expression d'un gène de chitinase de haricot par des pommes de terre provoque également des effets délétères sur le lépidoptère Lacanobia oleracea (Gatehouse et al., 1997). Récemment exprimée chez la tomate, une chitinase de peuplier semble présenter des effets délétères pour le doryphore de la pomme de terre (Leptinotarsa decemlineata), mais avec des effets peu reproductibles d’une série expérimentale à une autre (Lawrence et Novak, 2006). Les effets insecticides les plus marqués qui ont été décrits sont basés sur l’utilisation de plantes transgéniques exprimant des chitinases d’insectes. Ainsi, la chitinase du lépidoptère Manduca sexta induit in vitro une mortalité totale du coléoptère Oryzaephilis mercator (Wang et al., 1996). Des plants de tabac
Tableau 2 : Exemples de plantes transformées avec des gènes de chitinase et leurs effets
Origines du gène Plantes
transformées Organismes cibles Effets Références
Tabac (Nicotiana tabacum) Tabac Cercospora nicotiana Pas d’effet (Neuhaus et al., 1991) Betterave (Beta vulgari C. nicotiana Pas d’effet (Nielsen et al., 1993)
Betterave Bouleau Pyrenopeziza betulic
Melampsoridium betulinum
Pas d’effet
Antifongique (Pappinen et al., 2002) Haricot (Phaseolus vulgaris) Fraise (cv Pajaro) Botrytis cinerea Antifongique (Vellicce et al., 2006) Cacao (Theobroma cacao) Cacao Colletotrichum
gloeosporioides Antifongique (Maximova et al., 2006)
Colza (Brassica napus) Colza
Cylindrosprium conc Phoma linga Sclerotinia sclerotior
Antifongique (Grison et al., 1
Streptomyces griseus Riz Magnaporthe grise Antifongique (Itho et al., 2003) Moutarde (Brassica jun Tabac Trichoderma viride Antifongique (Fung et al., 2002) Tabac Arachide C. arachidicola Antifongique (Rohini et Sankara Rao, 2001)
Trichoderma harzianum Broccoli Alternaria brassicicola Antifongique (Mora et Earle, 2001)
Trichoderma atroviride Pomme
(Marshall McIntosh) Venturia inaequalis Antifongique (Bolar et al., 2001)
Saccharomyces cerevisiae Tabac B. cinerea Antifongique (Carstens et al., 2003) Riz (Oryza sativa) Ryegrass Puccinia coronata Antifongique (Takahashi et al., 2
Trichoderma atroviride Riz R. solani
M. grisea Antifongique (Liu et al., 2004)
Rhizopus oligosporus Tabac S. sclerotiorum
B. cinerea Antifongique (Terakawa et al., 1997)
Riz Riz R. solani Antifongique (Sridevi et al., 2003)
Trichoderma harzianum Tabac
Pomme de terre
Alternaria alternata A. solani B. cinerea
R. solani
Antifongique (Lorito et Scala, 1999)
Trichoderma virens Coton A. alternata
R. solani Antifongique (Emani et al., 2003)
Riz Ginseng Antifongique (Chen et Punja, 2003)
Haricot Tabac
Colza Rhizoctonia so Antifongique (Broglie et al., 1991)
Riz Riz M. grisea Antifongique (Nishizawa et al., 1999)
Peuplier (Populus sp.) tomate Leptinotarsa decemlin Insecticide (Lawrence et Nova
Manduca sexta Colza Plutella maculip Insecticide (Wang et al., 2
Streptomyces albidoflav Tomate Trichoplusia Insecticide (Gongora et al., 200
Manduca sexta Tabac Heliotis virescens Insecticide (Ding et al., 1998
s) Tabac ola entricum m um a 996) cea) 005) lani eata s k, 2006) 005) 1) ) eni ni us
Synthèse bibliographique
surexprimant cette même chitinase induisent un ralentissement de la croissance du lépidoptère
Heliothis virescens et une diminution des dégâts provoqués par leur prise de nourriture, mais
aussi de fortes mortalités larvaires chez plusieurs lépidoptères (Ding et al., 1998). Enfin, la chitinase de la mouche de la tomate Lacanobia oleracea (Lépidoptère) possède des effets insecticides sur ce même insecte (Fitches et al., 2004).
L'augmentation de la protection antifongique conférée par la coexpression de chitinases recombinantes avec d'autres protéines de défense contre les pathogènes est rapportée dès 1994 lors de l'expression conjointe d'une chitinase de riz et d'une glucanase de luzerne dans des lignées de tabac (Zhu et al., 1994). Les "ribosome inactivating" protéines (Jach et al., 1995; Bornhoff et al., 2005) et les "thaumatin-like" protéines (Hejgaard et al., 1991; Kalpana et al., 2006) sont également susceptibles d'agir en synergie avec les chitinases. La coexpression de chitinases et de β-1,3-glucanase a permis d’accroître les résistances contre les champignons pathogènes (Leubner-Metzger et Meins, 1999). Malgré l'induction de résistance au laboratoire contre Fusarium graminearum, des lignées de blé transgénique coexprimant une chitinase et une β-1,3-glucanase ne présentent aucune protection en conditions de champ (Anand et al., 2003). Ces travaux constituent la première expérimentation au champ de plantes co-exprimant deux enzymes, dont une chitinase.
L'action synergique de chitinases associées à des δ-endotoxines de Bacillus
thuringiensis (Bt) est rapportée dès 1972 par des travaux montrant une augmentation de la
mortalité des larves du lépidoptère Choristoneura fumiferana (Smirnoff, 1974). Cette action synergique des chitinases et des toxines de Bt sera également mise en évidence sur les larves des lépidoptères Spodoptera littoralis (Regev et al., 1996), Spodoptera exigua (Tantimavanich et al., 1997) et Plutella xylostella (Wiwat et al., 2000). L'association d’une chitinase avec la toxine CryIC de Bt, induit une réduction significative de la prise de nourriture chez les larves d’Heliothis virescens (Regev et al., 1996; Ding et al., 1998). Plus récemment, l'expression d'une chitinase recombinante dans des lignées de Bt a permis d’augmenter les effets insecticides de ces bactéries sur des larves de S. exigua (Thamthiankul et al., 2001) et Lymantria dispar (Lertcanawanichakul et al., 2004). En revanche, Gatehouse
et al., (1996) ont mis en évidence que lorsqu’un gène de chitinase est coexprimé avec la
lectine du perce-neige (GNA), les effets sur le puceron M. persicae sont moindres que lorsque les pommes de terre expriment uniquement la GNA.
Synthèse bibliographique
3. Contrôle du métabolisme de la chitine
Le métabolisme de la chitine étant crucial pour le développement des champignons et des insectes, la dérégulation des enzymes clés impliquées dans ce métabolisme représente une cible majeure dans le développement de fongicides et d’insecticides, y compris des agents antimalariens puisque la chitine est absente chez les vertébrés (Cohen, 1993).
3.1 Inhibition des chitine synthases
Les inhibiteurs de chitine synthases ont été classés en trois groupes majeurs, les peptidyl nucléosides, les acylurées et les substances interférant avec le contrôle hormonal. Les premiers, isolés de diverses espèces de Streptomyces, agissent comme des analogues de substrats des chitine synthases et incluent les polyoxines et les nikkomycines (Zhang et Miller, 1999) qui inhibent de façon compétitive les chitine synthases fongiques et d’insectes, par liaison au site catalytique de l’enzyme (Ruiz-Herrera et San-Blas, 2003). Les polyoxines sont utilisées pour le contrôle de champignons phytopathogènes alors que les nikkomycines n’ont pas encore d’applications commerciales, bien que présentant des activités inhibitrices supérieures à celles des polyoxines (Gooday, 1972; Zhang et Miller, 1999; Tellam et al., 2000). La faible utilisation de ces composés repose sur le fait qu’ils présentent une forte labilité et une activité variable vis-à-vis des champignons et une multitude d’animaux (Zhang et Miller, 1999; Ruiz-Herrera et San-Blas, 2003).
Les acylurées et les benzoylphenylurées sont largement utilisés pour le contrôle intégré des ravageurs. Si ces composés, parmi lesquels le diflubenzuron, le triflumuron, le flufénoxuron, le chlorfluazuron et le teflubenzuron, affectent la synthèse de chitine (Post et al., 1974; van Eck, 1979; Londershausen et Turberg, 1997), leur mode d’action est encore inconnu. Cependant, il semblerait que ces inhibiteurs n’interagissent pas directement avec les chitine synthases (Mayer et al., 1981), mais plutôt sur le transport ou la translocation des fibrilles de chitine à travers la membrane plasmique (Nakagawa et Matsumura, 1994; Cohen, 2001) voire sur la production d’ecdystéroïdes impliqués dans la régulation hormonale de la synthèse de chitine (Fournet et al., 1995).
Le troisième groupe d’inhibiteurs de chitine synthases affecte la régulation hormonale de la croissance et du développement des insectes. Un des multiples effets de ces substances est la dérégulation de la synthèse de chitine en bloquant la synthèse ou l’activité des
Synthèse bibliographique
hormones de mue. Ainsi, la biosynthèse d’ecdystéroïdes peut être inhibée par des dérivés d’imidazoles et de cholestérol (Kadano-Okuda et al., 1987; Roussel, 1994; Lorenz et al., 1995). La synthèse d’hormone juvénile est également bloquée par des composés hétérocycliques tels que la brévioxime et l’arborine alcaloïde (Moya et al., 1997; Muthukrishnan et al., 1999). L’application d’hormone de mue, de dérivés synthétiques agonistes ou antagonistes entraîne l’apparition de malformations dans le développement des insectes. Ainsi, le tébufénozide, un insecticide agoniste de l’ecdystéroïde, interagit avec les récepteurs de l’ecdysone, les fénoxycarbe, méthoprène et pyriproxyfène, et les précocène I et II (respectivement des agonistes et des antagonistes de l’hormone juvénile) agissent en mimant l’action des hormones (Hoffmann et Lorenz, 1998; Retnakaran et al., 2001).
3.2. Inhibiteurs de chitinases
Si de nombreux inhibiteurs de la synthèse de chitine sont commercialisés, aucun inhibiteur de la dégradation de la chitine n’a jusqu’alors été utilisé. Les effets attendus d’un inhibiteur de chitinases sont l’inhibition de l’apolyse et la perturbation des processus d’exuviation. Toutefois, de nombreux inhibiteurs de chitinases ont été découverts, isolés et caractérisés au cours de ces deux dernières décennies. Différents types d’inhibiteurs de chitinases ont pu être mis en évidence, les uns mimant la structure de la chitine, les autres des intermédiaires de dégradation de la chitine par les chitinases de la famille 18.
3.2.1 L’allosamidine
L’inhibiteur le plus étudié est l’allosamidine (Figure 5), un pseudotrisaccharide découvert par Sakuda et al. (1987) et isolé à partir de bactéries du genre Steptomyces. Une puissante activité inhibitrice est décrite contre les chitinases de la famille 18, dont celles des insectes et des champignons (Sakuda et al., 1987; Blattner et al., 1997) mais l'allosamidine n’affecte pas les chitinases de la famille 19 (Sakuda et Sakurada, 1998). Ce composé, qui agit par inhibition compétitive des chitinases, présente de nombreux effets délétères sur les insectes. Les effets insecticides (inhibition des mues) de l’allosamidine, mis en évidence dès 1987 chez le lépidoptère Bombyx mori (Sakuda et al., 1987), ont été retrouvés chez de nombreux autres insectes, notamment chez la mouche Lucilia cuprina chez laquelle le taux de mortalité est également significativement augmenté. Chez la mite du vêtement Tineola bisselliella, la forte mortalité larvaire s’accompagne de retards de croissance des insectes qui conduisent à
Synthèse bibliographique
l’interruption des mues et au développement de larves anormales (Blattner et al., 1997). L’allosamidine possède également des effets multiples dans l’interaction entre le plasmodium responsable du paludisme et son hôte, le moustique Aedes aegypti. Après un apport d’allosamidine dans l’alimentation, les chitinases du plasmodium, nécessaires à la pénétration de la membrane péritrophique sont inhibées (Tsai et al., 2001), mais les activités chitinases de l’hôte sont également affectées induisant des modifications dans l’organisation et le maintien dans le temps de la membrane péritrophique : après ingestion d’allosamidine, la membrane péritrophique est plus épaisse et sa dégradation demande plus de temps (Shahabuddin et al., 1993; Filho et al., 2002).
Les effets de l’allosamidine ne se limitent pas uniquement aux insectes. En effet, cet inhibiteur retarde l’enkystement de l’amibe Entamoeba invadens (Villagomez-Castro et al., 1992) et affecte aussi les chitinases du nématode Onchocerca gibsoni(Gooday et al., 1988) et celles des bactéries du genre Bacillus (Sampson et Gooday, 1998). L’allosamidine possède enfin des propriétés antifongiques dirigées contre des champignons pathogènes tels que
Candida albicans et Neurospora crassa (Dickinson et al., 1991; McNab et Glover, 1991).
L’allosamidine inhibe également la fragmentation des hyphes de Acremonium chrysogenum (Sandor et al., 1998) et de Penicillium chrysogenum (Sami et al., 2001).
Chez le crustacé Artemia salina, l’allosamidine est non seulement capable d’inhiber l’activité chitinolytique, mais aurait également un effet activateur sur les chitine synthases (Peter et Schweikart, 1990). Enfin, Suzuki et al. (2006) ont montré que l’allosamidine est capable d’induire la production de chitinase et de favoriser la croissance chez Streptomyces sp. AJ9463 en agissant comme molécule signal pour la production de chitinase.
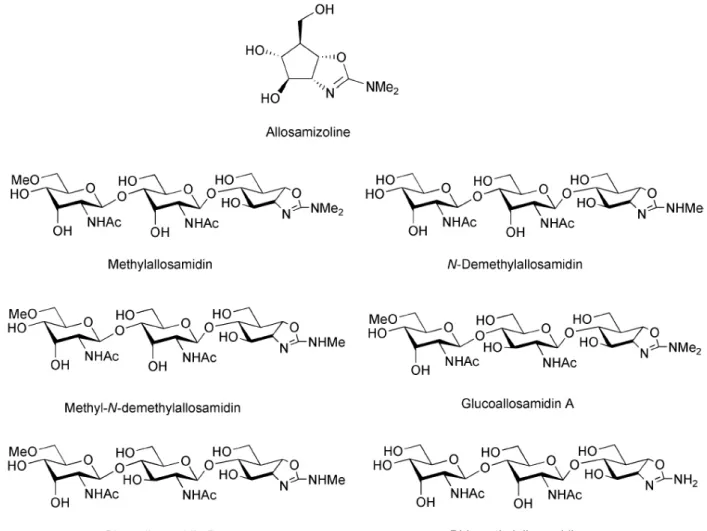
Le mode d’interaction entre les chitinases de la famille 18 et cet inhibiteur a été mis en évidence par cristallographie ; l’allosamidine mime un état transitoire de la catalyse de la chitine (van Aalten et al., 2001). L’allosamidine est constituée de deux groupements N-acétylallosamine liés à une allosamizoline et présente une structure analogue à celle de la chitine mais qui n’est pas hydrolysable (Bortone et al., 2002; Fusetti et al., 2002; Rao et al., 2003).
De nombreux dérivés de l’allosamidine ont été synthétisés (Figure 6). Parmi ces dérivés, on peut citer les déméthylallosamidines, les méthylallosamidines, les glucoallosamidines A et B, les méthyl-N-déméthylallosamidines qui présentent des activités inhibitrices vis-à-vis des chitinases fongiques de S. cerevisiae, C. albicans et Trichoderma sp. (Nishimoto et al., 1991). La déméthylation de l’allosamidine réduit toutefois ses effets inhibiteurs sur les chitinases de S. marcescens, Artemia salina et de Chironomus tentans
Synthèse bibliographique
(Spindler et al., 1997). En revanche, des pseudodisaccharides dérivés de l’allosamidine inhibent également les chitinases de C. albicans et de Bombyx mori (Nishimoto et al., 1991). Bien que de nombreuses études aient été menées sur l’allosamidine et ses dérivés, leur production est onéreuse en raison des difficultés de synthèse. C’est pourquoi de nombreuses recherches ont été développées pour cribler de nouvelles molécules aux pouvoirs inhibiteurs vis-à-vis des chitinases de la famille 18.
3.2.2 Les styloguanidines
Trois styloguanidines (Figure 7) ont été isolées à partir de l’éponge marine Stylotella
aurantium (Kato et al., 1995). Ces composés de nature cyclique présentent une activité
inhibitrice contre des chitinases de bactéries du genre Shewanella sp. La mue des larves de certains crustacés est également inhibée par ces styloguanidines (Kato et al., 1995). Les styloguanidines ont toutefois fait l’objet de très peu d’études.
3.2.3 Les cyclopentapeptides
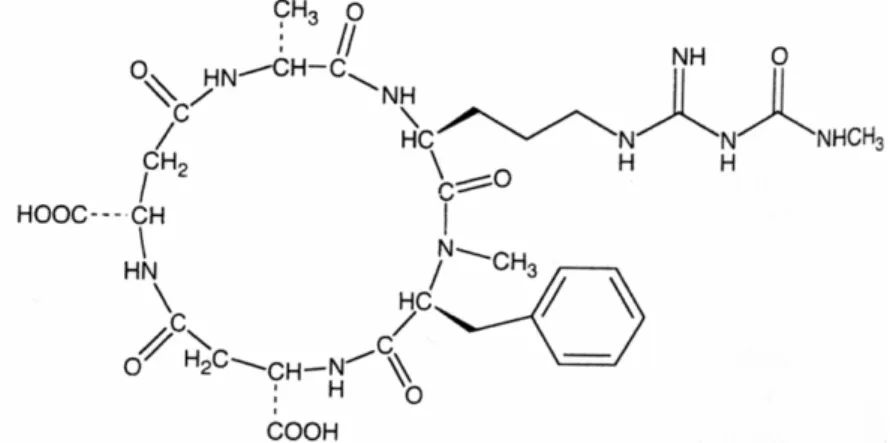
L’argifine (Figure 8) est le premier inhibiteur d’origine fongique à avoir été isolé. Issu de la souche FTD-0668 de Gliocladium sp., il est classé dans la famille des cyclopentapeptides et est constitué d’arginine, de N-méthyphénylalanine, de deux acides aspartiques ou deux asparagines, d’alanine et de résidus N-méthylcarbamoyl. Bien que présentant de faibles propriétés inhibitrices contre les chitinases de la famille 18, l’argifine inhibe la croissance des larves de la blatte américaine Periplaneta americana (Arai et al., 2000a; Omura et al., 2000). Récemment synthétisé (Dixon et al., 2005), ce cyclopentapeptide inhibe la chitinase B1 d’Aspergillus fumigatus et des chitinases humaines (Rao et al., 2005b).
L’argadine (Figure 8), un autre cyclopentapeptide inhibiteur de chitinases isolé à partir de la souche FO-7314 du champignon du sol Clonostachys sp., est composé d’arginine, de proline, d’homosérine, d’histidine et d’acide 2-aminoadipique. Des résidus acétyl interviennent également dans la structure de cet inhibiteur. Si l’argadine ne possède pas d’effet inhibiteur sur de nombreux microorganismes, son activité inhibitrice est rapportée sur une chitinase du diptère Lucilia cuprina. De même, l’injection de cet inhibiteur dans des larves de blattes américaines induit une mortalité pouvant atteindre 60% (Arai et al., 2000b). Comme l’argifine, l’argadine exerce une activité inhibitrice sur les chitinases humaines et d’A. fumigatus (Rao et al., 2005b).
Figure 7 : S ure des styloguanidines (Kato et al., 1995)
Figure 8 : Structure des cyclopentapeptides (Arai et al., 2000 ; Houston et al., 2002)
Argifine
Argadine
Synthèse bibliographique
3.2.4 Les dipeptides cycliques
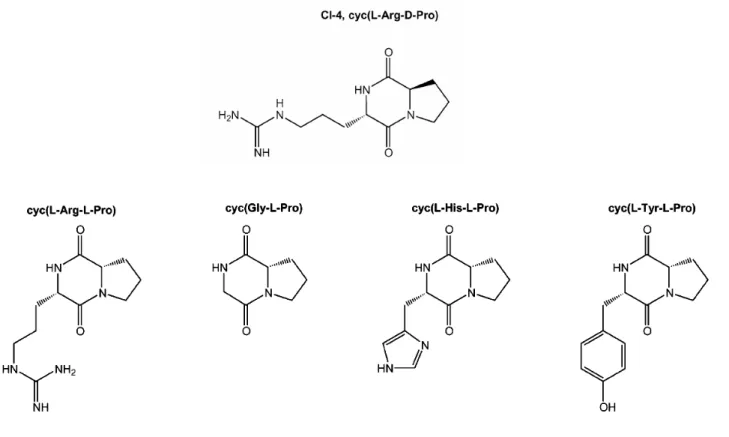
Le premier dipeptide cyclique à avoir été mis en évidence est le cyclo(L-Arg-D-Pro) également nommé CI-4 (Figure 9); il est issu de la bactérie marine Pseudomonas sp. IZ208. Bien qu’il présente une affinité modérée pour les chitinases (Houston et al., 2002a), le CI-4 possède des activités biologiques intéressantes puisqu’il induit in vivo l’inhibition de la séparation des cellules filles de la levure Saccharomyces cerevisiae (Izumida et al., 1996b). De plus, la croissance et l’élongation des hyphes du champignon filamentaire C. albicans sont perturbées en présence de CI-4 (Izumida et al., 1996a). Des études cristallographiques ont montré que le résidu Arg n’est pas essentiel pour la liaison au site actif des chitinases (Houston et al., 2004). C’est pourquoi d’autres dipeptides cycliques ont été étudiés parmi lesquels le Arg-L-Pro), le Gly-L-Pro), le Tyr-L-Pro) et le cyclo(L-His-D-Pro). Parmi les quatre inhibiteurs supposés, ce dernier est celui qui possède la plus forte affinité pour la chitinase bactérienne ChiB de Serratia marcescens, l’histidine établissant de nombreux contacts avec le site actif. Ce composé inhibe également la séparation des cellules de S. cerevisiae, mais est un moins bon inhibiteur que le CI-4 (Houston et al., 2004).
3.2.5 La psammapline A
La psammapline A (Figure 10) est un produit naturel dérivé de tyrosine bromée, récemment extrait de l’éponge Aplysinella rhax (Tabudravu et al., 2002). Ce produit phénolique présente un pouvoir cytotoxique vis-à-vis de certaines cellules cancéreuses (tumeurs ovariennes et cellules leucémiques), inhibe certaines aminopeptidases (Shim et al., 2004) et topoisomérases humaines (Kim et al., 1999b) et présente des propriétés antibiotiques sur la bactérie Staphyloccocus aureus (Kim et al., 1999a). Outres ces effets thérapeutiques, la psammapline A présente des effets inhibiteurs modérés sur les chitinases bactériennes de
Bacillus sp., Streptomyces sp., Actinomyces sp. et S. marcescens avec des activités inhibitrices
variables d’une espèce à une autre. Cette molécule inhibe également la croissance du mildiou de la vigne Plasmopora viticola. En revanche, si elle ne présente pas d’effet sur Drosophila
melanogaster ni sur Heliotis virescens, elle induit toutefois une mortalité de 55% sur le
lépidoptère Plutella xylostella (Tabudravu et al., 2002).
Ces dernières années, plusieurs études ont été menées pour découvrir de nouveaux inhibiteurs de chitinases. Des oligo- et polysaccharides isolés à partir de filtrats de cultures de
Figure 9 : Structure des dipeptides cycliques (Houton et al., 2004)
Synthèse bibliographique
champignons mycéliens présentent des activités inhibitrices contre des chitinases de
Spodoptera litura mais pas contre celles de Streptomyces griseus (Nitoda et al., 2003a). Parmi
les polysaccharides isolés de ces cultures fongiques, l’un d’eux, a été isolé de la souche TNPT116-Cz de Sphaeropsis sp. Ce polysaccharide de faible poids moléculaire (16 kDa) et nommé FPS-1 serait composé de deux résidus N-acétylglucosamine, d’un glucose et d’un galactose. Le FPS-1 inhibe fortement la chitinase de S. litura avec un pouvoir inhibiteur comparable à celui de l’allosamidine (Nitoda et al., 2003b). D’autres sucres ont également été décrits comme des inhibiteurs de chitinases (Huang et al., 2006). Trois dérivés de la xanthine (la théophylline, la caféine, et la pentoxifylline) sont décrits comme étant des inhibiteurs de chitinases bactériennes, fongiques et humaines (Rao et al., 2005a; Schuttelkopf et al., 2006).
3.3 Importance de l’interaction entre inhibiteurs et site catalytique des chitinases
Les inhibiteurs de chitinases montrent qu’il existe de nombreuses disparités dans les effets observés. Ces différences peuvent être associées à la structure des inhibiteurs et à leurs modalités d’interactions avec les chitinases. Les études cristallographiques montrent que la force des liaisons établies entre les inhibiteurs et le site actif des chitinases détermine le niveau d’activité inhibitrice et les spécificités d’action. La nature de l’inhibiteur et la composition en acides aminés du site actif des chitinases sont des facteurs importants dans la mise en place de ces interactions. Ainsi, la structure de l’allosamidine mime le substrat naturel des chitinases et se lie très fortement aux chitinases. Chez les dérivés de l’allosamidine, des modifications plus ou moins importantes de la structure de cet inhibiteur peuvent affecter l’efficacité de l’inhibition (Terayama et al., 1993; Spindler-Barth, 1997; Spindler-Barth et al., 1998). Les inhibiteurs d’origine peptidique (argifine, argadine et dipeptides cycliques) se lient également au site actif des chitinases mais avec d’autres types d’interactions, induisant des activités inhibitrices variables (Houston et al., 2002b). La nature des acides aminés qui constituent le site actif des chitinases varie d’un organisme à l’autre et des modifications du site actif des chitinases peuvent significativement modifier les interactions entre l’inhibiteur et les chitinases. La mutation d’un résidu tryptophane ne modifie pas l’affinité des chitinases pour leur substrat, mais peut perturber les propriétés catalytiques de l’enzyme (Zhang et al., 2002). Le résidu Arg présent dans le site catalytique des chitinases de la famille 18 est également essentiel pour leur liaison avec les cyclopentapeptides (Dixon et al., 2005).
Synthèse bibliographique
4. La Pomme de terre
4.1 Taxonomie et botanique
La pomme de terre (Solanum tuberosum) est une Solanacée au même titre que la tomate (Lycopersicum esculentum), l'aubergine (Solanum esculentum), le tabac (Nicotiana
tabacum) ou le poivron (Capsicum annuum). Le genre Solanum est constitué d’environ 1000
espèces réparties à travers le monde, principalement en Amérique du Sud et en Amérique centrale. Environ 200 espèces de solanacées produisent des tubercules que l’on trouve de l’Argentine au Chili en passant par l’Uruguay, le Brésil, la Bolivie et le Pérou (Hawkes, 1990).
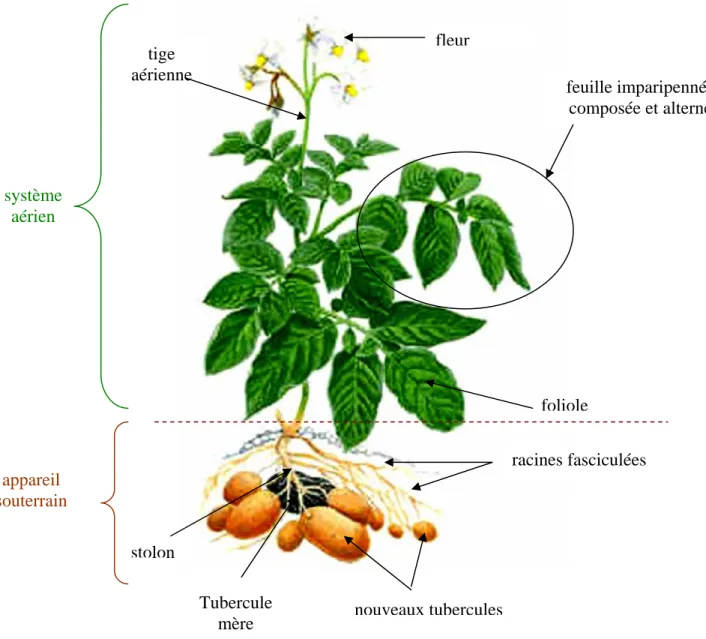
La pomme de terre est une plante herbacée, vivace et annuelle. La partie aérienne est constituée de tiges au port dressé pouvant atteindre un mètre de haut. Les feuilles sont composées de folioles ornées d’une pubescence et de trichomes glandulaires. Les inflorescences ombelliformes se développent à l’extrémité des tiges aériennes. Bien qu’étant autogames, les fleurs sont souvent stériles, rendant les croisements naturels et la fructification difficiles. La production de fruits est rare ; chaque baie peut contenir de nombreuses graines essentiellement utilisées pour les programmes de sélection variétale. Toutefois, la pomme de terre est rarement reproduite par voie sexuée et sa multiplication est principalement végétative au niveau de l’appareil souterrain. Celui-ci se met en place autour du tubercule mère qui possède des « yeux » à partir desquels se développent des germes, puis des tiges souterraines, les stolons, qui se ramifient. De nombreuses racines adventives naissent de ces stolons et assurent la croissance de la plante. Les tubercules sont des renflements des extrémités des stolons. Ils constituent des organes de réserve où est stocké l’amidon et permettent la multiplication végétative de la plante (Figure 11).
4.2 Historique
La domestication de la pomme de terre daterait d’au moins 9000 ans et a débuté en Amérique du Sud et en Amérique centrale où eurent lieu les premières sélections variétales. A partir de variétés tubéreuses diploïdes cultivées, sont apparues des plantes tétraploïdes aux propriétés qualitatives et quantitatives supérieures (Spire et Rouselle, 1996).
Figure 11 : Morphologie de la pomme de terre1 1 http://www.prosea.nl nouveaux tubercules fleur foliole feuille imparipennée composée et alterne système aérien stolon tige aérienne appareil souterrain Tubercule mère racines fasciculées
Synthèse bibliographique
L’introduction de la pomme de terre en Europe remonte au XVIème siècle lorsque les conquistadors espagnols découvrirent l’Amérique et la "papa". En France, ce n'est qu'au cours du XVIIIème siècle que va se développer la production de pommes de terre grâce à la ténacité du célèbre picard Antoine Augustin Parmentier qui l’introduit à la cour de Louis XVI et contribue à la diffusion de cette culture. Les années qui suivirent furent consacrées aux programmes de sélection qui permirent l’obtention de nouvelles variétés. La pomme de terre occupe aujourd’hui une place majeure dans l’agriculture européenne et mondiale.
4.3 Un légume d'importance économique
La production annuelle mondiale de pomme de terre est d'environ 311 millions de tonnes, pour un peu plus de 20 millions d'hectares cultivés (FAOSTAT, 20062). En France, après avoir connu un fort développement au XIXème siècle, la culture de la pomme de terre a fortement chuté depuis le début du XXème siècle. La France est actuellement le quatrième producteur européen de pommes de terre avec 160 000 hectares cultivés en 2003 et une production totale d'environ 6 millions de tonnes (Tableau 3) , dont environ 4,8 millions de tonnes de pommes de terre de conservation. Environ 140 variétés sont cultivées, parmi lesquelles on compte la Désirée, la Franceline, la Charlotte, la Ratte ou encore la Bintje. Une partie de la production de pomme de terre est également destinée à la féculerie (Figure 12). Cette industrie requiert des variétés riches en amidon, la plus cultivée étant la Kaptah Vandel, d'origine danoise. La fécule de pomme de terre a de nombreux débouchés, à 80% industriels: papeterie, chimie, pharmacie, textile, couches pour bébés et plus récemment l’incorporation dans les emballages plastiques.
La première région française productrice de pommes de terre est le Nord-Pas-de-Calais avec 35% de la production française, suivie de la Picardie avec 25%. Ces deux régions occupent également une place importante dans les approvisionnements destinés à l'industrie féculière et de transformation. De nombreux groupes de transformations sont implantés en Nord Pas-de-Calais / Picardie, notamment Roquette, Vico, Flodor, Lunor et Touquet Savour. Les autres régions productrices alimentent principalement le marché du frais et participent à la production de pomme de terre primeur. La France est le leader mondial de l’exportation avec 25 à 30 % de sa production annuelle, notamment vers ses voisins européens (UNPT, 2006). Les principaux clients de la France sont l'Espagne et l'Italie, ainsi que le Portugal et l'Allemagne pour le marché du frais, la Belgique et les Pays-Bas pour l'industrie de
2
http://faostat.fao.org