31
MOHAMMED V DE RABAT
FACULTE DE MEDECINE ET DE PHARMACIE - RABAT
DOYENS HONORAIRES :
1962 – 1969 : Professeur Abdelmalek FARAJ
1969 – 1974 : Professeur Abdellatif BERBICH
1974 – 1981 : Professeur Bachir LAZRAK
1981 – 1989 : Professeur Taieb CHKILI
1989 – 1997 : Professeur Mohamed Tahar ALAOUI
1997 – 2003 : Professeur Abdelmajid BELMAHI
2003 - 2013 : Professeur Najia HAJJAJ – HASSOUNI
ADMINISTRATION :
Doyen
Professeur Mohamed ADNAOUI
Vice-Doyen chargé des Affaires Académiques et estudiantines
Professeur Brahim LEKEHAL
Vice-Doyen chargé de la Recherche et de la Coopération
Professeur Toufiq DAKKA
Vice-Doyen chargé des Affaires Spécifiques à la Pharmacie
Professeur Jamal TAOUFIK
Secrétaire Général
1 - ENSEIGNANTS-CHERCHEURS MEDECINS ET PHARMACIENS
PROFESSEURS :
DECEMBRE 1984
Pr. MAAOUNI Abdelaziz Médecine Interne – Clinique Royale
Pr. MAAZOUZI Ahmed Wajdi Anesthésie -Réanimation
Pr. SETTAF Abdellatif Pathologie Chirurgicale
NOVEMBRE ET DECEMBRE 1985
Pr. BENSAID Younes Pathologie Chirurgicale
JANVIER, FEVRIER ET DECEMBRE 1987
Pr. LACHKAR Hassan Médecine Interne
Pr. YAHYAOUI Mohamed Neurologie
DECEMBRE 1989
Pr. ADNAOUI Mohamed Médecine Interne –Doyen de la FMPR
Pr. OUAZZANI Taïbi Mohamed Réda Neurologie
JANVIER ET NOVEMBRE 1990
Pr. HACHIM Mohammed* Médecine-Interne
Pr. KHARBACH Aîcha Gynécologie -Obstétrique
Pr. TAZI Saoud Anas Anesthésie Réanimation
FEVRIER AVRIL JUILLET ET DECEMBRE 1991 Pr. AZZOUZI Abderrahim Anesthésie Réanimation- Doyen de FMPO
Pr. BAYAHIA Rabéa Néphrologie
Pr. BELKOUCHI Abdelkader Chirurgie Générale
Pr. BENCHEKROUN Belabbes Abdellatif Chirurgie Générale
Pr. BENSOUDA Yahia Pharmacie galénique
Pr. BERRAHO Amina Ophtalmologie
Pr. BEZAD Rachid Gynécologie Obstétrique Méd. Chef Maternité des
Orangers
Pr. CHERRAH Yahia Pharmacologie
Pr. CHOKAIRI Omar Histologie Embryologie
Pr. KHATTAB Mohamed Pédiatrie
Pr. SOULAYMANI Rachida Pharmacologie- Dir. du Centre National PV Rabat Pr. TAOUFIK Jamal Chimie thérapeutique V.D à la pharmacie+Dir. du CEDOC +
DECEMBRE 1992
Pr. AHALLAT Mohamed Chirurgie Générale Doyen de FMPT
Pr. BENSOUDA Adil Anesthésie Réanimation
Pr. CHAHED OUAZZANI Laaziza Gastro-Entérologie
Pr. CHRAIBI Chafiq Gynécologie Obstétrique
Pr. EL OUAHABI Abdessamad Neurochirurgie
Pr. FELLAT Rokaya Cardiologie
Pr. GHAFIR Driss* Médecine Interne
Pr. JIDDANE Mohamed Anatomie
Pr. TAGHY Ahmed Chirurgie Générale
Pr. ZOUHDI Mimoun Microbiologie
MARS 1994
Pr. BENJAAFAR Noureddine Radiothérapie
Pr. BEN RAIS Nozha Biophysique
Pr. CAOUI Malika Biophysique
Pr. CHRAIBI Abdelmjid
Endocrinologie et Maladies Métaboliques Doyen de la
FMPA
Pr. EL AMRANI Sabah Gynécologie Obstétrique Pr. EL BARDOUNI Ahmed Traumato-Orthopédie Pr. EL HASSANI My Rachid Radiologie
Pr. ERROUGANI Abdelkader Chirurgie Générale – Directeur du CHIS-Rabat
Pr. ESSAKALI Malika Immunologie
Pr. ETTAYEBI Fouad Chirurgie Pédiatrique
Pr. HASSAM Badredine Dermatologie
Pr. IFRINE Lahssan Chirurgie Générale
Pr. MAHFOUD Mustapha Traumatologie – Orthopédie
Pr. RHRAB Brahim Gynécologie –Obstétrique
Pr. SENOUCI Karima Dermatologie
MARS 1994
Pr. ABBAR Mohamed* Urologie Directeur Hôpital My Ismail Meknès Pr. ABDELHAK M’barek Chirurgie – Pédiatrique
Pr. BENTAHILA Abdelali Pédiatrie
Pr. BENYAHIA Mohammed Ali Gynécologie – Obstétrique Pr. BERRADA Mohamed Saleh Traumatologie – Orthopédie Pr. CHERKAOUI Lalla Ouafae Ophtalmologie
Pr. LAKHDAR Amina Gynécologie Obstétrique
Pr. MOUANE Nezha Pédiatrie
MARS 1995
Pr. ABOUQUAL Redouane Réanimation Médicale
Pr. AMRAOUI Mohamed Chirurgie Générale
Pr. BARGACH Samir Gynécologie Obstétrique Pr. DRISSI KAMILI Med Nordine* Anesthésie Réanimation Pr. EL MESNAOUI Abbes Chirurgie Générale Pr. ESSAKALI HOUSSYNI Leila Oto-Rhino-Laryngologie
Pr. HDA Abdelhamid* Cardiologie Inspecteur du Service de Santé des FAR Pr. IBEN ATTYA ANDALOUSSI Ahmed Urologie
Pr. OUAZZANI CHAHDI Bahia Ophtalmologie
Pr. SEFIANI Abdelaziz Génétique
Pr. ZEGGWAGH Amine Ali Réanimation Médicale
DECEMBRE 1996
Pr. AMIL Touriya* Radiologie
Pr. BELKACEM Rachid Chirurgie Pédiatrie Pr. BOULANOUAR Abdelkrim Ophtalmologie Pr. EL ALAMI EL FARICHA EL Hassan Chirurgie Générale
Pr. GAOUZI Ahmed Pédiatrie
Pr. MAHFOUDI M’barek* Radiologie
Pr. OUZEDDOUN Naima Néphrologie
Pr. ZBIR EL Mehdi* Cardiologie DirecteurHôp.Mil. d’Instruction Med V Rabat
NOVEMBRE 1997
Pr. ALAMI Mohamed Hassan Gynécologie-Obstétrique
Pr. BEN SLIMANE Lounis Urologie
Pr. BIROUK Nazha Neurologie
Pr. ERREIMI Naima Pédiatrie
Pr. FELLAT Nadia Cardiologie
Pr. KADDOURI Noureddine Chirurgie Pédiatrique
Pr. KOUTANI Abdellatif Urologie
Pr. LAHLOU Mohamed Khalid Chirurgie Générale
Pr. MAHRAOUI CHAFIQ Pédiatrie
Pr. TOUFIQ Jallal Psychiatrie Directeur Hôp.Ar-razi Salé
Pr. YOUSFI MALKI Mounia Gynécologie Obstétrique
NOVEMBRE 1998
Pr. BENOMAR ALI Neurologie Doyen de la FMP Abulcassis Pr. BOUGTAB Abdesslam Chirurgie Générale
Pr. ER RIHANI Hassan Oncologie Médicale
Pr. BENKIRANE Majid* Hématologie
JANVIER 2000
Pr. ABID Ahmed* Pneumo-phtisiologie
Pr. AIT OUAMAR Hassan Pédiatrie
Pr. BENJELLOUN Dakhama Badr.Sououd Pédiatrie
Pr. BOURKADI Jamal-Eddine Pneumo-phtisiologie Directeur Hôp. My Youssef Pr. CHARIF CHEFCHAOUNI Al Montacer Chirurgie Générale
Pr. ECHARRAB El Mahjoub Chirurgie Générale Pr. EL FTOUH Mustapha Pneumo-phtisiologie
Pr. EL MOSTARCHID Brahim* Neurochirurgie
Pr. MAHMOUDI Abdelkrim* Anesthésie-Réanimation Pr. TACHINANTE Rajae Anesthésie-Réanimation Pr. TAZI MEZALEK Zoubida Médecine Interne
NOVEMBRE 2000
Pr. AIDI Saadia Neurologie
Pr. AJANA Fatima Zohra Gastro-Entérologie
Pr. BENAMR Said Chirurgie Générale
Pr. CHERTI Mohammed Cardiologie
Pr. ECH-CHERIF EL KETTANI Selma Anesthésie-Réanimation
Pr. EL HASSANI Amine Pédiatrie - Directeur Hôp.Cheikh Zaid
Pr. EL KHADER Khalid Urologie
Pr. EL MAGHRAOUI Abdellah* Rhumatologie
Pr. GHARBI Mohamed El Hassan Endocrinologie et Maladies Métaboliques
Pr. MDAGHRI ALAOUI Asmae Pédiatrie
Pr. ROUIMI Abdelhadi* Neurologie
DECEMBRE 2000
Pr.ZOHAIR ABDELLAH * ORL
Pr. BALKHI Hicham* Anesthésie-Réanimation
Pr. BENABDELJLIL Maria Neurologie
Pr. BENAMAR Loubna Néphrologie
Pr. BENAMOR Jouda Pneumo-phtisiologie
Pr. BENELBARHDADI Imane Gastro-Entérologie
Pr. BENNANI Rajae Cardiologie
Pr. BENOUACHANE Thami Pédiatrie
Pr. BEZZA Ahmed* Rhumatologie
Pr. BOUCHIKHI IDRISSI Med Larbi Anatomie Pr. BOUMDIN El Hassane* Radiologie
Pr. CHAT Latifa Radiologie
Pr. DAALI Mustapha* Chirurgie Générale
Pr. DRISSI Sidi Mourad* Radiologie
Pr. EL HIJRI Ahmed Anesthésie-Réanimation
Pr. EL MAAQILI Moulay Rachid Neuro-Chirurgie
Pr. EL MADHI Tarik Chirurgie-Pédiatrique
Pr. EL OUNANI Mohamed Chirurgie Générale
Pr. ETTAIR Said Pédiatrie - Directeur Hôp. d’EnfantsRabat
Pr. GAZZAZ Miloudi* Neuro-Chirurgie
Pr. HRORA Abdelmalek Chirurgie Générale
Pr. KABIRI EL Hassane* Chirurgie Thoracique Pr. LAMRANI Moulay Omar Traumatologie Orthopédie
Pr. LEKEHAL Brahim Chirurgie Vasculaire Périphérique Pr. MAHASSIN Fattouma* Médecine Interne
Pr. MEDARHRI Jalil Chirurgie Générale
Pr. MIKDAME Mohammed* Hématologie Clinique
Pr. MOHSINE Raouf Chirurgie Générale
Pr. NOUINI Yassine Urologie - Directeur Hôpital Ibn Sina
Pr. SABBAH Farid Chirurgie Générale
Pr. SEFIANI Yasser Chirurgie Vasculaire Périphérique Pr. TAOUFIQ BENCHEKROUN Soumia Pédiatrie
DECEMBRE 2002
Pr. AL BOUZIDI Abderrahmane* Anatomie Pathologique
Pr. AMEUR Ahmed * Urologie
Pr. AMRI Rachida Cardiologie
Pr. AOURARH Aziz* Gastro-Entérologie
Pr. BAMOU Youssef * Biochimie-Chimie
Pr. BELMEJDOUB Ghizlene* Endocrinologie et Maladies Métaboliques
Pr. BENZEKRI Laila Dermatologie
Pr. BENZZOUBEIR Nadia Gastro-Entérologie Pr. BERNOUSSI Zakiya Anatomie Pathologique Pr. BICHRA Mohamed Zakariya* Psychiatrie
Pr. CHOHO Abdelkrim * Chirurgie Générale
Pr. CHKIRATE Bouchra Pédiatrie
Pr. EL ALAMI EL Fellous Sidi Zouhair Chirurgie Pédiatrique Pr. EL HAOURI Mohamed * Dermatologie
Pr. FILALI ADIB Abdelhai Gynécologie Obstétrique
Pr. HAJJI Zakia Ophtalmologie
Pr. IKEN Ali Urologie
Pr. JAAFAR Abdeloihab* Traumatologie Orthopédie
Pr. KRIOUILE Yamina Pédiatrie
Pr. MABROUK Hfid* Traumatologie Orthopédie
Pr. MOUSSAOUI RAHALI Driss* Gynécologie Obstétrique Pr. OUJILAL Abdelilah Oto-Rhino-Laryngologie Pr. RACHID Khalid * Traumatologie Orthopédie
Pr. RAISS Mohamed Chirurgie Générale
Pr. RGUIBI IDRISSI Sidi Mustapha* Pneumo-phtisiologie
Pr. RHOU Hakima Néphrologie
Pr. SIAH Samir * Anesthésie Réanimation
Pr. THIMOU Amal Pédiatrie
JANVIER 2004
Pr. ABDELLAH El Hassan Ophtalmologie
Pr. AMRANI Mariam Anatomie Pathologique
Pr. BENBOUZID Mohammed Anas Oto-Rhino-Laryngologie Pr. BENKIRANE Ahmed* Gastro-Entérologie
Pr. BOULAADAS Malik Stomatologie et Chirurgie Maxillo-faciale
Pr. BOURAZZA Ahmed* Neurologie
Pr. CHAGAR Belkacem* Traumatologie Orthopédie
Pr. CHERRADI Nadia Anatomie Pathologique
Pr. EL FENNI Jamal* Radiologie
Pr. EL HANCHI ZAKI Gynécologie Obstétrique Pr. EL KHORASSANI Mohamed Pédiatrie
Pr. EL YOUNASSI Badreddine* Cardiologie
Pr. HACHI Hafid Chirurgie Générale
Pr. JABOUIRIK Fatima Pédiatrie
Pr. KHARMAZ Mohamed Traumatologie Orthopédie Pr. MOUGHIL Said Chirurgie Cardio-Vasculaire Pr. OUBAAZ Abdelbarre * Ophtalmologie
Pr. TARIB Abdelilah* Pharmacie Clinique
Pr. TIJAMI Fouad Chirurgie Générale
Pr. ZARZUR Jamila Cardiologie
JANVIER 2005
Pr. ABBASSI Abdellah Chirurgie Réparatrice et Plastique Pr. AL KANDRY Sif Eddine* Chirurgie Générale
Pr. ALLALI Fadoua Rhumatologie
Pr. AMAZOUZI Abdellah Ophtalmologie
Pr. AZIZ Noureddine* Radiologie
Pr. BAHIRI Rachid Rhumatologie Directeur Hôp. Al Ayachi Salé
Pr. BARKAT Amina Pédiatrie
Pr. BENYASS Aatif Cardiologie
Pr. DOUDOUH Abderrahim* Biophysique
Pr. EL HAMZAOUI Sakina * Microbiologie
Pr. HAJJI Leila Cardiologie (mise en disponibilité
Pr. HESSISSEN Leila Pédiatrie
Pr. JIDAL Mohamed* Radiologie
Pr. LAAROUSSI Mohamed Chirurgie Cardio-vasculaire
Pr. LYAGOUBI Mohammed Parasitologie
Pr. RAGALA Abdelhak Gynécologie Obstétrique
Pr. SBIHI Souad Histo-Embryologie Cytogénétique
AVRIL 2006
Pr. ACHEMLAL Lahsen* Rhumatologie
Pr. AKJOUJ Said* Radiologie
Pr. BELMEKKI Abdelkader* Hématologie
Pr. BENCHEIKH Razika O.R.L
Pr. BIYI Abdelhamid* Biophysique
Pr. BOUHAFS Mohamed El Amine Chirurgie - Pédiatrique
Pr. BOULAHYA Abdellatif* Chirurgie Cardio – Vasculaire. Pr. CHENGUETI ANSARI Anas Gynécologie Obstétrique
Pr. DOGHMI Nawal Cardiologie
Pr. FELLAT Ibtissam Cardiologie
Pr. FAROUDY Mamoun Anesthésie Réanimation
Pr. HARMOUCHE Hicham Médecine Interne
Pr. HANAFI Sidi Mohamed* Anesthésie Réanimation Pr. IDRISS LAHLOU Amine* Microbiologie
Pr. JROUNDI Laila Radiologie
Pr. KARMOUNI Tariq Urologie
Pr. KILI Amina Pédiatrie
Pr. KISRA Hassan Psychiatrie
Pr. KISRA Mounir Chirurgie – Pédiatrique
Pr. LAATIRIS Abdelkader* Pharmacie Galénique Pr. LMIMOUNI Badreddine* Parasitologie
Pr. MANSOURI Hamid* Radiothérapie
Pr. OUANASS Abderrazzak Psychiatrie
Pr. SAFI Soumaya* Endocrinologie
Pr. SEKKAT Fatima Zahra Psychiatrie
Pr. SOUALHI Mouna Pneumo – Phtisiologie
Pr. TELLAL Saida* Biochimie
Pr. ZAHRAOUI Rachida Pneumo – Phtisiologie
DECEMBRE 2006
Pr SAIR Khalid Chirurgie générale Dir. Hôp.Av.Marrakech
OCTOBRE 2007
Pr. ABIDI Khalid Réanimation médicale
Pr. ACHACHI Leila Pneumo phtisiologie
Pr. ACHOUR Abdessamad* Chirurgie générale
Pr. AIT HOUSSA Mahdi * Chirurgie cardio vasculaire Pr. AMHAJJI Larbi * Traumatologie orthopédie
Pr. AOUFI Sarra Parasitologie
Pr. BAITE Abdelouahed * Anesthésie réanimation Directeur ERSSM Pr. BALOUCH Lhousaine * Biochimie-chimie
Pr. BOUTIMZINE Nourdine Ophtalmologie Pr. CHERKAOUI Naoual * Pharmacie galénique Pr. EHIRCHIOU Abdelkader * Chirurgie générale
Pr. EL BEKKALI Youssef * Chirurgie cardio-vasculaire Pr. EL ABSI Mohamed Chirurgie générale
Pr. EL MOUSSAOUI Rachid Anesthésie réanimation
Pr. EL OMARI Fatima Psychiatrie
Pr. GHARIB Noureddine Chirurgie plastique et réparatrice
Pr. HADADI Khalid * Radiothérapie
Pr. ICHOU Mohamed * Oncologie médicale
Pr. ISMAILI Nadia Dermatologie
Pr. KEBDANI Tayeb Radiothérapie
Pr. LALAOUI SALIM Jaafar * Anesthésie réanimation
Pr. LOUZI Lhoussain * Microbiologie
Pr. MADANI Naoufel Réanimation médicale
Pr. MAHI Mohamed * Radiologie
Pr. MARC Karima Pneumo phtisiologie
Pr. MASRAR Azlarab Hématologie biologique
Pr. MRANI Saad * Virologie
Pr. OUZZIF Ez zohra * Biochimie-chimie
Pr. RABHI Monsef * Médecine interne
Pr. RADOUANE Bouchaib* Radiologie
Pr. SEFFAR Myriame Microbiologie
Pr. SEKHSOKH Yessine * Microbiologie
Pr. SIFAT Hassan * Radiothérapie
Pr. TABERKANET Mustafa * Chirurgie vasculaire périphérique
Pr. TACHFOUTI Samira Ophtalmologie
Pr. TAJDINE Mohammed Tariq* Chirurgie générale Pr. TANANE Mansour * Traumatologie-orthopédie
Pr. TLIGUI Houssain Parasitologie
Pr. TOUATI Zakia Cardiologie
DECEMBRE 2008
Pr TAHIRI My El Hassan* Chirurgie Générale
MARS 2009
Pr. ABOUZAHIR Ali * Médecine interne
Pr. AGADR Aomar * Pédiatrie
Pr. AIT ALI Abdelmounaim * Chirurgie Générale Pr. AIT BENHADDOU El Hachmia Neurologie
Pr. AKHADDAR Ali * Neuro-chirurgie
Pr. ALLALI Nazik Radiologie
Pr. ARKHA Yassir Neuro-chirurgie Directeur Hôp.des Spécialités Pr. BELYAMANI Lahcen* Anesthésie Réanimation
Pr. BJIJOU Younes Anatomie
Pr. BOUHSAIN Sanae * Biochimie-chimie
Pr. BOUI Mohammed * Dermatologie
Pr. BOUNAIM Ahmed * Chirurgie Générale
Pr. BOUSSOUGA Mostapha * Traumatologie-orthopédie
Pr. CHTATA Hassan Toufik * Chirurgie Vasculaire Périphérique Pr. DOGHMI Kamal * Hématologie clinique
Pr. EL MALKI Hadj Omar Chirurgie Générale Pr. EL OUENNASS Mostapha* Microbiologie
Pr. ENNIBI Khalid * Médecine interne
Pr. FATHI Khalid Gynécologie obstétrique
Pr. HASSIKOU Hasna * Rhumatologie
Pr. KABBAJ Nawal Gastro-entérologie
Pr. KABIRI Meryem Pédiatrie
Pr. KARBOUBI Lamya Pédiatrie
Pr. LAMSAOURI Jamal * Chimie Thérapeutique Pr. MARMADE Lahcen Chirurgie Cardio-vasculaire
Pr. MESKINI Toufik Pédiatrie
Pr. MESSAOUDI Nezha * Hématologie biologique
Pr. MSSROURI Rahal Chirurgie Générale
Pr. NASSAR Ittimade Radiologie
Pr. OUKERRAJ Latifa Cardiologie
Pr. RHORFI Ismail Abderrahmani * Pneumo-Phtisiologie
OCTOBRE 2010
Pr. ALILOU Mustapha Anesthésie réanimation
Pr. AMEZIANE Taoufiq* Médecine Interne
Pr. BELAGUID Abdelaziz Physiologie
Pr. CHADLI Mariama* Microbiologie
Pr. CHEMSI Mohamed* Médecine Aéronautique
Pr. DAMI Abdellah* Biochimie- Chimie
Pr. DARBI Abdellatif* Radiologie
Pr. DENDANE Mohammed Anouar Chirurgie Pédiatrique
Pr. EL HAFIDI Naima Pédiatrie
Pr. EL KHARRAS Abdennasser* Radiologie
Pr. EL MAZOUZ Samir Chirurgie Plastique et Réparatrice
Pr. EL SAYEGH Hachem Urologie
Pr. ERRABIH Ikram Gastro-Entérologie
Pr. LAMALMI Najat Anatomie Pathologique
Pr. MOSADIK Ahlam Anesthésie Réanimation
Pr. MOUJAHID Mountassir* Chirurgie Générale
Pr. NAZIH Mouna* Hématologie
DECEMBRE 2010
Pr.ZNATI Kaoutar Anatomie Pathologique
MAI 2012
Pr. AMRANI Abdelouahed Chirurgie pédiatrique Pr. ABOUELALAA Khalil * Anesthésie Réanimation Pr. BENCHEBBA Driss * Traumatologie-orthopédie Pr. DRISSI Mohamed * Anesthésie Réanimation Pr. EL ALAOUI MHAMDI Mouna Chirurgie Générale Pr. EL KHATTABI Abdessadek * Médecine Interne Pr. EL OUAZZANI Hanane * Pneumophtisiologie
Pr. ER-RAJI Mounir Chirurgie Pédiatrique
Pr. JAHID Ahmed Anatomie Pathologique
Pr. MEHSSANI Jamal * Psychiatrie
Pr. RAISSOUNI Maha * Cardiologie
* Enseignants Militaires FEVRIER 2013
Pr.AHID Samir Pharmacologie
Pr.AIT EL CADI Mina Toxicologie
Pr.AMRANI HANCHI Laila Gastro-Entérologie
Pr.AMOR Mourad Anesthésie Réanimation
Pr.AWAB Almahdi Anesthésie Réanimation
Pr.BELAYACHI Jihane Réanimation Médicale
Pr.BELKHADIR Zakaria Houssain Anesthésie Réanimation
Pr.BENCHEKROUN Laila Biochimie-Chimie
Pr.BENKIRANE Souad Hématologie
Pr.BENNANA Ahmed* Informatique Pharmaceutique Pr.BENSGHIR Mustapha * Anesthésie Réanimation
Pr.BENYAHIA Mohammed * Néphrologie
Pr.BOUATIA Mustapha Chimie Analytique et Bromatologie Pr.BOUABID Ahmed Salim* Traumatologie orthopédie
Pr BOUTARBOUCH Mahjouba Anatomie
Pr.CHAIB Ali * Cardiologie
Pr.DENDANE Tarek Réanimation Médicale
Pr.DINI Nouzha * Pédiatrie
Pr.ECH-CHERIF EL KETTANI Mohamed Ali Anesthésie Réanimation Pr.ECH-CHERIF EL KETTANI Najwa Radiologie
Pr.EL FATEMI NIZARE Neuro-chirurgie
Pr.EL GUERROUJ Hasnae Médecine Nucléaire
Pr.EL JAOUDI Rachid * Toxicologie
Pr.EL KABABRI Maria Pédiatrie
Pr.EL KHANNOUSSI Basma Anatomie Pathologique
Pr.EL KHLOUFI Samir Anatomie
Pr.EL KORAICHI Alae Anesthésie Réanimation
Pr.EN-NOUALI Hassane * Radiologie
Pr.ERRGUIG Laila Physiologie
Pr.FIKRI Meryem Radiologie
Pr.GHFIR Imade Médecine Nucléaire
Pr.IMANE Zineb Pédiatrie
Pr.IRAQI Hind Endocrinologie et maladies métaboliques
Pr.KABBAJ Hakima Microbiologie
Pr.KADIRI Mohamed * Psychiatrie
Pr.MAAMAR Mouna Fatima Zahra Médecine Interne
Pr.MEDDAH Bouchra Pharmacologie
Pr.MELHAOUI Adyl Neuro-chirurgie
Pr.MRABTI Hind Oncologie Médicale
Pr.NEJJARI Rachid Pharmacognosie
Pr.OUBEJJA Houda Chirugie Pédiatrique
Pr.OUKABLI Mohamed * Anatomie Pathologique
Pr.RAHALI Younes Pharmacie Galénique
Pr.RATBI Ilham Génétique
Pr.RAHMANI Mounia Neurologie
Pr.REDA Karim * Ophtalmologie
Pr.REGRAGUI Wafa Neurologie
Pr.RKAIN Hanan Physiologie
Pr.ROSTOM Samira Rhumatologie
Pr.ROUAS Lamiaa Anatomie Pathologique
Pr.ROUIBAA Fedoua * Gastro-Entérologie
Pr SALIHOUN Mouna Gastro-Entérologie
Pr.SAYAH Rochde Chirurgie Cardio-Vasculaire
Pr.SEDDIK Hassan * Gastro-Entérologie
Pr.ZERHOUNI Hicham Chirurgie Pédiatrique
AVRIL 2013
Pr.EL KHATIB MOHAMED KARIM * Stomatologie et Chirurgie Maxillo-faciale
MAI 2013
Pr.BOUSLIMAN Yassir Toxicologie
MARS 2014
Pr. ACHIR Abdellah Chirurgie Thoracique
Pr.BENCHAKROUN Mohammed * Traumatologie- Orthopédie
Pr.BOUCHIKH Mohammed Chirurgie Thoracique
Pr. EL KABBAJ Driss * Néphrologie
Pr. EL MACHTANI IDRISSI Samira * Biochimie-Chimie
Pr. HARDIZI Houyam Histologie- Embryologie-Cytogénétique
Pr. HASSANI Amale * Pédiatrie
Pr. HERRAK Laila Pneumologie
Pr. JANANE Abdellah * Urologie
Pr. JEAIDI Anass * Hématologie Biologique
Pr. KOUACH Jaouad* Gynécologie-Obstétrique
Pr. LEMNOUER Abdelhay* Microbiologie
Pr. MAKRAM Sanaa * Pharmacologie
Pr. OULAHYANE Rachid* Chirurgie Pédiatrique
Pr. RHISSASSI Mohamed Jaafar CCV
Pr. SABRY Mohamed* Cardiologie
Pr. SEKKACH Youssef* Médecine Interne
Pr. TAZI MOUKHA Zakia Gynécologie-Obstétrique
AVRIL 2014
PROFESSEURS AGREGES :
DECEMBRE 2014
Pr. ABILKASSEM Rachid* Pédiatrie
Pr. AIT BOUGHIMA Fadila Médecine Légale
Pr. BEKKALI Hicham * Anesthésie-Réanimation
Pr. BENAZZOU Salma Chirurgie Maxillo-Faciale
Pr. BOUABDELLAH Mounya Biochimie-Chimie
Pr. BOUCHRIK Mourad* Parasitologie
Pr. DERRAJI Soufiane* Pharmacie Clinique
Pr. DOBLALI Taoufik* Microbiologie
Pr. EL AYOUBI EL IDRISSI Ali Anatomie
Pr. EL GHADBANE Abdedaim Hatim* Anesthésie-Réanimation
Pr. EL MARJANY Mohammed* Radiothérapie
Pr. FEJJAL Nawfal Chirurgie Réparatrice et Plastique
Pr. JAHIDI Mohamed* O.R.L
Pr. LAKHAL Zouhair* Cardiologie
Pr. OUDGHIRI NEZHA Anesthésie-Réanimation
Pr. RAMI Mohamed Chirurgie Pédiatrique
Pr. SABIR Maria Psychiatrie
Pr. SBAI IDRISSI Karim* Médecine préventive, santé publique et Hyg.
AOUT 2015
Pr. MEZIANE Meryem Dermatologie
Pr. TAHRI Latifa Rhumatologie
JANVIER 2016
Pr. BENKABBOU Amine Chirurgie Générale
Pr. EL ASRI Fouad* Ophtalmologie
Pr. ERRAMI Noureddine* O.R.L
Pr. NITASSI Sophia O.R.L
JUIN 2017
Pr. ABI Rachid* Microbiologie
Pr. ASFALOU Ilyasse* Cardiologie
Pr. BOUAYTI El Arbi* Médecine préventive, santé publique et Hyg.
Pr. BOUTAYEB Saber Oncologie Médicale
Pr. EL GHISSASSI Ibrahim Oncologie Médicale
Pr. OURAINI Saloua* O.R.L
Pr. RAZINE Rachid Médecine préventive, santé publique et Hyg.
Pr. ZRARA Abdelhamid* Immunologie
2 - ENSEIGNANTS-CHERCHEURS SCIENTIFIQUES
PROFESSEURS/Prs. HABILITES
Pr. ABOUDRAR Saadia Physiologie
Pr. ALAMI OUHABI Naima Biochimie-chimie
Pr. ALAOUI KATIM Pharmacologie
Pr. ALAOUI SLIMANI Lalla Naïma Histologie-Embryologie
Pr. ANSAR M’hammed Chimie Organique et Pharmacie Chimique
Pr .BARKIYOU Malika Histologie-Embryologie
Pr. BOUHOUCHE Ahmed Génétique Humaine
Pr. BOUKLOUZE Abdelaziz Applications Pharmaceutiques Pr. CHAHED OUAZZANI Lalla Chadia Biochimie-chimie
Pr. DAKKA Taoufiq Physiologie
Pr. FAOUZI Moulay El Abbes Pharmacologie
Pr. IBRAHIMI Azeddine Biologie moléculaire/Biotechnologie
Pr. KHANFRI Jamal Eddine Biologie
Pr. OULAD BOUYAHYA IDRISSI Med Chimie Organique
Pr. REDHA Ahlam Chimie
Pr. TOUATI Driss Pharmacognosie
Pr. ZAHIDI Ahmed Pharmacologie
Mise à jour le 10/10/2018 Khaled Abdellah
A mon très cher père Dr Adjou:
A celui qui m’a entouré d’attention, m’a appris les valeurs nobles de la vie,
de l’honnêteté et de la responsabilité.
Merci d’être toujours là pour moi, un soutien inconditionnel tout au long
de mes études.
Tu as été et tu seras toujours un exemple à suivre pour tes qualités
humaines et ta persévérance.
Aucune dédicace ne serait exprimer ma reconnaissance et mon amour
éternel pour les sacrifices que tu as consenti pour mon éducation.
J’espère de tout cœur que cette thèse t’apporte la joie de voir aboutir tes
espoirs Puisse dieu, le tout puissant, te préserver et t’accorder santé,
longue vie et bonheur.
A ma très chère mère
Tu es pour moi le symbole de la bonté par excellence, la source de tendresse
et l’exemple du dévouement.
Aucune dédicace ne pourrait être assez éloquente pour exprimer ce que tu
mérites.
Je te dédie ce travail en témoignage de mon profond amour.
Puisse Allah, te protéger et te procurer santé et longue vie.
A mon merveilleux frère Fahd.
Merci de me supporter, de m’encourager et de croire inconditionnellement
en moi.
Je te dédie ce modeste travail en témoignage de l’amour, l’affection et
l’attachement que je te porte.
A ma grand-mère paternelle
Je te remercie infiniment pour tes encouragements et tes prières tout au
long de mon parcours.
Puisse Dieu te préserver du mal, te comble de santé et de bonheur.
A la mémoire de mes grands-parents maternels et de
mon grand-père paternel
Qui sont toujours dans mon cœur et mon esprit et qui le seront à tout
jamais
Je vous dédie aujourd’hui ce travail.
Que dieu, le miséricordieux, vous accueille dans son éternel paradis.
A mes très chères amies
Ichraq Achour, Najoua Ahjiej, Lina Guennoun
En souvenir des instants merveilleux que nous avons passés.
Un grand merci pour votre soutien, vos encouragements et votre appui.
Avec toute mon affection, je vous souhaite une vie pleine de bonheur et de
succès.
Je prie Dieu, pour que notre amitié soit éternelle.
A tous mes maîtres de l’enseignement primaire,
secondaire et supérieur.
A tous ceux qui ont contribué de près ou de loin à
l’élaboration de ce travail.
A
Notre maître et président de thèse
Mr. le Professeur Ahmed GAOUZI
Professeur de Pédiatrie
Vous m’avez accordé un immense honneur et un grand privilège en
acceptant la présidence du jury de cette thèse.
Veuillez trouver Monsieur et cher Maître dans ce travail, le témoignage de
ma profonde gratitude, considération et grande estime.
A
Notre maître et directeur de thèse
Mr. Le professeur Mohamed El Khorassani
Professeur de pédiatrie
Merci pour m’avoir accueilli dans votre service et pour m’avoir accepté ce
sujet de thèse, pour la confiance que vous m’avez accordée du début à la
fin du travail et pour votre disponibilité.
Vous n’avez jamais lésiné ni sur votre temps ni sur votre savoir tout le
long de ce travail.
Merci pour votre soutien, votre patience, et votre optimisme infaillible.
Je n’oublie pas enfin votre aide précieuse dans la relecture et la correction
de ma thèse.
Je vous prie de trouver ici, cher Professeur, le témoignage de ma profonde
reconnaissance et de mon immense respect.
A
Notre maître et juge de thèse
Mr. Azlarab MASRAR
Professeur d’hématologie biologique
Je vous remercie énormément de l’honneur que vous me faites en acceptant
de juger ce travail.
Veuillez recevoir ici Monsieur et Cher Maître l’expression de mes vifs
remerciements, ma profonde reconnaissance et grande estime.
A
Notre maître et juge de thèse
Madame Le Professeur Maria El KABABRI
Vous me faites aujourd’hui un grand honneur en acceptant de faire partie
du jury de cette thèse.
Veuillez recevoir ici chère Maître l’expression de ma profonde gratitude et
grande estime.
A
Notre maître et juge de thèse
Mr. Le Professeur Aomar AGADR
Professeur de Pédiatrie
Je vous remercie profondément de l’honneur que vous nous faites en
acceptant de siéger parmi le jury de cette thèse.
Puisse ce travail témoigner de ma profonde reconnaissance et grande
estime. Veuillez croire à mes sincères remerciements.
Liste des abréviations :
EDTA : Acide éthylène diamine tétraacétique
NFS : Numération formule sanguine
Hb : Hémoglobine
Ht : Hématocrite
VGM : Volume globulaire moyen
TCMH : Teneur corpusculaire moyenne en hémoglobine
CCMH : Concentration corpusculaire moyenne en hémoglobine
MGG : May-Grünwald-Giemsa
MCDh : Micro Chromatic Detection for Haematology
RFID : Identification par radiofréquence
RDW-CV : Red cell distribution width
DS : Déviation standard
GR : Globule rouge
Epo : Erythropoïétine
ADN : Acide désoxyribonucléique
µm : Micromètre
G6PD : Glucose-6-phosphate déshydrogénase
RGO : Reflux gastro-œsophagien
AINS : Anti-inflammatoire non stéroïdien
SMG : Splénomégalie
fL : Femtolitre
pg : Picogramme
UMP : Uridine monophosphate
ARN : Acide ribonucléique
PK : Pyruvate Kinase
pH : Potentiel hydrogène
AHAI : Anémie hémolytique auto-immune
Liste
Liste des figures :
Figure 1: Tube EDTA. ...7 Figure 2: Confection du frottis sanguin. ... 12 Figure 3: Automate Sysmex SP-1000i du Laboratoire Central d’Hématologie du CHU
Ibn Sina de Rabat. ... 13
Figure 4: Frottis de bonne qualité. ... 14 Figure 5: Zones du frottis sanguin. ... 14 Figure 6: KIT RAL STAINER MCDh. ... 21 Figure 7: Automate semi automatique RAL STAINER du Laboratoire Central
d’Hématologie de CHU Ibn Sina de Rabat. ... 22
Figure 8: Répartition des patients selon le sexe. ... 25 Figure 9: Répartition des patients selon l’âge. ... 26 Figure 10: Répartition des cas selon le taux d’Hb... 27 Figure 11: Les différents aspects du VGM trouvé à l’hémogramme. ... 28 Figure 12: L’érythropoïèse. ... 41 Figure 13: GR vue de profil et de face... 44 Figure 14: Globules rouges au microscope à balayage électronique mettant en
évidence leur aspect biconcave. ... 44
Figure 15: Schéma de la structure interne du globule rouge. ... 44 Figure 16: Pâleur conjonctivo-palmaire... 46 Figure 17: Etiologies de l’anémie de l’enfant. ... 51 Figure 18: Exemple de frottis montrant des macrocytes (89 éme cas de notre étude).
... 59
Figure 19: Annulocytes. ... 60 Figure 20: Schizocyte (42 éme cas de notre étude). ... 61 Figure 21: Elliptocyte (75 éme cas de notre étude). ... 61 Figure 22: Exemple de frottis sanguin arborant des dacryocytes (18 éme cas de notre
étude). ... 62
Figure 23: Stomatocytes (38 éme cas de notre étude). ... 63 Figure 24: Exemple de frottis sanguin montrant des acanthocytes. (71 éme cas de
notre étude) ... 64
Figure 25: Hématies cibles. ... 65 Figure 26: Echinocytes et acanthocytes (23 éme cas de notre étude). ... 66 Figure 27: Drépanocytes (56 éme cas de notre étude). ... 67
Figure 28: Exemple de frottis sanguin montrant des sphérocytes. (72 éme cas de notre
étude). ... 68
Figure 29: Hématies fantômes. ... 69 Figure 30: Ponctuations basophiles. ... 71
Liste des tableaux :
Tableau I: Indications cliniques nécessitant la réalisation du frottis sanguin. ...10
Tableau II: Classification générale selon le VGM et la CCMH. ...29
Tableau III: Les anomalies érythrocytaires perçues durant notre étude du frottis
sanguin de 100 nourrissons et enfants anémiques. ...31
Tableau IV: Normes de l’hémoglobine en fonction de l’âge ...39
Tableau V: Répartition selon le sexe rapporté par les différentes études. ...53
Tableau VI: Répartition selon les tranches d’âges rapportée par les études. ...54
Tableau VII: Répartition selon la sévérité de l’anémie rapportée par les diverses
études. ...56
Tableau VIII: Pathologies les plus fréquentes en fonction du type d’anémie. ...57
Tableau IX: Les inclusions intra-érythrocytaires et les pathologies auxquelles elles
sont associées. ...70
Tableau X: Interprétation des anomalies morphologiques des globules rouges sur
Introduction ...1 Matériels et méthodes ...4
I. Patients :...5
1. Type et population d’étude : ...5
2. Lieu et période d’étude : ...5
3. Critères d’inclusion : ...5
II. Méthodes :...5
1. Collecte des données : ...5
2. Prélèvements : ...6
3. Méthodes d’analyse :...7
3.1. Hémogramme : ...7
3.2. Frottis sanguin : ...8
3.2.1. Délai pour confectionner un frottis : ...8
3.2.2. Indications du frottis : ...9
3.2.3. Identification du frottis sanguin : ... 10
3.2.4. Confection du frottis : ... 11
3.2.5. Coloration du frottis : ... 16
3.2.6. Examen du frottis sanguin : ... 22
4. Méthodes d’analyse et traitement des données : ... 23
Résultats ... 24
I. Répartition des patients selon le sexe : ... 25
II. Répartition des patients selon l’âge : ... 26
III. Répartition des patients selon le taux d’hémoglobine : ... 27
V. Résultats en fonction des anomalies érythrocytaires sur frottis sanguins : ... 30
Discussion... 38
I. Rappel : ... 39
1. Définition de l’anémie : ... 39
2. Physiologie de l’érythropoïèse : ... 40
3. Morphologie du globule rouge : ... 42
4. Diagnostic de l’anémie de l’enfant : ... 45
4.1. Circonstances de découverte : ... 45
4.2. La démarche diagnostic : ... 46
4.2.1. Etude clinique : ... 46
4.2.2. Etude biologique : ... 47
II. Discussion des résultats : ... 52
1. Répartition selon le sexe :... 52
2. Répartition selon les tranches d’âges : ... 53
3. Répartition selon le taux d’hémoglobine : ... 55
4. Répartition en fonction des constantes érythrocytaires : ... 56
5. Discussion des résultats en fonction des anomalies érythrocytaires sur ... 57
frottis sanguin : ... 57
5.1. Les anomalies de la taille : ... 58
5.1.1. Anisocytose : ... 58
5.1.2. Microcytose : ... 58
5.1.3. Macrocytose : ... 58
5.2. Les anomalies de la teinte : ... 59
5.3.1. Les schizocytes : ... 60
5.3.2. Les elliptocytes :... 61
5.3.3. Les dacryocytes : ... 62
5.3.4. Les stomatocytes : ... 62
5.3.5. Les acanthocytes : ... 63
5.3.6. Les hématies cibles (codocytes) : ... 64
5.3.7. Les échinocytes : ... 65
5.3.8. Les drépanocytes (faucilles) : ... 66
5.3.9. Les sphérocytes : ... 67
5.3.10. Les hématies fantômes : ... 68
5.4. Les inclusions intra-érythrocytaires : ... 69
Conclusion ... 73 Annexe ... 75 Résumés ... 77 Bibliographie ... 81
1
2
L’anémie représente un problème de santé publique étendu, avec des conséquences majeures sur la santé de l’individu aussi bien que sur le développement économique et sociale. [1]
Elle concerne selon les estimations de l’OMS plus de 2 milliards de personnes dans le monde. [1]
Cette affection est la plus fréquente des anomalies de l’hémogramme. [1]
La découverte d’une anémie chez l’enfant pose la question de son étiologie. Si de nombreuses causes d’anémie sont d’identification aisée, il existe un certain nombre de situation dans lesquels aucun diagnostic précis n’est évident. [2]
Une démarche rigoureuse et hiérarchisée doit permettre d’appréhender son mécanisme et d’envisager son étiologie. [2]
Si les automates fournissent les arguments initiaux de cette enquête (réticulocytes et volume globulaire moyen), l’étude du frottis sanguin reste d’un grand intérêt. [2]
Cet examen simple, d’interprétation optimale dans le cadre d’une collaboration clinicien-biologiste, peut contribuer avantageusement à l’orientation diagnostique des anémies de l’enfant. [2]
Le problème, est que l’étude du frottis sanguin a perdu de son intérêt en dépit de toutes les richesses que peut comporter l’analyse d’un frottis sanguin.
Cependant, cette analyse quoique pourrait paraitre simple, ou élémentaire, nécessite un hématologue spécialisé averti.
L’analyse du frottis ne peut être contributive sans des renseignements cliniques complets.
3
L’objectif de notre étude est :
De démontrer l’intérêt primordial du frottis sanguin dans le diagnostic des anémies de l’enfant.
De sensibiliser les cliniciens et biologistes à l’intérêt d’une interprétation adéquate de l’hémogramme et de confectionner un frottis sanguin si nécessité.
4
Matériels
et
5
I. Patients :
1. Type et population d’étude :
Il s’agit d’une étude prospective, descriptive et analytique intéressant 100 patients (enfants et nourrissons) présentant une anémie.
2. Lieu et période d’étude :
Cette étude a été menée au sein de l’unité d’hémato-oncologie du service de pédiatrie (Chop) de l’Hôpital d’Enfant de Rabat, en collaboration avec le laboratoire d’Hématologie Central du CHU Ibn Sina de Rabat, s’étalant sur une période de trois mois (de Mai à Juillet 2019).
3. Critères d’inclusion :
Cette étude a impliquée tous les nourrissons et enfants avec suspicion clinique d’anémie ayant bénéficiés d’une numération formule sanguine et d’un frottis sanguin, aussi bien les patients hospitalisés au service de pédiatrie Chop de l’Hôpital d’Enfant de Rabat que ceux vue en hôpital de jour durant notre période d’étude.
II. Méthodes :
1. Collecte des données :
Les données de cette étude ont été recueillies par exploitation de la fiche de demande d’examen de laboratoire (Annexe 1) dument remplie pour chaque patient par le médecin prescripteur et comportant les renseignements nécessaires, à savoir l’âge du patient, son sexe, le motif de demande d’examen, et l’identifiant du patient qui permet de recueillir de manière plus précise les informations numérisés ainsi que les résultats fournis par l’automates.
6
2. Prélèvements :
Les prélèvements ont été effectués indépendamment soit au lit des malades hospitalisés soit dans la salle de prélèvement pour les consultants de l’hôpital de jour. Pour chacun des nourrissons et enfants inclus dans notre étude, les prélèvements de 2 ml de sang minimum sont des échantillons de sang total mis dans des tubes à bouchon violet contenant de l’EDTA (acide éthylène diamine tétraacétique).
L’EDTA est l’anticoagulant utilisé pour les analyses courantes d’hématologies, parce qu’il assure la conservation des éléments figurés du sang. Il prévient la coagulation du sang par son action de chélation sur le calcium. [3]Cet anticoagulant lyophilisé permet également d’éviter les erreurs de comptage dues à la dilution du sang par un excès d’anticoagulant liquide comme l’héparine. [4]
Le sang est ensuite mélangé à l’anticoagulant en réalisant 8 retournements manuels. Il peut s’agir soit de prélèvement de sang veineux sur EDTA ou de sang capillaire (pulpe du doigt, talon chez le nourrisson) dans des microtubes calibrés. [4]L’identification des patients était notée sur les spécimens. Les échantillons sont ensuite acheminés au laboratoire d’Hématologie Centrale Du CHU Ibn Sina de Rabat pour la réalisation d’une numération formule sanguine (NFS) et d’un frottis sanguin. Par ailleurs, tous les prélèvements sont obligatoirement accompagnés de la feuille de demande d’examen de laboratoire contenant les renseignements nécessaires concernant le patient.
7
Figure 1: Tube EDTA.
3. Méthodes d’analyse :
Un bilan biologique a été réalisé pour chaque patient de notre étude comprenant un hémogramme et un frottis sanguin.
3.1. Hémogramme :
L’hémogramme appelé couramment numération formule sanguine (NFS) est l’examen le plus demandé en pratique quotidienne pédiatrique (parfois avec une fréquence excessive). [5]
Il renseigne sur l’existence de l’anémie, sa profondeur et sur la vitesse de son installation. [6]
8
C’est l’examen clé qui prodigue des renseignements utiles permettant de suspecter une anomalie hémoglobinique. [7]
C’est un examen biologique automatisé correspondant à l’analyse qualitative et quantitative des cellules sanguines (numération des hématies, des leucocytes et des plaquettes), mesure et/ou calcul des paramètres érythrocytaires, et du taux de réticulocytes. [8]
Ces constantes hématologiques sont le taux d’hémoglobine (Hb), l’hématocrite (Ht), le volume globulaire moyen (VGM), la teneur corpusculaire moyenne en hémoglobine (TCMH) et la concentration corpusculaire moyenne en hémoglobine (CCMH).
3.2. Frottis sanguin :
Malgré le progrès et le perfectionnement des analyseurs automatisés d’hématologie destinés à la confection des hémogrammes, l’examen du frottis sanguin reste indispensable lorsque les données fournies par les appareils sont qualitativement ou quantitativement anormales ou demandent confirmation. [9]
Le frottis sanguin apporte alors des informations que l’analyseur d’hématologie seul ne peut pas fournir, permettant dans de nombreuse situation la validation technique du résultat. [9]
3.2.1. Délai pour confectionner un frottis : [3]
Idéalement, pour un échantillon de sang avec EDTA, le frottis sanguin devrait être confectionné dans l’heure suivant le prélèvement. Cependant, un frottis de qualité
acceptable peut être confectionné dans les délais suivants :
Pour un échantillon veineux avec EDTA, confectionner le frottis dans un délai de moins de 4 heures. Ne pas réfrigérer le spécimen avant la réalisation du frottis.
9
Pour un échantillon capillaire, dans un tube à micro prélèvement contenant de l’EDTA, élaborer le frottis moins de 4 heures après le prélèvement.
3.2.2. Indications du frottis : [10]
Le frottis sanguin peut être demandé par un médecin prescripteur ou initié par le personnel du laboratoire.
Une demande de frottis initié par un médecin est généralement une réponse à des caractéristiques cliniques perçues ou à une anomalie montrée dans une numération complète précédente.
Alors qu’une demande de frottis émanant d’un laboratoire est habituellement le résultat d’anomalie de la formule sanguine complète ou d’une réponse à des alarmes produites par un instrument automatisé.
Moins souvent il s’agit d’une réponse aux détails cliniques fournis avec la demande de numération sanguine complète lorsque le médecin n’a pas spécifiquement demandé l’examen d’un frottis.
Les examens de laboratoires effectués sur frottis sanguin destinés à des patients anémiques résultent généralement d’une politique de laboratoire selon laquelle un frottis sanguin est demandé chaque fois que la concentration en hémoglobine est étonnamment basse. Cette politique devrait être encouragée, car la prise en compte du frottis sanguin et des indices érythrocytaires est une première étape dans la recherche logique de toute anémie inexpliquée.
10
Tableau I: Indications cliniques nécessitant la réalisation du frottis sanguin. [10]
Indications cliniques : Raisons d’effectuer un frottis sanguin :
Lymphadénopathie ou splénomégalie Peut indiquer une mononucléose infectieuse
ou un autre état réactif, une leucémie ou un lymphome.
Anémie cliniquement évidente Aide dans le diagnostic différentiel
Tendance aux ecchymoses ou aux
saignements, y compris les hémorragies rétiniennes inexpliquées
Peut confirmer une thrombocytopénie ou montrer des plaquettes morphologiquement anormales (qui peuvent avoir une fonction défectueuse) une leucémie aigüe ou une autre condition provoquant une insuffisance de la moelle osseuse
Insuffisance rénale aigue Le syndrome hémolytique et urémique et le
purpura thrombotique thrombocytopénique doivent être confirmés ou exclus
Ictère Peut montrer des schizocytes
Douleur osseuse Peut indiquer une infiltration de la moelle
osseuse, ou une drépanocytose
Douleur thoracique ou abdominale
inexpliquée ou hypertrophie splénique aigue chez un enfant
Possible drépanocytose
Hyperbilirubinémie inexpliquée Evaluation de l’hémolyse possible
3.2.3. Identification du frottis sanguin : [11]
Le frottis doit, au moins, porter une double identification, c’est-à-dire ; nom et prénom du client et numéro d’identification personnalisé. De plus la date devrait être inscrite sur chaque frottis.
11
3.2.4. Confection du frottis :
Le frottis sanguin peut être confectionné manuellement ou mécaniquement à l’aide d’appareils automatiques et semi-automatiques. [12]
En ce qui concerne la technique manuelle d’étalement, elle suit les étapes décrites ci-dessous, et doit être exécutée par un opérateur habilité : [13]
Préparer la ou les lames, posées horizontalement sur un plan dur non incliné. Homogénéiser le sang dans le tube par retournements consécutifs.
Déposer une goutte de sang à l’extrémité de la lame.
Maintenir la lame posée avec la lame non directrice, et présenter avec la main directrice une seconde lame inclinée de 30° à 45° devant la goutte
Placer la seconde lame en contact avec la goutte en tirant en arrière, puis laisser diffuser le sang le long de l’arête (il faut bien récupérer la totalité de la goutte) Etaler le sang vers l’autre extrémité de la lame posée en glissant la seconde
lame d’un mouvement régulier, sans appuyer, de manière que la totalité du sang soit étalée sur la lame
Identifier le frottis selon la procédure en vigueur dans le laboratoire, puis le laisser sécher à l’air libre sans forcer le séchage (pas d’agitation ou d’utilisation de séchoir qui peuvent abimer les cellules et compromettre leur identification ultérieure).
Lors de l’étalement, il faut adapter son geste à la viscosité du sang : [13]
Sang de viscosité basse (anémie) : Le mouvement doit être plus rapide que la normale et/ou la lame tenue plus verticalement (angle supérieur à 45°). [13] Sang de viscosité haute (en cas de polyglobulie par exemple) :
Le mouvement doit être lent et/ou la lame tenue moins verticalement (angle inférieur à 45°). [13]
12
Figure 2: Confection du frottis sanguin. [14]
Alors que la technique mécanique, elle met en cause des analyseurs modernes qui peuvent être équipés d’un étaleur, qui permet la préparation automatisée des frottis de sang. [13] L’étalement est accompli selon le même principe que la méthode manuelle avec une adaptation des paramètres d’étalement de l’automate au taux d’hématocrite afin d’acquérir une qualité de frottis reproductible quelle que soit la viscosité du sang. [13]
Le « Laboratoire Central d’Hématologie du CHU Ibn Sina de Rabat » est équipé d’un automate de type SP-1000i de Sysmex.
Le SP-1000i est la troisième génération de produit de préparation et de coloration de lame intégrés éprouvés, développés, fabriqués et soutenus par Sysmex. [15]
Cet automate supprime un processus manuel à haut risque grâce à un processus sur, reproductible et de haute qualité, offrant un délai d’exécution rapide (120 échantillons par heure) et produisant des frottis codés à code pouvant être traités rapidement par les systèmes de microscope numérique automatisé Cellavision. [15]
13
Figure 3: Automate Sysmex SP-1000i du Laboratoire Central d’Hématologie du CHU Ibn Sina de Rabat.
Préparation du frottis par l’automate : [15]
Cet appareil utilise une lame d’étalement robuste et autonettoyante pour confectionner des frottis monocouches.
Il imprime instantanément sur la lame porte-objets des informations selon les options définies par le laboratoire qui peuvent comporter :
Etiquettes de code à barres uni-ou bidimensionnelles. Le nom du patient.
Le numéro de code à barres.
Le résultat spécifique à l’instrument.
Il sèche ensuite automatiquement les frottis avant la coloration. Puis il abrite les lames dans des cassettes individuelles.
Deux tours d’entreposage latéraux intégrés offrent la capacité d’abriter des lames de couleurs différentes afin de distinguer visuellement les frottis urgent des autres.
14
Un frottis de bonne qualité doit respecter les critères suivants : [14,16]
Il doit posséder une tête, un corps et une queue (figure 5) en empreinte de pouce ;
Il ne doit être ni trop mince ni trop épais ;
Il doit être régulier (sans coupures), avec des bords parallèles à la lame mais distant de ceux-ci avec l’extrémité arrondie ou en pinceau ;
Il doit être correctement séché (sinon présence d’artefacts, hématies crénelées) ;
Il ne doit pas présenter de stries (étaleur mal rodé) ou de trous (lame mal dégraissée).
Figure 4: Frottis de bonne qualité. [16]
15
Exemples de frottis de mauvaise qualité (non accepté) : [17]
Frottis arborant des trous (lame mal dégraissée)
Frottis trop long et/ou trop fin avec des franges.
Frottis avec des stries (irrégularité du mouvement lors de sa confection)
Frottis avec un angle trop obtus (frottis trop épais et/ou trop court)
16
3.2.5. Coloration du frottis :
La coloration du frottis sanguin doit permettre d’identifier les éléments cellulaires en mettant en évidence les caractéristiques propres à chacun. [3]
Les hématologistes utilisent presque uniquement l’examen du frottis sanguin après coloration panoptique par des méthodes dérivées de celle de Romanovski (coloration de May-Grünwald Giemsa « MGG » et de Wright). [18]
Cette technique, en effet, met en relief un très grand nombre de caractère que nulle autre méthode ne permet d’apprécier simultanément. [18]
Elle donne presque tous les renseignements nécessaires à un diagnostic cellulaire correct, et c’est en raison, précisément, de son importance pratique pour le diagnostic des affections sanguines qu’elle a pris le pas sur les autres techniques d’étude cytologique. [18]
La coloration panoptique de MGG repose sur l’action complémentaire de deux colorants neutres : [19]
Un colorant selon May Grünwald qui est composé d’un colorant acide, l’éosine et d’un colorant basique, le bleu de méthylène. [19]
Un colorant selon Giemsa qui est composé lui aussi, d’éosine et d’un colorant basique qui est métachromatique, l’azur de méthylène. [19]
Le MG fixe le frottis par son méthanol, le MG dilué au ½ dans l’eau neutre colore les éléments acidophiles et les granulations azurophiles. [20]
Le Giemsa surcolore les noyaux et colore les granulations azurophiles. [20]
Etapes pré-analytiques : Séchage rapide et fixation au méthanol absolu. [21]
Les frottis doivent être séchés immédiatement après leur réalisation à l’air libre. [21]Ensuite, ils doivent être fixés après séchage pendant 3 à 10 minutes dans le méthanol absolu ou le May Grünwald pur en solution alcoolique. [21]
17
Exemples de procédé opératoire en méthode manuelle :
Premier temps : May-Grünwald pur (fixation)
La préparation à colorer est placée dans le couvercle d’une boite de Laveran, le frottis étant à la face supérieure de la lame. [18]On verse le nombre de gouttes (ou de ml) de May-Grünwald nécessaire pour que les frottis soient entièrement couverts. [21]Le colorant est laissé en place trois à dix minutes. [21]L’alcool méthylique dans lequel il est dissous a pour effet de fixer les frottis qui n’ont pas besoin, dans ce cas, d’autre fixation. [18]Les frottis ne présentent encore aucune coloration, les colorants n’étant pas ionisés dans l’alcool méthylique pur. [18]
Deuxième temps :
On ajoute autant d’eau tamponné à ph 6,8 (v/v) que de May-Grünwald : 3 à 5 minutes. [21]L’homogénéité du mélange est obtenue par quelques mouvements imprimés à la boite. [18]
Troisième temps : Coloration de Giemsa [21]
On élimine le May-Grünwald dilué et, sans laver, on passe les lames dans la solution Giemsa. La durée de la coloration est de 10 à 30 minutes. Les frottis sont
ensuite lavés sous un fort courant d’eau (1 à 2 minutes), puis séchés. Il est recommandé d’utiliser une eau tamponnée : tampon de ph optimal 6,8Préparation
extemporanée de la coloration Giemsa30 ml d’eau tamponnée + 15 gouttes de Giemsa (ou Giemsa à 10 %dans le tampon) Frottis si possible à la face inférieure pour éviter les précipités sur les lames. [21]
Résultats de la coloration panoptique (Avec la coloration de May-Grünwald-Giemsa) : [18]
18
Les éléments : Couleur au frottis sanguin :
Les noyaux Rouge-violet (basi-chromatine) et roses
(oxy-chromatine)
Les cytoplasmes basophiles Varient du bleu ciel au bleu foncé
Les cytoplasmes acidophiles Roses
Les cytoplasmes polychromatophiles Grisâtres avec des zones rosées et
d’autres bleutées
Les granulations neutrophiles Marron, rose sale
Les granulations acidophiles
(éosinophiles) Orangées
Les granulations basophiles
(métachromatiques) Violet foncé
Les granulations azurophiles Pourpre ou violet-pourpre
Les granulations basophiles des
érythrocytes Bleu cobalt
Le « Laboratoire Central d’Hématologie du CHU Ibn Sina de Rabat » utilise l’appareil semi-automatique de coloration RAL Stainer (figure 7) afin de confectionner des lames de bonne qualité et standardisées.
Il s’agit d’un système automatisé de coloration compact, simple, intelligent et sûr pour la coloration complète de frottis sanguins utilisé en combinaison avec les réactifs de coloration sans méthanol MCDh ( Micro Chromatic Detection for Haematology). [22]De plus, le temps de coloration est diminué de moitié par rapport aux méthodes manuelles. (Résultats obtenus en 11 minutes identiques à ceux obtenus avec les colorants traditionnels en 20 minutes). [22]L’autre avantage considérable de cet automate de coloration concerne la possibilité d’accomplir d’autres tâches en toute confiance, même lorsque le processus de coloration est en cours. [22]
19
MCDh est une méthode de coloration panoptique de type MGG. Formulé sans méthanol, elle est constituée d’une séquence de quatre réactifs spécifiques (MCDh 1, MCDh 2, MCDh 3, MCDh 4 concentré) utilisés dans la différenciation et le comptage des cellules sanguines et médullaires. [22]
Les réactifs MCDh sont fournis dans des conditionnements fermés pour prolonger leur durée de vie et élimine tout risque de contamination. Une puce RFID permet d’éviter l’utilisation des réactifs au-delà de leur date d’expiration ce qui réduit davantage les risques d’erreur. Les réactifs MCDh sont prêt à l’emploi et sont utilisés les uns après les autres et toujours dans un ordre spécifique au sein du colorateur. [22]
La grande rapidité de l’automate de coloration est due à la possibilité de charger 10 lames par porte-lames, qui est ensuite placé dans l’un des deux tiroirs de chargement. Il suffit d’appuyer sur le bouton Start et le porte-lame est plongé dans chacune des 5 stations de coloration. Le protocole de coloration standard MCDh a été optimisé pour les frottis sanguins périphériques, colorés en 13 minutes. [22]
Avantages clés du RAL Stainer : [22]
Simple Kit de préparation prêt à l’emploi pour un chargement direct
Aucune préparation des colorants
Protocoles de coloration personnalisable
Sécuritaire Mécanisme fiable et robuste
Aucune exposition dangereuse
Un filtre au charbon actif neutralise les vapeurs des colorants Vidange automatique des colorants usagés
Intelligent RFID (identification par radiofréquence)
Détection et gestion automatique des kits de réactifs Traçabilité de la performance des cycles de coloration Détection des niveaux de liquide de rinçage et d’effluents
20
Mécanismes de coloration : [22]
MCDh 1 Il s’agit d’un mélange de colorants neutres utilisé pour fixer les frottis et
préparer la coloration, principalement des éléments hydrosolubles (granulations basophiles). Ces colorants ne sont pas actifs dans un milieu alcoolique et ne s’activent de manière sélective que lorsqu’ils sont libérés dans une solution aqueuse tamponnée.
MCDh 2 Ce réactif mène à la concentration et la précipitation du colorant sur les
hématies, le cytoplasme des granulations neutrophiles et sur les granulations éosinophiles
MCDh 3 Il est utilisé pour colorer le cytoplasme des monocytes et des lymphocytes et
exécuter la coloration métachromatique des granulations azurophiles en rouge
MCDH 4 Il s’agit d’un liquide de rinçage pour enlever l’excès de colorant et finaliser la
coloration.
Caractéristiques techniques : [22]
Kit de réactifs MCDh pour RAL Stainer : (figure 6)
Prêt à l’emploi
Capacité de coloration maximale 500 lames
Durée de conservation 18 mois avant ouverture, 20 jours après ouverture Température de stockage entre 15° c et 30° c
Débit : (selon le protocole de coloration utilisé)
Protocole de coloration standard 11 minutes Cycle de séchage : 2 minutes
Coloration, 4 bains de coloration et 1 bain de rinçage 2 Stations de chargement.
21
Figure 6: KIT RAL STAINER MCDh. [22]
Mode opératoire : [22]
RAL Stainer est un appareil semi-automatique de bain de coloration.
Le bras de l’automate suit une trajectoire circulaire et verticale successivement : Il accroche le porteur de lames déposé par l’utilisateur ;
Apporte le porteur de lames dans chaque réservoir de colorations et ensuite dans le réservoir en fonction de l’enregistrement protocole ; Fait retourner le porteur de lames à sa position initiale
Les lames sont ensuite séchées. La coloration est ainsi terminée.
22
Figure 7: Automate semi automatique RAL STAINER du Laboratoire Central d’Hématologie de CHU Ibn Sina de Rabat.
3.2.6. Examen du frottis sanguin :
L’examen du frottis sanguin a pour but l’analyse morphologique des éléments figurés du sang (leucocytes, hématies, plaquettes) ainsi que, si nécessaire, l’établissement d’une formule leucocytaire manuelle. [13]
Cet examen est interprété parallèlement aux donnés cliniques du patient fournies par le médecin prescripteur, et aux résultats d’autres analyses de laboratoire de routine, notamment la numération formule sanguine. [23]
Une bonne préparation est absolument indispensable, même pour un examen routinier, car le diagnostic dépend souvent de l’interprétation adéquate d’images situées à la limite de la visibilité (par exemple, les ponctuations basophiles des érythrocytes). [18]
23
Même lorsque la préparation semble satisfaisante, il est possible qu’elle ne le soit pas sur toute sa surface ; il faut choisir le meilleur endroit pour l’examen avec l’objectif à immersion. [18]
On commence par un examen macroscopique pour vérifier la qualité de l’étalement du frottis, et sommairement la qualité de la coloration. [3]
Puis on passe à l’analyse du frottis microscopiquement à faible grossissement (objectif x10 ou x20) pour vérifier la coloration, la distribution des éléments figurés du sang, la présence ou l’absence d’anémie, estimer la numération leucocytaire ainsi que choisir la zone adéquate pour réaliser la formule leucocytaire. [3]
L’examen microscopique est réalisé dans la partie moyenne du frottis, où les éléments ne sont ni trop tassés ni trop étalés. [13]Les hématies servent de point de repère : elles doivent être étalées en couche monocellulaire, bien séparées les unes des autres, et leur centre clair doit être visible. [13]Les cellules les mieux étalées se trouvent en général vers 1 cm avant la fin des franges. [24]
Enfin on réalise un examen microscopique à fort grossissement en parcourant le frottis selon un trajet en créneaux ; pour effectuer la formule leucocytaire, l’estimation plaquettaire et l’évaluation morphologique des éléments figurés du sang. [13,3]
A l’issue de cet examen, le biologiste doit informer le clinicien de toutes les anomalies érythrocytaires détectées ainsi que l’éventuelle présence de parasite.
4. Méthodes d’analyse et traitement des données :
Les données de notre étude ont été saisies et traitées par le logiciel Excel 2007, permettant une analyse statistique descriptive afin de démontrer l’intérêt capital du frottis sanguin dans le diagnostic des anémies de l’enfant.
24
25
I. Répartition des patients selon le sexe :
Les patients de notre étude sont répartis en 56 sujets masculins (soit 56% des cas), et 44 sujets féminins (soit 44% des cas).
Les résultats sont représentés dans la figure suivante :
Figure 8: Répartition des patients selon le sexe.
44%
26
II. Répartition des patients selon l’âge :
L’âge des nourrissons et enfants de notre étude se situe entre 1 mois et 18 ans, avec une moyenne de 7 ans et 5 mois, et un écart type de 5 ans.
34 patients ont un âge situé entre 1 mois et 5 ans (soit 34 % des cas de notre étude) : avec 18 % de cas masculin et 16 % de cas féminin.
30 patients ont un âge situé entre 5 et 10 ans (soit 30 % des cas) : avec 19 % de cas masculin et 11 % de cas féminin.
28 patients ont un âge entre 10 et 15 ans (soit 28 % des cas) : avec 15 % de cas masculin et 13 % de cas féminin.
8 patients ont un âge entre 15 et 18 ans (soit 8 % des cas) : avec 4 % de cas masculin et 4% de cas féminin.
Figure 9: Répartition des patients selon l’âge.
34% 30% 28% 8% 0% 5% 10% 15% 20% 25% 30% 35% 40%
entre 1 mois et 5 ans entre 5 et 10 ans entre 10 et 15 ans entre 15 et 18 ans
p o u rc e n ta ge d e s ca s Age
27
III. Répartition des patients selon le taux d’hémoglobine :
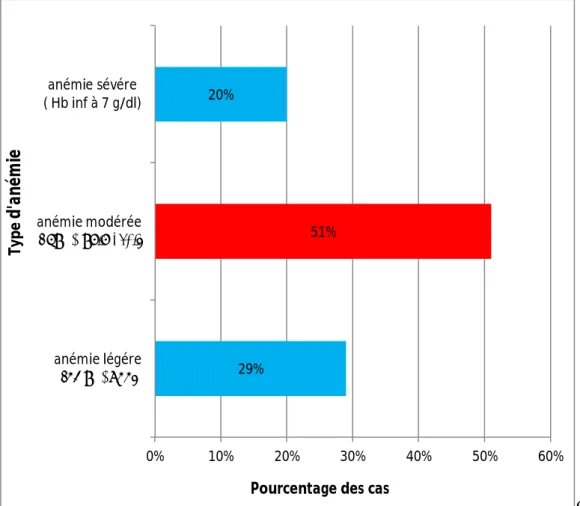
Les valeurs d’Hb ont variés entre 3,6 et 13,2 g/dl avec une moyenne de 8,61 g/dl et un écart type de 2,04 g/dl. Le taux d’Hb permet de distinguer la sévérité de l’anémie des nourrissons et enfants de notre étude. Ainsi, on constate que 29 patients ont une anémie légère (soit 29% des cas de notre étude) dont 16 cas de sexe masculin (soit 16% des cas) et 13 cas de sexe féminin (soit 13 % des cas).Et que 51 patients ont une anémie modérée (soit 51 % des cas de notre étude) dont 29 cas de sexe masculin (soit 29 % des cas) et 22 cas de sexe féminin (soit 22 % des cas).Les 20 patients restant ont un taux d’Hb inférieur à 7 g/dl (par conséquent 20 % des cas de notre étude ont une anémie sévère) dont 12 cas de sexe masculin (soit 12% des cas) et 8 cas de sexe féminin (soit 8% des cas).
Figure 10: Répartition des cas selon le taux d’Hb.
29% 51% 20% 0% 10% 20% 30% 40% 50% 60% anémie légére (10 ≤Hb<11) anémie modérée ( 7≤Hb ≤9,9 g/dl) anémie sévére ( Hb inf à 7 g/dl)
Pourcentage des cas
T yp e d 'a n é m ie
![Figure 2: Confection du frottis sanguin. [14]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038364.690954/52.892.268.629.102.490/figure-confection-du-frottis-sanguin.webp)

![Figure 6: KIT RAL STAINER MCDh. [22]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038364.690954/61.892.134.760.104.502/figure-kit-ral-stainer-mcdh.webp)





![Figure 12: L’érythropoïèse. [29]](https://thumb-eu.123doks.com/thumbv2/123doknet/15038364.690954/81.892.116.785.129.765/figure-l-érythropoïèse.webp)