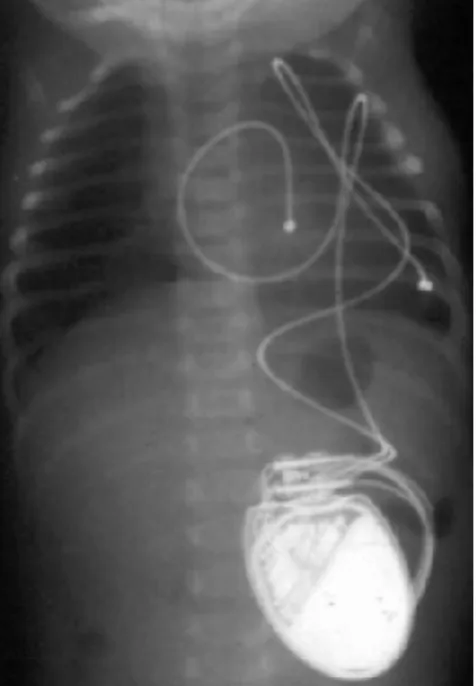
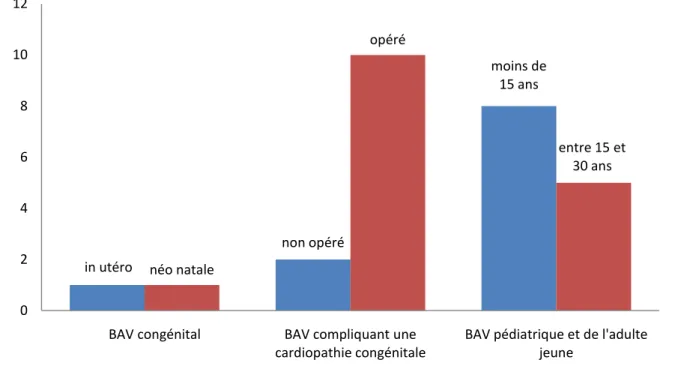
3
Remerciements
Je tiens à remercier infiniment
Mme le Professeur
IBTISSAM FELLAT d’avoir accepté
d’encadrer ce travail.
Je remercie également tous mes professeurs de cardiologie
pour le très beau parcours que nous avons passé ces 4 années, pour nous
avoir appris le sens de la rigueur, du sérieux
et de la persévérance.
Vous nous avez assistés avec patience pendant toutes
ces années d’études, avec le souci de bien nous apprendre
4 INTRODUCTION
CHAPITRE 1 : RAPPEL THEORIQUE I – Embryologie
II – Anatomie 1. Nœud sinusal
2. Les voies de conduction inter nodales 3. Jonction atrio ventriculaire
III- Physiologie des voies de conduction 1. Les centres d’automaticité
2. La conduction antérograde et rétrograde 3. Les périodes réfractaires
IV- Classification et progression des BAV selon le degré croissant de gravité V- Epidémiologie
VI- Physiopathologie et étiologies du BAV chez l’enfant 1. BAV à cœur d’écho structure normale
2. BAV associé à une cardiopathie structurale congénitale 3. BAV associé à une cardiopathie acquise
VII- Diagnostic du BAV anté et post natal 1. Présentation clinique
2. Evaluation diagnostique VIII- Evolution et pronostic
1. Evolution de l’anomalie de conduction
2. Cardiomyopathie des enfants avec BAV congénitaux immunologiques IX- Traitement
1. Voies de stimulation utilisées 2. Modes de stimulation
3. Indications thérapeutiques
CHAPITRE 2 : PATIENTS ET METHODOLOGIE I- Logistique du travail
II- Objectif du travail III- Population étudiée
IV- Critères d’inclusion et d’exclusion V- Limites d’étude
5 CHAPITRE 3 : RESULTATS
I- Age lors du diagnostic II- Présentation clinique
III- Notion de consanguinité et antécédents maternels et familiaux IV- Troubles de conduction au moment du diagnostic
V- Epreuve d’effort
VI- BAV compliquant une cardiopathie structurale congénitale VII- BAV congénital
VIII- BAV pédiatrique
IX- Voies, types et mode de pacing
X- Complications post implantation de PM XI- Suivi et contrôle de PM
CHAPITRE 4 : DISCUSSION I- Définitions
II- Etiologies et facteurs de risque liés à la survenue de BAV congénital ou acquis chez l’enfant
III- Stratégies d’implantation IV- Evolution et complications V- Alternatives thérapeutiques CONCLUSION
RESUMES ABREVIATION REFERENCES
6
INTRODUCTION :
Le retard ou l’absence de transmission d’un ou des influx des oreillettes aux ventricules définit le bloc auriculo-ventriculaire. Les blocs organiques sont soit transitoires liés à une cause aiguë régressive, soit chroniques et ils se divisent alors en blocs permanent ou paroxystique dont le diagnostic est plus difficile. Un bloc fonctionnel physiologique peut protéger les ventricules des rythmes auriculaires rapides. Les blocs sont classés en trois catégories selon que la conduction auriculo-ventriculaire est retardée, interrompue de façon intermittente, ou totalement. La localisation des blocs, bien précisée par l’enregistrement endocavitaire du potentiel du faisceau de His, peut être suggérée sur l’électrocardiogramme de surface.
Les causes des blocs chroniques sont variées et les récents progrès en génétique ont permis de réelles avancées dans la connaissance du mécanisme de certaines étiologies. Aussi, ce trouble de conduction peut être découvert aussi bien chez l’adulte que chez l’enfant même en anténatal.
Le bloc auriculo- ventriculaire complet (BAVC) de l’enfant et l’adulte jeune est une affection rare. Lorsqu’il est authentiquement congénital, il est la
conséquence d’une anomalie anatomique des voies de conduction, ou bien d’un passage transplacentaire d’anticorps maternels induisant une « myocardite » foetale puis une fibrose du tissu de conduction. Lorsque les BAVC découverts plus tardivement dans l’enfance ne sont pas en rapport avec une myopathie ou une cardiomyopathie, ou ne représentent pas une séquelle de myocardite, leur étiologie reste pour l’instant inconnue. Enfin, certains blocs sont la conséquence de lésions chirurgicales des voies de conduction.
Quel que soit l’âge de l’enfant ou l’adulte jeune, le seul traitement est
l’implantation d’un stimulateur cardiaque. Défaillance cardiaque et syncope sont des indications formelles d’implantation. La stimulation cardiaque a
radicalement transformé le pronostic en supprimant la menace de mort subite, et en améliorant la qualité de vie des patients grâce à des stimulateurs dotés
d’algorithmes de plus en plus performants qui permettent de respecter ou de mimer la physiologie.
Nous exposons dans ce travail, une série d’enfants et de jeunes adultes porteurs d’une Bloc auriculo ventriculaire congénital ou malformatifs, colligés au département de rythmologie du service de cardiologie B, Hôpital Maternité Souissi, centre hospitalier universitaire IBN SINA.
7
Le but de la série est de décrire les circonstances de découverte, les modes de présentations cliniques, les critères diagnostiques et les particularités échocardiographiques, rythmiques, ainsi que les aspects pronostiques et les différentes perspectives thérapeutiques à envisager chez l’enfant ou adulte jeune porteur de ce trouble de conduction fatale.
8
CHAPITRE 1
I) Embryologie:
Quelques notions basiques du développement embryologique du système conductif sont indispensables pour la compréhension ventriculaire chez l’enfant et l’adulte jeune.
Le développement du cœur humain commence autour de la 3eme semaine à travers la formation du tube cardiaque primitif.
commence à battre c’est-à semaine de vie intra-utérin conduction intracardiaque
conduction devient plus rapide avec la possibilité de réaliser un électrocardiogramme. [1]
Le looping ou la formation de la boucle cardia
latéralisation de l’embryon, intervient à 23 jours de vie intra
perturbations sont à l’origine des cardiopathies les plus complexes. Une série d’étapes aboutit à la septation cardiaque, à la formation des valv
auriculoventriculaires et semi pôle artériel du cœur.[2]
Schéma n° 1 : Développement des voies de conduction. 1. Anneau auriculoventriculaire droit ;
His ; 4. branche septale ; 5. bifurcation du faisceau de His ; 7. conotruncus ; 8. anneau primitif ;
La découverte en 2001 d’un
myocardiques aux deux pôles, artériel et veineux, du tube cardiaque primitif (ou premier champ cardiaque), est une étape fondamentale de la compréhension de l’embryologie cardiaque. Les anomalies de développement du
(incluant les cardiopathies conotruncales et la transposition des gros vaisseaux), qui représentent la plus grande part des malformations cardiaques congénitales, sont dues à des perturbations de ce second champ cardiaque.
9
CHAPITRE 1 : RAPPEL THEORIQUE
Quelques notions basiques du développement embryologique du
système conductif sont indispensables pour la compréhension du bloc auriculo ventriculaire chez l’enfant et l’adulte jeune.
Le développement du cœur humain commence autour de la 3eme semaine à tube cardiaque primitif. Dans un stade précoce, le cœur
à-dire à présenter des contractions rythmées, dès la 3e utérine, bien avant le développement du système de
conduction intracardiaque. Et avec la formation du chamber myocardium, conduction devient plus rapide avec la possibilité de réaliser un
ou la formation de la boucle cardiaque, première manifestation de la latéralisation de l’embryon, intervient à 23 jours de vie intra-utérine, ses
perturbations sont à l’origine des cardiopathies les plus complexes. Une série d’étapes aboutit à la septation cardiaque, à la formation des valv
auriculoventriculaires et semi-lunaires, au développement du pôle veineux et du
Développement des voies de conduction. AO : aorte ; AP : artère pulmonaire. Anneau auriculoventriculaire droit ; 2. zone du nœud auriculoventriculaire ; 3.
bifurcation du faisceau de His ; 6. septum interventriculaire ; anneau primitif ; 9. courbure externe ; 10. courbure interne.
La découverte en 2001 d’un second champ cardiaque, ajoutant des cellules myocardiques aux deux pôles, artériel et veineux, du tube cardiaque primitif (ou premier champ cardiaque), est une étape fondamentale de la compréhension de l’embryologie cardiaque. Les anomalies de développement du pôle artériel (incluant les cardiopathies conotruncales et la transposition des gros vaisseaux), qui représentent la plus grande part des malformations cardiaques congénitales, sont dues à des perturbations de ce second champ cardiaque.
: RAPPEL THEORIQUE
Quelques notions basiques du développement embryologique du cœur et du du bloc auriculo Le développement du cœur humain commence autour de la 3eme semaine à
Dans un stade précoce, le cœur dire à présenter des contractions rythmées, dès la 3e e, bien avant le développement du système de
chamber myocardium, la
que, première manifestation de la utérine, ses
perturbations sont à l’origine des cardiopathies les plus complexes. Une série d’étapes aboutit à la septation cardiaque, à la formation des valves
lunaires, au développement du pôle veineux et du
: artère pulmonaire.
tronc du faisceau de septum interventriculaire ;
champ cardiaque, ajoutant des cellules myocardiques aux deux pôles, artériel et veineux, du tube cardiaque primitif (ou premier champ cardiaque), est une étape fondamentale de la compréhension de
pôle artériel (incluant les cardiopathies conotruncales et la transposition des gros vaisseaux), qui représentent la plus grande part des malformations cardiaques congénitales,
10
Le développement du tronc du faisceau de His et de ses branches, système à conduction rapide, est étroitement lié au processus de septation ventriculaire, son rôle étant d’assurer la coordination des contractions des deux ventricules. L’intégralité du système de conduction ventriculaire est développée à partir du myocarde interventriculaire entourant le foramen ventriculaire primitif L’hypothèse communément admise jusqu’à une époquerécente était celle de la présence de quatre anneaux de myocarde « spécialisé » situés au niveau des quatre zones de transition entre les segments du myocarde embryonnaire. Ce sont :
• l’anneau sinoatrial ou sinusal, à l’intérieur de l’oreillette ; • l’anneau auriculoventriculaire, au niveau de la jonction atrioventriculaire primitive ;
• l’anneau primitif, situé sur le bord du septum interventriculaire primitif (au niveau du foramen interventriculaire
primitif) ;
• et l’anneau artériel, entre voie d’éjection et truncus.
Seuls trois de ces anneaux donnent naissance aux tissus de conduction, la
formation de la boucle et surtout le processus de septation cardiaque les amenant au contact les uns des autres au niveau de la courbure interne. Le nœud
sinoatrial proviendrait de l’anneau sinoatrial, le nœud atrioventriculaire de l’anneau sinoatrial et de l’anneau auriculoventriculaire, le tronc du faisceau de His (penetrating bundle) et sa branche gauche de l’anneau auriculoventriculaire et de l’anneau primitif, la branche droite du faisceau de His et la partie ramifiée du tronc (branching bundle) de l’anneau primitif.
Le système de conduction cardiaque se développe à partir des deux zones de transition dépourvues de bourgeons endocardiques, le sinus venosus et l’anneau primitif ou primary fold. Ces zones de transition sont reconnaissables par des marqueurs immunohistochimiques tels que HNK1.
La formation du nœud sinusal dépend de l’activité du gène Nkx2.5, essentiel pour différencier le myocarde auriculaire du myocarde du nœud sinusal.
Nkx2.5 et Tbx5 sont essentiels pour la formation du nœud atrioventriculaire et du faisceau de His. Chez l’homme, une mutation dominante du gène Nkx2.5 provoque un bloc auriculoventriculaire complet associé à des malformations congénitales (communication interauriculaire) ou à une cardiomyopathie. Le développement du tronc du faisceau de His et de ses branches, système à conduction rapide, est étroitement lié au processus de septation ventriculaire, son rôle étant d’assurer la coordination des contractions des deux ventricules. L’intégralité du système de conduction ventriculaire est développée à partir du myocarde interventriculaire entourant le foramen ventriculaire primitif.
Un anticorps monoclonal dirigé contre l’antigène tissulaire neural, protéine extraite du ganglion nodosum du poulet (GLN2) se lie de façon spécifique à une certaine subpopulation de cardiomyocytes dans le cœur humain embryonnaire.
11
De 31 à 35 jours de vie intraembryonnaire, les cardiomyocytes exprimant le GLN2 forment un anneau continu autour du foramen interventriculaire primitif. Le tissu de conduction auriculoventriculaire ne peut se former normalement que si les septa interauriculaires, interventriculaires et conales sont normalement formés et normalement alignés. Les nœuds auriculoventriculaires anormaux présents dans les défauts d’alignement, en général situés en position antérieure (dans la transposition corrigée des gros vaisseaux [S, L, L] par exemple), se développent néanmoins toujours dans la zone de l’anneau à GLN2. [3]
II) Anatomie :
Le cœur est un organe essentiellement musculaire tapissé en dedans par l’endocarde qui se continue par l’endothélium vasculaire.il est recouvert à sa surface par le péricarde viscéral ou épicarde. Cette masse musculaire ou
myocarde est constituée de fibres auriculaires et ventriculaires qui s’insèrent sur une solide charpente de tissu fibreux. L’innervation intrinsèque de cette masse musculaire est assurée par le système cardionecteur, soit les voies de conduction cardiaque qui sont indispensables pour la genèse de l’activité électrique normale et sa transmission à toutes les fibres myocardiques. Il est donc utile de rappeler sa constitution et ses particularités fonctionnelles pour mieux comprendre cette pathologie du tissu conductif.
Schéma n° 2 : coupe latérale du cœur montrant les différents éléments du système de conduction intra cardiaque. [4]
12
1-Le nœud sinusal :
Décrit par Keith et Flack au début du XXème siècle [5], il a la forme d’une grosse massue à grosse extrémité supérieure. Cette formation a une taille relativement importante et s’étend sur la paroi latérale de l’oreillette droite par une queue effilée se dirigeant, sans l’atteindre, vers la veine cave inférieure. Elle mesure 1,5 à 2cm de longueur et 5mm de largeur. [6]
13
Le nœud sinusal est situé sur l’oreillette droite près de l’abouchement de la veine cave supérieure, à la partie supérieure de la jonction sino atriale marquée à la surface du cœur par un sillon appelé sillon terminal (sulcus terminalis). Cette partie haute du sillon terminal qui sépare l’abouchement de la veine cave
supérieure du bord supérieur de l’auricule droit prend le nom d’incisure auriculo cave ; au dessous de laquelle, dans l’épaisseur de la paroi à 1 mm d’épaisseur, se trouve le nœud sino atrial centré par son artère nourricière ou l’artère de
Géraudel, issue dans la majorité des cas de l’artère coronaire droite. Sa situation précise est importante pour le chirurgien qui doit la respecter. A la surface du cœur, le nœud sinusal se projette dans une aire limitée par quatre points : - point supérieur sur la veine cave supérieure à 2 mm au dessus de l’incisure auriculo-cave.
- point inférieur sur l’oreillette droite à 4 mm au dessous de l’incisure. - point droit à 20 mm de l’incisure sur la partie droite du sillon terminal. - point gauche à 5 mm de l’incisure sur la partie gauche du sillon terminal. La pathologie du nœud sinoatrial est étroitement liée à ses rapports immédiats avec l’épicarde et à la pathologie de son artère nourricière.
14
2-Les voies de conduction inter-nodale :
La connexion entre le nœud sinusal et le nœud atrio-ventriculaire est resté pendant longtemps imprécise. Actuellement, il est admis qu’il existe des fibres musculaires sans spécificité histologique, organisées en trois faisceaux, situées au niveau interatrial reliant les deux nœuds. Ces connexions ont été mises en évidence par l’électrophysiologie. On distingue :
- Un faisceau antérieur qui nait du pole antérieur du nœud sino atrial, s’incurve à proximité de la veine cave supérieure vers la gauche du toit de l’atrium droit ; suit le septum inter atrial et descend vers le nœud atrioventriculaire. Du faisceau antérieur part également un faisceau de conduction spécialisé décrit par
Bachmann. Celui-ci est destiné au toit de l’atrium gauche.
- Un faisceau moyen qui nait du pôle postérieur du nœud sino atrial, fait une boucle derrière la veine cave supérieure, croise la face postérieure de l’atrium droit puis le septum inter atrial à sa partie moyenne.
- Un faisceau postérieur qui suit la crête terminale (crista terminalis) jusqu’au bord postérieur du septum inter atrial et du nœud atrioventriculaire.
15
3-La jonction atrio-ventriculaire :
Les oreillettes sont isolées des ventricules par la charpente fibreuse du cœur. La transmission de la dépolarisation naissant au niveau du nœud sinusal et allant vers les ventricules, doit passer obligatoirement par cette jonction
atrio-ventriculaire. Quatre éléments seront étudiés : les voies de connexion au nœud atrio-ventriculaire (NAV) ou nœud d’Aschoff Tawara, le nœud A-V, le faisceau de His et ses branches.
a) Les voies d’entrée dans le nœud atrio-ventriculaire : [7] Les fibres atrio-nodales sont classées en deux groupe:
*Le groupe postérieur comprend des fibres horizontales et des fibres verticales. Ce groupe postérieur passe près du sinus coronaire, tantôt au dessus, tantôt en dessous.
*Le groupe supérieur est formé par des fibres verticales qui se détachent des fibres inter nodales moyennes et antérieures et pénètrent dans le bord supérieur du nœud atrio-ventriculaire.
b) Le nœud atrio-ventriculaire (NAV) :
Le NAV est une formation située sur le plancher de l’atrium. C’est une
formation ovalaire plus petite que le nœud sinusal (5 mm de longueur et 3 à 3,5 mm de largeur dans sa portion condensée) [8].Il occupe un espace triangulaire (triangle de Koch) limité :
- En bas : par l’orifice de terminaison du sinus veineux coronaire et la valve du sinus coronaire.
- En avant : par l’insertion de la cuspide septale de la valve atrio-ventriculaire droite.
- En arrière et en haut : par la bande sinusale qui est le relief déterminé par le tendon de Torado ; celui-ci occupe le bord libre de la valvule de la veine cave inférieur et se perd dans le septum inter-atrial au dessus du sinus veineux coronaire.
La face gauche du noeud atrioventriculaire répond à une petite dépression de la face septale du ventricule gauche située au sommet de la chambre de chasse ventriculaire gauche ou canal aortique et comprise entre les valvules semi-lunaires aortiques coronaires droites d’une part et postérieures (ou non
coronaire) d’autre part ; il repose sur l’anneau atrioventriculaire gauche près de la commissure postérieure.
L’atteinte la plus fréquente du noeud atrioventriculaire est l’infarctus ou la fibrose due à une lésion de l’artère coronaire qui fournit son artère nourricière.il peut également être lésé lors de la chirurgie valvulaire aortique ou atrio
16
ventriculaire lorsque la zone correspondante du nœud est incluse dans les sutures de prothèses.
c) Le Faisceau de His :
Constitue de fibres issues du pôle antérieur et inférieur du nœud
atrio-ventriculaire , le tronc du faisceau de HIS se dirige en avant et un peu en bas vers le milieu du corps fibreux central , le long du bord postérieur puis inférieur du septum inter ventriculaire membranacé vers le sommet du septum
musculaire. Ce trajet l’amène à passer sous l’angle d’insertion des cuspides septale et antérieure de la valve atrio ventriculaire droite, sous l’endocarde auriculaire. A ce niveau, bombe le sinus aortique non coronaire, ainsi , le tronc peut-il être lésé lorsqu’il y a une atteinte des orifices aortiques ou
atrioventriculaires (endocardite) ou lors d’un remplacement valvulaire au niveau de ces orifices. De section triangulaire, le tronc prend progressivement un aspect triangulaire. Il a la forme d’un cordon régulier, arrondi ou aplati. Il mesure 10 à 15 mm de longueur et 3 à 5 mm de largeur. Son épaisseur varie entre 2 à 3 mm. Le NAV et le faisceau de His sont vascularisés par les artères septales
postérieures issues de l’artère coronaire droite. Plus rarement, la vascularisation se fait à partir du réseau circonflexe (10%).
d) Les branches du faisceau de His :
Schéma n°5 : coupe latérale du coeur montrant les branches du faisceau de His et ses rapports anatomiques.
17
Le faisceau de His se divise en deux branches (droite et gauche) qui chevauchent le bord supérieur de la portion musculaire et descendent
respectivement sur ses faces droite et gauche. La branche droite, épaisse de 1 à 2 mm, semble prolonger le faisceau d’origine. Elle a d’abord un trajet sous
endocardique puis pénètre dans la bandelette ansiforme pour gagner le pilier antérieur de la valve tricuspide. C’est ce trajet intra myocardique qui la rend plus vulnérable. Elle se termine dans les parois du ventricule droit en se transformant en de très fines ramifications prenant l’appellation de réseau de Purkinje. La branche droite est vascularisée par l’artère du pilier antérieur de la tricuspide, née de l’artère inter ventriculaire antérieure et donc de l’artère coronaire gauche. La branche gauche, plus volumineuse (4 à 5 mm) que la droite, traverse la
cloison inter ventriculaire dans une zone située entre la portion membraneuse et la portion musculaire. Elle descend sous l’endocarde de la face gauche de la cloison inter ventriculaire. Sa division en deux branches ou en éventail n’est pas tranchée. Classiquement, on retient une division en filets antérieur et postérieur destinés aux piliers correspondants de la valve mitrale. Comme la branche droite, elle se termine par un fin réseau de Purkinje. Sa vascularisation est assurée par l’artère coronaire gauche dans sa partie haute (artères septales
antérieures) et par l’artère coronaire droite dans sa portion basse (artères septales postérieures). Le filet postérieur doit sa plus grande résistance à la fréquence d’une double vascularisation (inter ventriculaire antérieure et postérieure).
18
III) Physiologie des voies de conduction:
1-Les centres d’automaticité :
Si le nœud sinusal est déficient, les centres secondaires constitués de cellules automatiques (Pacemakers secondaires) comme le NAV, ou tertiaires comme le système His-Purkinje, peuvent prendre le relais avec une fréquence d’échappement plus basse (40 à 60/min pour le NAV et 20 à 40/min en moyenne pour le réseau de Purkinje), qui est le plus souvent mal tolérée.
2-La conduction antérograde et rétrograde :
La conduction auriculo-ventriculaire (AV) est antérograde, alors que la conduction ventriculo-atriale (VA) est dite rétrograde.
Cette conduction rétrograde est le plus souvent déclenchée par une extrasystole ventriculaire ou la stimulation ventriculaire d’un Pacemaker.
Elle est possible même en présence d’un bloc auriculo-ventriculaire complet antérograde.
3-Les périodes réfractaires :
La période réfractaire absolue correspond à l’intervalle de temps durant lequel le myocarde n’est pas stimulable.
La période réfractaire relative suit immédiatement la période réfractaire absolue.
Les périodes réfractaires de l’oreillette, du NAV et du ventricule sont différentes.
En stimulation cardiaque, la définition de la période réfractaire est différente. Elle correspond à l’intervalle pendant lequel le stimulateur ne détecte aucun évènement dans la cavité cardiaque considérée.
2.4. Les réentrées :
Elles consistent en un mouvement circulaire de l’activité électrique qui, en se pérennisant, peut générer une tachycardie.
Elles nécessitent un bloc unidirectionnel (conduction possible dans un seul sens), et un temps de parcours du circuit supérieur à la période réfractaire des fibres où se produit cette réentrée.
2.5. Le phénomène de « gap » :
Il définit une période du cycle cardiaque pendant laquelle une stimulation atriale ne peut être conduite aux ventricules (gap antérograde) ou vice-versa (gap rétrograde).
19
Un stimulus prématuré peut entrainer une conduction de type 1/1 alors qu’un stimulus plus tardif survenant pendant le gap aurait été bloqué.
Ce phénomène est lié à l’hétérogénéité des périodes réfractaires du système de conduction.
Il implique un ralentissement de la conduction en proximal, permettant une récupération en distal (cellules sorties de leur période réfractaire).
IV) Classification et progression des BAV selon le degré
croissant de gravité :
a. BAV du 1er degré :
Il se définit par un allongement de l’espace PR au-delà de 0,20s chez l’adulte et de 0,18s chez l’enfant. Ceci traduit un simple ralentissement de la conduction AV avec conservation d’une transmission des ondes d’excitation auriculaires aux ventricules sur le mode 1/1.
b. BAV du 2ème degré :
- Mobitz I : Il se définit par l’allongement progressif de l’intervalle PR (période de Wenckebach) jusqu’à l’obtention d’une onde P bloquée après laquelle une autre séquence identique recommence. Il est souvent bénin, de siège nodal et peut être induit par des traitements antiarythmiques.
- Mobitz II ou BAV de haut degré : Il se définit par le blocage intermittent d’une onde P sans allongement de l’intervalle PR, qui peut survenir de façon régulière (1 fois sur 2, 2 fois sur 3, respectivement pour un BAV 2/1 ou un BAV 3/1)
Il est le plus souvent de siège hissien ou infrahissien.
c. BAV du 3ème degré ou complet :
Il se définit par une dissociation complète des oreillettes et des ventricules avec des oreillettes plus rapides que les ventricules. Sur l’ECG, on retrouve donc des ondes P plus fréquentes que les complexes QRS.
20
Figure n° 1: BAV complet avec échappement ventriculaire à 37/min à QRS fin On distingue :
Le BAV complet permanent, où les complexes QRS sont sous la dépendance d’un foyer de substitution situé au-dessous du bloc, dont la fréquence est très variable (50/min pour un rythme jonctionnel et 30/min pour un rythme idioventriculaire). Les symptômes sont fréquents, à type de malaises parfois syncopaux, de troubles psychiques ou confusionnels, d’asthénie ou de dyspnée d’effort voire d’insuffisance cardiaque. Il peut exister une conduction rétrograde ventriculo-atriale lorsque les oreillettes sont sorties de leur période réfractaire.
[9], [10]
Le BAV complet paroxystique, qui est fréquemment responsable de syncopes liées à des pauses ventriculaires prolongées. Le diagnostic peut être évident si l’ECG est enregistré au moment de la syncope (plusieurs ondes P non suivies de complexe QRS) mais peut être plus difficile en dehors des périodes symptomatiques.
Siège du bloc : En cas de bloc avec QRS fins, le niveau du bloc est plutôt atrio-ventriculaire ou hissien. En cas de bloc de haut degré avec QRS larges et
réponse lente, le niveau du bloc est à priori infrahissien. Pour connaître le niveau du bloc, on a recours à l’exploration électrophysiologique : enregistrement direct des potentiels atrials, hissiens et ventriculaires, avec mesure des intervalles AH, H1-H2, HV. On recherche aussi le point de Luciani qui apporte des informations sur la qualité de la conduction nodale antérograde (et facilite ainsi le choix du mode de stimulation).
21
Les mécanismes exacts du développement progressif d’une conduction cardiaque normal au bloc auriculo ventriculaire complet ne sont pas clarifiés jusqu’à présent.
On présume qu’il s’agit d’un processus graduel passant par plusieurs étapes. L’hypothèse principale dans le cadre du BAV congénital est basé sur une interaction entre les anticorps SSA/Ro et les canaux ioniques qui intervient au niveau moléculaire de chaque stade de BAV.
V) Epidémiologie:
Ce qu’on connait
La prévalence du bloc auriculo ventriculaire est de 1 sur 15000 à 20000 des naissances. Le BAV est défini comme congénital si diagnostiqué in utéro, à la naissance ou au bout du 1 mois de vie, et ainsi le BAV de l’enfant survient entre l’âge de 1 mois jusqu’à 18 ans.
Suite à ses différentes étiologies, le BAV congénital et le BAV chez l’enfant peut survenir sur un cœur de structure normale, ou en association avec des anomalies congénitales structurales. La stimulation cardiaque est indiquée chez les patients symptomatiques et cette indication peut être élargie pour les patients asymptomatiques comme prévention primaire contre la mort subite.
Le BAV congénital est associé à un taux élevé de mortalité néonatale et un risque élevé de développement de cardiomyopathie dilatée (CMD) dans 5 à 30% des cas.[11]
Ce qui est de nouveau
Plusieurs gènes incluant SCN5A ont été impliqués dans des formes autosomiques dominantes des troubles cardiaques conductifs progressifs familials.
L’innovation de la technologie du pacemaker sans sondes et l’utilisation de la thérapie génique dans les pacemakers biologiques reste des domaines de recherches prometteurs.
Le pacing in utéro reste une technique à haut risque et nécessite beaucoup de développement avant de l’adopter autant qu’une pratique de routine. Enfin, la resynchronisation cardiaque est une pratique validée indiquée pour les
22
VI) Etiologies et physiopathologie du BAV chez l’enfant :
Les troubles de conduction cardiaques sont des rare syndromes survenant chez les nouveaux nés et les enfants, ainsi que les adules jeunes. Et suite à multiples étiologies, le trouble conductif peut être associé à un cœur de structure normal ou en présence de malformation cardiaque congénitale concomitante.Contrairement au bloc auriculo ventriculaire acquis, le BAV congénital (identifié in utéro sur un cœur d’écho structure normale) garde un pronostic péjoratif avec un risque plus élevé de développer une cardiomyopathie dans les années à venir.
1- BAV à cœur de structure normale :
BAV immunologique :
Malgré que certains aspects nécessitent plus d’études et de précision, La pathophysiologie, la prise en charge thérapeutique et le pronostic à long cours du BAV immunologique ont été bien étudiés, comme étant une des principales causes du BAV congénital.
Quand le cœur est d’architecture normale, les BAV authentiquement
congénitaux, c’est- à- dire diagnostiqués avant la naissance ou très précocement, sont habituellement associés à la présence chez les mères de ces enfants
d’anticorps circulants anti- SSA/Ro et anti- SSB/la, qui sont isolés ou s’intègrent dans une maladie systémique telle qu’un lupus ou un syndrome de Gougerot- Sjögren [12, 13]. Les anticorps maternels traversent la barrière placentaire entre
la 13e et la 16e semaine de gestation et vont se fixer sur le myocarde fœtal. Les études expérimentales montrent que les anticorps maternels, mis en présence des antigènes fœtaux intracellulaires par un mécanisme d’apoptose, induisent une réaction inflammatoire et une « myocardite » fœtale ; la sécrétion par les macrophages de cytokines comme le TGF- β entraîne une transdifférenciation des fibroblastes cardiaques en myofibroblastes induisant une fibrose cicatricielle des tissus cardiaques et le bloc définitif constatés chez ces enfants [14, 15]. On a
également montré qu’une des cibles des anticorps était les canaux calciques, dont l’altération interviendrait dans le mécanisme de la défaillance cardiaque du fœtus et de l’apoptose cellulaire mettant en contact antigènes et anticorps [16, 17]. La fréquence du BAVC congénital est habituellement estimée à 1/10 000- 1/15 000 naissances vivantes [18]. La fréquence du bloc chez les nouveau- nés des femmes ayant des anticorps est inférieure à 3 % mais le risque de récurrence est de 15 à 20 % quand une femme a déjà un enfant atteint. Cette variabilité de l’atteinte fœtale est inexpliquée, de même que l’atteinte discordante parfois observée chez de vrais jumeaux. Récemment, Jaeggi et al.ont montré que
23
l’incidence de l’atteinte cardiaque était corrélée au taux d’anticorps anti- Ro
[19].
Il existe deux catégories de mères d’enfants atteints de « lupus néonatal », une première catégorie de mères atteintes elles-mêmes d’une connectivite, le plus souvent un lupus, parfois un syndrome de Gougerot Sjögren ou une autre connectivite et une seconde catégorie de femmes ayant une connectivite
indéterminée, habituellement asymptomatique lors de la naissance du nouveau-né, mais dont la connectivite peut s’exprimer 5 à 10 ans après la naissance d’un enfant atteint de « lupus néonatal » [20]. D’autres études ont montré que les mères porteuses d’anticorps anti-La, notamment à des titres élevés ou ayant une prédominance d’anticorps anti-Ro, ont plus de risques d’avoir un enfant avec un BAV que des mères positives pour les seuls anticorps anti-Ro. Il existe
plusieurs molécules Ro (SS-A), les deux principales étant Ro 60 kD (kiloDalton) et surtout Ro 52 kD qui est particulièrement abondante dans le tissu cardiaque
[21].
D’autres facteurs sont impliqués dans la survenue d’un BAV immunologique, en particulier le typage maternel human leucocyte antigen (HLA). En effet, la
plupart des mères sont porteuses de l’antigène HLA DR3 entraînant un risque relatif de lupus néonatal multiplié par 8, voire par 24 lorsque les haplotypes sont HLA B8, DR3, DRW52 et DQW2 [21]. En revanche, les groupes HLA DR2 seraient protecteurs de lupus néonatal. Les études anatomopathologiques faites chez les nouveau-nés décédés de BAV congénital ont montré une fibrose du nœud sinusal, du nœud auriculoventriculaire et fréquemment associé une fibroélastose de l’endocarde. Dans ces zones de fibrose, des dépôts de facteurs du complément et d’immunoglobulines de type G mais aussi de type A et M ont été retrouvées.
Le tissu de conduction fœtal se constituerait entre la 4e et la 6e semaine de gestation aboutissant à la réunion des branches et du tronc du faisceau de His au nœud auriculoventriculaire.
À la différence des BAV associés à des anomalies architecturales de type double discordance, dont le diagnostic est fait autour de la 11eme semaine
d’aménorrhée, les blocs immunologiques paraissent s’installer secondairement après la maturation du faisceau de His et sont reconnus à partir de la
16eme semaine d’aménorrhée. Les antigènes Ro et La ont été retrouvés à la surface des cœurs fœtaux avec BAV immunologique. On peut imaginer que l’expression ou la migration à la surface des cellules myocardiques fœtales de ces antigènes Ro et La sont à l’origine d’une réaction cytotoxique probablement à médiation cellulaire avec des immunoglobulines G maternelles anti-Ro ou anti-La, qui passent dans la circulation fœtale dès la 16eme semaine puis massivement à partir de la 18eme semaine pour se fixer sur les tissus
24
un modèle expérimental de rat où l’injection d’immunoglobulines G anti-Ro et anti-La a induit des BAVc par altération des canaux calciques et leurs protéines de régulation [23]. Différentes hypothèses impliquant une apoptose du faisceau de conduction, une anomalie des canaux calciques, une implication virale, voire génétique ont été proposées. Une première hypothèse consiste à une intrication des anticorps maternels anti-Ro et anti-La avec des myocytes en apoptose dont les antigènes ont été transférés à la surface de la membrane cellulaire,
permettant une action antigène-anticorps directe. Ceci entraîne une réaction inflammatoire des macrophages avec fibrose et éventuellement une calcification du nœud auriculoventriculaire. Une autre hypothèse serait que les anticorps maternels interagissent directement avec les canaux calciques de type L en bloquant les courants calciques, indispensables à la fonction cellulaire. La répétition de ce phénomène entraînerait la mort de la cellule, une fibrose et une calcification du nœud auriculoventriculaire entraînant un BAV [24, 25]. Ainsi, en clinique, pour expliquer les différentes présentations cliniques, on pourrait imaginer deux situations extrêmes avec des atteintes myocardiques sévères et fatales entraînant des morts in utero, ce qui expliquerait les avortements itératifs de certaines femmes lupiques et, à l’opposé, des enfants naissant avec des BAV congénitaux qui seraient les survivants d’une myocardite plus bénigne avec simplement des séquelles de fibrose sur les voies de conduction. Récemment, à partir du registre national du lupus, on a pu évaluer un risque de récurrence deux à trois fois plus important chez les mères ayant des anticorps anti-Ro et La qui ont déjà eu un enfant porteur d’un BAV congénital comparées aux mères porteuses de ces mêmes anticorps n’ayant jamais eu d’enfant porteur de BAV congénital. Ceci implique des recommandations obstétricales avec une
surveillance accrue entre la 18e et la 24e semaine de gestation. Ainsi, il a été proposé des traitements anti-inflammatoires de type corticoïdes dès la 17e semaine d’aménorrhée chez les femmes enceintes porteuses d’un groupe HLA DR3, ayant des anticorps anti-Ro et anti-La positifs ayant déjà eu un enfant ou un fœtus avec un BAV complet ou incomplet, définitif ou régressif. Néanmoins, à l’heure actuelle, il n’a jamais été publié de régression de BAV immunologique in utero après de telles thérapeutiques. Cependant, il semblerait qu’un traitement par corticoïdes permette une régression des épanchements sériques parfois
associés à des BAV in utero [26].
L’échocardiographie fœtale est le gold standard dans le diagnostic du BAV congénital. Les modes MM et Doppler sont utiles pour détecter la dissociation auriculo ventriculaire.
LE BAV auto immun est associé à un taux élevé de mortalité néonatal.
Le taux estimé de mortalité sans pacing est de 8 à 16% chez les nouveaux nés et de 4 à 8 % chez les enfants et adultes jeunes [27, 28]. Paradoxalement, le
développement d’une dilatation et /ou dysfonction des cavités cardiaques au long cours peut survenir chez les patients implantés et non implantés. On note
25
bien qu’on absence d’implantation de PM, l’association de la bradycardie et les volumes élevées de pré et post charge induit l’évolution du processus de
dilatation et dysfonction cardiaque. Globalement la prévalence de la CMD dans le BAV congénital est de l’ordre de 5 à 30% [29 ,30]. Multiples processus physiopathologiques inclus tels que la myocardite ou l’atteinte immunologique ont été proposé pour expliquer cette dilatation et dysfonction cardiaque. Une fibrose endocarditique droite et gauche a été observée lors de certaines autopsies.
Divers traitements préventifs maternels ont été proposés, en particulier la corticothérapie, sans résultat probant pour éviter la récidive de l’atteinte
cardiaque fœtale. En revanche, des résultats encourageants avec l’utilisation de corticoïdes fluorés ont été obtenus durant la grossesse, quand
l’échocardiographie fœtale montre un bloc qui n’est encore que partiel, pour obtenir la stabilité voire la réversibilité du bloc. Ces traitements ne sont pas dénués d’effets secondaires sur le fœtus. Dans 11 à 42 % des cas, les BAVC immunologiques sont associés à des malformations cardiaques, en particulier communication auriculaire Ostium Secundum et canal artériel. Ces anomalies de structure intracardiaque n’interviennent pas dans le mécanisme du bloc.
BAV héréditaire:
Le BAV héréditaire progressive survient chez les patients moins de 50 ans qui présente un trouble conductif progressif inexpliqué avec un cœur d’écho
structure normale, surtout si antécédents familiaux de trouble de conduction. Ceci exclus les myopathies et les dystrophies musculaires devant l’impact de ces troubles conductifs sur le muscle cardiaque.
Depuis l’étude publiée par MORQUIO sur la ségrégation familiale des BAV en 1901, un gros progrès dans la compréhension des caractéristiques moléculaire, génétique et cliniques du BAV héréditaire, ainsi on a découvert la présence d’une mutation génétique à pénétrance incomplète et avec une expression variable. Des gènes codant pour des canaux ioniques et pour des connexions protéiniques tels que SCN5A, SCN1B, SCN10A, TRPM4, et KCNK17. La mutation du gène SCN5A tend à exposer les canalopathies intéressant les canaux sodiques, et ainsi mettre en évidence les syndromes reliés à la mutation du gène SCN5A (Syndrome du QT long et Syndrome de BRUGADA) [31, 32 , 33].
Maintenant il est assez clair que le mécanisme physiopathologique du BAV héréditaire inclus des mutations génétiques, dont probablement autres mutations non encore déterminées. Le test génétique reste un moyen bénéfique qui peut aider dans la détermination du risque de progression du trouble conductif et aussi dans le choix optimal du moment correct de l’implantation.
26 BAV infectieux :
Chez l’enfant, la survenue d’un BAV complet compliquant une myocardite aiguë est une éventualité très rare [34, 35]. Le symptôme révélateur le plus souvent rapporté est un malaise ou une syncope, mais on ne peut exclure que certains des blocs diagnostiqués dans l’enfance soit la conséquence d’une myocardite initialement passée inaperçue. En aigu, le diagnostic repose sur l’IRM, qui montre des signes d’inflammation myocardique et sur la mise en évidence de l’agent pathogène causal.
L’endocardite bactérienne peut léser le tissu conductif à partir d’un abcès septal venant envahir la région nodo-hissienne ou sa bifurcation. Le bloc
auriculoventriculaire survient plus fréquemment en cas de localisation aortique que mitrale. Cette complication grave incite à une intervention chirurgicale rapide.
Au cours de la maladie de Lyme (ML), spirochétose due à Borrelia burgdorferi, transmise par l'intermédiaire d'une piqûre de tique infectée.L’atteinte cardiaque dans la ML se produit au stade secondaire, généralement quelques semaines à mois après sa transmission (en moyenne 21 jours). Les bactéries concernées peuvent atteindre toutes les structures cardiaques, tel que démontré par
l’expérimentation animale et les études post-mortem : le myocarde lui-même, le système de conduction, le tissu conjonctif comprenant le péricarde et
l’endocarde, ainsi que les vaisseaux sanguins. Les troubles de la conduction sont la complication la plus commune, dont la sévérité est toutefois variable. Des troubles mineurs tels qu’une bradycardie sinusale6 ou un BAV du premier degré
passent souvent inaperçus, rendant ainsi leur prévalence dans la ML difficile à estimer. Jusqu’à 50% des patients souffrant d’une cardite de Lyme présentent un BAV complet. Cette variabilité dans la sévérité de l’atteinte du système de
conduction peut se voir chez le même patient, raison pour laquelle des ECG répétés ou un monitoring rythmique prolongé peuvent se révéler nécessaires afin de préciser la véritable sévérité des troubles de la conduction.
En cas de ML à son stade précoce (premiers jours), le diagnostic est purement clinique ; les tests sérologiques seront en effet négatifs puisque la réponse immunitaire n’est pas encore activée. En cas de maladie secondaire ou tertiaire, et donc dans les cas de cardite de Lyme, les sérologies sont nécessaires. Le diagnostic sérologique est réalisé en deux étapes, successivement par ELISA puis par Western blot si nécessaire.
La diphtérie est une infection causée par Corynebacterium diphtheriae, qui produit une toxine responsable d’une myocardite, polyneuropathie, et autres complications systémique. Cette myocardite apparait dans 10 à 25% des patients porteurs d’une diphtérie et peuvent développer dans la phase aigue ou même après des troubles conductifs pouvant aller d’une fibrillation atriale, à un bloc aurirulo ventriculaire complet ou jusqu’à une fibrillation ventriculaire.
27
La myocardite à Trypanozoma cruzi de la maladie de Chagas est la cause principale des blocs auriculoventriculaires chroniques rencontrés en Amérique latine. Transmise par un insecte de type punaise (triatomine) qui suce le sang - pénètre dans la peau par le site de la morsure, ou par l'œil. Les insectes
triatomines se trouvent principalement en Amérique centrale et en Amérique du Sud, où ils infestent les maisons en pisé (fissures des vieux murs), mais aussi dans le sud des Etats-Unis et maintenant en Europe.
La maladie de Chagas se présente en 2 phases et la première, la phase aiguë qui dure environ 2 mois, est la période où un nombre élevé de parasites circule dans le sang (risque transfusionnel). Dans la plupart des cas à la phase aiguë, il n’y a pas de symptôme ou seulement des symptômes non spécifiques. Chez moins de 50% des personnes infectées, les premiers signes évocateurs peuvent être une lésion de la peau ou un œdème violacé des paupières d’un œil. Sinon, les signes non-évocateurs sont les suivants : fièvre, maux de tête,
lymphœdème, pâleur, douleurs des muscles, difficultés respiratoires, œdème et douleurs du ventre ou de la poitrine.Au cours de la phase chronique (10 à 20 ans), les parasites se cachent principalement dans le muscle cardiaque et les muscles digestifs. Jusqu’à 30% des patients souffrent de troubles cardiaques et jusqu’à 10% de troubles digestifs (généralement méga-œsophage ou
mégacôlon) et neurologiques (système nerveux périphérique). Le bloc de
branche droit est l’anomalie électrocardiographie la plus commune, mais autres blocs auriculo ventriculaire sont fréquemment observés/ Autres trouble de rythme sont possibles : extrasystole, tachyarrythmie, bradyarythmie… Aussi le risque de l’insuffisance cardiaque. Histologiquement, ces infections sont
responsables d’une réponse inflammatoire avec interruption de la conduction auriculo ventriculaire suite à une infiltration de lymphocytes activés et
monocytes dans le myocarde et une destruction des fibres et du stroma
interstitiel. Ces lésions inflammatoires et œdémateuses peuvent être temporaires avec possibilité de récupération spontanée.
Autres maladies infectieuses qui peuvent se compliquer exceptionnellement d’un bloc auriculoventriculaire : mononucléose infectieuse, rougeole, oreillons, varicelle, toxoplasmose, typhoïde, Entérovirus, Mycoplasme Pneumoniae etc. Les moyens de diagnostic biologique dans le carde du BAV infectieux est basé essentiellement sur des techniques immuno-histologiques : marquage des lymphocytes par des anticorps monoclonaux et des technique de biologie moléculaire : détection des ADN viraux dans les cellules myocardiques.
L’imagerie cardiaque a une place dans le bilan étiologique du BAV infectieux, La scintigraphie myocardique qui oriente vers les myocardites infectieuse par une fixation sur les cellules myocardiques nécrotiques, et l’IRM cardiaque, peu
28
utilisé chez l’enfant, qui peut objectiver un œdème à la phase aigue, et une fibrose à l’étape tardive.
Actuellement, le traitement repose sur l’administration de corticoïdes et
d’immunoglobulines, associé à une stimulation temporaire. Lorsque le bloc ne régresse pas, ce qui représentait 21 % des patients, le traitement est
l’implantation d’un stimulateur cardiaque [34].
Pathologie inflammatoire et coronarienne Fièvre rhumatismale
Bien que la fièvre rhumatismale soit secondaire à une angine streptococcique, il ne s’agit pas d’une infection. Il s’agit plutôt d’un processus inflammatoire réactionnel à l’infection streptococcique. Les parties du corps les plus
fréquemment touchées par l’inflammation sont : Articulations, cœur, peau et le système nerveux. La plupart des personnes qui souffrent de fièvre
rhumatismale en guérissent, mais l’atteinte cardiaque peut être définitive chez une faible proportion de personnes.
La cardite rhumatismale endommage souvent les valves mitrales et aortiques entrainant des fuites valvulaires mais peut aussi engendrer une insuffisance cardiaque. Sur le plan rythmique les manifestations peuvent aller de la simple tachycardie sinusale à un bloc auriculo ventriculaire complet.
Syndrome de Reiter
Le syndrome ou maladie de Reiter est une forme de rhumatisme inflammatoire ou d’arthrite réactionnelle. Il s’agit d’une inflammation articulaire qui apparaît en réaction à une infection survenue à un autre endroit du corps, qui peut être accompagné d’une pancardite ou aortite avec insuffisance aortique.
Sarcoïdose
Maladie systémique inflammatoire caractérisée par la formation de granulome qui affecte le plus souvent les poumons, les organes lymphoïdes, la peau, le foie….
Et quand la sarcoïdose affecte le cœur, elle peut entrainer des troubles conductifs allant du bloc de branche jusqu’au bloc auriculo ventriculaire complet qui peut être dans certains cas réversible.
29
Ischémie coronaire et dégénérescence du système conductif
L’ischémie suite à une pathologie coronaire acquise (maladie de Kawasaki) ou une ischémie de la paroi inférieure peut transitoirement ou de façon permanente endommager le tissu conductif, conduisant à des degrés variables du bloc
auriculo ventriculaire.
Hypertension ou la sténose aortique et / ou mitrale peut accélérer la dégénération du système conductif à travers la fibrose et les calcifications.
Pathologie neuromusculaire Dystrophie myotonique
Pathologie héréditaire autosomique dominante ; avec une anticipation génétique, dont l’atteinte cardiaque intéresse la conduction auriculo ventriculaire. Elle se caractérise sur le plan génétique par une mutation du gène codant pour la protéine DMPK (myotonic dystrophy protein kinase) situé sur le bras long du chromosome 19 (19q13, 3) et une expansion du triplet cytosine-thymine-guanine (CTG) (plus de 50 triplets), avec comme corollaire une accumulation intranucléaire de l'ARN complémentaire des CTG et réduction du taux de la protéine DMPK. L'atteinte cardiaque est fréquente et, bien que souvent asymptomatique, allant d’une simple prolongation du PR au bloc auriculo ventriculaire complet, elle conditionne le pronostic vital et explique en partie le taux élevé de mort subite rencontré dans cette affection.
Kearns-Sayre syndrome
Le syndrome de Kearns-Sayre est une maladie neuromusculaire caractérisée par l'apparition avant l'âge de 20 ans d'une ophtalmoplégie, d'un ptosis, et d'une rétinite pigmentaire. Ce syndrome est dû à des délétions de l’ADN
mitochondrial. D’autres signes peuvent se voir dans le cadre du KSS tels une myopathie, une hyperprotéinorachie, une ataxie cérébelleuse, une surdité, une atteinte cardiaque (cardiomyopathie, trouble de la conduction cardiaque), Le pronostic du KSS est déterminé par la cardiomyopathie. En effet, lorsqu’il y a un bloc de conduction auriculoventriculaire complet, le risque de syncope et de mort subite est élevé, d’où la nécessité de mettre en place un pacemaker.
Sclérose tubéreuse (STB)
La STB est une maladie génétique multi systémique autosomique dominante due à des mutations des gènes TSC1 (9q34) et TSC2 (16p13.3) pouvant atteindre de nombreux organes et faisant partie des phacomatoses. Elle est caractérisée par des hamartomes multisystémiques affectant le plus souvent la peau ; le
30
peuvent toucher le nœud AV causant un bloc auriculo ventriculaire ou autres types de trouble de rythme comme une tachycardie ventriculaire quand le rhabdomyome touche les ventricules.
Tumeur intracardiaque
Les tumeurs intracardiaques constituent une cause très rare du bloc auriculo ventriculaire qui nécessite une invasion du système conductif. Le mésothéliome cardiaque réfère un replacement hétérotopique épithélial du nœud AV. Le diagnostic définitif nécessite une autopsie qui peut confirmer l’infiltration
extensive du nœud AV. Le mélanome métastatique aussi a été décrit avoir causé des blocs AV et une mort subite. Aussi le lymphome cardiaque primitif a été décrit en association avec des troubles conductifs graves.
Amylose cardiaque
Les amyloses cardiaques regroupent des maladies aboutissant à l’infiltration du myocarde par des protéines fibrillaires. Cette pathologie était jusqu’alors
méconnue et sous-estimée, ce qui induisait une absence de diagnostic ou un retard de la prise en charge. Les troubles conductifs sont visibles au cours de cette pathologie.
BAV idiopathique :
Le BAV idiopathique est un BAV d’origine inconnue qui survient au cours de l’enfance, en absence d’anticorps maternels, de pathologies structurales
cardiaques, ou autres. La littérature est assez rare concernant ce type de BAV. Dans la première large étude française qui s’intéresse à l’hérédité dans ce type de BAV idiopathique, Baruteau et Al ont observé un degré élevé d’hérédité et un fort génétique background dans la pathogénie du BAV isolé non
immunologique. Ainsi un dépistage génétique familial pourrait mettre en
évidence des arguments supplémentaires en faveur de l’hérédité dans ce type de BAV également dans des cas sporadiques [36, 37].
2- BAV associé à une cardiopathie structurale congénitale :
Cardiopathie congénitale native:
Des nouveautés génétiques récentes suggèrent que approximativement 10% des cardiopathies congénitales sont en rapport avec des mutations génétiques qui contribuent au processus pathologique [38]. Des mutations codant pour la transcription de facteurs essentiels dans la formation des cavités cardiaques,
31
remodelage endocardique et le développement du système conductif, tel que le NKX2.5 et Tbx5, peuvent entrainer des troubles conductifs associés à des malformations congénitales structurales. Des mutations NKX2.5 ont été reliés à plusieurs cardiopathies congénitales, telles que une CIA OS, tétralogie de Fallot, Ventricule droit à double issue, tronc artériel commun, Transposition des gros vaisseaux, non compaction ventriculaire, arc de l’aorte interrompu… [39]. TBX5 mutations est responsable du Holt-Oram Syndrome, une pathologie
autosomique dominant héréditaire caractérisée par des anomalies du rayon radial (malformations de l’os carpien), des CIA, CIV, et aussi des troubles conductifs qui peuvent survenir même en absence de cardiopathie structurale [40].
Kearns-Sayre syndrome est un désordre mitochondriale et une maladie neuromusculaire caractérisée par l'apparition avant l'âge de 20 ans d'une
ophtalmoplégie, d'un ptosis, et d'une rétinite pigmentaire. Plus de deux cent cas ont été publiés. La prévalence de l'affection est estimée entre 1 et 3/100 000. Cette pathologie est associée dans 50% des cas de trouble conductifs dont le plus répandu est le BAV [41].
Le bloc conductif auriculo ventriculaire affecte le tiers des fœtus atteints du syndrome d’hétérotaxie ; Il s'agit d'un placement anormal des organes
thoraciques et/ou abdominaux qui sont inversés droite/gauche par rapport à la normale. C'est un groupe assez vaste d'anomalies car il existe de multiples possibilités d'inversion droite/gauche qui peuvent être complètes ou partielles. La pathologie congénitale la plus associée reste la L transposition des gros vaisseaux. C’est le développement anormal du squelette fibreux du cœur, avec un défaut d’union entre le nœud AV et les branches AV de Purkinje ou bien la formation du tissu de conduction à partir de l’endocarde antérieur, qui peuvent être responsable de l’origine du BAV dans la L transposition des vaisseaux. Le risque de mortalité par BAV chez ces patients est de 1% annuellement, et environ 50% développent un BAV spontanément à l’âge de 50 ans [42].
Schéma n°6 : Schéma expliquant la L transposition des gros vaisseaux et ses rapports anatomiques.
32 Post opératoire BAV :
Les BAV postopératoires surviennent avec une incidence de 1 à 3 %, souvent après chirurgie complexe et essentiellement la chirurgie des cardiopathies congénitales (Réparation ou remplacement de la valve mitrale ou aortique, fermeture de CIV, correction d’un canal AV…) ; Il s’agit le plus souvent d’un BAV complet ou d’un BAV de haut degré définitif. Dans certains cas, on observe un BAVC transitoire durant plus de 48 heures après la chirurgie, avec des anomalies résiduelles de la conduction dont il a été montré qu’elles
pouvaient évoluer brutalement vers le bloc complet avec un risque de syncope voire de mort subite. Une implantation de PM doit être considérer chez tous les patients qui présentent un BAV de haut degré post opératoire au bout de 7 à 10 jours du post opératoire. Durant cette période, des sondes de stimulation
épicardiques temporaire est nécessaire. Le BAV post opératoire peut survenir à distance de la chirurgie après la sortie du patient, d’où l’intérêt d’un suivi précoce des patients vu le risque de l’évolution vers un BAV au long cours
[43,44].
3- BAV associé à une cardiopathie acquise:
Le BAV à l’âge jeune peut aussi survenir dans autres pathologies coronaires, infectieuses, métaboliques, infiltratives.
La maladie de Chagas est une endémie dans l’Amérique latin, et autour des 1/3 des patients affectés, développement des troubles conductifs nécessitant une implantation de PM.
Autres procédures interventionnelles comme la fermeture percutanée du CIV et l’ablation du nœud AV lors des tachycardies par réentrée ou les faisceaux accessoires prédisposent à un risque élevé de BAV complet. L’incidence de la dysfonction du nœud AV est élevée dans la maladie de Kawasaki, probablement causée par une myocardite ou une anomalie de la circulation de l’artère irriguant le nœud AV. La cardite rhumatismale doit être retenue dans l’esprit dans
l’enquête étiologique devant un BAV chez l’enfant. Souvent il s’agit un BAV de 1er ou 2eme degré réversible.
33
VII) Diagnostic du BAV anté et post natal:
1- Présentation clinique :
Le patient enfant ou l’adulte jeune avec un BAV peut présenter cliniquement une liste de symptômes incluant une syncope, vertige, crise tonico clonique… L’analyse des symptômes doit comporter une évaluation des signes systémiques ou chroniques. Spécifiquement, il est important de rechercher des signes
associés aux pathologies systémiques (arthralgies), neurologiques (céphalées, développement psycho moteur), infectieuses (fièvre, grippe, ruch cutané), ainsi que des signes d’insuffisance cardiaque (dyspnée, fatigabilité, cyanose,
difficulté à téter...)…
Néanmoins le BAV chez l’enfant, ou adulte jeune peut être asymptomatique et de découverte fortuite retardant ainsi le diagnostic.
L’histoire familiale est assez importante à la recherche de pathologies
héréditaires qui peuvent être responsable de ce trouble conductif (mère porteuse de maladie de système, cardiomyopathie, syndrome du QT long…)
La recherche d’une exposition à la prise de médications, herbes ou plantes médicinales, peut être très utile dans l’explication de la symptomatologie et la cause du bloc auriculo ventriculaire.
L’examen physique du BAV chez l’enfant est peu riche. Seule la bradycardie qui peut être révéler. Néanmoins, un BAV 1er degré garde une fréquence
cardiaque quasi normale. Contrairement au BAV de bas degré, les enfants avec un BAV complet peuvent avoir un pouls paradoxal, des signes d’insuffisance cardiaque (râles à l’auscultation pulmonaire, tachypnée, hépatomégalie…) Un examen clinique minutieux doit être réalisé à la recherche de signes de maladies systémiques.
2- Evaluation diagnostique :
Échocardiographie fœtale
Le diagnostic anténatal de BAVc se fait à l’échocardiographie habituellement après la 20e semaine d’aménorrhée (SA). Devant une bradycardie en fin de grossesse, outre le BAVc, il convient d’évoquer une souffrance fœtale aiguë qui nécessiterait alors une extraction en urgence. Le plus souvent, le diagnostic différentiel du BAVc est celui d’une extrasystolie auriculaire bloquée. C’est l’enregistrement simultané essentiellement en mode TM échographique des contractions auriculaires et ventriculaires fœtales qui permet le diagnostic de BAVc. Ainsi, l’étude de la valve auriculo ventriculaire gauche en mode TM met en évidence une bradycardie ventriculaire avec des ondes A mitrales plus
contractent de façon indépendante. Le BAV est partiel, le plus souvent du 2e degré s’il existe un couplage plus ou moins fixe entre deux ou trois systoles auriculaires, voire plus, pour une seule contraction ventriculaire. Dans tous les cas, le rythme des oreillettes est plus rapide que celui des ventricules. Cette bradycardie fœtale amenant au diagnostic de BAVc est souvent révélatrice d’une cardiopathie complexe associée notamment à
pathologie de la concordance auriculo
multicentrique, l’association entre un BAVc et une cardiopathie complexe pouvait atteindre plus de 40 %
mortalité (près de 43 %) dont les facteurs pronostiques étaient l’existence d’un hydrops, d’une cardiopathie complexe associée, d’une fréquence auriculaire inférieure à 120/min et surtout d’une fréquence ventriculai
Cependant, lorsque le BAVc est isolé le pronostic anténatal est habituellement très favorable. Néanmoins, tout BAVc diagnostiqué nécessite une prise en charge en milieu spécialisé dès la naissance. Les formes anténatales sont de pronostic défavorable avec près de 50 % de mortalité, surtout lorsqu’il existe une cardiopathie congénitale malformative associée. Les facteurs de risque de mortalité étaient : le diagnostic anténatal, une dysfonction ventriculaire gauche, une fibroélastose endocardique et la prématurité < à 32 SA. L’indication d’une stimulation cardiaque définitive a été portée six fois plus souvent dans le groupe anténatal, 2 fois plus souvent dans le groupe néonatal que dans le groupe de découverte dans l’enfance.
Les enfants du groupe de diagnostic anténatal était presque tous issus de mère ayant des anticorps anti-RO et anti
endocardiques qui aggravaient le pronostic BAVc chez un fœtus impose une analyse
échocardiographie fœtale puis un suivi au moins bimensuel, voire
hebdomadaire, à la recherche d’une dysfonction ventriculaire gauche ou d’un hydramnios [45].
Figure n° 2: Echocardiographie fœtale objectivant une coupe 4
34
contractent de façon indépendante. Le BAV est partiel, le plus souvent du 2e degré s’il existe un couplage plus ou moins fixe entre deux ou trois systoles
our une seule contraction ventriculaire. Dans tous les cas, le rythme des oreillettes est plus rapide que celui des ventricules. Cette bradycardie fœtale amenant au diagnostic de BAVc est souvent révélatrice d’une
sociée notamment à des isomérismes gauches ou une pathologie de la concordance auriculo ventriculaire. Récemment, dans une série multicentrique, l’association entre un BAVc et une cardiopathie complexe
uvait atteindre plus de 40 % [45]. Dans cette série, il y avait une forte
mortalité (près de 43 %) dont les facteurs pronostiques étaient l’existence d’un hydrops, d’une cardiopathie complexe associée, d’une fréquence auriculaire inférieure à 120/min et surtout d’une fréquence ventriculaire inférieure à 55/min. Cependant, lorsque le BAVc est isolé le pronostic anténatal est habituellement très favorable. Néanmoins, tout BAVc diagnostiqué nécessite une prise en charge en milieu spécialisé dès la naissance. Les formes anténatales sont de
nostic défavorable avec près de 50 % de mortalité, surtout lorsqu’il existe une cardiopathie congénitale malformative associée. Les facteurs de risque de mortalité étaient : le diagnostic anténatal, une dysfonction ventriculaire gauche,
ndocardique et la prématurité < à 32 SA. L’indication d’une stimulation cardiaque définitive a été portée six fois plus souvent dans le groupe anténatal, 2 fois plus souvent dans le groupe néonatal que dans le groupe de découverte dans l’enfance.
nts du groupe de diagnostic anténatal était presque tous issus de mère RO et anti-LA et avaient des fibroélastoses
aggravaient le pronostic. C’est pourquoi la découverte d’un BAVc chez un fœtus impose une analyse morphologique précise par une échocardiographie fœtale puis un suivi au moins bimensuel, voire
hebdomadaire, à la recherche d’une dysfonction ventriculaire gauche ou d’un
Echocardiographie fœtale objectivant une coupe 4 cavités faite à 30 SA contractent de façon indépendante. Le BAV est partiel, le plus souvent du 2e degré s’il existe un couplage plus ou moins fixe entre deux ou trois systoles
our une seule contraction ventriculaire. Dans tous les cas, le rythme des oreillettes est plus rapide que celui des ventricules. Cette bradycardie fœtale amenant au diagnostic de BAVc est souvent révélatrice d’une
es gauches ou une ventriculaire. Récemment, dans une série multicentrique, l’association entre un BAVc et une cardiopathie complexe
. Dans cette série, il y avait une forte
mortalité (près de 43 %) dont les facteurs pronostiques étaient l’existence d’un hydrops, d’une cardiopathie complexe associée, d’une fréquence auriculaire
re inférieure à 55/min. Cependant, lorsque le BAVc est isolé le pronostic anténatal est habituellement très favorable. Néanmoins, tout BAVc diagnostiqué nécessite une prise en charge en milieu spécialisé dès la naissance. Les formes anténatales sont de
nostic défavorable avec près de 50 % de mortalité, surtout lorsqu’il existe une cardiopathie congénitale malformative associée. Les facteurs de risque de mortalité étaient : le diagnostic anténatal, une dysfonction ventriculaire gauche,
ndocardique et la prématurité < à 32 SA. L’indication d’une stimulation cardiaque définitive a été portée six fois plus souvent dans le groupe anténatal, 2 fois plus souvent dans le groupe néonatal que dans le groupe de
nts du groupe de diagnostic anténatal était presque tous issus de mère LA et avaient des fibroélastoses
. C’est pourquoi la découverte d’un morphologique précise par une échocardiographie fœtale puis un suivi au moins bimensuel, voire
hebdomadaire, à la recherche d’une dysfonction ventriculaire gauche ou d’un
35 Électrocardiogramme de surface
Le diagnostic de certitude de BAVc se fait sur l’électrocardiogramme (ECG) de surface. Celui-ci met en évidence une dissociation complète entre l’activité électrique auriculaire et ventriculaire avec une fréquence ventriculaire plus lente. La mesure des fréquences auriculaire et ventriculaire permet d’apprécier la gravité du bloc. Il est important de noter si l’échappement ventriculaire est fin ou large, c’est-à-dire plus bas situé et donc de pronostic moins favorable. On mesure avec attention l’intervalle QT corrigé par la fréquence cardiaque suivant la formule de Bazett. Ainsi, immédiatement à la naissance, sur un simple tracé ECG enregistré sur 12 dérivations, le diagnostic est posé : le rythme des activités auriculaire et ventriculaire est dissocié et l’activité auriculaire est plus rapide que l’activité ventriculaire. On peut estimer la sévérité du BAVc en calculant la fréquence ventriculaire, le QTc et en évaluant le siège du bloc.
Holter-électrocardiographie
L’enregistrement Holter-ECG des 24 heures permet de quantifier les fréquences auriculaire et ventriculaire diurnes, nocturnes et moyennes des 24 heures.
Cet enregistrement continu permet de rechercher des pauses ventriculaires qui ont un caractère péjoratif si elles sont supérieures à 2 à 3 secondes en fonction de l’âge (ou pauses ventriculaires de plus de trois fois l’espace RR précédent). Le Holter peut montrer des troubles du rythme ventriculaire et permet d’évaluer l’adaptation de la fréquence d’échappement ventriculaire à l’activité.
Épreuve d’effort cardiorespiratoire
L’épreuve d’effort est réalisable à partir de l’âge de 7 ans chez un enfant mesurant plus de 1,20 m et recherche une incapacité d’effort, des troubles du rythme ventriculaire adrénergiques. Cet examen recherche également
l’aggravation du trouble conductif et l’absence de variation du rythme
ventriculaire. Ainsi il a été montré une VO2 sous-maximale inférieure dans le groupe BAVc comparée à un groupe témoin apparié à l’âge et au sexe. Le BAVc ne nécessite plus, à l’heure actuelle, d’étude électro physiologique à la recherche du siège du bloc ni de cathétérisme cardiaque à la recherche de malformation associée.
Biologie
Certain troubles conductifs peut être d’origine infectieuse, inflammatoire ou toxique; quelques étiologies à citer:
1- Processus inflammatoire: myo-endocardite, fièvre rhumatismale, maladie de Lyme,