Régulation de l’activité du promoteur distal 1b du gène Gata4
Mémoire
Vanessa Théberge
Maîtrise en médecine moléculaire
Maître ès sciences (M. Sc.)
Québec, Canada
Régulation de l’activité du promoteur distal 1b du gène Gata4
Mémoire
Vanessa Théberge
Sous la direction de :
Robert Viger, directeur de recherche
iii
Résumé
Le facteur de transcription GATA4 est essentiel au développement et à la fonction des tissus dérivant du mésoderme et de l’endoderme, incluant les gonades. Le gène GATA4 est exprimé sous différents transcrits qui se distinguent par la séquence de leur premier exon non codant. Deux de ces transcrits sont majoritairement exprimés et sont conservés à travers les espèces : le transcrit GATA4 E1a (généré par un promoteur proximal 1a) et le transcrit GATA4 E1b (produit par le promoteur distal 1b). Des études effectuées chez des modèles de souris ont démontré qu’une séquence de 5 kb en amont du promoteur 1a du gène Gata4 est suffisante pour récapituler l’expression endogène du gène seulement dans une sous-population de cellules ayant le facteur GATA4, incluant les cellules de Sertoli dans les gonades mâles. Nous avons donc émis l’hypothèse que le promoteur 1b, tout comme le promoteur 1a, contribue au profil d’expression cellules- et tissus-spécifique de Gata4. Afin d’étudier les mécanismes qui contrôlent l’activité du promoteur alternatif 1b du gène Gata4 in vivo, nous avons généré une souris transgénique exprimant la protéine GFP sous le contrôle d’une séquence de 2 kb en amont de l’exon 1b. L’expression du transgène a été analysée dans plusieurs tissus et à différents stades de développement en détectant la protéine GFP par épifluorescence, immunohistochimie et Western Blot. Les résultats ont démontré qu’une séquence de 2 kb n’est pas suffisante pour induire l’expression du transgène chez la souris et suggèrent que des éléments de régulation supplémentaires sont nécessaires pour permettre l’expression endogène du gène Gata4 via son promoteur alternatif 1b. Afin d’identifier ces éléments, divers outils bio-informatiques couplés à des analyses in vitro ont été utilisés. Mes travaux de maîtrise mettent en évidence huit nouveaux enhancers potentiellement impliqués dans la régulation de l’activité du promoteur 1b de Gata4. Les résultats de cette étude permettent une meilleure compréhension des mécanismes transcriptionnels de l’activité du promoteur 1b de
iv
Abstract
The GATA4 transcription factor is essential for the development and function of multiple tissues derived from both mesoderm and endoderm, such as the gonads. The
GATA4 gene is expressed as multiple transcripts that differ in their first untranslated
exon sequence. Two of them are predominantly expressed and are conserved among species: transcripts GATA4 E1a (generated by the proximal 1a promoter) and GATA4 E1b (via its distal 1b promoter). Previous studies using transgenic mice demonstrated that a 5 kb sequence upstream of 1a promoter is sufficient to recapitulate endogenous
Gata4 expression only in a subset of cells normally containing GATA4, including
Sertoli cells in the male gonad. We therefore hypothesized that 1b promoter, like 1a promoter, contributes to cell- and tissue-specific Gata4 expression. To gain insight into the mechanisms that control the activity of the Gata4 1b promoter in vivo, we generated transgenic mice expressing a GFP reporter under the control of 2 kb of sequences upstream of the distal promoter. Transgene expression was assessed in several tissues and at many developmental stages by detecting GFP protein by epifluorescence, immunohistochemistry and Western Blot. The results showed that 2 kb of upstream sequences of Gata4 1b promoter are not sufficient to direct transgene expression in the mouse and suggest that other elements are required for endogenous transcription of the gene from its distal 1b promoter. To identify these elements, several bioinformatic analyses coupled with in vitro assays were performed. My work highlights eight new enhancers potentially involved in Gata4 1b promoter activity. The results from this thesis will help to provide a better understanding of the mechanisms involved in the transcriptional regulation of the GATA4 gene in different cell types and at different developmental stages.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... viii
Liste des figures ... ix
Liste des abréviations ... xii
Remerciements ... xv
Chapitre 1 : Introduction ... 1
1.1 Facteurs de transcription de la famille GATA ... 3
1.2 Rôles et fonction des facteurs GATA ... 4
1.2.1 Expression et rôles du facteur GATA1 ... 5
1.2.2 Expression et rôles du facteur GATA2 ... 6
1.2.3 Expression et rôles du facteur GATA3 ... 6
1.2.4 Expression et rôles du facteur GATA4 ... 7
1.2.5 Expression et rôles du facteur GATA5 ... 7
1.2.6 Expression et rôles du facteur GATA6 ... 8
1.3 Expression et fonction de GATA4 dans le développement des tissus dérivant du mésoderme et de l’endoderme ... 9 1.3.1 Intestin ... 10 1.3.2 Foie ... 11 1.3.3 Pancréas... 12 1.3.4 Estomac ... 13 1.3.5 Coeur ... 13 1.3.6 Surrénales ... 15 1.3.7 Ovaire ... 15 1.3.8 Testicule ... 16
1.4 Rôle de GATA4 dans les gonades chez le mâle ... 17
1.4.1 Détermination du sexe et différenciation sexuelle ... 17
vi
1.5 Mécanismes de régulation de l’activité des facteurs GATA ... 22
1.5.1 Différents exons en 5’ non codants ... 22
1.5.2 Enhancers des gènes GATA ... 24
1.6 Régulation transcriptionnelle de l’expression du gène GATA4 ... 26
1.6.1 Mécanismes post-transcriptionnels ... 26
1.6.2 Modifications post-traductionnelles ... 27
1.6.3 Interaction avec des cofacteurs ... 28
1.7 Objectifs et hypothèse de recherche ... 30
Chapitre 2 : Méthodologie ... 32
2.1 Génération des souris transgéniques Gata4 1b GFP ... 32
2.1.1 Génotypage ... 32
2.1.2 Préparation des tissus ... 33
2.2 Immunohistochimie ... 33
2.3 Épifluorescence ... 34
2.4 Extraction protéique totale ... 34
2.5 Immunobuvardage (Western Blot) ... 35
2.6 Cytométrie en flux ... 35
2.7 Analyse bio-informatique ... 36
2.8 Clonage ... 36
2.9 Culture cellulaire et transfections ... 40
2.10 enChIP ... 40
2.10.1 Conception des ARN guides ... 41
2.10.2 Analyse de l’efficacité des guides ... 41
2.10.3 Immunoprécipitation de la chromatine (ChIP) ... 43
2.10.4 Vérification de l’efficacité du ChIP ... 43
Chapitre 3 : Résultats ... 45
3.1 Analyse in vitro de l’activité du promoteur 1b ... 45
3.2 Génération des souris transgéniques Gata4 1b GFP ... 47
3.2.1 Schéma expérimental ... 47
3.3 Analyse de l’expression du transgène au stade fœtal ... 48
vii
3.3.2 Tissus gonadiques ... 52
3.4 Analyse de l’expression du transgène au cours du développement postnatal ... 55
3.5 Analyse de l’expression du transgène GFP au cours de la maturation testiculaire ... 58
3.6 Analyse du promoteur 1b in vitro ... 59
3.7 Analyses bio-informatique ... 61
3.7.1 Analyse par conservation d’espèces... 62
3.7.2 Analyse des bases de données Fantom5... 64
3.7.3 Analyse IM-PET ... 67
3.8 Perspectives : enChIP ... 70
Chapitre 4 : Discussion ... 74
4.1 Activité des promoteurs 1a et 1b du gène Gata4 ... 74
4.2 Interprétation des résultats de la lignée de souris Gata4 1b GFP... 75
4.3 Justification des outils utilisés pour l’identification d’enhancers potentiels 77 4.4 Régulation de la transcription de Gata4 par des enhancers ... 80
4.5 Modèles de souris pour l’étude de la régulation transcriptionnelle de l’expression de Gata4 ... 82
Chapitre 5 : Conclusion ... 85
viii
Liste des tableaux
Tableau 2.1 : Oligonucléotides utilisés pour amplification par PCR de la séquence promotrice 1b et des séquences identifiées par conservation
d’espèces et par la base de données Fantom5 ... 37
Tableau 2.2 : Paramètres PCR utilisés pour amplifier la séquence promotrice 1b .... 38
Tableau 2.3 : Paramètres PCR utilisés pour amplifier les séquences identifiées par conservation d’espèces et par la base de données Fantom5 ... 38
Tableau 2.4 : Oligonucléotides utilisés pour l’amplification par PCR de la séquence identifiée par IM-PET ... 39
Tableau 2.5 : Paramètres PCR utilisés pour amplifier la séquence identifiée par IM-PET ... 39
Tableau 2.6 : Séquences des ARNguides utilisés pour cibler le promoteur 1a
de Gata4 et le promoteur Star ... 42
Tableau 2.7 : Oligonucléotides utilisés pour la validation des séquences cibles des ARN guides par amplification PCR ... 42
Tableau 2.8 : Paramètres PCR utilisés pour l’appariement des séquences cibles par l’ARN guide ... 42
Tableau 2.9 : Oligonucléotides utilisés pour la validation des séquences cibles des ARN guides par amplification PCR ... 44
ix
Liste des figures
Figure 3.1 : Stratégie utilisée pour cloner le promoteur 1b de Gata4 souris ... 45
Figure 3.2 : Expression du transgène de la protéine fluorescente GFP sous le contrôle de 2 kb du promoteur de souris Gata4 1b in vitro ... 46
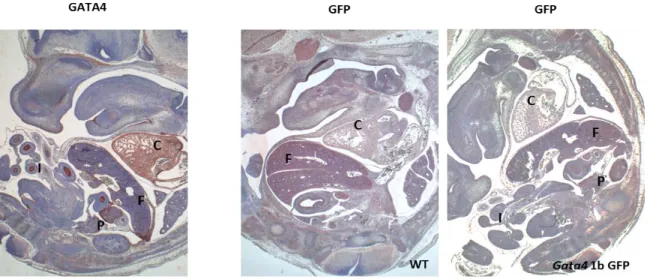
Figure 3.3 : Génération des souris transgéniques Gata4 1b GFP ... 47 Figure 3.4 : Visualisation de la protéine GFP dans des tissus embryonnaires E13,5 par épifluorescence ... 49
Figure 3.5 : Localisation de la protéine GATA4 au stade embryonnaire
murin E13,5 ... 50
Figure 3.6 : Détection des protéines GATA4 et GFP au stade embryonnaire
murin E13,5 ... 50
Figure 3.7 : Détection de la protéine GFP par cytométrie en flux
au stade E16,5 ... 51
Figure 3.8 : Étude comparative de l’expression de Gata4 et du transgène GFP dans les gonades fœtales des souris Gata4 1a GFP et
Gata4 1b GFP E13,5 ... 53
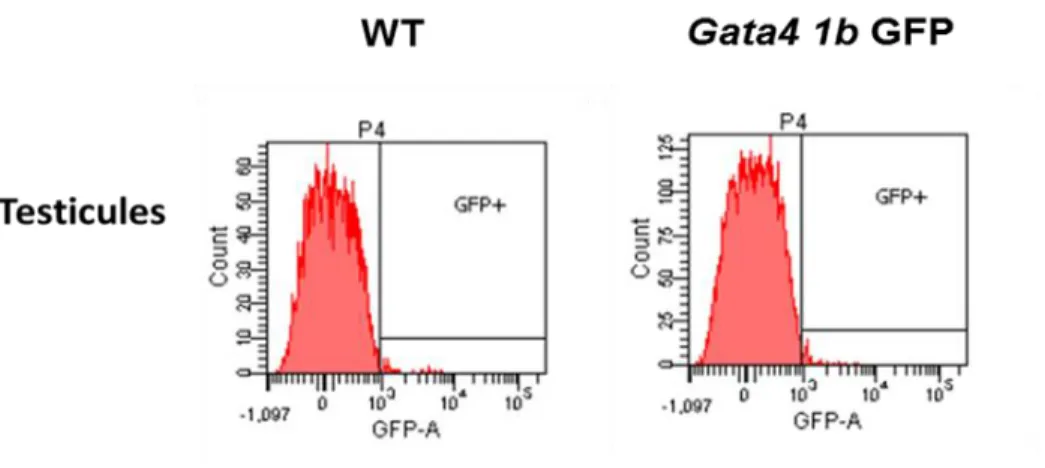
Figure 3.9 : Analyse de l’expression de la protéine GFP par cytométrie en flux sur des testicules d’embryons E16,5 ... 54
Figure 3.10 : Visualisation de la fluorescence GFP par épifluorescence au
stade adulte P35... 56
x
Figure 3.12 : Analyse de l’expression du transgène GFP dans les testicules
à différents stades de maturation par Western Blot ... 58
Figure 3.13 : Analyse de l’activité promotrice Gata4 1b in vitro ... 60
Figure 3.14 : Stratégie utilisée pour l’analyse in vitro des régions régulatrices
identifiées ... 61
Figure 3.15 : Analyse des séquences conservées entre les espèces en amont de l’exon 1b du gène GATA4 ... 62
Figure 3.16 : Analyse de l’activité des enhancers potentiels identifiés par séquences conservées ... 63
Figure 3.17 : Comparaison de l’activité des enhancers transcrits identifiés par
CAGE ... 65
Figure 3.18 : Représentation schématique dans la base de données ENCODE de la position de chaque enhancer ARN identifié autour de l’exon 1b ... 65
Figure 3.19 : Analyse de l’activité des enhancers potentiels identifiés par CAGE ... 66
Figure 3.20 : Représentation des interactions potentielles entre des enhancers et le promoteur 1b identifiés par l’algorithme IM-PET ... 68
Figure 3.21 : Analyse de l’activité des enhancers potentiels identifiés par
IM-PET.. ... 69
Figure 3.22 : Analyse de l’efficacité des guides à cibler leur région pour édition génomique avec Cas9 par la méthode de PAGE ... 71
xi
Figure 3.23 : Immunoprécipitation des séquences ciblées par les ARN guides
xii
Liste des abréviations
A ADN ADNc AMH AMHR2 ANF ARN ARNm BMP4 BNP BSA C CAGE Cas9 ChIA-PET ChIP CO2 Cyp Cys DHH DMRT1 E EMSA EMX2 ERK Fantom FOG FOX Adénine Acide désoxyribonucléique ADN complémentaire Hormone anti-Müllerienne Récepteur 2 de l’AMH
Facteur natriurétique auriculaire Acide ribonucléique
ARN messager
Protéine morphogénétique osseuse 4 Peptide cérébral natriurétique
Albumine de sérum bovin Cytosine
Cap Analysis Gene Expression CRISPR associated protein 9
Chromatin Interaction Analysis by Paired-End Tag Sequencing Chromatin immunoprecipitation (immunoprécipitation de la chromatine)
Gaz carbonique Cytochrome P450 Cystéine
Desert Hedgehog
Doublesex and mab-3 related transcription factor 1 Jour embryonnaire
Essai de retardement sur gel Empty Spiracles Homeobox 2
Extracellular signal–regulated kinases
Functional annotation of the mammalian genome Friend of GATA
xiii FSH FST G GATA GFP HNF3 HRP INHA INHB IM-PET IP IRX3 Kb LacZ LH LHX9 MAPK MEF MHC miARN mL Nkx2-5 PBS PFA PDX1 PKA RACE SDS SF1 Hormone folliculo-stimulante Follistatine Guanine
GATA binding protein Green Fluorescent Protein Facteur nucléaire hépatocytaire 3
Horseradish peroxidase (Peroxydase de raifort) Inhibine A
Inhibine B
Integrated Method for Predicting Enhancer Target Immunoprécipitation Iroquois-class homeodomain 3 Kilobase Beta-D-galactosidase gene Hormone lutéinisante LIM homeobox 9
Mitogen-activated protein kinase Myocyte enhancer factor
Complexe majeur d'histocompatibilité Micro-ARN
Millilitre
NK2 homeobox 5 Tampon phosphate salin Paraformaldéhyde
Pancreatic and Duodenal Homeobox 1 Protein kinase A
Rapid amplification of cDNA ends (amplification rapide des extrêmités d’ADNc)
Dodécylsulfate de sodium Steroidogenic factor 1
xiv siARN SNP SOX9 SPRR2 Sry STAR SUMO T Tie2 USF2 UTR WT Wt1 YAC
Petit ARN interférent
Polymorphisme nucléotidique SRY-box-containing gene 9 Small proline-rich protein 2 Sex determining region Y
Steroidogenic acute regulatory protein Small ubiquitin-related modifier Thymine
Récepteur de l’angiopoïétine Upstream Transcription Factor 2 Région non-traduite
Témoin Wilms tumor 1
xv
Remerciements
L’accomplissement de ce projet de maîtrise a été possible grâce à l’aide et au soutien de plusieurs personnes de mon entourage. Je tiens tout d’abord à remercier mon directeur de maîtrise, Robert Viger, sans qui tout ce travail n’aurait pu être accompli. Merci pour la confiance d’avoir accepté de diriger mes travaux de maîtrise et pour m’avoir confié un projet à la hauteur de mes espérances. Les compétences et l’apprentissage que j’ai acquis au cours de ma maîtrise sont énormes et me suivront sans aucun doute tout au long de ma carrière. Je te remercie pour le soutien et les commentaires qui m’ont permis de constamment m’améliorer et d’évoluer dans mon cheminement scientifique.
Je ne peux passer sous silence l’aide inestimable des professionnels de recherche du laboratoire. Merci tout d’abord à Francis d’avoir répondu à mes nombreuses (!) questions avec autant de patience et de m’avoir transmis ton désir de découvrir et d’apprendre. Je remercie également Marie-France pour son aide au quotidien dans le laboratoire et sa disponibilité. Vous avez tous les deux contribué à mon apprentissage au cours de cette maîtrise et je vous en serai éternellement reconnaissante.
J’aimerais remercier Charles Joly-Beauparlant, Audrey Lemaçon et Arnaud Droit de la plateforme de bioinformatique du CHU de Québec qui ont donné de leur temps pour contribuer à l’avancement de ce projet.
Je tiens à remercier tous les membres du CRDSI. Vous avez tous contribué à votre façon, de près ou de loin, à rendre mon expérience à la maîtrise plus agréable et enrichissante.
Enfin, mes plus sincères remerciements à ma famille : mon copain Yannick, mes parents, ma sœur et tous mes proches et amis, qui m'ont accompagné, aidé, soutenu et encouragé tout au long de la réalisation de cette maîtrise.
1
Chapitre 1 : Introduction
Les différents processus biologiques du développement, incluant la différenciation et la prolifération cellulaire, sont fondamentalement déterminés par un ensemble unique de combinaison d’expression de gènes. L’activation ou la répression de ces gènes selon le stade de développement et le type cellulaire permettent ainsi d’assurer le fonctionnement optimal et le devenir de la cellule. L’expression d’un gène peut être régulée à différentes étapes, notamment par des modifications de la chromatine, par la régulation de la transcription et de la traduction ou encore par des modifications post-transcriptionnelles et post-traductionnelles. Une régulation inadéquate de l’expression de certains gènes mène généralement à diverses pathologies ou problèmes développementaux. De ce fait, il est opportun de comprendre comment un gène devient exprimé ou non et comment celui-ci est régulé lors de divers processus biologiques autant dans un contexte sain que pathologique.
Parmi les différentes étapes de la régulation de l’expression génique mises en place par la cellule, la transcription est une des étapes critiques permettant la régulation de ses gènes. La transcription d'un gène correspond à la synthèse d'un ARN simple brin à partir d'une matrice d'ADN par l'action d'une ARN polymérase. Pour les gènes codants des protéines, cet ARN nouvellement synthétisé est appelé ARN messager (ARNm) et sera ensuite décodé sous forme protéique au cours de la traduction. La transcription débute par une étape cruciale d’initiation qui est soumise à une régulation complexe et dynamique. Chez les eucaryotes, cette action est contrôlée par différentes protéines nucléaires, dites facteurs généraux de transcription, qui reconnaissent et se lient à des éléments régulateurs des régions promotrices de gènes cibles afin d’aider au recrutement de l’ARN polymérase (Hahn, 2004; Liu et al., 2013). L’ensemble de ces protéines, facteurs généraux de la transcription et ARN polymérase, forment le complexe de préinitiation. L’ARN polymérase synthétise un court fragment d’ARN, soit approximativement 10 bases, puis passe à l’étape d’élongation. La polymérase dissocie la chaîne d’ARN nouvellement synthétisée au cours de sa progression et corrige les potentielles erreurs crées. Enfin, la terminaison de la transcription constitue en la libération de la molécule d’ARN produite (Li et al., 2007).
2
La machinerie transcriptionnelle se lie dans la région du promoteur minimal, une courte séquence comprenant la région minimalement requise pour que le promoteur soit actif. En plus du promoteur minimal, d’autres éléments de séquences de régulation sont également requis pour s’assurer d’une transcription efficace, incluant les éléments du promoteur proximal, les éléments amplificateurs distaux « enhancers » et les séquences de répression (silencers ou isolateurs) (revue dans Maston et al., 2006). Ces éléments lient des protéines régulatrices activatrices ou répressives, tel que des facteurs de transcription. Les facteurs de transcription sont des protéines de régulation nucléaires dont la majorité sont connus pour se lier spécifiquement à l’ADN des régions régulatrices de leurs gènes cibles par leur domaine de liaison à l’ADN (Todeschini et al., 2014). Cette liaison module l’expression des gènes, en agissant à la fois en tant qu’activateur ou répresseur au cours du développement ou en réponse à différents stimulis. De façon générale, cette régulation est possible par la synergie ou la coopération entre plusieurs de ces facteurs, certains ubiquitaires et d’autres exprimés spécifiquement selon le type cellulaire (Pan et al., 2010). La spécificité des fonctions des différents facteurs de transcription est assurée par des différences de séquences peptidiques et de conformations dans leur domaine de liaison à l’ADN et par des interactions protéines-protéines spécifiques.
Les enhancers sont des régions d’ADN qui recrutent les facteurs de transcription et les co-facteurs. La liaison des facteurs de transcription aux enhancers permet d’augmenter l’activité transcriptionnelle de leurs gènes cibles en plus de conférer une expression spécifique à un tissu ou une cellule (revue dans Bulger and Groudine, 2010). Bien qu’ils soient parfois situés dans des régions éloignées, les enhancers sont approchés à proximité de leur gène cible par le biais d’une boucle de chromatine permettant ainsi la régulation critique de différents processus développementaux (Spitz and Furlong, 2012).
Ces différents concepts soutiennent ainsi l’idée principale de l’importance de l’organisation et de la régulation du génome sur l’expression de ses gènes. Une dérégulation de ces processus chez les organismes eucaryotes peut mener à des retards ou des malformations lors du développement, en plus d’être propice à développer
3
certaines maladies ou cancers (Lee and Young, 2013). Il est donc essentiel de comprendre quels sont les mécanismes moléculaires et les éléments de régulation transcriptionnelle favorisés pour l’expression de chaque gène. Dans le cadre de ce mémoire, je m’attarderai plus précisément à l’étude des mécanismes entourant le facteur de transcription GATA4, un élément clé du développement. GATA4 est connu pour être un acteur crucial dans la régulation de gènes essentiels chez plusieurs organismes. Alors que son rôle et ses fonctions ont été largement étudiés et bien caractérisés dans la littérature, plusieurs questions restent en suspens quant aux mécanismes qui permettent une transcription adéquate du gène GATA4 dans un contexte sain. L’étude de ces mécanismes est une étape majeure vers la compréhension des différentes conséquences pathologiques qui découlent d’un défaut d’expression de ce gène.
1.1 Facteurs de transcription de la famille GATA
Les protéines GATA sont des facteurs de transcription à doigt de zinc qui participent aux processus développementaux et au maintien des fonctions de nombreux organes, incluant le cœur, l’intestin, le cerveau et les gonades, en plus d’être retrouvés dans le système hématopoïétique. Étant essentielles à de multiples fonctions biologiques, ces protéines ont été hautement conservées à travers l’évolution et sont retrouvées chez plusieurs espèces distinctes incluant la levure, les plantes, les champignons, les invertébrés ainsi que les vertébrés (Lowry and Atchley, 2000).
Chez les vertébrés, la famille des facteurs de transcription GATA comporte six membres, nommés GATA1 à GATA6, qui partagent un fort degré d’homologie dans leur domaine de liaison à l’ADN composé de deux doigts de zinc de type Cys-X2-Cys-X17-Cys-X2-Cys. Ces doigts de zinc sont encodés par différents exons. Cette structure
leur permet de se lier à leur séquence cible (A/T)GATA(A/G) dans la région promotrice de certains gènes requis pour la différenciation ou la morphogenèse afin d’en moduler leur expression au cours du développement et lors du stade adulte (revue dans Molkentin, 2000; Patient and McGhee, 2002; Zaytouni et al., 2011). Le doigt de zinc en C-terminal est hautement conservé entre les espèces et est indispensable à l’activité
4
transcriptionnelle du facteur par le fait qu’il permet la liaison spécifique à l’ADN. Celui en N-terminal pour sa part est beaucoup moins conservé. Il module les interactions protéines-protéines et augmente la spécificité et la stabilité de la liaison à l’ADN (Omichinski et al., 1993; Yang and Evans, 1992).
Certains partenaires modulent l’activité transcriptionnelle des facteurs GATA en agissant via des interactions protéines-protéines. Bien qu’une liste importante puisse être dénombrée, deux facteurs les plus importants pour l’activité des facteurs de transcription GATA sont les protéines Friend of GATA 1 (FOG1) et Friend of GATA 2 (FOG2), puisqu’ils agissent en tant que cofacteurs spécifiques des protéines GATA. Les protéines FOG ne peuvent se lier directement à l’ADN, mais elles possèdent des doigts de zinc leur permettant d’interagir avec le doigt de zinc en N-terminal des facteurs GATA (Tevosian et al., 1999; Tsang et al., 1997).
1.2 Rôles et fonction des facteurs GATA
Chacun des facteurs GATA est impliqué dans des processus physiologiques distincts lors du développement et de la fonction cellulaire. De façon générale, l’expression de ces facteurs au sein d’une cellule contribue à la maturation, la prolifération, la survie et la croissance cellulaire (Molkentin, 2000; Patient and McGhee, 2002). Leur expression est spécifique à différents tissus, bien que leurs profils d’activation se chevauchent parfois au sein d’un même tissu au cours du temps (Fujiwara et al., 2004). Les six membres de la famille GATA peuvent être divisés en deux groupes selon leur homologie de séquence et leur profil d’expression spatio-temporel, soit le groupe hématopoïétique composé des membres GATA1, 2 et 3 et le groupe cardiaque regroupant les facteurs GATA4, 5 et 6 qui sont principalement impliqués dans le développement des tissus dérivant du mésoderme et de l’endoderme. L’importance de ces facteurs dans le développement est mise en valeur par les différents modèles de souris invalidés pour les gènes GATA qui ont été générés, où la plupart démontrent un phénotype caractérisé par un arrêt précoce du développement et une létalité embryonnaire. De même, plusieurs mutations des gènes GATA chez l’humain ont été identifiées et sont responsables de diverses anomalies développementales et maladies.
5
Le rôle de ces facteurs dans la prolifération et la survie cellulaire révèle également un rôle soutenu de ces protéines dans divers processus tumoraux et cancers humains (revue dans Pihlajoki et al., 2016; Zheng and Blobel, 2010).
1.2.1 Expression et rôles du facteur GATA1
GATA1 est le premier membre de la famille GATA à avoir été identifié.Il est exprimé majoritairement dans la lignée hématopoïétique où il exerce des fonctions essentielles dans les processus de différenciation des cellules érythroides, des mégakaryocytes, des mastocytes ainsi que des éosinophiles (revue dans Kobayashi and Yamamoto, 2007; Weiss and Orkin, 1995). L’invalidation du gène Gata1 chez la souris au stade embryonnaire entraîne une perte complète de la production des précurseurs des cellules de la lignée érythroïde, résultant ainsi en une anémie sévère et une mort embryonnaire aux stades E10,5 et E11,5 (Fujiwara et al., 1996). Outre le système hématopoïétique,
Gata1 est également exprimé dans les cellules de Sertoli du testicule postnatal où son
expression est dépendante du stade de la spermatogenèse (Ito et al., 1993; Wakabayashi et al., 2003; Yomogida et al., 1994). Toutefois, bien que plusieurs études in vitro aient démontré un rôle potentiel du facteur dans la régulation de l’activité des promoteurs de certains gènes testiculaires, l’invalidation de Gata1 spécifiquement dans les cellules de Sertoli chez la souris ne démontre aucun phénotype aberrant, révélant ainsi que le gène
Gata1 seul n’est pas essentiel à la fonction de ces cellules (Beau et al., 2000; Feng et
al., 1998; Lindeboom et al., 2003). L'absence de phénotype pourrait toutefois s'expliquer par d’autres membres de la famille GATA, soit GATA4 et GATA6, qui sont présents également dans la cellule de Sertoli et qui peuvent agir en tant que mécanisme de compensation.
Chez l’humain, certains désordres développementaux ont été associés à des mutations ou des pertes de fonction du facteur GATA1 (revue dans Crispino and Weiss, 2014). Un cas important consiste en la mutation du résidu valine 205 pour une méthionine, laquelle est requise pour l’interaction avec le cofacteur FOG-1. (Nichols et al., 2000). Cette substitution résulte en une anémie dysérythropoïétique reliée au chromosome X en plus d’une thrombocytopénie sévère à la naissance.
6
1.2.2 Expression et rôles du facteur GATA2
À l’instar du facteur GATA1, GATA2 est également retrouvé en abondance dans les cellules progénitrices hématopoïétiques et dans les érythrocytes, où son niveau décroît avec l'augmentation des niveaux de GATA1 (Ohneda et Yamamoto, 2002). Cette transition de l’expression de GATA2 vers l’expression de GATA1 au cours du temps permet de réguler finement l’expression des gènes exprimés précocement et tardivement à chaque stade de la différenciation des cellules érythroïdes (Bresnick et al., 2010). Les modèles de souris invalidés pour le gène Gata2 présentent des phénotypes similaires aux souris invalidées pour Gata1, le phénotype étant caractérisé par une anémie sévère et une mort embryonnaire précoce (Tsai et al., 1994). Outre son rôle dans le système hématopoïétique, GATA2 est également impliqué dans le développement de l’oreille interne, les neurones GABAergique, la différenciation des adipocytes et des cellules endothéliales cardiaques (Kala et al., 2009; Lillevali et al., 2007; Okitsu et al., 2007; Perez-Stable et al., 2000; Wozniak et al., 2007). Des expériences de sauvetage du gène Gata2 chez des souris invalidées ont été réalisées par insertion d’un YAC de 250 kpb de la séquence de Gata2. Cette étude a démontré un rôle du gène dans le système urogénital, notamment pour les canaux de Wolff et le métanéphros (Zhou et al., 1998). Dans le système reproducteur, GATA2 est le seul facteur à être retrouvé dans les cellules germinales ovariennes où il est exprimé de façon restreinte au stade fœtal entre les stades E11,5 et E14,5. (Siggers et al., 2002)
Certains syndromes cliniques reliés à des mutations du gène GATA2 chez l’humain ont été répertoriés, notamment des cas de monocytopénie, d’infection mycobactérienne, de déficiences en cellules dendritiques et monocytes B, de neutropénie pédiatrique, d’anémie, ou encore des cas d’immunodéficience (revue dans Spinner et al., 2014).
1.2.3 Expression et rôles du facteur GATA3
Au cours du développement embryonnaire, la présence de GATA3 et décelée dans une multitude de tissus incluant le placenta, les glandes surrénales, le foie, le thymus, ainsi que le système nerveux central et périphérique. Ce profil d’expression décroit toutefois avec le temps, se limitant ainsi aux lymphocytes T et au système nerveux central chez l’adulte (George et al., 1997). Chez la souris, une délétion du gène Gata3 entraîne une
7
létalité précoce, soit vers le stade fœtal E11,5, en raison d’un retard développemental, d’une déficience en noradrénaline et de sévères aberrations de l’hématopoïèse dans le foie primitif. (Pandolfi et al., 1995).
Chez l’humain, le syndrome HDR est une maladie héréditaire caractérisée par une hypoparathyroïdie, une surdité neurosensorielle et une dysplasie rénale. Dans la majorité des cas, l’anomalie génétique est due à une insuffisance ou des mutations du facteur GATA3 (Ali et al., 2007).
1.2.4 Expression et rôles du facteur GATA4
L’expression du gène Gata4 chez la souris débute juste avant la gastrulation. Les souris invalidées pour Gata4 meurent in utero au stade E10,5, résultat d’un défaut dans la morphogenèse ventrale et la formation du tube cardiaque (Kuo et al., 1997; Molkentin et al., 1997).
Les mutations du gène GATA4 chez l’humain sont reliées à divers phénotypes, notamment des problèmes cardiaques congénitaux, une hernie diaphragmatique congénitale, du diabète et des désordres du développement testiculaire (Lourenco et al., 2011; Prendiville et al., 2014; Shaw-Smith et al., 2014; Yu et al., 2013). Les fonctions du gène GATA4 dans le développement et ses mécanismes de régulation seront détaillés à la section 1.3.
1.2.5 Expression et rôles du facteur GATA5
Le facteur GATA5 est retrouvé dans le cœur, le poumon en formation, l’allantoïde, la crête urogénitale, la vessie et l’épithélium intestinal. Les transcrits de Gata5 sont initialement détectés dans le mésoderme précardiaque vers E7-7,5, puis dans le tube cardiaque à E8. Cette expression devient par la suite limitée aux cellules de l’endocarde vers E12,5 (Molkentin, 2000; Morrisey et al., 1997).
Contrairement aux autres membres de la famille GATA, l’invalidation du gène Gata5 chez la souris n’est pas liée à un arrêt développemental causant la mort au stade embryonnaire. Une première étude invalidant un seul isoforme de la protéine a révélé que les souris demeurent viables, bien que les femelles démontrent de sévères
8
anormalités dans leur tractus génital menant à une sous-fertilité (Molkentin et al., 2000). En comparaison, une étude invalidant la totalité des isoformes de la protéine GATA5 démontre plusieurs anomalies cardiaques, incluant des dysfonctions endothéliales, de l’hypertension et une bicuspidie valvulaire aortique (Laforest et al., 2011). Ce modèle a également permis de confirmer le rôle du facteur dans la régulation de la pression sanguine et l’hypertension (Messaoudi et al., 2015).
Une grande variété d’anomalies cardiaques congénitales ont été répertoriées en lien avec des mutations ou des pertes de fonction du gène GATA5 chez l’humain. Parmi celles-ci, on retrouve notamment des risques de tétralogie de Fallot, de ventricule droit à double issue, de sténose aortique, de bicuspidie valvulaire aortique ainsi que des défauts dans la communication interauriculaire et interventriculaire (Jiang et al., 2013; Padang et al., 2012; Shi et al., 2014; Wang et al., 2013; Wei et al., 2013a; Wei et al., 2013b; Yang et al., 2012).
1.2.6 Expression et rôles du facteur GATA6
De tous les facteurs GATA, GATA6 est celui dont le profil d’expression et les fonctions sont les plus similaires à ceux de GATA4. Il est notamment retrouvé dans les tissus dérivés du mésoderme latéral, incluant le cœur, l’intestin et les gonades (Molkentin, 2000). Son expression est également essentielle au développement de l’endoderme viscéral puisqu’une absence de GATA6 cause une létalité embryonnaire due à un défaut dans la différenciation de l’endoderme et des tissus extraembryonnaires. (Koutsourakis et al., 1999; Morrisey et al., 1998). La similarité des fonctions entre les deux facteurs a récemment été étudiée dans un modèle in vivo. L’étude visait à vérifier si le facteur GATA6 était suffisant pour réchapper le phénotype létal obtenu par l’absence de GATA4 en remplaçant le locus du gène Gata4 par la séquence du gène Gata6. Ce modèle a permis de démontrer un rétablissement partiel du développement dans les tissus extraembryonnaires (Borok et al., 2016).
Dans les gonades mâles, l’expression de GATA6 chevauche partiellement l’expression de GATA4 dans les cellules de Sertoli au cours du développement fœtal et postnatal. Le facteur est également retrouvé dans les cellules germinales et les cellules lutéales des gonades chez la femelle (Lavoie et al., 2004a). Le facteur est requis pour
9
l’expression de certains gènes stéroïdogéniques, en plus de jouer un rôle important dans le maintien de la fertilité (Ketola et al., 1999; Padua et al., 2015).
Chez l’adulte, GATA6 est retrouvé dans le tractus génital, la vessie, le pancréas, les poumons et le cœur. Cette expression est en concordance avec certains syndromes cliniques rapportés chez des individus ayant des variantes du gène. On retrouve entre autres des cas de défauts cardiaques congénitaux, d’agénésie pancréatique, de diabète, d’anomalies du tractus biliaire et d’hernie diaphragmatique congénitale (Bonnefond et al., 2012; Lango Allen et al., 2012; Maitra et al., 2010; Prendiville et al., 2014; Yu et al., 2014).
1.3 Expression et fonction de GATA4 dans le développement des
tissus dérivant du mésoderme et de l’endoderme
À la fin de la gastrulation, les trois feuillets embryonnaires se différencient afin de former les différents tissus de l’organisme. D’une part, l’endoderme non différencié se spécialise en trois régions distinctes selon l’axe antéro-postérieur, soit l’intestin antérieur, qui est le précurseur de l’œsophage, la trachée, les poumons, l’estomac, le foie et le pancréas, ainsi que les intestins moyens et postérieurs qui vont devenir respectivement l’intestin grêle et le colon (Guiu and Jensen, 2015; Kim and Ong, 2012). L’ectoderme pour sa part donne naissance principalement au système nerveux et à l’épiderme de la peau. Enfin, le feuillet mésodermique se différencie pour former le reste des organes internes, incluant les reins, le cœur et les gonades en plus des tissus conjonctifs et musculaires (Kiecker et al., 2016). Cette régionalisation est dépendante de l’action concertée de différents facteurs de transcription et de molécules de signalisation tout au long du développement.
Les facteurs GATA sont des régulateurs cruciaux de différents processus biologiques du développement. L’invalidation du gène Gata4 chez la souris résulte en une létalité embryonnaire précoce en raison d’un défaut de l’endoderme extraembryonnaire (Narita et al., 1997). Cette insuffisance conduit ensuite à un problème de morphogenèse ventrale et de formation du tube cardiaque (Kuo et al., 1997; Molkentin et al., 1997). Afin d’outrepasser cette limitation et d’étudier le rôle de ce facteur dans la
10
différenciation et le développement précoce de certains organes, des expériences de complémentation tétraploïde d’embryon ont été réalisées (Duncan, 2005). Cette technique permet ainsi de générer des embryons à partir de cellules souches embryonnaires génétiquement modifiées avec un endoderme extraembryonnaire normal. En parallèle à des études in vitro et des souris invalidées conditionnellement, plusieurs rôles de GATA4 dans la morphogenèse de divers organes dérivant de l’endoderme et du mésoderme ont été démontrés par cette approche.
1.3.1 Intestin
Le facteur GATA4 est exprimé abondamment dans la partie proximale de l’intestin grêle, incluant le duodénum et le jéjunum, alors qu’il est absent de l’iléon distal et du colon (Haveri et al., 2008; Molkentin, 2000). Ce profil d’expression est étroitement lié avec les fonctions qu’occupent GATA4 au sein de l’intestin. En effet, plusieurs études ont confirmé le rôle du facteur dans le maintien des fonctions du jéjunum par rapport à l’iléon. Par exemple, dans un contexte sain, il semble que l’expression de GATA4 dans la partie proximale réprime l’expression de certains gènes spécifiques à l’iléon en inhibant l’acétylation de la lysine 27 de l’histone H3 (H3K27) (Aronson et al., 2014). Également, une invalidation conditionnelle de Gata4 dans la partie proximale intestinale a démontré une diminution de l’expression de certains gènes spécifiques au jéjunum, en comparaison avec une augmentation de l’expression de certains gènes spécifiques à l’iléon, suggérant ainsi une transition de l’identité cellulaire causée par la perte de Gata4 (Bosse et al., 2006; Walker et al., 2014). De plus, cette perte entraîne des conséquences importantes sur le métabolisme des lipides et du cholestérol, résultant en un défaut d’absorption (Battle et al., 2008; Patankar et al., 2011). Ces études abondent dans le même sens en ce qui a trait au fait que GATA4 active et réprime l’expression de certains gènes dans la partie proximale de l’intestin afin de permettre une régionalisation et de maintenir des fonctions biologiques distinctes.
Des invalidations conditionnelles du gène utilisant une recombinase cre exprimée sous le contrôle des séquences régulatrices de villin n’ont démontré aucun phénotype majeur quant à la différenciation ou la prolifération des cellules intestinales (Battle et al., 2008; Bosse et al., 2006). Toutefois, un modèle d’invalidation conditionnelle pour le gène
11
Gata4 dans l’intestin embryonnaire moyen a récemment été développé en utilisant une
recombinase cre active au moment de l’expression du gène Sonic Hedgehog (Kohlnhofer et al., 2016). Ils ont ainsi remarqué une diminution de la longueur intestinale ainsi que du nombre de cellules prolifératives vers les stades E10,5 et E11,5. Ces changements corrélaient également avec un retard de la morphogenèse des villosités, révélant ainsi que GATA4 est essentiel aux stades précoces du développement intestinal.
1.3.2 Foie
Chez la souris, vers le 8e jour embryonnaire (E8), certaines cellules endodermiques de l’intestin antérieur ventral de l’embryon se différencient pour devenir le parenchyme du foie et du pancréas (Deutsch et al., 2001; Tremblay and Zaret, 2005). Les cellules principales du foie, appelées hépatocytes, se différencient ensuite vers le stade E9. Le facteur GATA4 est retrouvé abondamment dans les hépatocytes aux stades fœtaux et adultes et est requis pour l’expression de certains gènes dont les fonctions sont spécifiques au foie (Dame et al., 2004; Island et al., 2011; Zheng et al., 2013). Par exemple, au moment de la différenciation hépatique, les facteurs GATA4 et HNF3/FOXA agissent de concert afin d’augmenter la transcription des gènes par leur liaison spécifique à certaines cibles tels qu’un enhancer du gène codant l’albumine, les gènes ABCG5 et ABCG8 codant pour des transporteurs de stérol ou le promoteur du gène Hex (Bossard and Zaret, 1998; Denson et al., 2000; Sumi et al., 2007). Il a également été démontré que GATA4 et HNF3/FOXA agissent en tant que facteurs de transcription pionniers, lesquels peuvent recruter des remodeleurs de la chromatine qui repositionnent les nucléosomes afin d’ouvrir la chromatine compactée, permettant ainsi la liaison à d’autres facteurs de transcription (Cirillo et al., 2002).
Des études d’invalidation par complémentation tétraploïde de cellules souches embryonnaires invalidées pour le gène Gata4 (ES Gata4 -/-) ont également suggéré un
rôle du gène dans l’expansion du foie (Watt et al., 2007). Toutefois, il semble que ce phénotype soit lié davantage à une perte du gène dans le mésenchyme du septum transversum et non dans le foie (Delgado et al., 2014). Il a été proposé que GATA4
12
contrôle certains signaux paracrines provenant du mésenchyme, affectant ainsi la croissance de l’endoderme hépatique.
Bien que GATA4 soit connu pour réguler l’expression de plusieurs gènes hépatiques, une délétion spécifiquement dans les hépatocytes au stade adulte ne semble pas affecter les fonctions de ceux-ci (Zheng et al., 2013). Les auteurs de l’étude ont souligné le rôle potentiel de GATA6 en tant que facteur de compensation pour expliquer le phénotype observé. Étonnamment, une double délétion de ces deux gènes, Gata4 et Gata6, n’affecte que minimalement l’expression des gènes et les fonctions du foie.
1.3.3 Pancréas
Lors du développement embryonnaire, le pancréas est formé par la fusion des bourgeons ventraux et dorsaux de l’intestin primitif antérieur de l’endoderme vers les stades E8,75 à E9,5. Celui-ci subit ensuite une phase proliférative vers les stades E11,5 à E15,5 (revue dans Pan and Wright, 2011).
L’expression de GATA4 est spécifique aux cellules pancréatiques exocrines, incluant les cellules acineuses, alors que GATA6 est préférentiellement exprimé dans les cellules endocrines (Decker et al., 2006; Ketola et al., 2004). Des embryons mutants
Gata4-/- générés par complémentation tétraploïde ont révélé un rôle essentiel de GATA4 dans les étapes précoces de la formation du bourgeon pancréatique ventral (Watt et al., 2007). Toutefois, des souris transgéniques exprimant le domaine de répression de la protéine Engrailed fusionné à Gata4 ne démontrent aucun phénotype sévère quant au développement pancréatique suggérant ainsi un rôle non essentiel du facteur dans la spécification pancréatique (Decker et al., 2006). Des résultats similaires ont été obtenus par le biais d’un autre modèle d’invalidation (Carrasco et al., 2012). Tel qu’attendu, la délétion simultanée des deux gènes, soit Gata4 et Gata6, entraîne des défauts majeurs quant à la prolifération, la morphogenèse ainsi que la différenciation des cellules pancréatiques (Carrasco et al., 2012; Xuan et al., 2012).
Tout comme dans l’intestin, Gata4 participe également au maintien de l’identité et des fonctions pancréatiques. En effet, une invalidation du gène au moment de l’expression de PDX1, un facteur de transcription essentiel au développement pancréatique,
13
démontre un arrêt du développement accompagné d’une transition du pancréas ventral et dorsal en des cellules dérivées de l’intestin et de l’estomac (Xuan and Sussel, 2016). Enfin, certaines évidences ont également démontré un rôle du facteur dans la régulation des cellules productrices de glucagon (Ritz-Laser et al., 2005).
1.3.4 Estomac
L’épithélium de l’estomac est régionalisé selon un axe proximal distal durant le développement, ce qui permet des régions fonctionnelles distinctes (revue dans Kim and Shivdasani, 2016)). La partie proximale est définie par un épithélium squameux facilitant la digestion mécanique, alors que la partie distale comprend des invaginations de la muqueuse qui contribuent à la sécrétion des enzymes et des hormones digestives. Ces invaginations, appelées fossettes gastriques, comprennent différents types cellulaires, soit les cellules mucosécrétantes qui recouvrent la surface et les cryptes, les cellules pariétales qui composent la paroi des glandes gastriques et qui sécrètent l’acide chlorhydrique, ainsi que les cellules principales qui élaborent la pepsine, une enzyme digestive.
Les premières évidences du rôle de GATA4 dans le développement gastrique proviennent d’études de transactivation et de retard sur gel (EMSA). Ces études ont démontré un rôle potentiel du facteur dans la régulation de l’expression de certains gènes des cellules pariétales et mucosécrétantes (Nishi et al., 1997; Tamura et al., 1994). Ces données ont été renforcées par des expériences de souris chimériques déficientes en GATA4, lesquelles présentaient des défauts dans la différenciation des cellules épithéliales glandulaires de l’estomac (Jacobsen et al., 2002). Ce groupe de recherche a également démontré un rôle essentiel de l’interaction de GATA4 et de son cofacteur FOG-1 dans le développement précoce de l’épithélium gastrique (Jacobsen et al., 2005).
1.3.5 Coeur
Le cœur est le premier organe à devenir fonctionnel au cours du développement embryonnaire. Le développement cardiaque chez les mammifères s’effectue en quatre étapes majeures, débutant par la différenciation des cellules progénitrices du myocarde et de l’endocarde provenant du mésoderme latéral au stade E7,5 (Evans et al., 2010;
14
McCulley and Black, 2012). Vers le stade E8,5 chez la souris, les cellules se condensent et migrent afin de former le tube linéaire cardiaque (Harvey, 2002). Cette structure subit ensuite un repliement, suivi de la formation de l’endocarde vers E10-E12 (Person et al., 2005). La dernière étape majeure consiste en la septation, soit la formation des quatre chambres cardiaques vers les stades E14-E18 (McCulley and Black, 2012).
Une multitude de facteurs, incluant la protéine à homéodomaine NKX2-5, les facteurs GATA4/5/6, le facteur MEF2 et certains facteurs T-box, agissent de concert afin de réguler adéquatement les différentes étapes précoces du développement cardiaque (Greulich et al., 2011; Harvey et al., 2002; He et al., 2011; Lints et al., 1993; Peterkin et al., 2005). Parmi ceux-ci, GATA4 est l’un des facteurs de transcription à être retrouvé le plus précocement dans les cellules précurseurs cardiaques où il contrôle le développement embryonnaire et la différenciation des cardiomyocytes (Heikinheimo et al., 1994). Les transcrits de Gata4 peuvent être détectés dans le mésoderme précardiaque vers E7,0-7,5 et cette présence des transcrits continue au moment de la formation du tube cardiaque vers E8 dans l’endocarde et le myocarde. GATA4 agit en tant que régulateur transcriptionnel de plusieurs gènes cardiaques incluant ANF, BNP,
αMHC et βMHC tout au long du développement (Pikkarainen et al., 2004; Wang et al.,
1998).
Une série de délétions conditionnelles du gène Gata4 ont été effectuées afin d’outrepasser la létalité précoce d’une invalidation et d’étudier son rôle dans le développement cardiaque. Les premières études proviennent de souris génétiquement modifiées ayant une substitution d’un acide aminé empêchant l’interaction de GATA4 avec son cofacteur FOG-2. Les souris meurent vers le stade E12,5 de défauts cardiaques, démontrant ainsi un rôle majeur du facteur GATA4 dans le développement vasculaire (Crispino et al., 2001). Ces résultats ont été renforcés par différents modèles de souris utilisant une approche Cre-lox invalidant le gène au moment de l’expression de Nkx2-5, Tie2, αMHC, βMHC et Mef2c. Les phénotypes retrouvés sont tous associés à des défauts cardiaques, incluant une hypoplasie du ventricule droit, un amincissement du myocarde, une diminution de la prolifération des myocytes cardiaques et un défaut
15
de communication interventriculaire (Oka et al., 2006; Rivera-Feliciano et al., 2006; Rojas et al., 2008; Zeisberg et al., 2005).
1.3.6 Surrénales
Les surrénales comprennent le cortex surrénalien et la médulla, dérivant tous deux d’origines embryonnaires distinctes et impliqués dans la synthèse et la sécrétion des glucocorticoïdes et des minéralocorticoïdes. Au cours du développement embryonnaire, le cortex surrénalien et les gonades, pour leur part, dérivent tous deux de la même origine embryonnaire vers le stade E9,5. Cette origine commune explique pourquoi GATA4 et GATA6 sont coexprimés dans le cortex surrénalien au stade fœtal. Toutefois, après la naissance, l’expression de GATA4 diminue, alors que celle de
GATA6 est maintenue tout au long du développement et de la vie adulte (Kiiveri et al.,
2002). L’étude a également démontré que GATA4 ne semble pas être essentiel au développement précoce des surrénales.
Une analyse des souris invalidées pour GATA4 et GATA6 démontrent une aplasie des surrénales (Padua et al., 2015; Tevosian et al., 2015). Étonnamment, les souris femelles meurent peu après la naissance d’une insuffisance surrénalienne alors que les souris mâles survivent grâce à une compensation par le testicule. De ce fait, ces études ont démontré un rôle majeur des facteurs GATA4 et GATA6 dans le maintien de l’identité des cellules stéroïdogéniques dans les surrénales et les gonades.
1.3.7 Ovaire
Le facteur GATA4 est essentiel au développement et à la fonction ovarienne chez les mammifères, incluant un rôle dans la folliculogenèse et la fertilité. L’expression de
Gata4 débute dans les cellules somatiques au stade E10,5. Au stade postnatal, la
présence de GATA4 corrèle avec les cellules de la granulosa en mitose et en prolifération, alors que ses niveaux diminuent au niveau postnatal dans les cellules lutéales du corpus luteum (Anttonen et al., 2003). La gonadotropine FSH, connue pour son rôle dans la croissance folliculaire, augmente l’expression et l’activité de GATA4 dans les cellules de la granulosa (Kwintkiewicz et al., 2007).
16
Une haploinsuffisance du gène causée par des souris hétérozygotes Gata4+/- démontre
une baisse des niveaux de l’ARN messager de Cyp19, un gène codant pour une enzyme clée de la biosynthèse des estrogènes, en plus d’une diminution de la réponse aux gonadotropines. Ces changements provoquent un retard de puberté, bien que les souris demeurent fertiles (Kyronlahti et al., 2011b). Une invalidation conditionnelle du gène, générée à l’aide de souris Sf1Cre; Gata4flox/flox, résulte pour sa part en une infertilité. Ces souris présentent des ovaires plus petits que la normale, ainsi qu’un nombre réduit de follicules, démontrant ainsi un rôle essentiel de GATA4 dans la différenciation et le développement ovarien au stade postnatal (Efimenko et al., 2013). Des résultats similaires ont été obtenus au stade adulte chez des modèles de souris possédant des systèmes d’invalidation conditionnels utilisant les souris Cyp19- et la Amhr2-Cre (Bennett et al., 2012; Kyronlahti et al., 2011b).
Tel que décrit pour les autres organes, une double délétion des gènes Gata4 et Gata6 chez la souris entraîne des phénotypes importants altérant les fonctions ovariennes. Chez le fœtus, la perte simultanée des deux gènes mène à une diminution de l’expression de certains gènes reliés au développement ovarien (Fst et Irx) ainsi qu’une diminution des niveaux de certains marqueurs des cellules de la granulosa tels que FOXL2 et SPRR2 (Padua et al., 2014). Ces souris présentent un arrêt de la folliculogenèse tôt dans le développement. Au stade adulte, l’invalidation simultanée de Gata4 et Gata6 entraîne une infertilité en raison d’une perte d’ovulation. On retrouve une augmentation des gonadotropines FSH et LH ainsi qu’une diminution de l’estradiol (Bennett et al., 2012). Des résultats complémentaires par micropuces ont également confirmé le rôle combiné de ces facteurs dans les processus de stéroïdogenèse et de la différenciation des cellules germinales, en plus de l’apoptose, l’adhésion cellulaire et le maintien de la matrice extracellulaire (Bennett et al., 2013). Les résultats ont également démontré que le facteur GATA6 agit en tant que facteur compensateur lors de la perte de GATA4.
1.3.8 Testicule
Durant le développement testiculaire fœtal, Gata4 est fortement exprimé dans les cellules pré-Sertoli, les cellules de Sertoli, les cellules de Leydig fœtales et les cellules
17
myoïdes péritubulaires. Cette expression se limite ensuite aux cellules de Sertoli et aux cellules de Leydig à l’âge adulte. Plusieurs études ont démontré un rôle de GATA4 dans la régulation de l’expression de gènes cibles testiculaires associés à la différenciation sexuelle, à la production d’hormones peptidiques, à la voie de signalisation des gonadotropines, à la synthèse d’hormones stéroïdiennes et aux interactions cellules-cellules. Ces fonctions seront détaillées davantage à la prochaine section.
1.4 Rôle de GATA4 dans les gonades chez le mâle
1.4.1 Détermination du sexe et différenciation sexuelle
La détermination du sexe et la différenciation sexuelle chez un individu consistent en une série d’étapes coordonnées allant de l’acquisition du sexe chromosomique (XX ou XY), au développement des gonades (testicule ou ovaire), puis au développement des organes génitaux internes et externes appelé sexe phénotypique (revue dans Bachtrog et al., 2014; Lucas-Herald and Bashamboo, 2014).
La différenciation gonadique débute par la formation de la crête génitale, une structure sexuellement indifférenciée, localisée sur la surface ventrale du mésonéphros. La formation de la crête génitale est amorcée par la prolifération des cellules de l’épithélium cœlomique et l’épaississement du mésenchyme sous-jacent vers le stade E10,5 chez la souris (revue dans Tanaka and Nishinakamura, 2014). Un rôle important du facteur GATA4 dans ces étapes précoces de développement a récemment été démontré via un système d’invalidation du gène Gata4 par une recombinase cre inductible par tamoxifène. L’étude a en effet révélé que GATA4 est le marqueur génétique le plus précoce de la gonadogenèse, en plus d’être essentiel à l’initiation de la formation de la crête génitale (Hu et al., 2013). Les étapes subséquentes menant au développement intégral de la crête génitale sont dépendantes de l’expression de plusieurs gènes clés dont Wt1, Lhx9, Sf-1/Nr5a1 et Emx2 (Birk et al., 2000; Kreidberg et al., 1993; Kusaka et al., 2010; Luo et al., 1994; Miyamoto et al., 1997). Des modèles de souris invalidées génétiquement pour chacun de ces gènes ont tous démontré une régression de la crête génitale à la suite de l’initiation de sa formation, confirmant ainsi
18
leur rôle essentiel. À ce stade développemental, les cellules somatiques de la crête génitale sont bipotentielles, c’est-à-dire qu’elles peuvent adopter des caractéristiques mâles ou femelles selon les signaux environnants. Ces cellules donneront ainsi naissance aux cellules de soutien et aux cellules stéroïdogéniques, respectivement appelées les cellules de Sertoli et les cellules de Leydig dans le testicule ainsi que les cellules de la granulosa et de la thèque dans l’ovaire (revue dans Wilhelm et al., 2007). Chez la plupart des mammifères, la détermination sexuelle est contrôlée par la présence ou l’absence de l’expression de SRY, un gène retrouvé sur le chromosome Y. Le gène
SRY est exprimé dans une fenêtre restreinte au moment de la différenciation sexuelle
(Hiramatsu et al., 2009). Les transcrits de ce gène sont présents transitoirement chez la souris : l’expression de Sry débute au stade E10,5, devient maximale à E11,5 et diminuent progressivement jusqu’à E12,5. SRY régule directement l’expression d’un autre gène clé, Sox9, déclenchant ainsi la différenciation des cellules de pré-Sertoli en cellules de Sertoli et la différenciation vers l’appareil reproducteur mâle (Jakob and Lovell-Badge, 2011). Un retard d’expression de Sry mène à une mauvaise différenciation de ces cellules et à un défaut de formation testiculaire (Bullejos and Koopman, 2001; Hiramatsu et al., 2009). De même, les souris Sox9-/- présentent des
anomalies développementales, incluant une expression aberrante des marqueurs des cellules de Sertoli et des défauts dans l’organisation des cordons et des vaisseaux sanguins du testicule (Kobayashi et al., 2005). À la suite de l’action de ces facteurs, les cellules de Sertoli s’agrègent autour des cellules germinales et favorisent la formation des cordons testiculaires qui deviendront les tubules séminifères à l’âge adulte. Les cellules de Leydig fœtales, pour leur part, se différencient vers le stade E12,5 (revue dans Wen et al., 2016). L’acquisition des caractères sexuels masculins est sous l’influence d’hormones. Chez l’embryon mâle, les cellules de Leydig fœtales produisent la testostérone, permettant aux canaux de Wolff de subsister et de donner naissance aux canaux efférents, à l’épididyme, aux canaux déférents et aux vésicules séminales. L’hormone AMH sécrétée par les cellules de Sertoli induit la régression des canaux de Muller, lesquels sont les précurseurs des trompes de Fallope, de l’utérus et de la partie supérieure du vagin.
19
GATA4 est le seul facteur GATA à être exprimé dans la gonade bipotentielle avant la détermination sexuelle (Hu et al., 2013). Il est abondamment exprimé dans les cellules somatiques de la crête génitale en développement vers les stades E10,5-E11,5, puis son expression devient dimorphique vers le stade E13,5. Certaines études ont démontré que l’expression de Sry est dépendante de la présence du facteur GATA4. En effet, une invalidation du gène Gata4 au stade E10,5, c’est-à-dire au moment de l’expression de
Sry, résulte en une réversion de sexe, révélant ainsi l’importance du facteur dans les
étapes précoces de la détermination sexuelle masculine (Manuylov et al., 2011). Plusieurs autres modèles de souris invalidées conditionnellement pour le gène Gata4 ont été générés et sont en lien avec des défauts du développement gonadique (revue dans Tevosian, 2014). En effet, tel que mentionné plus tôt, GATA4 interagit avec son cofacteur FOG2 afin de permettre le développement adéquat du testicule. Un modèle de souris présentant une substitution d’un acide aminé de la protéine GATA4 qui empêche cette interaction a été généré. Ces souris présentent une diminution de l’expression du gène Sry et de certains gènes cruciaux pour le développement et/ou fonctionnement normal des cellules de Sertoli et de Leydig tel qu’Amh, Dhh, Sox9,
Cyp11a1, 3βHsd et Cyp17a1. Ces changements provoquent une mauvaise
différenciation des cellules de Sertoli ainsi qu’une réversion de sexe (Tevosian et al., 2002). Afin d’étudier plus en profondeur le rôle de GATA4 au moment de la détermination sexuelle, des invalidations conditionnelles du gène ont été effectuées à différents moments du développement embryonnaire. Par exemple, une perte de GATA4 spécifiquement dans les cellules de Sertoli à 10,5 jours de développement chez des souris Gata4flap/flap;Wt1CreERT2 démontre un blocage de la différenciation testiculaire et une réversion de sexe mâle-femelle (Manuylov et al., 2011). Cette réversion de sexe est le résultat d’une diminution de l’expression de certains marqueurs spécifiques mâles tels que SOX9 et 3βHSD ainsi qu’une augmentation de FOXL2, un marqueur de la différenciation ovarienne. De façon remarquable, une invalidation du gène plus tardivement, soit au stade E12,5 par un modèle de souris Sf1Cre;Gata4flox/flox, résulte en des phénotypes différents (Manuylov et al., 2011). En effet, aucune réversion de sexe n’a été identifiée. Ce groupe de recherche a cependant démontré que les souris présentent un arrêt du développement testiculaire précoce caractérisé par une absence
20
de la formation des cordons testiculaires et la perte de l’expression du gène Dmrt1 dans les cellules de Sertoli (Manuylov et al., 2011).
1.4.2 Fonctions de GATA4 dans les cellules de Sertoli et de Leydig
Les cellules de Sertoli ont un rôle de soutien dans le testicule par leur action favorisant la croissance et la maturation des cellules germinales. Elles sécrètent des facteurs de croissance et des chimiokines afin de promouvoir le renouvellement et le maintien des cellules souches spermatogoniales. Le passage des cellules germinales de la membrane basale à la membrane apicale est favorisé par l’entremise de la barrière hémato-testiculaire. Les cellules de Leydig, pour leur part, sont localisées dans l’interstice du testicule et sont responsables de la sécrétion de la testostérone. Elles sont ainsi impliquées dans le contrôle du développement et du maintien des caractères sexuels primaires et secondaires masculins (revue dans Piprek et al., 2016).
Le rôle de GATA4 dans les cellules de Sertoli a récemment été étudié par des expériences de siARN dans un modèle de lignée cellulaire (Schrade et al., 2016). L’inhibition de l’expression de Gata4 a révélé un rôle marqué du facteur GATA4 dans la régulation des fonctions de la barrière hémato-testiculaire. En effet, l’expression de nombreux gènes impliqués dans les jonctions adhérentes, l’organisation de la structure extracellulaire et l’adhésion focale étaient dérégulés suite à la perte de l’expression de
Gata4. Les expériences ont également démontré des changements significatifs de
l’expression de gènes impliqués dans les cascades de signalisation contrôlant le métabolisme du lactate. De même, in vivo, une invalidation de Gata4 spécifiquement dans les cellules de Sertoli a également démontré son rôle dans les fonctions de ces cellules (Chen et al., 2015). Les chercheurs ont suggéré que GATA4 régule certaines chimiokines impliquées dans l’établissement et la maintenance des cellules souches spermatogoniales. L’invalidation du gène entraîne une perte complète des cellules germinales dès la première vague de la spermatogenèse menant ainsi à une infertilité. De façon remarquable, ce phénotype peut être sauvé par une transplantation de cellules germinales directement dans les tubules séminifères, ouvrant ainsi la voie à d’éventuelles applications cliniques. Un autre groupe a également démontré un rôle de GATA4 dans les cellules de Sertoli in vivo par une invalidation conditionnelle du gène
21
au moment de l’expression d’Amhr2 (Kyronlahti et al., 2011a). Ces souris présentent un phénotype d’infertilité dépendante de l’âge, ainsi qu’une atrophie testiculaire et une vacuolisation des tubules séminifères.
GATA4 est également un régulateur crucial des fonctions des cellules de Leydig tel que la stéroïdogenèse. Les premières évidences proviennent d’études in vitro démontrant que GATA4 cible directement plusieurs régions promotrices de certains gènes impliqués dans les fonctions stéroïdogéniques, incluant Star, Cyp19a1, Cyp11a1 et Hsd3b2 (Tremblay and Viger, 2003a; Viger et al., 2008). Ces résultats ont récemment été validés par des expériences de siARN pour diminuer l’expression du gène Gata4 dans des cellules de Leydig en cultures. Des expériences par biopuces ont démontré plusieurs gènes cibles de GATA4, dont la plupart sont impliqués dans diverses fonctions stéroïdogéniques essentielles (Bergeron et al., 2015). Parmi les autres fonctions des gènes cibles de GATA4 identifiées dans les cellules de Leydig, on retrouve entre autres la sécrétion d’hormones peptidiques ainsi que la régulation du métabolisme du cholestérol. De façon similaire, une étude du même type réalisée par une autre équipe a identifié les mêmes fonctions dépendantes de GATA4 en plus de souligner son rôle dans la viabilité cellulaire et dans les processus métaboliques tel que la glycolyse (Schrade et al., 2015).
GATA4 n’est pas le seul facteur à être impliqué dans la régulation de la stéroïdogenèse. En effet, durant le développement embryonnaire murin, Gata4 et Gata6 sont coexprimés dans les cellules du cortex surrénalien, dans les cellules de Sertoli et les cellules de Leydig. Après la naissance, l’expression de Gata6 persiste dans le cortex surrénalien et le testicule, alors que l’expression de Gata4 n’est plus décelée dans les surrénales (Viger et al., 2008). Le rôle combiné de ces facteurs dans la stéroïdogenèse a récemment été étudié en effectuant une double invalidation conditionnelle des gènes
Gata4 et Gata6 (Padua et al., 2015; Tevosian et al., 2015). Sans GATA4 et GATA6,
les souris naissent avec une insuffisance des surrénales. Étonnamment, les femelles doublent homozygotes meurent de cette insuffisance en hormones surrénaliennes, alors que les souris mâles mutantes survivent en raison d’une production ectopique de corticoïdes par certaines cellules du testicule. Ce phénotype est possible en raison de