Les effets sur la santé respiratoire du travail de
moniteur/sauveteur au Québec
Mémoire
Gabrielle Bureau
Maîtrise en santé communautaire
Maître ès sciences (M.Sc.)
Québec, Canada
RÉSUMÉ
Le but des travaux de ce mémoire est d’évaluer les effets sur la santé respiratoire découlant du travail en piscine intérieure chez des sauveteurs au Québec. Nous avons étudié la relation entre l’exposition professionnelle à l’environnement des piscines intérieures et la présence de divers symptômes respiratoires et irritatifs, de même que la présence de plusieurs variables liées à l’asthme. Un questionnaire en ligne auto-administré au printemps 2014 a permis d’intégrer les réponses de 870 sauveteurs. Les travailleurs exposés dans la dernière année ont expérimenté plus de toux et d’irritation de la gorge et des yeux dans les douze derniers mois que les travailleurs non exposés au cours de cette période. Plusieurs des symptômes présents au travail étaient statistiquement associés à la durée de l’exposition au cours de la vie. Parmi les sujets asthmatiques, ceux exposés au cours de l’année ont présenté un risque statistiquement plus élevé de souffrir de crises d’asthme au cours de cette période que ceux non exposés. Les effets à la santé respiratoire rapportés par les présents travaux renforcent l’importance des mesures reconnues efficaces pour contrôler et suivre la présence de contaminants en piscine intérieure, dans le but d’assurer la sécurité des travailleurs de ce milieu, de même que celle des autres utilisateurs.
ABSTRACT
The purpose of this master thesis is to evaluate the effects of working in an indoor swimming pool environment on respiratory health of lifeguards in the Québec province. We studied the relationship between occupational exposure to indoor swimming pools environment and multiple irritative and respiratory symptoms, as well as various asthma-related outcomes. During the spring 2014, a self-administered online questionnaire documented answers from 870 lifeguards. Exposed workers in the past year experimented more cough, throat and eye irritation in the past twelve months than non-exposed workers for the same period of time. Many work-related symptoms were statistically associated with exposure over lifetime. Among asthmatic subjects, exposed ones during the past year presented a higher risk of having asthma crisis in this period than non-exposed subjects. Considering the effects on respiratory health reported by this study, it seems necessary to evaluate the need to put in place monitoring and control systems to improve air quality of indoor swimming pools, in order to ensure the safety of the workers, as well as the safety of other users.
TABLE DES MATIÈRES
RÉSUMÉ ... iii
ABSTRACT ... v
TABLE DES MATIÈRES ... vii
LISTE DES TABLEAUX ... xi
LISTE DES FIGURES ... xiii
LISTE DES ABRÉVIATIONS ET DES SIGLES ... xv
REMERCIEMENTS ... xix
AVANT-PROPOS ... xxi
INTRODUCTION ... 1
CHAPITRE 1. PROBLÉMATIQUE ... 3
1.1. Contaminants et piscines ... 3
1.1.1. Catégories de risques liés aux piscines ... 3
1.1.2. Désinfection des piscines ... 4
1.1.3. Contamination de l’eau des piscines ... 5
1.1.4. Voies d’exposition aux produits chimiques en piscine ... 6
1.1.5. Normes et règlementation entourant la qualité de l’eau et de l’air en piscine ... 7
1.2. Sous-produits de la chloration ... 10
1.2.1. Processus de formation des sous-produits de la chloration dans les piscines ... 10
1.2.2. Classification des sous-produits de la chloration ... 13
1.2.3. Facteurs influençant les concentrations de sous-produits de la chloration en piscine ... 16
1.2.4. Présence des sous-produits de la chloration dans les piscines au Québec ... 17
1.2.5. Toxicologie et effets sur la santé des sous-produits de la chloration ... 18
1.3. Question de recherche, objectifs et hypothèses ... 40
1.3.1. Question de recherche ... 40
1.3.2. Objectifs de recherche ... 40
1.3.3. Hypothèses de recherche ... 40
1.3.4. Pertinence de l’étude ... 41
CHAPITRE 2. CADRE THÉORIQUE ... 43
CHAPITRE 3. MÉTHODOLOGIE ... 47
3.1. Sélection des sujets à l’étude ... 47
3.1.1. Définition de la population à l’étude ... 47
3.1.3. Critères d’inclusion ... 48
3.1.4. Stratégies de recrutement ... 48
3.2. Collecte de données ... 48
3.2.1. Instrument de collecte de données ... 48
3.3. Variables de l’étude ... 50 3.3.1. Variables dépendantes ... 50 3.3.2. Variables indépendantes ... 51 3.3.3. Variables de contrôle ... 51 3.4. Plan d’analyse ... 52 3.5. Considérations éthiques ... 53 CHAPITRE 4. RÉSULTATS ... 55 4.1. Résumé ... 55 4.2. Article ... 56 ABSTRACT ... 57 INTRODUCTION ... 58 METHODS ... 60 RESULTS ... 64 DISCUSSION ... 69 CONCLUSIONS ... 76 ACKNOWLEDMENTS ... 77 REFERENCES ... 88 4.3. Résultats supplémentaires ... 93 CHAPITRE 5. DISCUSSION ... 97
5.1. Retour sur les objectifs ... 97
5.1.1. Documenter la prévalence des symptômes ... 97
5.1.2. Comparer la prévalence des symptômes ... 99
5.1.3. Établir une relation entre le travail, sa durée et les symptômes ... 101
5.1.4. Établir une relation entre le travail et l’exacerbation de l’asthme ... 103
5.1.5. Établir une relation entre l’arrêt du travail et les symptômes ... 104
5.2. Forces et limites de l’étude ... 106
CONCLUSION ... 109
BIBLIOGRAPHIE ... 111
ANNEXES ... 127
Annexe 2 : Deuxième message électronique pour le recrutement des participants ... 130
Annexe 3 : Textes de promotion dans les médias de la Société de sauvetage ... 133
Annexe 4 : Questionnaire pour les participants travailleurs actifs ... 135
Annexe 5 : Questionnaire pour les participants travailleurs inactifs ... 152
Annexe 6 : Questionnaire pour les non participants ... 168
Annexe 7 : Approbation du comité de programme de maîtrise en santé communautaire de l’Université Laval ... 170
Annexe 8 : Approbation du comité d’éthique de la recherche avec des êtres humains de l’Université Laval (CÉRUL) ... 172
Annexe 9 : Formulaire de consentement pour les participants ... 174
LISTE DES TABLEAUX
Tableau 1 Normes américaines d’exposition professionnelle pour le chlore ... 9 Tableau 2 Concentrations moyennes dans l’air (ug/m3) et dans l’eau (ug/L) des
sous-produits de la désinfection mesurées dans des établissements de Montréal et Québec .... 18 Tableau 3 Relation dose-effets du chlore gazeux (Cl2) ... 21
Tableau 4 Évaluation du CIRC sur les risques de cancérogénicité pour l'homme des sous-produits de la chloration ... 24 Tableau 5 Classement du CIRC des risques de cancérogénicité chez l'homme ... 25 Tableau 6 Variables liées à l’asthme selon le statut de travailleur et la durée du travail en piscine intérieure parmi ceux ayant reçu un diagnostic d’asthme par un médecin ... 93 Tableau 7 Modèles de régression logistique multiple de la durée d’inactivité et de la durée de l’activité professionnelle en piscine intérieure au cours de la vie parmi les travailleurs inactifs en relation avec la présence de symptômes au cours des 12 derniers mois ... 94
LISTE DES FIGURES
Figure 1 Risques à la santé associés aux piscines et stratégies afin de les réduire ... 4
Figure 2 Contaminants possibles des eaux de piscines ... 5
Figure 3 Processus de formation des principaux sous-produits de la chloration dans l'eau et l'air des piscines intérieures et extérieures ... 12
Figure 4 Principaux sous-produits de la chloration des piscines ... 14
Figure 5 Acides haloacétiques communs des eaux de piscines ... 14
LISTE DES ABRÉVIATIONS ET DES SIGLES
ACGIH : American Conference of Governmental Industrial HygienistsAFSSET : Agence française de sécurité sanitaire de l’environnement et du travail AHA : acides haloacétiques
Ca(ClO)2 : hypochlorite de calcium
CÉRUL : Comité d’éthique de la recherche sur des êtres humains de l’Université Laval
CHCl3 : chloroforme
CHCl2Br : bromodichlorométhane
CHClBr2 : dibromochlorométhane
CHBr3 : bromoforme
CIRC : Centre international de Recherche sur le Cancer Cl2 : chlore gazeux
cm : centimètre
CSST : Commission de la santé et de la sécurité du travail CVF : capacité vitale forcée
DIVS : danger immédiat pour la vie et la santé
ECRHS : European Community Respiratory Health Survey
EQSJS : Enquête québécoise sur la santé des jeunes du secondaire ESCC : Enquête sur la santé dans les collectivités canadiennes EPA : Environmental Protection Agency
H+ : ion d’hydrogène HAN : haloacétonitriles HCl : acide chlorhydrique HOCl : acide hypochloreux
HRB : hyperréactivité bronchique IC : intervalle de confiance
INRS : Institut national de recherche et de sécurité pour la prévention des accidents du travail et des maladies professionnelles
j : jour
kg : kilogramme
L : litre
LiClO : hypochlorite de lithium
m3 : mètre cube
MADO : maladie à déclaration obligatoire mg : milligramme
mL : millilitre
NaOCl : hypochlorite de sodium NCl3 : trichloramine
NDMA : N-nitrosodiméthylamine NH2Cl: monochloramine
NHCl2 : dichloramine
NIOSH : National Institute for Occupational Safety and Health NOAEL: no observed adverse effect level
OCl- : ion hypochlorite
OMS : Organisation Mondiale de la Santé ORL : oto-rhino-laryngologie
OSHA : Occupational Safety and Health Administration PEL : permissible exposure limit
PPM : partie par million
RADS : Reactive Airways Dysfunction Syndrome RC : rapport de cote
RD50 : 50% respiratory rate decrease
REL : recommended exposure limit RR : risque relatif
RSST : Règlement sur la santé et la sécurité du travail STEL : short-term exposure limit
TFR : tests de fonction respiratoire THM : trihalométhanes
TLV : threshold limit value
TLV-STEL : threshold limit value for short-term exposure limit TLV-TWA : threshold limit value for time-weighted average TWA : time-weighted average
ug : microgramme U.S. : United States
VECD : valeur d’exposition de courte durée VEMP : valeur d’exposition moyenne pondérée VEMS : volume expiratoire maximal par seconde
VRI : voies respiratoires inférieures VRS : voies respiratoires supérieures
REMERCIEMENTS
La réalisation de ce mémoire a été possible grâce au soutien, à la collaboration et à l’aide de plusieurs personnes.
J’aimerais d’abord remercier mon directeur, le docteur Benoît Lévesque. Merci pour votre support constant, votre grande disponibilité et votre enthousiasme face à ce projet. Je me suis sentie épaulée tout au long de ce parcours. Un grand merci également à mon codirecteur de recherche, le docteur Denis Laliberté. Merci à Denis Gauvin et Mélanie Tessier pour leur contribution lors des différentes étapes de ce projet; votre expertise, vos commentaires et votre disponibilité ont été grandement appréciés. Un merci spécial à Marjolaine Dubé pour sa contribution aux analyses, de même que pour ses précieux conseils sur les choix à effectuer. Merci Marjolaine pour ta grande disponibilité face aux nombreuses demandes d’analyses statistiques que j’ai pu faire, et ce, malgré le fait que l’échéancier de base fut maintes fois modifié en raison de mes deux congés de maternité.
Un merci particulier à François Lépine ainsi qu’à la Société de sauvetage, division Québec, pour leur contribution à ce projet de recherche. Sans votre appui, ce projet n’aurait pas pu être réalisé. Je tiens également à remercier les participants de ce projet pour avoir pris le temps de répondre au questionnaire.
Finalement, je tiens à remercier Charles, mon conjoint, de m’avoir supportée tout au long de la réalisation de ce projet et de me soutenir au travers de ce long parcours qu’est la résidence en médecine. Merci à Théo et Jeanne, mes deux amours, pour l’immense bonheur qu’ils m’apportent au quotidien. Merci à Christine Dufour-Turbis, mon amie et collègue, pour l’écoute et le support apportés. Merci également à mes parents pour leur appui dans tout ce que j’entreprends.
AVANT-PROPOS
Ce mémoire comporte un article intitulé « Indoor swimming pools environment and self-reported irritative and respiratory symptoms among lifeguards». Cet article a été soumis à la revue International Journal of Environmental Health Research le 3 mars 2017.
Auteurs de l’article : Gabrielle Bureau, MD (1, 2) Benoît Lévesque, MD, M. Sc. (1, 2, 3) Marjolaine Dubé, B. Sc (2) Denis Gauvin, M. Sc. (2) François Lépine, M. Sc. (4) Denis Laliberté, MD, MPH (1, 5)
Affiliations des auteurs de l’article :
1 Département de médecine sociale et préventive, Faculté de médecine, Université Laval, Québec, Québec, Canada
2 Direction de la santé environnementale et de la toxicologie, Institut national de santé publique du Québec, Québec, Canada
3 Axe santé des populations et pratiques optimales en santé, Centre de recherche du CHU de Québec, Québec, Québec, Canada
4 Société de sauvetage, Montréal, Québec, Canada
5 Direction régionale de santé publique de la Nationale, CIUSSS de la Capitale-Nationale, Québec, Québec, Canada
Contribution des auteurs de l’article :
L’auteure du présent mémoire, la Dre Gabrielle Bureau, est également l’auteure principale de l’article. L’auteure a procédé à la conception du projet, à l’analyse des données et à la rédaction de l’article, en collaboration avec les autres auteurs présentés ci-bas.
Le Dr Benoît Lévesque a supervisé l’ensemble du projet. Il a ainsi contribué lors de la conception du projet, de la collecte de données, de l’analyse des données et de la rédaction de l’article scientifique et du mémoire.
Le Dr Denis Laliberté a également supervisé l’ensemble du projet, notamment lors de la préparation des documents pour le comité d’éthique et la relecture de l’article.
Mme Marjolaine Dubé a réalisé les analyses statistiques et participé à la relecture de l’article.
M Denis Gauvin a participé à la conception du projet et de l’outil de collecte de données, à l’analyse des données et à la relecture de l’article.
INTRODUCTION
Au courant des dernières décennies, la natation a beaucoup gagné en popularité. Il s’agit maintenant d’une des activités les plus populaires dans les pays développés (Bernard, 2011). Au Canada, elle représente la quatrième activité de loisir en importance, après la marche, le jardinage et l’exercice à domicile (Dyck, Sadiq, Rodriguez, Simard, & Tardif, 2011). Cependant, des questionnements ont été soulevés quant à la sécurité des piscines pour les populations les fréquentant, en l’occurrence les bébés, les enfants, les nageurs récréatifs, les athlètes ainsi que les travailleurs. L’hypothèse voulant que la fréquentation d’une piscine chlorée, particulièrement les piscines intérieures, représente un facteur de risque pour la présence de symptômes irritatifs oculaires et respiratoires (Fantuzzi et al., 2010; Jacobs et al., 2007) ainsi que pour l’asthme bronchique est bien connue dans la littérature (Ferrari et al., 2011; Helenius et al., 1998).
Les études semblent démontrer que la présence de symptômes respiratoires chez les personnes fréquentant des piscines est généralement liée à l’exposition environnementale aux chloramines, un sous-produit de la désinfection de ces milieux. Quelques auteurs ont décrit la présence fréquente de symptômes irritatifs des voies respiratoires supérieures et des yeux (Chen et al., 2008; Massin et al., 1998). Des études ont été effectuées afin d’investiguer l’association entre l’exposition à l’eau des piscines et les plaintes liées à la santé rapportées par des nageurs, des enfants et des travailleurs de piscine (Thoumelin et al., 2005; Lévesque et al., 2006). Des questions ont été soulevées par rapport à l’inhalation de sous-produits de désinfection et l’apparition ou l’exacerbation de l’asthme. Toutefois, les conclusions ne sont pas claires concernant cette problématique.
Par ailleurs, même s’il existe de la littérature sur le sujet, peu d’études ont évalué la prévalence des symptômes respiratoires chez des sujets exposés aux sous-produits de la chloration dans le cadre de leur travail. Ceci est encore plus vrai au Québec, où aucune information n’est disponible en regard des effets respiratoires en lien avec l’exposition professionnelle à l’air potentiellement contaminé des piscines. Cette information serait fort pertinente afin de mieux comprendre les risques associés à l’exposition occupationnelle à ces contaminants chez les travailleurs de piscine et ainsi cerner les actions permettant de les atténuer. La présente recherche propose donc de documenter les symptômes respiratoires chez les travailleurs de piscine, nommément les moniteurs/sauveteurs, du Québec.
Le présent mémoire est divisé en cinq chapitres. Le premier chapitre présentera la problématique et la recension des écrits sur le sujet à l’étude, de même que les objectifs de la recherche. Le chapitre 2 expliquera le cadre théorique sur lequel s’appuie le projet et le chapitre 3 détaillera la méthodologie employée. Le chapitre 4, à l’intérieur duquel est inséré un article scientifique, présentera les résultats de l’étude. Finalement, une discussion des résultats sera effectuée au chapitre 5 de ce mémoire.
CHAPITRE 1. PROBLÉMATIQUE
Dans le présent chapitre, nous verrons les risques liés aux piscines, les sources potentielles de contamination de l’eau des piscines, les fondements de la désinfection de l’eau et les voies d’exposition aux différents produits chimiques. Par ailleurs, nous décrirons le processus de formation des sous-produits de la chloration en piscine et nommerons les principaux sous-produits ainsi que les facteurs expliquant les variations de leurs concentrations dans l’eau et dans l’air. Nous verrons également les normes de qualité de l’eau des piscines et les valeurs d’exposition occupationnelle suggérées. Nous décrirons par la suite ce qui est connu de la toxicité des sous-produits de la chloration et de leurs effets sur la santé. Finalement, nous présenterons les objectifs de la recherche issus de la recension des écrits.
1.1.
Contaminants et piscines
1.1.1. Catégories de risques liés aux piscines
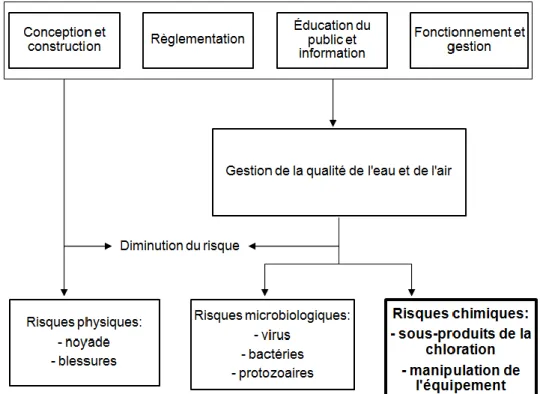
De prime abord, divers risques en lien avec les piscines et les bassins sont reconnus, soit les risques physiques (ex : blessures, noyades), les risques microbiologiques et les risques chimiques (Côté, 2005; World Health Organization, 2006). La Figure 1, inspirée d’un document écrit par l’Organisation Mondiale de la Santé (OMS) (World Health Organization, 2006) illustre ces risques et les stratégies devant être prises afin de les réduire. Les risques microbiologiques sont principalement en lien avec la présence d’espèces résistantes aux procédés de désinfection, telles que Giardia et
Cryptosporidium. Toutefois, avec de bonnes techniques de traitement et de désinfection,
la qualité microbiologique des eaux de piscines est généralement excellente, entraînant par le fait-même un faible niveau de risque pour les baigneurs du point de vue microbiologique (World Health Organization, 2006). Les risques chimiques, quant à eux, sont souvent engendrés par ces mêmes procédés et traitements et sont souvent mésestimés. Le présent mémoire s’intéresse à cette dernière catégorie de risques, plus spécifiquement aux sous-produits de la chloration et à leurs effets sur la santé respiratoire.
Figure 1 Risques à la santé associés aux piscines et stratégies afin de les
réduire
Adaptée de World Health Organization (2006)
1.1.2. Désinfection des piscines
La désinfection des piscines est un processus continu obligatoire qui permet de détruire les organismes pathogènes et microorganismes présents dans l’eau et pouvant affecter la santé des usagers (Côté, 2005). Le but est de prévenir les maladies associées à l’utilisation des eaux récréatives, tout en tentant de minimiser les effets sur la santé résultant d’un excès de sous-produits de désinfection (Centers for Disease Control and Prevention, 2013).
Plusieurs désinfectants peuvent être utilisés dans les piscines. L’introduction du chlore en tant qu’agent de désinfection de l’eau s’est faite en Belgique en 1902 (Montgomery Watson Hazra, 2005) et l’utilisation de cet agent est depuis reconnue comme étant une méthode efficace pour traiter les eaux municipales (eau potable) (Health Canada, 2012; U.S. Environmental Protection Agency, 2006; World Health Organization, 2011). Le chlore est actuellement l’agent de désinfection le plus couramment utilisé pour traiter les piscines, tant au Québec qu’ailleurs dans le monde (Côté, 2005; World Health Organization, 2006). Ceci s’explique par son faible coût, sa facilité d’utilisation, son
efficacité contre un large spectre de microorganismes ainsi que par la protection résiduelle qu’il offre (Silva et al., 2012). Plusieurs formes de chlore sont utilisées au Québec, soit l’hypochlorite de sodium (NaOCl), le chlore gazeux (Cl2), l’hypochlorite de calcium
(Ca(ClO)2) et l’hypochlorite de lithium (LiClO) (Côté, 2005). Par ailleurs, les autres produits
pouvant être utilisés à titre de désinfectant au Québec sont le brome, l’ozone et les lampes ultraviolettes (Côté, 2005; World Health Organization, 2006).
1.1.3. Contamination de l’eau des piscines
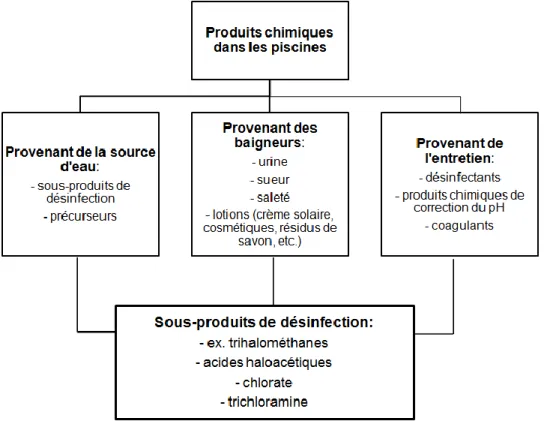
Plusieurs produits chimiques provenant de différentes sources se retrouvent dans l’eau des piscines (Figure 2). Ces produits peuvent venir de la source d’eau utilisée, des baigneurs qui entrent en contact avec l’eau des piscines et des produits employés pour l’entretien et la désinfection (Florentin, Hautemanière, & Hartemann, 2011; World Health Organization, 2006). Ces produits contaminent l’eau des bassins et mènent à la formation de sous-produits de désinfection. Nous verrons en détail ultérieurement le processus de formation de ces sous-produits (voir 1.2.1).
Figure 2 Contaminants possibles des eaux de piscines
1.1.4.
Voies d’exposition aux produits chimiques en piscine
Il existe trois principales voies d’exposition aux produits chimiques présents dans les piscines (Erdinger et al., 2004; Nemery, Hoet, & Nowak, 2002). Il s’agit de l’inhalation de produits volatils ou en aérosols, de l’ingestion d’eau ainsi que du contact dermique et de l’absorption par la peau (World Health Organization, 2006).
Voie respiratoire
La première voie d’exposition aux produits chimiques est celle respiratoire, c’est-à-dire l’inhalation d’air dans l’atmosphère. Cette voie d’exposition est importante, compte tenu du fait que les trihalométhanes (THM) et la trichloramine (NCl3), des sous-produits de la
chloration, sont des substances volatiles (Zwiener et al., 2007). Cette voie est probablement la plus importante pour ces composés (Strähle et al., 2000). Les principaux sous-produits de la chloration seront décrits à la section 1.2.2.
Les nageurs et les utilisateurs de piscines inhalent l’air présent à la surface de l’eau. La quantité inhalée dépend entre autres de l’intensité et de la durée de l’effort (World Health Organization, 2006; Zarzoso, Llana, & Pérez-Soriano, 2010). Ceci est vrai tant pour les piscines intérieures qu’extérieures. Par ailleurs, les utilisateurs inhalent également l’air présent dans l’enceinte des piscines intérieures. Ceci s’applique aux travailleurs de piscines tels que les moniteurs et sauveteurs qui sont présents autour des bassins. La voie respiratoire est la voie d’exposition principale pour ces travailleurs. Ce facteur est de moindre importance dans le cas des piscines extérieures, car la concentration de produits chimiques présents dans l’atmosphère de ces piscines est considérablement diluée (World Health Organization, 2006). L’exposition par inhalation est fortement associée aux substances volatiles, mais peut également inclure des aérosols. En effet, des facteurs comme la présence d’un spa ou d’une activité importante dans l’eau entraînant beaucoup d’éclaboussures mèneront à la formation d'aérosols pouvant être inhalés (World Health Organization, 2006).
Voie orale
La deuxième voie d’exposition est celle orale, c’est-à-dire par ingestion accidentelle d’eau. La quantité d’eau ingérée par les nageurs et les utilisateurs dépend, entre autres, de l’expérience, de l’âge, du sexe, des habiletés techniques, de l’intensité, de la durée et du type d’activité pratiquée (World Health Organization, 2006; Zarzoso et al., 2010). Dufour, Evans, Behymer, et Cantu (2006) ont estimé qu’un adulte âgé de plus de 18 ans ingère
approximativement 16 mL d’eau lors d’une activité de natation active d’une durée minimale de 45 minutes et qu’une personne âgée de moins de 18 ans en ingère environ 37 mL. La voie orale est la seule voie d’exposition possible aux acides haloacétiques (AHA) puisque ces substances ne sont pas volatiles (Zwiener et al., 2007).
Voie cutanée
La voie cutanée est la troisième et dernière voie d’exposition. Elle est considérée comme étant la moins importante. Néanmoins, lors d’un contact avec l’eau, la peau est exposée de façon importante aux produits chimiques et ceux-ci peuvent pénétrer la peau, en plus de provoquer des manifestations d’irritation (Zarzoso et al., 2010). Certains produits lipophiles et lipophobes peuvent, par ailleurs, être absorbés et se disséminer à l’intérieur du corps (Raykar, Fung, & Anderson, 1988). La température de l’eau, la durée d’exposition et la concentration des produits chimiques sont des facteurs qui modifient le niveau d’exposition (World Health Organization, 2006). Cette voie est particulièrement importante pour les THM et les halocétones non polaires qui sont en mesure de pénétrer la peau (Zwiener et al., 2007).
1.1.5. Normes et règlementation entourant la qualité de l’eau et de l’air en
piscine
Normes pour la qualité de l’eau des piscines
Au Québec, la qualité microbiologique et physico-chimique de l’eau des bassins se doit d’être conforme aux normes élaborées dans le Règlement sur la qualité de l’eau des piscines et autres bassins artificiels (Gouvernement du Québec, 2014a). Le règlement stipule, à l’article 5, que la teneur en chloramines dans l’eau doit être égale ou inférieure à 0,5 mg/L pour un bassin intérieur et égale ou inférieure à 1,0 mg/L pour un bassin extérieur. La teneur en chloramines représente la différence entre la mesure du chlore résiduel total et la mesure du chlore résiduel libre (Côté, 2005). Par ailleurs, les prélèvements pour mesurer la teneur en chloramines dans l’eau doivent être effectués avant, au milieu et après chacune des périodes d’ouverture du bassin (Gouvernement du Québec, 2014a). Advenant le cas où la teneur en chloramines dans l’eau dépasserait les normes fixées, l’exploitant du bassin se doit d’apporter les correctifs nécessaires sans délai afin de ramener la valeur en-dessous de la norme. Également, si la teneur est supérieure à 1,0 mg/L pour une période de plus de 24 heures consécutives, le
responsable du bassin doit faire sortir toutes les personnes présentes dans l’eau et fermer l’accès au bassin jusqu’à ce que la situation soit corrigée (Côté, 2005).
En ce qui a trait aux THM, la norme dans l’eau potable est établie à 80 μg/L au Québec. Tel que recommandé par l’OMS, la norme établie pour l’eau potable devrait être respectée dans l’eau des bassins artificiels (Côté, 2005). Cependant, certains pays ont des normes spécifiques pour l’eau des piscines, notamment l’Allemagne qui a émis une limite maximale plus sévère de 20 μg/L (Erdinger, Kühn & Gabrio, 2005). Toutefois, aucune norme n’est fixée par le Règlement sur la qualité de l’eau des piscines et autres bassins artificiels pour cette famille de contaminants.
Il n’existe par ailleurs pas de normes au Québec pour les autres sous-produits de la chloration formés dans l’eau des piscines qui seront décrits à la section 1.2.2.
Valeurs limites d’exposition occupationnelle aux contaminants de l’air en piscine
Comme indiqué antérieurement, la voie d’exposition principale des travailleurs de piscine aux sous-produits de la chloration est celle aérienne. Nous verrons à présent quelle est la valeur d’exposition admissible au Cl2, de même que les valeurs limites d’exposition
occupationnelle proposées pour le chloroforme (CHCl3)et le NCl3.
Au Québec, le Règlement sur la santé et la sécurité du travail (RSST) (Gouvernement du Québec, 2014b) a émis des valeurs d’exposition admissibles pour les contaminants de l’air, dont le Cl2. Ce gaz toxique est très irritant et peut provoquer de graves problèmes de
santé lorsqu’il est inhalé (Schnebelen & G. Bolduc, 2002). Les intoxications au Cl2 sont
inscrites dans la liste des maladies à déclaration obligatoire (MADO) au Québec. Pour cette substance, la valeur d’exposition de courte durée (VECD), correspondant à la concentration moyenne pondérée d’une substance chimique sur une période de 15 minutes (Sebez et al., 2011), est de 2,9 mg/m3 ou 1 ppm. La valeur d’exposition moyenne pondérée (VEMP) du Cl2, correspondant à la concentration moyenne d’une substance
chimique pondérée pour une journée normale de travail de huit heures, en fonction d’une semaine de 40 heures (Sebez et al., 2011), est de 1,5 mg/m3 ou 0,5 ppm.
Aux États-Unis, des recommandations ont été émises par divers organismes pour les valeurs acceptables de Cl2. Le tableau suivant en présente un résumé.
Tableau 1 Normes américaines d’exposition professionnelle pour le chlore
1Plafond TWA STEL
OSHA (PEL) 1 ppm (3 mg/m3)
NIOSH (REL) 0,5 ppm (1,5 mg/m3) 1 ppm (3 mg/m3)
ACGIH (TLV) 0,5 ppm (1,5 mg/m3) 1 ppm (3 mg/m3)
Référence: United States Department of Labor (2003)
Toutefois, il n’existe pas de recommandations aux États-Unis ou au Canada quant aux limites d’exposition occupationnelle pour des expositions répétées aux chloramines, en particulier au NCl3, ou aux THM pris dans leur ensemble. Des normes et valeurs limites
d’exposition professionnelle au CHCl3, le THM retrouvé en plus grande abondance dans
les piscines et dans l’atmosphère des piscines, ont toutefois été émises par divers organismes. La valeur de 50 ppm (240 mg/m3) a été fixée comme PEL par l’organisme OSHA, celle de 10 ppm (49 mg/m3) a été fixée comme TWA (TLV) par l’ACGIH et celle de 2 ppm (9,78 mg/m3) (60 minutes) a été fixée comme STEL par l’organisme NIOSH (REL) (United States Department of Labor, 2004). Au Québec, la VEMP pour le CHCl3 a été fixée
à 5 ppm (24 mg/m3) (Gouvernement du Québec, 2014b), mais il n’y a pas de mesure obligatoire de ce paramètre en piscine.
À l’aide d’une étude effectuée sur des souris, Gagnaire, Azim, Bonnet, Hecht, et Hery (1994) ont démontré que le NCl3 est un puissant irritant des voies respiratoires
supérieures et que ce pouvoir irritant est du même ordre que celui du Cl2. À partir de leurs
résultats, les auteurs ont proposé une TLV-STEL, correspondant à la valeur de NCl3 ne
devant pas être dépassée pour une exposition de 15 minutes au cours d’une journée de travail (Sebez et al., 2011), de 1,5 mg/m3 ou 0,3 ppm. Ils ont également proposé une TLV-TWA, correspondant à la « concentration moyenne pondérée dans le temps, pour une journée de travail normale de 8 heures, 5 jours par semaine, à laquelle on estime que presque tous les travailleurs peuvent être exposés de façon répétée, jour après jour, pendant toute une vie professionnelle, sans en subir d’effets nocifs » (Sebez et al., 2011, p. 9), de 0,5 mg/m3 ou 0,1 ppm.
1 OSHA: Occupational Safety and Health Administration
PEL: permissible exposure limit
NIOSH: National Institute for Occupational Safety and Health REL: recommended exposure limit
ACGIH: American Conference of Governmental Industrial Hygienists TLV: threshold limit value
TWA: time-weighted average STEL: short-term exposure limit
Peu de temps après, Hery et al. (1995) ont démontré une association entre la présence de symptômes respiratoires aigus chez des instructeurs français de piscine et les niveaux aériens de NCl3. Les instructeurs ont commencé à déclarer des symptômes irritatifs
oculaires et respiratoires à partir d’une concentration aérienne de 0,5 mg/m3 de NCl 3.
Cette valeur fut alors proposée comme valeur limite de confort et il s’agit encore actuellement de la valeur provisoire recommandée par l’OMS (World Health Organization, 2006). En contrepartie, tel qu’il sera mentionné plus loin (section 1.2.5), Parrat et al. (2012) ont suggéré d’abaisser la limite d’exposition à 0,3 mg/m3 puisqu’ils ont observé que
le risque de symptômes irritatifs augmentait à partir de ce niveau. L’Agence française de sécurité sanitaire de l’environnement et du travail (AFSSET) a également recommandé une limite de référence de 0,3 mg/m3, principalement fondée sur les risques à la santé chez les enfants et les travailleurs (AFFSET, 2010). Dernièrement, l’organisation WorkSafeBC en Colombie-Britannique, dédiée à l’amélioration des conditions de travail et de santé des travailleurs, a recommandé une valeur de 0,35 mg/m3 comme TLV-TWA, basée sur la littérature disponible (WorkSafeBC, 2014).
1.2.
Sous-produits de la chloration
En réagissant avec d’autres produits présents dans l’eau, les désinfectants produisent des sous-produits de désinfection. L’utilisation du chlore, premier agent de désinfection pour l’eau potable, a conduit à la découverte des sous-produits de la chloration en 1974 (Rook, 1974). À ce jour, plus de 600 sous-produits ont été identifiés dans l’eau de consommation (Bernard, 2011; Villanueva & Font-Ribera, 2012). Les autres agents de désinfection utilisés dans l’eau des piscines mènent également à la formation de sous-produits, dont plusieurs sont communs avec ceux du chlore. Toutefois, compte tenu du fait que le chlore est de loin l’agent étant le plus largement utilisé dans les piscines au Québec et que les sous-produits en découlant sont ceux ayant été les plus étudiés, nous parlerons à présent des sous-produits de la chloration. Nous verrons dans cette section le processus de formation de ces sous-produits, les différentes classes existantes et les facteurs responsables de la variation de leur concentration dans l’eau et dans l’air.
1.2.1. Processus de formation des sous-produits de la chloration dans les
piscines
L’interaction entre les désinfectants chlorés et les substances présentes dans l’eau des piscines mène à la formation d’un mélange complexe et varié de sous-produits de la désinfection, encore partiellement compris à ce jour (LaKind, Richardson, & Blount, 2010).
Malgré l’utilisation d’agents de désinfection dans les piscines depuis de nombreuses années, la littérature scientifique a des lacunes en ce qui concerne le processus de formation des sous-produits dans les piscines, en comparaison avec l’abondante masse d’information sur les produits de désinfection dans l’eau potable.
Au Québec, le chlore est principalement utilisé sous la forme de Cl2 ou de NaOCl (Côté,
2005). En présence d’eau, le Cl2 réagit d’abord pour former l’acide hypochloreux (HOCl) et
l’acide chlorhydrique (HCl) (équation 1). Une seconde réaction acide mène ensuite à la formation d’un ion hydrogène (H+) et de l’ion hypochlorite (OCl-) (équation 2) (Côté, 2005;
Zwiener et al., 2007). Ensemble, le HOCl et le OCl- représentent le chlore résiduel libre.
(1)
(2)
Lorsque le NaOCl est utilisé, les réactions suivantes surviennent: (3)
(4)
Un équilibre existe entre le HOCl et le OCl-; le premier composé est susceptible de se dissocier pour former le second. Par ailleurs, comme le HOCl représente l’agent désinfectant, sa concentration doit être élevée afin que le processus de désinfection soit efficace. Le pH idéal de l’eau, pour que le HOCl prédomine sur le OCl-, se situe entre 7,0
et 7,5 (Côté, 2005).
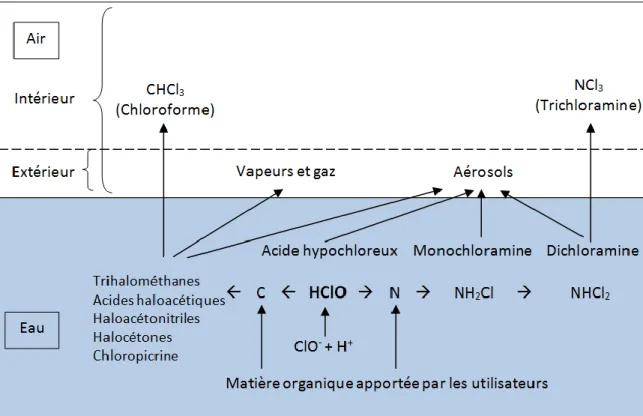
La partie libre du chlore réagit lorsqu’elle entre en contact avec des matières organiques et inorganiques contenant de l’azote, menant ainsi à la formation de sous-produits de la chloration (Bernard, 2011; Parrat et al., 2012). La Figure 3 démontre le processus de formation de ces sous-produits.
Figure 3 Processus de formation des principaux sous-produits de la
chloration dans l'eau et l'air des piscines intérieures et extérieures
Adaptée de Bernard (2011)
Nous pouvons distinguer deux classes d’espèces azotées qui contribuent à la formation des sous-produits. En premier lieu, nous retrouvons l’azote ammoniacal, qui mène à la formation de chloramines en réagissant avec le chlore. Les chloramines possèdent elles-mêmes un certain pouvoir désinfectant, mais il est 100 fois plus faible que celui du chlore résiduel libre. Afin de détruire les chloramines, il est nécessaire soit de maintenir une dose de chlore suffisamment élevée, soit de diminuer la concentration de l’azote ammoniacal, et ce, compte tenu du pouvoir irritant de la dichloramine (NHCl2) et du NCl3 (Côté, 2005). En
second lieu, nous retrouvons les composés organiques azotés réactifs avec le chlore. Ceux-ci proviennent majoritairement des utilisateurs. Les principales sources de ces composés organiques azotés sont l’urée, la créatinine et les différents acides aminés (Zarzoso et al., 2010). En réagissant avec le chlore, ils peuvent former des sous-produits chlorés. Ces derniers se décomposeront à leur tour pour former des chloramines simples. En raison de vitesses de réaction lentes, ces chloramines organiques pourront s’accumuler et entraîner un problème persistant (Côté, 2005).
Notons que l’eau des bassins est nécessairement contaminée par des composés contenant de l’azote et la formation de sous-produits est inévitable. En effet, malgré des mesures d’hygiène appropriées de la part des usagers telles que la prise d’une douche avant l’immersion dans l’eau, chaque baigneur apporte avec lui quelques grammes de matière organique dans la piscine (Batjer et al., 1980). Parmi les sources de matières organiques, nous retrouvons l’urine, la sueur, les cheveux, les produits cosmétiques, la crème solaire et les particules de peau (Villanueva & Font-Ribera, 2012; Zwiener et al.,2007). Par ailleurs, la matière organique présente dans l’eau de la source utilisée sert également de précurseur aux sous-produits de la chloration, tout comme les feuilles d’arbres et les algues, dans le cas particulier des piscines extérieures (Zwiener et al., 2007).
1.2.2. Classification des sous-produits de la chloration
Bien que plus de 600 sous-produits de la chloration aient été identifiés dans l’eau de consommation, de nombreux autres n’ont pas encore fait l’objet d’une identification (Bernard, 2011; Villanueva & Font-Ribera, 2012). Moins de 50% de la totalité des sous-produits aurait été identifié (Richardson, Demarini, Kogevinas, Fernandez, & Villanueva, 2010). Très peu de ceux identifiés ont fait l’objet d’études d’exposition et d’études toxicologiques. Les données disponibles sont donc peu nombreuses (Richardson, Plewa, Wagner, Schoeny, & DeMarini, 2007). Nous savons que plusieurs de ces sous-produits se retrouvent à la fois dans l’eau de consommation et dans l’eau des piscines. En contrepartie, de récentes études faites par Zwiener et al. (2007) et par Richardson et al. (2010) ont démontré l’existence de sous-produits spécifiques à l’eau des piscines et qui sont, en l’occurrence, absents de l’eau de consommation. Nous retrouvons ainsi les haloamides, les halonitriles et les haloamines, qui contiennent de l’azote. Actuellement, un peu plus d’une centaine de sous-produits ont été identifiés dans l’eau des piscines (Chowdhury, Alhooshani, & Karanfil, 2014). La
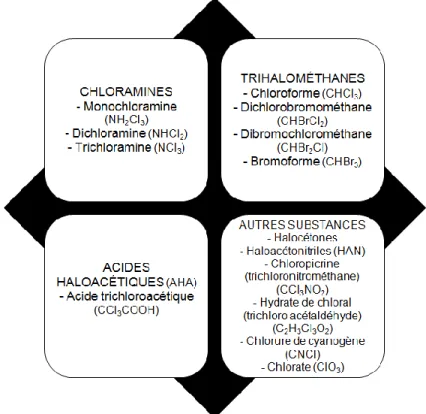
Figure 4 montre les principaux
sous-produits de la chloration des piscines. Globalement, ceux retrouvés en plus grande quantité dans ce type d’eau sont les AHA (60,8-72,6% du total des sous-produits de la chloration), les THM (13,7-25,5%), les chloramines (7,1-10,3%) et les haloacétonitriles (HAN) (3,4-6,6%) (Lee, Ha, & Zoh, 2009; Villanueva & Font-Ribera, 2012).Figure 4 Principaux sous-produits de la chloration des piscines
Adaptée de World Health Organization (2006) et Zarzoso et al. (2010)
Acides haloacétiques (AHA)
Les AHA peuvent se retrouver à la fois dans l’eau des piscines et dans l’air sous forme d’aérosols (Villanueva & Font-Ribera, 2012). Ils sont formés par la réaction entre la matière organique et le chlore (Florentin et al., 2011). Les AHA peuvent irriter les yeux, la peau et les membranes muqueuses (Zwiener et al., 2007). Ils sont divisés en trois groupes, soit celui des acides mono-, di- et trihaloacétiques. Neuf AHA communs sont retrouvés autant dans l’eau de consommation que dans l’eau des piscines (Figure 5) (Florentin et al., 2011). Plus spécifiquement, ce sont les acides di- et trichloroacétiques qui sont généralement retrouvés en plus grande quantité (World Health Organization, 2006).
Figure 5 Acides haloacétiques communs des eaux de piscines
Trihalométhanes (THM)
Cette classe est la mieux connue et est celle ayant été la plus étudiée (Zwiener et al., 2007). Ces sous-produits sont formés à l’issu d’une réaction complexe entre le chlore et les matières organiques (Florentin et al., 2011). Les THM sont présents en grande concentration. En comparaison avec l’eau du robinet, ils sont retrouvés en plus grande quantité dans l’eau des piscines, puisque cette eau doit être désinfectée régulièrement et que le temps de remplacement est long lors du recyclage (Chu & Nieuwenhuijsen, 2002; Erdinger et al., 2004). Les THM sont de nature volatile et peuvent être inhalés par toute personne présente dans l’enceinte de la piscine (Fantuzzi et al., 2001). Le composé majoritaire de cette classe est le CHCl3 (World Health Organization, 2006). Les autres
THM également trouvés en importance dans l’eau des piscines sont le dichlorobromométhane (CHCl2Br), le dibromochlorométhane (CHClBr2) et le bromoforme
(CHBr3) (Florentin et al., 2011).
Chloramines
Les chloramines sont des composés chimiques solubles dans l’eau, volatiles et détenant un potentiel d’oxydation très puissant. Elles correspondent au chlore combiné, en opposition au chlore libre nommé ci-haut. Trois chloramines existent, soit la monochloramine (NH2Cl), la dichloramine (NHCl2) et la trichloramine (NCl3) (Bernard,
2011). Tel que mentionné précédemment, le NH2Cl est tout d’abord formé par le contact
entre les composés organiques azotés et le chlore libre. Le NHCl2 et le NCl3 sont ensuite
formés par des réactions successives entre les composés organiques et le HOCl (Florentin et al., 2011). Le NCl3, (synonyme : trichlorure d’azote) est le plus irritant des
composés formant les chloramines (Zwiener et al., 2007). Il est quatre fois plus volatile que le CHCl3 (Sander, 1999). Il est prédominant lorsque le pH de l’eau est inférieur à 8.
Cette molécule donne aux piscines intérieures leur odeur caractéristique, faussement attribuée au chlore (Bernard, 2011; Massin et al., 1998). Il a été admis dans la littérature que, par une inférence de la constante d’Henry, le NCl3 est l’espèce ayant le potentiel
d’être retrouvé en plus grande concentration dans l’air des piscines intérieures (Bernard, 2011). Quant au NH2Cl et au NHCl2, ils peuvent être présents en quantité significative
seulement sous forme d’aérosols (Bernard, 2011). Bien que les chloramines soient également présentes dans les piscines extérieures, elles ont tendance à se dissiper dans l’air. À l’inverse, dans les piscines intérieures, une production constante résulte en une
concentration plus grande qui peut être néfaste pour la santé des personnes présentes dans l’enceinte de la piscine (Massin et al., 1998).
Autres substances
À l’heure actuelle, il existe peu de données concernant les autres produits de la chloration identifiés dans l’eau des piscines (aldéhydes, chloropicrine, halocétones, N-nitrosodiméthylamine ou NDMA, hydrate de chloral et ions bromates). Ceci s’explique par le fait qu’ils ne sont pas formés dans l’eau de consommation, ou qu’ils le sont à de très faibles concentrations, et qu’ils ne constituent pas une priorité pour la recherche (Florentin et al., 2011; Zarzoso et al., 2010). Par ailleurs, tel que mentionné précédemment, de nombreux sous-produits de désinfection n’ont pas été encore identifiés.
1.2.3. Facteurs influençant les concentrations de sous-produits de la
chloration en piscine
L’eau des piscines chlorées contient de plus grandes quantités de chlore résiduel et est maintenue à des températures plus élevées que l’eau potable des systèmes de distribution. Les niveaux aériens de certains sous-produits de la chloration sont élevés dans l’environnement des piscines, en raison de la désinfection continue nécessaire et de l’apport constant de matière organique par les utilisateurs (Chowdhury et al., 2014). Quelques études se sont penchées sur les facteurs pouvant influencer la concentration des sous-produits dans l’eau et dans l’air des piscines. Toutefois, les données sont limitées aux quelques substances majeures (World Health Organization, 2006).
Ainsi, nous savons que la quantité dans l’eau des piscines varie en fonction de la concentration de précurseurs et de la quantité de matière organique présents dans l’eau, de la dose et du niveau résiduel de désinfectant, ainsi que de la température et du pH de l’eau (World Health Organization, 2006). Par ailleurs, le nombre d’utilisateurs dans la piscine et la durée du contact entre les utilisateurs et l’eau influencent la quantité de THM et de chloramines dans l’eau (Chu & Nieuwenhuijsen, 2002; Florentin et al., 2011; Jacobs et al., 2007; Massin et al., 1998; World Health Organization, 2006).
Également, des facteurs influençent la quantité de THM transportée de l’eau à l’air. Nous retrouvons la concentration de ce sous-produit dans l’eau, la température de l’eau, la hauteur du plafond, la présence d’éclaboussures et la perturbation de l’eau (Jacobs et al., 2007; World Health Organization, 2006). Ces deux derniers facteurs, liés à la turbulence de l’eau occasionnée par les baigneurs, sont aussi associés à la concentration aérienne
en chloramines (Massin et al., 1998). La grandeur du bâtiment, la ventilation de l’endroit et la circulation d’air sont d’autres facteurs importants influençant les concentrations aérien-nes dans les pisciaérien-nes intérieures (World Health Organization, 2006). À cet effet, il est à no-ter que les niveaux aériens de THM et de chloramines sont plus élevés en hiver, en com-paraison avec l’été, démontrant que le faible taux d’échange d’air en hiver mène à l’ac-cumulation de contaminants aériens (Bessonneau, Derbez, Clement, & Thomas, 2011). Dans un autre ordre d’idées, les concentrations des sous-produits de la chloration ne sont pas les mêmes pour les piscines intérieures et extérieures. En effet, les concentrations de THM dans l’eau des piscines extérieures sont généralement plus élevées que dans les piscines intérieures. Les AHA sont également présents en plus grandes quantités dans les piscines extérieures selon un ratio de 1,5 à 2,5 fois (Simard, Tardif, & Rodriguez, 2013). Des concentrations plus grandes de précurseurs et de composés organiques, ainsi qu’un pH de l’eau plus élevé dans les piscines extérieures peuvent expliquer ces différences, de même que l’exposition prolongée au soleil (Liu, Cheung, Yang, & Shang, 2006; Simard et al., 2013). En contrepartie, tel que mentionné précédemment, des niveaux plus élevés de composés volatiles (NCl3 et THM) dans l’air des piscines intérieures sont rapportés dans la
littérature (Bessonneau et al., 2011; Richardson et al., 2010).
1.2.4. Présence des sous-produits de la chloration dans les piscines au
Québec
À notre connaissance, peu d’études ont documenté les niveaux de sous-produits de la chloration dans les piscines au Québec. Une étude menée par Lévesque et al. (2000) a rapporté des concentrations moyennes de CHCl3 dans l’eau de piscines intérieures de la
région de la Capitale-Nationale (n=8) variant entre 18 µg/L et 80 µg/L. Les concentrations aériennes de CHCl3 variaient, quant à elles, de 78 µg/m3 à 329 µg/m3. Simard, Tardif, et
Rodriguez (2013) ont évalué la présence de divers sous-produits de la chloration, notam-ment les THM et les AHA, dans l’eau de 54 piscines intérieures et extérieures de la ville de Québec. Des prélèvements ont été effectués de façon mensuelle pour les piscines intérieures et de façon bi-mensuelle pour celles extérieures, pour une durée d’un an. La concentration moyenne de THM totaux était de 63,7 µg/L dans les 15 piscines intérieures étudiées et de 97,9 µg/L dans les 39 piscines extérieures. Le THM le plus prévalent était le CHCl3 et représentait environ 97% de tous les THM retrouvés dans l’eau des piscines. La
concentration moyenne d’AHA était de 412,9 µg/L et de 807,6 µg/L dans l’eau des piscines intérieures et extérieures respectivement.
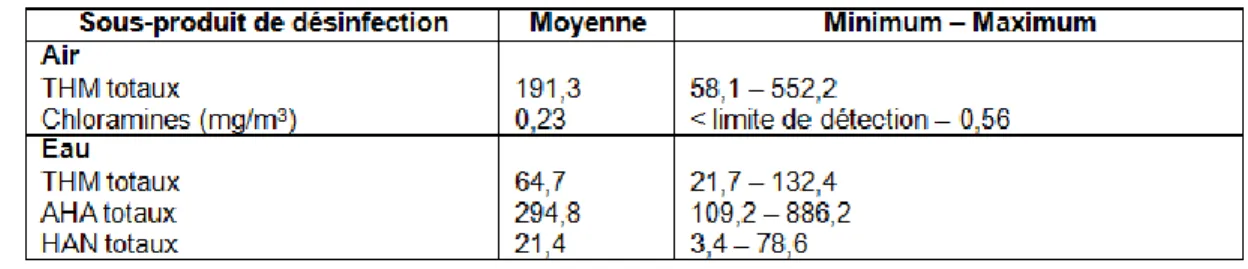
Tardif, Catto, Haddad, et Rodriguez (2015) ont dressé un tableau de la contamination environnementale en sous-produits de la chloration (THM dans l’eau et dans l’air, chloramines dans l’air et AHA et HAN dans l’eau) à partir d’un échantillon de piscines publiques du Québec. En octobre et novembre 2012, des mesures ont été effectuées dans 41 piscines intérieures volontaires (26 à Montréal et 15 à Québec). Les prélèvements dans l’eau (à une profondeur de 30 cm) ont été effectués au début et à la fin de la visite d’environ trois heures. L’échantillonnage de l’air s’est effectué en continu pour une période de 95 minutes pour les THM et de 120 minutes pour les chloramines. Les pompes étaient situées à la hauteur de la chaise de sauveteur la plus centrale, c’est-à-dire à environ 150 cm de la surface de l’eau. Une seconde pompe installée au pied de cette chaise et à 30 cm de la surface du sol a été utilisée pour les THM. Le Tableau 2 résume les résultats des échantillonnages.
Tableau 2 Concentrations moyennes dans l’air (ug/m
3) et dans l’eau (ug/L)
des sous-produits de la désinfection mesurées dans des établissements de
Montréal et Québec
Tiré de Tardif et al. (2015)
Lévesque, Vézina, Gauvin et Leroux (2015) ont documenté les niveaux aériens de NCl3 et
de chloramines dans l’eau d’une piscine intérieure où des employés se sont plaints de divers symptômes. Entre octobre et décembre 2011, les auteurs ont prélevé un total de 26 échantillons, d’une durée de trois heures chacun. La concentration aérienne moyenne de NCl3 était de 0,38 mg/m3 (écart type = 0,15; étendue 0,11 – 0,70) tandis que la
concentration moyenne de chloramines dans l’eau était de 0,6 mg/L (écart type = 0,1; étendue : 0,4 – 0,8).
1.2.5. Toxicologie et effets sur la santé des sous-produits de la chloration
Nous verrons à présent ce qui est connu de la toxicité des sous-produits de la chloration. Bien que la plupart des études effectuées aient porté sur l’eau de consommation, il nous est possible d’appliquer ces connaissances aux sous-produits formés dans les piscines,puisque de nombreux sous-produits sont communs aux deux types d’eau. Notons, par contre, que les eaux des piscines sont probablement plus contaminées que l’eau pro-venant des sources de consommation (Plewa, Wagner, & Mitch, 2011) et que les types d’exposition diffèrent (inhalation, dermique et ingestion). En ce qui a trait aux sous-produits spécifiques à l’eau des piscines identifiés ci-haut, les connaissances sur leur toxicité sont peu nombreuses et de plus amples études doivent être effectuées. Ils ne seront donc pas abordés dans le cadre du présent travail. Nous débuterons par la toxicité des sous-produits connus chez l’animal pour ensuite discuter de la toxicité chez l’humain.
Toxicologie
Toxicité chez l’animal
Barbee, Thackara, & Rinehart (1983) ont mis en lumière l’effet irritant par voie respiratoire du NCl3 en exposant des rats à cette substance. Les auteurs ont démontré qu’une
exposition d’une heure à une dose de 550 mg/m3 est létale et que l’œdème pulmonaire est
la principale cause de décès. Par ailleurs, Gagnaire et al. (1994) ont démontré que la fréquence respiratoire de la souris baisse lorsqu’elle est exposée durant une heure au NCl3 par voie respiratoire. En effet, ils ont calculé une RD50 (dose pour laquelle est
observée une diminution de la fréquence respiratoire de 50%) de 2,5 ppm.
Une seule étude s’est intéressée à la toxicité orale du NCl3. En effet, la presque totalité
des études se sont attardées à l’inhalation de cette substance, probablement en raison de son caractère volatil (Bonvallot, Glorennec, & Zmirou, 2010). Nakai et al. (2000) ont exposé des rats à des concentrations de NCl3 allant de 0,2 à 90 ppm via leur eau de
consommation. Aucun signe clinique ne fut observé, mais de légers changements biochimiques et histologiques sont apparus à des concentrations de 0,23 mg/kg/j chez les femelles et de 0,29 mg/kg/j chez les mâles.
Au regard des THM, la littérature a démontré qu’une dose inhalée de 300 ppm de CHCl3
est extrêmement toxique et peut entraîner une dépression du système nerveux central et des effets cardiaques (Templin et al., 1996b). Tel que démontré par des études effectuées sur des rats et des souris, une exposition respiratoire ou orale peut conduire à une toxicité rénale et hépatique, de même qu’à des lésions de l’épithélium nasal. Chez les rats, une concentration inhalée de 10 ppm de CHCl3 correspond au niveau pour lequel aucun effet
n’est observé (NOAEL – no observed adverse effect level) au niveau hépatique. Une dose de 300 ppm inhalée est associée à des effets toxiques hépatiques, tandis que des lésions
à l’épithélium nasal sont observées à des concentrations plus faibles (à partir de 10 ppm) (Larson et al., 1996; Templin et al., 1996b; Templin, Jamison, Sprankle, Wolf, & Wong, 1996a). Par ailleurs, Jorgenson, Melerhenry, Rushbrook, Bull, et Robinson (1985) ont démontré qu’une exposition au CHCl3 via l’eau consommée à des concentrations
supérieures à 400 mg\L induit une augmentation de l’incidence de tumeurs rénales chez les rats. Toutefois, la littérature n’a pas démontré d’effet sur le système reproducteur ni d’effet tératogène.
Toxicité chez l’humain
L’hypothèse d’un lien entre la présence d’irritation des yeux et de la peau chez des nageurs et le contact avec l’eau de piscine traitée au chlore fut initialement proposée par Mood en 1953. L’auteur émit l’hypothèse que la combinaison de chlore et d’ammoniac pouvait mener à une irritation des yeux, ce qui fut confirmé par la suite. Dans la présente partie, nous verrons d’abord la toxicité aiguë des sous-produits de la chloration, puis leur toxicité chronique chez l’humain. Nous effectuerons également un survol de la cancérogénicité, de la génotoxicité et de la mutagénicité des sous-produits, puis de la toxicité sur la reproduction et de la tératogénicité.
Toxicité aiguë
Les premières évidences que l’environnement des piscines pouvait être toxique pour la santé respiratoire sont parvenues de rapports de cas faisant état d’intoxication aiguë à la suite d’une exposition accidentelle au chlore (Agabiti et al., 2001; Bonetto et al., 2006; Martinez & Long, 1995; Parimon, Kanne, & Pierson, 2004). Les effets d’une exposition aiguë à des doses élevées de Cl2 résultant d’explosions, de fuites ou d’un système de
désinfection défectueux sont maintenant bien connus. Les manifestations dépendent de l’intensité et de la durée de l’exposition. Les victimes peuvent présenter des symptômes d’irritation tels qu’un larmoiement transitoire, de la toux, un mal de gorge, une oppression thoracique et de la dyspnée, de même qu’une inflammation des voies respiratoires, des dommages à l’épithélium pulmonaire et une diminution de la fonction respiratoire (Bernard, 2011). Dans les cas les plus sévères, un œdème laryngé, des crises d’asthme, des brûlu-res chimiques des muqueuses des voies brûlu-respiratoibrûlu-res supérieubrûlu-res et inférieubrûlu-res et une pneumonie chimique, nommée pneumonite, peuvent survenir (Das & Blanc, 1993). Par ail-leurs, une exposition accidentelle au Cl2 ou au NCl3 peut mener à un syndrome d’irritation
bronchique aiguë -- Reactive Airways Dysfunction Syndrome ou RADS -- causé par la destruction de l’épithélium bronchique ainsi que par la libération de médiateurs de
l’inflam-mation et de l’activation directe des voies de l’inflaml’inflam-mation (Rosenberg, 2000). Dans la plupart des cas, les dommages pulmonaires sont causés par le Cl2, mais des cas dus à
une exposition aiguë aux chloramines dans des piscines insuffisamment ventilées ont éga-lement été rapportés aux États-Unis (Bernard, 2011). Des cas d’atteinte pulmonaire aiguë suite à des expositions accidentelles à des désinfectants ou à des agents de nettoyage contenant du chlore ont été rapportés par divers auteurs (Karnak, Tanyel, Buyukpamukou, & Hicsonmez, 1996; Martinez et Long, 1995; Tanen, Graeme, & Raschke, 1999). Les dommages pulmonaires observés à la suite d’accidents sont habituellement transitoires et la fonction pulmonaire guérit entièrement en quelques semaines. Toutefois, l’inflammation des voies respiratoires peut persister durant plusieurs mois (Bonetto et al., 2006).
Le Service du répertoire toxicologique de la CSST (Gouvernement du Québec, 2000) a rapporté les valeurs suivantes sur les effets du Cl2 selon la concentration dans l’air :
Tableau 3 Relation dose-effets du chlore gazeux (Cl
2)
2Référence : Gouvernement du Québec (2000)
En outre, l’exposition aiguë au NCl3 est associée à une irritation des yeux ainsi qu’à des
symptômes respiratoires hauts dans la population générale et chez les travailleurs (Bonvallot et al., 2010). Le NCl3 et des dérivés chlorés peuvent se retrouver dans l’air de
2 VEMP : valeur d’exposition moyenne pondérée
VECD : valeur d’exposition de courte durée DIVS : danger immédiat pour la vie et la santé
certaines installations industrielles. Sanderson, Weber, et Echt (1995) ont noté la présence d’irritation oculaire et d’irritation des voies respiratoires supérieures (VRS) chez 90% des 340 travailleurs d’une usine de transformation de volaille potentiellement exposés au NCl3 et à des dérivés chlorés présents dans l’air. Cependant, aucune mesure
de NCl3 ne fut effectuée, rendant impossible l’établissement d’une relation dose-réponse
ou d’une association temporelle. Également, Hery et al. (1998) ont rapporté des symptômes oculaires et respiratoires hauts chez des travailleurs d’une usine de traitement de salades vertes, sans toutefois être en mesure de préciser avec exactitude à quel irritant les travailleurs étaient exposés. Finalement, King et al. (2006) ont démontré que les employés d’une usine de transformation de volaille plus exposés au NCl3 et au chlore,
selon leur zone de travail, avaient plus de symptômes tels que des sibilances, de la toux et un écoulement du nez, en comparaison aux travailleurs moins exposés de la même usine.
Toxicité chronique
Les études ont démontré que le NCl3, compte tenu du fait qu’il est peu soluble dans l’eau,
peut pénétrer aisément les voies respiratoires inférieures (VRI) des nageurs. Des dommages aux cellules bronchiolaires non-ciliées de Clara peuvent être causés en raison de la perméabilité de l’épithélium pulmonaire. Ceci peut donc entraîner une dysfonction ainsi que des effets secondaires lors d’une exposition continue au NCl3 (Bernard,
Carbonnelle, de Burbure, Michel, & Nickmilder, 2006; Bernard et al., 2003; Lagerkvist et al., 2004). Quelques auteurs ont démontré que le temps passé dans une piscine chlorée pouvait causer des changements dans la fonction pulmonaire et augmenter le risque d’asthme (Bernard et al., 2003, 2006; Jacobs et al., 2007). En contrepartie, une autre étude menée par Massin et al. (1998) n’a pas démontré cet effet. Ceci pourrait être attribuable au fait que l’asthme est une maladie multifactorielle et qu’il est difficile d’établir une association avec des facteurs de risque spécifiques (Bonvallot et al., 2010).
Divers mécanismes ont été proposés pour expliquer les dommages respiratoires en lien avec l’exposition aux piscines chlorées. Nous retrouvons l’inflammation des voies respiratoires (Bonetto et al., 2006; Grasemann, Tschiedel, Groch, Klepper, & Ratjen, 2007; Moreira et al., 2008; Perderson et al., 2009), le stress oxydatif (Varraso et al., 2002) et l’hyperperméabilité de l’épithélium pulmonaire (Bonetto et al., 2006; Carbonnelle et al., 2002, 2008).
Le fait de se trouver dans l’enceinte d’une piscine chlorée induit une perturbation rapide et transitoire de l’épithélium des voies respiratoires chez les nageurs récréatifs et de haut niveau ainsi que chez les enfants et le personnel de piscine, sans nécessairement mener à un développement concomitant de symptômes d’asthme (Carbonnelle et al., 2002). Une sensibilisation aux allergènes peut possiblement survenir à la suite d’inhalations répétées de sous-produits de la chloration, compte tenu de la survenue de changements structurels dans l’épithélium pulmonaire. Ces changements permettraient aux allergènes d’accéder plus facilement aux cellules présentatrices d’antigènes (Bernard, 2007). Par ailleurs, Tatsumi et Fliss (1994) ont démontré que les sous-produits de la chloration peuvent agir comme adjuvants chimiques et faciliter le passage d’allergènes à travers la barrière épithéliale en détruisant les jonctions cellulaires. Une augmentation de la perméabilité épithéliale peut alors survenir, comme en témoigne une élévation des niveaux sériques de surfactant associé aux protéines A et B (Carbonnelle et al., 2002). Ainsi, en conséquence à une exposition répétée aux sous-produits, il est théoriquement possible de développer des allergies, de l’hyperréactivité bronchique, de l’asthme ainsi que d’autres troubles des voies respiratoires.
Cancérogénicité, génotoxicité et mutagénicité
Bien que des différences existent entre l’eau de consommation et l’eau des piscines au regard de la présence des sous-produits de désinfection et de la voie d’exposition à ces derniers, Richardson et al. (2010) ont démontré que les deux types d’eau possèdent une mutagénicité équivalente. À notre connaissance, une seule étude concernant spécifiquement la génotoxicité de l’eau des piscines est disponible dans la littérature. Il s’agit de l’étude de Kogevinas et al. (2010) qui démontre que la génotoxicité semble être augmentée et associée avec les THM bromés, mais pas avec le CHCl3. En effet, les
auteurs ont mis en évidence une augmentation significative (β3 = 5,27 [1,80-8,75], p =
0,004) de la mutagénicité urinaire après une exposition de 40 minutes dans une piscine chlorée, en association avec une concentration de CHBr3 expiré plus élevée.
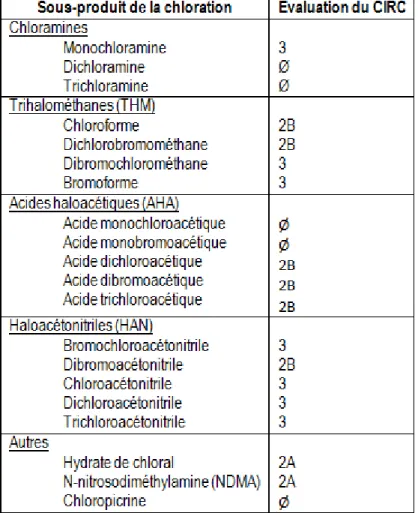
Le Tableau 4 détaille les risques de cancérogénicité pour l’homme des principaux sous-produits de la chloration tels qu’évalués par le Centre international de la Recherche sur le Cancer (CIRC). À l’heure actuelle, de nombreux sous-produits, particulièrement ceux spécifiques à l’eau des piscines, ne peuvent pas être classés en raison du manque
3 Le coefficient β représente un changement du niveau du biomarqueur pour une différence de 1 μg/m3 de THM mesuré
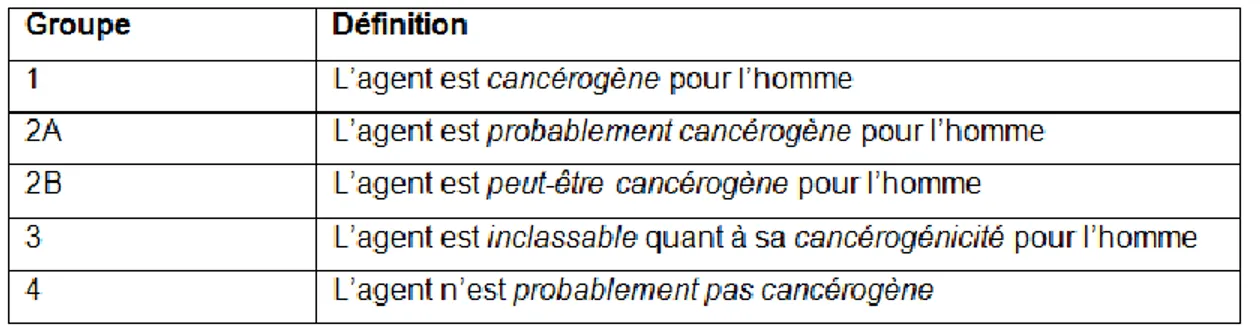
d’études et d’information disponible. Le Tableau 5 explique la classification du CIRC. Brièvement, la classification est fondée sur une révision rigoureuse de la littérature scientifique menée par un groupe d’experts indépendants. Les données disponibles examinées portent sur les situations lors desquelles les humains sont exposés à un agent, sur les études épidémiologiques concernant la carcinogénicité chez l’humain, sur les études expérimentales évaluant la carcinogénicité chez les animaux et sur les études investiguant les mécanismes liés au développement du cancer (International agency for research on cancer, 2014).
Tableau 4 Évaluation du CIRC sur les risques de cancérogénicité pour
l'homme des sous-produits de la chloration
Légende: Ø ; pas de donnée disponible