Un niveau minimal d’un homologue potentiel de la
phosphoinositide-phosphatase SAC1 chez Plasmodium
falciparum semble requis pour assurer la survie durant le
stade érythrocytaire asexué
Mémoire
Catherine Thériault
Maitrise en microbiologie-immunologie
Maitre ès sciences (M. Sc.)
Québec, Canada
© Catherine Thériault, 2017
Un niveau minimal d’un homologue potentiel de la
phosphoinositide-phosphatase SAC1 chez
Plasmodium falciparum semble requis pour assurer
la survie durant le stade érythrocytaire asexué
Mémoire
Catherine Thériault
Sous la direction de :
iii
Résumé
La malaria, endémique dans 91 pays tropicaux et sub-tropicaux, est l’une des maladies infectieuses les plus mortelles chez l’humain. Le fardeau de cette maladie porte principalement sur l’Afrique, qui compte plus de 90% des cas d’infections ainsi que des morts enregistrés, la majorité étant des enfants en bas âge. Des cinq espèces de parasites du genre Plasmodium qui peuvent causer la maladie chez l’humain, Plasmodium falciparum est de loin la plus mortelle et la plus étudiée. La résistance aux médicaments actuels et l’absence d’un vaccin préventif procurant une immunité de longue durée démontrent l’urgent besoin de trouver de nouvelles cibles thérapeutiques. Chez les cellules eucaryotes, l’identité des organites cellulaires est définie par les phosphoinositides, des composants mineurs des membranes cellulaires, et maintenue grâce aux kinases et aux phosphatases impliquées dans leur métabolisme. Les rôles de certaines phospholipides-kinases dans plusieurs étapes critiques du cycle de vie de Plasmodium ont récemment été découverts, toutefois, rien n’est connu quant aux fonctions des phosphoinositides phosphatases de cet organisme. Les travaux décrits ci-dessous présentent une première caractérisation d’une protéine homologue à la famille des phosphoinositides phosphatases SAC1. Les résultats montrent que cette protéine est exprimée durant tout le cycle érythrocytaire asexué et qu’elle se localise au réticulum endoplasmique ainsi que potentiellement à l’appareil de Golgi. L’étude de lignées conditionnelles et knockout suggèrent qu’un niveau minimal de la protéine est nécessaire pour la survie du parasite durant le cycle érythrocytaire. En somme, la combinaison des résultats obtenus laisse penser que cette protéine pourrait avoir une fonction dans le système de sécrétion du parasite P. falciparum et qu’elle pourrait donc constituer une cible thérapeutique intéressante pour le développement de nouveaux antimalariaux.
iv
Abstract
Malaria is endemic in 91 tropical and sub-tropical countries and is one of the deadliest infectious human diseases. Africa has the highest burden with more than 90% of cases and malaria deaths registered yearly, mostly in children under 5 years-old. Despite the fact that infection in human can be caused by five Plamsodium species, infection by Plasmodium falciparum is the most severe and therefore the most studied. Resistance to antimalarials and the absence of a preventive vaccine show the urgent need of new therapeutic targets. In eukaryotic cells, organelles identity is defined by phosphoinositides, minor membranes components, and maintained by the kinases and phosphatases involved in their metabolism. The fact that certain kinases have roles in critical steps of Plasmodium life cycle has recently been acknowledged. However, the roles of the phosphatases are still unknown. My work presents a first characterization of a putative phosphoinositide phosphatase of the SAC1 family. Results provided show that the protein is expressed throughout the asexual blood stages and that it localizes to endoplasmic reticulum and potentially to the Golgi apparatus. Studies on knockdown and knockout strains suggest that a minimal amount of the protein is required during the asexual blood stages. In summary, the combination of the results presented suggests that the protein has an important function in the parasite P. falciparum secretion system and therefore, may represent an interesting potential target for drug development.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des figures ... vii
Liste des abréviations ... viii
Remerciements ... x
Avant-propos ... xi
Chapitre I ... 1
1. Introduction générale... 1
1.1. Le parasite Plasmodium falciparum ... 1
1.1.1. Informations générales ... 1
1.1.2. Épidémiologie et pathogénicité ... 1
1.1.3. Cycle de vie ... 3
1.1.4. Invasion du globule rouge et complexe apical ... 6
1.1.5. Prévention et traitements ... 8
1.2. Trafic protéique chez Plasmodium falciparum ... 14
1.2.1. Trafic interne au parasite ... 15
1.2.2. Export de protéines ... 17
1.3. Les phosphoinositides ... 18
1.3.1. Les phosphoinositides chez les eucaryotes : en bref ... 19
1.3.2. Phosphoinositides chez Plasmodium falciparum ... 24
1.4. La famille des protéines à domaine SAC1 ... 26
1.4.1. Protéine Sac1 chez la levure ... 27
1.4.2. Homologues de Sac1 chez les mammifères et l’humain ... 28
1.5. Problématique ... 29
Chapitre II ... 31
2. Minimal amounts of a putative Plasmodium falciparum SAC1 phosphoinositide-phosphatase homologue are likely required for survival during the asexual erythrocytic stage ... 32
2.1. Résumé ... 33
vi
2.3. Introduction ... 33
2.4. Results and Discussion ... 35
2.4.1. Identification of a Plasmodium falciparum putative SAC1 phosphoinositide-phosphatase homologue. ... 35
2.4.2. PfSAC1 is constitutively expressed throughout the asexual blood stages ... 35
2.4.3. PfSAC1 is found in the endoplasmic reticulum and enriched at/close to the Golgi apparatus. ... 38
2.4.4. Minimal amounts of PfSAC1 are likely required for survival of the asexual blood stages……. ... 42
2.5. Conclusion ... 44
2.6. Materials and Methods ... 44
2.6.1. Parasite Culture ... 44
2.6.2. Vector Construction, Transfection and Southern Blotting ... 44
2.6.3. Western Blotting ... 45
2.6.1. Fluorescence Imaging ... 47
2.6.2. Conditional Knockdown analysis ... 47
2.6.3. Knock out attempts by single cross-over using selection linked-integration for targeted gene disruption (SLI-TGD). ... 48
2.7. References ... 48 2.8. Acknowledgements ... 52 2.9. Author Contributions... 52 2.10. Supplementary information ... 52 Chapitre III ... 54 3. Discussion et conclusion ... 55 3.1. Discussion ... 55 3.2. Conclusion et perspectives ... 57 Bibliographie ... 59
vii
Liste des figures
Figure 1. Cycle de vie de Plasmodium falciparum.
Figure 2. Invasion du globule rouge par Plasmodium falciparum.
Figure 3. Modèle de transport des protéines apicales.
Figure 4. Schéma de P. falciparum dans le globule rouge.
viii
Liste des abréviations
ACT
Artemisinin-based combination therapy
AMA1
Apical membrane antigen 1
ANTH
AP180 N-terminal homology
AQ
Amodiaquine
ARF1
ADP-ribosylation factor 1BIP
Binding immunoglobulin proteinC2
Conserved region-2 of protein kinase C
CD36
Cluster of differentiation 36
CK
Cellules de Kupffer
COP-I
Coat protein complex I
COP-II
Coat protein complex II
CQ
Chloroquine
CSA
Chondroitin sulfate A
CSP
Circumsporozoïte protein of P. falciparum
C-terminal
Carboxy-terminal
EBL
Erythrocyte binding ligand
EEP
Endonuclease, exonuclease phosphatase
ENTH
Epsin NH2-terminal homology
FERM
4.1, ezrin, radixin, moiesin
FYVE
Fab1, YOTB, Vac1, EEA1
GOLPH3
Golgi phosphoprotein 3
GR
Globule rouge
Hb
Hémoglobine
ICAM-1
Intercellular Adhesion Molecule-1
MF
Méfloquine
MII
Moustiquaires imprégnés d’insecticides
MSP1
Merozoite surface protein 1
mTOR
Mammalian target of rapamycin
mTORC1
Mammalian target of rapamycin complex 1MVP
Membrane de la vacuole parasitaire
N-terminal
Amino-terminal
OMS
Organisation mondiale de la santé
PDK1
Phosphoinositide-dependent kinase 1
PDZ
Postsynaptic density 95, disk large, zonula occludens
PEXEL
Plasmodium export element
PfCRT
Plasmodium falciparum Chloroquine Resistance Transporter
ix
PfRh
Plasmodium falciparum reticulocyte binding-like
PfSUB1
Plasmodium falciparum subtilisin-like 1
PfSUB2
Plasmodium falciparum subtilisin-like 2
PH
Pleckstrin homology domain
PI
Phosphatidylinositol
PI3K
Phosphatidylinositol-3-kinase
PI3P
Phosphatidylinositol-3-phosphate
PIP
Phosphoinositides
PKC
Protéine kinase C
PLP1
Perforin-like protein 1
PNEP
PEXEL-negative exported proteins
PROPPINS
β-propellers that bind phosphoinositides
PTB
Phosphotyrosine binding
PTEN
Phosphatase and tensin homolog
PTEX
Translocon for exported proteins
Px
Phox homology domain
RAMA
Rhoptry associated membrane antigen
RAP1
Rhoptry associated protein 1
RE
Réticulum endoplasmique
RON2
Rhoptry Neck protein 2
Sac1
Suppressor of actin 1
SPECT
Sporozoite microneme protein essential for cell traversal
SS-PTS
Signal sequence plastid targeting signal
tER
Transitional endoplasmic reticulumTGN
Trans-Golgi network
TSP
Thrombospondin
VCAM-1
Vascular cell adhesion protein 1
x
Remerciements
Je voudrais d’abord adresser mes remerciements au Dr Dave Richard qui m’a accueillie dans son laboratoire pour la durée de ma maîtrise et a supervisé mes travaux. Sa présence et sa disponibilité dans le laboratoire ont grandement facilité mon cheminement.
J’ai eu la chance de côtoyer des coéquipiers, passés et présents, formidables qui m’ont apporté une aide, un soutien quotidien ainsi que plusieurs fous rires qui ont été plus qu’appréciés. Mon expérience en laboratoire n’aurait certainement pas été la même sans vous.
Une merci spécial à ma famille et tous mes amis, scientifiques ou non, qui ont été présents à chaque étape de mon parcours. Ils ont su non seulement célébrer mes réussites, mais aussi me remonter le moral dans mes moments plus difficiles. Je n’aurais jamais réussi sans votre aide. Merci de tout cœur.
Finalement, merci aux Instituts de Recherche en Santé du Canada et à la Fondation du CHU de Québec pour le soutien financier qu’ils ont apportés et sans lequel ce projet n’aurait pu être mené.
xi
Avant-propos
Le chapitre 2 est rédigé en anglais pour permettre sa publication dans le journal Scientific Reports. Cet article, dont je suis le premier auteur, a été soumis le 6 septembre 2017. Pour la préparation de cet article, j’ai effectué toutes les manipulations, ainsi que la rédaction avec l’aide de mon directeur de recherche le Dr Dave Richard qui figure dans les auteurs avec moi. Les références cités dans l’article se trouvent à la fin du chapitre 2, tandis que celles utilisées dans le reste du mémoire figurent à la toute fin du manuscrit.
1
1
1. Introduction générale
1.1. Le parasite Plasmodium falciparum
1.1.1. Informations générales
Le paludisme est l’une des maladies infectieuses les plus importantes et les plus anciennes dans le monde. Les premières évidences de la reconnaissance de la maladie remontent aux civilisations de l’antiquité, plus particulièrement la Chine de 2700 av. J.-C1
. L’agent infectieux a donc évolué de concert avec la race humaine et s’y est très bien adapté2. De façon similaire, la mise en contact constante avec la maladie aurait effectué une pression sélective sur le génome humain et contribué à la conservation et à la dissémination dans la population de désordres génétiques regroupés sous le nom d’hémoglobinopathies. La similarité de distribution géographique de la malaria et des populations avec une plus grande fréquence de ces désordres suggère que ces derniers donnent un avantage de survie lors de l’infection2,3. La malaria humaine est causée par des parasites protozoaires du genre Plasmodium. Ces derniers appartiennent au phylum des Apicomplexa comprenant un certain nombre de parasites qui peuvent infecter l’humain. Les organismes de ce groupe ont comme particularité un regroupement d’organites sécrétoires à leur apex. Ces trois organites : les rhoptries, les micronèmes et les granules denses, sont uniques aux parasites et exécutent une sécrétion protéique séquentielle ainsi que hautement régulée essentielle à l’invasion de la cellule hôte4,5. La transmission de l’infection à l’humain est faite par l’entremise du moustique vecteur Anopheles femelle durant un repas sanguin. Jusqu’à récemment, on dénombrait quatre espèces de Plasmodium connues pour causer la maladie chez l’humain soit P. vivax, P. ovale, P. malariae et P. falciparum. Depuis quelques années, on compte également l’espèce simienne P. knowlesi dans les espèces pathogènes humaines et qui infligent une infection qui peut être sévère dans certain cas6. C’est toutefois P. falciparum qui est responsable de la forme la plus grave de la maladie et auquel on attribue le plus grand nombre de décès7,8.
1.1.2. Épidémiologie et pathogénicité
La malaria est endémique dans 91 pays et territoires tropicaux et subtropicaux. Elle met à risque près de la moitié de la population mondiale, ce qui en fait une des priorités de l’Organisation mondiale de la santé (OMS). Entre 2000 et 2015, l’organisme estime que la lutte pour contrôler la maladie a permis de réduire de 41% la fréquence des nouveaux cas et de 62% les taux de mortalité associés. Malgré ces améliorations importantes, l’organisme recense, pour l’année 2015 uniquement, 212 millions de cas et 429 000 morts dont la majorité sont des enfants en bas âge (0-5 ans)7. Chez ces derniers, la malaria constitue la troisième maladie infectieuse la plus mortelle, après
2 la pneumonie et la diarrhée9. Bien que le paludisme soit un enjeu important à l’échelle mondiale, c’est en Afrique, principalement dans la région subsaharienne, que la menace est la plus grande. Ces régions sont en effet affligées de la présence de P. falciparum et enregistrent 90% des cas ainsi que 92% des décès reliés à la maladie rapportés annuellement7. Dans ces zones hautement endémiques, les cas de malaria sévère et de morts sont associés principalement aux jeunes enfants comme mentionné plus haut. Il semble que l’exposition à répétition au pathogène permet aux adultes et enfants plus âgés de développer un certain niveau d’immunité contre P. falciparum qui les rend moins sujets à contracter une infection sévère10. Le paludisme peut être très néfaste chez les femmes en première grossesse avec des effets variant selon le niveau d’immunité de la mère. Chez les femmes enceintes vivant dans des zones faiblement endémiques, où les populations n’ont aucune immunité contre la maladie, les risques associés à l’infection sont la mort des bébés à la naissance et la malaria sévère chez la mère avec un haut risque d’hypoglycémie10. Dans les zones fortement endémiques, les risques sont l’anémie chez la mère, ainsi qu’un faible poids de naissance des enfants11.
P. falciparum est un parasite intracellulaire obligatoire qui se réplique dans les cellules de l’hôte. C’est lorsque le parasite se réplique rapidement dans les globules rouges (GR) humains que les signes de la maladie apparaissent. Les premiers symptômes de la maladie, non-spécifiques, se manifestent sous forme de fièvre, de maux de tête, de troubles digestifs (nausées, vomissements, diarrhées), de fatigue et de douleurs musculaires. Ils sont suivis par les crises, survenant plus ou moins aux 48 heures, provoquant des frissons, une fièvre élevée et des sueurs importantes2,7. L’infection causée par P. falciparum peut devenir très sévère et provoquer de graves complications, comme la détresse respiratoire, une anémie sévère, des défaillances rénales et hépatiques, ou la malaria cérébrale10. L’appellation malaria cérébrale n’est pas uniquement utilisée pour désigner l’accumulation de parasites dans la microvasculature du cerveau, mais plutôt comme un état comateux dû au parasite et peut donc être causé par différents facteurs10,12. La réplication exponentielle des parasites, la forte réaction inflammatoire déclenchée chez l’hôte ainsi que la cytoadhérence des GR infectés par les parasites matures sont des facteurs contribuant à la pathogénicité et à la mortalité de la malaria sévère10,13. La cytoadhérence est caractéristique de P. falciparum et cause l’obstruction des microvaisseaux sanguins. Cela a pour conséquence un défaut d’irrigation des organes situé en aval et leur défaillance2
.
Les GR infectés par des parasites aux stades matures, trophozoïtes et schizontes, sont plus rigides que des GR non infectés ou infectés par le stade plus précoce14–16. Ils devraient donc être éliminés lors de leur passage dans la rate, car la rigidité est une caractéristique des vieux érythrocytes qui
3 doivent être retirés de la circulation sanguine17. La cytoadhérence des GR infectés constitue un avantage considérable pour le parasite, puisque leur séquestration sur les parois des vaisseaux sanguins prévient leur élimination dans la rate. Les ligands responsables de la cytoadhésion font partie de la famille PfEMP1 (P. falciparum erythrocyte membrane protein 1). Ils sont exprimés à la surface de l’érythrocyte infecté dans des structures «knob» et lient différentes adhésines vasculaires de l’hôte telles que CD36 (cluster of differentiation 36), ICAM-1 (Intercellular Adhesion Molecule-1), TSP (thrombospondin), VCAM-1 (Vascular cell adhesion protein 1) et CSA (chondroitin sulfate A) chez la femme enceinte17,18. Les protéines PfEMP1, codées par les gènes var, sont hautement antigéniques et variables. Au total, il existe 60 gènes chez le parasite qui codent pour différentes isoformes de cette protéine19. Chez un parasite, un seul gène var peut être exprimé à la fois, suivant le principe d’exclusion allélique17,18
. La répression de ces gènes de virulence est régulée par les mécanismes épigénétiques de méthylation des histones20. Les protéines PfEMP1 sont très polymorphiques et sont aussi associées au phénomène de variation antigénique21–23. La variation antigénique est un avantage majeur pour le parasite puisqu’elle permet l’évasion immunitaire24. Chez un individu infecté, la grande majorité des parasites expriment à la surface du GR la même version de la protéine PfEMP1. La réponse immunitaire de l’hôte est donc dirigée uniquement contre cet isoforme. Lorsque les défenses immunitaires viennent à bout de la population de parasites exprimant cette version de la protéine, une autre population prend le dessus et les cellules immunitaires doivent produire une réponse dirigée contre ces nouveaux antigènes. Le nombre de gènes var, combiné au caractère hautement polymorphique des protéines PfEMP1 fait en sorte que le parasite peut créer un nombre presque illimité des protéines de surface responsables de la cytoadhésion23.
1.1.3. Cycle de vie
Le cycle de vie du parasite P. falciparum est complexe et peut être divisé en trois grandes étapes, réparties dans deux hôtes différents (Fig. 1). On nomme ces étapes : le stade sporogonique chez le moustique vecteur Anopheles, le stade hépatique et le stade érythrocytaire qui sont tous les deux complétés chez l’humain infecté. Durant le cycle, le parasite se métamorphose en plusieurs formes qui ont, pour la plupart, comme fonction d’envahir différents types cellulaires.
1.1.3.1.
Le stade sporogonique
Le stade sporogonique dure de 2 à 3 semaines25 et débute lorsqu’un moustique Anopheles femelle enceinte effectue un repas sanguin sur un être humain infecté par le parasite P. falciparum. Lors de ce repas, le moustique ingère des gamétocytes formés durant le cycle érythrocytaire (section 1.1.3.2.2). Une fois dans l’estomac de l’insecte, le changement de température et de pH ainsi que
4 l’acide xanthurénique, une molécule dérivée de l’insecte, permettent la formation des gamètes26,27
. La fusion des formes sexuées résulte en un zygote qui, après méiose et recombinaison génétique donne une cellule motile nommée ookinète. Cette forme du parasite est la seule qui est produite par reproduction sexuée et la seule dont le génome est diploïde28. Une fois formé, l’ookinète se transporte activement hors du repas sanguin en digestion pour rejoindre la paroi de l’estomac où il entreprend la traversée des cellules épithéliales afin d’atteindre la lame basale. Dans les cellules lésées par la traversée du parasite, l’expression de l’enzyme oxyde nitrique synthase est augmentée, ce qui induit une augmentation de la production d’oxyde nitrique nocif au parasite29. Les ookinètes qui survivent à la traversée de l’épithélium se transforment en oocystes qui forment un grand nombre de sporozoïtes avant de se rompre pour relâcher ces derniers dans la cavité corporelle du moustique28. Les sporozoïtes sont par la suite transportés par l’hémolymphe vers les glandes salivaires de l’insecte où ils subissent des changements antigéniques et de motilité qui les rendent hautement infectieux pour l’humain30,31
. Encore une fois, les parasites sont soumis aux défenses du moustique durant la migration et seule une fraction des sporozoïtes produits va se rendre intact aux
Figure 1. Cycle de vie de Plasmodium falciparum. Les flèches rouges montrent le cycle à
l’intérieur du moustique Anopheles et les flèches bleues représentent les stades retrouvés au niveau de l’être humain. (©: DPDx CDC's web site for laboratory identification of parasites) Traduit par Catherine Thériault.
5 glandes salivaires32. La présence des parasites dans ses glandes salivaires pousse l’insecte vecteur à procéder à un second repas sanguin sur un humain, lui injectant l’agent infectieux dans le derme. Les sporozoïtes, compétents pour l’invasion des cellules de foie humaines, entrent dans la deuxième phase du cycle qui résulte ultimement en une infection productive et symptomatique chez le nouvel hôte infecté.
1.1.3.2.
Les stades chez l’hôte humain
1.1.3.2.1. Le stade hépatique
Lorsque les sporozoïtes sont injectés dans le derme humain par la morsure d’un moustique vecteur infecté, ils doivent obligatoirement compléter un cycle de réplication unique et asymptomatique dans les cellules hépatiques33. Ils migrent hors du site d’injection pour rejoindre le réseau vasculaire et traversent les parois des vaisseaux afin d’entrer dans la circulation sanguine. Ils sont ensuite véhiculés vers les sinusoïdes hépatiques, des vaisseaux dont la paroi est tapissée de cellules épithéliales discontinues et de macrophages appelés cellules de Kupffer (CK)25. Les sporozoïtes doivent alors franchir la barrière sinusoïdale en traversant les CK ou les cellules épithéliales34 pour atteindre les cellules ciblées pour l’infection : les hépatocytes. Une fois dans le parenchyme hépatique, les sporozoïtes traversent plusieurs hépatocytes avant d’en infecter un35. Ce processus migratoire actif les prépare à l’infection en permettant l’exocytose des micronèmes, des organites apicaux, qui sont essentiels à l’invasion des cellules et à la formation d’une vacuole autour du parasite (vacuole parasitaire ou VP)36. Une étude publiée récemment a montré que des parasites mutants pour les protéines SPECT (sporozoite microneme protein essential for cell traversal) et SPECT2 (aussi nommée PLP1 (perforin-like protein 1)), deux protéines contenues dans les micronèmes, sont incompétents à la fois pour la traversée des cellules humaines et pour l’infection subséquente des hépatocytes37. Une fois dans l’hépatocyte, le parasite se transforme et se réplique jusqu’à causer la rupture de la cellule, libérant de façon générale de 20 000 à 40 000 mérozoïtes dans la circulation sanguine38.
1.1.3.2.2. Le stade érythrocytaire
La libération des mérozoïtes dans le sang marque le début du stade érythrocytaire symptomatique. Les parasites effectuent le contact avec les GR et procèdent à leur infection de façon très efficace; ils sont exposés aux défenses du système immunitaire moins d’une minute (l’invasion est détaillée à la section 1.1.4)39. Tout de suite après l’invasion, le mérozoïte est sous la forme nommée anneau et entouré d’une membrane appelée la VP39. Durant le cycle, P. falciparum se transforme et passe par deux autres phases de son développement, trophozoïte et schizonte. Durant le cycle, l’érythrocyte
6 subi plusieurs modifications ayant pour but de le rendre adéquat à la survie du parasite2. Au stade trophozoïte, l’hémoglobine du GR commence à être consumée dans la vacuole digestive, afin de contenir sa toxicité, ce qui produit de l’hème non toxique pour le parasite40. Des protéines du parasite sont aussi insérées dans la membrane du GR afin de permettre l’importation de nutriments essentiels2. Ce remodelage de la cellule hôte permet à P. falciparum non seulement de survivre, mais également de s’évader du système immunitaire41
. Au terme du cycle érythrocytaire, les schizontes se rompent et libèrent de nouveaux mérozoïtes dans la circulation sanguine qui infectent de nouveaux GRs pour poursuivre le cycle39. Sous la pression de facteurs de stress, une portion des parasites au stade anneau vont suivre une voie de différenciation en gamétocytes, responsables de la dissémination de la maladie dans la population humaine par l’entremise du moustique vecteur8,42.
1.1.4. Invasion du globule rouge et complexe apical
P. falciparum étant un parasite intracellulaire obligatoire, l’invasion des cellules de l’organisme hôte constitue une étape cruciale pour sa survie et son développement. Certains types de parasites, comme Leishmania, entrent dans les cellules cibles par l’entremise d’un mécanisme de l’hôte (par phagocytose dans le cas de cet exemple)43. P. falciparum, comme les autres organismes du phylum Apicomplexa, a développé son propre mécanisme d’invasion et est exceptionnellement bien adapté à l’invasion des GR44
.
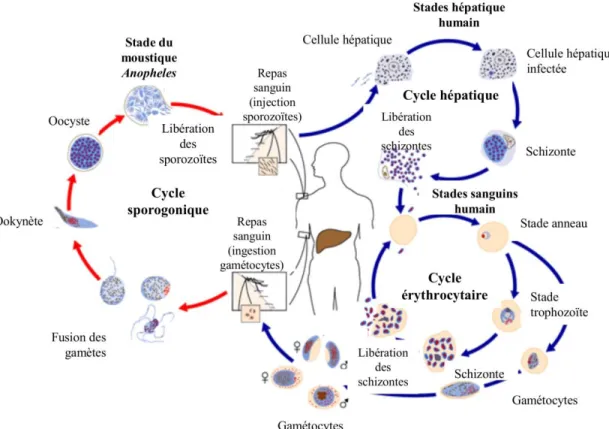
En plus des organites et de la structure du cytosquelette normalement trouvés chez les cellules eucaryotes, le mérozoïte possède des organites sécrétoires qui lui sont propres (Fig. 2A). Le complexe formé des micronèmes, des granules denses et des rhoptries est localisé à l’apex du parasite, ce qui lui a valu le nom de complexe apical. Toutes les formes invasives du parasite (sporozoïte, ookinète et mérozoïte) ont une morphologie qui se ressemble et possèdent le complexe apical ce qui démontre l’importance de cette structure dans les processus d’invasion. Afin de compléter l’invasion, les organites apicaux effectuent une sécrétion protéique séquentielle et hautement régulée4 qui peut être divisée en plusieurs étapes décrites ci-dessous (Fig. 2B).
7 Avant même la rupture de la cellule hôte, certaines protéines du mérozoïte essentielles à l’invasion subissent une étape de préparation qui les rend aptes à envahir un nouveau GR. Ainsi, des protéases dites subtilisin-like (PfSUB1 et PfSUB2) sont relâchées dans la VP et procèdent à la protéolyse des protéines SERA45,46, de MSP1 (merozoite surface protein 1) et de plusieurs autres protéines de surface du mérozoïte47–49.
Une fois libre dans la circulation sanguine, les bas niveaux de potassium auxquels le mérozoïte est exposé déclenchent une libération de calcium dans le parasite qui active la sécrétion à sa surface de
Apicoplaste Mitochondrie Microtubule Protéines du manteau Anneau polaire Micronème Rhoptrie Granules denses Ribosomes Noyau A B
Figure 2. Invasion du globule rouge par Plasmodium falciparum. A) Anatomie du mérozoïte.
Traduit par Catherine Thériault. B) Étapes de l’invasion du globule rouge. 1. Attachement à la surface de l’érythrocyte par des molécules de surface. 2. Réorientation et formation de la jonction serrée. 3-4. Le moteur d’actomyosine tire le parasite à l’intérieur du globule rouge. La jonction serrée se déplace sur la surface du parasite. 5. Invasion complétée. Les images sont tirées de : Cowman, A. F. & Crabb, B. S. Invasion of red blood cells by malaria parasites. Cell 124, 755– 766 (2006). 1 2 3 4 5
8 protéines d’adhésion qui résident dans les micronèmes50–52
. Les protéines sécrétées permettent donc au parasite de s’attacher faiblement à un nouveau GR lorsqu’ils entrent passivement en contact.
Une fois ce contact primaire établi, le mérozoïte entreprend de se réorienter de manière à ce que son apex se retrouve face à la surface de l’érythrocyte53
. Les protéines erythrocyte binding ligand (EBL) et Plasmodium falciparum reticulocyte binding-like (PfRh) se lient à des récepteurs présents sur la surface du GR4,51,52. L’attachement du mérozoïte au GR est alors irréversible et l’invasion est engagée4. Le bon déroulement du processus nécessite la formation d’une jonction serrée. Les rhoptries sont alors sollicitées et sécrètent la protéine RON2 (Rhoptry Neck protein 2) qui s’insère dans la membrane de l’érythrocyte et permet l’assemblage du complexe RON formant un point d’ancrage et de traction dans la membrane de la cellule hôte. La protéine du parasite AMA1 (apical membrane antigen 1) s’associe à RON2 pour créer le lien entre les deux cellules. Les protéines et les lipides du bulbe des rhoptries nécessaires à la formation de la VP sont ensuite sécrétés4,53. La jonction serrée qui est formée sert de point focal pour le moteur d’actomyosine du parasite. Au fur et à mesure que la tête de myosine avance sur les filaments d’actine, elle tire le parasite à l’intérieur du GR, la jonction serrée se déplaçant de façon concomitante sur la surface du parasite jusqu’à ce qu’il soit complètement inséré dans la cellule hôte54–56
. La VP se forme autour du parasite simultanément à son entrée dans la cellule. Une fois le parasite entièrement inséré dans le globule rouge et entouré de sa VP, il est sous la forme anneau4.
Les acteurs moléculaires impliqués dans l’invasion de l’érythrocyte sont essentiels au développement et à la survie du parasite. Ils représentent donc des cibles thérapeutiques potentiellement intéressantes pour bloquer le cycle érythrocytaire symptomatique.
1.1.5. Prévention et traitements
Les stratégies de lutte contre le paludisme dans les populations humaines sont diverses et comprennent le contrôle du vecteur et la chimioprévention. La section qui suit présente une vue rapide de chacune d’elles ainsi que de la résistance des parasites aux traitements qui est désormais une réalité bien installée qui menace les progrès réalisés dans un but d’élimination de la maladie. Bien que la vaccination ne soit pas encore un volet des programmes de prévention, plusieurs vaccins sont présentement en développement. Une section leur est aussi dédiée.
1.1.5.1.
Prévention
Les moyens les plus couramment utilisés pour contrôler le vecteur Anopheles sont la distribution de moustiquaires imprégnés d’insecticides (MII) pour protéger les dormeurs et l’épandage
9 d’insecticides à l’intérieur des bâtiments. La majorité des morsures de moustiques se produisent durant la nuit, ce qui rend l’utilisation des MII très efficace pour diminuer le nombre de morsures propageant de la maladie. De plus, des moustiquaires ayant une longue durée de vie ont été développés et ont donc l’avantage qu’ils évitent d’avoir à les retraiter souvent à l’insecticide. Puisqu’ils tuent les moustiques, ils protègent non seulement l’utilisateur, mais aussi la population et ils devraient pour cette raison être distribués dans toutes les régions où la malaria est endémique57,58. Leur utilisation a permis une diminution de moitié de l’incidence des cas de malaria et de mortalité chez les enfants de moins de cinq ans59,60. Les moustiquaires et les insecticides en agriculture ont cependant le désavantage d’avoir induit une pression sélective sur les moustiques. On voit donc apparaître des moustiques qui y sont résistants2. Les insecticides utilisés pour imprégner les MII étant tous à base de pyréthrine de synthèse, cette nouvelle réalité est d’autant plus inquiétante que le développement d’une résistance à un pyréthrine rend généralement le moustique résistant à toute la famille de composés61.
Afin de diminuer les risques d’incidence du paludisme chez les individus, la chimioprévention est utilisée chez deux groupes de personnes en particulier : les voyageurs62 et les femmes enceintes vivant en régions endémiques de malaria7. Dans les deux cas, le traitement qui sera choisi dépend du profil de susceptibilité aux antimalariaux dans cette région. En cas d’incertitude quant à la prophylaxie à donner, des traitements étant efficaces contre les parasites P. falciparum résistants (atovaquone–proguanil, doxycycline, primaquine, ou mefloquine) sont à privilégier2. L’infection à P. falciparum durant la grossesse est dangereuse autant pour la mère que pour le fœtus. La chimioprévention chez la femme enceinte a démontré des effets bénéfiques pour la santé de la mère et de l’enfant. Plusieurs études ont rapporté, chez des femmes en première ou seconde grossesse, une diminution de près de la moitié du risque d’anémie sévère, une diminution de 61% de la parasitémie prénatale et très peu de morts maternelles ont été enregistrées. Chez les bébés nés de ces premières ou secondes grossesses, la prophylaxie a permis d’augmenter la moyenne du poids à la naissance, de diminuer le nombre de petits poids de naissance et de diminuer de 46% la parasitémie placentaire63. Il y a quelques années, la chloroquine et la proguanil étaient recommandées en prophylaxie pendant la grossesse, mais l’émergence de parasites résistants à ces traitements a forcé les professionnels de la santé à recommander d’autres types de traitements. Le sulfadoxine-pyrimethamine est maintenant recommandé en Afrique de façon intermittente. Un minimum de trois doses est prescrit pour assurer une protection continue durant la grossesse. Malheureusement, on voit encore une fois des parasites résistants émerger et le besoin de trouver de nouveaux médicaments efficaces se fait sentir2,64.
10
1.1.5.2.
Vaccination
Le développement d’un vaccin anti-malaria fait l’objet d’un travail acharné depuis plusieurs années et représente en quelque sorte le but ultime de la lutte contre cette maladie. La difficulté à obtenir un produit efficace réside en l’habilité du parasite à échapper au système immunitaire de l’hôte et à s’acclimater à son environnement. De plus, il y a un manque de compréhension des interactions ayant cours entre le parasite et les cellules de l’hôte durant l’infection chez l’humain65. Quatre étapes du cycle de vie de P. falciparum ont été identifiées comme cibles potentiellement intéressantes pour la conception d’un vaccin : le cycle hépatique, le cycle érythrocytaire, la cytoadhérence et les stades sexués.
Les deux vaccins les plus avancés en développement s’attaquent à la phase hépatique en ciblant le sporozoïte. Réussir à créer un vaccin efficace contre le parasite à ce stade de son cycle de vie aurait comme avantage de bloquer le cycle érythrocytaire symptomatique et par le fait même la production de gamétocytes (voir section 1.3.2.2) ce qui permettrait d’éviter la propagation de la maladie dans la communauté66. Le vaccin à sous-unité RTS,S ciblant la protéine CSP (circumsporozoïte protein) du parasite, est le premier vaccin anti-malaria à recevoir l’approbation d’un organisme réglementaire67. En essai clinique de phase 3, deux groupes ont été formés. Le premier groupe était constitué d’enfants âgés de 6 à 12 semaines et le deuxième, d’enfants âgés de 5 à 12 mois. Dans les deux groupes, certains sujets ont reçu le vaccin RTS,S/AS01, d’autres un vaccin placebo et tous les participants ont reçus 3 doses de vaccin. L’efficacité vaccinale a été évaluée dans l’année suivant la troisième dose de vaccin68,69. Les résultats ont montré, une protection de 30% - 55% contre la malaria clinique et 26%-35% de protection contre la malaria sévère (enfants âgés de 6 à 12 semaines ou 5 à 12 mois respectivement) dans les 12-14 mois suivant la dernière dose68,69. Ces résultats étant jugés acceptables, le vaccin sera inclus, en combinaison avec d’autres antimalariaux, dans un programme pilote de chimioprévention saisonnière chez les enfants d’Afrique résidant en zones de transmission élevée67,70. Le vaccin PfSPZ est fabriqué avec des sporozoïtes complets atténués. Les parasites injectés se développent dans les cellules hépatiques jusqu’à former des schizontes, mais meurent avant d’être libérés dans la circulation sanguine. Les essais cliniques réalisés sur deux groupes de volontaires : un groupe d’individus n’ayant jamais été exposés au parasite au cours de leur vie et un groupe d’individus vivant en zone de transmission de malaria. Les résultats ont montré que la préexposition à la malaria des sujets du deuxième groupe semble diminuer la protection fournie par le vaccin. En effet, chez les sujets pré-exposés à la maladie, la protection à 6 mois après la dernière dose atteignait les 48,3%, alors que chez les sujets naïfs, elle atteignait les 70% lorsque l’infection était faite avec une souche homologue à celle contenue dans le
11 vaccin (contre 10% seulement lors d’une infection avec une souche hétérologue; cas plus susceptible d’arriver en conditions naturelles)65,71
. Il semblerait donc qu’une immunité naturelle acquise antérieurement à la vaccination interfère avec l’établissement de l’immunité fournie par le vaccin. Afin de contourner ce problème, il est suggéré de vacciner les enfants à un bas âge, c’est-à-dire avant même qu’ils aient été exposés à l’infection, ou alors d’augmenter le nombre de sporozoïtes dans la solution vaccinale66.
Les interactions du parasite avec les érythrocytes sont également intéressantes à cibler puisqu’elles sont responsables des symptômes de la maladie. Les principales molécules ciblées pour le développement d’un vaccin sont des molécules de surface impliquées dans l’invasion, telles que MSP1 ou PfRH572,73. Un essai clinique de phase II a été conduit pour un vaccin contenant du MSP1 pur, mais aucune protection significative n’a été notée74. Un vaccin avec la protéine PfRH5 serait particulièrement intéressant puisque c’est une protéine très conservée à travers les lignées de P. falciparum. Un essai conduit sur des primates non-humains a montré que le vaccin à base de protéine PfRH5 offre une protection contre le stade érythrocytaire de souches hétérologues de P falciparum75. Il est donc considéré comme prometteur et est toujours en développement. La cytoadhérence des érythrocytes infectés est un facteur aggravant dans l’infection au paludisme. Un vaccin à base de protéines impliquées dans les mécanismes d’adhérence s’avérerait également très intéressant. Les protéines hypervariantes PfEMP1 sont bien connues comme causant l’adhérence des érythrocytes infectés aux tissus de l’hôte (voir section 1.2). Cette hypervariabilité caractéristique rend toutefois le développement d’un vaccin très difficile. La plus conservée des PfEMP1 est codée par le gène VAR2CSA et représente une bonne cible vaccinale potentielle puisque moins variable76. Elle se lie à la protéine CSA dans le placenta, causant l’agrégation des GR infectés dans le tissu. Un tel vaccin fournirait une nouvelle arme thérapeutique pour éviter les effets néfastes de l’agrégation placentaire pour le fœtus et la mère et est présentement en essai clinique76.
Les vaccins de la dernière catégorie sont qualifiés de "altruistes", puisqu’ils ne permettent pas de prévenir l’infection chez l’individu vacciné, mais empêchent la transmission de la maladie en bloquant la gamétogenèse. Le développement de ces vaccins se concentre sur des protéines de surface des formes sexuées du parasite. Les essais réalisés en laboratoires sur des souris ont montré que des anticorps dirigés contre ces protéines permettent de bloquer efficacement la transmission77,78. Plus d’essais doivent être réalisés afin de déterminer si cela peut se transférer chez l’humain.
12
1.1.5.3.
Traitements
Le traitement de la malaria se fait souvent en combinaison de plusieurs drogues, ce qui diminue le risque d’échec de traitement et diminue le risque d’apparition de résistance.
1.1.5.3.1. Quinolines
La famille des quinolines comprend la Quinine ainsi que ses analogues : la Chloroquine (CQ), l’Amodiaquine (AQ) et Méfloquine (MF). Toutes ces drogues possèdent un anneau quinoline comme structure de base et tuent les parasites du cycle érythrocytaire qui dégradent l’hème (trophozoïtes et schizontes)79. La Quinine, l’ingrédient actif extrait de l’écorce de quinquina, est le plus vieux médicament utilisé contre la malaria. Elle est efficace contre la malaria sévère, mais sa toxicité à long terme a mené au développement des analogues préalablement nommés80. La CQ est elle aussi efficace contre les schizontes du stade érythrocytaire, mais pas contre le cycle hépatique ni contre les gamétocytes matures. Elle a largement été utilisée à partir des années 40 pour traiter toutes les infections à Plasmodium, mais l’apparition et la dissémination de résistances a forcé à se tourner vers d’autres stratégies thérapeutiques. Elle est encore aujourd’hui utilisée dans les rares régions du globe où les parasites y sont sensibles. La MQ est recommandée en prophylaxie et pour des traitements de courte durée dans les régions où la CQ n’est plus efficace80. L’effet délétère des quinolines sur les parasites est dû à l’interférence que créent ces drogues avec les mécanismes d’alimentation du parasite79
. Pour se nourrir dans les GR, P. falciparum digère l’hémoglobine (Hb) en acides aminés et en hème dans sa vacuole digestive (revu dans 40). Ce dernier étant toxique, le parasite le polymérise en cristaux d’hémozoïne non toxiques. Les quinolines empêchent la formation de l’hémozoïne, tuant ainsi les parasites.
1.1.5.3.2. Thérapies en combinaison à base d’artémisinine
La résistance aux antimalariaux couramment utilisés étant devenue un fléau mondial (voir section 1.4.3), les organismes réglementaires recommandent depuis plusieurs années l’artémisinine et ses dérivés (artesunate, artemether et artemotil) comme plans de traitement. Cette molécule active, issue de la plante Artemisia annua, est utilisée par les Chinois depuis plus de 2000 ans81. Dans la lutte contre le paludisme, elle présente les avantages d’être efficace contre les souches de parasites multi-résistantes82 et de tuer le stade anneau circulant dans le sang ainsi que les gamétocytes immatures et en cours de développement83,84 en plus des stades plus matures, ce qui diminue le temps d’élimination des parasites de l’organisme. Afin de diminuer le risque de l’émergence de résistance, l’utilisation des dérivés de l’artémisinine est depuis une vingtaine d’année conseillée en combinaison avec d’autres antimalariaux85
13 cette combinaison, l’artémisinine tue rapidement les parasites, alors que la seconde drogue à demi-vie plus longue va éliminer les parasites restants dans l’organisme86. L’apparition récente de
résistance aux dérivés de l’artémisinine (voir section 1.1.5.4) est un enjeu inquiétant, mais l’ACT reste malgré tout privilégiée, et approuvée par l’OMS, dans le traitement des infections à Plasmodium non compliquées. L’organisme recommande également une dose unique de primaquine, un gamétocyde, dans tous les plans de traitements87.
Le mécanisme d’action des dérivés de l’artémisinine est toujours inconnu bien que son activité semble dépendante de l’hème qui permet d’ouvrir l’anneau endoperoxide de sa structure10
. Les parasites sous artémisinine semblent mourir par stress oxydatif. L’étude de parasites résistants à ces composés a permis de mettre en évidence que l’artémisinine pourrait également inhiber une phosphatidylinositol-3- kinase (PI3K) et que de hauts niveaux de PI(3)P dans les parasites étaient associés à la résistance88.
1.1.5.4.
Résistance aux antimalariaux
Les thérapies basées sur l’artémisinine sont aujourd’hui le traitement le plus recommandé et le plus efficace pour les cas de malaria non compliqués. Ces nouvelles directives sont issues des problèmes d’échec de traitement à la CQ et aux sulfadoxine-pyriméthamines qui ont causé une augmentation de la mortalité infantile due à la malaria dans une période où la mortalité infantile en général diminuait86. Malheureusement, des parasites résistants à l’artémisinine sont apparus au Cambodge, menaçant la dernière option de traitement contre la maladie. Si la résistance s’étendait en Afrique, les conséquences seraient dévastatrices et feraient régresser les progrès réalisés dans l’élimination du paludisme depuis les dernières années. On en a d’ailleurs eu un avant-goût lors de la vague d’échec de traitement à la CQ, durant laquelle on avait enregistré une augmentation des morts infantiles dues à la malaria, et ce dans une période où les taux globaux de décès chez les jeunes enfants étaient en baisse86. Plusieurs mesures ont été mises en place afin d’éviter que la résistance à l’artémisinine ne s’étende à d’autres régions : diagnostic précoce et traitement approprié, diminution de la pression de la drogue, optimisation du contrôle du vecteur, ciblage des populations mobiles qui contribuent à la dispersion de la résistance et renforcement des systèmes de surveillance de la résistance86.
La protéine PfCRT (Plasmodium falciparum Chloroquine Resistance Transporter) est une pompe à proton responsable de la résistance à la CQ. Elle permet de transporter la CQ chargée positivement à l’extérieur de la vacuole digestive, empêchant ainsi la drogue d’interférer avec le processus de détoxification de l’hème89
14 les mécanismes de résistances restent eux aussi nébuleux. Toutefois, des analyses de séquences génomiques et transcriptionnelles de parasites issus de patients ayant montré une réponse plus lente au traitement donnent des pistes d’éléments de réponses. En effet, il semble que des mutations dans les protéines Kelch13 soient des marqueurs de résistance à l’artéminisine10,88.
L’apparition des résistances à tous les traitements présentement disponibles démontre l’urgence de trouver de nouvelles cibles thérapeutiques potentielles afin de développer de nouveaux traitements contre le parasite.
1.2. Trafic protéique chez Plasmodium falciparum
Durant le cycle érythrocytaire asexué, le parasite modifie complètement le GR afin de rendre cet environnement inhospitalier apte à sa survie et à son développement. Ces modifications, qui lui permettront d’importer les nutriments essentiels à sa survie, demandent un trafic intense de protéines du parasite vers la cellule hôte. La biologie de P. falciparum comporte des organites uniques comme l’apicoplaste ou encore les organites sécrétoires du complexe apical, auxquels un grand nombre de protéines doivent être dirigées de manière précise. Les processus de transport protéique effectués par le parasite étant critiques dans la poursuite de l’infection, ils représentent des cibles potentielles de grand intérêt pour le développement de nouveaux traitements antimalariaux. La section qui suit présente un aperçu des mécanismes impliqués dans les mouvements de protéines cruciaux à P. falciparum.
Afin d’être acheminées vers leurs destinations finales respectives, les protéines produites par le parasite doivent d’abord transiter par le réticulum endoplasmique (RE) et l’appareil de Golgi (ou voie sécrétoire de type eucaryote). Grâce à la séquence signal hydrophobe classique se trouvant à leur extrémité N-terminale, les protéines en cours de synthèse sont transloquées de manières co-traductionnelle dans la membrane du RE90,91. C’est la porte d’entrée du système de sécrétion. Une fois dans le RE, le peptide signal est clivé et les protéines seront repliées dans la bonne conformation par les protéines chaperonnes, puis incluses dans des vésicules de transport pour être acheminées à l’appareil de Golgi91,92. C’est dans ce compartiment cellulaire que les protéines sont triées, puis emmagasinées dans des vésicules qui les transporteront vers d’autres organites internes du parasite ou vers la membrane plasmique pour être exportées dans d’autres structures.
15
1.2.1. Trafic interne au parasite
Une fois entrées dans le système de sécrétion, les protéines sont marquées par des signaux qui diffèrent selon qu’elles soient destinées à l’apicoplaste, à la vacuole digestive ou aux organites sécrétoires apicaux90.
L’apicoplaste, un organite unique aux organismes du phylum Apicomplexa, est le vestige d’un chloroplaste acquis il y a des millions d’années par phagocytose d’une algue. Au fil de l’évolution, le génome contenu dans cet organite s’est transféré dans le noyau du parasite et les protéines pour lesquelles il code sont produites dans le cytoplasme par la machinerie parasitaire. Elles doivent donc être transportées post-traductionnellement vers l’apicoplaste pour effectuer leurs fonctions essentielles91. Le signal en N-terminal SS-PTS (signal sequence plastid targeting signal) additionnel au peptide signal classique de type RE/Golgi dirige l’empaquetage des protéines dans des vésicules qui sortent du RE et vont fusionner avec la membrane de l’apicoplaste91,93.
Certaines protéines destinées à la vacuole digestive y sont transportées directement du RE94. Toutefois, certaines enzymes de dégradation de l’Hb sont synthétisées sous forme de proenzyme qui contient un signal hydrophobe interne qui sert à leur insertion dans la membrane du RE pour le transport vers le cytostome; une structure qui permet l’endocytose de l’Hb de l’érythrocyte par le parasite en vue de sa digestion. Le cytostome fusionne ensuite avec la vacuole digestive, délivrant ainsi les proenzymes qui sont clivées en enzymes nécessaire à la dégradation de l’Hb95
.
Les rhoptries, les micronèmes et les granules denses, les organites formant le complexe apical, ont un rôle crucial dans l’invasion des cellules de l’hôte par P. falciparum. Uniques au parasite, elles représentent de potentielles cibles thérapeutiques intéressantes. Toutefois, les signaux spécifiques de recrutement de protéines dans des vésicules destinées à ces différents organites sont encore incompris. Il est maintenant connu que la formation de ces organites sécrétoires est due à la fusion de vésicules ayant bourgeonné de l’appareil de Golgi96
. Il est donc logique que la majorité des protéines destinées à ces organites possèdent un signal sécrétoire hydrophobe classique leur permettant de suivre la voie sécrétoire de type RE/Golgi97. Chez les cellules mammifères ainsi que chez Toxoplasma, un autre Apicomplexa, le tri des protéines membranaires adressées aux organites apicaux est effectué par des protéines adaptatrices cytosoliques. Ces dernières lient des motifs, spécifiant la destination finale, localisés sur la queue cytoplasmique des protéines membranaires pour les regrouper dans des vésicules et recruter les protéines de manteau nécessaires au bourgeonnement des vésicules98,99. Cependant, toutes les protéines apicales ne possèdent pas une queue cytoplasmique et doivent donc être recrutées et transportées selon un autre mécanisme. Une
16 étude suivant le transport de la protéine de rhoptries RAP1 (Rhoptry associated protein 1) a permis d’élaborer un modèle (Fig. 3) pour le transport des protéines dépourvues d’un signal cytoplasmique. Selon ce modèle, la protéine RAP1 située dans la lumière du Golgi serait recrutée par la protéine escorte RAMA (Rhoptry associated membrane antigen) dans un complexe protéique au niveau des radeaux lipidiques de la membrane de la face trans de l’appareil de Golgi. Ainsi, les protéines destinées aux rhoptries, aux micronèmes et aux granules denses, seraient regroupées en agrégats dans des régions distinctes (de par leur composition protéique et lipidique) de la membrane de l’appareil de Golgi pour quitter le compartiment dans des vésicules différentes et être acheminées vers leurs destinations respectives100. Les molécules identifiant les différentes vésicules sont encore inconnues et les phosphoinositides (PIP), des lipides membranaires impliqués dans l’identification des compartiments cellulaires, ont été suggérés.
Figure 3. Modèle de transport des protéines apicales. L’exemple donné ici est celui du modèle
de transport proposé pour les protéines destinées aux rhoptries. Fait par Catherine Thériault. Adapté de Richard D, Kats LM, Langer C, et al. Identification of rhoptry trafficking determinants and evidence for a novel sorting mechanism in the malaria parasite Plasmodium falciparum. PLoS Pathogens. 2009;5(3):e1000328. doi:10.1371/journal.ppat.1000328.
17
1.2.2. Export de protéines
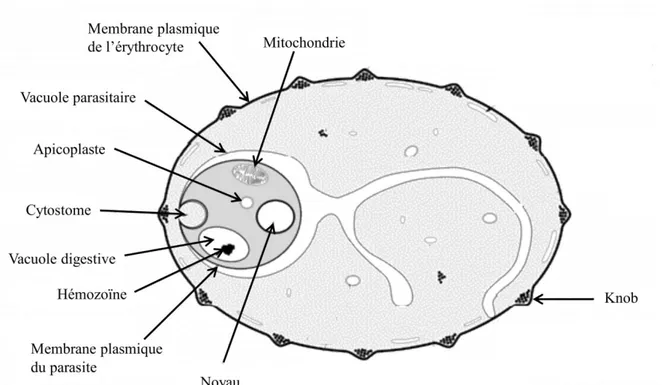
En plus du trafic de protéines vers ses organites uniques, Plasmodium exporte également une variété de protéines, principalement des facteurs de virulence et des protéines de remodelage de la cellule hôte, dans le cytosol de l’érythrocyte infecté ainsi qu’à sa surface (voir Fig. 4 pour un schéma d’érythrocyte infecté). À la différence du système sécrétoire classique eucaryote, la destination des protéines sécrétées par Plasmodium est la VP, le cytosol ou la surface du GR et non le milieu extracellulaire97. Des facteurs du parasite doivent donc intervenir afin de faire le tri des protéines selon leurs destinations respectives91. La VP est la voie de sécrétion par défaut et ne demande pas de système particulier au-delà du transit par le RE/Golgi97. Qu’elles soient en route pour le cytosol ou la surface érythrocytaire, les protéines doivent obligatoirement passer la membrane plasmique du parasite, puis la membrane de la vacuole parasitaire (MVP). La traversée de la première membrane se fait par exocytose des vésicules de transport en provenance de l’appareil de Golgi90
. Quant au transport à travers la MVP, il serait rendu possible par le complexe PTEX (Plasmodium translocon for exported proteins) qui créerait un canal permettant aux protéines destinées au GR de passer101.
L’ensemble des protéines exportées dans l’érythrocyte infecté constitue l’exportome et sont classifiées en deux groupes : les protéines possédant le motif PEXEL (Plasmodium export element) et les protéines PNEP (PEXEL-negative exported proteins).
Le motif PEXEL est le nom de la séquence consensus RxLxE/Q/D qui, pour être fonctionelle, doit être située à environ 20 acides aminés en aval du peptide signal102,103. Ce motif comprend une séquence reconnue par la protéine Plasmepsin V. Cette protéase résidante du RE effectue le clivage, indépendamment de celui du peptide signal, du motif PEXEL entre ses 3e et 4e acides aminés. Cela crée une nouvelle extrémité N-terminale qui est N-acétylée et permet l’export de la protéine vers la cellule hôte (Revu dans104). Le mécanisme exact selon lequel le motif PEXEL est traité pour promouvoir l’export est toujours mal compris.
18 Jusqu’à maintenant, moins de protéines de la famille des PNEPs ont été identifiées que celles contenant le motif PEXEL (contenant plus de 450 protéines connues). Les protéines PNEPs ne possèdent pas de peptide signal, mais une région hydrophobique qui permet leur entrée dans le système sécrétoire105,106. Ces protéines ne possèdent pas de motif signature permettant leur export et c’est l’extrémité N-terminale qui est essentielle au processus107
.
1.3. Les phosphoinositides
Comme mentionné précédemment, les PIP ont été suggérés comme étant des acteurs moléculaires impliqués dans le trafic des vésicules transportant les protéines à partir de l’appareil de Golgi, jusqu’aux différents organites de P. falciparum. Les PIP sont des composants mineurs des membranes lipidiques qui font face au cytosol et qui dérivent du phosphatidylinositol (PI). Ce dernier est initialement synthétisé dans le RE, puis transporté dans les membranes des autres compartiments de la cellule par transport vésiculaire ou sous l’action des protéines de transfert cytosoliques du PI108. Associé à sa chaîne d’acides gras, le PI possède un anneau inositol qui peut être phosphorylé en différentes positions (3, 4 ou 5). Les différentes combinaisons de phosphorylation permettent la formation des 7 espèces de PIP connues dans les cellules eucaryotes
Figure 4. Schéma de P. falciparum dans le globule rouge. Représentation des différentes
structures développées par le parasite à l’intérieur de l’érythrocyte durant l’infection. Image adaptée par Catherine Thériault de : Emmanuel Bischoff, Qu’est-ce que la Paludisme, http://ebischoff.free.fr/index.html.
19 (Fig. 5A)108. Trois catégories d’enzymes agissent dans le métabolisme des PIP : les PIP kinases/phosphatases qui permettent de passer rapidement d’une forme à une autre et les lipases qui forment des seconds messagers par clivage des molécules. Ces enzymes sont activées par des signaux extracellulaires et assurent une réponse rapide aux stimuli via les voies de signalisation appropriées109. Chaque forme de PIP est distribuée dans les membranes des différents compartiments cellulaires de façon spécifique et régulée, assurant le maintien de l’identité de leurs membranes (Fig. 5B)110. Des protéines effectrices, comprenant des domaines reconnaissant chaque forme de PIP de façon spécifique, (Fig. 5C) permettent de recruter un ensemble de protéines à un compartiment précis. La localisation différentielle des PIP111, leur courte demi-vie et le large éventail de protéines effectrices qui leur sont associées, les rendent indispensables aux processus régulant l’homéostasie des cellules108.
1.3.1. Les phosphoinositides chez les eucaryotes : en bref
Comme mentionné précédemment, sept espèces de phosphoinositides ont été identifiées jusqu’à maintenant, chacune d’entre elles étant impliquée dans des fonctions biologiques particulières et étant spécifiquement enrichie dans les membranes des différents compartiments cellulaires. Des études afin d’établir des cartes de la distribution des PIP ont associé le phosphatidylinositol 4-phosphate (PI(4)P) majoritairement à l’appareil de Golgi, le phosphatidylinositol (4,5)-bis4-phosphate (PI(4,5)P2) et le phosphatidylinositol (3,4,5)-triphosphate (PI(3,4,5)P3)à la membrane plasmique et
le PI(3)P aux endosomes ainsi qu’aux autophagosomes108. Cet enrichissement différentiel dans les membranes de différents compartiments cellulaires est lié à des rôles différents pour chaque espèce de PIP dans les cellules.
20
Figure 5. Les phosphoinositides. A) Représentation du métabolisme des phosphoinositides
sous l’action des kinases et des phosphatases. Les flèches noires représentent une phosphorylation par une kinase et les flèches rouges une déphosphorylation par une phosphatase. PI : phosphatidylinositol, PI3K : PI(3)-kinase, PI4K : PI(4)-kinase, PI5K : PI(5)-kinase. Image tirée de :Bishé, B., Syed, G. & Siddiqui, A. Phosphoinositides in the hepatitis C virus life cycle. Viruses 4, 2340–2358 (2012). B) Distribution des différentes espèces de phosphoinositides dans les compartiments cellulaires. CMV : Corps multivésiculaire. Figure réalisée par Catherine Thériault.
21
1.3.1.1.
Rôle des différents phosphoinositides
1.3.1.1.1. PI(3)P
Jusqu’à maintenant, trois classes de PI 3-kinases ont été identifiées et produisent trois ensembles distincts de PIP ayant des fonctions différentes. Les classes II et III phosphorylent le PI à la position 3 de l’anneau inositol pour former le PI(3)P. Activées par des cytokines et des facteurs de croissance, les kinases de classes II ainsi que le PI(3)P qu’elles produisent sont impliquées dans les voies de signalisation régulant la survie et la croissance cellulaire110. Chez la levure, une seule kinase de type 3, VPS34, a été identifiée. Tout comme son homologue mammifère, elle produit un PI(3)P qui est localisé principalement aux endosomes et est donc impliquée dans le trafic endosomal des phagosomes et dans l’autophagie en périodes de carences en nutriments109,112,113. Contrairement aux deux autres classes de PI 3-kinases, la classe I ne permet pas de synthétiser du PI(3)P. Ces kinases ajoutent plutôt un phosphate en position 3 au PI(4)P et au PI(4,5)P2 afin de
former le PI(3,4)P2 et le PI(3,4,5)P3. Tout comme les kinases de classe II, elles sont activées en
réponses à des cytokines et à des facteurs de croissance et agissent dans les voies de survie et de croissance cellulaire110.
1.3.1.1.2. PI(3,5)P
2Le PI(3,5)P2 est peu abondant dans les cellules, représentant moins de 5% des phosphoinositides
totaux114. Comme toutes les autres espèces de PIP, le PI(3,5)P2 est impliqué dans le trafic de
protéines et de membranes. Il se trouve principalement aux endosomes tardifs et précoces ainsi qu’aux lysosomes115
. Bien que le mécanisme précis soit toujours inconnu, il est suggéré qu’il soit impliqué directement dans l’empaquetage des protéines cargos aux corps multivésiculaires114. Le PI(3,5)P2 possède également une fonction dans une variété d’autres processus cellulaires qui sont
assez bien conservés de la levure aux cellules mammifères116. Ces rôles incluent la régulation de la fonction vacuolaire/endo-lysosomale116, l’autophagie, la croissance cellulaire et les processus métaboliques (via la régulation de mTORC1 (mammalian target of rapamycin complex 1))116,117. De
C) Représentation de la reconnaissance de chaque espèce de phosphoinositide par les différents domaines protéiques. Noms des domaines de reconnaissance des PIP : ANTH (AP180 N-terminal homology), C2 (Conserved region-2 of protein kinase C), ENTH (Epsin N-N-terminal homology), FERM (4.1, ezrin, radixin, moiesin), FYVE (Fab1, YOTB, Vac1, EEA1), GOLPH3 (Golgi phosphoprotein 3), PDZ (postsynaptic density 95, disk large, zonula occludens), PH (Pleckstrin homology), PROPPINS (β-propellers that bind phosphoinositides), PTB (phosphotyrosine binding), PX (Phox homology), et Tubby. Image tirée de :Kutateladze, T. G. Translation of the phosphoinositide code by PI effectors. Nat. Chem. Biol. 6, 507–513 (2010).
22 plus, il semble réguler certains canaux ioniques de la levure afin de maintenir l’osmolarité et le pH lors d’un choc osmotique116,118,119.
1.3.1.1.3. PI(4)P
Le PI(4)P, combiné avec le PI(4,5)P2, est le PIP qui est trouvé en plus grande quantité dans les
cellules. S’il était autrefois considéré uniquement comme un substrat intermédiaire des PIP 5-kinases pour former le PI(4,5)P2, plusieurs protéines effectrices lui ont été associées depuis et la
fonction essentielle qu’on lui attribue est indépendante de celle occupée par le PI(4,5)P2 (voir
section 1.3.1.1.4)109. Fortement concentré dans la membrane de la face trans de l’appareil de Golgi,
le PI(4)P occupe un rôle majeur dans le contrôle de la morphologie de cet organite et du trafic vésiculaire qui en sort120,121. Il peut être synthétisé par deux types de PI 4-kinases, dites type II et type III ou par la déphosphorylation du PI(3,4)P2 ou du PI(4,5)P2 par les PI-phosphatases
appropriées114. Le PI(4)P à la membrane de l’appareil de Golgi lie directement les adaptateurs de clathrines régulant ainsi le trafic vésiculaire sortant de ce compartiment cellulaire122–124. Dans les cellules mammifères, une diminution de l’expression de la protéine GOLPH3 (Golgi phosphoprotein 3), un effecteur du PI(4)P impliqué dans la régulation de la kinase mTOR (mammalian Target of Rapamycin), est associé avec des défauts de transports et une morphologie atypique de l’appareil de Golgi125,126
. Puisque mTOR occupe un rôle dans les voies de croissance cellulaire, il est possible qu’un lien fonctionnel existe entre elles et la régulation de la fonction de l’appareil de Golgi109
.
1.3.1.1.4. PI(4,5)P
2Le PI(4,5)P2 peut être synthétisé à partir du PI(4)P ou du PI(5)P par des PI 5-kinases ou des PI
4-kinases, respectivement. Chez l’humain, trois PI5K de type I (α, β et γ) ont été identifiées114. Dans les cellules mammifères, il peut aussi être produit par la déphosphorylation du PI(3,4,5)P3 par des
PI 3-phosphatases comme PTEN (phosphatase and tensin homolog)127. Chez la levure et dans les cellules de mammifères, le PI(4,5)P2 est particulièrement enrichi à la membrane plasmique des
cellules d’où il contrôle plusieurs processus, tels que les interactions entre la membrane plasmique et le cytosquelette, le recrutement des adaptateurs de clathrines durant l’endocytose109 et l’arrimage des vésicules en prévision de l’exocytose128,129. Il est notamment important dans la transduction de signal classique, dans laquelle il est soit clivé par la phospholipase C pour produire les seconds messagers, soit phosphorylé par la PI 3-kinase pour former le PI(3,4,5)P3
110