Université de Sherbrooke
Identification de l’activité histone acétyltransférase responsable de l’hyperacétylation de l’histone H4 durant la spermiogenèse
Par Jessica Leroux Département de biochimie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de maître ès sciences (M. Sc.) en biochimie
Sherbrooke, Québec, Canada Avril 2013
Membres du jury d ’évaluation
Guylain Boissonneault, Biochimie, FMSS, Université de Sherbrooke Luigi Bouchard, Biochimie, FMSS, Université de Sherbrooke
Claude Asselin, Anatomie et biologie cellulaire, FMSS, Université de Sherbrooke
1+1
Library and Archives Canada Published Héritage Branch Bibliothèque et Archives Canada Direction du Patrimoine de l'édition 395 Wellington Street Ottawa ON K 1A0N 4 Canada 395, rue Wellington Ottawa ON K1A 0N4 CanadaYour file Votre référence ISBN: 978-0-494-95157-6
Our file Notre référence ISBN: 978-0-494-95157-6
NOTICE:
The author has granted a non-
exclusive license allowing Library and Archives Canada to reproduce, publish, archive, preserve, conserve, communicate to the public by
télécomm unication or on the Internet, loan, distrbute and sell theses
worldwide, for commercial or non- commercial purposes, in microform, paper, electronic and/or any other formats.
AVIS:
L'auteur a accordé une licence non exclusive permettant à la Bibliothèque et Archives Canada de reproduire, publier, archiver, sauvegarder, conserver, transmettre au public par télécomm unication ou par l'Internet, prêter, distribuer et vendre des thèses partout dans le monde, à des fins com merciales ou autres, sur support microforme, papier, électronique et/ou autres formats.
The author retains copyright ownership and moral rights in this thesis. Neither the thesis nor substantial extracts from it may be printed or otherwise reproduced without the author's permission.
L'auteur conserve la propriété du droit d'auteur et des droits moraux qui protégé cette thèse. Ni la thèse ni des extraits substantiels de celle-ci ne doivent être imprimés ou autrement
reproduits sans son autorisation.
In compliance with the Canadian Privacy A ct some supporting forms may have been removed from this thesis.
W hile these forms may be included in the document page count, their removal does not represent any loss of content from the thesis.
Conform ém ent à la loi canadienne sur la protection de la vie privée, quelques
form ulaires secondaires ont été enlevés de cette thèse.
Bien que ces form ulaires aient inclus dans la pagination, il n'y aura aucun contenu manquant.
Identification de l’activité histone acétyltransférase responsable de l’hyperacétylation de l’histone H4 durant la spermiogenèse
Par Jessica Leroux Département de biochimie
Mémoire présenté à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de maître ès sciences (M.Sc.) en biochimie, Faculté de médecine et des sciences
de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
La stabilité de l ’information génétique est d ’une importance cruciale pour la fonction normale et la reproduction de tous les êtres vivants. Or, la capacité de fertilisation chez l’homme est habituellement mesurée en considérant la concentration, la motilité et la morphologie des spermatozoïdes. Cependant, ces paramètres ne prennent pas en considération l’intégrité du matériel génétique. Pourtant, de fortes évidences démontrent que la spermiogenèse, qui est la phase haploïde de la spermatogenèse durant laquelle se produit un important remodelage de la chromatine, serait une importante source d ’instabilité génétique. En effet, des bris transitoires de l’ADN surviennent durant la spermiogenèse au même moment que l’hyperacétylation des histones H4 et la stimulation de l’hyperacétylation de H4 par traitement à la trichostatine A stimule la formation de cassures dans l’ADN. Ainsi, des histones acétyltransférases (HATs) pourraient affecter la compaction et l ’intégrité de l’ADN et par conséquent le potentiel fertilisant du gamète mâle. Il est donc important d ’identifier l’histone acétyltransférase impliquée dans l’hyper acétylation des histones H4 durant la spermiogenèse, puisqu’il s ’agit d ’un processus possiblement important pour la fertilité de l’homme. À la suite d ’analyses par spectrométrie de masse d’échantillons protéiques de testicules de souris possédant la propriété d ’acétyler l’histone H4 aucune HAT n ’a été identifée. Par contre, la protéine mitochondriale ACAT1, qui catalyse la transformation réversible de deux acétyl-CoA en CoA et acétoacétyl-CoA, a été détectée. Ces observations permettent d’émettre l ’hypothèse que cette protéine pourrait jouer un rôle dans la spermiogenèse en augmentant le niveau d’acétyl-CoA chez les spermatides en élongation. En effet, puisque selon mes résultats les histones H4 sont en mesure de s’auto-hyperacéty 1er, on peut supposer qu’une augmentation du niveau d ’acétyl- CoA causerait une acétylation de ces histones à l’échelle du génome, permettant ainsi la poursuite de la spermiogenèse et éventuellement la formation de spermatozoïdes matures et fonctionnels.
Identification o f histone acetyltransferase activity responsible for hyperacetylation o f histone H4 during spermiogenesis
By Jessica Leroux Département de biochimie
Submission to the Faculté de médecine et des sciences de la santé for graduation maître ès sciences (M.Sc.) in Biochemistry, Faculté de médecine et des sciences de la santé,
Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
The stability o f the genetic information is crucial for the normal fonction and reproduction of ail living beings. The ability of fertilization in humans is usually measured in ternis o f concentration, motility and morphology o f sperm. Flowever, these parameters do not take into account the integrity of the genetic material. Strong evidence shows that spermiogenesis, which is the haploid phase of spermatogenesis associated with an important chromatin remodeling, is an important source o f genetic instability. Indeed, transient DNA breaks occur during spermiogenesis at the same time as the hyperacetylation of histone H4, and stimulation of FI4 hyperacetylation by trichostatin A treatment stimulâtes the formation of DNA breaks. Therefore, histone acetyltransferases (HATs) could affect compaction and DNA integrity and the fertilizing potential o f the maie gamete. It is thus important to identify the histone acetyltransferase involved in histone H4 hyperacetylation during spermiogenesis. Following analysis by mass spectrometry o f protein samples from mouse testes having the property to acetylate histone H4 no HAT activity was identifïed. However, ACAT1 mitochondrial protein, which catalyzes the réversible conversion of two acetyl-CoA to CoA and acetoacetyl-CoA, was detected. These observations allow to hypothesize that this protein may play a rôle in spermiogenesis by increasing the level of acetyl-CoA in elongating spermatids. Since according to my results histones H4 are able to self-acetylate, we can suppose that an increase in the level of acetyl- CoA may cause hyperacetylation of H4 in the entire genome, allowing the continuation o f spermiogenesis and eventually the formation o f mature and fonctional spermatozoa.
T A B L E D E S M A T I È R E S
TABLE DES M ATIERES ... «.... ... .... . IV
LISTE DES TA B L E A U X ... VI LISTE DES F IG U R E S ....
...
vu
LISTE DES A BR E V IA T IO N S ... _ H U 1 , IN TR O D U C TIO N 1 0 1 .1 . Te s t ic u l e... 1 0 1 .2 . Cellules de Se r t o l i... 1 0 1 .3 . Cellules de Le y d ig... ...1 1 1 .4 . Sp e r m a t o g e n è s e... 1 1 1 .4 .1 . Phase de pro lifér a t io n... 1 2 1 .4 .2 . Phase m éiotique...1 2 1 .4 .3 . Phase de différenciation (spermiogenèse) ... 1 3 1 .5 . St a d e s de la s p e r m a t o g e n è s e... 1 3 1 .6 . Or g a n isa t io n d e la c h r o m a t in e... 1 4 1 .7 . Mo d ific a t io n s p o s t-t r a d u c t io n n e l l e s e t v a r ia n t s d'h is t o n e s lors d e la sper m io g e n è se...1 5 1 .8 . Re m odelage de la c h r o m a t in e... 1 8 1 .9 . His t o n e s a c é t y l tr a n sfé r a ses (H A Ts) et d é sa c é ty la se s (H D A Cs) ... 2 2 1 .1 0 . L’h y pe r a c é t y l a t io n de l'h ist o n e H 4a u c o u r s d e la spe r m io g e n è s e...2 31 .1 1 . Pr o b l é m a t iq u e... 2 3
1 .1 2 . Hy po t h è s e s e t o b je c t if s...2 3
2u MATERIEL ET M ETH O DES ... »... 2 4
2 .1 . Im m u n o f l u o r e sc e n c e... 2 4 2 .2 . INGELASSAY ... 2 4 2 .3 . Im m u n o b u v a r d a g e... 2 5 2 .4 . Ex t r a c tio n et id e n t ific a t io n des A R Nm chez les s p e r m a t id e s r o n d e s... 2 6 2 .5 . Pr é p a r a t io n d e s e x t r a it s nucléaires t e s t ic u l a ir e s t o t a u x et SRS (s p e r m a t id e s r é s ist a n t e s à la SONICATION)... 2 6 2 .6 . PRÉPARATION DE L’EXTRAIT NUCLÉAIRE DE CULTURE CELLULAIRE NIH 3 T 3 ... 2 7 2 .7 . FPLC...2 7 2 .8 . Test H A T SD S-PA G E r a d io a c t if... 2 8 2 .9 . PRODUCTION D’UNE PROTÉINE RECOMBINANTE...2 8 2 .1 0 . Te st HAT im m u n o b u v a r d a g e... 2 9 2 .1 1 . 2 D -D IG E ... 2 9 2 .1 2 . Spe c t r o m é t r ie de m a sse... 3 0 2 .1 3 . G S Tp u l l d o w n...3 0 2 .1 4 . Te st d’a c t iv it é H A T avec im m u n o p r é c ip it a t io n...3 0 i R ESULTATS ... »... ... ... 3 .1 . Appr o c h e pa r c a n d id a t s... i... 3 2
V
3 .1 .1 . VÉRIFICATION DE LA PRÉSENCE CHEZ LA SOURIS DE L 'H A T M Y S T 4 IDENTIFIÉE CHEZ LE BOVIN.. 3 2 3 .1 .2 . INGELASSAY... 3 3 3 .2 . App r o c h e s s y s t é m a t iq u e s... .'... 3 7 3 .2 .1 . QUANTIFICATION DES ARN M DE CERTAINES H A TS CHEZ LES SPERMATIDES RONDES...3 7 3 .2 .2 . F P L C ... 3 9 3 .2 .3 . G ST PULL DOWN ... 4 7 3 .2 .4 . Pr o t é in e sm it o c h o n d r ia l e sd u r a n t las p e r m io g e n è s e...4 8 3 .2 .5 . Mis ea u p o in td’u nt e s td’a c t iv it é H A T a v e ci m m u n o p r é c ip it a t i o n... 4 9 3 .2 .6 . L’AUTO-ACÉTYLATION d el’h is t o n e H 4 ... 5 3 & D IS C U S S IO N E T C O N C L U S IO N S ... 1,1,1...11... 55 IL R E M E R C IE M E N T S ... 58 <L L IS T E D E S P U B L IC A T I O N S ... 59 1 A N N E X E S ... »... »... ... 6 3
LISTE DES TABLEAUX
Tableau 1. Variants et modifications post-traductionnelles des histones durant la
spermiogenèse... 16
Tableau 2 CTs des ARNm d ’extrait testiculaire de spermatides rondes ou to tal...38
Tableau 3 Plus haut score obtenu par spectrométrie de masse pour chacun des échantillons protéiques obtenus par FPLC et séparés par 2D-DIGE... 46
Tableau 4 Plus haut score obtenu par spectrométrie de masse pour l’élution du GST pull down avec un extrait SRS ou de NIH 3T3...48
Tableau 5. Résultats de spectrométrie de masse pour le premier FPLC... 63
Tableau 7. Résultats de spectrométrie de masse du deuxième FPLC... 89
LISTE DES FIGURES
Figure 1. Classification de la spermatogenèse chez la souris (Russell et a l, 1990)...14
Figure 2. Événements associés aux étapes de remodelage (Leduc et al., 2 0 0 8 )... 18
Figure 3. Organisation de l ’ADN dans une cellule somatique et un spermatozoïde (Braun, 2001) : 20 Figure 4. Un modèle pour le remodelage de la chromatine lors de la spermiogenèse (Leduc et al., 2008)... 21
Figure 5. Mécanismes d’action des histones acétyltransférases (Bemdsen et Denu, 2005).22 Figure 6. Immunofluorescence de l’HAT MYST 4 sur une coupe de testicule humain 33 Figure 7. « In gel assay »... 34
Figure 8. Immunobuvardage contre l’HAT MYST2...35
Figure 9. Immunofluorescence contre yH2AX et MYST2 sur une coupe testiculaire murine. ...36
Figure 10. Détection de l’activité HAT avec la trousse Active M otif et des fractions FPLC de colonnes monoS... 40
Figure 11. Détection de l’activité HAT avec la trousse Active M otif et des fractions FPLC de colonnes monoQ... 41
Figure 12. Détection de l’activité HAT sur gel SDS-PAGE en présence d ’acétyl-CoA marqué au 14C ... 43
Figure 13. Détection de l’activité HAT par immunobuvardage avec les 22 fractions du FPLC... 44
Figure 14. Intensité relative de l’acétylation pour les quatre lysines de l’extrémité N-terminale de l ’histone H4...45
Figure 15. Gels 2D-DIGE pour les fractions 12, 13 et 14... 46
Figure 16. Détection de l’activité HAT dans l’éluat du GST pull down (H4 AcK5)... 47
Figure 17. Immunofluorescence de ACAT1 sur une coupe de testicule de souris...49
Figure 18. Détection de l’acétylation de l’histone H4 avec un compteur à scintillation en présence de quantités croissantes de p300... 50
Figure 19. Vérification de l ’activité HAT par immunoprécipitation de l’histone H4, sur un extrait protéique de cellules HeLa en présence de butyrate de sodium ou de TSA...51
Figure 20. Vérification de l ’activité HAT par immunoprécipitation de l’histone H4...52
LISTE DES ABRÉVIATIONS
2D-DIGE : électrophorèse bi-dimensionnelle quantitative Acétoacétyl-CoA : acétoacétylCoenzyme A
Acétyl-CoA : acétyl-Coenzyme A ADN : acide désoxyribonucléique ARN : acide ribonucléique
ARNm : acide ribonucléique messager BSA : albumine sérique bovine
CoA : coenzyme A
Cornet : électrophorèse en gel de cellules simples CT : cycle threshold Cy3 : cyanine 3 Cy5 : cyanine 5 Da : Dalton DAPI : 4 ’,6’-diamidino-2-phénylindole DTT : dithiothréitol
EDTA : acide éthylène diamine tétraacétique FACS : fluorescence-activated cell sorting FPLC : fast protein liquid chromatography GST : glutathion S-transférase
HAT : histone acétyltransférase HC1 : chlorure d ’hydrogène HDAC: histone désacétylase
IPTG: isopropyl (3-D-1 -thiogalactopyranoside LB : lysogeny broth
LH : hormone lutéinisante MgCl2 : chlorure de magnésium
NaCl : chlorure de sodium PI : protamine 1
P2 : protamine 2
PBS : tampon phosphate salin
PBST : tampon phosphate salin tween PCR : réaction en chaine par polymérase pi: point isoélectrique
pH: potentiel hydrogène RPM : tours par minute TCA : acide trichloroacétique TPI : protéine de transition 1 TP2 : protéine de transition 2 SDS : dodécylsulfate de sodium
SDS PAGE : électrophorèse sur gel de polyacrylamide en présence de SDS SRS : spermatide résistante à là sonication
Tris : trishydroxyméthylaminométhane
1. INTRODUCTION
L ’infertilité est un problème en croissance dans notre société. De 11,5% à 15,7% des couples hétérosexuels canadiens seraient infertiles (Bushnik et ai, 2012). Environ la moitié des cas serait attribuable à l’homme du moins en partie (Brugh e t Lipshultz, 2004). À ce jour, seulement 15% des cas d ’infertilité masculine sont expliqués (R ajender et ai,
2011). Il est donc important de bien comprendre la formation des spermatozoïdes pour parvenir à traiter l’infertilité masculine. Ceci pourrait également mener à la création d’une stratégie de contraception masculine non-hormonale.
1.1. Testicule
La formation des gamètes mâles se produit dans les testicules. Ceux-ci sont habituellement externes et à une température légèrement inférieure à celle du corps chez la majorité des mammifères (35°C chez l’humain) pour permettre une gamétogenèse efficace. Les testicules sont également responsables de la stéroidogenèse. Chez le mâle, la gamétogenèse est appelée spermatogenèse, et est définie comme le processus de différenciation et de maturation cellulaire qui, à partir des spermatogonies souches, aboutit à la production des spermatozoïdes (Hermo et ai, 2010). La spermatogenèse se produit dans les tubules séminifères, qui sont contenus dans une capsule nommée la tunica albuginea (Davis et Langford, 1969). Lors de la maturation des cellules germinales, celles-ci se déplacent vers la lumière du tubule séminifère où les spermatozoïdes sont libérés et migrent ensuite vers l ’épididyme (Russell et Malone, 1980).
1.2. Cellules de Sertoli
Les cellules de Sertoli, de forme pyramidale, occupent un espace allant de la membrane basale du tubule séminifère jusqu’à sa lumière (Schulze, 1974). Elles communiquent avec les spermatides via des complexes tubulobulbaires (Russell et Malone, 1980). Elles
11
remplissent de nombreuses fonctions essentielles au .bon déroulement de la spermatogenèse. D ’abord, elles possèdent des jonctions serrées formant la barrière hémato- testiculaire (Dym et Fawcett, 1970). Cette barrière accomplit plusieurs rôles. Par exemple, elle empêche le corps de développer une autoimmunité envers les spermatozoïdes, contrôle la diffusion de nombreuses molécules et donne une polarité aux cellules de Sertoli (Li et al,
2009). Ces cellules sont également responsables de nourrir les cellules germinales (Vilar et al, 1962). Elles sécrètent du fluide dans la lumière du tubule séminifère, ce qui permet entre autre de maintenir la structure des tubules et d ’empêcher que ceux-ci s ’effondrent sur eux-même (Jegou et al, 1982). La spermiation, c’est-à-dire la relâche des spermatozoïdes dans la lumière du tubule séminifère, implique les cellules de Sertoli qui éliminent les jonctions reliant les cellules germinales entre elles (Russell et al, 1988). Elles phagocytent les cellules germinales anormales ainsi que les corps résiduels (Schulze, 1974; Carr etal.,
1968; Reddy et Svoboda, 1967).
1.3. Cellules de Leydig
Elles sont situées dans l’espace interstitiel, c’est-à-dire entre les tubules séminifères, et sont la principale source d ’androgènes chez le mâle. La stimulation de la production d ’androgènes est faite par l ’hormone lutéinisante (LH) (M endis-Handagama, 1997; Mori et Christensen, 1980). La testostérone est nécessaire pour le bon fonctionnement de la spermatogenèse. En absence de cette hormone, la spermatogenèse ne progresse pas au-delà des spermatocytes pachytènes (Yeh et al, 2002).
1.4. Spermatogenèse
Elle peut être divisée en trois phases : la phase de prolifération, la phase méiotique et la phase de différenciation aussi appelée spermiogenèse.
12
1.4.1. Phase de prolifération
• Spermatogonies (A et B)
Ce sont les cellules souches qui se divisent pour former éventuellement les spermatozoïdes. Les spermatogonies de type A peuvent se diviser pour former d’autres spermatogonies de type A et ainsi maintenir la population de cellules souches, ou encore former des spermatogonies de type B qui se différencieront pour donner les spermatocytes (Dym, 1 9 9 4 ) . La prolifération des spermatogonies est contrôlée par les
cellules de Sertoli (Rossi é ta l, 1993).
1.4.2. Phase méiotique
• Spermatocytes primaires et secondaires
Les spermatocytes primaires sont obtenus suite à la différenciation des spermatogonies de type B. Les spermatocytes primaires se divisent par méiose, pour donner les spermatocytes secondaires et finalement les spermatides. La méiose peut être divisée ainsi (Hermo é ta l, 2 0 1 0 ) :
o Méiose I
■ Prophase
• Préleptotène : synthèse de l’ADN
• Leptotène : condensation des chromosomes • Zygotène : alignement des chromosomes
• Pachytène : enjambement, apparition du corps sexuel
• Diplotène : légère séparation des chromosomes qui restent liés par les chiasma
• Diacinèse : disparition du nucléole, désintégration de la membrane nucléaire, formation du fuseau méiotique
■ Métaphase : attachement des chromosomes au plan équatorial ■ Anaphase : séparation des chromatides soeurs
• Télophase : division en deux cellules qui sont dorénavant nommées spermatocytes secondaires.
13
o Méiose II : Les spermatocytes secondaires abordent directement la phase de différenciation sans dupliquer le matériel génétique. On obtient ainsi des spermatides haploïdes suite à la seconde méiose.
1.4.3. Phase de différenciation (spermiogenèse)
La spermiogenèse est la maturation des spermatides en spermatozoïdes (Hermo et ai,
2010). On observe une condensation du noyau, la formation de l’acrosome et du flagelle et l’expulsion du cytoplasme (Russell, 1979). L ’ARN serait entreposé pour un usage futur dans une structure nommée le corps chromatoïde (Soderstrom e t Parvinen, 1976). Suite à ces étapes, on obtient un spermatozoïde qui sera relâché dans la lumière du tubule séminifère, d ’où il se rendra dans l ’épididyme pour maturer et acquérir la capacité de fertilisation de l’ovocyte.
1.5. Stades de la spermatogenèse
Chez la souris, la spermatogenèse est divisée en 12 « stades » représentés en chiffres romains dans la Figure 1. Un stade correspond aux différentes cellules germinales retrouvées dans une coupe transversale d ’un tubule séminifère. Les cellules débutant la spermatogenèse se retrouvent en périphérie des tubules, puis progressent vers la lumière du tubule au for et à mesure que la spermatogenèse avance. Ainsi les cellules germinales les plus matures se retrouvent au centre des tubules séminifères.
La spermiogenèse est sous-divisée en 16 « étap es» chez la souris, indiquées en chiffres arabes dans la Figure 1. Les spermatides peuvent être divisées en trois sous-classes : les spermatides rondes, allongeantes et allongées. Chez la souris, on retrouve les spermatides rondes aux étapes 1 à 8, les allongeantes aux étapes 9 à 11 et les allongées aux étapes 12 à 16 (Russell et al., 1990). Après l’étape 16, les spermatides sont relâchées dans la lumière du tubule séminifère et se dirigent vers l ’épididyme pour poursuivre leur maturation.
15
fibre de 30 nm. On distingue deux types de chromatine : l’euchromatine et l’hétérochromatine. L ’euchromatine est associée à une chromatine plus ouverte et davantage accessible ainsi qu’à une acétylation de l ’histone H4, alors que l’hétérochromatine est plus condensée (O'Neill et Turner, 1995). En plus des histones de base, de nombreux variants d ’histones ont des fonctions spécifiques (T albert et Henikoff, 2010). Parmi ceux-ci, le variant d ’histone H2AX, appelé yH2AX lorsque phosphorylé, est impliqué dans la réparation des dommages bicaténaires d ’ADN (Rogakou et al., 1998). La méthylation de l’ADN et l’ensemble des modifications post-traductionnelles des histones sont appelés mécanismes épigénétiques. Les modifications des histones les plus étudiées sont l’acétylation, la méthylation, la phosphorylation et l’ubiquitination, m a is. d ’autres modifications sont découvertes régulièrement. Ces modifications forment ce qui est appelé le code des histones. Selon cette théorie, les combinaisons des différentes modifications possibles permettraient le recrutement de protéines spécifiques (Jenuwein e t Allis, 2001). Par exemple, les bromodomaines, qu’on retrouve entre autre sur les histones acetyltransférases, reconnaissent les histones acétylées (Dhalluin etal., 1999).
1.7. Modifications post-traductionnelles et variants d ’histones lors de la
spermiogenèse
Durant la spermiogenèse, les histones sont modifiées post-traductionnellement de plusieurs façons et plusieurs histones canoniques sont remplacées par des variants (voir Tableau 1). L’histone H4 est acétylée sur les quatre lysines de son extrémité N-terminale au cours de la spermiogenèse. Cette hyperacétylation est associée à l’éjection des histones de la chromatine et au remodelage qui s’en suit.
16
Tableau 1. Variants et modifications post-traductionnelles des histones durant la spermiogenèse
Histone Modification Effet Présence Référence
H it Aucune Décondensation de la chromatine Pachytène à spermatides allongeantes (Drabent et al, 1996; Sarg et al, 2009) Phosphorylation Inconnu Spermatides
H1T2 Aucune Décondensation de la chromatine Spermatides rondes et allongeantes (Martianov éta l, 2005)
HILS1 Aucune Rôle possible
dans le remodelage de la chromatine Spermatides allongeantes et allongées (Yan et al., 2003)
H2A Acétylation (K5) Inconnu Spermatogonies,
préleptotènes, spermatides allongeâtes étapes 9-11 (Hazzouri et al., 2000; Baarends et al, 1999) Ubiquitination (Kl 19) Corps sexuel, déstabilisation des nucléosomes Pachytènes, spermatides allongeantes H2AX Phosphorylation (S139) Réparation de l’ADN, corps sexuel Leptotènes à pachytènes, spermatides rondes et allongeantes (Blanco-Rodriguez, 2009)
H2AZ Aucune Compaction de
la chromatine
Pachytènes à spermatides allongeantes
(Greaves et al, 2006) Ubiquitination Inconnu Spermatides allongeantes
H2AL1 Aucune Réorganisation
de la structure de la chromatine Spermatides allongeantes et allongées, spermatozoïdes (Govin et al, 2007)
H2AL2 Aucune Réorganisation
de la structure chromatinienne Spermatides allongeantes et allongées, spermatozoïdes (Govin et al, 2007)
H2B Acétylation Inconnu Spermatogonies,
préleptotènes, spermatides allongeantes étapes 10-11
(Hazzouri et al, 2000)
17
Histone Modification Effet Présence Référence
TH2B Acétylation Phosphorylation (T116) Méthylation (Kl 17) Déstabilisation des nucléosomes Spermatocytes primaires à pachytènes tardifs, spermatides rondes et allongeantes (Govin et al, 2007; Lu et al., 2009) H2BL1 Aucune Réorganisation de la structure de la chromatine Spermatides allongeantes et allongées, spermatozoïdes (Govin et al, 2007; Zalensky et al., 2002) H3 Acétylation Inconnu Etapes 10-11 (souris) (Hazzouri et
al, 2000; Chen et al,
1998;
Godmann et al, 2007) Ubiquitination Inconnu Spermatides allongeantes
H3K4mel Inconnu Spermatogonies à
zygotènes
H3K4me2, me3 Inconnu Spermatogonies à zygotène, spermatides rondes et allongeantes
TH3 Aucune Inconnu Spermatogonies,
spermatocytes, spermatides rondes (Trostle- Weige et al, 1984; Chen et al, 1998) Ubiquitination Inconnu Spermatides allongeantes
H3.3 Aucune Participe possiblement à la conformation ouverte de la chromatine Spermatocytes primaires à spermatides allongées (Akhmanova étal., 1997) H4 Acétylation (K5, K8, K12, K16) Associée avec le déplacement des histones Spermatogonies et préleptotènes (K5, K8 and K16 seulement), spermatides allongeantes étapes 8-11 (Hazzouri et al, 2000)
19
une grande diminution de la motilité et de la fertilité (Yu et ai, 2000). On retrouve également deux types de protamines, soit P I, qui est présente chez tous les mammifères étudiés, et P2, que l’on retrouve chez seulement quelques espèces dont la souris et l’homme (Queralt et al, 1995). Les protamines sont riches en cystéines (Queralt et ai, 1995). De plus, la proportion de P2 chez les spermatozoïdes varie d ’une espèce à l’autre, de 34% chez la soüris à 67% chez l’homme (Bench et ai, 1996). Chez les espèces possédant les deux types de protamines, elles sont toutes deux essentielles et n ’ont donc pas une fonction redondante (Cho et ai, 2001). Les protamines permettent une organisation extrêmement compacte du matériel génétique assurant sa protection. Cependant, une proportion d ’environ 15% d’histones est conservée chez les spermatozoïdes (Tanphaichitr et ai,
1978). Ce processus d ’échange des histones pour les protamines est extrêmement important. Un ratio histones-protamines plus élevé a été observé chez les hommes infertiles (Zhang et ai, 2006). Les histones retenues chez le spermatozoïde pourraient avoir un rôle dans l’expression hâtive de certains gènes suite à la fertilisation (Gatewood et ai, 1990).. Lorsqu’associé aux protamines, l’ADN est contraint en domaines topologiques sous formes de boucles attachées à la membrane nucléaire, celles-ci étant beaucoup plus petites que celles retrouvées dans une cellule somatique (W ard e t ai, 1989).
23
Au contraire des HATs, les histones désacétylases retirent les groupements acétyls des histones. Le niveau d’acétylation des histones dans la cellule dépend donc de l’équilibre entre les HATs et les HDACs (Wade, 2001).
1.10. L’hyperacétylation de l’histone H4 au cours de la spermiogenèse
Les histones H4 sont hyperacétylées dans tout le génome avant d ’être éjectées et remplacées par les protéines de transition et finalement les protamines (Hazzouri et ai,
2000). Il a été démontré chez la drosophile qu’en absence d ’hyperacétylation de l’histone H4, le remplacement des histones par les protéines de transition et les protamines n ’a pas lieu (Awe et Renkawitz-Pohl, 2010). Or, en absence de protamines les souris sont infertiles, et un défaut d ’expression des protamines a été démontré chez certains hommes infertiles (Oliva, 2006; Cho é ta l, 2001; Balhorn é ta l, 1988).
1.11. Problématique
L’hyperacétylation de l’histone H4 est un phénomène essentiel au bon déroulement de la spermiogenèse. Ainsi, on observe l’infertilité chez le mâle en absence de ce phénomène. Pourtant, celui-ci est mal compris et on ignore toujours quels sont la ou les histones acétyltransférases impliquées dans l’hyperacétylation de H4 durant la spermiogenèse. Il est donc crucial de bien caractériser cette étape de la spermiogenèse qui pourrait être impliquée dans certains cas d ’infertilité. Il est également possible que l’identification des protéines impliquées puisse mener à la création d ’un contraceptif masculin.
1.12. Hypothèses et objectifs
Puisque l ’hyperacétylation de l ’histone H4 est un phénomène de première importance pour la spermiogenèse, une ou plusieurs HATs sont probablement impliquées dans l’hyperacétylation du génome. L ’objectif de ma maîtrise est de déterminer quelles protéines sont impliquées dans ce phénomène.
2. MATÉRIEL ET MÉTHODES
2.1. Immunofluorescence
Les coupes de testicules murins ou humains ont été fixées avec une solution de bouin (acide picrique, acide acétique, formaldéhyde) puis ont été déparaffinées en incubant les lames 3 fois 3 minutés dans du xylène puis 3 fois 3 minutes dans du méthanol. Elles ont été ensuite rincées 10 minutes à l’eau courante froide puis incubées 15 minutes dans le tampon de présentation des épitopes (10 mM Tris, 1 mM EDTA, 0,05% Tween 20, pH 9.0) bouillant. Les lames sont refroidies 10 minutes à l’eau courante froide. Elles ont ensuite été incubées dans le tampon de blocage (PBS IX, 1,5% BSA, 0,5% triton X-100) pendant une heure à 37°C, puis dans l’anticorps primaire dilué dans le tampon de blocage (anti yH2AX abcam #ab22551 dilution 1 :100, anti MYST2 abcam #ab70183 dilution 1 :100, anti MYST4 abcam #ab58823 dilution 1 :100) pour la nuit à 4°C. Les lames ont été lavées 3 fois'5 minutes dans des bains de PBS IX avec 0,1% triton X-100 puis incubées avec l’anticorps secondaire dilué dans le tampon de blocage (Dylight 549-conjugated affiniPure Goat anti- rabbit IgG Jackson ImmunoResearch Lab #111-505-046 dilution 1 :100, goat anti-mouse Alexa Fluor 488 Jackson ImmunoResearch Lab #115-545-003 dilution 1 :100) durant 1 heure à 37°C. Elles ont été lavées 3 fois 5 minutes dans des bains de PBS IX avec 0,1% triton X-100 puis l’ADN a été coloré au DAPI (0,01 p,g/mL dans du PBST) 5 minutes. Dix pL de slow fade (Invitrogen #S36936) ont été ajoutés sur le tissu puis une lamelle.scellée avec du vernis à ongle a été ajoutée.
2.2. In gel assay
Les échantillons ont été resuspendus dans le tampon de chargement SDS PAGE 2X (0,15 M Tris pH 6.8, 1,2% SDS, 30% glycérol, 15% P-mercaptoéthanol, bleu de bromophénol 27pM), puis déposés sur un gel de polyacrylamide d ’une épaisseur de 1,5 mm contenant 1 mg/mL d ’histones. Les échantillons ont migré dans le tampon d ’électrophorèse SDS PAGE (1% SDS, 0,025 M Tris, 0,192 M glycine) contenant 0,1 mg/mL d’histones jusqu’à ce que
25
le front de migration ait atteint le bas du gel à un voltage entre 90 et 150V. Le gel a été lavé 4 fois 20 minutes dans 100 mL de tampon B (50 mM Tris-HCl pH 8.0, 1 mM DTT, 0,1 mM EDTA) avec 20% d ’isopropanol, puis lavé 4 fois 20 minutes dans le tampon B avec 8 M d ’urée. Les lavages ont été effectués avec agitation douce. Les protéines sont renaturées dans 100 mL de tampon B avec 0,04% Tween 40 sans agitation durant :
• 20 minutes à 4°C • Toute la nuit à 4°C • 45 minutes à 4°C
• 45 minutes à température pièce
Le gel a ensuite été lavé 20 minutes dans 100 mL de tampon A (50 mM Tris-HCl pH 8.0, 1 mM DTT, 0,1 mM EDTA, 10% glycérol) à température pièce avec agitation douce. La réaction d ’acétylation a été effectuée en incubant le gel durant 1 heure 30 minutes à 30°C dans 50 mL de tampon A avec 50 nCi d ’acétyl-CoA marqué au 14C, puis le gel a été lavé 4 fois 20 minutes et 2 fois lh30 avec du TCA 5%. Le gel a ensuite été séché et exposé durant 3 mois contre un écran de phosphore.
2.3. Immunobuvardage
Les échantillons ont été resuspendus dans le tampon de chargement SDS PAGE 2X, portés à ébullition 10 minutes et déposés sur un gel de polyacrylamide d ’une épaisseur de 0,5 mm. Les protéines ont migré à un voltage ajusté entre 90 et 150V dans le tampon de migration SDS PAGE jusqu’à ce que le front de migration ait atteint le bas du gel, puis les protéines ont été transférées sur une membrane de nitrocellulose dans le tampon de transfert (glycine 38,63 mM, TRIS 47,88 mM, SDS 1,28 mM, éthanol 20%) à 100 V pendant une heure. La membrane a été immergée dans le tampon de blocage (PB S IX, 5% lait) durant une heure puis incubée avec l’anticorps primaire dilué dans le tampon de blocage pour la nuit. Les anticorps primaires utilisés ont été MYST2 (abcam ab70183) et H4 acétylé en lysine 5, 8, 12 ou 16 (Millipore 17-211) dilués 1 :1000. La membrane a ensuite été lavée 3 fois 5 minutes dans du PBS IX puis incubée avec l’anticorps secondaire diluée dans le tampon de
7
26
secondaire (Goat anti-rabbit IRDye 800CW Li-Cor #926-32211) a été dilué 1 :10 000. Les protéines ont été visualisées en utilisant l’Odyssey Imaging system (LI-COR Biosciences).
2.4. Extraction et identification des ARNm chez les spermatides rondes
Les spermatides rondes ont été purifiées par FACS (Leduc et al., communication personnelle). L ’ARN des cellules triées par FACS ou testiculaires totales a été extrait avec le RNeasy de Qiagen (#74104). La présence d ’ARNm codant pour des HATs a été vérifiée avec la RT2 Profiler PCR array (Qiagen #PAMM-085Z) pour les enzymes de modification de la chromatine.
2.5. Préparation des extraits nucléaires testiculaires totaux et SRS (spermatides
résistantes à la sonication)
Les souris ont été sacrifiées selon le protocole en place à l’animalerie du CHUS (3 souris pour un extrait nucléaire testiculaire total, 6 souris pour un extrait SRS). Les testicules ont été prélevés et conservés dans du PBS IX stérile sur glace. La capsule a été retirée et les tubules séminifères ont été homogénéisés dans 750 p L de PBS IX à l’aide de ciseaux et d’une pipette P1000. L’homogénat a été filtré à travers un filtre BD Falcon Cell Strainer 40 p M Nylon (#352340) et les tubes ont été lavés avec 750 p L de PBS dont le volume est également déposé sur le filtre. L ’homogénat a été séparé en 3 pour les extraits totaux ou en 6 pour les extraits SRS et centrifugé à 3000 rpm durant 1 minute, puis lavé 2 fois au PBS. Pour l’extrait de SRS, les culots ont été resuspendus dans 500 p L de PBS, soniqués (sonicateur Misonix S4000) 6 fois 30 secondes avec 15 secondes de pause à une amplitude de 25% puis centrifugés à 5000 rpm 7 minutes. Pour les deux types d’extraits, les culots ont été resuspendus dans 1,5 mL de tampon A (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 1 mM EDTA) et incubés sur glace durant 15 minutes avant d ’être centrifugés à 13000 rpm durant 10 minutes. Les culots ont été resuspendus dans 250 p L de tampon B (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 1,5 mM MgCE) et incubés sur glace 30 minutes. L ’homogénat a été
27
soniqué sur glace 6 fois 30 secondes à 25% d ’amplitude, avec des pauses de 10 secondes. Ils ont ensuite été centrifugés à 13000rpm durant 10 minutes et les surnageants ont été récupérés et conservés à -80°C avec 25% de glycérol.
2.6. Préparation de l’extrait nucléaire de culture cellulaire NIH 3T3
Environ 6 millions de cellules ont été utilisées pour préparer l ’extrait nucléaire (3 millions de cellules par tubes à minicentrifuge). Les cellules ont été centrifugées à 6000 rpm durant 3 minutes, puis lavées 2 fois avec 1 mL de PBS IX. Elles ont été resuspendues dans 750 pL de tampon A (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 1 mM EDTA) et incubées sur glace durant 15 minutes. Les cellules ont été lysées en utilisant une seringue 26G puis centrifugées 10 minutes à 6000 rpm. Le culot a été lavé avec 300 pL de tampon B (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 1,5 mM MgCh) puis incubé sur glace 30 minutes. L’homogénat a été soniqué (sonicateur Misonix) sur glace 6 fois 30 secondes à 25% d ’amplitude, avec des pauses de 10 secondes, et centrifugé durant 20 minutes à 13000 rpm. Le surnageant contenant les protéines nucléaires a été récupéré et conservé à -80°C avec 25% de glycérol jusqu’à son utilisation.
2.7. FPLC
L’échantillon a été injecté dans le FPLC (GE Healthcare Akta) et fractionné grâce à une colonne échangeuse d’ions monoQ 4.6/100 PE (GE Healthcare #17-5179-01) ou monoS 4.6/100 PE (GE Healthcare #17-5180-01). Les protéines liées à la colonne ont été éluées avec un gradient croissant de NaCl jusqu’à 1 M et récoltées dans des fractions de 1,5 mL. Les fractions ont été conservées avec du glycérol à -80°C jusqu’à leur utilisation.
28
2.8. Test HAT SDS-PAGE radioactif
Les échantillons à tester ont été incubés à 32°C pendant 1 heure en présence de tampon d ’activité HAT 5X (250 mM Tris-HCl pH8.0, 50% glycérol, 5 mM dithiothréitol, 50 mM butyrate de sodium), 20 pg d ’histones calf thymus (Sigma #H9250) et d ’Acétyl-CoA radiomarqué au 14C (0,04 pCi). La réaction a été précipitée au TCA et les culots ont été resuspendus dans le tampon de chargement SDS PAGE. Les échantillons ont été séparés avec un gel de polyacrylamide 0,75 mm 15%. Le gel a été séché puis exposé contre un écran de phosphore.
2.9. Production d ’une protéine recombinante
Le plasmide pGEX-2T contenant la construction codant pour les acides aminés 1 à 34 de l’histone.H4 a été fourni par le Dr. Michael Gmnstein (Hecht et al., 1995). Le milieu de culture LB (100 pg/mL ampicilline) a été inoculé avec une culture de E. coli Rosetta contenant le plasmide pGEX-2T H4 N-terminal. La culture a été incubée à 37°C avec agitation jusqu’à l ’obtention d’une densité optique de 0,4 à 0,6, puis la production de la protéine recombinante a été induite par l’ajout d ’une concentration finale de 0,4 mM d’IPTG durant 3 heures à 37°C. Les bactéries ont été récupérées et resuspendues dans le tampon de lyse (20 mM Tris-HCl pH8.0, 200 mM NaCl, 1 mM EDTA pH 8.0), puis lysées par un gel rapide suivi d ’une sonication à une puissance de 25% de 5 fois une minute (sonicateur Misonix). Du Triton X-100 a été ajouté à une concentration finale de 1% puis le lysat a été incubé sur glace 30 minutes. Suite à une centrifugation à 12 000 X g durant 10 minutes, le surnageant a été incubé avec la résine glutathione sepharose 4B (GE Healthcare #17-0756-01) durant une heure à 4°C. Les protéines non liées ont été lavées 5 fois avec le tampon de lavage (20 mM Tris-HCl pH 7.5, 5 mM MgCl2, 300 mM NaCl, 0.1% NP40,
10% glycérol, 1 mM glutathione réduite) puis éluées avec le tampon d ’élution (50 mM Tris-HCl pH 8.0, 50 mM glutathione réduite).
29
2.10. Test HAT immunobuvardage
Les échantillons à tester ont été incubés à 32°C pendant 1 heure en présence de tampon d ’activité HAT 5X, 5 ug d’histone H4 N-terminal GST et 0,06 mM d ’acétyl-CoA. La réaction a été précipitée au TCA et les culots ont été resuspendus dans le tampon de chargement SDS PAGE. Les niveaux d ’acétylation ont été évalués par immunobuvardage.
2.11. 2D-DIGE
Le pH des échantillons a été ajusté à 8 puis ceux-ci ont été marqués avec le Cy3 (Cyanine 3-NHS ester pack, Enzo life sciences #ENZ-42541) ou le Cy5 (Cyanine 5-NHS ester pack, Enzo life sciences #ENZ-42542) à la température de la pièce durant 1 heure (500 pmol de Cy3 ou Cy5 pour 50 pg de protéines). Les protéines marquées ont été précipitées au TCA puis resuspendues dans 65 pL tampon de réhydratation (Bio-Rad #163-2106) et combinés. La bandelette de 7cm à pH 3-10 (Bio-Rad #163-2000) a été réhydratée à 50 V en présence des protéines durant la nuit avec le protean IEF (Bio-Rad #165-4001). Les protéines de l’échantillon ont été séparées selon le point isoélectrique (pH auquel la protéine^ n ’a globalement pas de charge) jusqu’à 10 000 Volts-heure. Les bandelettes ont ensuite été équilibrées 15 minutes dans le tampon I (0,375 M Tris-HCl pH8.8, 20% glycérol, 6 M urée, 2% SDS, 0,13 M DTT) puis 15 minutes dans le tampon II (0,375 M Tris-HCl pH8.8, 20% glycérol, 6 M urée, 2% SDS, 0,13 M iodoacétamide). La bandelette a été déposée sur un gel de polyacrylamide (Bio-Rad #161-1392). De l ’agarose 1% à basse température de fusion a été ajouté pour combler l’espace libre entre la bandelette et le gel de polyacrylamide. Les protéines ont été séparées selon le poids moléculaire à 200 V. Les protéines ont été visualisées au Typhoon (Typhoon Trio GE Healthcare). Les images ont été analysées avec le logiciel Delta2D (Decodon) pour sélectionner les protéines intéressantes. Les protéines ont été colorées avec la lumitein (biotium #21002-1) et les protéines d ’intérêts ont été extraites et conservées à -80°C jusqu’à leur analyse par spectrométrie de masse.
30
2.12. Spectrométrie de masse
Les échantillons ont été analysés à l ’institut de recherche en immunologie et en cancérologie (IR1C, Université de Montréal) par nanochromatographie liquide couplée à un spectomètre de masse hybride (nano-LC-MS/MS). Les protéines ont été digérées de façon automatisée avec le ProPre (Perkin Elmer), puis injectées dans le nano-LC-MS/MS (Q- STAR de Sciex) à un débit de 600nl/min. L’identification des protéines a été faite avec les logiciels Mascot Daemon et Mascot Distiller, puis le profil peptidique a été effectué avec des logiciels développés à l ’IRIC.
2.13. GST pull down
500 pL de résine glutathione sepharose 4B (GE #17-0756-01) ont été équilibrés avec 1 mL de tampon B (10 mM Tris-HCl pH 7.4, 10 mM NaCl, 1,5 mM MgCl2) en rotation à 4°C durant 10 minutes. La résine a été centrifugée à 2000 rpm 2 minutes et le surnageant a été retiré. H4-GST (1790 pg) a été incubé avec la résine en rotation à 4°C durant 1 heure puis lavé 2 fois avec du PBS IX. L ’extrait (extrait de NIH 3T3 ou extrait de SRS) a été ajouté à la résine liée à H4-GST et incubé avec la résine en rotation à 4°C durant 2 heures, puis la résine a été lavée 2 fois avec du PBS IX. Les protéines ont été éluées en ajoutant 250 pL de tampon d ’élution (50 mM Tris HC1 pH 8.0, 50 mM glutathione réduite) et en incubant avec agitation à 4°C 20 minutes, puis une deuxième élution a été effectuée de la même manière. L’éluat a été conservé à -80°C avec du glycérol à une concentration finale de 25%.
2.14. Test d’activité HAT avec immunoprécipitation
L ’anticorps détectant l’histone H4 (1 pg de #Ab7311, Abcam) a été dilué dans 100 pL de PBST, ajouté à 25 pL de Dynabeads (#10004D, Invitrogen) et incubé en rotation à la température de la pièce durant 1 heure et 30 minutes. Durant ce temps, l’extrait à tester a été incubé durant 1 heure à 30°C en présence de tampon d ’essai HAT 5X (250 mM Tris- HCl pH8.0, 50% glycérol, 5 mM DTT, 50 mM butyrate de sodium, inhibiteurs de protéases), 10 pg d ’histones de thymus de veau (#H9250, sigma), 0,02 pCi d ’acétyl-CoA
31
14C. Le complexe billes-anticorps a été lavé avec du PBST. Pour mesurer le bruit de fond, l’extrait a été bouilli durant 10 minutes pour détruire l’activité enzymatique. Le complexe billes-anticorps a été lavé avec du PBST, puis incubé une heure à la température de la pièce avec le produit de la réaction d’acétylation. Le complexe billes-anticorps-histones H4 a été lavé 3 fois avec du PBST, puis resuspendu dans l’eau et ajouté au liquide à scintillation. L’intensité a été mesurée avec un compteur à scintillation (Beckman Coulter LS6500).
3. RÉSULTATS
Deux approches ont été utilisées pour identifier l’histone acétyltransférase responsable de l’hyperacétylation de l’histone H4 lors de la spermiogenèse. La première est une approche par candidats, c’est-à-dire tester la présence de différentes HATs qui semblent les plus susceptibles de remplir ce rôle. La seconde est une approche systématique, où un extrait testiculaire comportant une activité histone acétyltransférase est analysé pour tenter d’identifier les HATs présentes dans l’extrait.
3.1. Approche par candidats
3.1.1. Vérification de la présence chez la souris de l ’HAT MYST4 identifiée chez le
bovin
MYST4 est une HAT qui est exprimée durant la spermiogenèse chez le bovin (McGraw et al, 2007). J’ai vérifié par immunofluorescence sa présence dans les cellules germinales humaines avec des coupes de testicules. Comme on peut le voir dans la Figure 6, MYST4 est présent en foci dans les noyaux des spermatides rondes, donc juste avant le remodelage chromatinien que ces cellules doivent traverser. La présence du variant d ’histone acétylé yH2AX a également été vérifiée afin de faciliter l’identification des spermatides en élongation. Ainsi, MYST4 pourrait jouer un rôle dans l’hyperacétylation de l’histone H4.
37
3.2. Approches systématiques
3.2.1. Quantification des ARNm de certaines HATs chez les spermatides rondes
La présence de l’ARNm de certaines HATs a été évaluée par qPCR (PCR quantitatif ou PCR en temps réel) à l’aide de puces PCR disponible chez Qiagen. Le qPCR permet de mesurer la quantité initiale d ’ADN présente dans l’échantillon ainsi de quantifier l’abondance des ARNm. L ’ARN de spermatides rondes purifiées par FACS ou d’extrait testiculaire total a été isolé. Les cellules ont d ’abord été lysées avec un tampon guanidine isothiocyanate puis TARN a été purifié une membrane de silice et l’ADN digéré avec une DNase. Ensuite, les ARNm ont été transformés en ADNc à l ’aide de la trousse RT2 First Strand (Qiagen #330401). Ensuite, l’ADNc a été mélangé avec le RT2 SYBR Green Mastermix, qui contient les nucléotides nécessaires à la réaction de PCR ainsi que la HotStart DNA Taq polymérase. L ’échantillon est ensuite distribué dans chacun des puits de la plaque RT2 profiler PCR (Qiagent #PAMM-085Z) détectant les ARNm de gènes de modification de la chromatine. La présence de 5 gènes de ménage a été évaluée (Gusb, Hprt, Hsp90abl, Gapdh, Actb), ainsi qu’un contrôle pour la présence d’ADN génomique, 3 contrôles pour la transcription inverse, et trois contrôle pour vérifier l ’efficacité de la réaction de PCR. (qui contient une séquence d ’ADN amplifiée lors du PCR). Les 3 contrôles pour la réaction de PCR permettent également de vérifier la reproductibilité entre les différents puits de la plaque. Pour la réaction de PCR, le rotor gene Q de Qiagen a été utilisé. Un premier cycle a été effectué durant 10 minutes à 95°C afin d ’activer la polymérase, puis 40 cycles (15 secondes à 95°C, 30 secondes à 60°C) ont permis l’amplification des ARNm. Grâce à la très grande reproductibilité de ces puces, Qiagen ne recommande pas d ’effectuer un duplicata. Suite à la réaction de PCR, une valeur de CT
(threshold cycle ou cycle seuil) a été obtenue pour chaque ARNm vérifié. Le CT est le nombre de cycle de PCR à partir duquel le produit d ’amplification de la réaction est détectable. Il est dépendant de la quantité d ’ARNm présent dans l’échantillon testé. Ainsi, plus le ÇT est petit plus l’ARNm est présent en grande quantité.
38
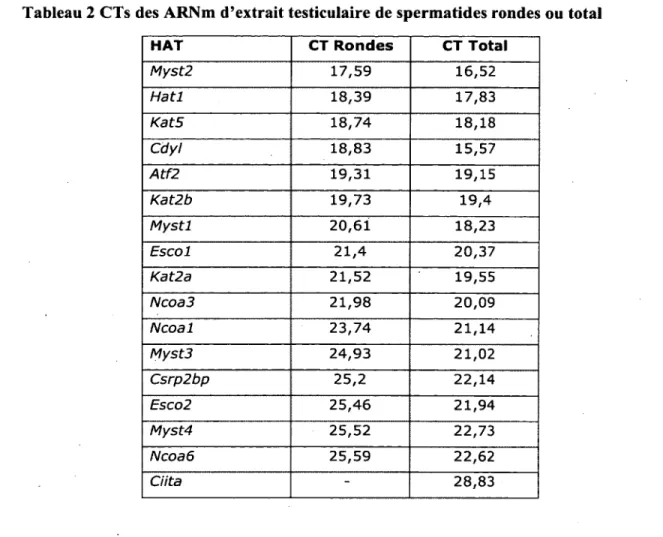
Tableau 2 CTs des ARNm d’extrait testiculaire de spermatides rondes ou total
HAT CT Rondes CT Total
Myst2 1 7 , 5 9 1 6 , 5 2 Hatl 1 8 , 3 9 1 7 , 8 3 Kat5 1 8 , 7 4 1 8 , 1 8 Cdyl 1 8 , 8 3 1 5 , 5 7 Atf2 1 9 , 3 1 1 9 , 1 5 Kat2b 1 9 , 7 3 1 9 , 4 M ystl 2 0 , 6 1 1 8 , 2 3 Escol 2 1 , 4 2 0 , 3 7 Kat2a 2 1 , 5 2 1 9 , 5 5 Ncoa3 2 1 , 9 8 2 0 , 0 9 Ncoal 2 3 , 7 4 2 1 , 1 4 Myst3 2 4 , 9 3 2 1 , 0 2 Csrp2bp 2 5 , 2 2 2 , 1 4 Esco2 2 5 , 4 6 2 1 , 9 4 Myst4 2 5 , 5 2 2 2 , 7 3 Ncoaô 2 5 , 5 9 2 2 , 6 2 Ciita - 2 8 , 8 3
Les résultats obtenus sont indiqués dans le Tableau 2. C ’est l ’ARNm de l’HAT Myst2 qui serait présent en plus grande quantité chez les spermatides rondes, suivi de Hat 1, Kat5 et
Cdyl. Les résultats sont similaires pour l’extrait testiculaire total, mais c ’est Cdyl qui obtient la plus petite valeur de CT. Dans tous les cas, les CTs sont plus faibles pour l’extrait testiculaire total que pour les spermatides rondes, ce qui semble indiquer que les ARNm de ces HATs ne seraient pas présents en plus grande concentration chez les spermatides rondes que dans les autres types de cellules testiculaires. Il faut cependant considérer ce résultat avec précaution, car bien que ces expériences aient été réalisées dans les mêmes conditions et que les CTs aient été normalisés en fonction de certains ARNm de gènes de ménage, les spermatides sont un type cellulaire très particulier et on ne peut écarter la possibilité que les niveaux des ARNm des gènes de ménage varient. En effet, pour les 5 gènes de ménage testés, seul Hsp90abl est similaire pour les échantillons de spermatides rondes et de
39
cellules testiculaires totales. De plus, chez les spermatides, les ARNm ne sont pas automatiquement traduits en protéine, mais peuvent être conservés pour un usage ultérieur puisqu’il n ’y a pas de transcription lors du remodelage de la chromatine et des étapes subséquentes. Bien que la présence de l ’ARNm ne confirme pas la présence de la protéine pour lequel il code, l ’analyse des ARNm peut être un indice intéressant pour investiguer la présence de certaines HATs.
3.2.2. FPLC
Afin d’obtenir des échantillons protéiques moins complexes qu’un extrait nucléaire testiculaire total pour éventuellement procéder à une analyse par spectrométrie de masse, une séparation par FPLC a été effectuée.
Un extrait nucléaire de spermatides résistantes à la sonication a été préparé avec les testicules de 6 souris. Cet extrait a été fractionné par FPLC en utilisant une colonne monoS échangeuse de cations. Un test HAT avec la trousse de la compagnie Active M otif a été effectué pour chacune des 18 fractions obtenues par FPLC. De l’activité a été trouvée principalement dans les fractions 2, 8 et 9 (Figure 10).
54
possible d ’hyperacétyler un génome complet sans la présence d ’HATs si la concentration d ’acétyl-CoA était suffisamment élevée.
4. DISCUSSION ET CONCLUSIONS
Tel que soulevé dans l'introduction, l'acétylation globale des histones est nécessaire au bon déroulement de la spermiogenèse. Il est important d'en connaître le mécanisme puisque sa dérégulation pourrait expliquer plusieurs cas d'infertilité ou pourrait être exploitée pour le développement de stratégies contraceptives non-hormonales. L'inhibition de l'enzyme reconnaissant l'acétylation des histones des spermatides (BRDT) provoque l'infertilité et est un bon exemple de l'utilisation des voies reliées à l'acétylation comme approches contraceptives masculines (Matzuk et ai, 2012). Dans ce contexte, mes travaux rapportent que malgré une approche systématique pour identifier une HAT, soit par FPLC ou par GST pull down, il s'avère que l ’hyperacétylation de l ’histone H4 lors de la spermiogenèse ne
semble pas être le résultat de l’activité de cette famille d’enzyme. Ce pourrait être aussi le cas pour les autres histones canoniques qui deviennent acétylées aux. étapes coïncidant avec le remodelage chromatinien de la spermatide.
Les histones acétyltransférases MYST2 et MYST4 semblent être présentes en faible quantité, tel que démontré par immunofluorescence ou immunobuvardage. Par contre, il est peu probable que ces enzymes soient présentes en quantité suffisante pour expliquer l’hyperacétylation complète d’un génome. Les ARNm de certaines HATs ont été identifiés par PCR quantitatif. Par contre, il est bien connu que les cellules germinales entreposent des ARNm pour un usage ultérieur (Steger, 2001). Il n ’est donc pas certain que ces ARNm soient traduits. Par exemple, selon les CTs obtenus, l ’ARNm de Myst2 serait le plus abondant parmi ceux testés, mais les résultats d’immunobuvardage montrent que cette protéine est moins présente dans un extrait de SRS qui regroupe les spermatides allongeantes et allongées que dans un extrait testiculaire total. Il est donc peu probable que ces HATs soient surexprimées dans ce type cellulaire. Bien que certaines HATs, dont MYST2, soient présentes, leur abondance semble être insuffisante pour expliquer Phyperacétylation d’un génome complet.
L’état d’acétylation des histones est le résultat de l’équilibre entre les histones acétyltransférases et les histones désacétylases. Deux hypothèses existent pour expliquer
56
l’hyperacétylation qui se produit lors de la spermiogenèse : soit une production massive d ’une ou plusieurs histones acétyltransférases ou l’inhibition des histones désacétylases. Puisqu’il ne semble pas y avoir d ’augmentation drastique dans le niveau des HATs, il est probable que l’hyperacétylation soit plutôt due à l’inhibition des HDACs, L ’identification de la protéine 14-3-3 dans mes échantillons analysés par spectrométrie de masse semble plutôt indiquer une inhibition des HDACs. Il a été démontré que la protéine 14-3-3 possède la propriété de séquestrer au cytoplasme certaines HDACs (Grozinger et Schreiber, 2000). Autant l’approche par FPLC que celle par GST pull down ont permis l’identification par spectrométrie de masse de certaines protéines mitochondriales impliquées dans le métabolisme de l’acétyl-CoA, dont l’enzyme ACAT1. Ces enzymes pourraient acétyler les histones ou influencer le niveau d ’acétyl-CoA à la hausse au cours du remodelage de la chromatine.
Environ 20% des protéines mitochondriales sont acétylées (Kim et al, 2006). Les mitochondries possèdent donc certainement un système pour être en mesure d ’acétyler un si grand nombre de protéines. Pourtant, aucune acétyltransférase mitochondriale n ’a été identifiée jusqu’à maintenant, bien que certaines désacétylases soient présentes dans les mitochondries (Lombard et ai, 2007). Par contre, une acétyltransférase bactérienne capable entre autre d ’acétyler les histones a été découverte chez Salmonella enterica. Hors, les mitochondries sont très semblables aux bactéries (Vetting et ai, 2004). Il est donc envisageable qu’une protéine mitochondriale joue un rôle dans l’acétylation de diverses protéines, dont les histones. Une des protéines mitochondriales identifiée par spectrométrie de masse dans les échantillons protéiques présentant la capacité d ’acétyler les histones pourrait jouer le rôle d’une HAT lors de la spermiogenèse. Il serait intéressant de vérifier la capacité de ces protéines à acétyler les histones.
Une autre piste à envisager serait celle de l’autoacétylation des histones. En effet, une hausse du niveau d’acétyl-CoA conjuguée à une diminution de l ’activité HDACs pourraient résulter en un hyperacétylation des histones. Il a été démontré que les histones pouvaient être acétylées non-enzymatiquement (Krajewski, 1996). Mais peu de groupes de recherche semblent s’être intéressés à ce mécanisme par la suite. Mes résultats confirment in vitro qu’une forte concentration d’acétyl-CoA est suffisante’ pour permettre l’autoacétylation de
57
l’histone H4. Or l’enzyme ACAT1 est présente chez les spermatides en élongation, tel que démontré par immunofluorescence, et cette enzyme catalyse la transformation réversible d ’acétoacétyl-CoA en deux acétyl-CoA. Elle pourrait ainsi influer sur le niveau d ’acétyl- CoA présent chez les spermatides. Le niveau élevé d’acétyl-CoA permettrait l’autoacétylation de l’histone H4. Cette histone pourrait ainsi être hyperacétylée dans tout le génome même en l’absence d ’HATs.
Selon mes observations, l’hypothèse la plus plausible pour expliquer Thyperacétylation de Thistone H4 lors de la spermiogenèse serait l ’augmentation du niveau d ’acétyl-CoA chez les spermatides au cours du remodelage de la chromatine. Cette augmentation serait effectuée par la protéine ACATl, bien qu’on ne puisse exclure la participation d ’autres enzymes à ce processus. Suite à l’augmentation du niveau d ’acétyl-CoA, les histones seraient autoacétylées dans tout le génome, ce qui permettrait leur déplacement et leur remplacement par les protéines de transition puis les protamines, événements essentiels au bon déroulement de la spermatogenèse.
À pH physiologique, la grande majorité des lysines sont protonées sur leur chaîne latérale. Or, c’est la forme non-protonée qui doit réagir avec le groupement acétyl. Il est cependant possible que le pH nucléaire de la spermatide s’élève transitoirement permettant une augmentation de la proportion des formes non-protonées de lysines facilitant l’auto acétylation si les concentrations nucléaires d ’acétyl-CoA sont optimales. Des expériences sont en cours afin de vérifier cette hypothèse.
Le remodelage chromatinien de la spermatide est indispensable à la formation d ’un gamète fonctionnel. Le contrôle métabolique des concentrations nucléaires d’acétyl-CoA pourrait avoir un effet déterminant sur ces étapes cruciales de différenciation et s’avérer une stratégie de choix pour le développement de contraceptifs masculins puisque peu d ’options pharmacologiques existent pour l’instant.
5. REMERCIEMENTS
Tout d ’abord, je tiens à remercier mon directeur de recherche, Dr Guylain Boissonneault, pour m ’avoir donné l’opportunité d’effectuer ma maîtrise dans un domaine passionnant, ainsi que pour son écoute et sa disponibilité au cours de ma maîtrise.
Ensuite, je remercie mes collègues Frédéric Leduc, Mélina Arguin, Marie-Chantal Grégoire, Geneviève Acteau, Olivier Simard, Marc-André Brazeau et Julien Massonneau pour leur aide et leur expertise.
Je souhaite également remercier mes proches pour m ’avoir soutenu et encouragé durant ma maîtrise, tout particulièrement mes parents, Serge Leroux et Guylaine Ducharme, et mon conjoint Kevin Bédard-St-Amant.
Je remercie Dr Xavier Roucou pour son soutien technique et l’utilisation du FPLC.
Finalement, je remercie le CRSNG (Conseil de Recherches en Sciences Naturelles et en Génie du Canada), le FRSQ (Fonds de Recherche en Santé du Québec) et le RQR (Réseau Québécois en Reproduction) pour leur soutien financier.