Université de Sherbrooke
L’association du récepteur β2-Adrénergique (β2AR) avec les protéines RGGT et HACE1 module son trafic intracellulaire en régulant les mécanismes de maturation et
d’activation de la protéine Rab11a
Par
Véronik Lachance Département de Biochimie
Service de Rhumatologie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du grade de Philosophiae Doctor (Ph.D.) en Biochimie
Sherbrooke, Québec, Canada Avril, 2014
Membres du jury d’évaluation
Dr. Jean-Luc Parent, Département de Médecine Dr. Xavier Roucou, Département de Biochimie Dr. Richard Leduc, Département de Pharmacologie
Dr. Audrey Claing, Département de Pharmacologie, Faculté de Médecine, UdeM
ii Don’t worry, be happy, la vie finit toujours par arranger les choses -Pépé
iii
RÉSUMÉ
L’association du récepteur β2-Adrénergique (β2AR) avec les protéines RGGT et HACE1 module son trafic intracellulaire en régulant les mécanismes de maturation et
d’activation de la protéine Rab11a
Par
Véronik Lachance Programme de Biochimie
Thèse présentée à la Faculté de médecine et des sciences de la santé en vue de l’obtention du diplôme de Philosophiae Doctor (Ph.D) en Biochimie, Faculté de médecine et des sciences de la santé, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4
L’expression de surface des récepteurs couplés aux protéines G (GPCRs) est un processus hautement régulé et très important dans le maintien de l’homéostasie cellulaire. En effet, un déséquilibre dans leur niveau d’expression est souvent relié à différentes pathologies comme le cancer, le diabète, l’obésité, les maladies cardiovasculaires et les maladies neurodégénératives. C’est pourquoi la compréhension des mécanismes moléculaires influençant ce phénomène est si importante et nous permettra d’élaborer et/ou d’améliorer les médicaments ciblant la régulation de ce processus.
Il est bien connu qu’un des acteurs importants dans le trafic vésiculaire des GPCRs est représenté par la famille des Rab GTPases. Effectivement plusieurs de ces dernières, soit les Rabs 1, 2, 4, 5, 6, 7, 8 et 11 pour ne nommer que les plus connues, modulent l’expression de surface des GPCRs. De plus, certaines études soulèvent la possibilité qu’un GPCR soit lui-même capable de réguler son propre trafic intracellulaire, et ce grâce à son interaction avec les Rab GTPases. Toutefois, le mécanisme emprunté par le GPCR pour atteindre cette fin reste à élucider.
Dans le présent travail, je démontre que le GPCR, β2AR, module non seulement la
maturation de la petite protéine G Rab11a grâce à son interaction avec la Rab GéranylGéranylTransférase (RGGT), mais influence également son activation en modulant son ubiquitination via son association avec la E3-ubiquitine ligase, HACE1. De plus, je révèle que la sous-unité alpha de la RGGT (RGGTA) accroît significativement la maturation et le transport antérograde du récepteur β2AR, ce qui souligne ainsi un nouveau
rôle cellulaire pour cette protéine. L’ensemble des résultats générés appuie l’hypothèse qu’un GPCR puisse contrôler son propre routage intracellulaire, et éclaircit les mécanismes utilisés pour réguler l’activé de la Rab GTPase avec laquelle il interagit.
Mots clés : Récepteurs couplés aux protéines G, Rab GTPases, trafic vésiculaire, prénylation, ubiquitination.
v
SUMMARY
β2-Adrenergic Receptor (β2AR) association with RGGT and HACE1 modulates its intracellular trafficking by regulating Rab11a maturation and activation mechanisms
By
Véronik Lachance Biochemistry Program
Thesis presented at the Faculty of medicine and health sciences for the obtention of Doctor degree diploma Philosophiae Doctor (Ph.D) in Biochemistry Faculty of medicine and
health sciences, Université de Sherbrooke, Sherbrooke, Québec, Canada, J1H 5N4 Cell surface expression of G Protein-Coupled Receptors (GPCRs) is a highly regulated and very important phenomenon for keeping cellular homeostasis. In fact, dysregulation of their cell expression is related to many diseases like cancer, neurological disorders, obesity, diabetes and cardiovascular diseases. These facts illustrate how important understanding the molecular mechanisms involved in cell surface transport of those receptors is, which will help us in designing or improving drugs which actually target this pathway.
Rab GTPases are proteins known for being essential regulators of GPCR vesicular trafficking. Indeed, an increasing number of studies report the implication of Rab1, 2, 4, 5, 6, 7, 8 and 11 (to cite the most frequently studied) cell surface transport of GPCRs. Moreover, some studies also put forward the possibility that a GPCR might be able to regulate its own cellular trafficking by interacting and controlling activation of Rab GTPases. However, the mechanism involved in this process remains to be clarified.
In the present study, I demonstrate that the prototypic GPCR, β2AR, not only
modulates prenylation/maturation of the small G protein Rab11a by interacting with Rab GeranylGeranylTransferase (RGGT), but also influences Rab11a activation by modulating its ubiquitination via its association with the E3-ubiquitin ligase, HACE1. Furthermore, I reveal that the α subunit of the RGGT (RGGTA) also promotes the maturation and anterograde transport of the receptor, which highlight a new cellular role for this protein. Altogether, those results support the hypothesis that GPCRs control their own trafficking, and shed light on some of the mechanisms that might be employed by those receptors in activation of Rab GTPases.
Keywords: G Proteins-Coupled Receptors, Rab GTPases, vesicular trafficking, prenylation, ubiquitination
vi
TABLE DES MATIÈRES
Résumé ... iii
Summary ... v
Table des matières ... vi
Liste des figures ... ix
Liste des tableaux ... xi
Liste des abréviations ... xii
Introduction ... 1
1. Les Récepteurs Couplés aux Protéines G (GPCRs) ... 1
1.1 Synthèse et Maturation des GPCRs ... 3
1.1.1. Première étape : Repliement des GPCRs dans le RE ... 3
1.1.2. Deuxième étape : Export du RE ... 6
1.1.3. Troisième étape : Tri fait au ERGIC ... 7
1.1.4. Quatrième étape : L’appareil de Golgi ... 8
1.2. Activation et Signalisation des GPCRs ... 10
1.2.1. Mode d’activation et Changements structuraux ... 10
1.2.2. Processus de signalisation ... 13
1.2.2.1. Modèle de Signalisation classique ... 13
1.2.2.2. Modèle de Signalisation biaisée ... 17
1.3. Processus de désensibilisation et resensibilisation des GPCRs ... 17
1.3.1. Désensibilisation et diminution d’expression ... 18
1.3.1.1. Internalisation ... 18
1.3.1.1.1. Initiation : Phosphorylation et Motif d’internalisation ... 18
1.3.1.1.2. Terminaison : Recrutement des β-arrestines et Formation de la cage de clathrine ... 20
1.3.1.2. Dégradation des GPCRs et stabilité de leur ARNm ... 22
1.3.2. Resensibilisation : Recyclage ... 25
2. Les petites protéines G ... 28
2.1. Structure et Maturation ... 28
2.1.1. Caractéristiques Structurales ... 28
vii
2.1.2.1. Généralités ... 29
2.1.2.2. Mécanisme d’action ... 31
2.2. Localisation ... 32
2.3. Processus d’activation/inactivation des GTPases ... 33
2.4. GPCRs et petites GTPases… ce que l’on sait... 35
2.4.1. Les Ras GTPases et les Rho GTPases ... 35
2.4.2. Les Arf/Sar GTPases ... 36
2.4.3. Les Rab GTPases ... 38
3. Pathologies associées aux GPCRs et aux Rab GTPases ... 41
3.1. Le récepteur β2-Adrénergique ... 42 3.2. La protéine Rab11a ... 45 4. Problématique et Hypothèse ... 47 4.1. Objectifs ... 48 4.1.1. Objectif 1 ... 48 4.1.2. Objectif 2 ... 48 Article 1 ... 49 Article 2 ... 81 Discussion ... 111
1. Approfondissement du mécanisme de géranylgéranylation des Rab GTPases régulé par le récepteur β2AR ... 112
2. Implication de la RGGTA dans la maturation du récepteur β2AR ... 114
3. Caractérisation du rôle d’HACE1, sans son activité d’E3-ubiquitine ligase, dans le transport antérograde du récepteur β2AR ... 115
4. Détermination de l’activité GEF d’HACE1 et caractérisation de la fonction de l’ubiquitination de Rab11a dans son mécanisme d’activation. ... 117
5. Caractérisation du mécanisme d’ubiquitination de Rab6a et Rab8a ... 119
6. Implication physiopathologique des mécanismes présentés ... 119
Conclusion ... 122
Remerciements ... 123
Liste des références ... 124
viii Annexe II ... 136 Annexe III ... 137 Annexe IV ... 138
ix
LISTE DES FIGURES
INTRODUCTION
Figure 1: Les récepteurs membranaires. ... 1
Figure 2: Diversité des ligands pouvant lier les GPCRs. ... 2
Figure 3: Initiation de la synthèse de protéines membranaires et/ou de sécrétion. ... 4
Figure 4: Les types de N-glycosylation. ... 9
Figure 5: Diagramme illustrant les trois classes de GPCRs ainsi que leurs principales caractéristiques. ... 11
Figure 6: Schéma illustrant les sites de liaison de différents ligands sur leur GPCR ... 12
Figure 7: Changements structuraux des GPCRs suite à leur activation. ... 13
Figure 8: Cycle d’activation/désactivation des protéines G hétérotrimériques ... 14
Figure 9: Modèle de signalisation à deux phases des GPCRs. ... 15
Figure 10: Les modèles de signalisation ... 17
Figure 11: Schéma des différentes étapes de régulation du trafic des GPCRs. ... 18
Figure 12: Représentation de l’internalisation des GPCRs dépendante des arrestines ... 20
Figure 13: Les quatre complexes ESCRT et leurs sous-unités ... 23
Figure 14: Schéma résumant le trafic intracellulaire des GPCRs menant au système de dégradation lysosomal. ... 24
Figure 15: Représentation des mécanismes de recyclage ... 27
Figure 16: Structure des protéines G monomériques. ... 29
Figure 17: Biosynthèse des groupements prényles via le métabolisme du mévalonate.. ... 30
Figure 18: Représentation du mécanisme de prénylation. ... 31
Figure 19: Éléments influençant la localisation des petites protéines G. ... 33
Figure 20: Cycle d’activation et d’inactivation des petites protéines G. ... 34
Figure 21: Représentation des relations partagées entres les GPCRs, leurs effecteurs et les Ras et Rho GTPases ... 36
Figure 22: Fonctions des Arf GTPases dans la formation des vésicules de transport ... 37
Figure 23: Fonctions des Rab GTPases dans le trafic vésiculaire. ... 38
Figure 24: Principales voies de signalisation activées par les récepteurs β1AR et β2AR.. ... 44
ARTICLE 1 Figure 1 : Modulation of Rab11a geranylgeranylation by the β2AR.. ... 60
Figure 2 : Agonist-stimulation of the β2AR regulates the geranylgeranylation of Rab11a..61
Figure 3 : The β2AR interacts with and modulates the geranylgeranylation of Rab6a and Rab8a.. ... 62
Figure 4 : RGGTA and RGGTB co-immunoprecipitate with the β2AR.. ... 63
Figure 5 : RGGTA promotes the maturation and the anterograde trafficking of the β2AR.65 Figure 6 : Identification of the RGGTA-interacting site on the β2AR C-terminus ... 68
Figure 7 : Confocal microscopy analysis of β2AR and β2AR-F(X)6AA co-localization with endogenous RGGTA.. ... 69
Figure 8 : The β2AR L339L340 motif is required for RGGTA to promote receptor maturation and anterograde trafficking, as well as to modulate Rab11a geranylgeranylation………... 71
x ARTICLE 1 (FIGURES SUPPLÉMENTAIRES)
Supplementary Figure 1 : Overexpression of Rab11a does not modulate the β2AR maturation. ... 79 Supplementary Figure 2 : Identification of the RGGTB-interacting site on the β2AR C-terminus. ... 80
ARTICLE 2
Figure 1 : HACE1 interacts with β2AR and regulates its cell surface expression and
recycling ... 87 Figure 2 : HACE1 depletion affects 2AR trafficking... 88
Figure 3 : HACE1 regulates β2AR recycling through Rab11a ... 89
Figure 4 : β2AR modulates Rab11a dimerization and promotes HACE1-mediated
ubiquitination of Rab11a ... 91 Figure 5 : Ubiquitination on Lys145 of Rab11a is involved in regulation of β2AR recycling
... 93 Figure 6 : Rab11a GTPS-loading is induced by β2AR/HACE1-mediated ubiquitination .. 94
Figure 7 : Identification of Rab6a and Rab8a as HACE1 substrates ... 96 Figure 8 : Model for Rab11a activation by β2AR via HACE1-mediated ubiquitination.. .... 99
xi
LISTE DES TABLEAUX
Tableau 1: Liste des protéines influençant la synthèse/maturation des GPCRs ... 5
Tableau 2: Sous-unités des protéines G hétérotrimériques : fonctions et régulation... 16
Tableau 3: Principales caractéristiques des GRKs ... 19
Tableau 4: Signalisation médiée par les arrestines ... 21
Tableau 5: Sommaire des motifs de recyclage identifiés chez les GPCRs et leurs partenaires d’interaction ... 26
Tableau 6: La famille des Rab GTPases; localisation intracellulaire; fonctions, effecteurs et maladies associées ... 40
Tableau 7: Distribution et fonctions des récepteurs β-Adrénergiques ... 43
xii
LISTE DES ABRÉVIATIONS
AAA-ATPase ARNm α1B-AR α2A-AR α2B-AR AMPc ANK Arf AP-2 AT1R βA β-Arr β2AR βARK1, βARK2 BiP (GRP78) BP CA CB2 c-Cpn CNX COPI, COPII CREs CRT CXCR2 CXCR4 D1R D2R DAG DENND DN DOR DRiP78 DUBs ECL ERGIC ESCRT FPP FTase GI GII GAP GASP GBF1
ATPases Associated with diverse cellular Activities-Adenosinetriphosphatase
Acide ribonucléique messager Récepteur α1B-Adrénergique
Récepteur α2A-Adrénergique
Récepteur α2B-Adrénergique
Adénosine monophosphate monocyclique Ankyrin domains
ADP-ribosylation factor Adaptor Protein complex 2 Angiotensin II Type I Receptor β-amyloïde
β-Arrestine
Récepteur β2-Adrénergique
β2-Adrenergic Receptor Kinase 1 and 2
Binding immunoglobulin protein (78 kDa glucose-regulated protein) Bisphosphonates
Constutivement actif
Cannabinoid receptor type 2 Cytosolic-chaperonin Calnexine
Coat protein I and II cAMP response elements Calréticuline
C-X-C chemokine receptor type 2 C-X-C chemokine receptor type 4 Dopamine Receptor D1
Dopamine Receptor D2 Diacylglycerol
Differentially expressed in neoplastic and normal cells domains Dominant négatif
Delta opioid Receptor
Dopamine receptor-interacting protein 78 Deubiquitinases
Boucle extracellulaire/Extracellular loop ER-Golgi Intermediate Compartment
Endosomal Sorting Complex Required for Transport Farnésyl-pyrophosphate
Farnésyltransférase Glucosidase I Glucosidase II
GTPases-Activating Protein GPCR-associated Sorting Protein
xiii GDF (PRA) G-domains GDP GEF GGPP GGTase GRKs GRP74 GTP GTPase GPCRs HACE1 HECT Hrs Hsp ICL Icmt IP IP3 M4R MAPKs MC2R mGluR MOR MVBs MVEs NFκB NHERF (EBP50) NSF OBs OST PAR1 PDZ PFTase PI3K PKA, PKC PSs Rab11-FIPs RabF RabSF RANKL Rce1 RE
GDI displacement factor (Prenylated Rab Aceptor protein) GTP-binding domains
Guanosine Diphosphate
Guanine nucleotide Exchange Factor Géranylgéranyl-pyrophosphate Géranylgéranyltransférase
G protein-coupled Receptor Kinases 74 kDa glucose-regulated protein Guanosine Triphosphate
Guanosine TriPhosphatase
Récepteurs couplés aux protéines G/G protein-coupled receptors HECT domain and Ankyrin repeat-Containing E3 ubiquitin-protein ligase 1
Homologous to the E6-AP Carboxyl Terminus
Hepatocyte-growthfactor regulated tyrosin kinase substrate Heat shock protein
Boucle intracellulaire/Intracellular loop Isoprenylcysteine carboxyl methyltransferase Prostacyclin receptor (Prostaglandin I2 Receptor)
Inositol Triphosphate Muscarinic 4 receptor
Mitogen-Activated Protein Kinases Melanocortin Receptor type 2 Metabotropic Glutmate Receptor Mu opioid Receptor
Corps multivésiculaires/Multivesicular bodies
Endosome multivésiculaires/Multivesicular endosomes Nuclear factor-kappa B protein
NA+/H+ exchanger regulatory factor (Ezrin-radixin-moesin (ERM)-binding phosphoprotein 50)
NEM-sensitive factor Ostéoblastes
Oligosaccharide Transférase Protease-Activated receptor 1
Domaine présent chez les protéines : Post synaptic density protein (PSD95), Drosophila disc large tumor suppressor (Dlg1), and Zonula occludens-1 protein (zo-1)
Prényltransférase
Phosphatidylinositol-3-Kinase Protein Kinase A and C Presinilines
Rab11-Family Interacting Proteins Rab Family motif
Rab subfamily motif
Receptor activator of nuclear factor kappa-B ligand Ras converting enzyme 1
xiv REP-1 RGGT RGGTA RGGTB RGS SNARE (t- et v-) SNP SNX1 SRC SRP SST3R TGN TM TPβ Tsg101 UIM UXT-2 V1B/V3 V2R VHS Vps4
Rab escort protein-1
Rab GeranylGeranylTransferase
Rab GeranylGeranylTransferase alpha subunit Rab GeranylGeranylTransferase beta subunit Regulator of G protein Signalling
Soluble NSF Attachment Protein receptor (target et vesicle) Single nucleotide polymorphism
Sorting Nexin-1
Proto-oncogene tyrosine-protein kinase Sarcoma
Particule de reconnaissance du signal/Signal Recognition Particle Somatostatin 3 receptor
Trans Golgi Network
Domaine transmembranaire/Transmembrane Isoforme β du récepteur au thromboxane Tumor suppressor gene product 101 Ubiquitin-Interacting Motif
Ubiquitously Expressed Transcript-2 Récepteur de la vasopressine de type 3 Récepteur de la vasopressine de type 2
Domaine présent chez les protéines VPS-27, Hrs and STAM Vacuolar protein-sorting 4
1
INTRODUCTION
1. Les Récepteurs Couplés aux Protéines G (GPCRs)
Comme tout bon système, toute bonne société, toute bonne entreprise et toute bonne relation, le corps humain se doit d’avoir un réseau de communication fonctionnel afin que puissent régner harmonie et équilibre entre ses nombreux systèmes physiologiques (cardiaques, digestifs, nerveux, etc.). Bien évidemment, l’entité la plus fondamentale dévouée à réguler cet équilibre n’est nulle autre que la cellule. La présence de récepteurs membranaires exprimés au niveau de sa surface, est l’un des facteurs qui lui permet de détecter les signaux environnants et d’ainsi réagir à ces derniers. Ces récepteurs se divisent en trois grandes catégories : les récepteurs à canaux, les récepteurs à activité enzymatique
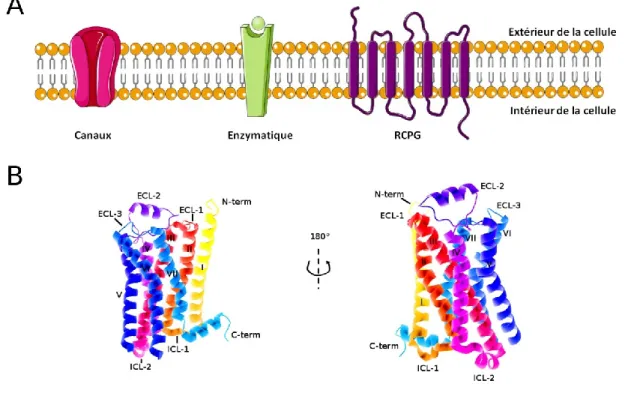
Figure 1: Les récepteurs membranaires. (A) Représentation des principaux types de récepteurs membranaires : les canaux, les récepteurs à activité enzymatique et les récepteurs couplés aux protéines G (GPCRs). (B) Structure tridimensionnelle du récepteur β2AR montrant les extrémités N- et C-terminales, les sept domaines transmembranaires (I-VII) et les boucles extra- (ECL) et intracellulaires (ICL) (PDB 3P0G) (Rasmussen et al., 2011). Images obtenues à l’aide du logiciel PyMOL (www.pymol.org).
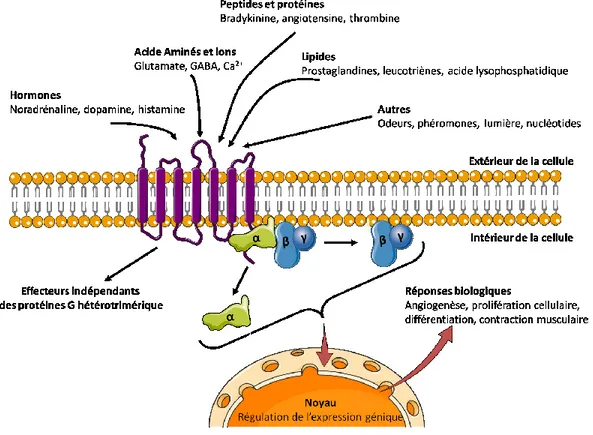
2 et les récepteurs couplés aux protéines G (GPCRs) (Figure 1A). Parmi ceux-ci, les GPCRs constituent approximativement 4 % du génome humain, soit une possibilité de 865 gènes sur 20 687 (Fredriksson and Schioth, 2005; Harrow et al., 2012). C’est par cette observation que les GPCRs représentent la plus importante classe de récepteurs membranaires. Ces derniers possèdent une topologie typique comportant une extrémité N-terminale extracellulaire, sept domaines transmembranaires (TM I-VII) reliés par trois boucles extracellulaires (ECL) et trois boucles intracellulaires (ICL) ainsi qu’une extrémité C-terminale intracellulaire (Figure 1B). Un large spectre de molécules, allant du simple photon à la plus complexe des protéines, peut interagir avec ces récepteurs. Une fois la liaison récepteur/ligand établit, s’initie une cascade de réactions via l’activation de la protéine G hétérotrimérique associée au récepteur (Figure 2). Cette action entraîne ainsi différentes réponses biologiques pouvant se traduire physiologiquement en contraction musculaire (cardiaque ou utérine lors d’un accouchement par exemple), en réponse visuelle, gustative et olfactive. Toutefois, pour que ces récepteurs puissent être
Figure 2: Diversité des ligands pouvant lier les GPCRs (Inspiré de Marinissen and Gutkind, 2001).
3 correctement activés, ils se doivent d’être convenablement acheminés jusqu’à la surface cellulaire. Pour ce faire, la cellule a su développer un éventail de mécanismes hautement régulés veillant à leur bonne synthèse et leur bon cheminement lors de leur passage au niveau intracellulaire.
1.1. Synthèse et Maturation des GPCRs
1.1.1. Première étape : Repliement des GPCRs dans le RE
Comme la majorité des protéines membranaires, la synthèse des GPCRs se déroule au sein de la voie de production des protéines de sécrétion. Il est ainsi sous-entendu que les GPCRs débutent leur synthèse au sein du réticulum endoplasmique (RE). Ce processus est communément appelé processus de translocation co-traductionnelle. De manière plus détaillée, l’acheminement du polypeptide en synthèse se fait suite à la reconnaissance d’une séquence signal par une particule de reconnaissance du signal (SRP, Signal Recognition Particle). La liaison de la SRP au complexe ribosome/polypeptide ralentit le processus de synthèse et permet la translocation de cet amalgame au RE grâce à l’association de la SRP à son récepteur. L’insertion du polypeptide dans la membrane du RE est ensuite possible grâce à la présence d’un complexe protéique nommé translocon. Une fois l’arrimage au translocon effectué, la traduction de la protéine reprend son cours (Araki and Nagata, 2011). La formation des domaines transmembranaires s’effectue une seconde fois grâce à l’action du translocon, mais également grâce aux signaux d’orientation compris de façon intrinsèque dans la séquence protéique du GPCR. La présence de protéines chaperonnes, de protéines co-chaperonnes, d’enzymes favorisant la formation de ponts disulfures et la glycosyl-/déglycosylation, ainsi que la formation d’oligomères sont tous des facteurs importants pour le bon repliement de ces récepteurs. Les chaperonnes les plus connues pour intervenir dans le processus de synthèse des GPCRs sont les chaperonnes dites classiques (i-e non-spécifiques aux GPCRs) : BiP (GRP78, famille des Hsp70), GRP74 (famille des Hsp90), la calnexine (CNX, lectine) et la calréticuline (CRT, lectine). Il est à mentionner, que les chaperonnes de la famille des protéines Hsp (Heat shock protein) sont principalement reconnues pour stabiliser et favoriser le repliement des protéines néo-synthétisées. Les lectines quant à elles promeuvent le bon repliement des GPCRs en empêchant l’agrégation des protéines nouvellement produites en plus d’en prévenir un
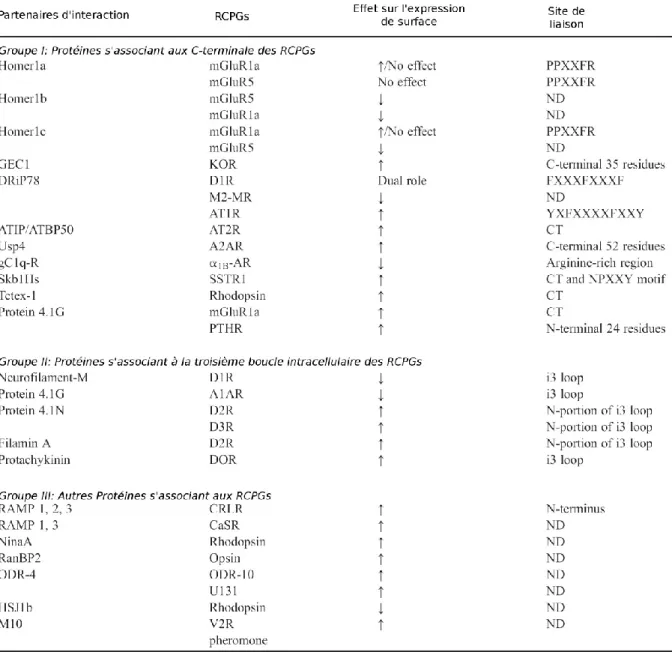
4 export prématuré (Achour et al., 2008; Araki and Nagata, 2011) (Figure 3). Bien évidemment, au fil des ans, beaucoup de protéines furent découvertes et caractérisées pour être impliquées spécifiquement dans la synthèse et/ou maturation des GPCRs. Un résumé du rôle de ces différentes protéines est présenté dans le Tableau 1. Toutefois, cet aspect ne sera pas approfondi puisqu’il aborde un sujet situé au-delà des objectifs de cette thèse.
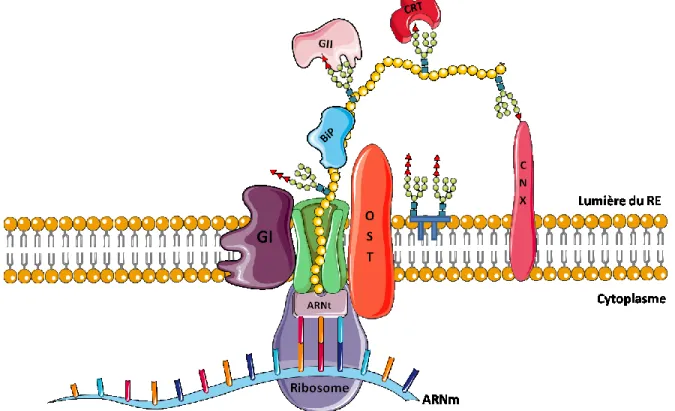
La frontière entre les processus de synthèse et de maturation des GPCRs reste ambiguë puisque ces deux procédés se font en concomitance. En effet, aussitôt le processus de translocation co-traductionnelle amorcé, déjà il y a ajout de modifications post-traductionnelles sur la chaîne polypeptidique. La N-glycosylation est sans doute une des plus importantes. Comme l’illustre la figure 3, la présence de l’oligosaccharyltransférase (OST) catalyse le transfert d’oligosaccharide (Glucose)3(Mannose)9(N-acétylglucosamine)2
du dolichol sur un résidu asparagine (N) localisé au niveau du motif consensus N-X-S/T. Figure 3: Initiation de la synthèse de protéines membranaires et/ou de sécrétion. Au fur et à mesure que l’élongation de la chaîne polypeptidique s’effectue au travers du translocon (pore en vert), divers facteurs protéiques interviennent afin d’assurer le bon repliement ainsi que la bonne maturation de la protéine. Parmi ces facteurs, on retrouve l’oligosaccharide transférase (OST), les glucosidases (GI et GII) ainsi que des chaperonnes moléculaires (BiP, CNX et CRT) (Inspiré Hebert and Molinari, 2007).
5 Par la suite, les glucosidases I et II (GI et GII) éliminent séquentiellement deux des trois glucoses présents sur l’oligosaccharide. Cette action permet ainsi aux lectines, CNX et CRT, d’accomplir leur travail. Par cette action, la glycosylation facilite le recrutement de protéines chaperonnes, augmentant du même fait la solubilité et la stabilité de la protéine nouvellement synthétisée. Une fois cette étape terminée, le GPCR quitte le RE et poursuit sa maturation.
Tableau 1: Liste des protéines influençant la synthèse/maturation des GPCRs (Adapté de Dong et al., 2007).
6 1.1.2. Deuxième étape : Export du RE
Outre le bon repliement, la formation de ponts disulfure, la formation d’oligomères et la glycosylation des GPCRs, plusieurs autres éléments participent à l’export des récepteurs provenant du RE vers l’appareil de Golgi. Un des aspects prédominants de ce procédé provient de la présence de motifs spécifiques encodés dans la structure primaire des GPCRs. Quelques-uns de ces motifs furent identifiés dans l’ICL1 et l’ICL3. En effet, il a été démontré que la mutation d’un simple résidu leucine (L), situé au cœur de l’ICL1 des récepteurs α1B-AR, α2B-AR, β2AR et AT1R, diminuait leur expression de surface;
conséquence de leur rétention au RE (Duvernay et al., 2009a). De plus, un résidu lysine (K), toujours localisé au niveau de l’ICL1, a également été identifié pour être essentiel au bon transport antérograde des récepteurs α2A-AR et α2B-AR (Fan et al., 2012). En ce qui a
trait l’ICL3, il est connu qu’un triple motif arginine (RRR) favorise le transport à la surface cellulaire du récepteur α2B-AR. En fait, une étude a prouvé que la mutation de ce motif
provoquait la rétention du récepteur au RE, étant donné que ce dernier ne pouvait plus s’associer aux composantes Sec24C/D de la protéine COPII (coat protein II), protéine essentielle aux revêtements des vésicules bourgeonnants du RE et se dirigeant vers le Golgi (Dong et al., 2012). Ainsi, ces observations soulignent l’importance de l’interaction entre les composantes de COPII dans l’export de protéines du RE. En effet, outre la présence de motifs d’export spécifiques aux GPCRs, il est bien connu que des motifs diacidiques (DXE) et dihydrophobiques (FF, LL) sont prompts à favoriser les interactions avec les composantes moléculaires de COPII (Nishimura and Balch, 1997; Nufer et al., 2003).
Généralement, la plupart des motifs d’export des GPCRs se retrouvent cryptés dans leur portion C-terminale. Jusqu’à présent, seulement quatre séquences agissent à ce titre, soit les séquences E(X)3LL, F(X)3F(X)3F, FN(X)2LL(X)3L et F(X)6LL. Dans le premier
cas, il a été démontré que les résidus E335(X)3L339L du récepteur de la vasopressine, V2R,
étaient nécessaires au bon repliement et subséquemment à la bonne maturation/glycosylation du récepteur. En fait, la mutation de ces résidus générait la rétention du récepteur au RE, empêchant ainsi la maturation/glycosylation faite au niveau du Golgi (Schulein et al., 1998). Par la suite, le motif F(X)3F(X)3F fut identifié comme
7 décrivant l’importance de ce motif poussa son analyse en démontrant que ce dernier était utile à l’association du récepteur à la protéine DRiP78. Les auteurs ont ainsi proposé que l’interaction entre DRiP78 et ce motif module le transport à la surface cellulaire du récepteur (Bermak et al., 2001). En ce qui a trait au motif FN(X)2LL(X)3L, il fut
originalement caractérisé chez le récepteur à la vasopressine V1b/V3. Tout comme il a été montré pour les autres motifs, la mutation d’un ou de plusieurs des résidus conservés de la séquence générait une rétention du récepteur au RE (Robert et al., 2005). Finalement, le motif F(X)6LL, pour sa part, fut initialement identifié chez le récepteur α2B-AR et le
récepteur AT1R. Encore une fois, il fut démontré que l’altération de cette séquence
provoquait une rétention des récepteurs au niveau du RE (Duvernay et al., 2004). Quelques années plus tard, le même groupe démontra la présence de ce motif chez les récepteurs α1B
-AR et β2AR. Lors de cette étude, ils soulignèrent que le résidu phénylalanine (F) conférait
une stabilité structurale au récepteur en interagissant avec un résidu présent au sein du TMI. Le motif LL, quant à lui, fut illustré pour être grandement accessible au niveau cytoplasmique et ainsi suspecté à promouvoir l’interaction des récepteurs avec des constituants moléculaires favorisant un transport antérograde efficace (Duvernay et al., 2009b). Cette hypothèse fut dernièrement prouvée puisque les protéines Rab8, Rab1 et la sous-unité alpha de Rab géranylgéranyltransférase (RGGTA) ont toutes été identifiées pour s’associer aux leucines du motif F(X)6LL du récepteur β2AR et ainsi augmenter l’export du
GPCR à la surface cellulaire (Dong et al., 2010a; Hammad et al., 2012; Lachance et al., 2011). L’ensemble de ces observations souligne donc l’importance du rôle des motifs d’export dans le mécanisme d’externalisation des GPCRs du RE. En résumé, ces motifs peuvent soit augmenter la stabilité structurale des GPCRs, soit en favoriser l’association avec d’autres molécules, comme la COPII et les Rab GTPases, ceci facilitant leur export. Suite à cette étape, les GPCRs peuvent continuer leur maturation au niveau de la voie de sécrétion.
1.1.3. Troisième étape : Tri fait au ERGIC
Une fois sortis du RE, les GPCRs se dirigent vers le ERGIC (ER-Golgi Intermediate Compartment). Ce compartiment est connu comme lieu discriminant les processus de transport antérograde (i-e le trafic des vésicules se dirigeant vers le cis-Golgi) et de
8 transport rétrograde (i-e le trafic des vésicules retournant au RE). Essentiellement, les protéines régulant ce processus sont la COPI, certaines Arf et Rab GTPases. L’état de la protéine néo-synthétisée, son interaction avec les protéines mentionnées précédemment ainsi que la présence de motifs de rétention (KDEL, KXXX ou RXR) sont les principales caractéristiques qui influencent le trafic vésiculaire du ERGIC (Achour et al., 2008; Appenzeller-Herzog and Hauri, 2006). En ce qui concerne les GPCRs, il a été montré que les GTPases Arf1, Arf6 et Rab1 sont impliquées dans le trafic des récepteurs du RE/ERGIC vers le Golgi. La protéine Rab2, quant à elle, régule le transport rétrograde entre le Golgi et le ERGIC/RE (Wang and Wu, 2012). Une fois cette station de contrôle traversée, les GPCRs terminent leur maturation dans les différentes cisternes du Golgi.
1.1.4. Quatrième étape : L’appareil de Golgi
Une fois rendues au Golgi, les protéines cargos, i-e les protéines transportées, ont le choix de se diriger vers la surface cellulaire, de retourner au RE ou d’être envoyées vers le système endosomal. Il est bien connu que le processus de transport associé au Golgi est régulé par l’activité de la protéine Rab6 (Achour et al., 2008; Liu and Storrie, 2012). En effet, des études démontrent que l’inaction de cette GTPase entraîne une perte d’expression de surface et diminue la maturation de plusieurs GPCRs (Dong and Wu, 2007). Lors de leur traversée du cis-, med-, et trans-Golgi, les GPCRs subiront majoritairement un changement dans leur état de glycosylation. Plus précisément, de multiples glycosyltransférases viendront altérer le/les oligasaccharides présents sur l’extrémité N-terminale et les ECLs des GPCRs. Ainsi donc, les GPCRs peuvent arborer différents types de N-glycosylation, soit le type mannose prédominant, le type hybride et le type complexe (Figure 4A). Il faut préciser que le niveau de glycosylation trouvé chez un GPCR permet d’établir l’endroit ou le trajet emprunté par ce dernier lors de sa maturation. Comme l’indique la figure 4B, les protéines arborant un état de glycosylation à mannose prédominant sont maturées et retrouvées au RE tandis que celles ayant un niveau de glycosylation de type hybride et complexe ont fort probablement traversé l’appareil de Golgi et sont considérées totalement matures (Hossler et al., 2009).
9 Figure 4: Les types de N-glycosylation. (A) Représentation structurale des trois classes de N-glycans et leur composition en monosaccharides. La signification des pictogrammes est détaillée au bas. (B) Schéma des différentes réactions de glycosylation ayant lieu dans une cellule de mammifère indiquant l’organelle où a lieu ces modifications ainsi que les glycosyltransférases associées à chaque étape (Adapté de Hossler et al., 2009).
10 Pour clore cette section, il faut surtout retenir qu’une synthèse/maturation efficace d’un GPCR est affectée dans un premier temps par la structure primaire du récepteur. Ultimement, ceci influence son repliement en modulant son association avec différentes protéines chaperonnes. Dans certains cas, cette association est induite par l’addition de modifications post-traductionnelles (ex : association des lectines aux groupements glycosyles). Ces interactions et ces changements ont pour objectif d’augmenter la solubilité et la stabilité des GPCRs en synthèse afin d’en faciliter le passage dans la voie de sécrétion. Comme discuté ci-dessus, l’action de plusieurs protéines chaperonnes (tableau 1) et de GTPases (ex : Arfs et Rabs) est également primordiale pour un transport antérograde/rétrograde efficient des GPCRs. Conséquemment, le récepteur convenablement replié sera acheminé à la surface cellulaire et apte à répondre aux signaux externes.
1.2. Activation et Signalisation des GPCRs
1.2.1. Mode d’activation et Changements structuraux
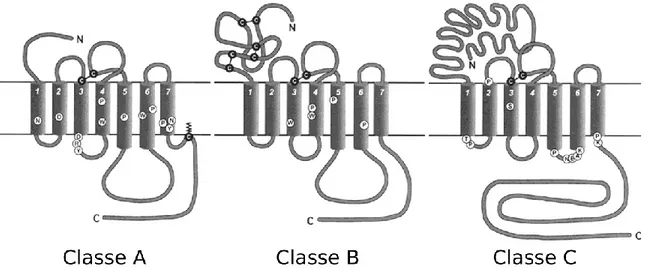
Une fois arrivés à la surface cellulaire, les GPCRs peuvent dorénavant être stimulés. Comme représentés à la figure 2, plusieurs types de ligands lient et activent ces récepteurs. Toutefois, il faut préciser que le mode d’activation, i-e le site de liaison du ligand au récepteur, va différer selon la classe/le type de GPCRs rencontré. Initialement, les GPCRs étaient reconnus pour se diviser en six grandes catégories, soit les récepteurs de classe A, B, C, D, E et F. Parmi ces classes, seulement les trois premières englobaient les GPCRs d’origine humaine (Jacoby et al., 2006; Kolakowski, 1994). La classe A représentait les GPCRs semblables à la rhodopsine, la classe B, les récepteurs similaires à la sécrétine tandis que la classe C symbolisait les récepteurs ressemblant aux récepteurs du glutamate (mGluRs, Metabotropic Glutamate Receptors). Malgré le fait qu’encore beaucoup de gens utilisent cette nomenclature, l’emploi d’un système alternatif de classification, nommé GRAFS, est plus approprié de nos jours (toutefois, pour le reste du document la nomenclature de type A, B et C sera utilisée). En effet, ce mode de classement répertorie les cinq différents types de GPCRs humains soit les récepteurs semblables aux récepteurs du glutamate (G, initialement classe C), de la rhodopsine (R, anciennement classe A), des GPCRs d’adhésion (A, compris dans la classe B), les récepteurs Frizzled/Taste type 2 (F, compris dans la classe F) et finalement les GPCRs similaires aux récepteurs de la sécrétine
11 (S, représenté par la classe B). Il va sans dire que dans chacun de ces systèmes de classification, les récepteurs de la classe A constituent la plus grande famille de GPCRs. Comprenant plus de 700 membres, cette classe se caractérise principalement par une extrémité N-terminale courte, la présence d’un pont disulfure entre l’ECL1 et l’ECL2, la présence de motifs conservés tel le NSxxNPxxY au sein du TMVII et le motif E/DRY localisé à la jonction du TMIII et de l’ICL2, ainsi que la présence d’un site de palmitoylation au sein du C-terminale qui génère une quatrième boucle intracellulaire. Les autres types, quant à eux, possèdent majoritairement une longue extrémité N-terminale et présentent quelques résidus conservés. La classe B se démarque par la présence de ponts disulfure au sein de son N-terminal tandis que la classe C possède généralement une petite ICL3 (Figure 5) (Fredriksson et al., 2003).
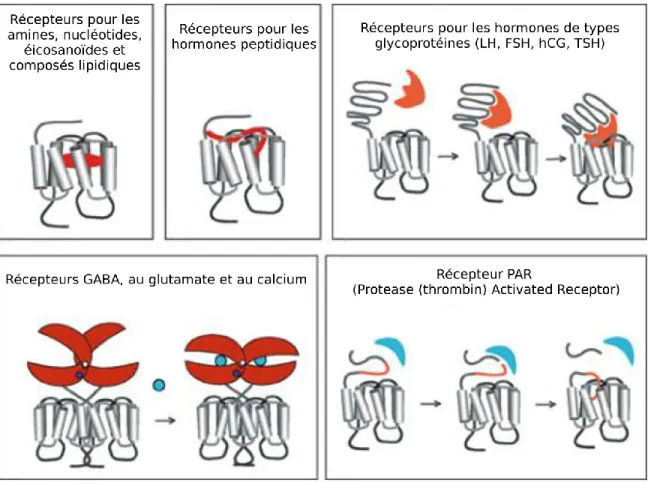
Connaissant maintenant les principaux attributs de chaque type de GPCRs, il est plus facile d’illustrer les différents modes d’activation de ces derniers. Comme le démontre la figure 6, dépendamment de leur nature, les ligands peuvent se lier de différentes manières. On peut donc ainsi retenir que la plupart du temps, les petits ligands (peptides, amines, nucléotides, etc.) se lient au niveau des TMs tandis que les plus gros ligands (hormones, glycoprotéines, protéines, etc.) s’associent à l’extrémité N-terminale ainsi qu’au niveau des ECLs (Kobilka, 2007). Cependant, la dimension du ligand ne prédit en aucun cas son site de liaison sur le récepteur.
Figure 5: Diagramme illustrant les trois classes de GPCRs ainsi que leurs principales caractéristiques. Les résidus/motifs conservés sont désignés par une lettre noire à l’intérieur d’un cercle (Adapté de Gether, 2000).
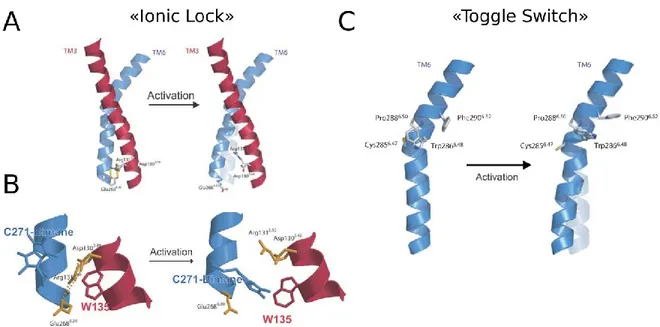
12 Une fois la liaison du ligand/agoniste à son récepteur effectuée, il se produit d’importants changements structuraux. En effet, il fut démontré, dans le cas du récepteur β2AR, que son activation provoquait le mouvement de ses TMIII et VI (Gether et al., 1997).
Des études démontrèrent que ce déplacement rompait l’interaction ionique entre le motif E/DRY, présent à la fin du TMIII (Figure 5, classe A), et un résidu acide présent dans le TMVI, déplacement plus communément appelé le « ionic lock disruption » (Figure 7A-B). Cette particularité fut non seulement caractérisée chez le récepteur β2AR, mais également
pour le récepteur de la rhodopsine (Farrens et al., 1996; Yao et al., 2006). De plus, il fut démontré que l’activation du récepteur β2AR induisait une rotation du TMVI, ce qui induit
un mouvement de ce domaine au niveau cytoplasmique. Ce mouvement est ordinairement désigné comme étant le « toggle switch » (Figure 7C) (Ghanouni et al., 2001; Jensen et al., 2001; Shi et al., 2002). Bref, l’ensemble de ces changements structuraux est caractéristique de l’activation d’un GPCR.
Figure 6: Schéma illustrant les sites de liaison de différents ligands sur leur GPCR (Adapté de http://www.springerreference.com/index/chapterdbid/137855)
13 1.2.2. Processus de signalisation
1.2.2.1. Modèle de Signalisation classique
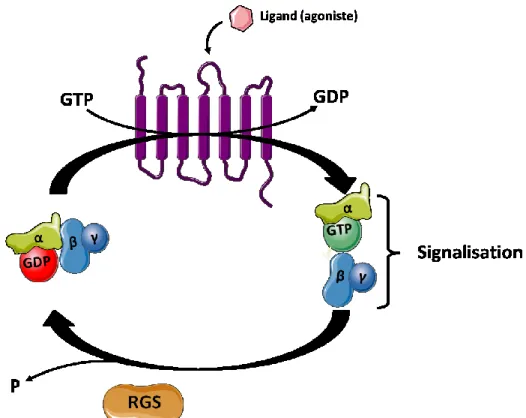
Inévitablement, les changements de conformations du GPCR provoquent la dissociation de la protéine G hétérotrimérique lui étant associée. Ce changement structural catalyse l’échange du GDP, présent sur la sous-unité α en GTP, ce qui déclenche l’activation de cette sous-unité et la dissociation des sous-unités βγ. Par cette action, le récepteur agit à titre de GEF (Guanine Exchange Factor). À son tour, la protéine Gα-active, i-e GTP-liée, ainsi que les sous-unités βγ déclencheront distinctes cascades de réactions menant à l’activation de protéines effectrices qui provoqueront soit la production, le relâchement et/ou à la dégradation de seconds messagers comme l’AMPc, l’IP3, le Ca2+
(Hewavitharana and Wedegaertner, 2012; Milligan and Kostenis, 2006). Le signal émis par la protéine Gα est ensuite arrêté par l’action des protéines RGS (Regulator of G protein Signalling) qui agissent comme GAP (GTPase-Activating Protein) et catalysent l’hydrolyse du GTP en GDP (Figure 8).
Figure 7: Changements structuraux des GPCRs suite à leur activation. (A) Mouvement des TMIII et TMVI du récepteur β2AR montrant les acides aminés impliqués dans la formation du « ionic lock ». (B) Agrandissement du « ionic lock » montré en A et les modifications apportées pour mesurer le changement de conformation de cette région. (A-B, adapté de Kobilka, 2007) (C) Déplacement du TMVI du récepteur β2AR montrant les acides aminés impliqués dans le « toggle switch » (Adapté de Deupi and Kobilka, 2007).
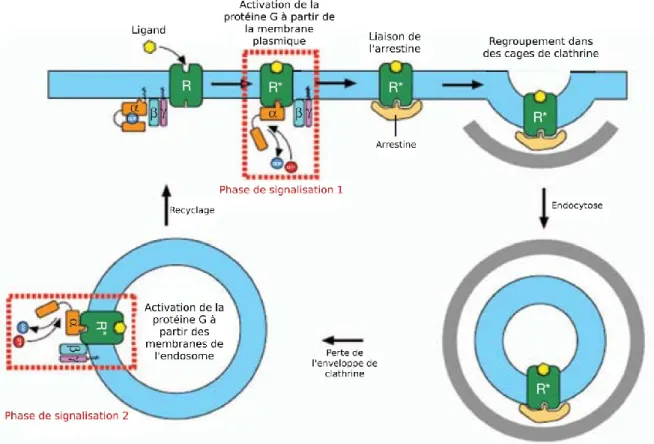
14 Jusqu’à tout récemment, les GPCRs étaient considérés aptes à signaler via la protéine G seulement lorsque ces derniers se trouvaient à la membrane plasmique. Cependant, de plus en plus d’évidences démontraient une activation persistante de certains GPCRs suite à leur internalisation, laissant ainsi supposer que ces récepteurs pouvaient toujours signaler une fois à l’intérieur de la cellule (Calebiro et al., 2009; Ferrandon et al., 2009; Mullershausen et al., 2009; Werthmann et al., 2012). Une brillante étude menée par l’équipe du Pr. Mark von Zastrow et ses collaborateurs prouva clairement cette hypothèse en utilisant une technologie de bio-senseurs reconnaissant spécifiquement les formes actives du récepteur β2AR et sa protéine G associée (Gαs). En effet, ils établirent que ce
récepteur possédait deux phases de signalisation; une première à la membrane plasmique et une seconde au niveau des endosomes précoces (Irannejad et al., 2013) (Figure 9).
Figure 8: Cycle d’activation/désactivation des protéines G hétérotrimériques (Inspiré de Hewavitharana and Wedegaertner, 2012).
15 Finalement, il faut mentionner que la diversité des réponses produites par l’activation des GPCRs s’explique par l’existence de plusieurs isoformes de chacune des sous-unités Gα et Gβγ. En effet, la présence de seize gènes codant pour une Gα, cinq pour une Gβ et douze gènes encodant pour une Gγ est répertoriée jusqu’à maintenant (Downes and Gautam, 1999). Un sommaire des fonctions raccordées à chacun de ces isoformes est présenté dans le Tableau 2, mais ne sera pas discuté puisque ce sujet se situe au-delà des objectifs de cette thèse.
Figure 9: Modèle de signalisation à deux phases des GPCRs. La première se déroule à la membrane plasmique et la seconde aux membranes des endosomes, le tout séparé par le processus d’endocytose (Adapté de Irannejad et al., 2013).
16 T ab leau 2: S ou s-un ité s d es p rot éin es G h été ro tr imé riq u es : fonc tion s et r égu lation ( Adap té d e M il li gan an d Koste n is, 2006) .
17 1.2.2.2. Modèle de Signalisation biaisée
Depuis quelques années, le modèle classique de signalisation fut révisé étant donné la cumulation d’études démontrant l’aptitude des GPCRs à signaler indépendamment de la protéiné G. Par exemple, l’habilité que possède les β-arrestines d’interagir avec des protéines de signalisation intracellulaire telles les MAPKs. SRC, NFκB et PI3K fait entre autre partie du modèle de signalisation biaisée (Luttrell et al., 1999; Rajagopal et al., 2010). Cette nouvelle découverte diversifie, pour ne pas dire complexifie, davantage l’étude des mécanismes de signalisation médiée par les GPCRs, puisqu’il faut maintenant considérer deux modèles de signalisation possible lors de ces analyses (Figure 10A-B). D’un point de vue thérapeutique, ce constat amène tout un lot de possibilités dans le développement de nouveaux ligands, dits biaisés. Ultimement, ceux-ci cibleraient précisément la voie d’activation dépendante de la protéine G au détriment de celle dépendante de l’arrestine par exemple (Figure 10C).
1.3. Processus de désensibilisation et resensibilisation des GPCRs
Ayant toujours pour but de conserver son homéostasie, la cellule se doit de contrôler son niveau d’activation et conséquemment le niveau de récepteurs présents à sa surface. Pour ce qui est des GPCRs, ce processus englobe les mécanismes de désensibilisation et de resensibilisation. Brièvement, suite à son activation et à la dissociation de la protéine G Figure 10: Les modèles de signalisation classique (A), de signalisation biaisée (B) et de ligands biaisés (C) (Adapté de Rajagopal et al., 2010).
18 hétérotrimérique (Figure 11, étape 1), des kinases provoquent la phosphorylation de résidus Ser/Thr présents sur les domaines intracellulaires du récepteur. À son tour, cette phosphorylation favorise le recrutement de protéines au GPCR facilitant l’endocytose du récepteur (Figure 11, étape 2-3). Suite à son endocytose, le récepteur est soit dirigé vers la surface cellulaire ou bien envoyé vers les lysosomes pour y être dégradé (Figure 11, étape 5a et 5b). Évidemment, ces mécanismes nécessitent l’action de plusieurs protéines dont les plus importantes seront mentionnées dans les prochaines sections.
1.3.1. Désensibilisation et diminution d’expression 1.3.1.1. Internalisation
1.3.1.1.1. Initiation : Phosphorylation et Motif d’internalisation
Figure 11: Schéma des différentes étapes de régulation du trafic des GPCRs. Les principales protéines, motifs et modifications post-traductionnelles impliqués sont affichés sous chacune des étapes (Adapté de Moore et al., 2007).
19 L’élément déclencheur du processus d’internalisation le plus répandu à travers la famille des GPCRs est sans doute la phosphorylation de ce dernier. Cette phosphorylation peut être dépendante d’un agoniste ou non. Dans le premier cas, les kinases couramment engagées dans ce processus sont les GRKs (G protein-coupled Receptor Kinases), et l’on dit qu’elles sont impliquées dans les processus de désensibilisation homologue des GPCRs. Comme l’affiche le Tableau 3, cette famille d’enzymes est constituée de sept membres dont les trois premiers sont associés à la phosphorylation des récepteurs de la rhodopsine (GRK1) et β2AR (GRK2 et GRK3, initialement βARK1 et βARK2). Dans le second cas, les
kinases impliquées sont la PKA et la PKC (Protéine Kinase A/C). Ces dernières agissent suite à l’élévation du niveau intracellulaire de seconds messagers tels l’AMPc, le Ca2+ et le DAG (DiAcylGlycérol), ce qui signifie que ces kinases peuvent également accomplir leur rôle lors de l’activation de récepteurs autres (Ferguson, 2001). Par ces caractéristiques, on dit que la PKA et la PKC sont responsables du processus de désensibilisation hétérologue des GPCRs (Pierce et al., 2002). Qui plus est, il fut démontré, dans le cas du récepteur β2AR, que la phosphorylation faite par la PKA favorisait son couplage avec la sous-unité
Gαi (Daaka et al., 1997) sous-entendant ainsi que la phosphorylation des GPCRs mène non seulement à leur endocytose, mais peut aussi influencer leur signalisation.
La présence de motifs d’internalisation encodés dans la séquence primaire des GPCRs est un deuxième élément promoteur de l’endocytose indépendante d’un agoniste de ces récepteurs. L’internalisation à ce moment est dite constitutive. Les motifs les plus connus sont le dileucine, D/E-X-X-X-L-L/I ou D/E-X-X-L-L/I, et celui à base de tyrosine Y-X-X-ϕ, où ϕ représente un acide aminé hydrophobe (Marchese et al., 2008). Ces motifs sont connus pour promouvoir l’interaction entre le récepteur et généralement la protéine Tableau 3: Principales caractéristiques des GRKs (Adapté de Ferguson, 2001).
20 AP-2 (Adaptor Protein complex 2), l’une des composantes essentielles à la formation de la cage de clathrine (Figure 12) (Moore et al., 2007).
1.3.1.1.2. Terminaison : Recrutement des β-arrestines et Formation de la cage de clathrine
La phosphorylation des GPCRs facilite le recrutement d’un puissant médiateur vers ceux-ci. En effet, plusieurs études répertorient la translocation de la β-arrestine1 et/ou de la β-arrestine2 (ou Arrestine-2 et Arrestine-3) vers les GPCRs activés/phosphorylés. Les arrestines sont connues pour agir en tant que protéines d’échafaudage, signifiant ainsi qu’elles facilitent la formation de complexes protéiques. Dans le processus d’internalisation, elles sont particulièrement connues pour favoriser la formation de la cage de clathrine, et ce en interagissant directement avec la clathrine elle-même ainsi qu’avec la sous-unité β2-adaptine de la protéine AP-2 (Goodman et al., 1996; Laporte et al., 1999). Une fois la vésicule de clathrine formée, celle-ci est clivée par la dynamine, ce qui génère une vésicule enrobée de clathrine (Figure 12). Pour ce qui est de l’endocytose constitutive, il est important de spécifier que l’action des β-arrestines n’est pas essentielle (Dale et al., 2001; Parent et al., 2001). L’implication des β-arrestines dans l’internalisation des GPCRs ne se limite pas seulement aux fonctions énumérées ci-haut. Puisque cela ne touche en aucun point le sujet de recherche de la présente thèse, ces autres fonctions ne seront pas discutées. Toutefois, le tableau 4 présente quelques-unes des ces dernières en plus de celles impliquées dans leur signalisation.
Figure 12: Représentation de l’internalisation des GPCRs dépendante des arrestines (Adapté de Pierce and Lefkowitz, 2001).
21 Tableau 4: Signalisation médiée par les arrestines (Adapté de Luttrell and Gesty-Palmer, 2010).
22 Le dernier acteur important dans la régulation de l’internalisation des GPCRs est sans aucun doute la protéine Rab5. En effet, plusieurs études démontrent à l’aide de mutants constitutivement actifs (CA, i-e GTP-lié) et dominants négatifs (DN, i-e GDP-lié) de la protéine Rab5, que ces mutations agissent positivement et négativement sur l’endocytose des GPCRs. Plus précisément, la présence du mutant Rab5-CA augmente l’internalisation des récepteurs tandis que le mutant Rab5-DN la diminue (Moore et al., 1995; Murph et al., 2003; Schmidlin et al., 2001; Seachrist et al., 2000).
1.3.1.2. Dégradation des GPCRs et stabilité de leur ARNm
L’internalisation complétée, les récepteurs sont dirigés vers les endosomes précoces. À partir de ce point, certains GPCRs seront directement dirigés vers la dégradation. Dans ce cas, les principaux compartiments de dégradation sont les lysosomes. Jusqu’à maintenant, on dénombre deux principaux mécanismes d’envoi des GPCRs vers les lysosomes : les voies indépendante et dépendante de l’ubiquitination. Dans le premier cas, l’action des protéines GASP (GPCR Associated Sorting Protein) et SNX1 (Sorting Nexin-1) a été identifiée originalement pour jouer un rôle dans la dégradation des récepteurs DOR (δ Opoïd Receptor) et β2AR, ainsi que PAR1 (Protease-Activated-Receptor-1)
respectivement (Gullapalli et al., 2006; Wang et al., 2002; Whistler et al., 2002). Pour ce qui a trait au processus de dégradation lysosomale dépendante de l’ubiquitination, ce dernier est un peu plus complexe. En effet, il requiert l’action de plusieurs protéines soit la Hrs (hepatocyte-growthfactor regulated tyrosine kinase substrate) et la machinerie des ESCRT-I, -II et -III (endosomal sorting complex required for transport). De manière plus détaillée, la protéine Hrs, faisant partie du complexe ESCRT-0, reconnaît les récepteurs ubiquitinés, via son domaine UIM (Ubiquitin-Interacting Motif), et les transfère à la Tsg101 (Tumor suppressor gene product 101), composante du complexe ESCRT-I. Par la suite, les complexes ESCTR-II et –III sont recrutés et promeuvent la formation des corps multivésiculaires (MVBs, multivesicular bodies). Pour qu’il y ait formation de vésicules intraluminales et donc de MVBs, les GPCRs sont d’abord déubiquitinés par l’action des DUBs (Deubiquitinases), et la machinerie ESCRT est ensuite désassemblée par la protéine Vps4 (Vacuolar protein sorting 4), une AAA-ATPase catalysant cette réaction (Marchese et
23 al., 2008) (Figure 13). Une fois toutes ces actions accomplies, les MVBs sont formés et peuvent fusionner avec les lysosomes, ce qui provoque la dégradation de leur contenu.
Le premier cas de GPCR répertorié pour emprunter cette voie de dégradation fut celui du récepteur CXCR4 (Marchese et al., 2003). Toutefois, des cas de dégradation empruntant un chemin ESCRT et ubiquitine-indépendant, mais nécessitant l’action de Hrs et Vps4, en plus de cas ubiquitine-indépendant/ESCRT-dépendant, sont recensés pour le récepteur DOR et le récepteur PAR1 respectivement (Dores et al., 2012; Hislop et al., 2004). En résumé, l’ensemble de ces évidences dévoile non seulement que ces processus de dégradation sont finement régulés, mais démontre clairement que la dégradation des GPCRs varie principalement selon les partenaires d’interaction et les modifications post-traductionnelles présentes sur ces derniers (Figure 14). On peut donc en conclure que la Figure 13: Les quatre complexes ESCRT et leurs sous-unités. Les composantes de la machinerie ESCRT sont recrutées de façon séquentielle à la membrane des endosomes multivésiculaires (MVEs également nommé MVBs). Les domaines de liaison à l’ubiquitine et aux lipides sont indiqués FYVE, UIM, UEV, GLUE). Le complexe ESCRT-III mobilise les DUBs permettant ainsi le recyclage des groupements ubiquitines. La protéine Vps4 dissocie le complexe ESCRT-III (Tiré de Luttrell and Gesty-Palmer, 2010).
24 voie de dégradation empruntée par un GPCR est fonction de sa condition et de ses partenaires d’interaction.
En plus des mécanismes de dégradation des GPCRs, la diminution des niveaux de leur ARNm est une autre stratégie employée par la cellule pour se désensibiliser des signaux extérieurs. En effet, l’élévation des niveaux intracellulaires d’AMPc, suite à une activation prolongée du récepteur β2AR, entraîne une diminution des niveaux de son
ARNm et par le fait même la présence du récepteur à la surface cellulaire (Bouvier et al., 1989; Hadcock et al., 1989). Une seconde étude démontra qu’une courte exposition à l’agoniste, quant à elle, augmentait la synthèse d’ARNm du même récepteur. De plus, la Figure 14: Schéma résumant le trafic intracellulaire des GPCRs menant au système de dégradation lysosomal. Représentation des différents chemins pouvant être empruntés par les récepteurs (A) PAR1 (B) CXCR4 et (C) β2AR (Adapté de Marchese et al., 2008).
25 présence d’une séquence consensus CREs (cAMP response elements) fut démontrée pour être encodée dans la région promotrice du gène du récepteur β2AR. Avec ces informations,
cette même étude démontra l’importance de cette séquence et conclut qu’un mécanisme de rétroactivation expliquerait le phénomène observé. Ainsi l’augmentation d’AMPc activerait les CREs favorisant la transcription du gène (Collins et al., 1989). Toutefois, les éléments régulant la diminution de l’ARNm lors d’une stimulation prolongée ne furent pas détaillés, mais un changement dans la stabilité de l’ARNm plutôt que dans l’inhibition de sa synthèse fut mentionné et confirmé plus tard par une autre étude (Danner et al., 1998).
Pour conclure, les mécanismes de désensibilisation des GPCRs ont pour objectif ultime de réduire les signaux émis par les récepteurs; autrement dit de réduire la sensibilité de la cellule à son environnement. Comme décrit ci-dessus, ce processus débute, ou non, par la phosphorylation de ces GPCRs, ce qui mène à leur internalisation et potentiellement à leur dégradation au niveau des lysosomes. L’élévation des niveaux intracellulaires de seconds messagers peut également déstabiliser les ARNm produits et contribuer à la diminution des niveaux de récepteurs présents à la surface cellulaire. Bref, une réduction des niveaux d’expression de surface des GPCRs couplée à une diminution de leur quantité totale définissent les conséquences des processus de diminution d’expression des GPCRs.
1.3.2. Resensibilisation : Recyclage
Certains contextes physiologiques, comme la contraction musculaire cardiaque, requièrent toutefois une activité continue des cellules et donc un niveau d’activation et d’expression constantes de récepteurs. Pour ce faire, les cellules font appel à des mécanismes de recyclage aidant à conserver une bonne expression de ces derniers à leur surface, et soutenir la réponse aux stimuli. Le recyclage des GPCRs est facilité par la présence de motifs de recyclage. La plus typique de ces séquences conservées est le motif PDZ (postsynaptic density 95/disc large/zonula occludens-1). En effet, ce motif est retrouvé chez une multitude de GPCRs et se subdivise en trois sous-types : type I (X-S/T-X-ϕ), type II (X-ϕ-X-ϕ) et type III (X-D/E-X-ϕ) où ϕ représente un acide aminé hydrophobe (Marchese et al., 2008). D’autres motifs sont également répertoriés, mais peu répandus. Comme l’indique le tableau 5, ces motifs promeuvent l’interaction des GPCRs avec des
26 protéines spécifiques. Pour le récepteur β2AR, il est bien établi que son motif PDZ, -DSLL,
facilite son recyclage, et ce par son interaction avec les protéines NHERF (Na+/H+ exchanger regulatory factor)/EBP50 (ezrin-radixin-moesin (ERM)-binding phosphoprotein-50) et NSF (NEM-sensitive factor). En effet, la mutation de ce motif entraîne dans chacun des cas, la perte de l’interaction entre le récepteur et son partenaire menant de ce fait à une réduction du taux de recyclage de ce dernier (Cao et al., 1999; Cong et al., 2001; Hall et al., 1998; Xiang and Kobilka, 2003).
La protéine Hrs semble également importante pour le recyclage des GPCRs encodant un tel motif. Une hypothèse stipulant que cette protéine pourrait servir d’élément régulateur central discriminant l’envoi des GPCRs vers les compartiments de dégradation et les compartiments de recyclage est née, suite à une étude démontrant son implication dans le recyclage du récepteur β2AR (Hanyaloglu et al., 2005). Dans cette étude, les auteurs
démontrèrent que le domaine VHS, et non pas le domaine UIM, de la protéine Hrs était essentiel pour son effet dans le recyclage du récepteur. Ainsi donc, le domaine d’interaction récepteur/Hrs pourrait diriger en quelque sorte l’envoi du récepteur vers la dégradation ou le recyclage. Quelques années plus tard, le même groupe démontra que la mutation de la Tableau 5: Sommaire des motifs de recyclage identifiés chez les GPCRs et leurs partenaires d’interaction (Tiré de Hanyaloglu and von Zastrow, 2008).
27 séquence EXEXXLL présente dans le C-terminal du récepteur empêchait l’action de la protéine Hrs sans toutefois inhiber le recyclage (Hanyaloglu and von Zastrow, 2007). De ces observations émergèrent les modèles actuels de recyclage, soit le modèle dépendant de Hrs/PDZ (séquences/motifs) (Figure 15A) et celui indépendant de Hrs/PDZ- (constitutif) (Figure 15B).
Outre les motifs de recyclage, l’action des GTPases Rab4 et Rab11 est également importante dans la régulation du processus de recyclage. En effet, ces dernières sont associées respectivement à la régulation du recyclage rapide (des endosomes précoces vers la membrane plasmique) et du recyclage lent (des endosomes de recyclage tardif vers la membrane plasmique) de plusieurs GPCRs. Pour en nommer quelques-uns, le recyclage, rapide et lent, des récepteurs AT1R, D2R, MOR, MC2R et β2AR sont contrôlés par ces
deux GTPases (Li et al., 2008a; Li et al., 2012; Moore et al., 2004; Parent et al., 2009; Roman-Vendrell et al., 2012; Roy et al., 2011; Seachrist et al., 2000). De plus, la protéine Rab11 fut également identifiée pour influencer le recyclage des récepteurs β1AR, TPβ, IP,
SST3R, CXCR2, CB2 et M4R (Fan et al., 2003; Gardner et al., 2011; Grimsey et al., 2011; Hamelin et al., 2005; Kreuzer et al., 2001; Tower-Gilchrist et al., 2011; Volpicelli et al., 2002; Wikstrom et al., 2008).
Figure 15: Représentation des mécanismes de recyclage (A) dépendant de Hrs/PDZ, nécessitant des motifs de recyclage et (B) indépendants de Hrs/PDZ également nommé recyclage constitutif (Adapté de Hanyaloglu and von Zastrow, 2008).
28 Pour récapituler, le processus de resensibilisation des GPCRs peut s’effectuer de façon constitutive ou bien nécessiter la présence de motifs de recyclage facilitant l’association des récepteurs avec certaines protéines (NHERF/EBP50, Hrs et Rab GTPases) et favorisant le retour à la membrane plasmique de ces derniers.
2. Les petites protéines G
L’implication de GTPases, autre que les protéines G hétérotrimériques, dans le trafic intracellulaire des GPCRs fut mentionnée de nombreuses fois au cours du chapitre précédent. En effet, la famille des petites protéines G est extrêmement importante dans les processus de signalisation et de trafic vésiculaire des GPCRs. Comprenant plus de 100 membres, cette classe de protéines se divise en cinq familles : les Ras GTPases, les Rho GTPases, les Arf/Sar GTPases, les Rab GTPases et les Ran GTPases. Retrouvées sous forme monomérique, ces protéines ayant un poids moléculaire 20-40 kDa sont impliquées dans la signalisation cellulaire et la modulation de la transcription génique (famille des Ras); dans la réorganisation du cytosquelette d’actine, la motilité cellulaire et dans la modulation de la transcription génique (famille des Rhos); dans la formation, fusion et motilité des vésicules entre les différents compartiments intracellulaires (famille des Rabs et des Arf/Sar); finalement dans la réorganisation des microtubules et le transport nucléocytoplasmique de protéines (famille des Rans) (Takai et al., 2001). Évidemment, ces protéines se doivent d’être totalement matures, localisées aux bons endroits et activées, afin de pouvoir accomplir leur rôle au niveau intracellulaire. Les sections qui suivent traiteront donc des événements régulant ces différents procédés.
2.1. Structure et Maturation
2.1.1. Caractéristiques Structurales
D’une famille à l’autre, les petites protéines G ont comme caractéristiques principales de détenir une pochette de liaison au GTP ultraconservée. En effet, on retrouve dans chacune d’elles la présence de cinq « G-domains or boxes » (pour GTP-binding domains) codant pour différentes séquences consensus nécessaires à la liaison du GTP/GDP (Figure 16). La mutation d’une de ces séquences favorise préférentiellement l’association du GTP ou du GDP au sein de la GTPase. Ainsi, cette modification génère
29 soit un mutant actif, liant préférentiellement le GTP, ou un mutant inactif, liant, quant à lui, préférentiellement le GDP. Outre la famille des Arfs et Ran GTPases, la dernière particularité qu’arbore cette classe de protéines est la présence d’un motif C-A-A-X (où C représente une cystéine, A un résidu aliphatique et X n’importe quel résidu). Ce dernier est indispensable pour l’ajout d’un groupement prényle qui favorise l’ancrage des GTPases aux membranes de leur compartiment. Ce processus est décrit comme étant la prénylation et fera l’objet de la prochaine section (Casey, 1992).
2.1.2. La prénylation 2.1.2.1. Généralités
La prénylation est une modification post-traductionnelle lipidique irréversible. Ce terme englobe plus précisément trois types de réactions : la farnésylation, la géranylgéranylation et la di-géranylgéranylation. Conséquemment, deux types d’acide gras peuvent être ajoutés sur les protéines ayant un motif C-A-A-X, soit le farnésyl-pyrophosphate (FPP, 15 carbones) et le géranylgéranyl-pyrophosphate (GGPP, 20 carbones) produits tous deux via le métabolisme du mévalonate (Figure 17). L’implication d’une prényltransférase (PTase) spécifique est attribuée à chacun des types de prénylation : la farnésylatransférase (FTase) est associée à la farnésylation tandis que la géranylgéranyltransférase (GGTase ou GGTase-I) et la Rab géranylgéranyltransférase (RGGT ou GGTase-IGGTase-I) sont associées à la géranylgéranylation et la di-géranylgéranylation respectivement. Chacune de ces PFTases Figure 16: Structure des protéines G monomériques. Les séquences consensus des acides aminés responsables de l’interaction avec le GTP/GDP et l’activité de la GTPase sont détaillées sous chacun des domaines (Inspiré de Paduch et al., 2001; Takai et al., 2001).
30 sont constituées de deux sous-unités, une α et l’autre β. La FTase et la GGTase partagent la même sous-unité α en plus d’être principalement associées à la prénylation des Ras et Rho GTPases. Quant à elle, la RGGT possède sa propre sous-unité α comportant un domaine IgG et LRR de fonctions encore inconnues, et est associée, comme son nom l’indique, à la prénylation des Rab GTPases. Les sous-unités β diffèrent entre chacune des PFTases puisque celles-ci s’adaptent à chaque groupement lipidique devant être transféré, c’est-à-Figure 17: Biosynthèse des groupements prényles via le métabolisme du mévalonate. Le 3-hydroxy 3-methylglutaryl-CoA (HMG-CoA) est converti en mévalonate par la réductase HMG-CoA. Par la suite le mévalonate est transformé en isopentenyl pyrophosphate (Isopentenyl-PP, l’unité basale de 5 carbones des isoprènes). Subséquemment, il y a production du farnesyl-pyrophosphate (farnesyl-PP, un isoprénoïde de 15 carbones) suite à une série de réactions enzymatiques. Par l’addition d’un isopentenyl-PP, le farnesyl-PP est converti en géranylgéranyl pyrophosphate (geranylgeranyl-PP, un isoprénoïde de 20 carbones. Le farnesyl-PP peut alternativement être transformé en cholestérol ou dolichyl phosphate (dolichyl-P ou dolichol) servant à la N-glycosylation de récepteurs (Tiré de Konstantinopoulos et al., 2007).