© Joseline Zafack Guetsop, 2020
Risque de récidive des manifestations cliniques
indésirables survenant après la vaccination
Thèse
Joseline Zafack Guetsop
Doctorat en épidémiologie
Philosophiæ doctor (Ph. D.)
i
RISQUE DE RÉCIDIVE DES MANIFESTATIONS CLINIQUES
INDÉSIRABLES SURVENANT APRÈS LA VACCINATION
Thèse
Joseline Guetsop Zafack
Sous la direction de :
Gaston De Serres, directeur de recherche
Alexandre Bureau, codirecteur de recherche
ii
RÉSUMÉ
La vaccination est un outil important et très efficace dans la prévention des maladies. Cependant, pour que la vaccination soit pleinement efficace, chaque individu doit recevoir toutes les doses de vaccins nécessaires à l’établissement et au maintien d’une immunité protectrice. Les personnes ayant eu une manifestation clinique indésirable après une vaccination (MCIV) précédente sont parfois enclines à arrêter ou retarder leur série vaccinale par crainte d’une récidive (potentiellement plus sévère) de la MCIV s’ils reçoivent les prochaines doses du vaccin. Lors de la prise en charge de ces patients, le médecin doit évaluer la MCIV et déterminer s’il est sécuritaire pour le patient de recevoir les prochaines doses de vaccin. Cette dernière étape est souvent difficile car la majorité des études de sécurité vaccinale décrivent la fréquence des MCIV dans la population générale mais rapportent rarement le risque de récidive et les facteurs influençant ces récidives. L’objectif de cette thèse était d’évaluer le risque de récidive des MCIV et d’identifier les facteurs qui influencent ce risque de récidive. Afin de répondre à cet objectif, quatre études ont été menées :
1) L’étude 1 est une revue systématique avec méta-analyse qui a permis de synthétiser la littérature disponible sur le risque de récidive des MCIV.
2) L’étude 2 est une analyse rétrospective qui avait pour but d’estimer le risque de récidive des MCIV à partir des données recueillies par le système de surveillance passive du Québec entre 1998 et 2016.
3) L’étude 3 est une analyse rétrospective de dossiers médicaux qui avait pour but d’estimer le risque de récidive des MCIV d’allure allergique et comparer la prise en charge des patients ayant eu une MCIV d’allure allergique aux recommandations de pratique du Joint Task Force on Practice Parameters (JTFPP), un groupe d’experts américains. 4) L’étude 4 était une analyse secondaire des données de réactogénicité recueillies lors de trois essais cliniques menés en Europe entre 2004 et 2010 auprès de 5026 enfants âgés de moins de 2 ans. Elle avait pour but d’estimer le risque de récidive des MCIV et l’interaction résultant de la coadministration du vaccin à 4 composantes contre le méningocoque de sérogroupe B (4CMenB, Bexsero™, GSK) et des vaccins de routine sur l’occurrence, la récidive et la sévérité des MCIV.
iii
Ce travail a montré qu’à ce jour, très peu d’études ont évalué le risque de récidive des MCIV. La revaccination est sécuritaire chez la majorité des patients avec une MCIV légère ou modérée. Pour les patients avec des MCIV graves les données semblent aussi aller dans la même direction mais sont moins robustes car ces patients étaient moins souvent revaccinés. La majorité des MCIV d’allure allergique ne sont pas suggestives d’anaphylaxie mais sont prises en charge comme si elles en étaient. La définition de l’anaphylaxie du JTFPP est non spécifique et nécessiterait probablement une révision. Limiter les précautions (tests cutanés et la revaccination en doses graduées) aux patients ayant eu une MCIV d’allure allergique débutant ≤ 1heure suivant la vaccination (compatible avec une réaction IgE médiée) et à ceux rencontrant les critères spécifiques de l’anaphylaxie (quel que soit le délai de survenue) semble suffisamment sensible et prudent pour prévenir les anaphylaxies lors de la revaccination.
Comparé à l’administration à des visites séparées, la coadministration du 4CMenB et des vaccins de routine réduit le risque de MCIV de 4% à 49% (interaction négative) selon la MCIV avec une réduction plus importante chez les enfants ayant eu des MCIV lors des vaccinations antérieures. Comparé aux enfants sans antécédents de MCIV, les enfants avec des antécédents sont plus à risque de présenter la même MCIV lors des vaccinations ultérieures mais les récidives ne sont généralement pas plus sévères que les MCIV antérieures.
En conclusion, la majorité des personnes ayant eu une MCIV lors de vaccination(s) précédente(s) peuvent être revaccinées de manière sécuritaire. Pour fournir une base scientifique robuste aux cliniciens prenant en charge les patients ayant eu des MCIV, il serait utile que les futures études cliniques présentent non seulement le risque global de MCIV mais aussi leur risque de récidive.
iv
ABSTRACT
Immunization is an important and very effective tool in the prevention of diseases. However, for immunization to be fully effective, each individual must receive all the vaccine doses needed to establish and maintain a protective immunity. People who have had a previous adverse event following immunization (AEFI) are sometimes inclined to stop or delay their vaccination series by fear of a potentially more severe recurrence of the AEFI if they receive the next doses of vaccine. When managing these patients, physicians should evaluate the AEFI and determine if it is safe for the patient to receive the next doses of vaccine. This last step is often difficult because most vaccine safety studies describe AEFI frequency in the general population but rarely report their risk of recurrence and the factors influencing these recurrences. The objective of this thesis was to assess the risk of AEFI recurrence and to identify the factors influencing it. To meet this objective, four studies were conducted:
1) Study 1 is a systematic review with meta-analysis that synthesized the available literature on the risk of AEFI recurrence.
2) Study 2 is a retrospective analysis aimed at estimating the risk of AEFI recurrence using the data collected by the Quebec passive surveillance system between 1998 and 2016.
3) Study 3 is a retrospective analysis of medical records that aimed at estimating the risk of recurrence of allergic-like AEFIs and comparing the management of patients who had an allergic-like AEFI with the practice guidelines of the Joint Task Force on Practice Parameters (JTFPP), a group of American experts.
4) Study 4 was a secondary analysis of reactogenicity data collected in three European randomized controlled clinical trials conducted between 2004 and 2010 among 5026 children aged less than 2 years. The purpose of this study was to estimate the risk of AEFI recurrence and the interaction resulting from the co-administration of the 4-component meningococcal serogroup B vaccine (4CMenB, Bexsero ™, GSK) and routine vaccines on the occurrence, recurrence and severity of AEFIs.
This work has shown that to date, very few studies have evaluated the risk of AEFI recurrence. Re-immunization is safe in most patients with mild or moderate AEFIs. For patients with serious AEFIs, the data appear to be in the same direction but are less
v
robust as these patients were less often re-immunized. Most allergic-like AEFIs are not suggestive of anaphylaxis but are treated as if they were. The JTFPP definition of anaphylaxis is nonspecific and may require revision. Limiting precautions (skin tests and revaccination in graduated doses) to patients who have had an allergic-like AEFI starting ≤ 1 hour following vaccination (compatible with an IgE-mediated reaction) and those meeting the specific criteria of anaphylaxis (whatever their delay of onset) seems sufficiently sensitive and careful to prevent anaphylaxis during re-immunization.
Compared to separate visits, co-administration of 4CMenB and routine vaccines reduces the risk of AEFI from 4% to 49% (negative interaction) depending on the AEFI with a greater reduction in children who have had an AEFI at previous immunizations. Compared to children without a history of AEFI, children who have had a previous AEFI are at higher risk of presenting the same AEFI at subsequent immunizations but recurrences are generally not more severe than previous events.
In conclusion, the majority of people who have had an AEFI during previous immunization(s) can be safely re-immunized. To provide a robust scientific basis to clinicians caring for patients with AEFIs, it would be useful for future clinical studies to present not only the overall risk of AEFI but also their risk of recurrence.
vi
TABLE DES MATIÈRES
RÉSUMÉ ... ii
ABSTRACT ... iv
TABLE DES MATIÈRES ... vi
LISTE DES TABLEAUX ... ix
LISTE DES FIGURES... xi
LISTE DES ABRÉVIATIONS ... xii
REMERCIEMENTS... xiv
AVANT-PROPOS ... xvi
Introduction et pertinence ... 1
Chapitre 1 : État des connaissances ... 4
1.1 Immunologie ... 5
1.2 Manifestations cliniques indésirables survenant après la vaccination ... 10
1.3 Facteurs de risque des manifestations cliniques indésirables ... 16
1.4 Hypersensibilité de type I et anaphylaxie ... 17
1.5 Évaluation de la sécurité du vaccin. ... 22
1.6 Risque de récidive des manifestations cliniques indésirables survenant après la vaccination. ... 23
Chapitre 2 : Objectifs et méthodologie ... 37
2.1 Objectifs de recherche ... 37
2.2 Méthodologie de recherche ... 37
Chapitre 3: Risk of recurrence of adverse events following immunization: a systematic review ... 50 3.1 Résumé ... 51 3.2 Abstract ... 52 3.3 Introduction ... 53 3.4 Methods ... 53 3.5 Results ... 55 3.6 Discussion ... 60
Chapitre 4: Rate of recurrence of adverse events following immunization: results of 19 years of surveillance in Quebec, Canada ... 81
vii
4.1 Résumé ... 82 4.2 Abstract ... 83 4.3 Introduction ... 84 4.4 Methods ... 84 4.5 Results ... 86 4.6 Discussion ... 88Chapitre 5: Clinical approach used in medical consultations for allergic-like events following immunization: case series report in relation to practice guidelines. ... 105
5.1 Résumé ... 106 5.2 Abstract ... 107 5.3 Introduction ... 109 5.4 Methods ... 110 5.5 Results ... 111 5.6 Discussion ... 114
Chapitre 6: Adverse events following immunization with four component meningococcal serogroup B vaccine (4CMenB): interaction with co-administration of routine infant vaccines and risk of recurrence in European randomized controlled trials ... 128 6.1 Résumé ... 129 6.2 Abstract ... 130 6.3 Introduction ... 132 6.4 Methods ... 133 6.5 Results ... 136 6.6 Discussion ... 138 Chapitre 7: Discussion ... 159
7.1 Résumé des principaux résultats ... 159
7.2 Forces et limites des études ... 161
7.3 Interprétation des résultats, retombées et orientations futures ... 166
Conclusion ... 169
Bibliographie ... 170
ANNEXES... 188
viii
Annexe 2 : Principales caractéristiques des essais cliniques pré-commercialisation du vaccin 4CMenB (Bexsero™). ... 191 Annexe 3: Programmes SAS. ... 192 Annexe 4: Interaction contrast evaluating for dose 1 to 3 administered before 12 months of age the impact of coadministration in children who previously had the same AEFI or not ... 193 Annexe 5: Évaluation du biais sur le rapport de risque lorsque la période témoin n’est pas prise en compte. ... 194 Annexe 6: Stratégie de recherche dans PubMed (Supplementary file 1) ... 195 Annexe 7 : Formulaire d’évaluation du risque de biais dans les études ... 197
ix
LISTE DES TABLEAUX
Tableau 1-1. Types de vaccins ... 29
Tableau 1-2. Classification des hypersensibilités de Gell et Coombs ... 30
Tableau 1-3. Définition clinique du National Institute of Allergy and Infectious Diseases et Food Allergy and Anaphylaxis Network (NIAID/FAAN) ... 31
Tableau 1-4. Définition d’anaphylaxie de la Collaboration Brighton ... 32
Tableau 1-5. Signes et symptômes majeurs et mineurs composant la définition clinique d’anaphylaxie de la Collaboration Brighton. ... 33
Tableau 1-6. Définition clinique d’anaphylaxie ou de réaction IgE-dépendante systémique du Joint Task Force on Practice Parameters (JTFPP) 25 ... 35
Tableau 1-7. Définitions du syndrome oculorespiratoire (SOR) ... 36
Table 3-1. Case definitions of adverse events following immunization (AEFI) ... 66
Table 3-2. Description of the 29 studies included in the review ... 69
Table 3-3. Risks of recurrence of adverse events following immunization ... 72
Table 3-4. Risk ratios comparing the incidence of AEFIs in vaccinees with and without a history of the same AEFI ... 78
Table 4-1. Characteristics of the patients with adverse events following immunization (AEFI) who required additional doses of vaccine ... 93
Table 4-2. Reimmunization and rate of recurrence depending on the characteristics of the vaccinee and initial adverse event following immunization (AEFI) ... 95
Table 4-3 Reimmunization and recurrence per type of vaccine (not mutually exclusive) and type of adverse event following immunization ... 97
Table 4-4. Rate ratios comparing reimmunization and recurrence by type of adverse event following immunization (AEFI) ... 99
Supplemental table 4-1. Quebec routine immunization schedule ... 101
Supplemental table 4-2. Description of patients reported for anaphylaxis following immunization ... 102
Table 5-1. Characteristics of patients who consulted an allergist for an allergic-like event (ALE) following vaccination ... 121
Table 5-2. Clinical presentation of allergic-like events per vaccine ... 122
Table 5-3. Management of allergic-like events by delay of onset of symptoms and by type of vaccines ... 124
x
Table 5-4. Patients with AEFI upon revaccination by interval between vaccination and symptom onset in the initial ALE ... 125 Table 5-5. Criteria and practice guidelines of the AAAAI for the management of allergic-like events in relation to allergic-likelihood of IgE-mediated anaphylaxis following additional vaccine doses ... 127 Table 6-1. Main features of the randomized control trials and vaccination groups ... 144 Tableau 6-2. Cumulative incidence of adverse events following immunization (AEFI) in days 1&2 in children who did or did not previously have the same AEFI at prior doses ... 145 Table 6-3. Adjusted risk ratios comparing the cumulative incidence of adverse events following immunization (AEFI) in days 1&2 in children who did or did not previously have the same AEFI... 146 Supplemental table S6-1. Characteristics of the study population ... 147 Supplemental table S6-2. Reactogenicity of immunization in children who received the four component serogroup B meningococcal vaccine (4CMenB) and routine vaccines at separate visits ... 148 Supplemental table S6-3. Severity of adverse events following immunization (AEFI) per vaccination group ... 149 Supplemental table S6-4. Rate of adverse events following immunization (AEFI) per vaccine dose ... 150 Supplemental table S6-5 Severity of the recurrence per severity of the initial adverse events following immunization (AEFI)... 151 Supplemental table S6-6. Incidence of adverse events following immunization (AEFI) in children who received their first doses of four component serogroup B meningococcal vaccine (4CMenB) at 12months of age or more ... 152
xi
LISTE DES FIGURES
Figure 1-1. Différents types d'immunité adaptative ... 25 Figure 1-2. Classification des hypersensibiltés de l'European Academy of Allergy and Clinical Immunology (EAACI) ... 26 Figure 1-3. Algorithmes de prise en charge et d’évaluation des réactions d’allure allergique aux vaccins du Joint Task Force on Practice Parameters (JTFPP). ... 27 Figure 2-1 Périodes à risque et périodes témoins des manifestations cliniques indésirables. ... 49 Figure 2-2. Risque de MCI après administration de 4CMenB (Bexsero™) et de vaccins de routine. ... 49 Figure 3-1. Flow diagram of search process ... 64 Figure 3-2. Risk of bias in the individual studies ... 65 Figure 4-1. Percentage of patients with information about reimmunization and percentage of patients reimmunized per study year ... 92 Figure 5-1.a Management of patients with immediate allergic-like events (≤4hours) following immunization ... 119 Figure 5-1.b Management of patients with delayed allergic-like events (> 4hours) following immunization ... 120 Figure 6-1. Adverse events following immunization (AEFI) attributable to vaccination ... 142 Figure 6-2. Interaction contrast evaluating the impact of coadministration in children who previously had the same AEFI or not ... 143 Supplemental Figure S6-1. Day of onset of adverse events following immunization (AEFI) ... 153 Supplemental figure S6-2. Cumulative incidence of adverse events following doses 3 and 4 in children who previously had the same AEFI or not (all vaccination groups) ... 154
xii
LISTE DES ABRÉVIATIONS
4CMenB Vaccin à 4 composantes contre le méningocoque de sérogroupe B
AAAAI American Academy of Allergy Asthma and Immunology (Académie
Américaine d’ Allergie Asthme et Immunologie)
AEFI Adverse event following immunization
ALE Allergic-like event
CHUL Centre hospitalier de l'Université Laval
CI Contraste d’interaction
CIQ Comité sur l’immunisation du Québec
CISA Clinical Immunization Safety Assessment
DCaT-Polio-HepB-Hib
Vaccin contre la diphtérie (D), la coqueluche (Ca), le tétanos (T), la poliomyélite (Polio), l’hépatite B (HepB) et l’Hæmophilus influenzæ de type b (Hib)
DCaT-Polio-Hib
Vaccin contre la diphtérie (D), la coqueluche (Ca), le tétanos (T), la poliomyélite (Polio) et l’Hæmophilus influenzæ de type b (Hib)
dTap Reduced antigen Diphteria-Tetanos-acellular Pertussis vaccine (the lower
cases d and p indicate reduced antigen content)
DTaP Full content Diphteria-Tetanos-acellular Pertussis vaccine
DTaP-IPV-Hib-HepB
Full content Diphteria-Tetanos-acellular Pertussis-Inactivated polio-Haemophilus influenzae-Hepatitis B vaccine
DTwP Diphteria-Tetanos-whole Pertussis vaccine
ELS Extensive limb swelling
ESPRI Effets secondaires possiblement reliés à l’immunisation
HCP Health care provider
HepB Vaccin contre l’hépatite B (Hepatitis B vaccine)
Hep AB Hepatitis A and B vaccine
HHE Hypotonic hyporesponsive episode
HPV Human Papilloma Virus
xiii
IC Intervalle de confianceIgE Immunoglobulines E
IIV Inactivated influenza vaccine
JTFPP Joint Task Force on Practice Parameters (Groupe de travail mixte sur les paramètres de pratique)
MCI Manifestation clinique indésirable
MCIV Manifestation clinique indésirable survenant après la vaccination
MenC-C Meningococcal serogroup C conjugate vaccine
MMR Measles mumps rubella vaccine
MMRV Measles mumps rubella varicella vaccine
ORS Oculo respiratory syndrome
PCV7 Vaccin (V) conjugué (C) heptavalent (7) contre le pneumocoque (P)
PPSV23 23 valent pneumococcal polysaccharidic vaccine
RCT Randomized controlled trial
ROR Vaccin contre la rougeole (R), les oreillons (O) et la rubéole (R)
ROR-Var Vaccin contre la rougeole (R), les oreillons (O), la rubéole (R) et la varicelle (Var)
SAE Serious adverse event
SOR Syndrome oculorespiratoire
xiv
REMERCIEMENTS
Cette thèse de doctorat n’aurait pas pu voir le jour sans l’aide et le support de mon directeur de recherche, mes collègues, mes amis et ma famille.
Je tiens tout d’abord à remercier mon directeur de recherche, Gaston De Serres, qui m’a encouragée et supportée financièrement, et émotionnellement tout au long de ce projet. Merci de m’avoir donné le temps quand j’en ai eu besoin et d’avoir partagé avec moi ton expertise épidémiologique, scientifique et clinique. Mes échanges avec toi ont été des sources d’apprentissage aussi bien professionnel que personnel.
Merci à Alexandre Bureau, mon codirecteur de recherche, dont la patience et la rigueur m’ont été utiles tout au long de ce travail.
Merci à tous mes collègues de l’unité de recherche en vaccination du CHU de Québec-Université Laval. Vous avez fait de notre unité un lieu où il fait bon travailler mais surtout où il fait bon vivre. Un endroit où on discute des dernières avancées scientifiques, de modèles mathématiques mais aussi où on célèbre les naissances, les anniversaires, les départs, où l’on se réjouit lors des succès et où l’on accompagne lors des peines. J’ai apprécié chacun des moments passés avec vous ces dernières années.
J’aimerais remercier Geneviève Deceuninck qui a toujours été disponible, merci à Manale Ouakki pour ses précieux conseils statistiques et merci à tous ceux qui ont collaboré de près ou de loin à chacune des études : Marie-Claude Gariépy, Marie-Noelle Billard, Isabelle Rouleau, Marilou Kiely. À tous mes collègues de l’unité de recherche en vaccination et de l’Institut national de santé publique de Québec : France, Sara, Diane, Jo-Ann, Sophie, Dany, Vladimir, Rodica, Chantal, Nicholas... Vous avez su faire de notre lieu de travail un endroit scientifiquement stimulant, chaleureux et convivial.
Je tiens également à remercier Eveline Toth et Monique Landry, du bureau de surveillance et de vigie du Ministère de la santé et des services sociaux, qui ont toujours pris le temps de répondre à mes questions. Ce fut un plaisir de travailler avec vous.
xv
Un merci aussi aux docteurs Karina Top, Danuta Skowronski, Jean-Philippe Drolet et Rémi Gagnon pour leur expertise clinique et scientifique.
J’aimerais aussi remercier Eliette Mague, Pierre Nguimfack et Aimé Messiga dont la présence et les encouragements m’ont permis de traverser des moments difficiles. Merci à tous de votre présence, de votre appui et de votre amitié, j’espère avoir su vous rendre la pareille.
Pour finir, je tiens à remercier les membres de ma famille. À mes parents Martin et Berthe Zafack qui m’ont tellement appris, c’est grâce aux connaissances et aux valeurs que vous m’avez inculquées que j’ai su mener ce projet à bout. Merci pour votre soutien indéfectible. À Ethan mon petit bout de chou. Merci pour ton calme et ta personnalité, nous formons une belle équipe. À mes frères et sœurs : Armelle et Christian, Thibaut, Florine, Guylaine, Billy, et Cliff. Bien que nous soyons éparpillés à travers le monde, vous m’avez toujours accompagnée et avez su à chaque fois me donner le petit coup de pouce qu’il me fallait pour continuer d’avancer. Je sais que je suis généralement une personne qui agit plus qu’elle ne parle, c’est donc avec plaisir que je saisis cette occasion de vous dire que je vous aime très fort.
xvi
AVANT-PROPOS
La présente thèse vise à mieux comprendre la sécurité de la revaccination des personnes ayant déjà eu des manifestations cliniques indésirables survenant après la vaccination. Cette thèse de doctorat comporte sept chapitres : le Chapitre 1 présente l’état des connaissances sur le sujet, le Chapitre 2 expose les objectifs et méthodes, les Chapitres 3, 4, 5 et 6 sont des articles publiés ou acceptés pour publication dans le cadre de mon projet de recherche et enfin le Chapitre 7 présente la discussion. Ces travaux de recherche ont été financés par l’Agence de Santé Publique du Canada (ASPC/PHAC) et les Instituts de Recherche en Santé du Canada (IRSC/CIHR) à travers des bourses de doctorat attribués par les réseaux PCIRN (PHAC-CIHR Influenza Research Network) et CIRN (Canadian Immunization Research Network). Ma contribution à l’élaboration de chaque article ainsi que leur état de publication sont détaillés ci-dessous.
Le premier article présenté au chapitre 3, s’intitule « Risk of recurrence of adverse events following immunization: a systematic review » et a été publié dans Pediatrics en Septembre 2017. Il a également fait l’objet d’un communiqué de presse lors de sa sortie. Je suis le premier auteur avec comme co-auteurs : Gaston De Serres, Marilou Kiely, Marie-Claude Gariépy, Isabelle Rouleau et Karina Top. J’ai participé à la conception de l’étude, effectué le protocole avec le plan d’analyse, la sélection d’articles, l’extraction de données et la méta-analyse. J’ai rédigé la première version du manuscrit.
Le second article présenté au chapitre 4, s’intitule « Rate of recurrence of adverse events following immunization: results of 19 years of surveillance in Quebec, Canada » et a été publié dans Pediatric Infectious Disease Journal en avril 2019. La présentation de ce travail m’a valu une bourse du vaccinology student research program lors de la conférence canadienne d’immunisation en 2016. Il a également fait l’objet d’un communiqué de presse lors de sa sortie. Je suis le premier auteur avec comme co-auteurs : Eveline Toth, Monique Landry, Jean-Philippe Drolet, Karina Top, et Gaston De Serres. J’ai participé à la conception de l’étude, du plan d’analyse et à l’extraction de données. J’ai effectué les analyses et rédigé la première version du manuscrit.
Le troisième article présenté au chapitre 5, s’intitule « Clinical approach used in medical consultations for allergic-like events following immunization: case series report in relation to practice guidelines » et a été publié en Mai 2017 dans le Journal of Allergy
xvii
and Clinical Immunology: In practice. Cet article a été sélectionné par les éditeurs afin qu’un résumé paraisse dans la section « latest research » du site de l’académie américaine d’allergie, asthme et immunologie. Je suis le premier auteur avec comme co-auteurs : Gaston De Serres, Isabelle Rouleau, Marie-Claude Gariépy, Remi Gagnon, Jean-Philippe Drolet, et Danuta Skowronski. J’ai participé à la conception de l’étude et j’ai fait le plan d’analyse avec Gaston De Serres et Isabelle Rouleau. J’ai participé à l’extraction de données des dossiers médicaux, réalisé les analyses statistiques et rédigé la première version du manuscrit.
Le quatrième article présenté au chapitre 6, s’intitule « Adverse events following immunization with four component meningococcal serogroup B vaccine (4cmenB): interaction with co-administration of routine infant vaccines and risk of recurrence in European randomized controlled trials » et a été accepté pour publication dans le journal BMJ Open en Janvier 2019. Je suis le premier auteur avec comme co-auteurs : Alexandre Bureau, Danuta Skowronski, et Gaston De Serres. J’ai participé à la conception de l’étude et du plan d’analyse. J’ai effectué les analyses statistiques et rédigé la première version du manuscrit.
Pour chacun des articles qui constituent le corps de cette thèse, le processus de révision de l’article par les autres coauteurs a été supervisé conjointement par Dr De Serres et moi-même. Les numéros des tableaux et figures ainsi que l’ordre des références dans chaque article ont été modifiés afin de respecter leur ordre d’apparition dans cette thèse.
1
Introduction et pertinence
La vaccination est un outil important et efficace dans la prévention des maladies 1. Elle
peut conférer une immunité individuelle et de groupe 2 et a permis une réduction
importante et parfois l’élimination ou l’éradication de certaines maladies infectieuses. Cependant, pour que la vaccination soit pleinement efficace, chaque individu doit recevoir toutes les doses de vaccins nécessaires à l’établissement et au maintien d’une immunité protectrice 1,3.
Les personnes ayant eu une manifestation clinique indésirable après une vaccination (MCIV) sont parfois enclines à arrêter ou retarder la poursuite de leur série vaccinale par crainte d’une récidive (potentiellement plus sévère) de la MCIV 4,5. Lors de la prise en
charge de ces patients, le vaccinateur doit évaluer la MCIV et déterminer s’il est sécuritaire pour le patient de recevoir les prochaines doses de vaccin. Le risque de récidive d’une MCIV est une information critique pour le patient et pour le clinicien dans la décision de poursuivre ou non la série vaccinale. Cette information est rare car la majorité des études de sécurité vaccinale décrivent la fréquence des manifestations cliniques indésirables (MCI) post vaccinales dans la population générale mais très peu rapportent le risque de récidive et les facteurs influençant ces récidives 6. La plupart des
recommandations concernant la revaccination des personnes ayant présenté une MCI post vaccinale sont basées sur des opinions d’experts et reposent sur peu ou pas de preuves scientifiques.
L’objectif de cette thèse est d’évaluer le risque de récidive des MCI post vaccinales (MCIV) et d’identifier les facteurs qui influencent ce risque de récidive. Spécifiquement nous allons :
a) Estimer le risque de récidive des MCIV et les facteurs de risque de ces récidives selon la littérature.
b) Estimer le risque de récidive des MCIV à partir du système québécois de surveillance passive des MCIV
2
c) Estimer le risque de récidive des MCIV d’allure allergique et comparer la prise en charge des patients ayant eu une MCIV d’allure allergique aux recommandations de pratique du Joint Task Force on Practice Parameters (JTFPP)i
d) Estimer le risque de récidive des MCIV et l’interaction résultant de la coadministration du vaccin à 4 composantes contre le méningocoque de sérogroupe B (4CMenB, Bexsero™, GSK) et des vaccins de routine sur l’occurrence, la récidive et la sévérité des MCIV chez les enfants de 2 ans et moins
La revue systématique de la littérature publiée sur le risque de récidive des MCIV est la première revue systématique sur ce sujet et fait un état des lieux des données disponibles.
Nous avons ensuite estimé le risque de récidive de MCIV à partir du système de surveillance passive québécois et évalué si les estimés obtenus étaient cohérents avec ceux retrouvés dans la revue systématique réalisée précédemment. Ce travail nous a permis de vérifier l’efficacité du système de surveillance québécois et de déterminer comment les systèmes de surveillance de la sécurité vaccinale en général peuvent être intégrés dans le cadre de l’évaluation du risque de récidive de MCIV.
Dans l’étude 3, nous avons évalué les MCIV d’allure allergique qui comportent un risque théorique de récidive grave potentiellement mortelle (l’anaphylaxie) et entrainent plus d’arrêts et de retard injustifiés de la vaccination que les autres MCIV. Cette étude évalue la fréquence des récidives de MCIV d’allure allergique et leur sévérité (notamment la fréquence des anaphylaxies). Elle présente la prise en charge adoptée par les allergologues du CHUL-CHU de Québec-Université Laval et la compare à celle recommandée par un groupe d’experts américains (Joint Task Force on Practice Parameters) représentant 3 grandes associations américaines d’allergie et immunologie. Cette comparaison nous a permis de proposer des modifications visant à optimiser cette prise en charge.
Dans l’étude 4, nous avons estimé le risque de récidive des MCIV lié au vaccin 4CMenB et recherché la présence d’interaction résultant de sa coadministration avec les vaccins pédiatriques de routine. Cette étude est importante car elle a été basée sur les données
i Représentant trois grandes associations américaines d’allergie et immunologie l’American Academy of Allergy, Asthma
& Immunology (AAAAI), l’American College of Allergy, Asthma & Immunology (ACAAI), et le Joint Council of Allergy, Asthma and Immunology (JCAAI).
3
d’essais cliniques randomisés qui incluent plusieurs milliers d’enfants et s’intéresse à un vaccin considéré réactogène (MCIV observées chez plus de 71% des nourrissons vaccinés). Ce vaccin premièrement mis sur le marché en 2013 a été utilisé au Québec en 2014 dans le cadre d'une large campagne de vaccination incluant les enfants au Saguenay Lac-St-Jean. Une analyse approfondie du profil de sécurité de ce vaccin était pertinente parce que les études précommercialisation suggéraient que sa coadministration avec les vaccins de routine augmentait l’incidence de MCIV. Notre étude a permis une évaluation adéquate de l’interaction. Les résultats permettent de déterminer le calendrier de vaccination le plus sécuritaire (coadministration avec les vaccins de routine ou non) et fournissent aux médecins et vaccinateurs les connaissances nécessaires pour la prise en charge et l’éducation des patients qui présenteront une MCIV après l’administration du 4CMenB. Finalement, cette étude nous a permis d’évaluer pour la première fois l’interaction résultant de la coadministration des vaccins sur la récidive des MCIV.
Globalement, les résultats de cette thèse visent à fournir des données pour informer tant les patients qui ont eu une MCIV que les professionnels de santé en vue d’assurer une prise en charge optimale et une poursuite sécuritaire de la vaccination de ces patients. Le chapitre 1 présente l’état des connaissances sur les MCIV et leur risque de récidive. Le chapitre 2 décrit les objectifs et la méthodologie. Puis, les résultats seront présentés sous la forme de quatre articles scientifiques insérés aux chapitres 3, 4, 5 et 6. Enfin, la discussion disponible au chapitre 7 intègre les différents résultats pour réfléchir sur leurs implications dans le contexte global de la sécurité de la vaccination.
4
Chapitre 1 : État des connaissances
Nous allons d’abord présenter quelques définitions, puis nous décrirons brièvement les principes d’immunologie et de vaccinologie de base dont la connaissance est essentielle pour la compréhension et l’application des principes généraux en vaccination. Ensuite, nous présenterons les MCIV (différents types, facteurs de risque et prise en charge) et leurs méthodes de surveillance. Pour finir nous parlerons du risque de récidive des MCIV qui sera aussi développé dans la revue systématique qui fait l’objet du premier article (Chapitre 3).
Une manifestation clinique indésirable survenant après la vaccination (MCIV) est tout événement médical fâcheux qui se produit à la suite de l'administration d'un vaccin et qui n'a pas nécessairement de lien causal avec celle-ci 7–10. Une MCIV peut donc
correspondre à un signe défavorable ou non intentionnel, à un résultat de laboratoire anormal, à un symptôme ou à une affection 7,8. On parle de manifestation clinique
indésirable et non d’effet secondaire car la survenue d’une manifestation clinique après la vaccination ne signifie pas toujours qu’elle a été causée par le vaccin ou le processus de vaccination mais peut être due à d’autres causes qui surviennent par hasard au moment de la vaccination 7,8. Ainsi, certaines MCIV ne sont associées que fortuitement
à la vaccination (association temporelle) c’est-à-dire qu’elles seraient survenues même si la personne n’avait pas été vaccinée 9,10. Tandis que les autres, sont véritablement
des effets secondaires du vaccin et il y a une relation de cause à effet. Cette relation peut être établie sans équivoque (ex. : réaction au site d’injection du vaccin), ou être probable ou possible en fonction des effets secondaires connus du vaccin administré et de la présence d’autres causes possibles 9,10.
Une MCIV grave est une MCIV potentiellement mortelle ou qui entraîne au moins une des occurrences suivantes : hospitalisation, prolongation d'hospitalisation en cours, invalidité permanente, anomalie congénitale, issue fatale 7. Malgré leur gravité, pour
plusieurs MCIV graves le mécanisme causal demeure inconnu. Une MCIV « inattendue » est une MCIV qui n'est pas mentionnée dans la monographie du vaccin.
La pharmacovigilance des vaccins est la surveillance de leur innocuité. Elle comprend la science et les activités liées à la détection, à l'évaluation, à la compréhension, à la prévention et à la communication des MCIV ou de tout autre problème lié à
5
l'immunisation ou aux vaccins 3,7. Elle a pour but de minimiser le risque et maximiser les
avantages des vaccins et de l'immunisation. L'évaluation et la surveillance de l'innocuité des vaccins est un continuum qui englobe la totalité des phases du « cycle de vie » du vaccin, depuis sa conception jusqu'à l'autorisation de mise en marché et au-delà 3,7. De
nombreux intervenants et de nombreuses activités y entrent en jeu. Au Canada, certains intervenants tels que les fabricants de vaccins et les organismes de réglementation ont des rôles et des responsabilités pendant toute la durée du cycle de vie, alors que d'autres tels que les autorités de santé publique (fédérales et provinciales) et les fournisseurs de vaccins interviennent plus tard dans le processus, après la commercialisation du produit
3,7. Avec la diminution des maladies évitables par la vaccination, l'attention de la
population et des médias se concentre de plus en plus sur l'innocuité des vaccins. De plus, vu que les vaccins sont habituellement administrés à des personnes en santé, en particulier à des enfants, on tolère peu la survenue d'évènements indésirables. La surveillance de la sécurité de la vaccination est donc primordiale pour s’assurer que la balance bénéfice/risque est toujours en faveur du patient et pour maintenir la confiance des populations dans les programmes de vaccination.
1.1 Immunologie
1.1.1 DéfinitionsL’immunologie est l’étude de l’organisation et du fonctionnement du système immunitaire qui est un réseau de cellules, de tissus et d’organes travaillant ensemble pour défendre l’organisme contre les attaques d’agresseurs étrangers 3,7. La réponse
immunitaire induite par les vaccins peut être à l’origine de la présence des MCIV et influence leur nature, fréquence, délai de survenue, etc.
L’immunité est la capacité que possède un organisme de se défendre, en particulier quand il subit une agression par un agent infectieux7. Le système immunitaire humain
est capable de réagir à un nombre considérable et diversifié d’antigènes étrangers; il procure l’immunité par deux types de réponses complémentaires: l’immunité innée et
l’immunité adaptative 7,11,12. L’immunité innée est le premier niveau de défense du corps.
Elle est constituée de barrières physiques (ex : peau et muqueuses); de défenses physiologiques (ex : température, pH gastrique faible et médiateurs chimiques); de réponses inflammatoires humorales et phagocytaires 12. Elle entre en action dans les
6
secondes ou heures suivant l’entrée d’un agent pathogène dans le corps et ne dépend pas d’une exposition antérieure à l’agent pathogène, ne produit pas de mémoire immunologique, ne s’améliore pas avec une exposition répétée à l’agent pathogène. L’immunité adaptative est le second niveau de défense du corps qui se développe à la suite à un contact naturel (infection) ou artificiel/provoqué (vaccination) avec l’agent pathogène12. Cette immunité peut être humorale (repose sur les anticorps ou
immunoglobulines) ou cellulaire (repose sur les cellules lymphoïdes) 7,12. Elle fournit une
protection contre un agent pathogène précis et met des jours ou des semaines à devenir protectrice. L’immunité adaptative peut générer une mémoire immunologique ce qui fournit une immunité durable pouvant persister toute une vie et devenant plus forte et plus précise chaque fois qu’elle affronte l’antigène 12. L’immunité adaptative est dite
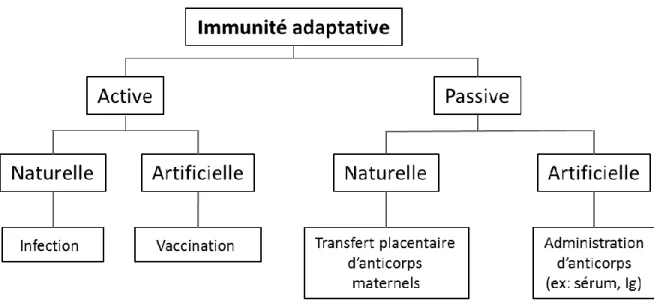
active lorsque l’acquisition de la protection fait suite à la rencontre et la réaction à un antigène 7,11,12 grâce à une infection naturelle ou à une vaccination (Figure 1-1). Cette
immunité s’améliore au fil des expositions à un antigène donné. L’immunité adaptative active naturelle qui résulte d’une infection est de degré et durée variable selon la maladie
7. Par exemple, l’infection par le virus de la rougeole confère une immunité à vie tandis
que pour d’autres maladies comme la typhoïde on doit vacciner les personnes qui ont eu certaines infections dans le passé 7,12. L’immunité adaptative active artificielle résulte de
la protection provoquée par la vaccination qui induit une rencontre avec un antigène peu ou pas virulent réduisant ainsi les complications possibles de la maladie naturelle. Cette immunité exploite les caractéristiques du système immunitaire à des fins préventives
7,12. Contrairement à l’immunité adaptative active, l’immunité adaptative passive est une
protection résultant du transfert passif des anticorps à un individu comme le transfert d’anticorps à travers le placenta ou l’administration d’anticorps (ex. : sérum). Elle confère une protection de durée limitée.
Un antigène est une substance capable de provoquer une réponse du système immunitaire lorsqu’elle est introduite dans un organisme7. Il peut s’agir d’une substance
rencontrée dans l’environnement (ex : latex), un agent infectieux complet ou une de ses parties (ex : capsule) ou un de ses produits (ex : toxine) 7,12. Un anticorps est une
protéine (immunoglobuline [Ig]) produite par un organisme en réponse à la rencontre avec un antigène. Chaque anticorps réagit en présence de son antigène cible. Il se combine spécifiquement avec cet antigène afin de former des complexes
antigène-7
anticorps qui facilitent la destruction de l’antigène 7,12. On distingue 5 principaux types
d’anticorps : IgG, IgM, IgA, IgD et IgE 7,12.
La réaction inflammatoire est un mécanisme de défense non spécifique (inné) de l’organisme, qui fait suite au stress causé par un dommage tissulaire ou l’agression par un agent infectieux. Elle se manifeste par 4 principaux signes et symptômes: la rougeur, la douleur, la chaleur et l’œdème 7,12. Elle contribue à l’élimination des
micro-organismes, des toxines ou d’autres corps étrangers, prévient leur propagation aux organes adjacents et favorise la réparation tissulaire 7,12. La réaction inflammatoire peut
être localisée ou généralisée
La vaccination est une méthode de prévention de certaines infections. Elle consiste à administrer des préparations antigéniques connues et contrôlées (vaccins) dans le but d’entraîner une immunité active tout en évitant les conséquences liées à l’infection naturelle 7. La primovaccination, ou la vaccination primaire, est le nombre de doses d’un
même produit immunisant que l’on doit administrer à une personne pour obtenir une immunité adéquate 7. La vaccination de rappel englobe les doses de vaccins administrés
après la primovaccination. Elle induit une réponse immunitaire secondaire et vise à relever le taux d’anticorps afin d’assurer une protection à long terme 7,11. Grâce à la
mémoire immunitaire, la réponse immunitaire de rappel est généralement plus rapide et plus importante que celle de la vaccination primaire 7,11.
1.1.2 Facteurs influençant la réponse immunitaire
Plusieurs paramètres sont à prendre en compte lors de la vaccination :
- L’âge : La réponse immunitaire est variable tout au long de la vie. Les nouveau-nés sont plus susceptibles de contracter des infections graves à plusieurs types d’agents infectieux que les enfants plus âgés 13–15. Chez les nouveau-nés, la réponse immunitaire
peut être modifiée par l’immaturité du système immunitaire et par la présence d’anticorps maternels transmis de façon passive 16. Les MCI associées fortuitement à la
vaccination surviendront plus souvent chez les jeunes enfants 17. La réponse immunitaire
chez les personnes âgées est également influencée par les modifications liées au vieillissement 18.
8
- La présence d’immunodéficience innée (primaire) ou acquise (ex : chimiothérapie, SIDA) peut affecter la capacité à produire une réponse immunitaire efficace. Lorsque ces patients reçoivent des vaccins vivants atténués, il existe un risque de développer une infection à partir de l’agent infectieux contenu dans le vaccin 19–21.
- La présence d’anticorps résultant de vaccinations ou d’infections naturelles antérieures peut également modifier la réponse immunitaire. Par exemple, l’inflammation locale produite par l’injection du vaccin contre la diphtérie, la coqueluche et le tétanos chez les enfants est souvent plus intense, après la 4e dose de la série vaccinale. Aussi pour les vaccins vivants, la présence d’anticorps résultant d’une vaccination ou d’une infection naturelle antérieure peut entrainer une destruction rapide de l’agent infectieux atténué contenu dans le vaccin.
- La prise de certains médicaments tels que les antipyrétiques peut interférer avec la réponse immunitaire 22,23.
1.1.3 Les vaccins
Les vaccins sont des produits biologiques (préparations antigéniques) généralement administrés à une personne en bonne santé afin de déclencher une réaction immunitaire lui permettant de se protéger contre la maladie visée tout en minimisant les risques liés à l’infection naturelle 3. Il existe plusieurs modes d’administration des vaccins :
intramusculaire, intranasale, sous cutanée, orale. L'administration de plusieurs doses de vaccin est souvent nécessaire pour obtenir une immunité protectrice (vaccination primaire) ou pour la renforcer et la prolonger (vaccination de rappel) 3, 7. Les vaccins
contiennent un ou plusieurs antigènes 3, 7. L'antigène peut être une bactérie ou un virus
vivant atténué, une bactérie ou virus tué ou une fraction du virus ou de la bactérie (ex : anatoxine, polysaccharides) obtenue de manière naturelle ou synthétisée en laboratoire par recombinaison génétique (vaccin sous unitaire) 3, 7. Les vaccins sont
généralement classés en deux groupes selon le type d’antigène qu’ils contiennent : les vaccins vivants atténués et les vaccins inactivés (Tableau 1-1). Les vaccins vivants atténués contiennent des bactéries ou des virus vivants entiers affaiblis qui ne produisent plus les symptômes importants des maladies visées (ex : vaccin rougeole-oreillons-rubéole [ROR], vaccin polio oral). Avec les vaccins vivants, le stimulus au système immunitaire ressemble davantage à celui associé à l’infection naturelle, produisant une immunité de plus longue durée et plus large que celle qu’on peut obtenir avec les vaccins
9
inactivés car l’agent infectieux se réplique à l’intérieur du sujet vacciné 3,7,8. Les vaccins
vivants doivent être conservés et manipulés avec soin afin d’éviter leur inactivation accidentelle. Ils sont généralement contre indiqués chez les personnes atteintes d’immunodéficience afin d’éviter d’induire une infection à partir de la souche vaccinale
19–21. Les vaccins inactivés contiennent des bactéries ou des virus inactivés (tués) entiers
ou partiels (polysaccharides), des produits sécrétés par des bactéries modifiées afin d’éliminer leurs effets pathogéniques (anatoxines), ou des parties d’une bactérie ou d’un virus obtenu par recombinaison technologique. Il existe trois types de vaccins inactivés : les vaccins polysaccharidiques (ex : vaccin pneumo23), les vaccins entiers (ex : vaccin polio injectable, vaccin inactivé contre l’influenza) ou les vaccins à protéines purifiées (ex : vaccin dT contre la diphtérie et le tétanos) ainsi que les vaccins conjugués (ex : vaccin conjugué contre le pneumocoque) 7,8. Les vaccins inactivés ne peuvent pas causer
la maladie qu’ils doivent prévenir car ils ne contiennent pas d’agents infectieux vivants. Associé à l’antigène le vaccin peut contenir:
- Des agents de conservation qui sont des produits ajoutés aux vaccins tués ou sous unitaires multidoses afin de prévenir la contamination bactérienne du vaccin. (ex : thimérosal, phénol, antibiotiques tels que la néomycine et la streptomycine) 8,24,25. Ils
maintiennent ainsi la qualité biologique des vaccins, leur asepsie et les rendre capables de supporter des variations physiques telles que la temprérature.
- Un adjuvant (ex : hydroxyde d’aluminium, sulfate d’aluminium et de potassium) qui est une substance qui augmente la réponse immunitaire ce qui améliore l’efficacité du vaccin et peut permettre de réduire la quantité totale d’antigène par vaccin ou le nombre total de doses nécessaires pour obtenir un niveau protecteur d’anticorps 8,24-26.
Comme la réponse immunitaire aux vaccins inactivés peut être plus faible que celle induite par des agents infectieux vivants, les vaccins inactivés ont souvent besoin d’adjuvants qui potentialisent la réponse immunitaire et nécessitent parfois l’administration de plusieurs doses lors de la vaccination primaire 8.
- Des stabilisants qui maintiennent la qualité du vaccin pendant son entreposage (ex : gélatine, albumine) 8.
- Finalement, les vaccins peuvent contenir des produits résiduels provenant du processus de fabrication (ex : traces d’œufs ou de levures) 8,25.
10
Les vaccins visent à provoquer de manière sûre une réponse immunitaire efficace contre la maladie. Un vaccin idéal offre maints avantages : il doit être sécuritaire et ne comporter que des effets secondaires minimes; être peu coûteux, stable durant l’expédition et l’entreposage et facile à administrer 3,7. Il peut être administré dès la
naissance et confère une protection à vie contre une maladie. Certains vaccins répondent davantage à ces critères que d’autres. Même si chaque vaccin possède ses propres bénéfices et risques, ils assurent tous une protection contre la maladie pour laquelle ils ont été conçus et comportent des risques acceptables d’où leur mise sur le marché 7.
1.2
Manifestations cliniques indésirables survenant après la
vaccination
Dans le cadre de la surveillance de la sécurité du vaccin, on ne parle pas d’effets secondaires du vaccin mais de manifestation clinique indésirable survenant après la vaccination (MCIV). Une MCIV désigne un problème de santé survenant après la vaccination, qu’il ait ou non été causé par le vaccin lui-même, par ses composants ou par la technique d’injection 7,8. Ainsi, certaines MCIV ne sont associées que fortuitement
à la vaccination (association temporelle) c’est-à-dire qu’elles seraient survenues même si la personne n’avait pas été vaccinée 9,10. Tandis que les autres sont véritablement des
effets secondaires du vaccin avec une relation de cause à effet. Cette relation peut être établie sans équivoque (ex. : réaction au site d’injection du vaccin), ou être probable ou possible en fonction des effets secondaires connus du vaccin administré et de la présence d’autres causes possibles.
La nature et la fréquence des MCIV varient selon les caractéristiques du vaccin et de la personne vaccinée. Pour les vaccins homologués, les effets secondaires les plus fréquents sont bénins et transitoires (ex : fièvre, réactions locales). Dans de rares cas, il peut survenir des réactions imprévues (ex : syndrome oculorespiratoire)27–29 ou graves
(ex : anaphylaxie, encéphalite, syndrome de Guillain Barré) 30,31.
1.2.1 Réactions au site d’administration (réactions locales)
Le vaccin est un corps étranger dont l’introduction dans l’organisme peut entrainer une réaction inflammatoire au site d’administration. Il s’agira généralement d’une petite douleur, induration, rougeur ou chaleur locale. Lorsque l’inflammation est plus
11
importante (diamètre ≥10cm), selon la présence de fièvre ou d’autres symptômes généraux le diagnostic pourra être une cellulite, une réaction d’Arthus ou une tuméfaction locale importante 32–34. Pour les vaccins administrés par voie orale ou
intranasale la réaction inflammatoire locale peut se traduire par une diarrhée ou un écoulement nasal 35,36.
D’autres formes de réactions locales incluent les nodules et les abcès 37-39. Les nodules
sont de petites masses sous cutanées survenant quelques semaines ou mois particulièrement après l’administration de vaccins contenant des adjuvants 7. Les abcès
stériles ou infectieux résultent généralement de l’administration de vaccins contenant des sels d’aluminium ou du non-respect de l’asepsie lors de la vaccination 37. La maitrise
de la technique d’injection et l’utilisation d’une longueur d’aiguille appropriée permettent généralement d’éviter ces réactions qui sont généralement bénignes et ne contre-indiquent pas la poursuite de la vaccination 7,37.
1.2.2 Réactions systémiques
Un vaccin peut causer des symptômes systémiques. Les manifestations systémiques varient en nature et en fréquence selon le vaccin (fièvre, malaise général, irritabilité, fatigue, myalgies, diarrhée, vomissements, l’insomnie, la somnolence…); les plus fréquentes sont non spécifiques et peuvent aussi être causées par des problèmes de santé courants ainsi, seules les études comparant des vaccinés à des non vaccinés permettent de distinguer la proportion de MCI réellement attribuable au vaccin 7,10. Dans
ces études, le groupe de non vaccinés (ou ayant reçu un placebo) permet de calculer la fréquence de base de MCI observées dans la population en absence de vaccination 7,10.
La fièvre débute généralement dans les 24-48h suivant l’administration des vaccins inactivés 3,7,40. Pour les vaccins vivants, elle surviendra généralement après une période
d’incubation variable en fonction de la nature du pathogène (ex : 5-12 jours pour la rougeole) 3,7. Chez les enfants de 6 mois à 3 ans, une fièvre élevée peut dans certains
cas entrainer des convulsions fébriles 40–46.
La réaction d’hypotonie-hyporéactivité est une manifestation post vaccinale peu fréquente caractérisée par l’installation soudaine d’une hypotonie musculaire, accompagnée d’une diminution de l’état de veille ou une perte de conscience et d’un changement de la coloration cutanée (pâleur ou cyanose) chez le nourrisson 47,48. Ces
12
symptômes sont limités dans le temps et n’ont aucun impact sur le développement psychomoteur de l’enfant 48. A ce jour, la cause de ces épisodes est inconnue, mais
certains pensent qu’ils correspondent à des évanouissements ou à des convulsions atoniques. Depuis que le vaccin coqueluche à cellules entières a été remplacé par un vaccin acellulaire dans les pays développés, on ne recense plus que quelques rares cas de réactions d’hypotonie-hyporéactivité 49.
D’autres réactions telles que la crise d’anxiété, l’évanouissement ou la réaction vasovagale liées au processus d’immunisation (ex : peur des aiguilles) peuvent survenir
50,51.
1.2.3 Réactions allergiques ou d’hypersensibilité.
Les vaccins peuvent causer une réaction allergique ou réaction d’hypersensibilité qui est une réponse anormale et excessive du système immunitaire envers une substance contenue dans le vaccin, nommée allergène 24,25,52. La réaction allergique est rarement
causée par l’antigène lui-même, mais le vaccin peut contenir plusieurs allergènes potentiels tels que : la gélatine, les traces d’œuf, les levures, le latex…24,25. Selon le
délai d’apparition des symptômes et le mécanisme immunitaire impliqué, Gell et Coombs ont classé les réactions d’hypersensibilité en 4 principaux types : type I (ou immédiate), type II (ou cytotoxique), type III (ou à complexes immuns) et type IV (ou retardée)
24,53. La classification de Gell et Coombs est toujours largement utilisée, mais
l’avancement des connaissances a permis de démontrer que cette classification ne tient pas compte de la complexité des mécanismes des réactions immunitaires 53,54;c’est
pourquoi d’autres classifications et descriptions ont été proposées. L’académie européenne d’allergie et immunologie clinique (European Academy of Allergy and Clinical Immunology, EAACI) a défini l’hypersensibilité comme un ensemble de signes et symptômes reproductibles survenant après l’exposition à un stimulus toléré par un individu normal. Les hypersensibilités peuvent être causées par un mécanisme immunologique bien identifié; on parle alors d’hypersensibilité immunologique (ou allergique) qui peut être IgE dépendante ou non. Lorsqu’aucune cause immunologique n’a pu être identifiée on parlera d’hypersensibilité non immunologique 54,55 (Figure 1-2).
Sur le plan clinique, l’hypersensibilité allergique la plus fréquemment rencontrée est l’allergie IgE dépendante qui correspond à l’allergie de type I (ou allergie immédiate) de
13
la classification de Gell et Coombs (Tableau 1-2). C’est celle qui peut être la plus grave. Cette hypersensibilité est causée par la présence d’anticorps (IgE) qui ciblent une des composantes du vaccin (antigène ou autre). Lorsqu’un patient sensibilisé lors d’une vaccination antérieure est réexposé à l’allergène au cours d’une nouvelle vaccination, il développera généralement une réaction allergique mineure mais il peut parfois avoir une réaction très grave et potentiellement mortelle appelée anaphylaxie 24,25,30,55. Chez une
personne sensibilisée à un allergène, les IgE spécifiques sont fixées aux récepteurs FCεRI exprimés à la surface des mastocytes et des basophiles 24,56. Ces cellules sont donc
activées rapidement lors d’une exposition subséquente à l’allergène. Dans certains cas, les manifestations allergiques résultent de l’activation des mastocytes par un mécanisme immunologique non IgE médié (allergie à complexes immuns, activation du système de contact, activation de la cascade du complément, phénomènes autoimmunitaires) ou par un mécanisme non-immunologique (ex. le froid, la chaleur, la vancomycine, l’exposition au soleil ou l’activité physique, l’alcool…) 55. Peu importe l’allergène ou le mécanisme (immunologique ou non) ayant causé la réaction, l’activation des mastocytes et des basophiles entraîne leur dégranulation avec libération d’histamine et la synthèse de médiateurs lipidiques (prostaglandines et leucotriènes) et de cytokines 24,56. Ce sont ces
éléments biochimiques qui entraînent les signes et symptômes typiques de l’allergie; c’est pourquoi il n’est pas possible de déterminer le mécanisme d’une réaction allergique à partir du tableau clinique du patient. La fréquence des réactions d’hypersensibilité de type I aux vaccins n’est pas bien documentée et l’anaphylaxie est un évènement rare dont l’incidence varie de 1/100.000 à 1/1.000.000 de doses distribuées selon le vaccin administré 30,57-59. Afin d’éviter la survenue d’une anaphylaxie lors de la revaccination,
beaucoup de patients ayant eu une MCI d'allure allergique après une vaccination antérieure sont évalués par un spécialiste afin d’identifier s’ils sont à risque d’anaphylaxie et s’ils peuvent continuer leur vaccination. A ce jour, il existe plusieurs protocoles proposés pour la prise en charge des patients ayant eu une MCI allergique après la vaccination 25,60,61.
Les hypersensibilités de type II sont des réactions cytotoxiques ou cytolytiques qui démarrent quelques minutes à quelques heures (4-6 h) après le contact avec l’allergène. Dans ces réactions, la rencontre entre l’anticorps (IgG) circulant et l’antigène 12,24,53
entraîne la destruction de la cellule (cytotoxicité) par activation du complément et par phénomène d’ADCC (antibody dependent cellular cytotoxicity) 62–64. Ces phénomènes
14
ont déjà été décrits suite à la vaccination Influenza. Cependant ils surviennent rarement après la vaccination et sont surtout liées aux cytopénies médicamenteuses, aux incompatibilités lors des transfusions sanguines 7 et aux maladies auto-immunes, (ex :
anémie pernicieuse, maladie d’Addison).
L’hypersensibilité de type III regroupe les réactions dues à la formation et à l’accumulation d’un trop grand nombre de complexes immuns (combinaisons antigène-anticorps) qui provoquent une réaction inflammatoire intense 7,34. Elle peut être
responsable de vascularites, de maladies sériques ou de dommages tissulaires. L’hypersensibilité de type III la plus souvent décrite en vaccination est le phénomène d’Arthus une réaction grave au site de vaccination caractérisée par une tuméfaction importante et douloureuse du membre vacciné débutant 2 à 8 heures après la vaccination 7. Elle survient lorsqu’il y a beaucoup d’anticorps préformés chez une
personne vaccinée. À la vaccination suivante, les complexes immuns qui sont alors en trop grand nombre pour être éliminés par les mécanismes habituels endommagent les tissus sur lesquels ils se déposent. Ce type de réactions n’empêche généralement pas la poursuite de la vaccination, mais comme sa physiopathologie suggère une production excessive d’anticorps, il est recommandé d’espacer la vaccination chez les personnes ayant présenté une telle réaction.
L’hypersensibilité de type IV est une hypersensibilité "retardée" à médiation cellulaire. Elle débute généralement 24 à 72 heures après la vaccination et se différencie des 3 autres types en ce sens qu’elle n’est pas médiée par des anticorps mais par des cellules les lymphocytes T (médiation cellulaire) qui vont permettre le recrutement et l'activation de macrophages. Les exemples les plus fréquents dans le contexte de la vaccination sont les réactions tuberculiniques et certaines éruptions cutanées (dermatite de contact, eczéma) 7.
1.2.4 Autres manifestions cliniques indésirables d’origine immunologique
Il s’agit des réactions auto-immunes et idiopathiques. À cause de la similitude entre l’antigène vaccinal et un épitope endogène, la vaccination peut induire la production d’anticorps dirigés contre des cellules de l’organisme. Comme exemple nous avons le purpura thrombopénique idiopathique (PTI) et le syndrome de Guillain Barré 65–68. Le PTI
survient dans environ 1 pour 30,000 à 40,000 doses de vaccin ROR mais il arrive encore plus souvent en cas d’infection naturelle (1 par 6000 cas pour la rougeole, 1 par 3000
15
pour la rubéole) 65–67
.
Le syndrome de Guillain Barré est une atteinte rare des nerfspériphériques pouvant survenir dans les 6 semaines suivant la vaccination influenza à raison de 0,6 à 1 cas pour 100.000 vaccinés 31,68,69. Les mécanismes immunologiques à
l'origine d’effets secondaires tels que l’invagination intestinale après le vaccin contre le rotavirus 70–75 ou le syndrome oculorespiratoire après la vaccination influenza ne sont
pas encore bien connus 76–78.
1.2.5 Autres troubles neurologiques survenant après la vaccination
Différents troubles neurologiques (anesthésie, paresthésies, convulsions, névrite brachiale) peuvent survenir après la vaccination 79. Ils ne contre-indiquent généralement
pas la poursuite de la vaccination car une association temporelle ne suffit pas à prouver que le vaccin a causé les évènements neurologiques. Les enfants qui présentent des convulsions fébriles ou non fébriles après avoir reçu le vaccin acellulaire contre la coqueluche ou un autre vaccin peuvent recevoir la ou les prochaines doses sans tarder, car ces évènements ne sont pas associés à des problèmes durables et ne sont pas des contre-indications à la vaccination 6,45,80,81.
1.2.6 Réactions attribuables à une erreur dans la fabrication ou l'administration du vaccin
En 1955 des cas de poliomyélite d’origine vaccinale sont survenus aux États-Unis suite à une mauvaise inactivation du poliovirus lors de la fabrication du vaccin 82,83. D’autres
MCIV causées par le non-respect de la chaine de froid, l’administration du mauvais vaccin ou l’utilisation d’un diluant inapproprié pour reconstituer le vaccin ont également été décrites 84.
1.2.7 Manifestations cliniques fortuitement associées à la vaccination (associations temporelles)
Comme les vaccins sont généralement administrés à des personnes en bonne santé et les problèmes de santé survenant peu après la vaccination seront souvent attribués à la vaccination même si le vaccin ne les a pas causés 17. Ces associations temporelles sont
inévitables et doivent toujours être prises en compte dans l’évaluation des MCIV. Grâce à des études incluant des groupes témoins (non vaccinés ou placébo), il est possible de connaitre la fréquence des problèmes de santé due à des causes non vaccinales et celle
16
causée par la vaccination. Par exemple, dans la surveillance de la vaccination influenza on a trouvé que parmi les MCIV systémiques observées chez 41,4% des vaccinés, seul un tiers (14,1%) était attribuable à la vaccination 85.
1.3 Facteurs de risque des manifestations cliniques indésirables
1.3.1 Facteurs liés à la personne vaccinéeLes caractéristiques du vacciné peuvent favoriser la survenue d’une manifestation clinique indésirable notamment :
- L’âge : le système immunitaire évolue au cours de la vie ce qui influence la survenue des MCIV 14,15,17. Les MCI associées fortuitement à la vaccination surviennent plus
souvent chez les jeunes enfants 17.
- Le sexe : il y a de plus en plus d’évidence sur le fait que les femmes en âge de procréer sont plus à risque de réactions inflammatoires et de manifestations d'allure allergique que les hommes de la même catégorie d’âge 86–88.
- La génétique : le patrimoine génétique des individus influence leur réaction à l’administration du vaccin. Cependant il existe très peu d’études ayant identifié des gènes potentiellement impliqués 17.
- Une infection précédente ou des doses antérieures de vaccin : la présence d’anticorps résultant d’une infection ou de vaccinations précédentes peut influencer l’intensité et la durée de la réaction post vaccinale 17,34,89.
1.3.2 Facteurs liés au vaccin ou au processus d’immunisation
Certaines caractéristiques du vaccin ou du processus de vaccination peuvent favoriser la survenue d’une manifestation clinique indésirable notamment:
- L’antigène : le délai de survenue, la fréquence, le type et la sévérité de certaines
MCIV sont liés à la nature de l’antigène contenu dans le vaccin 13,44,90. Pour les vaccins
inactivés, les symptômes systémiques surviennent généralement dans les 24-48h suivant la vaccination tandis que pour les vaccins vivants les symptômes généralement atténués mais similaires à ceux de l’infection naturelle surviendront après une phase d’incubation au cours de laquelle l’agent infectieux se multiplie (ex : 5 à 11 jours pour la rougeole).