Lutte biologique contre le tarsonème du fraisier
(Acari : Tarsonemidae) à l’aide d’acariens
prédateurs (Acari : Phytoseiidae) en fraisière
Mémoire
Stéphanie Patenaude
Maîtrise en biologie végétale
Maître ès sciences (M. Sc.)
Québec, Canada
Lutte biologique contre le tarsonème du fraisier
(Acari : Tarsonemidae) à l’aide d’acariens
prédateurs (Acari : Phytoseiidae) en fraisière
Mémoire
Stéphanie Patenaude
Sous la direction de :
Valérie Fournier, directrice de recherche
Stéphanie Tellier, codirectrice de recherche
iii
Résumé
Le tarsonème du fraisier Phytonemus pallidus Banks (Acari : Tarsonemidae) est un acarien ravageur invisible à l’œil nu et de plus en plus préoccupant en fraisière en raison des pertes de rendement considérables qu’il occasionne. Le retrait récent de l’insecticide/acaricide endosulfan nécessite la recherche de solutions de remplacement. La lutte biologique à l’aide d’acariens prédateurs (Acari : Phytoseiidae) fait partie de celles-ci, mais aucune recherche n’avait encore été réalisée en champ sous les conditions du Québec afin de valider sa faisabilité. Les objectifs de cette étude étaient : (1) évaluer l’efficacité de trois espèces d’acariens phytoséiides, Neoseiulus cucumeris Oudemans, N. fallacis Garman et Amblyseius andersoni Chant, à contrôler le tarsonème du fraisier en conditions de fraisières commerciales; (2) évaluer le rendement et la qualité des fruits en lien avec cette méthode de lutte; (3) examiner l’effet possible de ces prédateurs sur d’autres ravageurs en fraisière et (4) mieux comprendre la dynamique de population du tarsonème du fraisier sous notre climat. Nos résultats démontrent que N. cucumeris offre une bonne efficacité, mais qu’il est très sensible au froid et trop dispendieux pour une utilisation en champ. En 2017, lorsqu’un plafond de coût fut fixé (1000$/ha), aucun des trois prédateurs n’a pu réduire de façon significative le nombre de tarsonèmes. Le suivi des populations de ce ravageur au champ a permis la confirmation de certains faits connus, tout en permettant l’acquisition de connaissances nouvelles et essentielles sur sa phénologie. À la lumière des résultats obtenus, les trois phytoséiides ont offert un contrôle insuffisant du tarsonème du fraisier en champ dans les conditions expérimentées. Le tarsonème du fraisier demeure un problème très complexe et beaucoup de recherches supplémentaires sont nécessaires.
iv
Abstract
The cyclamen mite Phytonemus pallidus Banks (Acari: Tarsonemidae) is a major pest in strawberry production, causing serious yield losses. Due to the recent phase-out of endosulfan in Canada, alternative treatments are required. Biological control with predatory mites (Acari: Phytoseiidae) is promising, but its effectiveness under the conditions in Eastern Canada’s strawberry fields remains unknown. The aim of this study was to (1) assess the potential of three phytoseiid mite species: Neoseiulus cucumeris Oudemans, N. fallacis Garman and Amblyseius andersoni Chant to control cyclamen mites in commercial strawberry fields in the province of Québec; (2) measure the effect of this control method on fruit yield and quality; (3) evaluate predatory mite effects on other pests in the field and (4) monitor field populations of cyclamen mites. In 2016, our results showed that N. cucumeris was able to effectively suppress cyclamen mites but was too expensive for commercial use and appeared to be too cold-sensitive to maintain adequate control throughout the season in this region. In 2017, with an upper limit on the biocontrol cost ($1000/hectare), none of the predator species achieved effective control. Monitoring cyclamen mite populations in the field has confirmed some well-known facts on this pest and has led to the acquisition of new and essential knowledge on its phenology. Based on these results, all three phytoseiid mites provided insufficient control of cyclamen mites under the in-field conditions tested. Control of the cyclamen mite remains a very complex issue and further research is needed.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... vii
Liste des figures ... viii
Remerciements ... xi
Avant-propos ... xiii
Chapitre 1 : Introduction générale ... 1
1.1. La production de fraises ... 2
1.1.1. Historique ... 2
1.1.2. Taxonomie et caractéristiques générales ... 2
1.1.3. Statistiques de production ... 3 1.1.4. Régies de production ... 3 1.1.5. Ravageurs de la fraise ... 5 1.2. Le tarsonème du fraisier ... 5 1.2.1. Description ... 5 1.2.2. Cycle de vie ... 7 1.2.3. Dommages ... 8 1.2.4. Ennemis naturels ... 10
1.3. Lutte au tarsonème du fraisier ... 10
1.3.1. Moyens de lutte préventive ... 10
1.3.2. Lutte chimique... 11
1.3.3. Moyens alternatifs d’assainissement des plants ... 15
1.3.4. La lutte biologique ... 16
1.4. Objectifs et hypothèses ... 30
Chapitre 2: Assessing the effectiveness of the predatory mite Neoseiulus cucumeris
(Acari: Phytoseiidae) in the control of the cyclamen mite Phytonemus pallidus (Acari:
Tarsonemidae) in Eastern Canada strawberry fields ... 32
Résumé ... 33
Abstract ... 33
Introduction ... 34
Materials and Methods ... 35
Field experiment ... 35
Phenology of the cyclamen mite ... 38
Results ... 38
Field experiment ... 38
Phenology of the cyclamen mite ... 42
Discussion ... 43
Neoseiulus cucumeris efficacy in the field ... 44
vi
Acknowledgments ... 47
References ... 48
Chapitre 3: Biological control of the cyclamen mite Phytonemus pallidus (Acari:
Tarsonemidae) using three predatory mites (Acari: Phytoseiidae) in commercial
Eastern Canada strawberry fields ... 51
Résumé ... 52
Abstract ... 52
Introduction ... 53
Materials and Methods ... 54
Results ... 58
Discussion ... 62
Acknowledgments ... 65
References ... 66
Chapitre 4 : Conclusion générale ... 70
vii
Liste des tableaux
Tableau 1. Matières actives des pesticides expérimentés et leur efficacité contre P. pallidus ... 14 Table 2. Total number of phytoseiid mite species identified in the 2016 field experiment ... 40
viii
Liste des figures
Figure 1. Champ de fraisiers en rangs nattés ... 4
Figure 2. Tarsonème du fraisier A- Femelle; B- Femelle, larves et œufs; C- Mâle ... 6
Figure 3. Dommages sévères du tarsonème du fraisier sur les feuilles de fraisier (gauche) et sur les fruits (droite). ... 9
Figure 4. Étapes de la dispersion aérienne de N. fallacis. (A) Recherche aléatoire sur le substrat (B) Orientation dans le sens du courant d’air dominant (vue dorsale); (C) Position redressée sur les pattes postérieures, dos au courant d’air (af); (D) Décollage ... 19
Figure 5. Cycle de vie d'un acarien phytoséiide typique à 27°C et 70 % HR.. ... 21
Figure 6. Neoseiulus cucumeris adulte. ... 24
Figure 7. Neoseiulus fallacis adulte ... 27
Figure 8. Amblyseius andersoni adulte. ... 29
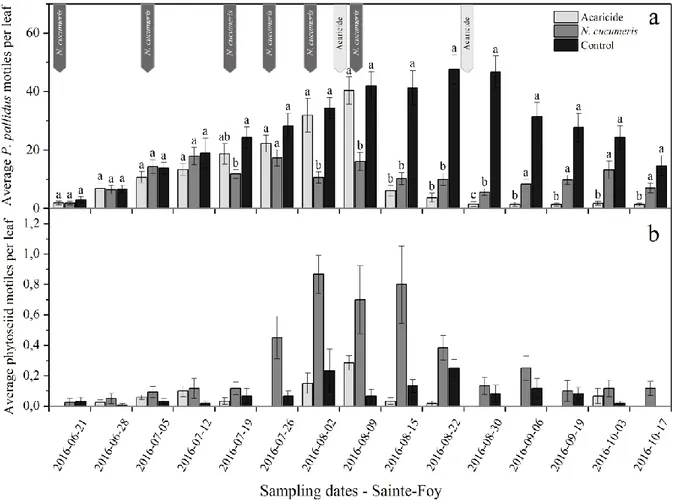
Fig 9. Average numbers (±SE) of P. pallidus motile forms (Fig. a) and phytoseiid mite motile forms (Fig. b) per young leaf for the acaricide, N. cucumeris and control treatments on each sampling date for the 2016 field experiment in Sainte Foy, Quebec ... 39
Fig. 10. Average numbers of P. pallidus motile forms per young leaf (±SE in shaded area) for the acaricide, N. cucumeris and control treatments on each sampling date for the 2016 field experiment and follow-up in 2017 in Sainte Foy, Quebec ... 41
Fig. 11. Strawberry yield for the three treatments (Acaricide, N. cucumeris, and Control) at the second-year follow-up (2017) of the 2016 field experiment in Sainte Foy, Quebec.. ... 42
Fig. 12. Evolution in average number of P. pallidus females, larvae, males and eggs per young leaf for 2016 and 2017 sampling dates in untreated plots in Sainte-Foy, Quebec. ... 43
ix
Fig 14. Average number (±SE) of P. pallidus motile forms (Fig. a & b) and phytoseiid mite motile
forms (Fig c & d) per young leaf for the six treatments on each sampling date of the 2017 field experiment 2017 on Île d’Orléans (left) and in Trois-Rivières (right), Québec. ... 59
Fig. 15. Picture of P. pallidus female and eggs on fruit. ... 60 Fig. 16. Identification and total number of phytoseiid mites per treatment found on fruits, young
leaves and old leaves for each sampling date of the 2017 field experiment in Trois-Rivières. 61
Fig 17. Strawberry yield for the six treatments (Acaricide, A. andersoni, N. cucumeris, N. fallacis,
x
xi
Remerciements
« Oh mon dieu, dans quoi me suis-je embarquée… », voici le sentiment éprouvé lors de mes premiers contacts avec le très problématique tarsonème du fraisier au début de cette maîtrise. Heureusement, j’ai eu l’aide indispensable de nombreuses personnes dans cette aventure et ce projet est le fruit d’un réel travail d’équipe. Je voudrais donc prendre le temps de les remercier.
Tout d’abord, je voudrais remercier ma directrice et ma codirectrice, Valérie Fournier et Stéphanie
Tellier, pour votre soutien, vos connaissances et vos conseils. Je suis également reconnaissante pour
cette confiance témoignée tout au long de cette maîtrise.
Ce projet aurait été impossible sans la participation, l’expertise et la générosité de François Demers, présent depuis le tout début du projet, Thierry Chouffot, Diane Gagnon, Liette Lambert,
Guy-Anne Landry, Pierrette Lavoie, Jean-Philippe Légaré, Émilie Lemaire, Caroline Martineau, Patrick Martineau, Joseph Moisan-De Serres, Annie-Pier Paradis, Alexandre Tanguay, Patrice Thibault, Jacinthe Tremblay, Édith Tousignant et le personnel du CRIV, de
même qu’Awa Diop et Gaétan Daigle pour le soutien statistique. Un merci tout spécial pour l’expertise taxonomique (et la grande patience) de Mario Fréchette du Laboratoire de diagnostic en phytoprotection du Ministère de l’agriculture, des pêcheries et de l’alimentation (MAPAQ) et de
Frédéric Beaulieu d’Agriculture et agroalimentaire Canada (AAC), des atouts rares et indispensables
dans les contrées nébuleuses de l’acarologie.
Je voudrais remercier chaleureusement les producteurs Laurent Fiset, Jean-Julien Plante, David
Lemire et toute leur équipe pour votre grande disponibilité, votre collaboration et votre patience
(notamment dans la gestion des fameuses bâches de plastique). Ce fut un réel un plaisir de vous côtoyer au cours de ces deux années.
Je tiens également à remercier les évaluateurs de ce mémoire pour leur temps et leurs commentaires constructifs. Merci également à Daniel Dostaler, Raymond-Marie Duchesne, André Gosselin et
Véronique Martel pour l’évaluation des différents séminaires au cours de cette maîtrise.
Un grand merci à mes collègues de labo : Amélie Gervais (peintre en bourdons professionnelle),
Marianne Lamontagne-Drolet (Team agr., aux passions insolites), Frédéric McCune (l’inventeur
du McSquash), Sabrina Rondeau (l’être supérieur) et Mouna Kahia pour votre aide sur le terrain (entre deux bouffées de moisissure grise), mais surtout pour votre présence, votre humour et les anecdotes savoureuses en quantité industrielle à se radoter jusqu’à la fin de nos jours. Vous êtes tous
xii
de réels coups de cœur et cette maîtrise sans vous aurait été bien différente. Clin d’œil également aux autres membres à distance des Charlie Angels, mais tout aussi importants : Mélanie
Normandeau-Bonneau et Phanie Normandeau-Bonneau. Merci aussi à Olivier Robert-Samson pour ton savoir infini et tes
apparitions de superhéros, brèves et intermittentes, mais toujours très appréciées.
Il ne faudrait pas oublier les indispensables aides de terrain qui ont dû apprendre, bien malgré eux, à voir l’invisible dans ce projet. Tout d’abord, un grand merci à Audrey Boivin pour l’ensemble de l’œuvre. Merci pour ta compétence, ta proactivité et ta capacité à lire dans mes pensées durant la première année de ce projet. Merci également à Clémence Landreau et Aurélie Boilard d’avoir brillamment pris le relais pour la 2e année, ainsi qu’à Thaïs Andro, Guillaume Guengard et Lucie
Alexandre pour leur aide supplémentaire sur le terrain.
Un grand merci à ma famille, ce que j’ai de plus précieux. À ma mère Isabelle pour ton soutien, ton amour, ta résilience et ta grande force. À mon père Daniel pour ta confiance et ta présence rassurante, malgré le fait que tu nous quittes maintenant peu à peu, beaucoup trop tôt. À mes sœurs et meilleures amies Caroline et Lysane, de même qu’à ma belle-sœur Sarah, pour partager cette douce folie. À
mes nièces qui me permettent de redécouvrir la vie à travers leurs yeux et à ma grand-mère Monique,
une femme forte et fière avec qui je partage beaucoup de similarités, dont cette tête (un peu dure…) pleine d’idées en constante ébullition.
Merci aussi à mes très bons amis Benoit Bérubé, Mélanie Dionne, Laura Thériault et Hugo Alix pour votre présence dans ma vie. Merci pour votre aide, pour nos activités hétéroclites et pour cette amitié, très précieuse, qui survit à tout.
Finalement, merci à tous les gens inspirants qui ont croisé ma route et qui ont contribué à faire de moi ce que je suis aujourd’hui.
xiii
Avant-propos
Ce mémoire constitue la finalité d’un projet rendu possible grâce à une subvention de recherche du Ministère de l’agriculture, des pêcheries et de l’alimentation du Québec (MAPAQ) via le programme Prime-Vert volet 4 - Appui au développement et au transfert de connaissances en agroenvironnement par l’entremise de la Stratégie Phytosanitaire québécoise en agriculture 2011-2021, d’une contribution supplémentaire du Programme d’appui au développement de l’agriculture et de l’agroalimentaire en région (PADAAR) Mauricie et de l’implication des organismes suivants : Association des producteurs de fraises et de framboises du Québec, Laboratoire d'expertise et de diagnostic en phytoprotection du MAPAQ, Ferme Jean-Pierre-Plante, Ferme Ernest Fiset et fils, Ferme horticole Gagnon, le Conseil de recherche en sciences naturelles et génie (CRSNG) pour le financement d’une bourse d’études, ainsi que les distributeurs d’agents de lutte biologique : Koppert Canada, Plant Products et Anatis bioprotection.
Les chapitres 2 et 3 constituent le corps du mémoire et sont rédigés en anglais sous forme d’articles scientifiques qui seront soumis dans les journaux scientifiques Biocontrol et The Canadian Entomologist. Les manuscrits intitulés «Assessing the effectiveness of the predatory mite Neoseiulus cucumeris (Acari: Phytoseiidae) in the control of the cyclamen mite Phytonemus pallidus (Acari: Tarsonemidae) in Eastern Canada strawberry fields» et «Biological control of the cyclamen mite Phytonemus pallidus (Acari: Tarsonemidae) in commercial Eastern Canada strawberry fields : comparison of three predatory mites (Acari: Phytoseiidae)» ont été écrits en collaboration avec Valérie Fournier, PhD., professeure d'entomologie à l'Université Laval et Stéphanie Tellier, agr., M. Sc., conseillère régionale petits fruits et experte provinciale dans le secteur des petits fruits au MAPAQ de la direction régionale de la Capitale-Nationale, respectivement directrice et codirectrice de ce projet de recherche. Les autres sections du mémoire, soit l’introduction générale présentée au chapitre 1 ainsi que la conclusion générale constituant le chapitre 4, sont rédigées en français. Les références citées dans ces sections sont présentées dans une bibliographie située immédiatement après la conclusion générale.
La récolte des données, l’analyse des données ainsi que la rédaction de l’ensemble des textes ont été réalisées par le candidat. Valérie Fournier (directrice) et Stéphanie Tellier (codirectrice) ont collaboré aux textes et sont coauteures du chapitre 2 et 3.
2
1.1. La production de fraises
1.1.1. Historique
Les fraises sont connues des humains depuis des millénaires. Consommées dès le Néolithique, elles auraient fait partie de la composition des jardins des Grecs et des Romains (Hancock et Hancock 1999). À cette époque, il s’agissait principalement de l’espèce sauvage très parfumée et à petits fruits, Fragaria vesca, la fraise des bois (Catoire 2004). Cette espèce a dominé en Europe jusqu’au début des années 1600, jusqu’à l’arrivée de F. virginiana en provenance de l’Amérique du Nord. Cette fraise écarlate, plus rustique et résistante aux températures froides, s’est répandue rapidement à travers l’Europe (Husaini et Neri 2016). Toutefois, la fraise moderne majoritairement cultivée aujourd’hui, F. x ananassa Duch., n’apparaîtra qu’un siècle plus tard. Cette espèce dotée de gros fruits rouges caractéristiques doit sa création à un espion français, Amédée-François Frézier, qui rapporta du Chili en 1714 un fraisier à gros fruits de couleur pâle, F. chiloensis. C’est l’hybridation naturelle de F. virginiana et F. chiloensis dans un jardin de France qui a donné naissance à cette nouvelle espèce, dont le nom provient de son parfum rappelant l’ananas. Elle fut rapidement adoptée en raison de sa rusticité, de sa productivité et du calibre de ses fruits (Husaini et Neri 2016). Dans les siècles qui ont suivi, plusieurs variétés ont été développées un peu partout dans le monde afin d’améliorer constamment cette espèce.
1.1.2. Taxonomie et caractéristiques générales
La fraise est une plante herbacée pérenne de la famille des Rosacées et du genre Fragaria. Elle possède une tige compacte appelée couronne et ses feuilles sont pétiolées et trifoliolées. Les plants se reproduisent principalement par stolons. La fraise est composée d’un réceptacle charnu qui porte les fruits, appelés akènes. La ploïdie des fraises est variable, allant de diploïde à décaploïde. Les espèces américaines, dont fait partie F. x ananassa, sont généralement octaploïdes (Hancock et Hancock 1999). Plusieurs étapes de développement des fraisiers, dont la floraison, sont régies par la photopériode et la température.
Il existe environ 34 espèces de Fragaria réparties en Amérique, Asie et Europe (Husaini et Neri 2016). Fragaria x ananassa demeure la plus cultivée à l’échelle mondiale avec un nombre important de variétés qui ne cesse de croître. À l’échelle mondiale, 900 nouvelles variétés ont été développées entre 1982 et 2008 (Della Strada et Fideghelli 2011). Bien qu’elle soit adaptée à une vaste gamme de températures, la fraise est cultivée principalement dans les climats tempérés ou méditerranéens, soit entre le 28e et le 60e parallèle (Hancock et Hancock 1999).
3
1.1.3. Statistiques de production
La production de fraises est importante à l’échelle mondiale. En 2014, plus de 8,1 millions de tonnes étaient produites. Avec 38 % de la production mondiale, la Chine demeure le plus important pays producteur, suivie par les États-Unis (17 %) et le Mexique (6 %). Le Canada arrive au 30e rang avec
une production de 20 210 tonnes, soit 0,2 % de la production mondiale (FAOSTAT 2016).
Avec ses 11 612 tonnes de fraises commercialisées en 2015, le Québec représente 57 % de la production canadienne. Ceci touche 524 exploitations sur 1558 hectares en culture (ISQ et MAPAQ 2016). Les fraises fraîches demeurent le principal marché du Québec, suivies par les fraises dédiées à la transformation et une petite proportion (4,8 %) est vouée à l’exportation (ISQ et MAPAQ 2016).
Bien que la demande pour les fruits et légumes biologiques soit en forte croissance mondialement, la production de fraises biologiques est encore peu répandue (Willer et Lernoud 2016). En 2013, seulement 21,8 hectares répartis sur 45 entreprises étaient dédiés à la culture de fraises biologiques au Québec (CARTV 2018). Ceci représente environ 1 % de la production québécoise de fraise pour la même année (ISQ et MAPAQ 2016). Toutefois, ce type de production suscite de plus en plus d’intérêt chez les producteurs. C’est pourquoi le soutien à la recherche en production biologique fait partie des priorités de recherche 2017 de l’Association des producteurs de fraises et framboises du Québec (APFFQ 2017).
1.1.4. Régies de production
Au Québec, on retrouve principalement deux types de fraisiers, soit les fraisiers à jours courts et à jours neutres. Les variétés à jours courts initient leurs bourgeons floraux à l’automne précédent et fructifient habituellement vers la fin du mois de juin. Elles peuvent être utilisées selon les méthodes culturales de plasticulture ou de rangs nattés, avec des plants de type « frigo », « motte » ou « frais » (Thireau et Lefebvre 2014). Bien que la plasticulture offre une meilleure qualité de fruits et un calibre plus gros, la régie dite en rangs nattés (Figure 1) demeure la plus répandue au Québec à ce jour (Novafruit 2003). Selon cette régie, les plants à racines nues, soit « frais » ou « frigo », sont plantés en plein champ au printemps et ne produisent des fruits que l’année suivante. Deux à trois années de production suivent l’année d’implantation. Il est rare de voir une fraisière en production au-delà de trois ans, car le calibre des fruits tend à diminuer avec les années et les problèmes phytosanitaires sont plus fréquents, ce qui peut compromettre la rentabilité (Novafruit 2013). À la fin de l’automne, les plants peuvent être protégés du froid par l’application d’une couche de paille appelée paillage ou encore par l’utilisation de couvertures flottantes (Agriculture et agroalimentaire Canada 2015). Il est
4
à noter que certaines couvertures flottantes, ou bâches d’automne, peuvent également permettre une récolte plus hâtive l’année suivante en devançant la floraison (Thireau et Lefebvre 2014). Plusieurs cultivars à jours courts sont disponibles au Québec et ceux-ci sont classés selon le moment de la récolte dans la saison. Ainsi, ils peuvent être hâtifs, de mi-saison ou tardifs. Le cultivar de mi-saison « Jewel » est un des plus connus dans la province.
Figure 1. Champ de fraisiers en rangs nattés. Photo: Stéphanie Patenaude
Les variétés à jours neutres, dites fraises d’automne, fleurissent tout au long de la saison. Les boutons floraux sont donc initiés la même année que la floraison (Agriculture et agroalimentaire Canada 2015). Ces variétés permettent de récolter des fruits de juillet à octobre, soit hors de la saison habituelle des fraises (Novafruit 2003). Le potentiel de rendement est donc supérieur. Toutefois, elles font l’objet d’une régie plus intensive et sont généralement cultivées sur des buttes recouvertes de plastique avec une irrigation au goutte-à-goutte (Agriculture et agroalimentaire Canada 2015). Quelques cultivars sont disponibles au Québec, le plus cultivé étant le « Seascape ».
Outre l’utilisation de ces deux types de fraisiers, les producteurs utilisent différentes stratégies pour étaler la production dans la saison ou pour augmenter les rendements et la qualité des fruits. Ainsi, l’utilisation de bâches, de plastique noir, la plantation programmée ou encore l’utilisation de tunnels font partie des stratégies possibles (Novafruit 2004). La culture hors-sol gagne également en popularité, notamment en raison de la présence croissante des pathogènes de sol en champ. La culture de fraises en serre, bien que de plus en plus de producteurs s’y intéressent, demeure encore marginale au Québec en raison du climat et des coûts élevés des investissements (Novafruit 2003). Il existe donc de multiples combinaisons possibles de méthodes de production selon les buts recherchés par les
5
producteurs. Toutefois, peu importe la régie de production adoptée, les producteurs auront à composer avec de multiples problèmes phytosanitaires, dont ceux associées à la présence de ravageurs de la culture.
1.1.5. Ravageurs de la fraise
Les fraisiers sont sujets à plusieurs problèmes phytosanitaires. Outre les désordres abiotiques et les maladies, plusieurs ravageurs affectent cette culture. Au Québec, la drosophile à ailes tachetées (Drosophila suzukii), la punaise terne (Lygus lineolaris), l’anthonome de la fleur du fraisier (Anthonomus signatus), le charançon noir de la vigne (Otiorhynchus sulcatus), le charançon de la racine du fraisier (O. ovatus) et le tétranyque à deux points (Tetranychus urticae) sont bien présents et causent beaucoup de dommages (Agriculture et agroalimentaire Canada 2015). Dans une moindre mesure, les thrips (Frankliniella occidentalis et F. tritici) et les pucerons (plusieurs espèces) peuvent être présents en pression modérée ou de façon sporadique. Le tarsonème du fraisier (Phytonemus pallidus) est également très important puisqu’il démontre une forte pression et une présence annuelle généralisée (Agriculture et agroalimentaire Canada 2015). Il est également préoccupant puisqu’il est un ravageur d’importance à l’échelle mondiale, notamment en Europe et en Amérique du Nord (Fountain et al. 2010; Hoy 2011b; Zhang 2003). Pour bien cerner ce problème, il incombe de mieux connaître ce ravageur.
1.2. Le tarsonème du fraisier
1.2.1. Description
Le tarsonème du fraisier (Phytonemus pallidus Banks), antérieurement Tarsonemus pallidus (Banks), Tarsonemus fragariae (Zimmerman) et Steneotarsonemus pallidus (Banks), est un acarien phytophage de la famille des Tarsonemidae. Il s’agit d’une grande famille mondialement distribuée qui possède 40 genres regroupant plus de 500 espèces (Zhang 2003). Le tarsonème du fraisier fait partie de la sous-famille des Tarsoneminae. Sa présence aurait été remarquée pour la première fois en 1898 à New York et en 1908 au Canada (Danemark 2000). Il s’agit d’un acarien minuscule impossible à voir à l’œil nu qui fuit la lumière directe et qui nécessite une humidité relative élevée pour compléter son cycle de vie (Hoy 2011b; Jeppson et al. 1975). Il démontre donc une préférence pour les jeunes feuilles non déployées et les boutons floraux (Fitzgerald et al. 2008; Zhang 2003). Il possède une large gamme d’hôtes, avec près de 60 plantes-hôtes potentielles (CABI Plantwise 2017). Outre le fraisier, il s’attaque également à plusieurs plantes ornementales, tels les bégonias, les
6
Gerberas et les cyclamens (Hoy 2011b; Zhang 2003). C’est d’ailleurs l’origine de son nom anglais : cyclamen mite. Certaines mauvaises herbes présentes au Québec pourraient également héberger ce ravageur, notamment la petite oseille (Rumex acetosella), le galinsoga (Galinsoga parviflora), l’ortie dioïque (Urtia dioica) et l’amarante à racine rouge (Amaranthus retroflexus) (CABI Plantwise 2017). Le mâle et la femelle sont faciles à différencier puisqu’un dimorphisme sexuel important est présent au sein de cette espèce. La femelle est brunâtre, ovoïde et mesure environ 250 µm (voir Figure 2). Contrairement aux femelles, dont les pattes postérieures sont minces et se terminent en une soie allongée, celles des mâles sont robustes et se terminent en pince (Alford 2007). Les œufs sont elliptiques et mesurent 125 µm x 75 µm. Ils sont blanchâtres et translucides (Alford 2007). Lors de fortes infestations, ils peuvent être visibles à l’œil nu (Zhang 2003). Les larves sont translucides, blanchâtres et possèdent uniquement trois paires de pattes. Elles mesurent environ 200 µm x 80 µm (Zhang 2003).
Figure 2. Tarsonème du fraisier A- Femelle (Photo : S. Patenaude) ; B- Femelle, larves et œufs (Photo : S. Patenaude);
C- Mâle (Photo : Karin Westrum/NIBIO).
Il est possible de confondre le tarsonème du fraisier avec le tarsonème trapu (Polyphagotarsonemus latus Banks), un ravageur important en serre, notamment en horticulture ornementale. Il s’agit d’une espèce très semblable à P. pallidus, causant des dommages comparables. Toutefois, il est possible de différencier les deux espèces par la présence de tubercules sur les œufs de P. latus, absents chez P. pallidus. Deux autres espèces de Tarsonemidae, soit Tarsonemus setifer (Erwing) et T. confusus (Erwing), ont été retrouvées dans des fraisières de la Californie et pourraient aussi porter à confusion lors des dépistages (Zalom et al. 2009). Ces espèces cosmopolites ne semblent cependant pas occasionner de dommages aux plants. Il est possible de les différencier de P. pallidus par l’absence de bride sur le fémur IV des mâles, par leur distribution plus uniforme sur la feuille et par leurs œufs, pondus individuellement et non regroupés comme P. pallidus (Zalom et al.
7
2009). Cette espèce fongivore et ravageuse mineure occasionnelle de cultures ornementales serait répandue un peu partout en Amérique du Nord, dont au Canada (Zhang 2003).
1.2.2. Cycle de vie
Au cours de son cycle de vie, le tarsonème traverse trois stades distincts, soit l’œuf, la larve et l’adulte. Au printemps, les femelles adultes ayant hiverné profondément enfouies dans la couronne des plants, émergent et commencent à se nourrir à la base des feuilles (Alford 2007; Jeppson et al. 1975). Peu de temps après, elles se mettent à pondre. Au Canada, cette étape s’amorcerait vers la mi-avril (Jeppson et al. 1975). Les femelles se reproduisent principalement par parthénogenèse, donc en absence de reproduction sexuée. Certaines populations de P. pallidus sont dites thélytoques, signifiant que les femelles non fécondées ne donneront que des femelles, alors que d’autres pourront donner à la fois des mâles et des femelles (Zhang 2003). La ponte se fait à un rythme moyen de 1,8 à 2,0 œufs par jour. Au cours de sa vie (jusqu’à 45 jours), une femelle peut pondre en moyenne 24,3 œufs à 20°C et 28,5 œufs à 25°C, pour un maximum de 49 œufs (Easterbrook et al. 2003). Ces œufs sont pondus entre les poils épidermiques de la plante, généralement à l’intérieur des bourgeons foliaires et floraux, des jeunes feuilles ou encore entre deux folioles adjacentes non déployées (Alford 2007; Zhang 2003). Les œufs peuvent prendre de quatre jours à 20°C à 13 jours à 15°C pour éclore, donnant place aux larves (Zhang 2003). Celles-ci vont se nourrir d’un à quatre jours avant d’entrer dans le stade quiescent (Zhang 2003). C’est à ce moment que s’amorcera la transformation au stade adulte à l’intérieur de leur cuticule (Alford 2007). Les mâles, lorsque présents, sont reconnus pour avoir un comportement de « pré-copulation » qui consiste à guetter et transporter sur leur dos des larves femelles. Ce comportement peut durer jusqu’à 24 heures et dès que la femelle émerge, la vraie copulation a lieu (Zhang 2003). Le temps de développement du tarsonème est inversement proportionnel à la température. Un cycle peut être complété en 28,4 jours à 12,5°C et en aussi peu que 8,8 jours à 25°C (Easterbrook et al. 2003). Le tarsonème aime les températures fraîches. Toutefois, les larves ne peuvent se transformer en adulte lorsque les températures sont sous 10°C (Easterbrook et al. 2003). Aucune étude ne rapporte leur diapause et en serre, ils peuvent se reproduire à l’année (Zhang 2003).
Peu d’études se sont attardées sur la dynamique de population de P. pallidus en champ. Une des rares études a eu lieu dans l’État de New York, dans les années 60. Dans une fraisière en première année de production, on dénotait une augmentation des densités de la population lors de la floraison, soit dès la fin du mois de mai, pour atteindre un pic au début du mois de juillet. Par la suite, un déclin rapide survenait en juillet et août. Un deuxième pic plus modeste se manifestait à la fin septembre.
8
Finalement, les densités de la population atteignaient leur creux saisonnier à la fin octobre (Schaefers 1963). Les chercheurs affirment toutefois que les pics et creux seraient davantage reliés à la croissance végétative des fraisiers. En effet, lorsque le taux de croissance est faible, notamment lors de la floraison et de la fructification, les tarsonèmes se retrouvent concentrés sur un nombre limité de jeunes feuilles. Ceci occasionne une plus grande détection lors des décomptes. Cette concentration peut aussi entraîner une forte mortalité des tarsonèmes en raison de la détérioration de la feuille plus rapide que son renouvellement. Ceci expliquerait la baisse des densités de la population qui suit invariablement un pic, notamment à la fin juin. Les creux peuvent également être dus à l’effet de dilution lors de fortes croissances végétatives, comme au printemps ou après la récolte. Les tarsonèmes sont alors davantage dispersés à travers les feuilles. Finalement, cette baisse peut également être partiellement expliquée par l’action de prédateurs indigènes, détectés en plus forte importance de juin à octobre (Schaefers 1963). Il est donc difficile d’avoir la véritable dynamique de population du tarsonème du fraisier, lorsqu’observé en champ. Le suivi du champ par les chercheurs l’année suivante, soit lors de la deuxième année de production, a démontré la même tendance, mais avec des densités de tarsonèmes plus élevées. Au Canada, le pic de population surviendrait de la mi-juin à la fin juillet, moment pendant lequel jusqu’à 300 tarsonèmes par plant peuvent être présents. La ponte des œufs diminuerait en août pour se terminer en octobre (Jeppson et al. 1975). En Europe, le pic surviendrait davantage vers le mois d’août ou septembre (Alford 2007).
1.2.3. Dommages
Les tarsonèmes du fraisier vont se nourrir sur les tissus tendres à l’abri de la lumière, principalement à la base des nouvelles folioles (Schaefers 1963). Les dommages sont causés, d’une part, par leur alimentation qui entraîne une nécrose et une distorsion du mésophylle. D’autre part, ils injecteraient une toxine causant une hypertrophie et une prolifération des cellules épidermiques (Schaefers 1963). Ces changements irréversibles donnent un aspect tordu et cloqué à la feuille (figure 3). Les boutons floraux en développement voient leur base noircir sous l’attaque de ces acariens.
Les tarsonèmes du fraisier se nourrissent à l’intérieur des jeunes feuilles jusqu’à ce qu’elles s’ouvrent et s’endurcissent. Par la suite, ils migreront pour trouver un nouveau site d’alimentation sur le même plant ou sur les plants adjacents. Pour se faire, ils se déplaceront par le feuillage, si les feuilles se touchent, ou par les stolons. Ils éviteront toutefois le sol, car ils sont très sensibles à la dessiccation (Hoy 2011b). En effet, la mort de ceux-ci surviendrait en quelques jours sur un sol sec ou en seulement quelques heures lorsqu’exposés aux rayons du soleil (Jeppson et al. 1975). Ils peuvent également être
9
dispersés de façon passive, soit via d’autres insectes, par la machinerie, les cueilleurs, l’eau d’irrigation ou encore par les vents (Alford 2007; Hoy 2011b; Jeppson et al. 1975).
Figure 3. Dommages sévères du tarsonème du fraisier sur les feuilles de fraisier (gauche) et sur les fruits (droite).
Photos : Stéphanie Patenaude
Les manifestations et la gravité des symptômes peuvent varier selon la densité de tarsonèmes présents. Le taux de croissance de la plante joue également un rôle dans la sévérité des dommages. En effet, plus la croissance est lente, plus les tarsonèmes profitent longtemps d’un environnement favorable à leur développement. Ceci entraîne donc des dommages plus importants (Schaefers 1963). La variété de fraisiers peut également influencer la manifestation des symptômes, puisque les dommages observés ne sont pas toujours corrélés de la même façon à la quantité de tarsonèmes présents. Ainsi, les cultivars possédant un haut taux de croissance et une forte pression osmotique seraient plus résistants à l’attaque de ces acariens (Schaefers 1963). Toutefois, aucun cultivar n’est actuellement résistant à ce ravageur (Łabanowska 2004).
Très peu d’études ont quantifié les dommages de P. pallidus. La plus connue demeure celle de Stenseth et Nordby (1976). Une population inférieure à huit tarsonèmes par foliole en post-récolte n’affecterait pas le rendement en fruit l’année suivante. Toutefois, une population plus importante, soit 34 et 44 acariens par foliole, entraînerait des pertes de rendement de 23 % et 33 % respectivement (Stenseth et Nordby 1976). En termes de rendement en fruits, aucune différence significative n’a été décelée pour le nombre d’inflorescences par plant. Toutefois, le nombre de fleurs par inflorescence était moindre lors de fortes infestations de P. pallidus. De plus, les fruits étaient plus petits pour les traitements où des tarsonèmes avaient été introduits par rapport au traitement sans tarsonèmes et au traitement acaricide. La baisse de rendements constatée serait due en partie à l’alimentation de P. pallidus lors de l’initiation des boutons floraux, soit après la récolte de l’année précédente. Quant
10
à la réduction du calibre des fruits, elle serait davantage causée par une infestation avant la récolte, soit en diminuant la vigueur des plants ou en attaquant directement les fleurs (Stenseth et Nordby 1976). Cette étude n’a pas dénoté de différence dans la mise à fruit, alors que Schaerfers (1963) affirmait le contraire.
Aucun seuil d’intervention contre ce ravageur n’a été répertorié au Canada, comme c’est le cas pour la quasi-totalité des pays où il est présent. Toutefois, la Pologne s’est fixé un seuil de deux à trois formes mobiles de P. pallidus par plus jeune feuille trifoliolée en post-récolte (Łabanowska et al. 2015). Au-delà de ce seuil, un traitement est recommandé. Il est à noter que les variétés tardives (mi- et fin de saison) ainsi que celles à jours neutres sont plus susceptibles d’être infestées par le tarsonème du fraisier. C’est également le cas lorsque des abris ou des protections sont utilisés dans la régie de culture (Fountain et al. 2010). Cela s’explique en partie par la création de conditions favorables à celui-ci plus longtemps en saison.
1.2.4. Ennemis naturels
Dans la nature, le tarsonème du fraisier possède des prédateurs naturels, bien que le phénomène soit encore peu documenté. Parmi ceux-ci se trouvent le thrips prédateur Scolothrips sexmaculatus (Pergande) ainsi que la punaise prédatrice Orius sp. (Solomon et al. 2010). Les acariens de la famille des phytoséiides, principalement les genres Amblyseius et Neoseiulus, sont également d’excellents prédateurs du tarsonème du fraisier (Solomon et al. 2010). Des champignons entomopathogènes, principalement du genre Hirsutella, peuvent infecter les acariens Tarsonemidae (Miętkiewski et al. 2000). Hirsutella nodulosa Petch a d’ailleurs été identifié en Angleterre sur des tarsonèmes du fraisier morts (Alford 1979). En conditions naturelles, la mortalité de P. pallidus résultant de ce champignon oscille entre 0,6 % et 13,0 %, le maximum étant atteint à l’automne (Tkaczuk et al. 2004). Cependant, ces agents fongiques peuvent également infecter les acariens prédateurs (Miętkiewski et al. 2000). De plus, certains pesticides utilisés dans la culture de la fraise ont un effet négatif sur la croissance de ce champignon (Tkaczuk et al. 2004). Il est donc plausible de penser que le contrôle de P. pallidus par celui-ci demeure marginal en conditions de fraisières commerciales.
1.3. Lutte au tarsonème du fraisier
1.3.1. Moyens de lutte préventive
La lutte au tarsonème du fraisier passe d’abord par la prévention. À cet effet, Hoy (2011b) a dressé une liste de moyens de lutte préventive à intégrer dans une optique de lutte intégrée. Tout d’abord,
11
des mesures de prophylaxie, telles que la destruction des résidus de culture infestés et l’élimination des mauvaises herbes hôtes, doivent être adoptées. Ensuite, l’équipement et la machinerie devraient être nettoyés régulièrement pour éviter le déplacement par inadvertance de tarsonèmes d’un champ infesté vers un champ sain. Une attention particulière devrait être portée à la fertilisation. En effet, celle-ci doit être adéquate, car un surplus favorise les infestations d’acariens. De plus, il est essentiel que le choix des pesticides soit fait dans le but de préserver au maximum les ennemis naturels déjà présents. Finalement, il est primordial de débuter la production avec des plants de fraisiers exempts de tarsonèmes et des cultivars moins sensibles à ce ravageur, lorsque disponibles.
1.3.2. Lutte chimique
La lutte chimique a été et demeure la plus utilisée pour contrôler le tarsonème du fraisier. Historiquement, les producteurs obtenaient un bon contrôle avec des pulvérisations d’endosulfan (Thiodan®, Thionex®) effectuées principalement en post-récolte, après la tonte du feuillage (rénovation de la fraisière). Cet insecticide/acaricide à large spectre de la famille des cyclodiènes chlorés (groupe 2A) s’est montré le plus efficace pour lutter contre ce ravageur à maintes reprises (Labanowska 1992; Schaefers 1963; Stenseth et Nordby 1976; Tanigoshi et Bergen 2005). Toutefois, sa toxicité et ses effets nocifs pour la santé humaine ont forcé son abandon graduel. D’abord retiré de l’Union européenne en 2007, c’est au tour de l’Agence de Protection de l’Environnement des États-Unis (EPA) d’annoncer, en 2010, son bannissement progressif. Ceci en raison des « risques inacceptables aux systèmes neurologique et reproducteur des agriculteurs et de la faune, de même que pour sa persistance dans l’environnement » (EPA 2010). Au Canada, l’Agence de réglementation de la lutte antiparasitaire (ARLA) a suivi le pas et amorcé l’abandon graduel de ce pesticide en 2011, aboutissant à son interdiction complète le 31 décembre 2016 (Gouvernement du Canada 2011). L’endosulfan a d’ailleurs été placé à l’Annexe A des polluants organiques persistants de la Convention de Stockholm en 2011, obligeant ainsi son élimination à l’échelle mondiale. Dans la foulée de ce retrait, plusieurs équipes de recherche ont tenté de trouver des acaricides de remplacement à l’endosulfan. Le tableau 1 résume les principales matières actives expérimentées ainsi que l’efficacité obtenue. Toutefois, ces résultats sont difficiles à généraliser en raison des nombreuses disparités entre les études en ce qui a trait aux doses et aux conditions d’application. En effet, comme l’efficacité du traitement dépend beaucoup de ces conditions, ceci explique la grande variabilité des résultats.
Les acaricides agissent principalement par contact. Cependant, réussir à atteindre ce ravageur est un défi de taille. Tout d’abord, cet acarien est protégé à l’intérieur des bourgeons ou des jeunes feuilles,
12
ce qui empêche le produit d’entrer en contact avec lui. Ensuite, les fraisiers sont très difficiles à mouiller en raison de leur cuticule cireuse et des poils épidermiques présents sur les feuilles (Fountain et al. 2010). Un adjuvant est donc souvent nécessaire en combinaison avec l’acaricide afin de diminuer la tension superficielle du produit, optimiser l’angle de contact et faciliter son adhésion. Sans cet ajout, des bulles d’air ont pu être observées entourant des tétranyques à deux points après une pulvérisation (Cowles et al. 2000). Ceci diminue donc grandement l’efficacité du traitement. L’adjuvant peut également avoir un léger effet acaricide, en provoquant la suffocation ou en perturbant certaines fonctions biologiques de l’acarien (Cowles et al. 2000). Fountain et al. (2010) ont démontré que les acaricides testés n’étaient efficaces qu’avec l’ajout d’un adjuvant alors que Labanowska et al. (2015) affirment que l’ajout de ce produit serait nécessaire seulement lorsque l’équipement de pulvérisation n’offre pas une bonne couverture du feuillage. Ce manque de consensus met en lumière le besoin de recherches supplémentaires sur le sujet.
D’autres paramètres sont essentiels à considérer. Tout d’abord, comme la majorité des acaricides n’ont pas d’effet ovicide, il est important d’effectuer deux pulvérisations à intervalle de sept jours afin de s’assurer d’un contrôle optimal. De plus, le moment des applications est important, puisque les traitements effectués après la récolte se sont montrés plus efficaces qu’avant la floraison (Labanowska 1992). Ceci s’explique en partie par les dangers d’effectuer une application trop tôt au printemps, lorsque les tarsonèmes sont encore cachés dans la couronne des plants, rendant l’intervention inefficace (Łabanowska 1992). Cette synchronisation est d’autant plus importante pour les pesticides dont le nombre de pulvérisations permises par année est limité. Le volume d’eau utilisé lors de l’application est un autre aspect primordial à considérer. En effet, une grande quantité d’eau est nécessaire pour permettre au produit de rejoindre les jeunes feuilles au cœur des plants (Gobin et Bangels 2008).
Malgré toute cette variabilité, quelques produits se démarquent. Tout d’abord, l’abamectine est l’une des matières actives les plus efficaces à l’heure actuelle contre le tarsonème du fraisier, malgré son contrôle incomplet. Celle-ci est vendue sous le nom d’Agri-Mek® SC au Canada. Cet insecticide/acaricide du groupe 6 agit sur les acariens par contact et par ingestion. Il a une action de surface et systémique locale sur la feuille (Tellier et al. 2017). Son efficacité s’est avérée grandement améliorée avec l’ajout d’un adjuvant (Fountain et al. 2010; Zalom et al. 2009). Le spirotétramate (Movento®), quant à lui, a été désigné comme un choix intéressant dans une démarche de gestion intégrée des ennemis de culture, vu son faible impact sur les organismes bénéfiques, tels les coccinelles, les syrphes et les acariens phytoséiides (Łabanowska et al. 2015). Peu de produits contre
13
ce ravageur sont approuvés pour l’agriculture biologique. Aux États-Unis, deux produits à base d’huiles essentielles ont été testés, soit l’Ecotrol® et le GC Mite®. Seul le GC Mite® a causé une mortalité significative après 24 h (Zalom et al. 2009). Toutefois, son efficacité dans le temps n’est pas recensée.
Au Québec, peu de matières actives sont homologuées contre le tarsonème du fraisier. Selon le Guide des traitements phytosanitaires du fraisier 2017 du Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ), seulement l’abamectine (Agri-Mek®), le diméthoate (Cygon 480®, Lagon 480®), l’huile de canola 96 % (Vegol®) et le sel de potassium d’acides gras (Opal®) figurent dans la liste (Tellier et al. 2017). Ainsi, le peu d’acaricides disponibles et leur contrôle incomplet nécessitent la recherche d’alternatives (Gobin et Bangels 2008).
14
Tableau 1. Matières actives des pesticides expérimentés et leur efficacité contre P. pallidus
Matière active Efficacité Études
Abamectine De non-significatif à efficacité très élevée
Fountain et al., 2010; Labanoswka et al. 2015; Gobin et Bangels, 2008; Lafontaine et al., 2011; Raudonis, 2006; Zalom et al., 2009
Acéquinocyle De non-significatif à efficacité faible
Gobin et Bangels, 2008; Fountain et al., 2010; Lafontaine et al., 2011; Zalom et al.,
2009
Bifénazate Non-significatif Fountain et al., 2010; Zalom et al., 2009
Etoxazole De non-significatif à efficacité de 85 % Fountain et al., 2010; Zalom et al., 2009
Fenpropathrine Réduction significative Zalom et al., 2009
Fenpyroximate De non-significatif à efficacité de 94 %
Fountain et al., 2010; Gobin et Bangels, 2008; Lafontaine et al., 2011; Zalom et al.,
2009
Flufénoxuron Efficacité faible Gobin et Bangels, 2008
Lambda-cyhalothrine Efficacité faible Raudonis, 2006
Milbémectine De non-significatif à réduction
significative importante Lafontaine et al., 2011; Zalom et al., 2009
Pyridabène Efficacité de 70 à 80 % Gobin et Bangels, 2008; Labanoswka et al. 2015
Spiromésifène De non-significatif à réduction significative
Fountain et al., 2010; Lafontaine et al., 2011; Zalom et al., 2009
Spirodiclofène De non-significatif à efficacité faible
Fountain et al., 2010; Gobin et Bangels, 2008; Lafontaine et al., 2011; Raudonis,
2006
Spirotétramate De non-significatif à efficacité moyenne Labanoswka et al. 2015; Lafontaine et al., 2011
Tébufenpyrad De non-significatif à efficacité de 70 % Gobin et Bangels, 2008; Fountain et al., 2010
15
1.3.3. Moyens alternatifs d’assainissement des plants
Outre la lutte chimique, d’autres moyens de lutte existent en remplacement ou complément de celle-ci. Afin d’obtenir des plants de fraisiers exempts de tarsonèmes, il est possible de traiter ceux-ci à l’eau chaude, puisqu’ils sont sensibles à la chaleur. L’efficacité de ce moyen de lutte est connue depuis plusieurs décennies, bien que les températures et les temps de trempage aient considérablement changé avec le temps (Hellqvist 2002; Hodson 1934; Stenseth 1975; Vernon 1962). Ce moyen, quelque peu délaissé, a fait l’objet d’un intérêt renouvelé avec le retrait de l’endosulfan. L’équipe de Hellqvist (2002) a déterminé que les conditions optimales pour le traitement des stolons dans l’eau chaude seraient une température de 46°C pendant 6,5 minutes. Ce sont d’ailleurs ces paramètres (46°C, 7 minutes) qui ont été utilisés et validés en France par la station d’expérimentation fruits et légumes en Aquitaine, Invenio (Turquet et Pommier 2014). Sur le plan commercial, la coopérative Anjou-plants a été la première entreprise à mettre au point un dispositif de traitement de ses plants de fraisiers à grande échelle (Sival innovation 2015). Toutefois, ce traitement doit être fait adéquatement, car il peut endommager les plants et les rendre plus sensibles aux champignons et aux bactéries pathogènes. De plus, il est important de considérer que les tarsonèmes se préparant à l’hiver sont beaucoup moins sensibles à la chaleur qu’en été. Ainsi, certains types de plants comme ceux récoltés à l’automne, les plants « frigo » ou encore à racines nues devraient être exposés plus longtemps à ces températures pour avoir la même efficacité (Hellqvist 2002).
Une autre technique d’assainissement des plants consiste à traiter ceux-ci selon la méthode de température et d’atmosphère contrôlées (CATTS). Celle-ci consiste à faire subir au matériel végétal des conditions d’atmosphère contrôlée pauvre en oxygène et riche en gaz carbonique à des températures élevées pendant une durée précise (Neven et Mitcham 1996). Le premier paramètre vise à abaisser la respiration du ravageur alors que le deuxième active son métabolisme, entraînant sa mort (Verschoor et al. 2013). D’abord élaborée pour le traitement en post-récolte des fruits contre des organismes de quarantaine, elle peut également être utilisée pour assainir le matériel de plantation. Cette méthode s’est montrée efficace aux Pays-Bas pour éliminer P. pallidus des plants de fraisiers (Verschoor et al. 2013). Les paramètres utilisés par les chercheurs pour obtenir une mortalité optimale du tarsonème étaient 0 % d’O2 et 50 % de CO2 à 35°C pendant 48 h. Cette méthode a également
l’avantage de contrôler d’autres ravageurs de la fraise, dont le tétranyque à deux points. Pour contrôler du même coup les nématodes, dont Meloidogyne hapla, certaines modifications sont requises. Ainsi, un traitement de 20 h à 35°C suivis de 20 h à 40°C est nécessaire (van Kruistum et al. 2014). Bien qu’elle ne soit pas encore très répandue, cette technique d’assainissement suscite de plus en plus d’intérêt à travers le monde.
16
1.3.4. La lutte biologique
Pour compléter l’éventail de moyens de lutte disponibles, une autre solution de remplacement à la lutte chimique serait le recours à la lutte biologique. La lutte biologique se définit comme « l’utilisation d’organismes vivants pour réprimer la densité de population ou l’impact d’un organisme nuisible spécifique, le rendant moins abondant ou moins dommageable qu’il ne le serait autrement » (Eilenberg et al. 2001). Il existe principalement quatre types de lutte biologique, soit la lutte biologique classique, inondative, inoculative et de conservation (Hajek 2004). La lutte biologique classique consiste à « introduire de façon intentionnelle un agent de lutte biologique exotique dans le but de son établissement permanent et du contrôle à long terme de l’organisme nuisible ciblé » (Eilenberg et al. 2001). La lutte biologique inondative et inoculative font partie de la lutte augmentative, qui ne vise pas l’établissement permanent de l’agent de lutte. Elles sont utilisées lorsque les ennemis naturels sont absents, en nombre insuffisant ou que leur contrôle surviendrait trop tard pour éviter les dommages (Hajek 2004). Bien qu’elles partagent certaines similarités, la première vise un contrôle rapide et immédiat de l’organisme nuisible avec les agents de lutte introduits, alors que la deuxième a plutôt pour but que ces agents «se multiplient et contrôlent le ravageur pour une période prolongée, sans être permanente » (Eilenberg et al. 2001). La lutte de conservation, quant à elle, est plutôt indirecte et vise à « modifier l’environnement ou les pratiques existantes pour protéger et promouvoir les ennemis naturels spécifiques ou autres organismes afin de réduire l’effet des ravageurs » (Eilenberg et al. 2001).
C’est majoritairement dans un but de lutte biologique augmentative inondative que les agents de lutte sont produits en masse et distribués commercialement. Parmi ceux-ci, on compte des bactéries, des champignons, des nématodes et des arthropodes parasitoïdes ou prédateurs (Hajek 2004). Le succès ou l’échec des introductions dépendront de plusieurs paramètres, dont la dose, le moment de l’application, la synchronisation avec le stade sensible de l’organisme nuisible, la surface traitée et la quantité de précipitations post-introduction (Hajek 2004). Il est parfois nécessaire de faire plusieurs introductions pour avoir une bonne efficacité et le ratio prédateur-proie est important.
Plusieurs motifs expliquent le recours à la lutte biologique. Ceux-ci sont majoritairement reliés aux problématiques de la lutte chimique. On retrouve ainsi le développement de résistance du ravageur à l’égard des pesticides utilisés, les problèmes de ravageurs secondaires suite à une pulvérisation, l’absence de matières actives efficaces contre le ravageur ou encore pour des raisons de santé humaine et environnementale (Hajek 2004). La lutte biologique comporte plusieurs avantages qui sont, conséquemment, un motif à son adoption. Il n’y a aucun délai requis entre le traitement et la récolte,
17
ni de résidus de pesticides sur les produits ou de dommages phytotoxiques sur les plantes. De plus, le ravageur ne développe pas de résistance face à l’arthropode (van Lenteren et al. 2017).
Toutefois, la lutte biologique comporte aussi des limitations. Elle agit généralement plus lentement qu’un traitement pesticide. Son degré d’efficacité et le niveau de mortalité du ravageur sont également plus difficiles à prévoir. De plus, comme il s’agit d’organismes vivants, ils ne peuvent être standardisés et leur durée de vie est limitée, ce qui complique leur production et leur distribution (Bale et al. 2008). Finalement, l’éradication complète du ravageur est plutôt rare, puisque la lutte biologique réduit plutôt les populations, ce qui peut constituer un avantage ou un désavantage selon les situations (Bale et al. 2008).
La lutte biologique contre le tarsonème du fraisier a fait l’objet de recherches au cours des dernières années. Tout d’abord, l’efficacité du champignon entomopathogène Beauveria bassiana a été évaluée par l’équipe de Labanowska et al. (2015). Ce champignon est commercialisé contre une vaste gamme de ravageurs, dont plusieurs coléoptères, hémiptères, lépidoptères, orthoptères et thysanoptères (Hajek 2004). Toutefois, son niveau de contrôle était inférieur et de plus courte durée que le traitement acaricide à l’abamectine et était statistiquement semblable au témoin non traité (Łabanowska et al. 2015). C’est plutôt la lutte biologique à l’aide d’acariens phytoséiides prédateurs qui demeure la plus prometteuse et la plus étudiée.
1.3.4.1. Les acariens phytoséiides Description
Les phytoséiides constituent la plus importante famille d’acariens prédateurs appartenant à l’ordre des Mesostigmata. Il s’agit d’une très grande famille regroupant 91 genres. Parmi ceux-ci, les genres Typhlodromus, Amblyseius, Neoseiulus, Phytoseius, Eusieus et Proprioseiopsis regroupent le plus grand nombre d’espèces (McMurtry et al. 2015). Ce sont des acariens en forme de poire possédant de longues pattes. Leur couleur est influencée par leur diète et peut prendre des teintes variant entre le blanc, le brun et le rouge (Hoy 2011a). La femelle adulte mesure 0,5 mm alors que le mâle fait la moitié de cette taille et est plutôt de forme ovale (Hoy 2011a).
Mis à part l’Antarctique, les phytoséiides sont présents sur tous les continents et la majorité (85 %) vit sur les plantes, tandis que 6 % d’entre eux sont terricoles ou vivent dans l’humus et la litière (McMurtry et al. 2015). Ce sont principalement des prédateurs d’acariens et d’autres petits insectes, pouvant également se nourrir de pollen, de spores fongiques, d’exsudats de plante et de nématodes (Zhang 2003). Pour compléter leur alimentation, certains phytoséiides du genre Euseius pourraient se
18
nourrir de cellules de plantes, mais n’occasionneraient pas de dommages économiques (McMurtry et al. 2013).
Les phytoséiides sont classés en quatre grands types, avec ou sans subdivisions, en fonction de leur mode de vie et leur préférence alimentaire (McMurtry et al. 2013). Le type I présente des espèces ayant une spécificité obligatoire au tétranyque (Tetranychus spp.), comme c’est le cas du genre Phytoseiulus. Le type II démontre une préférence pour les tétranyques et regroupe notamment des espèces des genres Neoseiulus, Galendromus et Typhlodromus. Le type III, quant à lui, renferme des espèces généralistes se nourrissant d’acariens, de petits insectes et de pollen. Plusieurs genres variés font partie de ce type, notamment d’autres Neoseiulus et Amblyseius. Finalement, le type IV présente des prédateurs généralistes possédant une préférence pour le pollen, principalement des Euseius, Iphiseius et Iphiseiodes (McMurtry et al. 2013). Les genres Neoseiulus, Amblyseius et Phytoseiulus sont les plus fréquemment utilisés en lutte biologique.
Le degré optimal de spécificité du prédateur à sa proie ne fait pas consensus en lutte biologique. En effet, les phytoséiides spécialistes offrent l’avantage de se concentrer sur leur proie, ce qui augmente l’efficacité et la rapidité du contrôle. Toutefois, ils ne peuvent survivre dans la culture en absence de proies. Les généralistes, quant à eux, peuvent se nourrir de sources alternatives de nourriture en absence de proies, ce qui leur permet de se maintenir dans la culture plus longtemps. Par contre, leur contrôle sera plus lent et un peu moins efficace en lutte augmentative, sauf si les autres sources de nourriture sont rares (Hoy 2011a). Le choix de l’un ou l’autre dépendra des buts recherchés.
Les phytoséiides n’ayant pas d’yeux, ils repèrent leurs proies à l’aide de signaux chimiques provenant des ravageurs, tels que des kairomones, des fèces ou encore des composés volatils émis par la plante en réponse à leur alimentation. Ceux-ci seront perçus par les phytoséiides à l’aide de récepteurs sensoriels situés sur leurs palpes et leurs pattes I (Hoy 2011a). Lorsqu’un signal est détecté, les phytoséiides se déplaceront plus lentement et tourneront plus fréquemment afin de se diriger vers les proies.
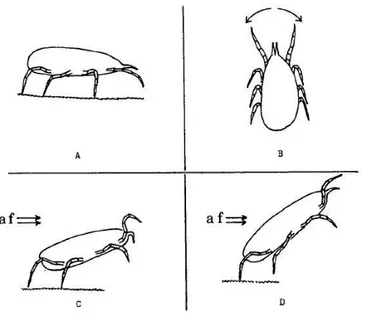
Ces acariens possèdent une grande capacité de dispersion. Tout d’abord, ils peuvent marcher pour se déplacer sur les feuilles d’un même plant ou entre les différents plants. Ils peuvent également déambuler sur une distance de quelques mètres sur la surface du sol, notamment par le biais de mauvaises herbes (Hoy 2011a). Ensuite, certains phytoséiides, dont N. fallacis, peuvent se disperser par voie aérienne (Figure 4). Pour se faire, la femelle se positionne à l’extrémité d’une feuille, puis se dresse sur ses pattes postérieures, dos au courant d’air. Elle sera emportée par le vent lorsque
celui-19
ci sera supérieur à 1,6 km/h (Johnson et Croft 1976). La vitesse de ce déplacement peut être de 0,39 à 0,73 m/s (Jung et Croft 2001). La dispersion aérienne est toutefois hasardeuse pour l’acarien, car les conditions du lieu d’atterrissage et la présence de proies ne sont pas garanties (Hoy 2011a). De façon générale, que ce soit en marchant ou par voie aérienne, la dispersion s’effectue par les femelles accouplées nouvellement émergées en période pré-ovipositoire (Hoy 2011a). Les phytoséiides spécialistes ont également une plus grande propension aux déplacements que les généralistes (Jung et Croft 2001). Contrairement à certains acariens, les phytoséiides ne font pas de phorésie, c’est-à-dire qu’ils ne s’accrochent pas à d’autres insectes pour se déplacer (Hoy 2011a).
L’efficacité, la survie et la reproduction des phytoséiides sont grandement influencées par des facteurs de stress environnementaux. En effet, plusieurs phénomènes abiotiques, tels que la température, l’humidité, le rayonnement ultraviolet et les pesticides, peuvent moduler de façon positive ou négative la performance de ces acariens (Ghazy et al. 2016). Bien que tous ces paramètres soient essentiels, la résistance aux pesticides est très importante pour un programme de lutte intégrée, puisque l’utilisation de pesticides y est fréquente (Hoy 2011a; Tuovinen et al. 2009).
.
Figure 4. Étapes de la dispersion aérienne de N. fallacis. (A) Recherche aléatoire sur le substrat (B) Orientation dans le sens
du courant d’air dominant (vue dorsale); (C) Position redressée sur les pattes postérieures, dos au courant d’air (af); (D) Décollage. Tirée de Johnson et Croft (1976).
Les phytoséiides sont également soumis à des stress biotiques, comme le cannibalisme, la prédation intraguilde, le manque de nourriture et les agents pathogènes. Ainsi, en pénurie de proies, du cannibalisme peut survenir principalement de la part des femelles adultes et des protonymphes sur
20
les jeunes larves et parfois sur les œufs (Schausberger 2003). Il peut également y avoir de la prédation intraguilde lorsque plusieurs espèces compétitionnent pour la même ressource. La dynamique de celle-ci est propre à chaque espèce et aux conditions du milieu. Toutefois, lorsque les proies sont rares, les acariens spécialistes auront tendance à être délogés par les généralistes (Schausberger et Walzer 2001; Zhang et Croft 1995). Ce phénomène, si présent en trop grande importance, peut compromettre l’efficacité d’un programme de lutte biologique en diminuant le nombre de prédateurs présents ou encore, en favorisant la consommation de compétiteurs au détriment des proies (Ghazy et al. 2016). Le manque de nourriture peut affecter plusieurs fonctions comme la reproduction, le sexe-ratio, la capacité de recherche de nourriture et de dispersion. Toutefois, la tolérance à celui-ci dépend grandement de l’espèce et peut varier selon le stade de développement, la température et l’eau disponible (Ghazy et al. 2016). De plus, les spécialistes seraient plus sensibles au manque de nourriture que les généralistes qui, eux, peuvent se nourrir d’autres sources de nourriture. Finalement, les phytoséiides peuvent être atteints par des agents pathogènes, dont des champignons, protozoaires, virus et bactéries (Ghazy et al. 2016). Le degré de sensibilité ou de résistance des phytoséiides face à ces facteurs de stress est propre à chaque espèce. De plus, il est préférable de considérer les interactions plutôt que chaque facteur pris isolément, car des effets additifs, antagonistes ou synergiques entre ceux-ci sont fréquents (Ghazy et al. 2016). La prise en compte de ces éléments de stress permet de mieux comprendre les facteurs de réussite de la lutte biologique.
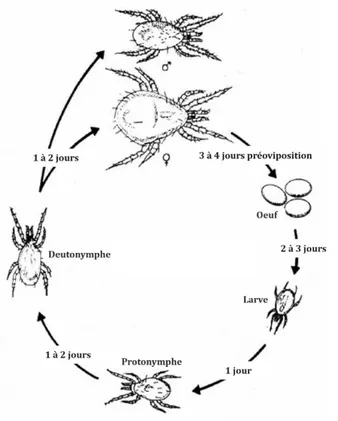
Cycle de vie
Les phytoséiides possèdent cinq stades de vie, soit l’œuf, la larve, la protonymphe, la deutonymphe et l’adulte. Le cycle de vie est présenté à la Figure 5. La larve possède trois paires de pattes, contrairement aux autres stades mobiles qui comptent quatre paires. Un cycle complet prend en moyenne sept à 10 jours pour la femelle et est généralement plus court chez le mâle. Ce temps de développement peut varier selon l’espèce, la température, l’humidité ainsi que l’abondance ou la diversité des proies disponibles (Hoy 2011a; Jeppson et al. 1975).
21
Figure 5. Cycle de vie d'un acarien phytoséiide typique à 27°C et 70 % HR. Adaptée de Yaninek et al. (1989).
Les mâles vont fréquemment être observés à « guetter » une femelle deutonymphe quiescente afin de pouvoir s’accoupler dès que la mue de cette dernière est complétée. Les accouplements entre frères et sœurs sont fréquents chez les phytoséiides (Hoy 2011a). Les femelles sont dites parahaploïdes (ou pseudo-arrhénotoques). Ainsi, elles doivent être fécondées, souvent plusieurs fois, pour pouvoir pondre leurs œufs qui seront diploïdes initialement. La ploïdie peut ensuite changer au cours de l’embryogénèse. Les œufs diploïdes donneront les femelles, alors que les mâles deviendront haploïdes durant l’embryogénèse en perdant les chromosomes reçus du père (Hoy 2011a). Chez les phytoséiides, les femelles sont généralement plus abondantes que les mâles, avec un sexe-ratio de 3 :1 pour plusieurs espèces. Ces femelles vont pondre de deux à quatre œufs par jour, pour un total de 20 à 50 œufs par femelle (Hoy 2011a). Pour pouvoir éclore, ceux-ci ont besoin d’une humidité relative élevée, généralement un minimum de 60 % est requis (Ferrero et al. 2010).
Bien qu’en régions tropicales le développement s’effectue à l’année, une diapause facultative hivernale peut être induite en régions tempérées par les jours courts ou une baisse de température (Zhang 2003). En tel cas, ce sera la femelle fécondée qui effectuera cette étape dans la litière, sous l’écorce ou encore à l’intérieur des écailles des bourgeons (Hoy 2011a; Jeppson et al. 1975).