Effet de l'ajout de biochar sur la symbiose tripartite
Ensifer meliloti-Rhizophagus irregularis-luzerne
(Medicago sativa L.), sur la production d'inocula
bactériens et envers la lutte aux agents pathogènes
Mémoire
Héla Selmi
Maîtrise en microbiologie agroalimentaire
Maître ès sciences (M.Sc.)
Québec, Canada
Effet de l'ajout de biochar sur la symbiose tripartite
Ensifer meliloti-Rhizophagus irregularis-luzerne
(Medicago sativa L.), sur la production d'inocula
bactériens et envers la lutte aux agents pathogènes
Mémoire
Héla Selmi
Sous la direction de :
Hani Antoun, directeur de recherche
Richard Hogue, codirecteur de recherche
iii
RÉSUMÉ
L’agriculture durable repose sur l’utilisation de moins d’intrants chimiques et favorise l’utilisation des produits biologiques comme le biochar. Ce dernier, à certaines doses, peut stimuler la fixation biologique d’azote chez les légumineuses. Notre projet vise à étudier l’effet d’un biochar de copeaux de pin pyrolysés à 700 ºC sur la symbiose tripartite Ensifer
meliloti-Rhizophagus irregularis-Medicago sativa L., sur la production d’inocula
bactériens et envers la lutte contre les agents pathogènes.
Une culture de luzerne inoculée avec deux E. meliloti A2 et S14, en présence du
Rhizophagus irregularis et dans un sol amendé avec 0, 15 ou 30 % de biochar (v:v) a été
réalisée. Une stimulation significative de la mycorhization a été observée en présence de 15 % de biochar, et des souches A2 et S14. Par contre, l’inoculation de la luzerne avec A2 ou
S14 n’a pas eu d’effet significatif sur les rendements, indiquant la présence dans le sol de
souches efficaces d’E. meliloti.
Une étude portant sur la survie des rhizobiums et du Bacillus subtilis MBI 600 menée pendant 120 jours à 4 et 25 °C. Elle a montré que 15 % de biochar favorise significativement la survie des cellules de rhizobiums. Par contre, pour Bacillus subtilis c’est le Pro-mix à 100 % qui supporte mieux la survie des cellules. Ainsi, l’effet de biochar sur la survie des microorganismes dépend de la nature de ces derniers et de la dose utilisée. L’étude de l’effet des trois doses du biochar sur les agents pathogènes a montré qu’à forte dose il pourrait favoriser le développement des pathogènes.
Les résultats apportent des pistes pour les modalités d’application de biochar en agriculture. Par contre, notre étude est réalisée avec un seul type de biochar à trois doses. Il sera donc très important de tester d’autres types ainsi que d’autres doses de biochar.
iv
ABSTRACT
Sustainable agriculture is based on the use of less chemical inputs and promotes the use of biological products such as biochar. Many studies clearly indicate that some biochars can stimulate biological nitrogen fixation in legumes. Our project aims to study the effect of a biochar (Pines, 700ºC) on the tripartite symbiosis Ensifer meliloti-Rhizophagus
irregularis-Medicago sativa L., on the production of bacterial inocula and on the fight against
pathogens.
A culture of alfalfa inoculated with two strains of E. meliloti A2 or S14, in the presence of
Rhizophagus irregularis and in a soil amended with 0, 15 or 30% of biochar (vol:vol) was
conducted. A significant stimulation of mycorrhization was observed in the presence of 15% biochar and A2 or S14. However, inoculation of alfalfa with A2 or S14 had no
significant effect on yields, indicating the presence in soil of effective strains of E. meliloti. A study on survival of rhizobia and Bacillus subtilis MBI 600 at 4°C and 25°C was conducted for 120 days. It showed that biochar (15%, vol:vol) promotes significantly the survival of rhizobial cells but for Bacillus subtilis it is the Pro-mix without biochar which supports better cell survival. Thus, the biochar effect on survival of microorganisms depends on the dose of biochar used.
The effect of biochar amendments on P. ultimum and FORL colonization and infection was also evaluated. The study of the effect of three doses of biochar (0, 15, 30%; vol:vol) on pathogens showed that high doses may offer a good environment for pathogens development.
Our study was performed using a single type of biochar with three doses. Therefore, it is very important to test other types and doses of biochar to be able to make recommendations.
v
TABLE
DES
MATIÈRES
RÉSUMÉ……….III
ABSTRACT………IV
TABLEDESMATIÈRES………V
LISTEDESTABLEAUX………IX
LISTEDESFIGURES……….XI
LISTEDESANNEXE………XII
REMERCIEMENT………XIII
INTRODUCTIONGÉNÉRALE……….1
CHAPITRE1-REVUEDELITTÉRATURE………...………..3
1.1. Biochar……….………...…………..3
1.1.1. Qu’est-ce que le biochar? ... ...3
1.1.2. Propriétés physico-chimiques du biochar ... .3
1.1.3. Effets du biochar sur le sol ... ..3
1.1.3.1. Effets du biochar sur les microorganismes du sol ... …3
1.1.3.2. Le biochar, les plantes et les mycorhizes ... …..4
1.1.4. Le biochar et la lutte biologique...5
1.1.4.1. Implication du biochar dans la lutte biologique contre Pythium ultimum et Fusarium oxysporum f.sp radicis lycopersici FORL dans la culture de tomate ... ...5
1.1.4.1.1. Effets de Pythium ultimum sur les cultures de tomates ... ...5
1.1.4.1.2. Effets des fusariums pathogènes sur les tomates...5
1.1.4.1.3. Moyens de lutte contre les maladies causées par P. ultimum et FORL ... 6
1.1.5. Utilisation du biochar comme additif aux inocula microbiens ... 8
1.2. Effet de l’ajout de biochar sur la symbiose tripartite entre luzerne- rhizobiums et mycorhizes ... 9
1.2.1. La vie en symbiose chez les légumineuses et les microorganismes ... 9
1.2.1.1. La luzerne ... 9
1.2.1.2. Les mycorhizes ... 9
1.2.1.3. Rôle des symbioses mycorhiziennes ... 10
1.2.1.3.1. Amélioration de la croissance des plantes ... 10
1.2.1.3.2. Protection de la plante contre les éléments de stress environnementaux ... 11
1.2.1.4. Les rhizobiums ... 11
vi
1.2.1.4.2. Comment se fait l’interaction entre les légumineuses et les rhizobiums? ... ...12
1.2.1.4.3. Importance de la symbiose ... 13
1.2.1.5. La symbiose tripartite : luzerne, rhizobiums et endomycorhizes ... 14
1.2.1.5.1. Les effets du biochar sur la symbiose tripartite ... 14
1.3. Hypothèse et objectifs ... 15
1.3.1. Hypothèse ... 15
1.3.2. Objectifs………...15
CHAPITRE 2 - ÉTUDE DE L’EFFET DE L’AJOUT DE BIOCHAR SUR LA COLONISATION MYCORHIZIENNE ET LA NODULATION DE LA LUZERNE INOCULÉE AVEC RHIZOPHAGUS IRREGULARIS ET ENSIFER MELILOI...16
2. Matériel et méthodes ... 16
2.1. Souches de rhizobiums et isolat mycorhizien utilisés ... 16
2.2. Les substrats ... 16
2.2.1. Biochar……….16
2.2.2. Sol……….17
2.3. La luzerne ... 17
2.4. Préparation de l’inoculum d’Ensifer meliloti ... 18
2.4.1. Cultures de Rhizobium en Erlenmeyer ... 18
2.5. Dispositif expérimental ... 18
2.6. Analyses statistiques ... 19
3. Résultats ... 20
3.1. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la mycorhization ... ...20
3.2. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la nodulation .. ....21
3.3. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la masse fraîche et sèche des plants de luzerne ... 22
4. Discussion ... 22
4.1. Effet de l’ajout de biochar et des souches de Rhizobium sur la mycorhization ... 22
4.2. Effet de l’ajout de biochar sur la nodulation des rhizobiums inoculés ou indigènes………24
4.3. Effet de l’ajout de biochar et des souches de Rhizobium sur la masse fraîche et sèche des plants de luzerne ... 25
CHAPITRE 3 - LE BIOCHAR, UN NOUVEL ADDITIF POUR LA PRODUCTION DES INOCULA COMMERCIAUX BACTÉRIENS...27
3. Matériel et méthodes ... 27
vii
3.1.1. Préparation de l’inoculum ... 27
3.1.1.1. Marquage des souches bactériennes d’Ensifer meliloti ... 27
3.1.1.2. Préparation de la souche bactérienne Bacillus subtilis MBI 600...28
3.2. Substrats ... 28
3.3. Inoculation des substrats ... 29
3.4. Dénombrement des microorganismes ... 29
3.5. Analyses statistiques ... 29
4. Résultats ... 30
4.1. Détermination de la survie des souches A2 rif+ et S14 rif+ dans les différents milieux de culture et à deux températures différentes ... 30
4.1.1. Taux de survie des souches A2 rif+ ... 33
4.1.2. pH et pourcentage d’humidité des différents milieux à la fin de l’étude de survie de la souche A2 rif+………...35
4.1.3. Taux de survies des souches S14 rif+ ... 36
4.1.4. pH et pourcentage d’humidité des différents milieux à la fin de l'étude de survie de S14 rif+………38
4.2. Le biochar, un nouvel additif pour la production des inocula commerciaux de Bacillus subtilis MBI 600 ... 39
4.2.1. Survie de B. subtilis dans les différents milieux de culture et à deux températures différentes………..40
4.2.2. Taux de survie de Bacillus subtilis MBI 600 ... 41
4.2.3. pH et humidité des différents substrats inoculés avec la souche de Bacillus subtilis MBI 600 à la fin de l’expérience ... 43
5. Discussion ... 44
CHAPITRE 4- ÉTUDE DE L’EFFET DE L’AJOUT DE BIOCHAR SUR PYTHIUM ULTIMUM ET FUSARIUM OXYSPORUM F.SP RADICIS-LYCOPERSICI FORL; DEUX AGENTS PATHOGÈNES DE LA TOMATE...47
4. Matériel et méthodes ... 47
4.1. Souches de microorganismes utilisées ... 47
4.1.1. Bactérie : Agent antagoniste ... 47
4.1.2 Champignons pathogènes ... 47
4.2 Préparation de l’inoculum ... 47
4.2.1 Préparation des souches bactériennes de Bacillus subtilis MBI 600 ... 47
4.2.2 Culture de Pythium ultimum et de FORL ... 48
4.3 Substrat ... 48
viii
4.3.2. Terreau Pro-mix ... 48
4.4. Tomate ... 49
4.5. Inoculation des substrats ... 49
4.6. Dispositif expérimental ... 49
4.7. Évaluation du développement de P. ultimum et FORL à la fin de l’expérience.. ... 50
4.8. Analyses statistiques ... 51
5. Résultats ... 51
5.1. Effet de l’ajout de biochar et du Bacillus subtilis sur les plants de tomate inoculés par Pythium ultimum ... 51
5.1.1. Effet de l’ajout de biochar et de la présence de l’agent antagoniste B. subtilis sur la masse fraîche et sèche des plants de tomate ... 51
5.1.2. Effet de l’ajout de biochar et de l’agent antagoniste sur le développement de P.ultimum...53
5.1.3. pH des substrats à la fin de l’expérience ... 54
5.2. Effet de l’ajout de biochar sur les plants de tomate inoculés avec Fusarium oxysporum en présence ou pas de Bacillus subtilis ... 55
5.2.1. Effet de l’ajout de biochar et du B. subtilis sur la masse fraîche et sèche des plants de tomate……….55
5.2.2. Effet de l’ajout de biochar sur le développement de FORL ... 57
5.2.3. pH des substrats à la fin de l’expérience ... 58
5.2.4. Effet du biochar sur le système racinaire et le développement général des plants de tomate……….59
6. Discussion ... 62
CHAPITRE 5-CONCLUSION GÉNÉRALE...64
ix
LISTE DES TABLEAUX
CHAPITRE 2Tableau 2.1: Propriétés physico-chimiques du biochar ... 17 Tableau 2.2: Dispositif expérimental de l’expérience de luzerne dans la chambre de croissance... 19 Tableau 2.3: Effet de l’inoculation des plants de luzerne (Medicago sativa L.) avec les souches A2 et S14 d'E. meliloti et les différents traitements de biochar sur la masse fraîche
et sèche des parties aériennes, la nodulation et le pourcentage de mycorhization ... .21 CHAPITRE 3
Tableau 3.1: Évolution du nombre d’UFC de A2 rif+ g-1 de substrat pendant la semaine
d’incubation à 28 °C ... 30 Tableau 3.2: Évolution du nombre d’UFC de S14 rif+ g-1 de substratpendant la semaine
d’incubation à 28 °C ... 31 Tableau 3.3: Le nombre d’UFC recouvré et le pourcentage de survie de la souche A2 rif+
dans chacun des substrats suite à une incubation prolongée à 4 °C ... 34 Tableau 3.4: Le nombre d’UFC recouvré et le pourcentage de survie de la souche A2 rif+
dans chacun des substrats suite à une incubation prolongée à 25 °C ... 35 Tableau 3.5: Mesures de pHeau et de l’humidité des substrats à la fin de l’étude de survie
de la souche A2 rif+ ... 36
Tableau 3.6: Le nombre d’UFC recouvré et le pourcentage de survie de la souche S14 rif+
dans chacun des substrats suite à une incubation prolongée à 4 °C ... 37 Tableau 3.7: Le nombre d’UFC recouvré et le pourcentage de survie de la souche S14 rif+
dans chacun des substrats suite à une incubation prolongée à 25 °C ... 38 Tableau 3.8: Mesures de pH et de l’humidité des substrats à la fin de l’étude de survie de la souche S14 rif+ ... 39
Tableau 3.9: Évolution de nombre d’UFC de Bacillus subtilis MBI 600g-1 de substrat
pendant la semaine d’incubation à 28 °C ... 40 Tableau 3.10: Le nombre d’UFC recouvré et le pourcentage de survie de la souche B.
subtilis MBI 600 dans chacun des substrats suite à une incubation prolongée à 4 °C ... 42
Tableau 3.11: le nombre d’UFC recouvré et le pourcentage de survie de la souche B.
subtilis MBI 600 dans chacun des substrats suite à une incubation prolongée à 25 °C. ... 43
Tableau 3.12: Mesures de pH et de l’humidité des substrats à la fin de l’étude de survie du
x
CHAPITRE 4
Tableau 4.1: Dispositif expérimental de l’essai avec deux agents pathogènes de la tomate ... 50 Tableau 4.2: Effet de la présence de Bacillus subtilis et les doses de biochar sur la masse fraîche et sèche des parties aériennes des plants de tomate (Solanum lycopersicum L.) inoculées avec P. ultimum ... 52 Tableau 4.3: Effet de la dose de biochar sur les masses fraîches et sèches des parties aériennes des plants de tomate (Solanum lycopersicum L.) inoculées avec P. ultimum en présence ou absence de B. subtilis ... 53 Tableau 4.4: pH des différents substrats amendés avec les différentes doses de biochar et inoculés avec P. ultimum en présence ou pas de B. subtilis ... 55 Tableau 4.5: Effet de la présence de B. subtilis sur la masse fraîche et sèche des parties aériennes des plants de tomate (Solanum lycopersicum L.) inoculées avec FORL en présence de différentes doses de biochar ... 56 Tableau 4.6: Effet de la dose de biochar sur les masses fraîches et sèches des parties aériennes des plants de tomate (Solanum lycopersicum L.) inoculées avec FORL en présence ou absence de B. subtilis ... 57 Tableau 4.7: pH des différents substrats amendés avec les différentes doses de biochar et inoculés avec FORL en présence ou pas de B. subtilis ... 59
xi
LISTE DES FIGURES
CHAPITRE 1Figure 1.1: Les différents types d’associations mycorhiziennes ... 10 Figure 1.2: La symbiose fixatrice d’azote ... 13 CHAPITRE 3
Figure 3.1: Observation des colonies de Bacillus subtilis après 24h d’incubation à 28 °C ... ...28 Figure 3.2: Survie de A2 rif+ dans différents supports: Biochar, Pro-mix, Pro-mix + 15 %
(v/v) biochar et Pro-mix + 30 % (v/v) biochar à 4 °C (a) et 25 °C (b) ... 32 Figure 3.3: Survie de S14 rif+ dans différents supports: Biochar, Pro-mix, Pro-mix+ 15 %
(v/v) biochar et Pro-mix+ 30 % (v/v) biochar à 4 °C (a) et 25 °C (b) ... 33 Figure 3.4: Survie de Bacillus subtilis dans différents supports: Biochar, mix, Pro-mix+ 15 % (v/v) biochar et Pro-Pro-mix+ 30 % (v/v) biochar à 4 °C (a) et 25 °C (b) ... 41 CHAPITRE 4
Figure 4.1: Nombre de propagules de P. ultimum g-1 des substrat cultivés dans du Pro-mix
amendé ou non avec du biochar en présence ou en l’absence de B. subtilis ... 54 Figure 4.2: Nombre de propagules de FORL g-1 des plants de tomates cultivés dans du
Pro-mix amendé ou non avec du biochar à différentes doses 0 %, 15 % et 30 % et en présence ou l'absence de B. subtili ... 58 Figure 4.3: Observation du développement général des plants de tomate cultivés dans différents substrats ... 60 Figure 4.4: Observation des racines des plants de tomate cultivés dans différents substrats ... 61
xii
LISTE DES ANNEXES
Annexe A: Milieux de cultures et solutions colorantes……….…………....………...….75
Annexe B: Protocole de désinfection des graines de luzerne………76
Annexe C: Solution d’oligoéléments de Hoagland et Arnon………77
Annexe D: Méthode d’évaluation de l’indice nodulaire et du pourcentage de mycorhization des racines………..………..…...78
Annexe E: Analyse de la variance de la matière fraîche et sèche (g plant-1), de la nodulation et du pourcentage de mycorhization (%) des plants de luzerne (Medicago sativa) cultivés avec du biochar et inoculés par deux rhizobiums A2 et S14………..…..81
Annexe F: Analyse de la variance de survie de A2 rif+………..82
Annexe G: Analyse de la variance de survie de S14 rif+………..…..83
Annexe H: Analyse de la variance de survie de Bacillus subtilis………...84
Annexe I: Analyse de la variance de la matière fraîche et sèche (g plant-1), des plants de tomate (Solanum lycopersicum L.) cultivés avec du biochar et inoculés par Pythium ultimum en présence ou pas de Bacillus subtilis……….……...85
Annexe J: Analyse de la variance de la matière fraîche et sèche (g plant-1), des plants de tomate (Solanum lycopersicum L.) cultivés avec du biochar et inoculés par FORL en présence ou pas de Bacillus subtilis………..…….….86
Annexe K: Analyse de la variance de développement de Pythium ultimum cultivés avec du biochar en présence ou pas de Bacillus subtilis………..87
Annexe L: Analyse de la variance de la survie de Fusarium oxysporum cultivés avec du biochar en présence ou pas de Bacillus subtilis………...88
xiii
REMERCIEMENTS
Il y a maintenant un peu plus de deux ans que je suis venue à l’Université Laval pour effectuer un stage de six mois dans le cadre d’un projet de fin d'études pour mon diplôme d'ingénieur en Biotechnologie. À mon arrivée, j’étais chaleureusement accueillie par Mr. Steeve Pépin et sa femme qui m’ont aidée à trouver mes repères dans ma nouvelle aventure. Après cette expérience très enrichissante, je me suis sentie très motivée pour entamer une maîtrise dans le même centre de recherche tout en travaillant sur un projet qui m’intéressait beaucoup.
Persévérance et patience, deux mots clés qui ont fait de ma maîtrise une belle aventure très riche, non seulement d’un point de vue scientifique, mais aussi humain. Simplement, tout ceci n’aurait pas été possible sans le bienveillant soutien de plusieurs personnes. Et je ne suis vraiment pas capable de dire dans les mots qui conviennent, le grand rôle qu’elles ont pu jouer à mes côtés pour me permettre d’en arriver là.
En premier lieu, mes remerciements vont à mon directeur, Mr Hani Antoun. Je tiens à lui témoigner toute ma reconnaissance pour m’avoir accueillie dans son laboratoire, et encadré mes travaux. Merci infiniment de m'avoir accompagnée tout au long de mon projet et de m’avoir transmis votre efficacité et votre rigueur scientifique.
Je remercie aussi mon codirecteur, Mr. Richard Hogue, pour son support, ses conseils et sa disponibilité.
Isabelle Clermont, merci pour ton aide, ton soutien dans les moments difficiles et pour ta patience à répondre à la multitude de questions que je t’ai posées !
Carole Martinez, merci pour vos conseils et votre aide au cours de la dernière expérience. Une pensée très spéciale à Salma. Merci pour ta gentillesse, ta présence dans les moments de doute et pour ta grande amitié si rare.
Dans le même temps, je remercie Vicky pour son accueil, sa gentillesse sa générosité, ses conseils et son aide. Merci infiniment!
xiv
Je n’oublie pas aussi les étudiants d’été dont l’aide a été bien précieuse.
Bien évidemment, je tiens à remercier ma famille pour son soutien et ses grands encouragements.
À la mémoire de mon père qui est parti trop tôt. Toute ma vie, tu me manqueras!
Mes sincères remerciements à celles-là, si rares, qui m’aiment et que j’aime énormément: mes deux sœurs.
À la personne que j’aime le plus dans la vie, ma très chère mère, pour son support et son grand amour. Aucune dédicace ne saurait être assez éloquente pour exprimer ma gratitude pour tous les sacrifices qu'elle a du faire pour moi. Je t’aime maman!
À une personne spéciale, à qui je dois ma vie et toutes mes réussites, celui qui m'a supporté jusqu’au bout, mon frère que j’aime beaucoup!
À Yazan et Lena, mon neveu et ma petite nièce.
Que ce travail soit pour vous tout le témoignage de ma reconnaissance pour m’avoir soutenue tout au long de cette expérience.
1
INTRODUCTION GÉNÉRALE
Dans le contexte actuel où les approches respectueuses de l’environnement sont de plus en plus valorisées, les choix mondiaux s’orientent vers une agriculture durable qui repose sur l’utilisation de moins d’intrants d’engrais chimiques et qui favorise l’utilisation des produits biologiques jouant un rôle important dans la lutte contre les différents problèmes environnementaux associés à la surfertilisation.
Les problèmes cités peuvent être résolus en profitant du fait qu’une bonne nutrition azotée peut être garantie par la plante elle même à partir de l’azote atmosphérique. En effet, dans le cadre d’un phénomène biologique naturel qui est la symbiose, certaines espèces végétales, surtout les légumineuses, s’associent à des bactéries de sol, notamment les rhizobiums (Vitousek et al., 1997). Cette association comble directement les besoins de la plante en azote en fixant des quantités importantes d’azote atmosphérique ce qui peut donner un apport annuel de 110-227 kg N/ha (Herridge et al., 2014).
En plus de leur association symbiotique avec les rhizobiums, les légumineuses sont capables d’établir d’autres associations symbiotiques avec les champignons mycorhiziens arbusculaires, notamment Rhizophagus irregularis, qui leur garantissent une bonne croissance, une protection contre les conditions de stress et une meilleure productivité (Evelin et al., 2009; Elmer et Pignatello, 2011).
L’inoculation des légumineuses avec les rhizobiums peut se confronter dans certain pays à un problème majeur qui est la disponibilité des inocula de bonne qualité et à un faible coût. En effet, la production des inocula de Rhizobium se trouve toujours contrôlée par la disponibilité et le coût de la source de carbone à utiliser pour la culture de l’inoculum (Bissonnette et al., 1986). Pour pallier à ce problème, les chercheurs ont testé plusieurs milieux de culture, comme par exemple les sous-produits des industries de levures (Meade et al., 1985) et les boues d’épuration (Ben Rebah et al., 2002).
Une avenue d’importance cruciale qui peut être appliquée dans la production des inocula de
2
de remplacer l’utilisation de la tourbe à cause de sa rareté dans certains pays et son prix d’achat élevé, consisterait à utiliser le biochar comme additif aux inocula bactériens.
Le biochar est un produit qui résulte de la pyrolyse de la biomasse à des températures élevées et en l’absence d’oxygène (Lehmann et al., 2011). L’utilité de son application dans les sols a été déduite suite à des constatations faites sur les terres noires en Amazonie : les
Terra Preta qui ont enregistré une amélioration des propriétés physico-chimiques du sol
ainsi que sa fertilité (Elmer et Pignatello, 2011). Selon plusieurs travaux, le biochar, en présence des microorganismes bénéfiques, est capable de retenir les nutriments permettant ainsi de garantir à la plante ses besoins nutritifs (Atkinson et al., 2010) et de la protéger contre les attaques des agents phytopathogènes (Elmer et Pignatello, 2011; Graber et Elad, 2013), ce qui augmente la productivité des cultures (Jaiswal et al., 2014). D’une part, il a été démontré que l’amendement répété des sols agricoles avec du biochar combiné à l’inoculation avec Bradyrhizobium japonicum durant trois ans a amélioré la nodulation et la fixation biologique de l’azote chez le soja(Iijima et al., 2015). D’autre part, les travaux d’Elmer et Pignatello. (2011) ont montré que l’amendement du sol avec du biochar a joué le rôle d’un agent de lutte contre les Fusarium oxysporum et il a favorisé aussi l’augmentation de la colonisation racinaire par les champignons mycorhiziens arbusculaires à raison de 100 % chez les asperges.
La présente étude vise donc à évaluer l’effet de l’ajout de biochar sur la symbiose tripartite entre la luzerne-Rhizobium-Rhizophagus irregularis, son utilisation à différents pourcentages comme additif pour la production d’inocula commerciaux de Rhizobium et l’étude de son effet sur Pythium ultimum et Fusarium oxysporum f.sp radicis lycopersici
3
Chapitre 1- Revue de littérature
1.1. Biochar
1.1.1. Qu’est-ce que le biochar?
Le biochar est le produit de la dégradation thermique de la matière organique à des températures élevées sous une très faible teneur d’oxygène (Elmer et Pignatello, 2011; Graber el Elad, 2013; Laird et al., 2010; Lehmann et al., 2011).
C’est un produit qui a été longtemps utilisé comme amendement pour les sols agricoles (Elad et al., 2010). De nos jours, son utilisation ne cesse de se répandre et connaît un grand essor, car il présente plusieurs effets bénéfiques sur la qualité et les rendements des cultures agricoles ainsi que sur les propriétés des sols (Quilliam et al., 2013; Singh et al., 2015). 1.1.2. Propriétés physico-chimiques du biochar
Selon la matière organique utilisée et la température appliquée, différents types de biochar peuvent être obtenus. Ils possèdent ainsi des propriétés physico-chimiques telles que la porosité, la surface spécifique, la composition minérale et la capacité d’échange cationique, qui sont très variables (Lehmann et al., 2011).
Le biochar se caractérise par sa composition importante en carbone aromatique. Il se caractérise aussi par un bon transport de gaz. C’est grâce à son contenu en micro et macro pores, qui retiennent l’air et l’eau, qu’il représente un bon habitat pour les microorganismes en leur garantissant les différents besoins métaboliques (Lehmann et al., 2011).
1.1.3. Effets du biochar sur le sol
L’amendement en biochar modifie le pH du sol (Chan et al., 2007; Yamato et al., 2006) ainsi que sa masse volumique. Il est capable d’assurer un bon développement des racines des plantes en augmentant l’absorption des nutriments existants dans le sol (Lehmann et al., 2011).
4
Il a été démontré que l’effet du volume de biochar utilisé influence les microorganismes du sol selon leur nature (Elmer et Pignatello, 2011; Gravel et al., 2013).
L’ajout de biochar mène à une modification des propriétés des sols (Jaiswal et al., 2014). En effet, un biochar provenant de la décomposition thermochimique des résidus de culture (résidus de récolte, de feuilles) à des températures inférieurs à 700 °C présente des effets positifs sur l’abondance, la diversité et l’activité des communautés microbiennes (Singh et al., 2015). En effet, selon Kim et al. (2007), une augmentation de 25 % de la diversité microbienne a été enregistrée dans la Terra Preta, sol noir de l’Amazonie enrichi en charbon.
Nous pouvons rapporter les différents effets bénéfiques que présente le biochar sur les microorganismes du sol à plusieurs mécanismes. i) il stimule la reproduction microbienne dans le sol (Jones et al., 2011). ii) il augmente la diversité microbienne et stimule leurs activités (Bailey et al., 2011). iii) il présente une source de nutriment qui joue un rôle important dans la stimulation de la microflore du sol (Jones et al., 2011; Smith et al., 2010). iv) il possède une structure poreuse qui lui permet de retenir les microorganismes dans le sol et de les protéger contre les prédateurs et les conditions de stress, car sa grande capacité de rétention d’eau lui confère une bonne capacité de garder ses pores humides permettant ainsi la poursuite de l’hydratation des microorganismes dans le sol (Lehmann et al., 2011). 1.1.3.2. Le biochar, les plantes et les mycorhizes
Selon Lehmann et al. (2011), le biochar modifie le système de signalisation qui peut s’établir entre les plantes et les mycorhizes. Ceci se fait par la modification de l’activité des microorganismes qui ont un effet sur les mycorhizes. En effet, sous certaines conditions, des bactéries de sol sont capables de sécréter des substances qui aident à la croissance du mycélium extracellulaire des mycorhizes, favorisant ainsi la colonisation des racines par les champignons.
Warnock et al. (2007) ont présenté trois mécanismes par lesquels le biochar peut présenter un effet positif sur la mycorhization: i) la modification de la disponibilité des éléments nutritifs dans le sol. ii) la stimulation de la population microbienne du sol qui favorise la
5
colonisation racinaire par les mycorhizes. iii) la perturbation des signaux chimiques ou des substances allélochimiques qui inhibent la mycorhization.
1.1.4. Le biochar et la lutte biologique
Les microorganismes pathogènes du sol peuvent affecter une grande variété de plantes, y compris les fruits, les légumes, les arbres, les arbustes, etc. Ceci engendre une réduction significative de la qualité et du rendement des cultures, ce qui exige l’utilisation des moyens de lutte contre les maladies. Néanmoins, les options de lutte utilisées peuvent ne pas présenter des moyens complets pour le contrôle de ces maladies.
1.1.4.1. Implication du biochar dans la lutte biologique contre Pythium ultimum et
Fusarium oxysporum f.sp radicis lycopersici FORL dans la culture de tomate
1.1.4.1.1. Effets de Pythium ultimum sur les cultures de tomates
Plusieurs essais pathogéniques avaient pour but de déterminer l’identité des agents pathogènes des racines des semis afin de préciser leur rôle par rapport aux symptômes observés dans les cultures.
L’inoculation des semis avec des souches de Pythium est à l’origine de nombreux dégâts induisant la fonte des semis qui se caractérise par un taux de levée très faible et un affaissement des plantules à un stade de croissance précoce ainsi que par la pourriture des racines et de la tige (Richard et Boivin, 1994).
Le champignon pathogène Pythium ultimum est à l’origine de la pourriture pythienne chez la tomate. Le système racinaire des plants est le premier à être affecté par différentes lésions (Khabbaz et Abbasi, 2013). Cette dégradation du système racinaire a un effet négatif sur l’ancrage des plants dans le substrat engendrant ainsi un problème de nutrition et de croissance (Gravel, 2007).
1.1.4.1.2. Effets des fusariums pathogènes sur les tomates
Les champignons du genre Fusarium sont à l’origine de plusieurs maladies chez les plantes. Ils attaquent les cultures à leurs différents stades de croissance, du stade plantule jusqu’au stade adulte. Ils causent la pourriture des racines, la décoloration du système vasculaire et le flétrissement des plantes avant la maturité des fruits, ce qui cause des pertes économiques
6
importantes (Benhamou et al., 1994; Myresiotis et al., 2012; Xu et Kim, 2014; Zhang et al., 2015).
Le champignon Fusarium oxysporum f. sp. radicis-lycopersici (FORL) peut endommager différentes cultures dont la tomate, chez laquelle il provoque la pourriture des racines qui est une maladie tellurique très dommageable à la production.
Les pratiques actuelles de contrôle des maladies des plantes sont largement basées sur les cultures résistantes aux maladies, la gestion de la culture dans les champs et l’application de fongicides synthétiques (Elmer et Pignatello, 2011).
1.1.4.1.3. Moyens de lutte contre les maladies causées par P. ultimum et FORL
Certes, l’exclusion totale des agents pathogènes qui nuisent à la culture est très difficile, voire impossible. Toutefois, opter pour de bonnes pratiques culturales peut aider à éviter la présence, la dissémination et le développement des agents pathogènes.
Plusieurs méthodes peuvent être utilisées pour lutter contre ces agents pathogènes, à savoir la lutte chimique ou la lutte biologique.
i. La lutte chimique
La lutte chimique est une méthode de répression des champignons pathogènes des plantes qui consiste à utiliser des fongicides. Parmi les raisons mises de l’avantpour l’utilisation de ces produits, ont peut citer l’efficacité de l’élimination et la limitation du développement des champignons pathogènes.
Cependant, dans un contexte où les approches respectueuses de l’environnement sont de plus en plus valorisées, les choix des agriculteurs se sont orientés vers une agriculture durable qui favorise l’utilisation des produits biologiques. De ce fait, ils ont cherché d’autres alternatives beaucoup plus efficaces et qui protègent l’écosystème, tels que les produits biologiques ou les microorganismes antagonistes.
7
Une alternative possible aux fongicides est l’utilisation des microorganismes comme agents de lutte biologique. En effet, l’utilisation des agents antagonistes qui jouent le rôle d’agents de lutte biologique est l’une des alternatives importantes de protection des cultures et de la lutte contre les microorganismes phytopathogènes. Les modes d’action de ces agents sont l’antibiose, le parasitisme, la compétition et l’induction de résistance chez les plantes hôtes (Khabbaz et Abbasi, 2013).
Plusieurs microorganismes peuvent jouer le rôle d’un agent répressif contre les champignons pathogènes. Parmi les bactéries du sol qui se sont révélées être capables de supprimer plusieurs maladies des plantes et de favoriser la croissance des végétaux, il y a les bacilles (Xu et Kim, 2014). Parmi ceux-ci, il y a les Bacillus subtilis, microorganismes employés comme des agents de lutte biologique qui favorisent la croissance des plantes et qui permettent de réduire les pertes résultantes des maladies comme la fonte des semis et la pourriture des racines (Khabbaz et Abbasi, 2013).
iii. Lutte contre les champignons avec des produits biologiques : exemple de biochar
Plusieurs nouveaux travaux avaient pour objectifs d’impliquer des produits biologiques, par exemple le biochar, dans la lutte contre les agents pathogènes pour déterminer son rôle dans la promotion de la croissance des plantes et le contrôle biologique des maladies.
Des études ont montré que l’amendement des sols agricoles avec un certain volume de biochar peut jouer un rôle important dans la lutte contre les agents phytopathogènes (Elad et al., 2010; Elmer et Pignatello, 2011; Graber et Elad, 2013; Jaiswal et al., 2014; Lehmann et al., 2011).
Selon Graber et Elad. (2013), l’efficacité de l’utilisation du biochar dans l’induction d'une résistance vis-à-vis les attaques des agents pathogènes dépend de la matière première et de la température utilisée pour produire le biochar, de la dose et de la période de l’application de ce produit ainsi que de la nature de la maladie.
Des travaux ont montré que l’utilisation du charbon de bois de noix de coco et d’un biochar dont la matière première provenait de la poussière de bois réduit l’effet des fusariums pathogènes sur les asperges (Elmer et Pignatello, 2011; Matsubara et al., 2002). En effet, Elmer et Pignatello. (2011) ont prouvé que l’utilisation de 3 % (v/v) de biochar permet une
8
réduction des lésions racinaires causées par Fusarium chez ces plantes. Ceci s’applique aussi pour les tomates chez qui Nerome et al. (2005) ont réussi à démontrer que l’infection par Ralstonia solanacearum a été considérablement réduite par l’ajout de biochar à 20 % (v/v).
Il existe différents mécanismes avec lesquels le biochar peut induire des défenses systémiques au niveau de la plante contre les attaques des pathogènes. Ces mécanismes ont été présentés par Graber et Elad. (2013) comme suit: i) l’ajout de biochar peut améliorer l’absorption des nutriments ce qui engendre une amélioration de la croissance de la plante. ii) la présence de biochar provoque un changement de la communauté microbienne du sol ce qui aboutit généralement à une protection directe contre les agents pathogènes par la production microbienne des antibiotiques et par la concurrence pour les ressources nutritives. iii) le biochar absorbe les toxines produites par les microorganismes pathogènes du sol. iv) le biochar peut changer la nature des composés sécrétés au niveau des exsudats racinaires dans la rhizosphère la rendant ainsi moins propice pour les microorganismes pathogènes et plus favorable à la production des microorganismes bénéfiques.
1.1.5. Utilisation du biochar comme additif aux inocula microbiens
Pour faire face aux différents problèmes qui peuvent être suscités suite à l’utilisation de la tourbe comme support pour les microorganismes (rareté de la tourbe dans certains pays, prix d'achat élevé, dégagement des gaz à effet de serre), l’emploi du biochar offre une alternative importante.
Les travaux de Hale et al. (2014) ont testé la possibilité d’utiliser un biochar de pin comme additif d'un inoculum microbien de la souche bactérienne Enterobacter cloacae UW5. Ils ont réussi à démontrer que la survie des cellules a été améliorée en utilisant le biochar comme additif pour l’inoculum.
Certes, l’utilisation de biochar comme additif aux inocula bactériens ou comme matériel de support aux microorganismes peut résoudre les différents problèmes qui limitent l’utilisation de la tourbe. Mais, ces utilisations doivent être précédées par des recherches visant à déterminer : i) la survie des inocula pendant le stockage. ii) la survie dans le sol et iii) l’efficacité de l’inoculation (Lehmann et al., 2011).
9
1.2. Effet de l'ajout de biochar sur la symbiose tripartite entre luzerne-
rhizobiums et mycorhizes
1.2.1. La vie en symbiose chez les légumineuses et les microorganismes
Les légumineuses sont des plantes dont le fruit est une gousse, elles présentent plus de 18000 espèces connues. Plusieurs de ces plantes ont l’habilité à être en symbiose avec certaines bactéries du sol surtout celles qui appartiennent au genre Rhizobium. Il s’agit d’une association durable qui permet à chaque partenaire symbiotique d’en tirer profit pour assurer sa nourriture et garantir sa croissance (Haag et al., 2013). En effet, la plante présente une source d’énergie pour les microorganismes sous forme de substrats carbonés provenant de la photosynthèse alors que les microorganismes réduisent l’azote atmosphérique (N2) sous forme assimilable par la plante (American Academy of
Microbiology, 2013; Fortin et al., 2008).
En agriculture de conservation, l’azote fait toujours défaut. En regardant la hausse des prix des engrais chimiques, on comprend bien l’importance d’un tel système naturel. Il est donc important de réhabiliter ce système pour profiter de son potentiel à augmenter les rendements et à protéger l’écosystème.
1.2.1.1. La luzerne
La luzerne, Medicago sativa L., est une légumineuse très cultivée au Canada, car elle est adaptée à son climat. Elle fait partie de la liste des plantes fourragères recommandées par le Centre de référence en agriculture et agroalimentaire du Québec (CRAAQ 2013-2014). Cette plante est souvent appelée la reine des fourrages, car elle fournit d’excellents rendements de fourrage de qualité et elle garantit une bonne nutrition azotée de la culture subséquente. La production de fourrage au Canada pendant les années 2004-2005 était de 240 000 tonnes expliquant ainsi la grande superficie consacrée à la culture de la luzerne, soit plus de 4 544 662 hectares en 2011 (Agriculture et Agroalimentaire Canada).
1.2.1.2. Les mycorhizes
On désigne par « mycorhizes » les différentes associations qui peuvent s’établir entre les racines d’une plante et les champignons qui se trouvent dans le sol (Bonfante et Anca,
10
2009). Ces champignons forment des symbioses mycorhiziennes avec 80 % des plantes terrestres. Il existe plusieurs types de mycorhizes dont la différence se base essentiellement sur le groupe taxonomique et les partenaires symbiotiques. Ce sont les ectomycorhizes, les endomycorhizes et les ectendomycorhizes (Figure 1.1).
Dans notre travail, nous nous intéresserons aux endomycorhizes.
Figure 1.1: Les différents types d’associations mycorhiziennes (Selosse et Le Tacon, 1998) Les endomycorhizes
Elles sont appelées aussi les mycorhizes arbusculaires (MA), ce sont des mycorhizes qui forment des relations symbiotiques avec les végétaux supérieurs entraînant ainsi une bonne croissance de la plante tout en la protégeant contre les différents agents de stress. Il y a plus que 120 espèces qui ont l’habilité de former ce type de mycorhizes et qui appartiennent majoritairement aux gloméromycètes. Ces derniers sont incapables de mener une vie individuelle, ils doivent être en association obligatoire avec les racines des plantes.
1.2.1.3. Rôle des symbioses mycorhiziennes
11
Les mycorhizes jouent un rôle important dans l’absorption de l’eau et des nutriments par la plante (American Academy of Microbiology, 2013). En effet, ils stimulent la croissance de la plante par l’amélioration de sa nutrition et ceci en augmentant le volume du sol disponible pour l’absorption des nutriments qui se fait grâce aux mycéliums racinaires de ces champignons.
Plusieurs travaux ont montré aussi que l’inoculation des racines avec des MA permet d’augmenter la matière sèche ainsi que le rendement et l’acquisition d’azote et de phosphore, surtout pendant la phase de développement de la plante (Chalk et al., 2006; Kistner et Parniske, 2002; Smith et Read, 2008).
1.2.1.3.2.. Protection de la plante contre les éléments de stress environnementaux
La présence des endomycorhizes au niveau racinaire aide les plantes à surmonter les mauvaises conditions et à maintenir une bonne santé physiologique. Ceci se fait par la stimulation de la croissance des racines, ce qui joue un rôle important dans l’amélioration de l’utilisation de l’eau qui existe dans le sol engendrant ainsi une meilleure nutrition et une augmentation du taux de transpiration et de photosynthèse (American Academy of Microbiology, 2013; Fitter et Nichols, 1988; Goicoechea et al., 1997).
Plusieurs travaux ont démontré que les plantes non mycorhizées ont été plus sensibles aux situations de stress comparativement aux plantes dont les racines étaient mycorhizées (Goicoechea et al., 1997).
1.2.1.4. Les rhizobiums
1.2.1.4.1. Généralités et définition
Les bactéries sont très abondantes dans le sol, on peut en dénombrer plus de 1010 UFC/g
sol. Une grande quantité de bactéries est aussi retrouvée à l’intérieur et autour des racines des plantes. Cette région, localisée près des racines et connue sous le nom de « rhizosphère », est très riche en microorganismes différents (American Academy of Microbiology, 2013). Parmi ces microorganismes, il y a les rhizobiums. Ce sont des bactéries aérobies qui font partie de la famille des Rhizobiaceae. La taxonomie des rhizobiums formant des nodules en s’associant à des légumineuses diffère selon leur
12
écologie, leur physiologie et leurs propriétés biochimiques. Une caractéristique majeure de ces bactéries est la capacité de former des symbioses avec des plantes qui appartiennent à la famille des fabacées (soja, trèfle, luzerne, etc) (Zhang et al., 1991).
1.2.1.4.2. Comment se fait l’interaction entre les légumineuses et les rhizobiums?
L’établissement de la symbiose entre la plante hôte et les bactéries présentes dans le sol débute par l’échange de signaux entre la légumineuse et le Rhizobium. C'est une reconnaissance spécifique qui vise à protéger la plante contre les microorganismes indésirables.
En effet, les racines de la plante possèdent un métabolisme qu’elles utilisent pour relâcher des substances (i.e. les flavonoïdes) qui possèdent un pouvoir attracteur sur certains microorganismes du sol. Ce signal, une fois détecté par les rhizobiums, va entraîner la production des facteurs Nod (Figure 1.2). Ceux-ci sont des signaux de nodulations qui vont susciter l’organogenèse des nodosités sur les racines des légumineuses (Hirsch et al., 2001; Kondorosi et al., 2013). À l’intérieur des nodules développés, la bactérie se différencie en bactéroïdes capables de réduire l’azote atmosphérique en ammonium assimilable par la plante.
La symbiose Rhizobium-légumineuse est ainsi un dialogue moléculaire qui aboutit à la fixation de l’azote atmosphérique (Kistner et Parniske, 2002).
13
Figure 1.2: La symbiose fixatrice d’azote (Baudet. 2002).
1.2.1.4.3. Importance de la symbiose
La plante nécessite de l'oxygène, du CO2, de l’eau, de l’azote, du phosphore, du potassium,
et beaucoup d’autres éléments pour sa croissance et sa survie. En association légumineuse-rhizobiums, ces derniers participent à différents processus qui permettent de garantir les besoins de la plante. En effet, les rhizobiums qui se trouvent en association avec la luzerne jouent un rôle essentiel dans l’assimilation des éléments nutritifs à partir du sol pour leur propre nutrition ainsi que pour la nutrition de leur partenaire symbiotique (Alden et al., 2001; Demoling et al., 2007; Rousk et Bååth, 2007). Des exemples de nutriments assimilables par les rhizobiums sont l’azote et le fer.
Plusieurs travaux ont montré que l’association Rhizobium-légumineuses peut aider ces dernières à surmonter les conditions de stress. Il a été démontré que la symbiose luzerne-rhizobiums peut aider la plante à acquérir une bonne résistance face aux agents pathogènes et ceci grâce aux biofilms formés par ces bactéries tel que rapporté par Mendes et al. (2013).
14
1.2.1.5. La symbiose tripartite : luzerne, rhizobiums et endomycorhizes
L’association tripartite luzerne, rhizobiums et endomycorhizes permet : i) la transformation des éléments nutritifs comme le sulfate, le potassium et le fer en forme assimilable par la plante. À titre d'exemple, les rhizobiums produisent des sidérophores qui chélatent le fer le rendant ainsi plus mobile donc plus assimilable par la plante. ii) la production des phytohormones qui stimulent la formation des poils absorbants entrainant ainsi l’augmentation de l’absorption racinaire des micro et macroéléments. iii) garantir les besoins en azote et en phosphate pour la plante assurant ainsi un bon rendement de la culture tout en réduisant l’utilisation des fertilisants. Dans le cas de l’azote par exemple, Les rhizobiums fixent l’azote atmosphérique grâce à la nitrogénase produite, dans les nodosités.
Les racines des plantes et les hyphes des mycorhizes secrètent des phosphatases extracellulaires qui hydrolysent les liaisons phosphodiester dans le sol libérant ainsi le phosphate dans le sol où il peut être assimilé par les racines des plantes (American Academy of Microbiology, 2013; Nygren et al., 2012).
Luzerne, mycorhizes et rhizobiums forment ainsi un système symbiotique d’importance cruciale dans les cultures des fourragères. Ce système forme une bonne combinaison qui présente une forte habilité à garantir les besoins de chaque partenaire symbiotique menant ainsi à des effets positifs sur la nutrition, la croissance de la plante et des microorganismes et du coup sur le rendement et la qualité des fourrages et la protection de l’écosystème. Il serait donc très important de penser à optimiser davantage cette relation symbiotique tripartite en ajoutant d’autres produits bénéfiques tel que le biochar.
1.2.1.5.1. Les effets du biochar sur la symbiose tripartite
Le biochar, grâce à ses effets bénéfiques sur les microorganismes du sol et les plantes, peut être impliqué dans l’optimisation des relations symbiotiques entre les plantes et certains microorganismes bénéfiques (Quilliam et al., 2013).
Il a été déjà mentionné que l’effet de l’ajout de biochar dans les sols dépend fortement du volume de biochar utilisé comme amendement, de la nature de la matière primaire utilisée pour le générer et de la nature du sol (Elmer et Pignatello, 2011; Gravel et al., 2013; Revell et al., 2012). Par conséquent, plusieurs tests préliminaires ainsi que des recherches
15
approfondies doivent être réalisés avant de pouvoir affirmer ou infirmer l’effet bénéfique de ce produit sur la symbiose entre légumineuse et microorganismes surtout qu’à nos connaissances ce volet n’a pas été encore abordé.
1.3. Hypothèse et objectifs
1.3.1. Hypothèse
Le présent projet de recherche vise à répondre à l’hypothèse suivante:
Le biochar favorise la survie, la croissance et l’activité des microorganismes bénéfiques (Ensifer meliloti, Rhizophagus irregularis) à la luzerne, il peut remplacer la tourbe comme support des microorganismes et il peut améliorer la lutte biologique par Bacillus subtilis contre les deux agents pathogènes Pythium ultimum et Fusarium oxysporum f.sp radicis
lycopersici (FORL).
1.3.2. Objectifs
Pour vérifier cette hypothèse, les objectifs de ce travail sont :
1- Déterminer l’effet de l’ajout de biochar à différentes doses sur la mycorhization et la nodulation de la luzerne inoculée avec R. irregularis et E. meliloti.
2- Comparer l’efficacité du biochar et de la tourbe en évaluant l’effet de biochar sur la croissance et la survie d’E. meliloti et de Bacillus subtilis.
3- Étudier l’effet de biochar combiné à un agent de lutte biologique Bacillus subtilis sur
Pythium ultimum et Fusarium oxysporum f.sp radicis lycopersici FORL; deux agents
16
Chapitre 2
-
Étude de l’effet de l’ajout de biochar sur la
colonisation mycorhizienne et la nodulation de la luzerne
inoculée avec Rhizophagus irregularis et Ensifer meliloti
Cette expérience vise à étudier l’effet de l'ajout de biochar à différentes doses sur la nodulation chez la luzerne inoculée avec Ensifer meliloti et sur la mycorhization avecRhizophagus irregularis.
2. Matériel et méthodes
2.1. Souches de rhizobiums et isolat mycorhizien utilisés
Pour notre étude, nous avons utilisé les souches A2 et S14 d’E. meliloti. Elles proviennent de
la collection du Centre de recherche et de développement sur les sols et les grandes cultures d’Agriculture et agroalimentaire Canada, Québec.
Avant de procéder à nos travaux avec les souches choisies, il était important de vérifier leur pureté. Pour ce faire, nous avons commencé par les inoculer sur le milieu à l’extrait de levure et au mannitol : Yeast Mannitol Agar (YMA) avec Rouge Congo (Annexe A), ce qui nous a permis par la suite d’isoler des colonies uniformes dont les caractéristiques morphologiques ont été confirmées par observation microscopique.
Des spores pures de Rhizophagus irregularis (Ri) DAOM 197198 nous ont été fournies gracieusement par Premier Tech, Rivière-du-Loup.
2.2. Les substrats
2.2.1. Biochar
Le biochar utilisé est de pH neutre, il provient de copeaux de pin dont la pyrolyse a été faite d’une manière rapide et continue à une température de 700 °C (Biochar Solutions Inc, Colorado, États Unis). Ce biochar a été tamisé à 2 mm, ses propriétés physicochimiques sont présentées dans le tableau 2.1.
17
Tableau 2.1: Propriétés physico-chimiques du biochar *.
Cendre (%) 8,4 pH 7 CE (mS cm-1) 1,62 C org (%) 76 C inorg (%) 0,45 H/C 0,48 Ntotal (%) 0,45
Masse volumique apparente (g cm-3) 0,08
Ptotal (%) 0,37
Ktotal (%) 20
*Valeurs pour un biochar sec (Taux d'humidité: 12,7 %) ; Source : Soil Control Lab (Watsonville, CA). Masse volumique apparente mesurée au laboratoire de Martine DORAIS, Agriculture et Agroalimentraire Canada, CRIV, Université Laval, Québec, Canada.
2.2.2. Sol
Il s’agit d’un sol prélevé sur le terrain de l’Université Laval en mai 2013. C’est un sol de jachère (loam pH 7; 4,35 % matière organique) qui a été séché, tamisé à 6 mm et mélangé avec de la perlite à raison de 20 % (v/v).
2.3. La luzerne
La variété de luzerne (Medicago sativa L.) utilisée dans cette expérience est la Calypso. C’est la variété recommandée par le Centre de Référence en Agriculture et Agroalimentaire du Québec (CRAAQ) en 2013. Avant le semis, les graines de luzerne utilisées ont été stérilisées en surface (Annexe B) et pré-germées sur de l’eau gélosée à 1,5 % (p/v) pendant une nuit à l’obscurité et à température ambiante.
18
2.4. Préparation de l’inoculum d’Ensifer meliloti
Pour obtenir un inoculum destiné à inoculer les graines de luzerne avec les souches de
Rhizobium, le milieu de base utilisé est le milieu à l’extrait de levure et au mannitol : Yeast
mannitol broth (YMB), décrit à l’annexe A.
Nous avons commencé par la préparation d’une pré-culture jeune de la souche A2 ou S14
d’Ensifer meliloti. En effet, dans une fiole Erlenmeyer de 250 ml, 50 ml du milieu YMB ont été déposés stérilement. Par la suite, nous avons ensemencé les 50 ml du milieu liquide avec une anse à partir d’une culture de Rhizobium, sur milieu gélosé YMA où les souches ont été repiquées puis incubées 3 jours à 28 °C. La culture a été faite à 28 °C sous agitation constante à 200 rpm pendant 3 jours.
2.4.1. Cultures de Rhizobium en Erlenmeyer
Un volume de 50 µl de la pré-culture de la souche A2 ou S14 d’Ensifer meliloti a été
transféré dans des Erlenmeyers de 250 ml contenant chacune 50 ml de milieu YMB stérile et nous les avons incubés à 28 °C sous agitation à 200 rpm pendant 3 jours jusqu’à l’obtention d’une suspension bactérienne ayant une densité optique (DO600 nm ) variant entre
0,8 et 1,0 ce qui est équivalent à 66,9 et 74,76 x106 UFC ml-1 pour A
2 et S14 respectivement.
Nous avons prélevé ensuite les 50 ml de cellules, que l’on a lavés 2 fois dans une solution saline stérile NaCl 0,85 %. Pour ce faire, nous les avons centrifugés dans des tubes Falcon stériles de 50 ml contenant chacun 25 ml de cellules. La centrifugation a été faite pendant 5 minutes à 16125 g à 4 °C (Sorval Legend XTR. Rotor F14- 6X 250 LE). Les cellules ainsi prélevées sont ensuite diluées pour produire un inoculum contenant 107 cellules par ml
selon des mesures de DO600 nm.
2.5. Dispositif expérimental
L’expérience a eu lieu dans une chambre de croissance située au Centre de recherche en innovation sur les végétaux (CRIV) de l’Université Laval où les plants étaient soumis à une photopériode de 16 heures avec une température de 20 °C le jour et 15 °C la nuit, une humidité de 70 % et une luminosité de 470 µmol m-2 s-1.
19
L’expérience a été réalisée selon un dispositif en blocs complets aléatoires avec 5 répétitions dans des pots de 1 litre (13 cm de diamètre et 11,5 cm de hauteur) contenant le sol amendé ou pas en biochar (15 ou 30 %, v/v). Les différents mélanges ont été incubés pendant une semaine puis chaque pot a reçu 800 spores de R. irregularis DAOM 197198 et 10 graines de luzerne ont été inoculées avec 5 ml d’une suspension bactérienne de 6,69 x107 et 7,47 x107 UFC ml-1 de la souche A
2 et S14 respectivement (Tableau 2.2). Les pots
ont été arrosés une fois par semaine avec une solution nutritive sans azote et avec de l’eau distillée au cours de la semaine. La solution nutritive contenait par litre: 1 ml de K2HP04, 1
ml de KH2P04, 1 ml de citrate de fer, 2 ml de MgSO4 7H2O, 1 ml de CaCl2 et 1 ml d’une
solution d’oligoéléments de Hoagland (Annexe C). Après 16 semaines de croissance (10 % de floraison), la luzerne a été récoltée pour déterminer les masses fraîche et sèche (séchage 3 jours à 60 °C) de la partie aérienne, l’indice de nodulation et le pourcentage de colonisation des racines par les mycorhizes (Annexe D).
Tableau 2.2: Dispositif expérimental de l’expérience de luzerne dans la chambre de croissance
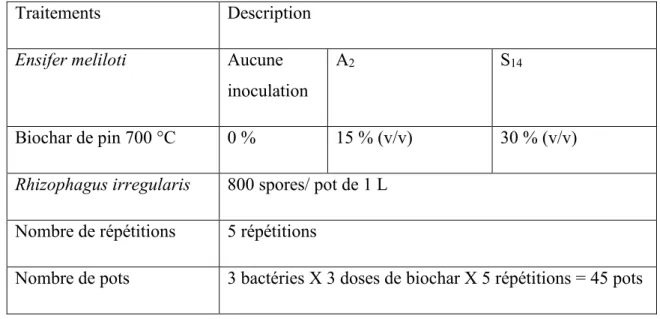
Traitements Description
Ensifer meliloti Aucune inoculation
A2 S14
Biochar de pin 700 °C 0 % 15 % (v/v) 30 % (v/v)
Rhizophagus irregularis 800 spores/ pot de 1 L Nombre de répétitions 5 répétitions
Nombre de pots 3 bactéries X 3 doses de biochar X 5 répétitions = 45 pots
2.6. Analyses statistiques
L’analyse de la variance (ANOVA) et les comparaisons multiples des résultats obtenus pour les masses fraîche et sèche de la partie aérienne, l’indice nodulaire et le pourcentage
20
de mycorhization des racines ont été effectués avec la version 9.1 de SAS (SAS Institute, Cary, NC). La normalité des données a été traitée à l’aide de la procédure Univariate et l’homogénéité de la variance des résultats a été vérifiée par l’analyse graphique des résidus. Les moyennes obtenues pour les différents traitements, ainsi que les différences statistiquement significatives (P<0,05 et P<0,1) ont été calculées (test de LSD – la plus petite différence significative).
3. Résultats
Les résultats ont montré que les différents paramètres mesurés sont affectés différemment par l’ajout ou non de biochar au sol et par la présence ou non des rhizobiums (Annexe E).
3.1. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la
mycorhization
En absence de biochar, les deux souches A2 et S14 d’E. meliloti ont augmenté
significativement le taux de colonisation des racines par les mycorhizes, de 81 % par rapport au témoin non inoculé. En présence de 15 % (v/v) de biochar, cette augmentation a été de 171 % par rapport au témoin non inoculé (Tableau 2.3).
Dans les traitements non inoculés avec E. meliloti, l’ajout de 30 % de biochar a doublé le % moyen de mycorhization des racines de luzerne par rapport au sol non amendé ou ayant reçu 15 % de biochar. Par contre, contrairement à ce que l’on a observé avec 15 % de biochar, l’inoculation avec les souches A2 et S14 n’a eu aucun effet significatif sur le % de
21
Tableau 2.3: Effet de l’inoculation des plants de luzerne (Medicago sativa L.) avec les souches A2 et S14 d’E. meliloti et les différents traitements de biochar sur la masse fraîche
et sèche des parties aériennes, la nodulation et le pourcentage de mycorhization.
Traitements Inoculum Biochar
(%; v/v)
Mycorhization (%)
Indice nodulaire Masse fraîche (g plant-1) Masse sèche (g plant-1) 0 % Témoin 17,75c 9,6b 11,10 3,72a A2 32,05b 7,6c 10,59 3,74a S14 32,11b 5,6c 10,38 3,64a 15 % Témoin 19,70c 12,0a 11,30 3,83a A2 53,70a 10,8b 11,31 3,77a S14 53,19a 10,0b 11,18 3,97a 30 % Témoin 38,58b 12,4a 9,54 3,07b A2 39b 14,4a 9,97 3,31b S14 27,96b 11,6b 9,75 3,28b
Les valeurs sont les moyennes de 5 répétitions. Dans chaque colonne, les moyennes suivies d’une lettre différente sont significativement différentes selon un test de LSD (P ≤ 0,05).
3.2. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la
nodulation
Les résultats ont montré que le processus de nodulation est affecté différemment par l’ajout ou non de biochar au sol et par la présence ou non des rhizobiums (Annexe E). En effet, nous avons enregistré une augmentation significative de 25 % et de 29,17 % de l’indice nodulaire dans les substrats non inoculés avec les rhizobiums et ayant été amendés avec 15 % et 30 % (v/v) de biochar respectivement (Tableau 2.3). De plus, l’indice de nodulation de la luzerne dans le substrat de sol sans ajout de biochar est significativement supérieur de 26,32 % et de 71,43 % à celui observé avec les traitements d’inoculation avec les souches d’E. meliloti A2 et S14 respectivement. L’indice de nodulation des luzernes semées dans les
substrats contenant 15 % (v/v) de biochar est significativement supérieur de 11,11 % et de 20 % à celui des substrats inoculés avec les souches d’E. meliloti A2 et S14 respectivement.
22
significativement réduit l’indice de nodulation de la luzerne par rapport aux deux autres traitements.
3.3. Effet de l’ajout de biochar et de l’inoculation avec E. meliloti sur la
masse fraîche et sèche des plants de luzerne
Selon les résultats de nos analyses, nous n’avons enregistré aucune différence significative entre les différents traitements pour la masse fraîche des parties aériennes (Annexe E). L’inoculation de la luzerne avec les souches A2 ou S14 n’a pas eu d’effet significatif sur les
rendements en masse sèche de la partie aérienne de luzerne (Tableau 2.3), suggérant ainsi la présence dans le sol témoin de souches efficaces d’E. meliloti. Il a été observé aussi qu’un amendement du sol avec 30 % (v/v) de biochar diminue la masse sèche de la partie aérienne de 17,5 % (P<0,05) par rapport au témoin sans biochar.
À noter que nous n’avons pas enregistré une interaction significative entre souches de
Rhizobium et dose de biochar appliquée (Annexe E).
4. Discussion
L’objectif principal de cette étude était de vérifier l’effet de l’ajout d’un type de biochar à trois doses (0 %, 15 % et 30 %; v/v) sur le rendement en matière aérienne sèche, le potentiel de colonisation des racines par Rhizophagus irregularis et l’indice nodulaire chez la luzerne plantée dans des substrats amendés on non en biochar et inoculés ou non par deux souches de Rhizobium.
Notre présente étude a réussi à montrer que les différents paramètres mesurés sont affectés différemment par l’ajout ou non de biochar à différentes doses au sol et par la présence ou non de Rhizobium.
4.1. Effet de l’ajout de biochar et des souches de Rhizobium sur la
mycorhization
23
Notre présente étude a démontré que le pourcentage de colonisation des racines de la luzerne par le champignon endomycorhizien Rhizophagus irregularis varie selon la dose de biochar ajoutée et selon la présence ou l’absence de Rhizobium.
L’évaluation de la mycorhization a été basée sur la détermination du nombre total des racines mycorhizées par rapport au total des racines examinées. Nous avons pu constater que la dose de 15 % (v/v) de biochar en présence de deux rhizobiums S14 et A2 a donné le
meilleur résultat. Des résultats similaires ont été observés par l’ajout de 10 % (v/v) de charbon de bois de noix de coco aux substrats d’une culture d’asperges (Matsubara et al., 2002). Ces auteurs ont enregistré une augmentation de la mycorhization des plants d’asperge.
Le biochar à 15 % (v/v) a réussi à stimuler la colonisation des racines par le champignon endomycorhizien ce qui peut être expliqué par le fait que cette dose de biochar affecte positivement la communauté microbienne bénéfique à la plante ce qui favorise la mycorhization (Warnock et al., 2007). Nous pouvons l’expliquer aussi par le fait que le biochar a fourni une niche de nutriments aux MA (Lehmann et al., 2011). À une dose plus importante (30 % v/v) et en présence d’inoculation bactérienne, le biochar semble avoir absorbé les signaux établis entre la plante et les microorganismes. En effet, selon Masiello et al. (2013), le biochar peut affecter les propriétés du sol par l’absorption des signaux cellulaires. Ceci nous laisse penser que dans notre cas, le biochar à une dose de 30 % (v/v) a causé une perturbation des signaux de communication entre plante-mycorhize-Rhizobium. Dans notre étude, une inoculation du substrat avec les souches d’E. meliloti en présence d’une dose de 15 % (v/v) de biochar a affecté positivement la colonisation mycorhizienne des racines de la plante. Ainsi, un effet de synergie entre Rhizophagus irregularis et les souches d’E. meliloti, favorisé par cette dose de biochar, peut être mis de l’avant.
Warnock et al. (2007) présentaient trois effets différents du biochar qui lui permettent d’affecter positivement la mycorhization: i) modification de la disponibilité des éléments nutritifs dans le sol. ii) stimulation de la population microbienne du sol qui favorise la colonisation racinaire par les mycorhizes et iii) perturbation des signaux chimiques ou