Modélisation électrophysiologique et biochimique
d’un neurone : CA1 cellule de l’hippocampe
Mémoire
Mazid Abiodoun OSSENI
Maitrise en Informatique Maître ès sciences (M.Sc.)
Québec, Canada
Résumé
Ce mémoire présente une nouvelle approche pour la réalisation de modèles biophysiques de neurone. Dans un premier temps, nous avons développé un modèle électrique compartimen-tal selon le formalisme de Hodgkin-Huxley avec le logiciel NEURON. En second lieu, nous avons procédé à la réalisation de la modélisation biochimique avec des systèmes d’équations différentielles représentant des réactions d’action de masse et des réactions enzymatiques. La modélisation biochimique se fait tant dans un modèle par compartiments avec des équa-tions différentielles ordinaires que dans un modèle spatial avec des équaéqua-tions différentielles partielles. VCell nous a permis de réaliser ce type de modélisation.
Le modèle hybride développé présente deux points de jonction entre les formalismes des mo-dèles électrique et biochimique pris indépendemment. Au premier point de jonction, les cou-rants calciques calculés avec les équations de type Hodgkin-Huxley sont convertis en concen-tration d’ions de calcium. Ce calcium est un messager secondaire pour de nombreuses voies de signalisation cellulaire. Une élévation de la concentration de calcium modifie la dynamique des réactions biochimiques. Le deuxième point de jonction est l’impact de l’activité de kinases sur les propriétés électriques de canaux ioniques. Par la phosphorylation, certaines kinases viennent moduler la réponse électrique du neurone. En intégrant tous ces effets biophysiques et biochimiques dans une même méthodologie de modélisation, nous pouvons modéliser des processus cellulaires complexes dans les neurones.
Le cross-talk synaptique est un phénomène physiologique observé, qui consiste en une aug-mentation de l’excitabilité membranaire suite à l’interaction entre les signaux électrique et biochimique et une communication entre les épines dendritiques du neurone. Cette interaction représente un excellent cas d’étude pour développer et valider notre méthodologie. Cette mé-thodologie porte sur l’interaction entre le calcium, la MAPK et les canaux KV4.2. Le calcium vient activer la MAPK par l’intermédiaire de différentes molécules. La MAPK vient ensuite phosphoryler les canaux KV4.2 qui sont possiblement responsables d’une augmentation ob-servée de l’excitabilité membranaire.
Abstract
This master’s thesis presents a new modeling technique for biophysical models of individual neurons that integrates their electrical and biochemical behaviors. First of all, we developped an electrical compartmental model. This model is based on the Hodgkin-Huxley formalism and developped in NEURON, a modeling software tool for neuroscience. Then, we developped a biochemical model. This second model is a system of differential equations based on mass action reations and enzymatic reactions. We implemented two versions of this model, one as a compartmental model with ordinary differential equations (ODE) and the other as a spatial model with partial differential equations (PDE). We used the software tool VCell for the biochemical modeling.
The hybrid model combining the electrical and biochemical behaviors has two connection points between the electrical and biochemical models. At the first junction, the calcium curents calculated by the Hodgkin-Huxley equations are converted into a concentration of calcium ions. This calcium is a secondary messenger for numerous cellular signaling pathways and a rise of the calcium concentration modifies the biochemical reaction dynamic. The second junction is the kinases activity on the ionic channel electrical properties. Through phosphorylation, the kinases modulate the electrical response of the neuron. By integrating all these biophysical and biochemical effects in the same methodology, we can build a complex cellular process models.
The synaptic crosstalk is a physiological event which leads to a local increase of the membrane excitability that is due to the interaction between electrical and biochemical signals. This interaction represents an excellent case study for the development and the validation of our methodology. Our model includes the regulation of calcium, MAPK the channel KV4.2.
Table des matières
Résumé iii
Abstract v
Table des matières vii
Liste des tableaux ix
Liste des figures xi
Remerciements xvii
Introduction 1
I Matériels et méthodes 3
1 Modélisation Neuronale : modèle de Hodgkin-Huxley 5
1.1 Système nerveux, neurones et modélisation . . . 6
1.2 Modèle de Hodgkin et Huxley . . . 12
1.3 Conversion du courant calcique en concentration ionique (𝐼𝐶𝑎 à [𝐶𝑎2+]) . . 23
1.4 Logiciel NEURON . . . 24
2 Modélisation de la signalisation cellulaire (Compartimentale et 3D) 29 2.1 Réseaux de signalisation . . . 30
2.2 Modélisation compartimentale. . . 30
2.3 Théorie chimique des réseaux de signalisation . . . 33
2.4 Virtual Cell . . . 37 3 Modélisation hybride 43 3.1 Modèle de Yu . . . 44 3.2 Modèle de Loew . . . 45 3.3 Modèle de Bhalla . . . 46 II Résultats 49 4 Modèle électrique 51 4.1 Morphologie du neurone . . . 52
4.2 Description des mécanismes bio-electriques . . . 53
4.3 Protocoles de simulation . . . 56
5 Modèle biochimique de l’activation de la voie de signalisation de RAS et de la MAPK par le calcium 65 5.1 Protéine RAS . . . 66
5.2 Modèle Compartimental . . . 67
5.3 Modèle Spatial . . . 72
5.4 Prédictions du modèle . . . 73
6 Modèle hybride 83 6.1 Conversion des données d’un environnement à l’autre(Vcell à NEURON) . . 84
6.2 Résultats comparatifs . . . 84
6.3 Canaux potassiques KV4.2 . . . 90
Discussion 103
Conclusion 107
A Annexe : Équations et Paramètres 109
Liste des tableaux
1.1 Unités de NEURON (Hines & Carnevale, 2001) . . . 27
2.1 Liste non-exhaustive des bases de données contenant des informations sur les réseaux de signalisations (Neves & Iyengar, 2002) . . . 32
2.2 Liste non-exhaustive des outils de modélisations biochimiques (Loew & Schaff, 2001) . . . 37
2.3 Modélisation par compartiments VS modélisation spatiale avec Virtual Cell . . 38
2.4 Unités de VCell . . . 41
4.1 Caractéristiques des canaux implémentés . . . 54
4.2 Tableau récapitulatif des comportements des neurones . . . 56
4.3 Résultats du modèle . . . 57
6.1 Conversion des unités d’un logiciel à l’autre 𝑁𝐴, le nombre d’Avogadro 6,022 141 29(27)×1023 molécules/mol. surface, l’aire en 𝜇𝑚2. . . . . 84
6.2 Valeurs moyennes des paramètres utilisées pour l’équation de Boltzmann (Schra-der et al. , 2006) . . . 92
Liste des figures
1.1 Structure typique d’un neurone . . . 6 1.2 Connectivité de deux neurones (Touzet, 1992) . . . 7 1.3 Mode d’action des neurotransmetteurs dans la conversion du signal (Lodish
et al. , 2000) . . . 8
1.4 Diffusion du courant dans une coupe longitudinale d’un neurone . . . 11 1.5 Les dendrites (A) sont représentés par des câbles (B) qui sont représentés par
des circuits électriques (C)(Bower & Beeman, 2012) . . . 12 1.6 Potentiel d’action
1- Na canaux ouverts et afflux de 𝑁 𝑎+ dans le neuron
2- Entrée massive de 𝑁 𝑎+
3- Canaux Na saturés
4- Ouverture et Sortie de 𝐾+ de la membrane vers l’extérieur
5- Fermeture des canaux K et réouverture progressive des canaux Na : hyper-polarisation
6- Retour au potentiel membranaire
. . . 13 1.7 Observation directe du potentiel d’action au niveau de la membrane (Cole &
Curtis, 1939) . . . 14 1.8 Première équivalence réalisée par Hodgkin et Huxley pour un court segment
de l’axone du calmar géant. Les résistances variables (𝐺𝑁𝑎, 𝐺𝐾 et 𝐺𝐿)
repré-sentent les conductances tensio-dépendantes(Bower & Beeman, 2012). . . 15 1.9 Variations de la conductance des canaux K dans le calmar géant (Hodgkin &
Huxley, 1952c) . . . 20 1.10 Meilleures courbes de fitting de 𝐺𝑘 = 𝑔𝑘 ⋅ 𝑛𝑝 (𝑝 ∈ [1, 2, 3, 4]) (Hodgkin &
Huxley, 1952c) . . . 21 1.11 Mode d’utilisation de NEURON . . . 26 2.1 Représentation simplifiée de la voie de la MAPK(SJTUBioX, n.d.)
où, NMDAR est un recepteur laissant passer le calcium, RAS-GTP, RAS-GDP, RASGRF1, RAF, MEK et ERK des molécules de la voie de signalisation. Nous
y reviendrons plus en détail dans le chapitre 5. . . 31 2.2 Diagramme de création d’un modèle computationnel(Neves & Iyengar, 2002) . 33 2.3 Développement d’un modèle cinétique à compartiments (Neves, 2011) . . . 38 2.4 Organisation de VCell (Loew & Schaff, 2001) . . . 39 2.5 Développement d’un modèle cinétique spatial (Neves, 2011) . . . 40
3.1 Interactions entre les conductances membranaires (courant) et les composantes
bichimiques (protéines) (Yu et al. , 2004) . . . 45
3.2 Schéma représentatif du modèle électrique et des interations entre le modèle chimique et le modèle électrique (Bhalla, 2011) . . . 47
4.1 Anatomie de l’hippocampe (Moser, 2011) . . . 52
4.2 Représentation de la structure physique du modèle (pas à l’échelle) . . . 53
4.3 Réponse électrique du modèle lors d’injection de courant . . . 57
4.4 Comportements électriques du modèle de Bhalla lors de l’injection de courant (Bhalla, 2011). . . 58
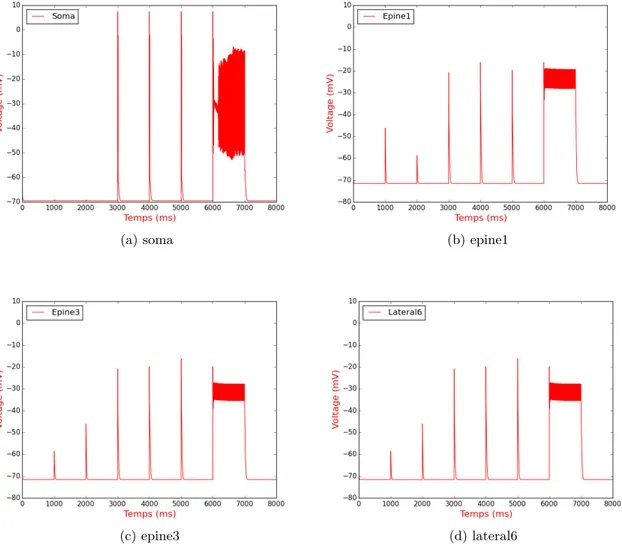
4.5 Réponse électrique du modèle lors de stimulation synaptique à quatre compar-timents Stim1 (à 1000 ms) : Sur l’Épine1 uniquement. Stim2 (à 2000 ms) : Sur l’Épine2 uniquement. Stim3 (à 3000 ms) : Sur tous les Dendrites uniquement. Stim4 (à 4000 ms) : Sur l’Épine1 + Dendrites. Stim5 (à 5000 ms) : Sur l’Épine2 + Dendrites. Stim6 (à 6000 ms) : Tétanique sur l’Épine1 + Dendrites. (1000 millisecondes de stimulations répétées à une fréquence de 100 Hz) . . . 59
4.6 Réponse électrique du modèle de Bhalla lors de la stimulation synaptique (Bhalla, 2011). . . 60
4.7 Concentration de calcium dans le modèle. Le protocole de stimulation est le même que celui de la figure 4.5 . . . 61
4.8 Concentration de calcium dans quatre compartiments du modèle de Bhalla en réponse à un protocole de stimulation synaptique (Bhalla, 2011) . . . 62
4.9 Activité électrique du modèle suite au stimulus synaptique de 30 pulses à une fréquence de 0.5 Hz . . . 62
4.10 Concentration de calcium dans le modèle suite au stimulus synaptique de 30 pulses à une fréquence de 0.5 Hz . . . 63
4.11 Concentration de calcium dans l’épine 1 résultant d’une stimulation synaptique 63 4.12 Concentration de calcium expérimentale lors de la stimulation par libération de glutamate d’une épine dendritique d’un neurone de type CA1. (En noir, concentration dans l’épine, en bleu, concentration dans le dendrite sous-jacent) (Harvey et al. , 2008) . . . 64
5.1 Activation/Désactivation de RAS (Lodish et al. , 2000) . . . 67
5.2 Comportement du calcium dans le temps pendant 1s. Couleur Bleue : Données brutes tirées de NEURON. Couleur Verte : Courbe de fitting utilisée dans Virtual Cell. . . 68
5.3 Schéma des réactions biochimiques pour le modèle compartimental . . . 72
5.4 Schéma des réactions biochimiques pour le modèle spatial . . . 73
5.5 Géométrie du modèle Spatial dans VCell. . . 74
5.6 Concentration de RAS dans le temps et l’espace suite à la stimulation électrique du protocole de (Harvey et al. , 2008) . . . 75
5.7 Comportement de la GEF en fonction du temps . . . 76
5.8 Comportement de la GEF en fonction du temps dans VCell suite à nos simulations 77 5.9 Diffusion de RAS dans un segment dedritique contenant des épines à différents t (0,60s,120s,360s,600s) . . . 79
5.10 Activité spatiale de RAS dans le modèle de Harvey et al. (2008)
A) Vue microscopique du déplacement de RASGTP visualisé avec une sonde fluorescente suite à ls stimulation à t = 0 (point blanc)
B) Le déplacement spatiale de RASGTP à différents moments temporels : t = -1 min, [RASGTP] ≃ 0.05
t = 2 mins, [RASGTP] ≃ 0.22 t = 4 mins, [RASGTP] ≃ 0.17
t = 7 mins, [RASGTP] ≃ 0.08 . . . 80 5.11 Activité spatiale de RAS dans le présent modèle développé dans VCell . . . 81 6.1 Nouvelle géométrie . . . 85 6.2 Activation de RAS dans 8 compartiments du modèle simulé avec les logiciels
NEURON et VCell . . . 87 6.3 Activation de RAF dans 8 compartiments du modèle simulé avec les logiciels
NEURON et VCell . . . 88 6.4 Activation de MEK dans 8 compartiments du modèle simulé avec les logiciels
NEURON et VCell . . . 89 6.5 Activation de MAPK dans 8 compartiments du modèle simulé avec les logiciels
NEURON et VCell . . . 90 6.6 Interaction MAPK-KV4.2 . . . 91 6.7 Activation de KV42P dans 3 compartiments du modèle simulé avec les logiciels
NEURON et VCell . . . 94 6.8 Élévation de la concentration de calcium, de la réponse électrique et activation
de RAS dans l’épine dendritique 1 suite au protocole 1 de stimulation synaptique 97 6.9 Élévation de la concentration de calcium, de la réponse électrique et activation
de RAS dans l’épine dendritique 1 suite au protocole 2 de stimulation synaptique 98 6.10 Élévation de la concentration de calcium, de la réponse électrique et activation
de RAS dans l’épine dendritique 7 suite au protocole 2 de stimulation synaptique. 99 6.11 Élévation de la concentration de calcium, de la réponse électrique et activation
de RAS dans l’épine dendritique 1 suite au protocole 1 de stimulation
synap-tique lors de la fixation du % (34/66) de phosphorylation des canaux KV4.2 . . 100 6.12 Courant potassique 𝐼𝑘 d’une stimulation dans les épines 1 et 7 suite aux
pro-tocoles 1 et 2 respectivement . . . 101 6.13 Voltage de la soma en absence et en présence de canaux KV42 phosphorylés . . 102
Learn from yesterday, live for today, hope for tomorrow. The important thing is not to stop questioning.
Remerciements
Plusieurs personnes ont contribué à la réalisation de ma maîtrise.
Je tiens à remercier particulièrement mes parents, mon frère et ma soeur pour le soutien constant aussi bien sur le plan psychologique, morale que financier. Merci du fond du coeur. Je tiens à remercier mes amis aussi qui m’ont apporté leur soutien dans la réalisation de ce travail.
Je voudrais grandement remercier mon directeur de recherche Simon Hardy, Ph.D., ing. qui m’a accueilli dans son laboratoire et qui ma supporter tout au long de mon projet. Je souhaite aussi remercier Dr Nicolas Doyon pour sa codi-rection et ses connaissances en modélisation dans le logiciel NEURON.
Introduction
La biologie computationnelle implique le développement et l’application de l’analyse des don-nées, des méthodes théoriques, des modèles mathématiques et des techniques de simulations computationnelles afin de procéder à des études biologiques et comportementales des systèmes. La neuroscience computationnelle, une science dérivée, permet d’analyser les données sur le cerveau dans le but d’étudier des aspects spécifiques du système neurobiologique. Plusieurs modèles sont ainsi réalisés à différentes échelles du général, cerveau en entier, au moindre détail cellulaire. Pour implémenter ces modèles, plusieurs environnements de modélisation sont développés chacun couvrant une variété de processus physiques et biochimiques. Chacun de ces environnements présente donc des avantages/inconvénients en fonction du problème à étudier. En effet, la communauté de la biologie des systèmes a développé de nombreux outils et méthodes permettant la représentation numérique des processus intracellulaires. Il existe 2 grandes catégories de simulations : les simulations stochastiques et les simulations déterministiques. Les simulations stochastiques sont appropriées pour les cas où le nombre de molécules, dans la région d’intérêt, est très faible ou pour les cas où la structure physique est très petite. MCell (Stiles et al. , 2001) ou Smoldyn (Andrews et al. , 2010) permettent de réaliser de telles simulations. Les simulations compartimentales sont dérivées de ce type de simulation (simulations stochastiques). Cependant, en présence d’un grand nombre de molécules et de la nécessité de mouvement pour provoquer une quelconque activité, les simu-lations déterministiques interviennent. Il existe des logiciels capable de supporter ces 2 types d’activité (stochastique et déterministique) : Virtual Cell (Schaff et al. , 1997) ou STEPS (Wils & De Schutter,2009) en sont quelques représentants. La structure complexe des neu-rones présente des caractéristiques qui font intervenir à la fois des prorpriétés stochastiques et déterministiques. Il faudrait donc prendre en compte ces 2 types de caractéristiques. Les neurones présentent la particularité de combiner une activité électrique et une activi-té biochimique simultanément. La signalisation électrique et la signalisation biochimique ne coexistent pas seulement : elles sont intimements liées l’une à l’autre (Blackwell, 2005). Les potentiels membranaires, base de l’activité électrique, sont créés et maintenus grâce aux mou-vements des ions à travers les canaux ioniques et les pompes. Ces derniers sont quant à eux, modulés par la signalisation biochimique intra et extra cellullaire. Ces agents biochimiques de modulation sont eux-mêmes générés par les processus membranaires découlant de
l’acti-vité électrique de la membrane (De Schutter,2008). Plusieurs expériences sont entrain d’être développées pour explorer la combinaison des 2 dynamiques biochimiques et électriques si-multanément. Cependant ce problème présente plusieurs difficultés : l’activité électrique du neurone implique la cellule en entier et est de l’ordre de la nano/milliseconde, tandis que l’activité biochimique est plus souvent localisée dans une petite région de la cellule et est de l’ordre de la seconde/minute. Combiner ces deux types d’activité dans un seul modèle pose des défis méthodologiques, tant mathématiques, informatiques que biologiques. Néanmoins le développement de nouveaux procédés, aussi bien au niveau expérimental qu’au niveau com-putationnel, comme dans ce cas présent, permet d’aboutir à l’obtention de modèles à plusieurs échelles nous permettant par exemple de connecter les causes pharmaceutiques (traitements chimiques) aux conséquences cliniques du traitement des maladies neurologiques, s’exprimant au niveau neuronal (Lytton,1996) (Ferrante et al.,2008).
Dans le même ordre d’idées que les différentes tentatives de solutions énoncées plus haut, ce travail a été réalisé dans l’objectif d’apporter un élément de réponse à la réalisation de ce genre de modèle combinant à la fois les activités électriques et biochimiques d’un neurone. Le neurone modélisé ici est le neurone CA1 de l’hippocampe (Migliore et al.,2005) (Migliore et al. ,2006) et la voie de signalisation modelisée est celle de RAS/MAPK activée par le calcium (Bhalla & Iyengar, 1999) (Schrader et al. , 2006). Cette dernière (la voie de Ras/MAPK) viendrait à son tour activer un canal KV4.2 responsable de la baisse de sensibilité des neurones d’après certaines études scientifiques (Adams et al. ,2000) (Schrader et al. ,2006).
La réalisation d’un tel modèle s’est déroulée en 3 parties :
I. la réalisation d’un modèle compartimental représentant l’activité électrique du neurone, à l’aide de Neuron (Hines & Carnevale,1997), un logiciel de modélisation
II. la réalisation d’un modèle spatial représentant l’activité biochimique du neurone, à l’aide de Virtual Cell (ou VCell) (Schaff et al. ,1997), un logiciel de modélisation et enfin III. la combinaison des 2 précédents modèles dans un seul combinant les activités électriques
et biochimiques du neurone dans Neuron (Hines & Carnevale,1997)
Dans la partie I, nous présenterons les notions importantes à la réalisation des différents modèles électriques et biochimiques. Dans la partie II, les résultats ainsi que les protocoles de simulations des différents modèles seront présentés. Nous finirons par une discussion sur le travail réalisé.
Première partie
Chapitre 1
Modélisation Neuronale : modèle de
Hodgkin-Huxley
L’activité électrique des neurones est un processus complexe qui obéit à des lois strictes. Plusieurs éléments sont impliqués dans la bonne réalisation de ce phénomène. Les équations mathématiques sont utilisées pour modéliser ces évènements. Il existe différents modes ou formalismes de réalisation de modeèles neuronaux. Dans ce travail, le formalisme utilisé est celui de Hodgkin-Huxley. Dans les lignes qui suivent, nous arboderont en détail les différents aspects de la modélisation neuronale.
1.1
Système nerveux, neurones et modélisation
1.1.1 Système nerveux et neurones
Le système nerveux est un système biologique animal responsable de la coordination des actions avec l’environnement extérieur et de la communication rapide entre les différentes parties du corps. Chez les vertébrés, on distingue le système nerveux central (encéphale et moelle épinière) du système nerveux périphérique (nerfs et ganglions). À l’échelle cellulaire, le système nerveux est défini par la présence de cellules hautement spécialisées appelées neu-rones, qui ont la capacité, très particulière, de véhiculer un signal électrochimique. En outre, le système nerveux contient des cellules de support appelées cellules gliales, qui apportent un soutien structurel, métabolique et fonctionnel aux neurones. Les neurones communiquent entre eux via les potentiels d’actions. Un potentiel d’action (P.A) est une dépolarisation tran-sitoire se propageant le long de la membrane plasmique. Son déclenchement respecte certaines conditions comme le dépassement d’un seuil et l’implication de plusieurs canaux ioniques. La propagation se fait dans un seul sens, de la soma aux terminaisons axonales. La figure 1.1 présente une structure de base d’un neurone et le sens de propagation de l’influx nerveux.
Figure 1.1 – Structure typique d’un neurone
d’une membrane plasmique, de ramifications ou dendrites (pour les connections avec les autres neurones), d’un axone (de longueur variable pouvant aller du millimètres à toute la longeur du corps ; exemple : le nerf sciatique ) et pour finir des terminaisons axonales (Figure 1.1). Les neurones sont connectés via les synapses (Figure 1.2). Selon Wikipédia, la synapse (du grec syn = ensemble et haptein = toucher, saisir ; signifiant connexion) désigne une zone de contact fonctionnelle qui s’établit entre deux neurones, ou entre un neurone et une autre cellule (cellules musculaires, récepteurs sensoriels ...). Elle assure la conversion d’un potentiel d’action déclenché dans le neurone présynaptique en un signal dans la cellule postsynaptique. On estime, pour certains types cellulaires (par exemple les cellules pyramidales et les cellules de Purkinje entre autres), qu’environ 40 % de la surface membranaire est couverte de synapses. On distingue habituellement deux types de synapses :
— la synapse chimique, très majoritaire, qui utilise des neurotransmetteurs pour trans-mettre l’information et
— la synapse électrique où le signal est transmis électriquement par l’intermédiaire d’une jonction communicante (en anglais gap-junction).
Figure 1.2 – Connectivité de deux neurones (Touzet,1992)
La structure physique des neurones n’est pas uniforme. Il existe plusieurs excroissances de la membrane des dendrites des neurones dont le volume est en moyenne d’environ 0,05 𝜇𝑚3
com-munément appelées les épines dendritiques. Ces dernières reçoivent les contacts synaptiques des axones des neurones présynaptiques. Contrairement à l’idée recue, elles ne sont pas des structures stables et présentent différentes formes. Elles sont en constantes re-modélistaion (Bonhoeffer & Yuste, 2002). L’information électrique provenant du neurone pré-synaptique (Figure1.2A) est tranformée en information chimique, les neurotransmetteurs qui s’occupent de transmettre le signal au neurone post-synaptique (Figure1.2B). Les neurotransmetteurs, ou neuromédiateurs, sont des composés chimiques libérés par les neurones (et parfois par les
cellules gliales) agissant sur d’autres neurones ou, plus rarement, sur d’autres types de cel-lules (comme les celcel-lules musculaires et les celcel-lules gliales comme les astrocytes) (Graybiel, 1990) (Lauder,1993). Les neurotransmetteurs sont stockés au niveau de l’élément présynap-tique dans des vésicules. Le contenu de ces vésicules est libéré (de 1000 à 2000 molécules en moyenne) dans l’espace synaptique au moment de l’arrivée d’un potentiel d’action. La figure 1.3présente le mode d’action de la conversion du signal électrique en signal chimique à l’aide des neurotransmetteurs. L’arrivée du potentiel d’action au niveau du neurone pré-synaptique provoque l’entrée de calcium dans ce dernier et la fusion des vésicules à la membrane. Les neurotransmetteurs sont expulsés et viennent se lier à leurs récepteurs spécifiques au niveau du neurone post-synaptique. Cette liaison provoque l’entrée d’ions et dépolarise la membrane de ce dernier : le signal électrique est retrouvé.
MBC 11-35 Canal"à"Ca2+" voltage= dépendant" Fermé" Terminaison" présynapDque" Fente" "synapDque" Vésicules" synapDques" neurotransmeLeurs" Terminaison"
nerveuse"au"repos" nerveuse"acDvée"Terminaison" Canal"à"Ca2+" voltage= dépendant" Ouvert" Récepteur"" postsynapDque" Cellule"" postsynapDque" PotenDel" d’acDon" " Exocytose"du"" neurotransmeLeur" Fusion"de"la" vésicule"synapDque" 20"
Figure 12-42 Essential Cell Biology (© Garland Science 2010) Terminaison"
nerveuse"acDvée" Synapse"acDve""
Récepteur"de" l’acétylcholine" NeurotransmeLeur"dans"
la"fente"synapDque"" NeurotransmeLeur"lié"au"récepteur"
Cellule" postsynapDque" Changement" dans"le" potenDel" électrique"de" la"membrane" TransformaDon"d’un"signal"chimique"en"signal"électrique" 22"
Figure 1.3 – Mode d’action des neurotransmetteurs dans la conversion du signal (Lodish
1.1.2 Modélisation
Les neurosciences désignent l’étude scientifique du système nerveux, tant du point de vue de sa structure que de son fonctionnement, depuis l’échelle moléculaire jusqu’au niveau des organes. Le terme neurosciences computationnelles a été introduit par le psychologue cognitif et neuroscientifique américain Eric L. Schwartz (Schwartz,1993) pour résumer l’état actuel d’un domaine qui jusque là avait différentes appelations telles que la modélisation de neurones, la théorie sur le cerveau et les réseaux neuronaux. Depuis lors, pas mal de chemin a été parcouru jusqu’à nos jours. La neuroscience computationnelle a plusieurs champs d’action. On distingue parmi ceux-ci :
— la Modélisation d’un neurone individuel : appartenant entre autres aux modèles neu-ronaux phénoménologiques à décharge dont le but est juste d’avoir une représentation sous forme de modèles d’un phénomène physiologique dans le neurone (Forrest, 2014). Le modèle biophysique de Hodgkin-Huxley appartient à cette catégorie, qui représente le centre d’intérêts de notre étude.
— le Développement et modelage des axones (Chklovskii et al. ,2004) — le Traitement sensoriel (Harth et al. ,1987)
— la Mémoire et plasticité synaptique, domaine intervenant aussi dans notre projet étant donné la présence de synapse dans notre modèle (Durstewitz et al. ,2000)
— les Comportements des réseaux (Anderson & Eliasmith,2004)
— la Cognition, la Discrimination et l’apprentissage (Robinson et al. ,2005) — la Conscience (Crick & Koch,2003)
Ces domaines permettent de réaliser à quel point cette science est vaste car elle touche plu-sieurs secteurs et différents aspects des neurones en particuliers et du cerveau en général.
Dans un premier temps, avant de vous introduire aux concepts de Hodgkin-Huxley, qui représentent les méthodes de modélisation utilisées dans notre modèle, il serait opportun de présenter les différents concepts existants et de présenter brièvement l’évolution et le mode de fonctionnement des concepts principaux. Historiquement, un des premiers modèles intro-duit en neurosciences computationnelles est le modèle Integrate and Fire par Louis Lapicque (Lapicque,1907). Le neurone est un corps cellulaire ayant la capacité de conduire le courant électrique pour transmettre l’information. Cette capacité est associée à la résistance de leur membrane et aux différents canaux ioniques existants permettant de changer le potentiel membranaire. Grâce à cette caractéristique, Louis Lapicque conceptualise un modèle repré-sentant le neurone par une fonction courant I dépendant du temps I(t).
𝐼(𝑡) = 𝐶𝑚×𝑑𝑉𝑚
où, I(t) représente le courant électrique, 𝐶𝑚 la capacitance de la membrane, 𝑉𝑚 le voltage de la membrane et 𝑡 le temps.
Cette équation représente juste la dérivée par rapport au temps de la loi d’Ohm :
𝑄 = 𝐶 × 𝑉 (1.2)
où, Q représente la charge électrique, V le voltage et C la capacitance.
Comme toutes avancées en sciences, ce modèle présentait des imperfections. Le princi-pal problème de celui-ci est qu’il ne comportait aucune mémoire temporelle, ce qui est non conforme au comportement normal des neurones. Ainsi une première amélioration a été ap-portée. Le modèle Leaky Integrate and Fire (Koch & Segev, 1998) est apparu. Ce dernier résout le problème de mémoire en insérant un terme de fuite au potentiel membranaire. Il est décrit par l’équation suivante :
𝐼(𝑡) −𝑑𝑉𝑚(𝑡)
𝑅𝑚 = 𝐶𝑚× 𝑑𝑉𝑚
𝑑𝑡 . (1.3)
Ce modèle permet d’introduire la notion de dépassement de seuil importante aux neurones. Ainsi il n’y aura aucun évènement dans le modèle tant que 𝐼(𝑡) ≤ 𝐼𝑡ℎ= 𝑉𝑡ℎ
𝑅𝑚. Il n’y aurait également aucun changement au niveau du potentiel membranaire. Par la suite une 3e
amélio-ration à ce type de modèle a été apportée. Il s’agit du modèle Exponential Integrate and Fire (Brette & Gerstner,2005) où la génération des piques de tensions (spike) est exponentielle :
𝑑𝑥
𝑑𝑡 = Δ𝑡⋅ 𝑒𝑥𝑝 ( 𝑥 − 𝑥𝑡
Δ𝑡 ) . (1.4)
En 1952, ce qui s’avère le modèle le plus réussi et le plus largement utilisé à nos jours, le modèle de Hodgkin et Huxley (Hodgkin & Huxley,1952b) est apparu. Ce modèle, à l’aide d’équations différentielles linéaires, explique les mécanismes ioniques à l’origine de l’initia-tion et de la propagal’initia-tion des potentiels dans l’axone du calmar géant. Contrairement aux trois modèles phénoménologiques présentés précédemment, le modèle d’Hogkin et Huxley est biophysique. Nous y reviendrons en détail dans les paragraphes suivants.
Lors de la réalisation d’un modèle détaillé de neurone, la convention veut que le neurone soit représenté par un nombre fini de compartiments cylindriques pour modéliser la propagation d’une modification du potentiel le long des dendrites et de l’axone du neurone. À n’importe quel point de la membrane cylindrique, le courant peut circuler de deux façons, soit à travers la membrane, soit longitudinalement. Le courant longitudinal 𝐼𝑖rencontre la résistance cyto-plasmique provoquant ainsi la dépolarisation membranaire. Ce courant est considéré positif (+) quand il évolue avec les valeurs grandissantes de x. La figure 1.4 présente une section longitudinale d’un neurone ainsi que la propagation du courant I.
Figure 1.4 – Diffusion du courant dans une coupe longitudinale d’un neurone
La résistance cytoplasmique est représentée par une résistance par unité de longueur sur l’axe des x, 𝑅𝑖. La loi d’Ohm (Équation1.2) permet d’obtenir :
1 𝑟𝑖 ⋅
𝑑𝑉
𝑑𝑥 = −𝐼𝑖. (1.5)
Le courant membranaire peut traverser la membrane via le potentiel de repos des canaux membranaires représenté par une résistance 𝑅𝑚 ou par la charge de la capacitance de la membrane 𝐶𝑚. Alors à une position x sur la membrane on a :
𝑑𝐼𝑖 𝑑𝑥 = −𝐼𝑚 = − ( 𝑉 𝑅𝑚 + 𝐶𝑚⋅ 𝑑𝑉 𝑑𝑡) . (1.6)
En combinant les équations1.5et1.6on obtient l’équation du câble, équation aux dérivées partielles d’ordre 2 (PDE) :
1 𝑟𝑖 ⋅ 𝜕2𝑉 𝜕𝑥2 = 𝐶𝑚⋅ 𝜕𝑉 𝜕𝑡 + 𝑉 𝑅𝑚. (1.7)
L’équation1.7représente le cas où il n’y a pas de courant supplémentaire qui est appliqué. Cependant les neurones sont toujours stimulés. Alors en présence d’un courant additionnel 𝐼𝑗 représentant le flot des ions du compartiment j à travers des canaux actifs, on obtient :
𝑙2 𝑅𝑎 ⋅ 𝜕2𝑉 𝑗 𝜕𝑥2 = 𝐶𝑚⋅ 𝜕𝑉𝑗 𝜕𝑡 + 𝑉𝑗 𝑅𝑚 + 𝐼𝑗. (1.8)
La modélisation compartimentale permet de remplacer l’équation continue et non linéaire du câble, par un ensemble d’équations différentielles ordinaires propre à chaque segment ou compartiment (Segev et al. ,1989). Chaque compartiment peut avoir des propriétés indépen-dantes et propres à lui. Ce dernier est modélisé en conséquence. La figure1.5montre le niveau d’abstraction permis grâce à la théorie des câbles.
Figure 1.5 – Les dendrites (A) sont représentés par des câbles (B) qui sont représentés par des circuits électriques (C)(Bower & Beeman,2012)
Les modèles présentés dans ce document, à moins d’indications contraires, sont représentés selon cette convention et avec les paramètres de Hodgkin-Huxley.
1.2
Modèle de Hodgkin et Huxley
Dans cette section, nous présenterons de façon détaillée, le modèle de Hodgkin et Huxley, des origines biologiques aux notions mathématiques.
1.2.1 Origines biologiques
Notre conception actuelle de la modélisation neuronale est largement influencée par les travaux de Hodgkin et Huxley. Ces derniers publièrent une série de 5 articles en 1952 (Hodg-kin & Huxley,1952a) (Hodgkin & Huxley, 1952b) (Hodgkin & Huxley, 1952c) (Hodgkin & Huxley,1952d) (Hodgkin et al.,1952) dans lesquels ils établirent les propriétés principales de la conduction ionique dans le potentiel d’action. Un potentiel d’action est une dépolarisation transitoire se propageant le long de la membrane plasmique. Pour qu’il ait lieu, il faut que la dépolarisation atteigne un seuil donné (Figure1.6). Pour ce travail remarquable, Hodgkin
et Huxley obtinrent en 1963, en compagnie de John Eccles (pour ses travaux sur les poten-tiels et les conductances dans les synapses des motoneurone), le prix Nobel en Physiologie et Médecine. Les 4 premiers articles de la série récapitulent les avancées extraordinaires (pour l’époque) dans les techniques expérimentales de caractérisation des propriétés membranaires des neurones. Le dernier papier présente l’analyse théorique basée sur les données expérimen-tales découlant des 4 précédents articles. Leur étude a pour support expérimental l’axone du calmar géant de 1 mm de diamètre. L’ordre de grandeur des axones est de l’ordre du micromètre habituellement d’où l’expression ‘géant’ au niveau de cet axone.
Figure 1.6 – Potentiel d’action
1- Na canaux ouverts et afflux de 𝑁 𝑎+ dans le neuron
2- Entrée massive de 𝑁 𝑎+
3- Canaux Na saturés
4- Ouverture et Sortie de 𝐾+ de la membrane vers l’extérieur
5- Fermeture des canaux K et réouverture progressive des canaux Na : hyperpolarisation 6- Retour au potentiel membranaire
Avant 1940, l’analogie du neurone à un circuit électrique était déjà vaguement établie : les notions de résistances membranaires, de capacitances électriques et de différences de poten-tiels électriques entre l’extérieur et l’intérieur de la cellule, étaient déjà associées aux neurones. Cependant aucune expérience ne permettait de mesurer directement le potentiel de la mem-brane. Cole & Curtis(1939) développèrent la première expérience confirmant le changement
du potentiel membranaire au cours du potentiel d’action. Leur étude vint corroborer une hypothèse préalablement établie par Bernstein (Bernstein,1902). Ils démontrèrent que le po-tentiel de repos membranaire est E=65 mV (Figure1.7). Bernstein avait émis l’hypothèse que cette valeur existe mais qu’elle est égale à 0. Il démontra aussi que la concentration d’ions potassiques est plus élevée dans le neurone que dans le cytoplasme ; la concentration d’ions sodium est plus élevée dans le cytoplasme que dans le neurone introduisant ainsi la notion de gradients pour expliquer la probable existence de différence de potentiel au niveau de la membrane. Les équations découlant de l’hypothèse de Berstein sont les suivantes :
[𝐾+ 𝑚] > [𝐾𝑐+] [𝑁 𝑎+ 𝑐] > [𝑁 𝑎+𝑚]. (1.9) où, [𝐾+
𝑚] est la concentration de 𝐾+membranaire (à l’extérieur), [𝐾𝑐+] la concentration de 𝐾+
cytoplasmique (à l’intérieur), [𝑁 𝑎+
𝑚] la concentration de 𝑁 𝑎+membranaire (à l’extérieur), et
[𝑁 𝑎+
𝑐] la concentration de 𝑁 𝑎+cytoplasmique (à l’intérieur). Ce déséquilibre de concentrations
(positif à l’extérieur et négatif à l’intérieur, dû au mouvement des ions de part et d’autre de la membrane) est à l’origine de la polarisation de la membrane et de l’existence du potentiel de repos. Les canaux sont continuellement entrain de maintenir ce déséquilibre crucial car les phénomènes de rafales permanentes ou d’absence de rafales ne sont pas désirés. Une rafale est une série de potentiels d’action successifs dans un interval de temps déterminé.
Figure 1.7 – Observation directe du potentiel d’action au niveau de la membrane (Cole & Curtis,1939)
En 1949, 2 techniques expérimentales pour analyser les changements qui ont lieu au cours des potentiels d’action sont développées : space clamp (Marmont,1949) et voltage clamp (Cole, 1949). La 1re consiste à maintenir une distribution spatiale uniforme de 𝑉
𝑚dans la région où
la mesure est effectuée. La 2e permet de maintenir 𝑉
𝑚à un voltage désiré. En 1949, Hodgkin
l’ion dont la perméabilité est dominante à la membrane. Cette dominance varie en fonction du temps. L’équation 1.10 de Nernst est une équation pour calculer le potentiel à l’équilibre entre diffusion et transport électrique.
𝐸𝑋= 𝑅 × 𝑇 𝑍 × 𝐹 𝑙𝑛 (
[𝑋]𝑒𝑥𝑡
[𝑋]𝑖𝑛𝑡) . (1.10)
R : constante des gaz parfaits T : température absolue en degrés Kelvin
Z : valence de l’ion
F : constante de Faraday, 96500 Coulombs/mole d’ion [𝑋]𝑒𝑥𝑡 = concentration extracellulaire de l’ion x
[𝑋]𝑖𝑛𝑡 = concentration intracellulaire de l’ion x
1.2.2 Modèle mathématique
Le modèle de Hodgkin-Huxley est basé sur le principe que les propriétés électriques des membranes des cellules nerveuses peuvent être modélisées par un circuit électrique équivalent (Figure 1.8). Le circuit électrique comporte 2 composantes principales : une composante re-présentant la capacitance de la membrane et une composante associée aux mouvements de chaque type d’ions. Dans le modèle original, le courant ionique est subdivisé en 3 catégories :
— le courant sodium 𝐼𝑁𝑎 — le courant potassique 𝐼𝐾 — le courant de fuite 𝐼𝐿
Figure 1.8 – Première équivalence réalisée par Hodgkin et Huxley pour un court segment de l’axone du calmar géant. Les résistances variables (𝐺𝑁𝑎, 𝐺𝐾 et 𝐺𝐿) représentent les conductances tensio-dépendantes(Bower & Beeman,2012)
Le circuit électrique de la figure1.8, est équivalent à l’équation différentielle suivante :
𝐶𝑚×𝑑𝑉𝑚
𝑑𝑡 + 𝐼𝑖𝑜𝑛 = 𝐼𝑒𝑥𝑡. (1.11)
où, 𝐶𝑚 est la capacitance membranaire, 𝑉𝑚 le voltage membranaire, 𝐼𝑖𝑜𝑛 les courants io-niques (𝐼𝑁𝑎, 𝐼𝐾 et 𝐼𝐿) comme nous le verrons à l’équation1.13et 𝐼𝑒𝑥𝑡 le courant extérieur appliqué.
En analysant l’équation1.11on peut déduire que 𝐼𝑖𝑜𝑛et 𝐼𝑒𝑥𝑡sont de signes opposés. Ainsi, un courant positif extérieur 𝐼𝑒𝑥𝑡 aura tendance à dépolariser la membrane c’est-à-dire rendre 𝑉𝑚 plus positif, tandis que un courant positif ionique 𝐼𝑖𝑜𝑛, aura tendance à hyperpolariser la membrane c’est à dire rendre 𝑉𝑚 plus négatif. Cette convention pour les courants ioniques est aussi connue sous le nom de courant intérieur négatif, signifiant que l’entrée d’ions positifs à l’intérieur de la cellule est équivalent à un courant négatif. La 2e convention concerne la
valeur du potentiel membranaire 𝑉𝑚. Le potentiel membranaire mesuré est une différence de potentiel entre 𝑉𝑒𝑥𝑡et 𝑉𝑖𝑛𝑡. Ces 2 conventions influencent le choix de fixation du potentiel de repos. Hodgkin et Huxley utilisent la convention qui fixe le potentiel de repos intracellulaire à zéro (𝑉𝑖𝑛𝑡 = 0). La convention contraire, celle utilisée dans la littérature, et dans notre projet, consiste à fixer le potentiel extracellulaire à zéro (𝑉𝑒𝑥𝑡 = 0). Ainsi, le potentiel de repos intracellulaire est autour de -70 mV. Dans les 2 cas, la différence de potentiel calculée, 𝑉𝑚= 𝑉𝑒𝑥𝑡− 𝑉𝑖𝑛𝑡 est la même quelque soit la convention utilisée. La 3e convention concerne
le signe du potentiel membranaire 𝑉𝑚. La convention moderne, celle adoptée dans cette étude, déclare que la dépolarisation rend 𝑉𝑚plus positif. Hodgkin et Huxley, quant à eux, utilisèrent l’exacte opposé : la dépolarisation rend 𝑉𝑚 plus négatif. D’un point de vue théorique, ces conventions n’ont aucun impact sur les modèles (Nelson & Rinzel,1998). Le problème se pose au niveau computationnel d’où la nécessité de les préciser ici en vue de ne pas faire d’erreurs potentielles.
1.2.3 Courants ioniques 1.2.3.1 Canaux ioniques
Un canal ionique est une protéine membranaire qui permet le passage à grande vitesse d’un ou de plusieurs ions. Il existe de nombreux types de canaux ioniques. Ils peuvent être sélectivement perméables à un ion tel que le sodium, le calcium, le potassium ou l’ion chlorure, ou bien à plusieurs ions à la fois. Les canaux ioniques sont présents dans la membrane de toutes les cellules. Ils ont un rôle central dans la physiologie des cellules excitables comme les neurones ou les cellules musculaires et cardiaques. On distingue plusieurs types de canaux ioniques selon le stimulus gouvernant leur ouverture. Deux groupes sont majoritaires :
— Voltage-dépendant ou tensiodépendant : leur ouverture dépend de la modification de la polarité membranaire (ex : canaux à sodium mis en jeux pour la propagation d’un
potentiel d’action. Figure1.6)
— Chimio-dépendant : il s’agit de la classe des récepteurs ionotropes, dont les membres s’ouvrent en présence d’un ligand. Ces canaux participent à la construction de la synapse chimique.
Le courant ionique total est la somme algébrique du courant généré par chaque ion : 𝐼𝑖𝑜𝑛= ∑ 𝐼𝑛
𝐼𝑖𝑜𝑛= ∑
𝑛
𝐺𝑛⋅ (𝑉𝑚− 𝐸𝑛). (1.12)
où, 𝐼𝑖𝑜𝑛 représente le courant ionique, 𝐼𝑛 le courant ionique du canal n, 𝐺𝑛 : la conductance du canal ionique de type n et 𝐸𝑛 le potentiel de repos du canal ionique de type n.
Chaque composante In a une conductance Gn qui lui est associée (la conductance est la réciproque de la résistance, Gn = 1/Rn) et un potentiel d’équilibre En (potentiel équivalent à Vm= 0 pour cet ion). Le courant est proportionnel à la conductance. Dans le modèle de base de l’axone du calmar géant, il y a 3 termes : le courant sodium INa, le courant potassium IK et le courant de fuite IL :
𝐼𝑖𝑜𝑛= 𝐺𝑁𝑎⋅ (𝑉𝑚− 𝐸𝑁𝑎) + 𝐺𝐾⋅ (𝑉𝑚− 𝐸𝐾) + 𝐺𝐿⋅ (𝑉𝑚− 𝐸𝐿). (1.13)
où, 𝐼𝑖𝑜𝑛 est le courant ionique, 𝐺𝑁𝑎la conductance du canal ionique calcium, 𝐺𝐾 la conduc-tance du canal ionique potassium, 𝐺𝐿 la conductance du canal de fuite, 𝐸𝑁𝑎 le potentiel de repos du canal ionique calcium, 𝐸𝐾 le potentiel de repos du canal ionique potassium et 𝐸𝐿 le potentiel de repos du canal de fuite.
À la base, Hodgkin et Huxley établirent le postulat que GNa et GK varient en fonction du voltage de la membrane. Mais les études ont par la suite démontré que ces valeurs sont reliées aux propriétés biophysiques de ces canaux. Et que chaque canal a des caractéristiques propres à la région du cerveau dans laquelle il est ; à l’espèce dans laquelle on l’étudie entre autres. Chaque canal est composé de plusieurs portes qui permettent la diffusion des ions à travers la membrane. Ces portes peuvent être dans 2 états possibles : perméable (permissif) ou non-perméable (non-permissif). Quand toutes ces portes sont dans un état non-perméable (permissif) les ions peuvent passés dans le canal et ce dernier est dit ouvert. Dans le cas contraire, il n’y a pas de diffusion d’ions et le canal est dit fermé. Si on considère des portes d’un type particuliers i, on peut définir la probabilité 𝑝𝑖 ∈ [0,1], représentant la probabilité d’une porte individuelle d’être dans l’état perméable (permissif). Si on considère une population de canaux, ce qui est souvent le cas, 𝑝𝑖 représente la fraction des portes dans cette population, qui sont dans l’état perméable (permissif) et (1 - 𝑝𝑖) représente la fraction dans l’état non-perméable (non-permissif). La transition entre ces 2 états est exprimée sous la forme d’une équation cinétique
du 1er ordre :
𝑑𝑝𝑖
𝑑𝑡 = 𝛼𝑖⋅ (1 − 𝑝𝑖) − 𝛽𝑖⋅ (𝑉 ) ⋅ 𝑝𝑖. (1.14) où, 𝛼𝑖représente la constante voltage dépendante décrivant la transition non-perméable à per-méable, 𝛽𝑖 constante voltage dépendante décrivant la transition perméable à non-perméable et 𝑝𝑖 probabilité de se trouver dans un état permissif ou non permissif.
Si Vm est fixé à une valeur donnée V, la fraction de portes dans l’état perméable peut atteindre un état stationnaire c’est-à-dire dpi/dt = 0 quand t→∞ :
𝑝𝑖,𝑡→∞(𝑉 ) = 𝛼𝑖(𝑉 ) 𝛼𝑖(𝑉 ) + 𝛽𝑖.(𝑉 ). (1.15) Démonstration : 𝑑𝑝𝑖 𝑑𝑡 = 0 𝛼 × (1 − 𝑝) − 𝛽 × (𝑝) = 0 𝛽 × (𝑝) = 𝛼 × (1 − 𝑝) 𝛽 × (𝑝) = 𝛼 − 𝛼 × (𝑝) 𝛽 × (𝑝) + 𝛼 × (𝑝) = 𝛼 𝑝 × (𝛼 + 𝛽) = 𝛼 𝑝 = 𝛼 (𝛼 + 𝛽).
La courbe du temps pour atteindre cette valeur d’équilibre est décrite par une simple expo-nentielle 𝜏i(V) :
𝜏𝑖(𝑉 ) = 1
𝛼𝑖(𝑉 ) + 𝛽𝑖(𝑉 ). (1.16) Un seul canal ouvert (implicitement toutes les portes dans l’état perméable) a une contribution fixe mais petite à la conductance totale ou aucune contribution dans le cas où il est fermé. La conductance globale assignée à chaque type de canal Gn, est donc proportionnelle, au nombre de canaux dans l’état ouvert qui eux sont proportionnels à la probabilité que les portes qui leurs sont associées sont dans l’état perméable. Gn est alors exprimée par l’équation suivante :
𝐺𝑛= 𝑔𝑛⋅ ∏
𝑖
⋅ 𝑝𝑖. (1.17)
où, 𝐺𝑛 représente la conductance maximale lorsque tous les canaux sont ouverts et 𝑔𝑛, la conductance maximale pour chaque canal.
Le modèle du calmar géant étudié par Hodgkin-Huxley, présente 2 canaux, la canal Na (sodium) et le canal K (potassium). Hodgkin-Huxley représentent le canal Na, avec trois
portes de type m et une porte de type h. Le canal K, est représenté avec quatre portes de types n. En intégrant toutes les équations générales précédentes on aboutit aux paramètres suivants, propres au modèle original de Hodgkin-Huxley :
𝐼𝑖𝑜𝑛 = 𝑔𝑁𝑎𝑚3ℎ(𝑉 𝑚− 𝐸𝑁𝑎) + 𝑔𝐾𝑛 4(𝑉 𝑚− 𝐸𝐾) + 𝑔𝐿(𝑉𝑚− 𝐸𝐿) 𝑑𝑚 𝑑𝑡 = 𝛼𝑚(𝑉 ) ⋅ (1 − 𝑚) − 𝛽𝑚(𝑉 )𝑚 𝑑ℎ 𝑑𝑡 = 𝛼ℎ(𝑉 ) ⋅ (1 − ℎ) − 𝛽ℎ(𝑉 )ℎ 𝑑𝑛 𝑑𝑡 = 𝛼𝑛(𝑉 ) ⋅ (1 − 𝑛) − 𝛽𝑛(𝑉 )𝑛. (1.18)
Il s’agit de faire le lien par la suite entre les taux de réactions et le voltage de la membrane pour avoir des taux dépendants du voltage membranaire.
1.2.3.2 Détermination des portes des canaux et des valeurs des variable
Comment Hodgkin-Huxley aboutissent aux paramètres m, n et h pour les canaux potas-sium et sodium ? Comment trouvent-ils les valeurs des paramètres alpha et beta ?
1.2.3.2.1 Canaux potassium 𝐾+
Pour obtenir les paramètres, Hodgkin-Huxley effectuent plusieurs expériences expérimen-tales. Ils enregistrent le voltage des canaux potassium à différentes valeurs Vc fixées comme le montre la figure 1.9 :
En analysant ces résultats, 2 tendances se dégagent. La 1re, la plus évidente, est que l’état
stationnaire de la conductance augmente en fonction de l’augmentation du voltage. La 2e, plus
subtile, est que la phase d’augmentation de la conductance devient plus rapide en augmentant la dépolarisation. Pour de petite dépolarisation de l’ordre de 20 mV, on atteint 𝑉𝑚𝑎𝑥/2 en 5 msec, tandis que pour de larges dépolarisations de l’ordre de 100 mV, 𝑉𝑚𝑎𝑥/2 est atteint en 2 msec. En intégrant ces données du canal potassium dans les équations préétablies, on obtient :
𝑑𝑛
𝑑𝑡 = 𝛼𝑛(𝑉 ) ⋅ (1 − 𝑛) − 𝛽𝑛(𝑉 )𝑛. (1.19) À l’état initial 𝑉𝑚 = 0, le potentiel de repos de la variable est exprimée comme suit :
𝑛∞(0) = 𝛼𝑛(0)
𝛼𝑛(0) + 𝛽𝑛(0). (1.20)
Lorsque Vm = Vc, n prend la forme suivante :
𝑛∞(𝑉𝑐) = 𝛼𝑛(𝑉𝑐)
Figure 1.9 – Variations de la conductance des canaux K dans le calmar géant (Hodgkin & Huxley,1952c)
La résolution de l’équation1.19en fonction de ces conditions limites est : 𝑛(𝑡) = 𝑛∞(𝑉𝑐) − (𝑛∞(𝑉𝑐) − 𝑛∞(0)) ⋅ 𝑒𝑥𝑝𝜏𝑛−𝑡 où 𝜏𝑛(𝑉𝑐) = 1
𝛼𝑛(𝑉𝑐) + 𝛽𝑛(𝑉𝑐)
. (1.22)
À partir de l’équation1.22, qui permet d’exprimer n en fonction d’un changement dans le voltage, la solution naturelle pour trouver les valeur 𝑛∞(0), 𝑛∞(𝑉𝑐) et 𝜏𝑛(𝑉𝑐) serait d’essayer des courbes d’ajustement (fitting). Les données générées par le modèle de Hodgkin-Huxley sont recueillies et tracées sur un graphique. On remarque à prime abord que les données ont une tendance sigmoïdale, en forme de S. La courbe exponentielle est alors choisie pour réaliser la courbe d’ajustement. La 1re d’ordre 1, n’épouse pas bien les données (Figure1.10). Ainsi
ils augmentent l’exposant de manière progressive et finissent par aboutir au fitting parfait à n = 4 d’où l’équation suivante :
L’équation décrivant la variation de la conductance et la satisfaction des conditions limites s’exprime alors sous cette forme :
𝐺𝐾 = {(𝐺∞(𝑉𝑐))1
4 − ((𝐺∞(𝑉𝑐))14 − (𝐺∞(0))14) ⋅ 𝑒𝑥𝑝𝜏𝑛−𝑡)}4. (1.24)
où, 𝐺∞(0) représente la conductance initiale et 𝐺∞(𝑉𝑐), conductance stationnaire.
Figure 1.10 – Meilleures courbes de fitting de 𝐺𝑘 = 𝑔𝑘 ⋅ 𝑛𝑝 (𝑝 ∈ [1,2,3,4]) (Hodgkin &
À partir de l’équation 1.22on obtient : 𝛼𝑛(𝑉 ) = 𝑛∞(𝑉 ) 𝜏𝑛(𝑉 ) 𝛽𝑛(𝑉 ) = 1 − 𝑛∞(𝑉 ) 𝜏𝑛(𝑉 ) . (1.25)
A partir de techniques d’ajustements de courbes aux données, une fois encore les valeurs des taux de constantes sont déterminées :
𝛼𝑛(𝑉 ) = 0.01(10 − 𝑉 ) 𝑒𝑥𝑝(10−𝑉 10 ) − 1 𝛽𝑛(𝑉 ) = 0.125 ⋅ 𝑒𝑥𝑝(−𝑉 80 ). (1.26) 1.2.3.2.2 Canaux 𝑁 𝑎+
En utilisant les mêmes techniques expérimentales que pour les canaux potassium, les varia-tions des conductances dans les canaux Na doivent être exprimées par un système d’équavaria-tions différentielles d’ordre 2 au moins. Afin d’exprimer les phases d’activation et d’inactivation des canaux sodium, ils définissent 2 variables d’état : m, la variable d’activation et h, la variable d’inactivation. En réalisant les courbes de fitting ils aboutissent à 𝑚3 et ℎ1.
𝐺𝑁𝑎= 𝑔𝑁𝑎⋅ 𝑚3⋅ ℎ. (1.27)
Les autres paramètres sont déduits également avec les mêmes techniques : 𝛼𝑚(𝑉 ) = 0.1(25 − 𝑉 ) 𝑒𝑥𝑝(25−𝑉 10 ) − 1 𝛽𝑚(𝑉 ) = 4 ⋅ 𝑒𝑥𝑝(−𝑉 18 ) 𝛼ℎ(𝑉 ) = 0.07 ⋅ 𝑒𝑥𝑝(−𝑉 20 ) 𝛽ℎ(𝑉 ) = 1 𝑒𝑥𝑝(30−𝑉 10 ) + 1 . (1.28)
Le modèle de Hodgkin et Huxley représente une énorme avancée dans la conceptualisa-tion et la modélisaconceptualisa-tion de systèmes capables de représenter des phénomènes physiologiques observés dans les neurones. Au fil du temps, différentes améliorations ont été apportées au modèle. Ainsi, en 1961-62, soit 10 ans après le modèle phare de Hodgkin et Huxley, FitzHugh et Nagumo (Nagumo et al.,1962) (FitzHugh,1961), introduirent les premières modifications. Par la suite, en 1981, Morris et Lecar (Morris & Lecar, 1981), combinèrent les 2 précédents modèles dans un modèle représentant un canal calcique voltage-dépendant associé à un canal potassique à rectificateur retardé. Finalement, en 1984, Hindmarsh et Rose, proposèrent une amélioration du modèle de FitzHugh et Nagumo (Hindmarsh & Rose, 1984), en présentant l’activité neuronale comme le couplage de 3 équations différentielles du 1er ordre.
1.3 Conversion du courant calcique en concentration ionique
(𝐼
𝐶𝑎à [𝐶𝑎
2+])
Les équations de Hodgkin et Huxley permettent de modéliser le courant électrique généré par chaque type de canal. Dans le système biologique du neurone, l’activité biologique est intimement liée à celle électrique. Ainsi certains courants des canaux génèrent des ions qui deviennent des effecteurs pour les réactions biochimiques en aval. C’est le cas du courant cal-cique qui génère des ions 𝐶𝑎2+ qui sont les effecteurs par excellence des activités biochimiques que nous aborderons plus loin.
Une conversion du courant calcique en concentration ionique s’impose alors. L’équation permettant cette conversion est la suivante (Bhalla,2011) :
𝑑[𝐶𝑎2+]
𝑑𝑡 = −𝛽 × 𝐼𝐶𝑎−
[𝐶𝑎2+]
𝜏 . (1.29)
où [𝐶𝑎2+] représente la concentration de calcium en moles, 𝐼
𝐶𝑎 le courant calcique en
mA/cm2, 𝜏 la constante d’expulsion du calcium en secondes et t le temps en secondes. Le 1er terme de l’équation1.29est celui responsable de la conversion du courant généré par
le passage de charges électriques en une concentration qui tient compte de nombre d’atomes chargés. Nous reviendrons par la suite sur le paramètre 𝛽. Le 2e terme est pour l’extrusion
du calcium car ce dernier ne s’accumule pas dans le neurone. Ceci est dûe aux propriétés biologiques des neurones. La constante 𝜏 est remplacée dans certaines formes de l’équation 1.29 par la constante 𝜙, dépendemment de la convention utilisée : 𝜙 = 1
𝜏.
Le paramètre 𝛽 a une importance capitale car c’est lui qui établit la conversion. Voici ci-dessous le détail de son calcul :
Définitions : 1. Aire : 𝐴𝑖𝑟𝑒 = 2 ⋅ 𝜋 ⋅𝑑𝑖𝑎𝑚 2 ⋅ 𝐿 ⇒ 𝐴𝑖𝑟𝑒 = 𝜋 ⋅ 𝑑𝑖𝑎𝑚 ⋅ 𝐿. 2. Volume : 𝑉 𝑜𝑙 = 𝜋 ⋅𝑑𝑖𝑎𝑚 2 ⋅ 𝑑𝑖𝑎𝑚 2 ⋅ 𝐿 ⇒ 𝑉 𝑜𝑙 = 𝜋 ⋅ 𝑑𝑖𝑎𝑚 2⋅ 𝐿 4 . 3. Constante de Faraday F 1 𝐶𝑜𝑢𝑙𝑜𝑚𝑏𝑠 = 1 𝐴𝑚𝑝𝑒𝑟𝑒𝑠 × 1 𝑆𝑒𝑐𝑜𝑛𝑑𝑒 ⇒ 𝐹 = 96485.3365 ⋅ 106 𝑚𝐴 ⋅ 𝑚𝑆.
Ainsi : 𝛽 = 𝐴𝑖𝑟𝑒 2 × 𝐹 × 𝑉 𝑜𝑙 ⇒ 𝛽 = 𝜋 ⋅ 𝑑𝑖𝑎𝑚 ⋅ 𝐿 ⋅ 10 −8 𝑐𝑚2 2 × 96485.3365 ⋅ 106 𝑚𝐴 ⋅ 𝑚𝑆 × 𝜋 ⋅ 𝑑𝑖𝑎𝑚 2⋅ 𝐿 4 ⋅ 10 −18 𝑚3 ⇒ 𝛽 = 2 ⋅ 10 −8 𝑐𝑚2 96485.3365 ⋅ 106 𝑚𝐴 ⋅ 𝑚𝑆 × 𝑑𝑖𝑎𝑚 ⋅ 10−18𝑚3. (1.30)
Par la suite, la concentration calculée est utilisée pour pouvoir activer les voies de signalisa-tions cibles.
1.4
Logiciel NEURON
NEURON est un logiciel pour la simulation de modèles biologiques et artificiels de neu-rones, individuellement ou en réseaux. La 1re version a été développée par Michael Hines,
John W. Moore, et Ted Carnevale des universités de Yale et Duke (Hines & Carnevale,2000) . La dernière version disponible au moment de la rédaction de ce document est la version 7.3. NEURON est distribué sur toutes les plateformes : Mac OS X, Linux et Windows. Il existe plusieurs centaines de modèles réalisés à partir de ce logiciel. Ces modèles sont variés. Ils vont de la description de modèles avec des propriétés morphologiques complexes aux modèles repré-sentant la transmission synaptique. Le traitement de l’information dans le système nerveux est basé sur deux types de signal : le signal électrique et le signal chimique qui permettent aux neurones d’interagir. Ces signaux sont des fonctions (f(x,t)) continues dans le temps et l’espace, décrites par l’équation de diffusion et l’équation de la théorie des câbles1.8.
Dans la réalisation conceptuelle des modèles biologiques, NEURON approxime les équa-tions différentielles partielles avec un ensemble de soustraction d’équaéqua-tions algébriques pou-vant être résolues numériquement. Il s’agit de remplacer un modèle continu, par un modèle discret qui est non-continu dans le temps et dans l’espace. Simuler un tel modèle revient à traiter des variables spatiotemporelles comme des points dans l’espace, appelés nœuds pour un nombre déterminé d’instants dans le temps. La représentation de base dans NEURON est la section qui correspond à un câble continu dont les propriétés anatomiques et biophy-siques peuvent variées de façon continue sur toute la longueur de la section. Ainsi, chacune des sections sont connectées pour former l’architecture complète du neurone de base. Chaque section dispose d’un paramètre nseg qui indique le nombre de nœuds auxquels les solutions des équations différentielles seront calculées. Plusieurs méthodes d’intégration existent et peuvent être choisis par l’utilisateur. Chacune présente des avantages et inconvénients. La réalisation de modèles dans NEURON peut se faire à l’aide d’un langage orienté-objet, d’une interface graphique ou d’une combinaison des 2 méthodes. Chaque méthode présente des avantages par-ticuliers. Le modèle graphique donne l’avantage de permettre des interactions rapides avec le modèle en cours de développement. Cependant toutes les tâches ne sont pas réalisables
avec ce mode. Et quand il s’agit de construire des canaux spécifiques, par exemple, l’usage du langage interprété est inévitable. Ce langage est basé sur le HOC (Pike & Kernighan,1984). Le meilleur mode d’utilisation de NEURON est donc une combinaison du GUI et du HOC.
NEURON possède une librairie de base pour les mécanismes biophysiques : canaux io-niques, pompes, buffers... Cependant ces canaux ne sont pas exhaustifs et face à l’accroisse-ment constant de leurs types et de leurs complexités, il existe un langage de programmation NMDOL pour pouvoir les réaliser. La syntaxe de ce langage est très familière avec les repré-sentations classiques des équations algébriques, des équations différentielles et des réactions cinétiques. Le mécanisme est décrit dans un fichier texte qui est transcrit automatiquement en C grâce à un traducteur. Les fichiers C produits sont alors compilés par la suite. L’un des principaux avantages de cet environnement est de permettre aux usagers de faire abstraction des langages de bas niveaux en se concentrant exclusivement sur les concepts scientifiques. Cela facilite grandement l’exportation de la science computationnelle auprès des neuroscien-tifiques car ces derniers demeurent avec des termes propres à leur domaine et ne s’emmêlent pas trop les pinceaux à comprendre un langage de haut niveau comme le C. La Figure 1.11 résume le mode d’utilisation de NEURON. Dans un 1er temps, tous les fichiers
représen-tants les mécanismes biochimiques sont réunis dans un dossier Fichier *.mod. Ces fichiers sont ensuite compilés à l’aide du traducteur automatique susmentionné (mknrndll) ((1) sur la Figure 1.11). Le programme automatique de compilation est lancé : ouverture du terminal et exécution. Une fois la compilation validée, un dossier contenant les fichiers en C est créé : x86_64 ((2) sur la figure1.11). Parallèlement le fichier .hoc, fichier contenant les processus de simulation, la définition de la structure physique et les différents paramètres biophysiques est développé. Le fichier définissant la structure en compagnie de du dossier des fichiers compilés x86_64, est mis dans un dossier Fichier *.hoc ((3) sur la Figure 1.11). Le fichier .hoc est alors compilé avec l’interface graphique nrngui ((4) sur la Figure 1.11). Les résultats de la simulation en cours apparaissent par la suite dans l’interface de NEURON ((5) sur la Figure 1.11).
Le modèle réalisé ici comprend 8 mécanismes biophysiques distribués dans 13 fichiers, certains mécanismes ayant besoin de 2 fichiers pour être implémentés. Ces mécanismes par-ticuliers utulisent la notion de pointeurs commune à la majorité des langages évolués. D’où la nécessité de développer 2 fichiers pour les représenter. Les mécanismes développés, repré-sentent les canaux : Na (Sodium) ; Ca (Calcium) ; K (Potassium) : plusieurs types ; NMDA (N-methyl-D-aspartate receptor) ; AMPA (𝛼-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid receptor). Nous disposons aussi de 3 fichiers HOC : CA1.hoc, dans lequel la structure physique est définie ainsi que les paramètres biophysiques ; Synapses_definition.hoc, qui com-prend les données spécifiques aux synapses (inclut dans le CA1.hoc) ; et le fichier de stim.hoc qui comprend les instructions de simulations. Les résultats des simulations sont présentés dans des graphes dans lesquels nous affichons les variables d’intérêts telles que le voltage
Figure 1.11 – Mode d’utilisation de NEURON
membranaire d’un compartiment, un courant ionique spécifique (générallement le calcium), et d’autres variables en fonction de la simulation et de nos besoins. Le tableau 1.1 présente les unités utilisées par défaut par NEURON :
En combinant les connaissances sur le modèle de Hodgkin-Huxley, les canaux ioniques et les méthodes de programmation dans NEURON, nous avons réalisé un modèle fonctionnel représentant les résultats expérimentaux tirés de (Bhalla,2011). Ces résultats seront présentés dans le chapitre4 de la partieII.
Catégorie Variable Unités
Temps t [ms]
Voltage v [mV]
Courant i [𝑚𝐴/𝑐𝑚2] (suffix)
[nA] (point process)
Concentration ko, ki, etc. [mM]
Capacitance cm [𝜇𝑓/𝑐𝑚2]
Longueur L [𝜇𝑚]
Diamètre diam [𝜇𝑚]
Conductance g [𝑆/𝑐𝑚2] (suffix)
[uS] (point process)
Résistivité cytoplasmique Ra [𝑜ℎ𝑚 ⋅ 𝑐𝑚]
Résistance Ri( ) [106 ohm]
Chapitre 2
Modélisation de la signalisation
En dehors de l’activité électrique, les neurones possèdent la capacité de véhiculer un mes-sage biochimique également. Ce mesmes-sage découle d’un réseau de signalisation qui peut-être modélisé de 2 façons : la modélisation compartimentale ou spatiale.
2.1
Réseaux de signalisation
Un réseau biologique est une représentation de la circulation d’un certains type d’infor-mation dans la cellule. Il en existe plusieurs types :
1. Réseau d’interaction protéine-protéine (la protéine A interagit physiquement avec la protéine B)
2. Réseau de signalisation (la protéine A transmet un signal à la protéine B) 3. Réseau génétique ou de régulation (le gène A régule l’expression du gène B)
4. Réseau métabolique (un sous-ensemble des réactions de la cellule impliquant les nutri-ments de la cellule) (Bailly-Bechet et al. ,2011)
Les réseaux de signalisation, catégorie à laquelle nous nous intéressons dans cette étude, ne sont plus considérés de nos jours comme de simples réseaux linéaires qui relaient l’information et l’amplifient. En effet il a été récemment prouvé que les cellules utilisent ces réseaux comme un moyen d’intégration de multiples informations en entrée pour générer un unique résultat en sortie. Le niveau de complexité de ces réseaux est assez élevé et varie générallement en fonction du niveau de détail visé. Cette complexité est mieux connue grâce à l’augmentation des techniques expérimentales et des données biologiques. Face à cette complexité croissante et élevée des réseaux, la nécessité de développer des modèles est apparue. Ces modèles devraient permettre d’augmenter les connaissances des interactions et des comportements des molécules des modèles afin d’aboutir à certaines prédictions. Ces prédictions devraient être testables expérimentalement.
La modélisation computationelle a émergé comme un puissant outil de description et de prédiction capable d’étudier des systèmes complexes. En biologie, on commence à l’utiliser de plus en plus fréquemment malgré la réticence rencontrée dans ce domaine vu qu’elle est fondamentalement une science expérimentale. Un modèle computationnel devrait représenter le système biologique au détail prêt et être capable de reproduire le comportement du système dans un panel varié de conditions (Neves & Iyengar,2002). Pour ce faire, le fondement princi-pal du modèle constitue les données expérimentales. La quantité et la qualité des informations expérimentales disponibles sont capitales à la viabilité du modèle.
2.2
Modélisation compartimentale
La réalisation d’un modèle est incrémentale : plusieurs étapes sont nécessaires pour y arriver. L’une des premières étapes est de réaliser une construction par module ou block