Encapsulation d'acides gras trans de ruminants et
industriels pour l'étude des facteurs de risques
associés au diabète de type 2
Mémoire
Elodie Chotard
Maîtrise en sciences pharmaceutiques - avec mémoire
Maître ès sciences (M. Sc.)
Encapsulation d’acides gras trans
de ruminants et industriels pour l’étude
des facteurs de risques associés
au diabète de type 2
Mémoire
Elodie Chotard
Maîtrise en sciences pharmaceutiques
Sous la direction de :
Nicolas Bertrand, directeur de recherche
Iwona Rudkowska, codirectrice de recherche
Résumé
L’impact biologique exact des acides gras trans (TFA) sur la santé globale n’est toujours pas clair. Actuellement, il y a deux sources principales de TFA : 1- ceux qui se produisent naturellement dans les produits laitiers et de viande à la suite de la biohydrogénation chez les ruminants (R-TFA) et 2-ceux formés par des procédés industriels (I-TFA). Les I-TFA ont des effets néfastes sur le risque cardiovasculaire (CV), la résistance à l’insuline et le diabète de type 2. Cependant, les résultats actuels suggèrent que les R-TFA peuvent avoir des effets bénéfiques sur les facteurs de risque du diabète. À ce jour, peu d’études animales ont été menées à l’aide de R-TFA. Ces études suggèrent des mécanismes d’action potentiels qui peuvent expliquer les effets de la R-TFA sur le diabète de type 2 : diminution de l’inflammation, modification des niveaux d’expression génique et diminution de la graisse hépatique.
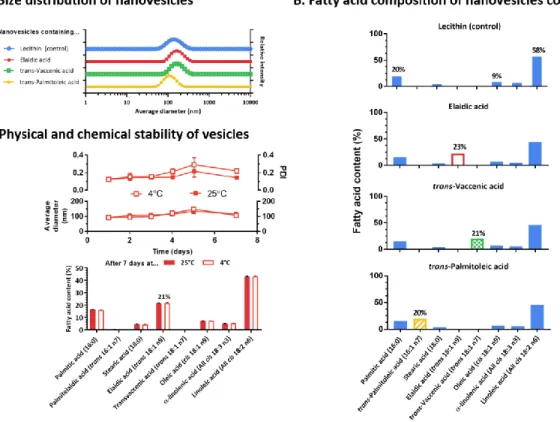
L’objectif de cette étude était de développer une formulation qui pourrait encapsuler des R-TFA de manière isolée sans les autres constituants du lait. Pour ce faire, une stratégie de formulation visant à obtenir des solutions de TFA stables, solubles dans l’eau et biodisponibles ont été développées. Dans un premier temps, nous avons développé des formulations encapsulant les TFA dans des nanovésicules de 100 nm en moyenne. Nos résultats démontrent que ces formulations sont stables physiquement et chimiquement pendant une semaine. Dans un deuxième temps, nous avons administré ces formulations contenant les TFA aux animaux, par gavage. Les résultats obtenus démontrent que nos formulations assurent la biodisponibilité des TFA, sans moduler les concentrations plasmatiques d’autres acides gras. Enfin, nous avons démontré la versatilité de cette technique en co-encapsulant des TFA avec d’autres molécules hydrophiles et hydrophobes telles que la vitamine D3 et la L-leucine.
Ces résultats démontrent l’intérêt de l’utilisation de nanovésicules en sciences des aliments pour l’encapsulation de composés non solubles dans l’eau. In fine, ces formulations représentent une base solide pour mener à bien les études in vivo futures et comprendre les effets réels des R-TFA sur le DT2 et ses facteurs de risques.
Table des matières
Résumé ... ii
Table des matières ... iii
Liste des figures ... v
Liste des tables ... vi
Liste des abréviations, sigles, acronymes ... vii
Remerciements ... viii
Avant-propos ... x
Introduction ... 1
Le diabète de type 2 ... 1
Définition ... 1
Incidence et prévalence au Canada ... 2
Traitements ... 2
Nutritionnels ... 2
Pharmacologiques ... 3
Les acides gras trans, une nouvelle approche nutritionnelle? ... 4
Les acides gras trans ... 6
Définition et structure chimique ... 6
Origines des acides gras trans et proportion dans l’alimentation ... 7
Proportion et apport en TFA ruminants dans l’alimentation ... 7
Les acides gras trans ruminants et facteurs de risques associés au diabète de type 2 ... 9
1. Insulino-résistance ... 9
2. Inflammation ... 10
3. Obésité et accumulation de gras hépatique ... 11
4. Les récepteurs activés par les proliférateurs de peroxysomes (PPAR) ... 12
La micro- et nanoencapsulation dans l’alimentation... 13
Principes généraux ... 13
L’encapsulation dans l’alimentation... 14
1. Les émulsions ... 14
3. Les complexes protéiques ... 17
4. La co-encapsulation ... 18
L’encapsulation de composés hydrophobes et particularité des acides gras. .... 20
1. L’encapsulation d’acides gras ... 20
2. Les raisons d’encapsuler des composés hydrophobes ... 21
Chapitre 1. Problématique et objectifs ... 25
Chapitre 2. Drinkable lecithin nanovesicles to study the biological effects of hydrophobic nutrients and molecules ... 27
Résumé ... 27
Abstract ... 28
1. Introduction ... 30
3. Materials and methods ... 32
4. Results and discussion ... 36
5. Concluding remarks ... 43
Chapitre 3. Méthodes et résultats complémentaires ... 55
Méthodes colorimétriques ... 55
1. Quantification du phosphore ... 55
2. Quantification des acides gras insaturés ... 55
Résultats ... 56
Chapitre 4. Discussion générale et perspectives ... 58
Discussion générale ... 58 1. Principaux résultats ... 58 2. Limitations ... 58 Perspectives ... 60 Conclusion ... 61 Bibliographie ... 62
Liste des figures
Figure 1. Traitements pharmacologiques disponibles pour les patients atteints de
DT2. (Adaptée de Stumvoll, 2005) ... 4
Figure 2. Acides gras insaturés en configuration cis vs. trans ... 6 Figure 3. Schématisation de la relation entre Inflammation et la résistance à
l’insuline dans la pathologie du diabète de type 2. ... 11
Figure 4. Co-encapsulation de plusieurs composés bioactifs dans une vésicule.
(Adaptée de Chawda et al., 2017) ... 18
Figure 5. Co-encapsulation de composants bioactifs hydrophiles et hydrophobes
dans les liposomes (adaptée de Tavano et a.l, 2014) ... 19
Liste des tables
Tableau 1. Proportions en acides gras trans dans les produits alimentaires
provenant des ruminants, les plus courants (Adapté de Gebauer, 2011) ... 8
Tableau 2. Apport en acides gras trans de ruminants dans l’alimentation (Adapté de
Gebauer, 2011) ... 9
Tableau 3. Ingrédients bioactifs lipophiles encapsulés dans des émulsions (Adapté
de Trujillo et al. 2017) ... 15
Tableau 4. Études sur la co-encapsulation de bioactifs pour matrice alimentaire.
(adapté de Chawda et al., 2017) ... 19
Liste des abréviations, sigles, acronymes
Définition
TFA Acides gras trans
CLA Acides linoléiques conjugués DT2 Diabète de type 2
IR Résistance à l’insuline
HDL-c Lipoprotéine du cholestérol haute densité LDL-c Lipoprotéine du cholestérol faible densité DPP4 Dipeptidylpeptidase-4
LA Acide linoléique ALA Acide alpha-linoléique HTA Hypertension artérielle
PHVO Huile partiellement hydrogénée R-TFA Acide gras trans de ruminants I-TFA Acide gras trans industriels TVA Acide trans vaccénique TPA Acide trans palmitoléique EA Acide élaïdique
CV Cardiovasculaire
GLP-1 Glucagon-like-peptide-1 NF-κB Facteur nucléaire kappa B
PPAR Récepteurs activés par les proliférateurs de peroxysomes PUFA Acides gras polyinsaturés
Remerciements
Ce mémoire constitue une riche expérience qui ne peut s’achever sans remercier les personnes qui m’ont encadrée, aidée et soutenue au cours de ces deux années de recherches scientifiques. Je m’excuse d’avance si certains prénoms manquent dans ces pages. Mes premiers remerciements vont vers mes directeurs de recherche, Nicolas Bertrand et Iwona Rudkowska, sans qui cela n’aurait jamais été possible. J’exprime dans ces pages ma grande gratitude à tous les deux pour m’avoir acceptée pour cette maitrise, de m’avoir soutenue et poussée dans mes travaux de recherches. Iwona et Nicolas, même si cela fut parfois compliqué entre nous, sachez que j’ai énormément appris auprès de vous et que je n’oublierai pas ces moment où vous vous êtes acharnés pour que je comprenne la rigueur scientifique. Nicolas, merci pour ta patience et tes encouragements. Tu as souvent trouvé les bons mots pour m’encourager dans mes expériences au laboratoire. Mes remerciements vont aussi vers toutes les personnes que j’ai pu rencontrer au laboratoire. Mes remerciements vont particulièrement à Phillipe Grenier. Sous tes airs réservés se cache quelqu’un toujours disponible pour m’aider, discuter et me soutenir dans mes nombreuses heures de procrastinations. Je ne vous oublie pas non plus les filles, Iara, Caroline, Amrita, Karine. Nos conversations au laboratoire et toutes ces histoires croustillantes me manqueront, c’est certains. Merci à Youcef, grâce à toi, je suis prête à affronter les réalités et les avis divergeants entre collègues dans le « monde du travail ». Sans vous et votre soutien, ces années auraient été fades.
Merci à tous mes amis qui m’ont soutenue et encouragée. J’ai eu cette chance de rencontrer des personnes formidables qui ont confiance en moi et qui me soutiennent dans tous mes projets. Rebecca et Thomas, merci d’avoir toujours participer à mes plans et péripéties complètements dégantés. Vous avez toujours su me conforter dans mes idées et mon imagination débordante. J’aurai peut-être écrit deux ou trois articles sans toutes ces soirées à la maison, mais je pense que je n’aurai pas été aussi heureuse.
Enfin je remercie avec grande émotion ma famille pour son irremplaçable et inconditionnel amour et soutient. Comme on dit en créole « Sé kouto sel ki sav' sa
ki en kè jiromon ». Merci Mami pour toutes les valeurs que tu m’as inculquées et la
force spirituelle que tu as su m’apporter durant toutes ces années. Merci Maman pour ta force et le sacrifice que tu as fait pour que nous soyons ce que nous sommes aujourd’hui. Merci à toi Ama, sans toi je n’aurai jamais eu cette aussi grande force de conviction pour avancer malgré les erreurs et échecs. Merci pour ces paroles motivantes et la force spirituelle que tu m’as apportées; grâce à toi, je suis prête à poursuivre ma mission (Hotep). Merci aussi à toi Omar pour ton soutien et encouragements, j’ai hâte d’être à la suite. Mais quelqu’un manque dans ces pages comme dans ma vie, merci à toi Papa, malgré tout je sais à quel point tu aurais été fière de moi.
Parce que rien n’est arrivé par hasard, je suis fière du parcours que j’ai fait et je suis plus que prête pour la grande suite.
Avant-propos
Ce mémoire avait pour objectif de développer une formulation stable et biodisponible encapsulant des TFA pour permettre d’étudier leurs effets in vivo.
Le présent document synthétise les travaux réalisés durant mes deux années d’études en maitrise en sciences pharmaceutiques sous la codirection du Dre Iwona Rudkowska et du Dr Nicolas Bertrand, au Centre de recherche du CHU de Québec. Ce mémoire débute par une revue de littérature (introduction) dont le but est de mettre en contexte les travaux afin d’aboutir à l’énoncé des objectifs et de l’hypothèse de recherche (Chapitre 1). S’en suit un nouvel article soumis, pour lequel je suis première auteure (Chapitres 2). Le chapitre 3 contient des méthodes et résultats expérimentaux additionnels n’ayant pas été intégrés à l’article de recherche. Enfin, le Chapitre 4 annonce la discussion générale et les perspectives des travaux présentés. L’article original intitulé « Drinkable lecithin nanovesicles to study the biological effects of hydrophobic nutrients and molecules » a été soumis dans le journal Molecular Nutrition and Food Research en avril 2019. Cet article propose et rationalise l’utilisation des nanovésicules de lécithine en tant qu’outil pour apporter des macronutriments hydrophobes pour les études animales. Dans le cadre de cette étude, j’ai réalisé les expériences en laboratoires, interprété les données, préparé les figures et rédigé une première version du manuscrit. Dr Nicolas Bertrand a réalisé les études pharmacocinétiques chez les animaux (avec mon aide technique) et analysé les résultats des études comportementales. Line Berthiaume, professionnelle de recherche dans l’équipe du Dr Pierre Julien, a réalisé l’analyse des lipides. L’étude comportementale a été effectuée à l’animalerie du CHU de Québec par l’équipe technique en soin des animaux. Le Drs Iwona Rudkowska et Nicolas Bertrand m’ont supervisée et guidée pour chacune de ces étapes. Tous les co-auteurs ont lu et approuvé la version finale du manuscrit.
Introduction
Le diabète de type 2
Définition
Selon la définition établie par l’Organisme mondial de la santé (OMS), le diabète de type 2 (DT2) ou diabète non-insulinodépendant résulte de l’utilisation inadéquate de l’insuline par l’organisme. L’insuline est une hormone hypoglycémiante naturellement sécrétée par les cellules-bêta situées dans les ilots de Langerhans du pancréas. En physiologie, cette hormone régule l’entrée du glucose dans les cellules, et transforme celui-ci en source d’énergie ou en réserves pour une utilisation ultérieure. La physiopathologie du DT2 est régie par l’insulinorésistance, caractérisée par : i. Une incapacité de l’insuline à déclencher une réponse maximale au niveau de ses organes cibles ii. Un défaut de captation musculaire du glucose au niveau périphérique et iii. Une hyperglycémie à jeun associée à une hyperproduction hépatique de glucose (1). L’insuline s’avère alors inefficace, ce qui déclenche une hausse de la production de l’insuline pour réduire l’augmentation du taux de glycémie (hyperinsulinémie compensatoire).
Souvent, le DT2 s’accompagne d’anomalies comme dans le cas du syndrome métabolique caractérisé par une obésité associée à une hypertriglycéridémie, un taux sanguin de lipoprotéines de haute densité (HDL-c) faible, une hypertension artérielle (HTA) et une hyperglycémie à jeun. De ce fait, les maladies cardiovasculaires sont les plus grandes causes de morbidité et de mortalité associées au DT2. L’insulinorésistance expose le patient à un risque vasculaire accru, ce qui nécessite un contrôle stricte du taux de glucose et lipides sanguins, ainsi que de la pression artérielle afin d’anticiper les risques de complications microvasculaires (rétinopathie, néphropathie, neuropathie) associées au DT2 (2-4).
Incidence et prévalence au Canada
L’augmentation de l’obésité, de la sédentarité et des régimes riches en calories ont abouti à l’accroissement du nombre de patients atteints de DT2. En 2017, on estimait que 425 millions de personnes avaient du diabète, dont plus de 90% étaient atteints de DT2 (5). Parmi ces 425 millions de patients, une personne sur deux serait non diagnostiquée. Ces mêmes statistiques prévoyaient une augmentation de 48% du nombre de patients atteints de la maladie, jusqu’à 629 millions de personnes, d’ici 2045. L’incidence et la prévalence du DT2 varient par région géographique, dont plus de 80% des patients vivent dans des pays à faible revenu, mais la tendance globale montre une augmentation de la prévalence du diabète depuis 1980 (5). Au Canada, la prévalence est estimée à 9,9 % de la population en 2020, soit près de 4 millions de patients atteint de DT2. Néanmoins une modification du mode de vie, de la pharmacothérapie ou des deux en association, peuvent inverser ou retarder le développement du DT2.
Traitements
Nutritionnels
Actuellement, les causes du DT2 ne sont pas totalement comprises, mais il existe une étroite corrélation avec le surpoids et l’obésité, l’âge, l’ethnicité et les antécédents familiaux. Les causes de l’insulinorésistance retrouvée chez ces patients diabétiques peuvent être modifiables (sédentarité, excès pondéral) ou non (patrimoine génétique). Parmi les principaux facteurs de risque modifiables, on y retrouve une adiposité excessive (obésité), une mauvaise alimentation, un manque d’activité physique (sédentarité), l’intolérance au glucose, le tabagisme et des antécédents de diabète gestationnel (avec une exposition du fœtus à une glycémie élevée lors du développement in utero). La prévention du DT2 par des mesures hygiéno-diététiques permettrait d’éviter plusieurs années de traitements pharmacologiques et complications chez les patients. Sur le plan des facteurs alimentaires, des données concluantes récentes ont également laissé entendre l’existence d’un lien entre une consommation élevée de boissons sucrées et le
risque de DT2 (6). Ainsi, une lutte active contre la sédentarité ainsi que la planification alimentaire représentent des interventions indispensables à toutes les étapes de la prise en charge du DT2.
De nombreuses évidences suggèrent que le DT2 peut être anticipé en prenant en charge l’obésité et l’altération de la régulation du glucose au moyen d’interventions visant à améliorer l’alimentation et les exercices physiques (7, 8). Selon les résultats du Programme américain de Prévention du Diabète (DPP) une modification intensive du mode de vie (activité physique et régime pauvre en graisses) réduirait les risques de DT2 (58%) et serait plus efficace que la metformine (31%) ou un placebo, chez 3324 adultes présentant une tolérance au glucose altérée, en surpoids ou obèses (9). Cette observation avait été constatée chez toutes les populations de patients, sans distinction de sexe, d’origine ethnique ou de prédisposition génétique. Ainsi, l'activité physique participe à la régulation de la glycémie chez le DT2, en facilitant l'utilisation du glucose et en augmentant la sensibilité à l'insuline. Elle améliore également la dyslipidémie en augmentant les HDL et en diminuant les triglycérides dans le sang, initialement impliqués dans l’émergence des maladies cardiovasculaires observées chez ces patients diabétiques.
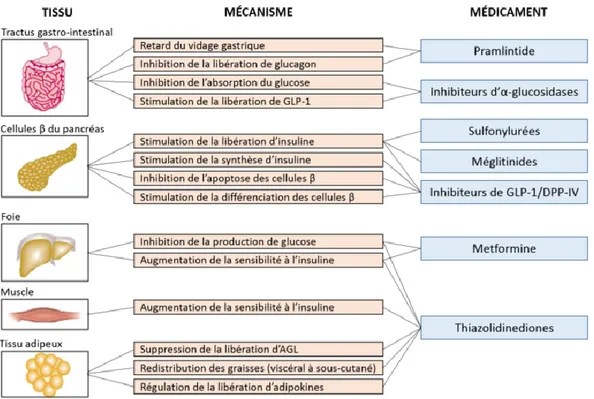
Pharmacologiques
Plusieurs traitements pharmacologiques sont disponibles pour traiter le DT2, et peuvent être utilisés conjointement aux mesures diététiques. Parmi ces traitements on y retrouve plusieurs classes de médicaments : les sulfonylurées (ou sulfamides), les glinides, les biguanides, les thiazolidinediones, les inhibiteurs des α-glucosidases et plus récemment, des analogues du glucagon-like-peptide-1 (GLP1) et des inhibiteurs de l’enzyme di-peptidyl-peptidase-4 (DPP4). Ces classes ont toutes des mécanismes d’action différents, mais ont une action hypoglycémiante commune. (Figure 1) Sauf contre-indication, la metformine (biguanide) reste le traitement de choix en première intention pour les patients atteints de DT2. Les biguanides ne stimulent pas l'insulinosécrétion (production d’insuline). Leur action principale est de diminuer la production du glucose hépatique, augmenter la
sensibilité des tissus périphériques et stimuler la sécrétion de GLP-1 (hormone de satiété). Elles ne provoquent pas d'hypoglycémie et peuvent avoir des effets bénéfiques modestes sur la pression sanguine et le profil lipidique (10). En comparaison aux traitement sulfonylurées ou placebo, la metformine diminue également les risques cardiovasculaires (11). L’effet indésirable le plus grave de la classe des biguanides est l’acidose lactique mais sa survenue est très rare et son pronostic est très défavorable. La metformine est également associée à une carence en vitamine B12 et est contre-indiquée chez les patients atteints d’insuffisance rénale chronique modérée à sévère (12).
Figure 1. Traitements pharmacologiques disponibles pour les patients atteints de
DT2. (Adaptée de Stumvoll, 2005)
Les acides gras trans, une nouvelle approche nutritionnelle?
Une alimentation saine permet de combler les besoins nutritionnels, de contrôler la glycémie, d'atteindre un poids santé et de prévenir le risque de maladies cardiovasculaire (CV) associées. Plus précisément, un apport réduit en lipides combiné à une alimentation pauvre en acides gras saturés et trans permettrait de
réduire le risque de maladies CV. Les TFA sont souvent considérés comme étant des protagonistes impliqués dans l’émergence des maladies CV. En effet, d’après certaines études épidémiologiques, les TFA auraient des effets néfastes sur le métabolisme du cholestérol et des lipoprotéines sériques, augmentant ainsi le risque CV (13). Également, les TFA seraient associés au DT2 et à ses facteurs de risque, notamment la résistance à l’insuline (IR) et l’inflammation. Spécifiquement, Gebauer
et al, ont observé que les TFA d’origine industriel (I-TFA) augmentaient les
concentrations des lipides plasmatiques, des lipoprotéines, des marqueurs de l’inflammations et altéraient la fonction endothéliale (14). Dans les études diététiques contrôlées, les TFA ont augmenté le taux de LDL-cholestérol (LDL-c) (15) et HDL-cholestérol (HDLc) (16) circulant, les triglycérides et la lipoprotéine-a (15, 17). Par conséquent, les TFA induisent des dyslipidémies et prédisposent à l’obésité et l’IR (18, 19).
Le 17 septembre 2018, l’ajout d’huiles partiellement hydrogénées (PHVO) dans l’alimentation ont été interdites. Il est dorénavant illégal pour les fabricants d'ajouter du PHVO dans les aliments vendus au Canada. L’interdiction contribue à atteindre l’objectif de santé publique qui consiste à réduire l’apport en gras trans à moins de 1 % de l’apport énergétique total chez la grande majorité de la population canadienne ; et ainsi, diminuer les risques CV de la population générale.
Cependant, une étude française a démontré que les TFA d’origine naturelle, provenant des ruminants (R-TFA), n’impacteraient pas les taux HDL-c sanguin, même si elles sont consommées à des doses beaucoup plus élevées que celles retrouvées dans l’alimentation usuelle. Deux autres études ont également démontré que les TFA naturels (1-2% de l’apport énergétique journalier) n'ont pas d'impact néfaste sur les marqueurs lipidiques sanguins associés aux risques CV, contrairement aux I-TFA. (20)
Dans une étude multivariée, aucune corrélation entre les taux d’absorption de R-TFA et les changements dans les facteurs de risques CV n’a été observée. Un apport en R-TFA allant de 4-19% de l’apport énergétique journalier n’ont pas changé les ratios TC : HDL-c et LDL-c : HDL-c. Ces données suggèrent qu’un apport maximal de 19% en TFA provenant de sources naturelles, n'a pas d'effet néfaste sur
les marqueurs de risque impliqués dans l’émergence des maladies CV chez les personnes en bonne santé (20). Plus récemment, Da Silva et al ont montré que les TFA provenant des ruminants sont associés à une diminution des niveaux d’insuline, de la pression artérielle et à une augmentation des niveaux d’adiponectine (molécule produite par le tissu adipeux impliquée dans la régulation du métabolisme des lipides et du glucose). Dans cette même étude, les TFA d’origine industrielle ont été associés à des taux de cholestérol, de triacylglycérol, et de glycémie plus élevé, contrairement aux R-TFA (21).
Les I-TFA et R-TFA semblent avoir des effets différents sur les facteurs de risques métaboliques associés au DT2. Actuellement, il y a une controverse qui serait de différencier les effets physiologiques des acides gras trans ruminant (R-TFA) (22) de ceux des acides gras trans industriels (I-TFA) (23-25).
Les acides gras trans
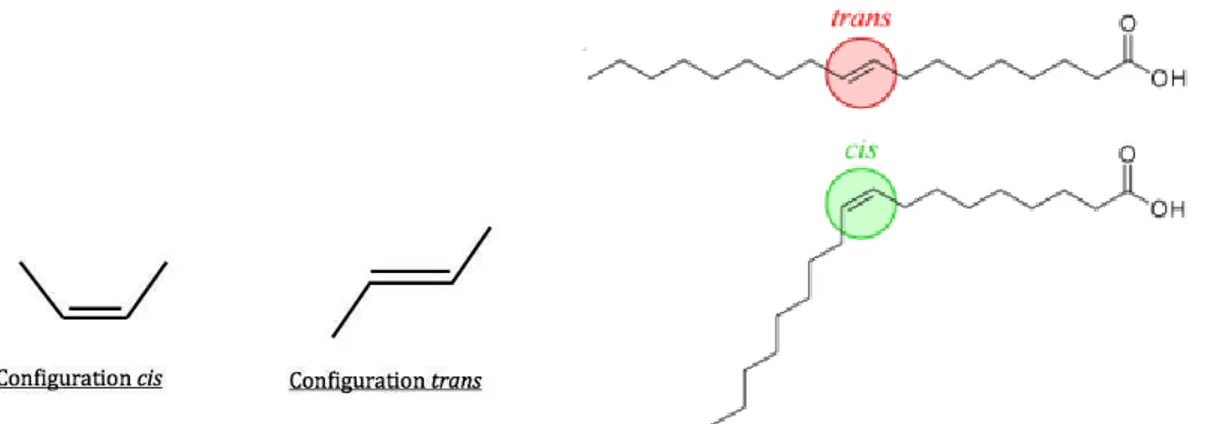
Définition et structure chimique
Par définition, un acide gras trans (TFA) est un acide gras mono- ou polyinsaturé avec une double liaison en configuration trans (Figure 2). Cette configuration trans est caractérisée par le positionnement des atomes d’hydrogène des deux côtés la double liaison. Cette configuration fait opposition à la configuration cis, où les atomes se trouvent du même côté de la double liaison.
Origines des acides gras trans et proportion dans l’alimentation
Les acides gras trans industriels (I-TFA) proviennent des huiles végétales partiellement hydrogénées (PHVO) et sont retrouvés dans de nombreux plats préparés et produits industriels (viennoiseries, fritures). L’acide élaïdique (trans C18 :1 n-9) est un I-TFA majoritairement présent dans l’alimentation. Contrairement, les R-TFA sont présents dans le lait, les produits laitiers et la viande bovine et sont issus d’une biohydrogénation d’origine bactérienne dans le rumen (13). Parmi ceux-ci, on distingue en majorité l’acide trans-vaccénique (tVA ; trans 18:1 n-7), l’acide
trans-palmitoléique (tPA ; trans 16:1 n-7) et l’acide linoléique conjugué (CLA). Tous
sont les produits de la biohydrogénation des acides gras C18 insaturés, principalement l’acide linoléique (LA) et alpha-linolénique (ALA).
Dans l’alimentation humaine, on retrouve majoritairement des acides gras en C18 incluant l’acide stéarique (C18), oléique (C18 :1 n-9), linoléique (C18 :2 n-6 ; LA) et alpha-linolénique (C18 :3 n3 ; ALA) et des quantités infimes de TFA, incluant le tVA. LA et ALA sont classifiés comme des acides gras essentiels (26). Par réaction enzymatique, LA et ALA peuvent produire des acides gras à longues chaînes n-6 et n-3 par élongation ou désaturation, respectivement (27, 28).
Proportion et apport en TFA de ruminants dans l’alimentation
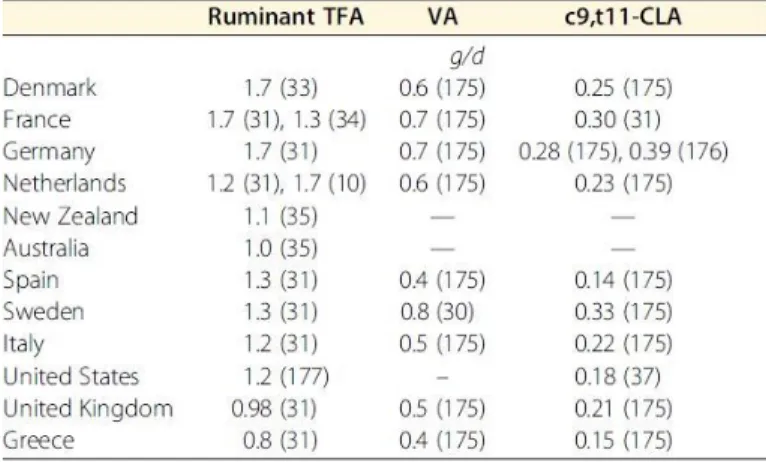
Les R-TFA représentent une faible proportion en gras totaux présents dans les produits laitiers (2 - 5%) et dans les viandes bovines (3 - 9% des acides gras totaux) (24, 25). La composition des matières grasses laitières peut être modifiée par les changements géographiques et/ou saisonniers et les variations dans l’alimentation bovine (29). En revanche, le PHVO peut comporter jusqu’à 60% des acides gras totaux en TFA. Les quantités en TFA dans les produits issus des ruminants couramment consommés sont présentées dans le Tableau 1.
D’après les données, il est difficile de consommer des quantités très élevées de R-TFA dans un régime alimentaire typique.
En 2003 l’OMS recommande que l’apport en TFA soit limité à <1% de la dépense énergétique globale (29). Plus récemment, une étude mondiale réalisée en 2010 comprenant 187 pays à montrer que la consommation moyenne globale en TFA est restée stable entre 1990 et 2010 (+1%). D’après cette étude, la proportion en TFA variait entre les pays de 0,2 à 6.5 % de l’apport en matière grasse totale. (30) Initialement, la consommation totale en TFA était considérée comme indépendante de leur provenance (ruminant vs produits industriels) (31). Cependant, des études plus récentes ont estimé séparément la consommation des TFA naturels issus des ruminants (R-TFA) des TFA totaux. L’apport alimentaire en R-TFA de divers pays est présenté dans le Tableau 2. Dans l’étude TRANSFAIR, la proportion en TFA issus du lait et des graisses de ruminants allait de 28 à 79% dans les 14 pays d’Europe occidentale étudiés (32). Dans les pays méditerranéens, > 50% de l’apport total en TFA provenaient de sources de ruminants. En Europe et en Amérique du Nord, les TFA représentent 10 à 20% de la consommation totale (33) (34). Au Danemark, où les produits de ruminants (produits laitiers, viande bovine) sont fortement consommés, la proportion en R-TFA dans l’alimentation peut représenter jusqu’à 60 à 80% de l’apport total en TFA (35). Les résultats des études épidémiologiques ont généralement montré une association inverse ou nulle entre l’apport de R-TFA dans l’alimentation et les risques CV dans plusieurs emplacements géographiques (20, 36).
Tableau 1. Proportions en acides gras trans dans les produits alimentaires
Tableau 2. Apport en acides gras trans de ruminants dans
l’alimentation (Adapté de Gebauer, 2011)
Les acides gras trans de ruminants et les facteurs de risques
associés au diabète de type 2
Suivant la source en TFA, des réponses physiologiques différentes ont été observées. D’après plusieurs études les acides gras trans d’origine naturelle (R-TFA) pourraient contribuer à diminuer certains facteurs de risque associés au DT2 et ses facteurs de risques (IR, inflammation, obésité, l’expression génique).
1. Insulino-résistance
L’origine des TFA, et notamment du type de R-TFA dans l’alimentation, pourrait avoir un effet sur les marqueurs de résistance et de sécrétion à l’insuline (37, 38). Des études spécifiques ont mis en évidence que le tVA n’aurait pas d’effet sur l’IR et le DT2 (37). Dans une étude randomisée en double aveugle comprenant 42 jeunes hommes, une consommation riche en tVA (3.6 g/j) pendant 5 semaines n’a pas affecté la glycémie et l’insulinémie (39). De plus, l’augmentation de l’apport et de la concentration plasmatique en tPA sont corrélées avec une diminution de l’insulinémie à jeun, l’IR, et l’incidence du DT2 (40, 41). Kratz et al, ont aussi relevé que le tPA diminuerait la glycémie à jeun, améliorerait la tolérance orale au glucose
et la sensibilité à l’insuline aux niveaux hépatique et systémique (42). Une méta-analyse comprenant sept études cliniques a conclu que la consommation de TFA n’affectait pas la concentration de glucose ou d’insuline (43).
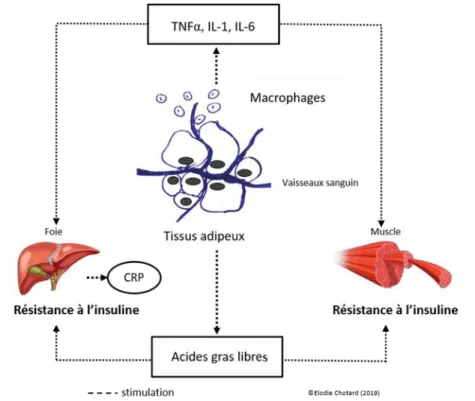
2. Inflammation
Les marqueurs de l’inflammation doivent être également pris en compte car des cytokines pro-inflammatoires prédisposent à l’IR (44). (Figure 3) Lors d’une étude réalisée sur des rats obèses, aucun changement au niveau des marqueurs de l’inflammation n’a été relaté en présence de tVA et de tPA (45). Une autre étude a démontré que le tVA diminuait l’expression des cytokines pro-inflammatoires dans les cellules T humaines (46). Le taux de protéine-C réactive (CRP) est un prédicteur des évènements CV futurs incluant le risque d’hypertension et le diabète (47). Dans l’étude Cardiovascular Health Study, un apport plus élevé en tVA était corrélé à une diminution des concentrations sanguines en CRP (40). Néanmoins, dans une étude randomisée en double aveugle (n= 42 hommes sains), la consommation de beurre riche en tVA n’a pas affecté les concentrations en CRP (39). À l’inverse, les margarines et des graisses contenant principalement de l’EA ont accru les concentrations plasmatiques en CRP (48). Également, chez des patients atteints d’hypercholestérolémie modérée, la consommation d’une diète composée enrichie en TFA (6,7%) a augmenté la production d’IL-6 et TNF-α des cellules sanguines mononuclées (49). Dans cette même étude, les niveaux de production d’IL-1 et du TNF-α avaient été corrélés à l’augmentation des ratios HDL-c. Dans l’étude Nurses’
Health Study I et une étude comprenant une cohorte de patients atteints
d’insuffisance cardiaque, les concentrations en EA ont été corrélées à l’augmentation de biomarqueurs pro-inflammatoires (sTNFR-2, sICAM-1, sVCAM-1), contrairement au tPA (50, 51). Plusieurs études démontrent que EA provoque une réponse physiologique différente des R-TFA, car le tVA et tPA ne semblent pas avoir des effets sur l’inflammation (17, 19, 45). Également, l’activité pro-inflammatoire induite par les TFA peut altérer la fonction endothéliale et ainsi augmenter les risques CV (17). Dans les cellules endothéliales, l’EA est associé à une augmentation de la production de superoxyde et d’IL-6, et augmente
l’expression génique de cytokines pro-inflammatoires NFκB-dépendantes tel que le TNF-α, ICAM et iNOS (45). A contrario, dans cette même étude le tVA n’a pas induit l’activation du NFκB ni augmenté la production de superoxyde. Les acides gras libres en circulation et l’hyperglycémie activent la voie NF-κB, via la stimulation des récepteurs TLR-2 et TLR-4 notamment dans les monocytes et les adipocytes (52, 53). Ces données révèlent le lien existant entre l’inflammation, l’obésité et le DT2.
Figure 3. Schématisation de la relation entre Inflammation et la résistance à
l’insuline dans la pathologie du diabète de type 2.
3. Obésité et accumulation de gras hépatique
Dans l’étude Cardiovascular Health Study, une alimentation riche en tPA est associée à une diminution de la masse adipeuse (41). Cependant une autre étude a montré que le tPA en faible quantité dans les tissus adipeux est corrélé à une meilleure perte de poids (54). Une étude a démontré qu’une alimentation composée de beurre enrichi en tVA sur une durée 4 semaines n’a pas affecté le poids d’hommes et de femmes en santé (55, 56). Selon Kratz et al. le tVA réduirait le gras hépatique, améliorait la sensibilité à l’insuline au niveau hépatique ainsi que la
tolérance au glucose, en stimulant la β-oxydation et en inhibant la néolipogénèse dans le foie (42).Une étude similaire a montré qu’une alimentation supplémentée en tVA préviendrait l’accumulation de tissus adipeux chez des rats diabétiques obèses (57). En effet, le tVA améliorerait l’IR, diminuerait l’accumulation de tissus adipeux, ainsi que la sécrétion de triglycérides au niveau hépatique et intestinal (57).
4. Les récepteurs activés par les proliférateurs de peroxysomes (PPAR)
De plus, il a été démontré que les TFA pouvaient avoir un effet direct sur la régulation de l’expression génique (58). Les mécanismes des R-TFA sur l’IR et le DT2 seraient liés à la capacité d’activer les récepteurs activés par les proliférateurs de peroxysomes (PPARs) et donc à l’origine de la transcription de gènes impliqués dans la signalisation à l’insuline (59). Le tVA est un ligand potentiel des récepteurs PPARs et activerait l’expression des PPAR-γ et PPAR-α chez les rats. (59) De plus, en impactant la voie de signalisation de l’insuline, tVA augmenterait la réplication des cellules β et, en conséquence, la biogénèse et la sécrétion d’insuline (60). En conclusion, le tVA semble avoir des effets neutres sur l’obésité, l’IR et les marqueurs pro-inflammatoire. Inversement, l’EA a des effets néfastes sur les lipides sanguins, favorise la résistance à l’insuline et la production de médiateurs de l’inflammation. Bien que les études avec le tPA sont limitées, il semble avoir des effets bénéfiques sur l’IR et les marqueurs inflammatoires. Ces données divergentes indiquent que les effets physiologiques des TFA peuvent être fonction de la longueur de la chaîne de l’acide gras et du positionnement de la double liaison.
La micro- et nanoencapsulation dans l’alimentation
Principes généraux
Dans le domaine pharmaceutique, lorsqu’un médicament est utilisé, celui-ci ne se distribue pas uniquement sur son lieu d’action mais se distribue, via la circulation systémique, à d’autres organes où il peut entrainer divers effets indésirables. En parallèle, dans le corps, de nombreuses enzymes peuvent dégrader partiellement le médicament (métabolisme) avant que celui-ci n’arrive sur son lieu d’action. En nanomédecine, des vésicules nanométriques peuvent être utilisées pour encapsuler, cibler et relarguer spécifiquement un principe actif dans une cellule ou organe cible (61). Par exemple, les particules nanométriques sont capables de protéger les acides nucléiques contre la dégradation par les nucléases (62).
L’idée étant de préserver le principe actif en l’encapsulant dans une vésicule qui servirait de réservoir et de transporteur, qui le protègerait des attaques extérieures. Les nanoparticules sont couramment utilisées en thérapeutique mais plus récemment dans les produits alimentaires (63). La création de transporteurs pour des nutraceutiques hydrophobes est un besoin croissant pour la protection des molécules contre l’oxydation et la dégradation enzymatique. Ainsi, l’encapsulation de molécules bioactives à l’aide de ces systèmes vésiculaires permet de répondre aux besoins spécifiques de l’industrie agroalimentaire (64, 65). La taille micro- ou nanométrique des vésicules permet une grande surface de contact avec le milieu, améliore la stabilité et la conservation des produits alimentaires. Actuellement, plusieurs applications de ces systèmes ont été utilisées dans l’alimentation pour supplémenter les aliments en vitamines, antimicrobiens, colorants, ou en saveurs. Dans l’alimentation, on retrouve principalement les nanovésicules de type lipidique. Parmi les formes lipidiques on retrouve notamment les liposomes et nanoémulsions qui permettent d’encapsuler et véhiculer des composés hydrophobes d’intérêt nutritionnel ou fragiles (ex : arômes), sensibles aux dégradations physico-chimiques. Les formes non-lipidiques peuvent être préparées à partir de polymères, hydrophiles, hydrophobes ou amphiphiles. Par exemple, en sciences des aliments, les polymères peuvent être formés à partir de protéines tel que l’albumine, la gélatine
ou le collagène et peuvent être associés à des polysaccharides tels que l’alginate et le chitosan (66).
L’encapsulation dans l’alimentation
L’encapsulation a des applications prometteuses dans la nutrition humaine, en particulier pour le développement d’aliments fonctionnels (67). Entre autre, l’encapsulation permettrait la dispersion des nutraceutiques insolubles dans un milieu aqueux (68). L’encapsulation de vitamines (69), oméga-3 (68, 70-73), d’acides gras (24), huiles comestibles (74) par des transporteurs vésiculaires a déjà été établie. L’intérêt d’ajouter des transporteurs nanométriques à un produit alimentaire permet de lui créer de la valeur ajoutée, que ce soit du point de vue nutritif, organoleptique, cosmétique ou encore pour en prolonger la conservation (8,13). Les liposomes, les émulsions et complexes protéiques peuvent permettre d’encapsuler et de maximiser la biodisponibilité de composés hydrophobes. Plusieurs méthodes d’encapsulation ont été décrites pour chacune d’entre elles. Parmi ces techniques d’encapsulation dans l’alimentation, les émulsions et les liposomes étaient les plus représentés (22-25, 69-72).
1. Les émulsions
La formation d’une émulsion résulte du mélange de trois ingrédients : huile, eau et émulsifiant. Les proportions de ces trois ingrédients sont importantes pour assurer la dispersion de la phase lipidique dans la phase aqueuse. L’architecture des micelles formées se distingue par une structure « cœur – coquille » composée de régions hydrophobes (cœurs interne) et de molécule amphiphiles (coquille externe), créant un espace de stockage délimité permettant le transport de molécules lipophiles. La technique décrite par McClements et al. consiste au mélange des phospholipides et des composés hydrophobes à encapsuler, en présence de tensioactifs (polysorbates, dérivés d’acides gras) pour obtenir une émulsion grossière (75). Ensuite, la taille des systèmes (50-500 nm) est définie par ultrasons ou homogénéisation à haute pression. Ce sont des méthodes à « haute énergie » consistant à appliquer des forces perturbatrices élevées capables de provoquer la
rupture des gouttelettes d’huile et de les disperser dans la phase de l’eau. Les approches dites à « faible énergie » reposent sur la formation de minuscules gouttelettes d’huile au sein d’un mélange huile-eau-tensioactifs, telles la méthode l’émulsification spontanée (76, 77).
Les vésicules de taille nanométrique (10-100 nm) sont utilisées pour supplémenter des aliments et améliorer leur valeur nutritive. Par exemple, la phase huileuse des émulsions peut être composée de lipides d’intérêt nutritionnels ou biocompatibles, tel que des triglycérides, des huiles essentielles et des huiles aromatiques pour maximiser les effets nutritionnels. Actuellement, plusieurs actifs ont été encapsulés dans l’alimentation tels que des huiles essentielles, des caroténoïdes, des oméga-3, des antioxydants, des quinones et des phytostérols (Tableau 3). Puisque l’encapsulation des acides polyinsaturés (PUFA) permet de stabiliser ces molécules contre l’oxydation et d’en améliorer les propriétés organoleptiques, plusieurs produits supplémentés en oméga-3 sont disponibles sur le marché (74, 78).
Tableau 3. Ingrédients bioactifs lipophiles encapsulés dans des émulsions (Adapté
de Trujillo et al. 2017)
2. Liposomes
Les liposomes ont été rapportés pour la première fois dans les années 1970 comme modèle de membrane biologique (79). Depuis, ils ont été utilisés pour le transport de médicaments et d’enzymes. Dans le domaine pharmaceutique, les liposomes figurent maintenant parmi les systèmes d’encapsulation les mieux caractérisés (80)
et plusieurs formulations liposomales sont disponibles (81). Dans le domaine de l’alimentation et des aliments fonctionnels, les liposomes sont utilisés pour encapsuler des molécules d’interet nutritionels telles que le β-carotène, les phytostérols, le lycopène ou l’ubiquinone (82).
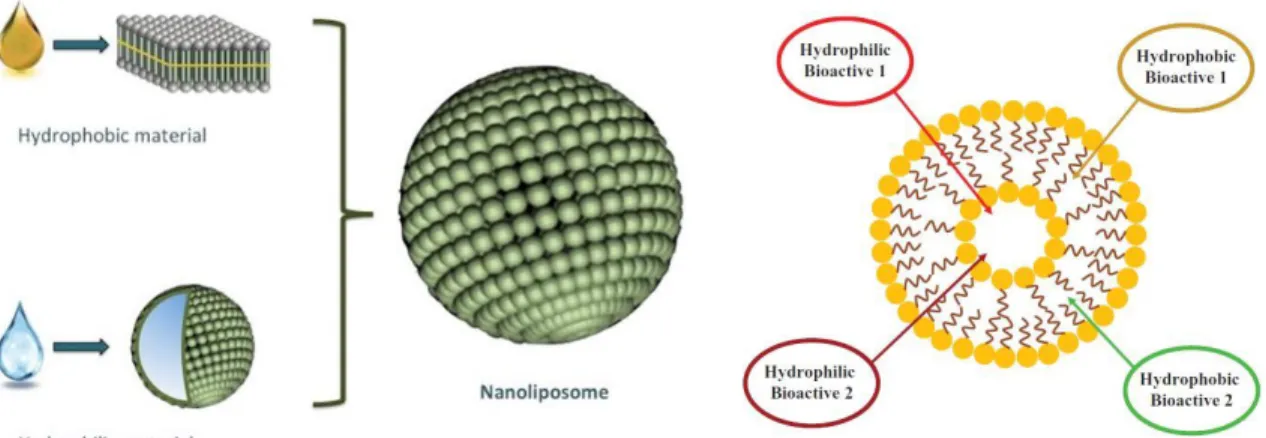
Les nano-liposomes sont définis comme des vésicules (50-500 nm) limitées par une bicouche lipidique délimitant un compartiment aqueux. Les liposomes sont principalement composés de phospholipides, molécules amphiphiles composées d’une tête polaire (groupement phosphate) et une partie hydrophobe (deux chaînes d’acides gras). Hope et al. ont décrit une méthode de fabrication permettant la préparation de vésicules unilamellaires de taille contrôlée (83). Cette méthode consiste à hydrater un film de phospholipides avec une solution aqueuse et à extruder le mélange obtenu à travers des membranes de polycarbonate possédant des pores de taille définie. Plus en détails, lorsque les phospholipides sont hydratés, ils forment spontanément des bicouches où les parties hydrophobes interagissent entres elles pour minimiser les contacts avec l’eau. La structure initiale obtenue est multi-lamellaire, principalement constituée de plusieurs vésicules sphériques concentriques, dont la distribution de taille est très large. Pour uniformiser la taille des liposomes, les vésicules multi-lamellaires sont extrudées à travers une membrane ayant des pores de 50 à 500 nm.
On peut adapter cette méthode pour encapsuler des composés hydrophobes ou hydrophiles. Ceux-ci sont rajouté à l’étape de formation du film lipidique ou à l’étape d’hydratation, respectivement. Les composés hydrophobes à encapsuler sont solubilisés en présence des phospholipides dans des solvants organiques. Les solvants sont évaporés, puis le film lipidique est hydraté avec ou sans solutions comportant des composés hydrophiles. Ainsi, des composés hydrophiles et hydrophobes peuvent être encapsulés ou co-encapsulés dans une structure liposomale.
3. Les complexes protéiques
Les protéines alimentaires, naturellement présentes dans les aliments, offrent un grand potentiel en tant que matériau pour la préparation de nanoparticules et de microparticules. Des complexes protéiques issus de protéines du lait, notamment la caséine, la lactoferrine et/ou la β-lactoglobuline, peuvent être utilisés pour encapsuler des composés hydrophobes. Notamment, la β-caséine bovine est une protéine de lait abondante, amphiphile, qui s’assemble en structures micellaires stables dans des solutions aqueuses. Par exemple, quelques études ont montré que la β-caséine pouvaient être utilisée pour encapsuler, stabiliser et protéger des molécules bioactives tel que la vitamine D2 (84), le thymol (85) et la curcumine (86).
Plusieurs techniques d’encapsulation utilisant des protéines existent pour transporter des molécules bioactives (87). La coacervation complexe de biopolymères est une des techniques qui a démontré une meilleure efficacité d’encapsulation (jusqu’à 99%) et un bon contrôle sur la libération des bioactifs (88). Plusieurs des systèmes répertoriés reposent sur la coacervation complexe entre les protéines et les polysaccharides (89, 90). Elle donne lieu à la formation de complexes électrostatiques (coacervats) protéine-polysaccharide qui conduisent à la formation de composés solubles neutres. Le couple de polymères le plus utilisé par le procédé de coacervation complexe est le couple gélatine-gomme d’acacia. Ce couple de polymère a d’ailleurs déjà été utilisé pour l’encapsulation d’huile riche en acides gras polyinsaturés (PUFA) (91). Ces biopolymères peuvent interagir par l’intermédiaire d’interactions attractives ou répulsives, et ainsi former des systèmes monophasiques ou biphasiques (66).
La formation d’un système d’encapsulation protéine-protéine est appelé coacervation complexe. Ce processus en deux étapes a été décrit par Chapeau et
al., et consiste aux mélanges de deux solutions comportant des protéines
différentes. Premièrement, le bioactif est incorporé dans une solution de protéine A (92). Ensuite, une solution contenant le protéine B, portant des charges électriques opposées, est ajouté à la solution A. Les coacervats obtenus piègent le composé bioactif par interactions électrostatiques entre les deux protéines, en formant un coassemblage supramoléculaire protéine-protéine. Des liaisons hydrophobes de
faible énergie se forment entre ces protéines et le composé à encapsuler, formant une micelle. Structurellement, la micelle (50–500 nm) est composée de molécules possédant une tête polaire hydrophile dirigée vers le solvant et une chaîne hydrophobe dirigée vers l'intérieur, formant un agrégat sphérique (93). Étant donné que la coacervation est la résultante des interactions électrostatiques, la nature des protéines, les rapports stœchiométriques protéine A – protéine B, le pH et la force ionique des solutions peuvent affecter le processus de coacervation (92, 94).
4. La co-encapsulation
La co-encapsulation de molécules bioactives est une technique prometteuse pour développer des produits alimentaires fonctionnellement actifs. Plusieurs composés tel que les antioxydants, les vitamines, les huiles essentielles, les saveurs et les antimicrobiens pourraient être co-encapsulés dans des systèmes colloïdaux (95, 96). La co-encapsulation est particulièrement utile car ce concept tient compte de l’effet synergique de plusieurs éléments bioactifs dans l’amélioration des bienfaits pour la santé. Cette nouvelle approche visant à co-encapsuler deux ou plusieurs ingrédients bioactifs dans une vésicule unique a, par exemple, été réalisé par Chen
et al. (69, 97, 98) (Figure 4). Dans leur étude, trois composés bioactifs lipophiles
comprenant de l’huile de poisson, du limonène et des esters de phytostérol ont été co-encapsulés dans le cœur de la structure vésiculaire (97) (Figure 5). Aussi, suivant le type d’encapsulation (micelles ou liposomes) des molécules hydrophiles et hydrophobes peuvent être co-encapsulées (Tableau 4).
Figure 4. Co-encapsulation de plusieurs composés bioactifs dans une vésicule.
Figure 5. Co-encapsulation de composants bioactifs hydrophiles et hydrophobes
dans les liposomes (adaptée de Tavano et a.l, 2014)
Tableau 4. Études sur la co-encapsulation de bioactifs pour matrice alimentaire.
L’encapsulation de composés hydrophobes et particularité des
acides gras.
1. L’encapsulation d’acides gras
L’encapsulation de composés hydrophobes et plus précisément des acides gras a été répertoriée dans plusieurs études. Les liposomes et les émulsions sont les techniques d’encapsulations les plus retrouvées. Parmi ces acides gras on trouve de l’huile de poisson (riche en oméga-3) (99) (70-72), de l’huile de lin (riche en ALA) (25), des oméga-3, et des oméga-6 (59). Plus spécifique aux acides gras trans, seul l’encapsulation de CLA dans des nano-émulsions a été rapportée. (Tableau 5).
Tableau 5. Études encapsulant des composés hydrophobes (acides gras)
Références Acide gras d’encapsulation Techniques
(Ojagh, 2018) Huile de poisson
(PUFA n-3 longue chaîne)
Liposomes
(Ghorbanzade et al., 2017) Huile de poisson
(PUFA n-3 longue chaîne)
Liposomes
(Komaiko et al., 2016) Huile de poisson
(PUFA n-3 longue chaîne)
Nano-émulsions
(Marsanasco et al., 2015) Omega-3, omega-6, (Tocophérol)
Liposomes
(Sugasini et al., 2013) Huile de poisson
(PUFA n-3 longue chaîne)
Liposomes
(Kim et al., 2013) CLA
(acide linoléique conjugué)
Nano-émulsions
(Sugasini et al., 2012) Huile de lin
(acide alpha-linolénique)
2. Les raisons d’encapsuler des composés hydrophobes
Augmenter la solubilité de substances hydrophobes
Dans leur forme la plus simple, les vecteurs colloïdaux peuvent être utilisés pour augmenter la solubilité aqueuse d’un principe actif. Il peut être avantageux de solubiliser le principe actif prometteur dans la phase hydrophobe d’un système colloïdal pour permettre son administration et freiner les problèmes de solubilité dans les milieux biologiques. Spécifiquement à l’alimentation, ces vecteurs permettraient l’amélioration de la dispersion des molécules dans les aliments. Ces systèmes permettent la stabilisation de systèmes hétérogènes et peuvent contribuer à améliorer la dispersion des molécules hydrophobes dans les matrices aqueuses. Les nanoémulsions, les vésicules de phospholipides (17), mais aussi les complexes protéiques (18) sont utilisés pour solubiliser différentes molécules bioactives dans des matrices alimentaires (5). À titre d’exemple, les micelles de caséine (une protéine du lait) allant de 20-400 nm contribuent naturellement à la solubilisation des lipides dans le lait (100). Plusieurs composés d’intérêts nutritionnels tel que des : phytostérols (97), oméga-3 (101), lycopène (82), ou autres composés bioactifs ont déjà été encapsulés.
Protéger contrer les dégradations physiques et chimiques
Certains composés bioactifs particulièrement fragiles doivent être protégés afin de pouvoir exercer leur effet thérapeutique in vivo. Dans le cas des huiles (composés hydrophobes) il est essentiel de protéger le composé encapsulé des dégradations chimiques incluant l’oxydation ou encore l’humidité, la lumière (photodégradation) et la température. Plusieurs études ont démontré que les vecteurs colloïdaux nanométriques peuvent également prévenir la dégradation de molécules bioactives durant l’entreposage ou la transformation des aliments (5,6,8,13–15,19). En ce sens, une huile de poisson encapsulée avait une meilleure stabilité à l’oxydation par rapport à une huile de poisson libre (non encapsulée) (99). Ces fonctions peuvent être accomplies en protégeant physiquement la molécule encapsulée de l’oxydation ou de la lumière en la séquestrant dans une enveloppe protectrice (18).
Au-delà de la stabilité chimique des composés encapsulés, les systèmes hétérogènes (comprenant une phase hydrophile et une phase hydrophobe) doivent aussi maintenir leur intégrité physique. La fusion des vésicules nanométriques correspond à la formation de nouvelles structures colloïdales. Spécifiquement, elle résulte d’un réarrangement et d’une relocalisation des lipides de deux membranes lipidiques adjacentes de liposomes (102). C’est un processus irréversible dans lequel la structure d’origine est définitivement perdue (103). La coalescence est une rupture irréversible de l’émulsion conduisant à la séparation de phase visible dans une formulation. Elle résulte d’une collision entre deux gouttelettes, entrainant une augmentation critique de l’épaisseur de la membrane, qui finit par rompre définitivement. Aussi, on retrouve des mécanismes de « crémage » des formulations dans l’industrie agro-alimentaire. Ces changements observés résultent d’une séparation gravitationnelle dans une solution initialement non homogène, généralement due à la différence de densité entre deux phases. Visuellement, cette séparation est caractérisée par des gouttelettes d’émulsion qui tendent à se regrouper à la surface du liquide ou à sédimenter (104). L'agrégation des vésicules dans une formulation serait un mécanisme physicochimique qui dépendrait entre autres du pH et de la température (22). Également, la taille nanométrique des vésicules augmente la stabilité physique des formulations en diminuant les risques de fusion, de séparation gravitationnelle et d’agrégation possible entre les particules. Par rapport aux particules de plus grandes tailles, les vésicules nanométriques sont imperceptibles à l’œil nu, sédimentent moins vite et sont donc plus stables. De ce fait, de nombreux paramètres peuvent avoir une influence sur le diamètre moyen des particules. Le processus de formulation (température, équipements, méthode d’encapsulation) (105-109), les conditions de stockages ou encore la composition lipidique (107, 110-113) sont des paramètres communs impliqués dans la caractérisation de la taille des vésicules. D’ordre général, les tailles des particules augmentaient avant l’apparition des modifications macroscopiques. Ainsi, la mesure de la taille des particules dans la caractérisation des formulations est un bon indicateur de stabilité physique.
Augmenter la biodisponibilité in vivo
En pharmaceutique, les particules nanométriques (30-200nm) sont capables d’augmenter la biodisponibilité orale des molécules peu solubles dans l’eau (114).
Dans leur étude pharmacocinétique, Penalva et al. ont comparé la biodisponibilité orale de l’acide folique (1 mg/kg) encapsulé dans des micelles de caséines et une supplémentation en acide folique classique (non encapsulé) (115). Dans cette étude, les animaux qui avaient reçu la formulation encapsulant l’acide folique avait des niveaux sériques plus élevés que ceux qui avaient reçu la solution en vitamine non-encapsulée. La biodisponibilité de l’acide folique sous forme de nanoparticules de caséine était environ 50% plus élevée que celle mesurée avec la solution aqueuse traditionnelle. De même, la biodisponibilité de diverses autres molécules lipophiles peut être augmentée lorsqu’elle est encapsulée dans des liposomes. Chez des rats, une formulation encapsulant de la curcumine dans des liposomes a augmenté deux fois plus la concentration plasmatique qu’une solution de curcumine libre (non encapsulée) (98). Également, par apport à une forme libre, les niveaux plasmatiques de la curcumine ont été 22 fois plus importants quand la molécule a été administrée sous forme d’émulsion (116). Aussi, la biodisponibilité de la vitamine E (α-tocophérol) est trois fois plus importante chez le rat, lorsqu’il est administré dans des nanoparticules lipidiques solides (117). Pareillement, les niveaux de c-oryzanol plasmatique ont doublé lorsqu’il a été administré sous forme de microémulsion (118). Des résultats similaires ont été rapportés par Sugasini et al. (24). Dans leur étude, ils ont encapsulé de l’huile de poisson dans des microémulsions à base de chitosan (1,293–1,296 nm), de gomme d’acacia (1,095– 1,099 nm), de protéine de lactosérum (702–708 nm) et de lipoïde (203–209 nm). Comparativement à l’huile non encapsulée, la biodisponibilité (in vitro) des acides eicosapentaénoïque et docosahexaénoïque d’huile de poisson a été augmentée de 7, 9, 23 et 68% respectivement.
Améliorer les propriétés organoleptiques
Dans le processus de développement d’un produit alimentaire, les propriétés physicochimiques et sensorielles (apparence, couleur, goût, odeur) ont un effet considérable sur l’appréciation des consommateurs. En encapsulant certaines molécules au goût désagréable, il est possible d’en améliorer la saveur ou l’odeur (palatabilité) (20), comme par exemple dans certains suppléments de polyphénols extraits du thé vert (21). Barrow et al. ont démontrer que le microencapsulation de PUFA permet de les protéger contre l’oxydation et de diminuer le goût et l’odeur indésirables (119). Dans un autre étude, de l’huile de poisson a été encapsulée puis lyophilisée pour produire un yogourt enrichi en oméga-3 (120). Dans cette étude, il n’y avait pas de différence significative entre les échantillons de yogourt (avec et sans huile de poisson) en termes de texture. Aussi, la plupart des panélistes préféraient l’échantillon contrôle et le yogourt enrichi (l’huile de poisson encapsulé) comparé à des yogourts comportant de l’huile de poisson non encapsulée.
Chapitre 1. Problématique et objectifs
Les informations présentées dans le chapitre précédent nous permettent d’affirmer que :
Les effets de la consommation des TFA sur le DT2 et ses facteurs de risques sont controversés et dépendraient de leur source : les acides gras provenant des ruminants (R-TFA), tels le tVA et le tPA, pourraient ne pas avoir le même effet que ceux d’origine industrielle (I-TFA), tel l’EA. Spécifiquement, les R-TFA semblent avoir des effets bénéfiques sur le DT2 et les facteurs de risques associés. Cependant, peu d’études sur le rôle spécifique des R-TFA in vivo ont été effectuées. Pour obtenir des réponses claires quant aux éventuels effets bénéfiques des R-TFA sur le DT2 et ses facteurs de risques, indépendamment des autres constituants de la nourriture, il incombe de pouvoir fournir un apport en TFA homogène aux animaux.
La problématique de mon projet de maitrise est la suivante : À ce jour, aucune donnée quant à l’encapsulation de R-TFA (EA, tVA et tPA) n’a été recensée. Les vecteurs colloïdaux nanométriques sont de plus en plus utilisés dans l’alimentation (63) et dans d’autres applications biomédicales. Des composés hydrophobes tels que des oméga-3 (68, 70-73), des acides gras (24), des vitamines (69), et des molécules utilisées en thérapeutiques (69, 98) ont déjà été encapsulés par le biais d’émulsions, de liposomes, et de complexes protéiques (22-25, 69-72).
Nous avons pour objectif général d’évaluer l’effet des R-TFA de manière isolée sur le DT2 et ses facteurs de risques, sans les autres constituants du lait. Or, les produits laitiers contiennent une large variété de nutriments et de composants dont certains pourraient moduler, seuls ou en combinaisons, les facteurs de risques du DT2. Mon objectif spécifique est de développer une formulation stable permettant d’encapsuler les TFA. Précisément, une formulation de R-TFA stable et biodisponible favoriserait l’étude de l’effet des TFA dans un modèle animal.
Cet objectif a été décomposé en trois sous-objectifs spécifiques :
1. Déterminer la formulation idéale permettant d’encapsuler les TFA (EA, TVA et TPA)
2. Confirmer que la formulation est biodisponible en évaluant la biodisponibilité in
vivo (pharmacocinétique)
3. Démontrer la versatilité de l’approche par la co-encapsulation des TFA avec d’autres molécules hydrophiles et hydrophobes (par exemple la vitamine D3 et la
L-leucine)
L’hypothèse générale de ma maîtrise est qu’en s’inspirant des méthodes utilisées dans le domaine pharmaceutique, il serait possible de développer une formulation encapsulant les TFA afin d’en faciliter l’étude dans des modèles animaux.
Chapitre 2. Drinkable lecithin nanovesicles to study
the biological effects of hydrophobic nutrients and
molecules
Nanovésicules de lécithine buvables pour étudier les effets biologiques des nutriments et des molécules hydrophobes
Résumé
Objectif : La faible solubilité dans l’eau des molécules bioactives complexifie parfois les études chez les animaux où des doses spécifiques doivent être administrées sans utilisation de solvants. Ici, des nanovésicules de lécithine sont proposées pour faciliter des études in vivo avec des macronutriments hydrophobes. L’impact biologique exact des TFA provenant des ruminants par rapport aux TFA d’origine industrielle n’est toujours pas clair. Le présent travail évalue la faisabilité de l’utilisation de nanovésicules de lécithine comme sources biodisponibles de TFA dans les modèles animaux. Méthodes et résultats : En utilisant des méthodes adaptées de l’industrie pharmaceutique, les phospholipides de lécithine ont été utilisés pour créer des vésicules encapsulant trois TFA : l’acide élaïdique, l’acide
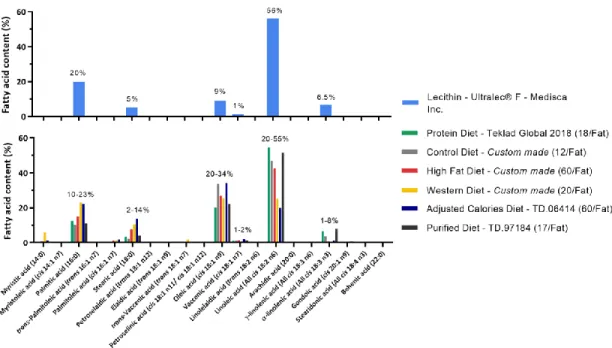
trans-vaccénique et l’acide trans-palmitoléique. La composition en acides gras des
phopholipides de lécithine a été trouvée en abondance dans divers types de nourriture pour rongeurs, fournissant des vésicules de contrôle avec des effets limités sur les profils d’acides gras des animaux. A contrario, les TFA sont biodisponibles après administration orale chez les animaux lorsque ceux-ci sont encapsulés dans les vésicules. Enfin, la palatabilité des formulations a été évaluée dans les études comportementales, et les résultats suggèrent que ces formulations hydrodispersibles sont acceptables pour les études nutritionnelles. Conclusion : Les nanovésicules actuelles offrent un outil élégant pour fournir efficacement des acides gras hydrophobes aux animaux. Ce système ouvre la voie à d’autres études qui permettront d’élucider les effets moléculaires spécifiques des TFA d’origines industrielles et ruminantes.
Abstract
Drinkable lecithin nanovesicles to study the biological effects of hydrophobic nutrients and molecules
Élodie Chotard1, Pierre Julien2, Line Berthiaume2, Iwona Rudkowska3*, Nicolas
Bertrand1*
1. Faculty of Pharmacy, CHU de Quebec Research Center, Université Laval, 2705 Laurier Blvd, Québec G1V 4G2, Canada
2. Department of Medicine, Faculty of Medicine, CHU de Quebec Research Center, Université Laval, 2705 Laurier Blvd, Québec G1V 4G2, Canada 3. Department of Kinesiology, Faculty of Medicine, CHU de Quebec Research
Center, Université Laval, 2705 Laurier Blvd, Québec G1V 4G2, Canada
Correspondence to:
Iwona Rudkowska
CHU de Quebec Research Center – Université Laval 2705 Laurier Blvd, T4-55B
Quebec City, QC, G1V 4G2 Tel +1 (418) 525-4444 ext 46380
iwona.rudkowska@crchudequebec.ulaval.ca
Nicolas Bertrand
CHU de Quebec Research Center – Université Laval 2705 Laurier Blvd, T4-13
Quebec City, QC, G1V 4G2 Tel +1 (418) 525-4444 ext 46302
Scope: The low water solubility of bioactive molecules sometimes complexifies studies in animals where specific doses must be administered without the use of solvents. Herein, nanovesicles of lecithin are proposed to facilitate in vivo studies with hydrophobic macronutrients. The exact biological impact of trans fatty acids (TFA) from ruminant compared to TFA of industrial origins is still unclear. The present work evaluates the feasibility of using nanovesicles of lecithin as bioavailable sources of TFA in animal models.
Methods and results: Using methods adapted from the pharmaceutical industry, the phospholipid lecithin was used to create vesicles encapsulating three TFA: elaidic acid, trans-vaccenic acid and trans-palmitoleic acid. The fatty acid components of the phospholipid lecithin were found to be highly abundant in various types of rodent diet, providing control vesicles with limited effects on fatty acid profiles of animals. In opposition, when TFA were encapsulated in the vesicles, the TFA were found to be bioavailable after oral administration in animals. Finally, the palatability of the formulations was evaluated in behavioral studies. Results suggest the acceptability of these water-dispersible formulations for nutritional studies.
Conclusion: The present nanovesicles offer an elegant tool to efficiently deliver hydrophobic fatty acids to animal models. This system paves the way for further studies which will elucidate the molecular effects of TFA from industrial and ruminant origins.
Keywords: Microencapsulation, industrial fats, liposomes, pharmacokinetics, trans
1. Introduction
Fundamental molecular studies are sometimes hindered by the low water solubility of bioactive molecules such as macronutrients. In cell experiments, hydrophobic molecules must be solubilized in solvents showing inherent bioactivities (121). Upon introduction of these organic solutions to aqueous media, the decrease in solubility can trigger the precipitation of hydrophobic molecules and render the assessment of dose-activity relationships difficult. In animals, hydrophobic molecules are often incorporated to solid pellets of chow. The oral bioavailability of hydrophobic molecules delivered from solids can be hindered by poor solubilization in the gastro-intestinal tract (114, 122). This limitation is well-appreciated in pharmaceutical sciences (114, 122) but appears to be sometimes overlooked in nutrition and food sciences. Finally, assessing the total oral intake from solid diets necessitates individual housing of animals, as well as frequent weighing of mangers (123); these two procedures can be stressful to animals and interfere with some biological readouts (124). Altogether, these elements rationalize the development of additional tools facilitating the study of hydrophobic molecules in the field of nutrition and food sciences.
In the past decades, nano-sized carriers have been proposed as differentiated technologies to protect and deliver drugs as well as other bioactive molecules (125). In pharmaceutical sciences, nanotechnologies are able to increase the oral bioavailability of poorly water-soluble molecules (114), target specific tissues (126) or protect nucleic acids against degradation (62). Although various materials exist to prepare nano-sized carriers (125), systems prepared from phospholipids which are naturally-occurring amphiphilic molecules, are particularly appealing in food sciences. Specifically, liposomes are vesicles with aqueous cores and diameters of 50-200 nm which are prepared from the self-assembly of phospholipid bilayers. Phospholipids are present in food and are required for the absorption of fat from the gut lumen into the enterocytes and the lymph (127, 128). In the present study, lecithin, a phospholipid which is a common food additive, will be used to prepare nanovesicles containing trans fatty acids and facilitate the study of these