T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier
Discipline ou spécialité : Sciences et Génie des Matériaux
JURY
P. BACCHIN Professeur LGC, Université de Toulouse Président G. CABOCHE Professeur ICB, Université de Bourgogne Rapporteur C. GUIZARD Directeur de Recherches Saint-Gobain C.R.E.E., Cavaillon Rapporteur
L. ANTOINE Ingénieur ADEME, Angers Examinateur
J. MOUGIN Docteur Ingénieur CEA, Grenoble Examinateur
P. TAILHADES Directeur de Recherches CIRIMAT, Université de Toulouse Examinateur F. ANSART Professeur CIRIMAT, Université de Toulouse Directeur de thèse P. LENORMAND Maître de Conférences CIRIMAT, Université de Toulouse Invité
M. ZAHID Docteur Ingénieur EDF-EIFER, Karlsruhe, Allemagne Invité
Ecole doctorale : Sciences de la Matière
Unité de recherche : Institut Carnot CIRIMAT-UMR 5085
Directeur de Thèse : Pr. Florence ANSART
Présentée et soutenue par Mathilde RIEU
Le 5 novembre 2009
Titre :
Préparation par voie sol-gel et caractérisation d'une cellule complète SOFC sur support métallique poreux
Ces travaux ont été réalisés au CIRIMAT (Centre Interuniversitaire de Recherche et d’Ingénierie des MATériaux) de l’Université Paul Sabatier de Toulouse. Ce laboratoire est co-dirigé par Philippe TAILHADES, Directeur de Recherches CNRS, que je remercie de m’avoir accueillie et d’avoir accepté de participer à ce jury.
J’adresse mes sincères remerciements à Gilles CABOCHE, Professeur à l’Université de Bourgogne, et à Christian GUIZARD, Directeur de Recherches CNRS à Saint-Gobain C.R.E.E., pour avoir accepté de juger ce travail en qualité de rapporteurs.
Je remercie Patrice BACCHIN, Professeur à l’Université de Toulouse, d'avoir accepté de juger ce travail et de présider ce jury.
Je remercie également Julie MOUGIN, Docteur Ingénieur au CEA de Grenoble, d’avoir participé à ce jury et pour la collaboration fructueuse que nous avons eue dans le cadre du projet ANR CERAMET.
Mes remerciements vont également à Loïc ANTOINE, Ingénieur à l'ADEME, et Mohsine ZAHID, Docteur Ingénieur à EDF-EIFER, qui ont co-financé ces travaux, les ont suivis pendant ces 3 ans et ont participé à ce jury.
Je tiens à remercier tout particulièrement Florence ANSART, Professeur à l’Université de Toulouse, pour avoir dirigé cette thèse et aussi pour sa disponibilité malgré toutes ses responsabilités, pour nos discussions constructives et pour notre complicité.
Je remercie très sincèrement Pascal LENORMAND, Maître de Conférences à l’Université de Toulouse, pour avoir co-encadré ces travaux et aussi pour sa bonne humeur, sa disponibilité et pour les nombreuses discussions que nous avons eues.
Merci à Stephen SKINNER et son équipe (en particulier Ruth et Miguel) de l'Imperial College, pour leur accueil, leur disponibilité et les bons moments passés à Londres.
Je remercie Laurent DESSEMOND et Nicolas GRUNBAUM du LEPMI à Grenoble avec qui j'ai eu beaucoup de plaisir à collaborer. Merci également aux partenaires du projet CERAMET ainsi qu'à la communauté française des piles SOFC (regroupée dans le GDR PACTE) pour les apports scientifiques et la convivialité des réunions.
Au sein du CIRIMAT, je remercie les personnes avec qui j'ai eu plaisir à travailler : Pierre A., Simone, Romain et les stagiaires M1. Merci également aux personnes qui étaient dans les bureaux voisins pour la bonne ambiance du bout de couloir, aux thésards pour les discussions informelles, au clan des fumeurs pour les pauses conviviales, aux valeurs sures du J'Go pour les bonnes soirées, aux collègues d'enseignement pour les bons moments passés en TP, et merci à tous ceux qui ont été des soutiens importants.
Sommaire
Introduction ... 1
Chapitre I – Bibliographie ... 5
I-1. Les piles à combustible ...6
I-1.1. Historique ...6
I-1.2. Différents types de piles à combustible...7
I-1.3. Avantages et inconvénients des piles à combustible ...8
I-2. Les SOFC ...9
I-2.1. Eléments constituant les piles SOFC ...10
I-2.1.a. L’électrolyte...10
I-2.1.b. L’anode...12
I-2.1.c. La cathode...14
I-2.1.d. L’interconnecteur...16
I-2.2. Evolution des technologies ...19
I-2.2.a. La technologie tubulaire ...20
I-2.2.b. La technologie planaire ...21
I-3. Procédés d’élaboration mis en œuvre dans ces travaux ...23
I-3.1. Métallurgie des poudres...24
I-3.2. Synthèse sol-gel ...24
I-3.2.a. Présentation et définitions ...25
I-3.2.b. La voie alcoxyde...25
I-3.2.c. La voie polymère ...27
I-3.3. Dip-coating ...28
I-3.3.a. Mise en forme de revêtements minces ...29
I-3.3.b. Mise en forme de revêtements épais...29
I-3.4. Frittage SPS ...29
Sommaire
II
Chapitre II - Techniques expérimentales ... 45
II-1. Caractérisations des précurseurs ...46
II-1.1. Mesures rhéologiques ...46
II-1.2. Analyses thermogravimétrique et thermique différentielle...46
II-1.3. Analyses chimiques...47
II-1.4. Mesures de surface spécifique ...47
II-1.5. Granulométrie...47
II-1.6. Potentiel Zeta ...48
II-2. Caractérisations des matériaux ...48
II-2.1. Estimation des densités relatives des céramiques massives ...48
II-2.2. Analyse dilatométrique ...49
II-2.3. Analyses de surface...49
II-2.4. Tests d’adhérence ...49
II-3. Caractérisations usuelles...50
II-3.1. Microscopie électronique à balayage ...50
II-3.2. Diffraction des rayons X ...51
II-3.2.a. Description des diffractomètres...51
II-3.2.b. Exploitation des données ...52
II-4. Fonctionnalités des composants ...54
II-4.1. Mesures de perméation ...54
II-4.1.a. Le support poreux en Ni ...55
II-4.1.b. L’électrolyte...55
II-4.2. Mesures électriques ...56
II-4.2.a. Montage ...56
II-4.2.b. Traitement des données ...57
II-4.3. Propriétés électrochimiques ...58
II-4.3.a. Etude par spectroscopie d’impédance complexe...58
II-4.3.b. Caractérisations électrochimiques de cellules complètes...63
Chapitre III - La demi-cellule "support métallique - anode" ... 67
III-1. Le support métallique...68
III-1.1. Le support métallique commercial ...68
III-1.1.a. L’acier dense...68
III-1.1.b. L’acier poreux...70
III-1.2. Le support poreux en Ni ...71
III-1.2.a. La poudre de Ni ...72
III-1.2.b. La pastille poreuse en Ni ...75
III-2. L’anode ...77
III-2.1. La synthèse des poudres...77
III-2.1.a. La voie alcoxyde...77
III-2.1.b. La voie polymère ...87
III-2.2. Etude des propriétés électriques ...96
III-2.2.a. Mise en forme de pastilles ...97
III-2.2.b. Caractérisations électriques ...101
III-3. Vers la demi-cellule "support métallique - anode" ...103
III-3.1. Revêtement anodique sur plaque dense ...103
III-3.1.a. Revêtements minces ...103
III-3.1.b. Revêtements épais ...106
III-3.2. Revêtement anodique sur support poreux ...115
III-3.2.a. Revêtements minces ...116
III-3.2.b. Revêtements épais ...118
III-3.3. Discussion ...122
Sommaire
IV
Chapitre IV - La demi-cellule "électrolyte - cathode"... 127
IV-1. L’électrolyte...128
IV-1.1. Mise en forme...128
IV-1.2. Caractérisations ...130
IV-1.2.a. Etanchéité ...130
IV-1.2.b. Performances électrochimiques...130
IV-2. La cathode ...134
IV-2.1. Mise en forme des revêtements cathodiques sur électrolyte...134
IV-2.1.a. Optimisation de la composition de la barbotine ...136
IV-2.1.b. Réactivité ...138
IV-2.1.c. Préparation d’un revêtement interfacial de cérine gadoliniée ...139
IV-2.2. Choix de différentes architectures de cathodes et tests électrochimiques ...141
IV-2.2.a. Mise en forme de différentes architectures de cathode ...142
IV-2.2.b. Caractérisations électrochimiques ...145
Chapitre V - La cellule SOFC sur support métallique
poreux... 155
V-1. Assemblage des parties "support métallique - anode"
et "électrolyte - cathode"...156
V-1.1. Démarche et premiers essais...157
V-1.2. Assemblage avec du matériau d’électrolyte ...158
V-1.3. Assemblage avec du matériau d’anode...159
V-1.4. Conclusions ...160
V-2. Les différentes cellules complètes préparées...161
V-3. Caractérisation de cellules SOFC sur métal poreux support...162
V-3.1. Caractérisations d'une première cellule ...163
V-3.2. Caractérisations d’une deuxième cellule ...166
V-3.3. Conclusions ...172
V-3.4. Discussion ...172
V-4. Vers la protection du support métallique poreux...174
Références ...177
Introduction
De nos jours, pour pouvoir satisfaire les besoins croissants en énergie de la population, plus de 60 % de la production mondiale d’énergie provient des combustibles fossiles (charbon, pétrole, gaz naturel), environ 20% du nucléaire et le reste des sources d’énergie renouvelables (éolienne, hydroélectrique, géothermique, etc.) [1].
Toutefois, l’utilisation des ressources fossiles dans de telles proportions pose, d’une part, des problèmes d’environnement, notamment par l’émission de CO2 (gaz à effet de serre) et de gaz polluants (SO2, NOx, CO, CH4, chlorofluorocarbones, particules solides, etc.) et, d’autre part, la question de l’épuisement de ces ressources.
C’est pourquoi, plusieurs gouvernements, conscients de cette situation, ont signé le Protocole de Kyoto en 1997 qui vise à réduire et à stabiliser les émissions de CO2 pour la période 2008-2012, à des valeurs correspondantes à celles émises en 1990.
En parallèle, la recherche de nouvelles technologies de production d’énergie dites propres et efficaces, a été encouragée et entreprise dans plusieurs pays, afin de développer des systèmes de conversion ou de production d’énergie électrique moins dépendants des ressources fossiles et plus respectueux de l’environnement.
Les piles à combustible et en particulier les piles à combustible à oxyde solide – Solid Oxide Fuel Cells : SOFC – sont très attractives pour des raisons essentiellement liées à leur rendement énergétique élevé et à leur possibilité d’industrialisation [2]. La pile à combustible est un système qui permet la conversion directe de l’enthalpie libre de la réaction chimique entre un combustible et un comburant en énergie électrique.
Afin de rendre compétitive et exploitable la filière SOFC, la température de fonctionnement de ces systèmes doit être réduite de manière significative. Actuellement de 800-1000°C, une diminution de cette gamme de température de fonctionnement dans un domaine compris entre 600°C et 800°C, sans altération des performances de la pile SOFC, est un des buts recherchés. Ces températures de fonctionnement réduites imposent d'une
Introduction
2
part, un choix judicieux des matériaux des différents constituants du cœur de la pile SOFC et d'autre part, une optimisation de leur microstructure. De plus, dans le but d’une future commercialisation, le coût de ces systèmes céramiques doit être également réduit.
En France, afin de fédérer les recherches sur les piles à combustible SOFC, un groupement de recherche (GDR IT-SOFC puis GDR PACTE) existe depuis une dizaine d’années, associant plusieurs laboratoires universitaires et industriels [3].
Mon travail de thèse s’inscrit dans le cadre d’un partenariat entre le CIRIMAT, l’ADEME et EDF-EIFER et une partie du travail est également incluse dans le projet ANR CERAMET. L’objectif de cette thèse est de réaliser un empilement de revêtements de matériaux actifs de pile SOFC (anode, électrolyte, cathode) sur support métallique poreux. Cette nouvelle génération de cellules SOFC permettrait, par rapport aux configurations existantes (anode support ou électrolyte support), une diminution significative de l'épaisseur des matériaux céramiques ce qui réduirait en conséquence le coût de ces systèmes.
Les matériaux actifs du cœur de pile qui sont synthétisés et mis en forme dans le cadre de cette thèse correspondent aux formulations les plus performantes et les mieux maîtrisées actuellement dans la gamme de températures de fonctionnement visée (700-800°C). Il s’agit d’une cellule complète SOFC basée sur l’empilement Ni-YSZ (anode) / YSZ (électrolyte) / La2NiO4 (cathode), préparée par voie sol-gel. Le CIRIMAT est, en effet, reconnu, depuis de nombreuses années, pour ses compétences dans le domaine de l'élaboration de ces matériaux par des procédés de chimie douce à bas coût et en particulier par voie sol-gel.
Le support mécanique de la cellule est un métal poreux, bon conducteur thermique et électrique, qui permet la distribution des gaz au travers des pores. Cependant, l’utilisation d’un métal comme support de cellule implique une limitation des traitements thermiques à 800°C afin de conserver l’intégralité des propriétés mécaniques du métal et de limiter sa corrosion. La densification de l’électrolyte n’étant pas possible à une telle température, la stratégie envisagée consiste à préparer deux demi-parties : l’anode sur le métal poreux et la cathode sur l’électrolyte, suivie par une étape d’assemblage de ces deux blocs grâce à une colle céramique.
Ce manuscrit se divise en cinq parties. Après un rappel du contexte énergétique et quelques généralités sur les piles à combustible, le premier chapitre est consacré à une étude
bibliographique sur les matériaux et les différentes configurations de pile SOFC. Les procédés de synthèse et de mise en forme utilisés au cours de ces travaux sont présentés à la fin de ce premier chapitre. Les techniques expérimentales utilisées pour la caractérisation des matériaux et de leurs propriétés font l'objet du deuxième chapitre. Dans le troisième chapitre, différents supports métalliques sont tout d'abord décrits, avant de présenter la synthèse et la caractérisation du matériau d'anode et enfin la mise en forme de la demi-cellule "métal support - anode". L'élaboration et la caractérisation de l'électrolyte et de la cathode font l'objet du quatrième chapitre avec, pour objectif, l'élaboration de la demi-cellule "électrolyte - cathode". Enfin, le cinquième chapitre correspond à l’aboutissement du travail avec la préparation de cellules complètes SOFC sur métal poreux support ainsi que leurs caractérisations.
1. I.E.A,
Monthly Electricity Statistics, May 2009
INTERNATIONAL ENERGY AGENCY, 2009
2. P. Stevens, F. Novel-Cattin, A. Hammou, C. Lamy, M. Cassir, Piles à combustible
Techniques de l'Ingénieur D3340, 2000 3. Site internet du GDR PACTE,
Chapitre I - Bibliographie
Ce premier chapitre a pour objectif d’exposer l’état de l’art de la technologie pile à combustible et plus particulièrement celui relatif aux piles à combustible à oxyde solide (ou SOFC selon l’acronyme anglais de Solid Oxide Fuel Cells). Il a également pour but d’apporter les informations qui permettront d’orienter les choix scientifiques mis en œuvre dans le cadre de ce travail.
Tout d’abord, des généralités sur les piles à combustible sont présentées. Ensuite, nous nous intéresserons aux piles à combustible à oxyde solide, depuis leur principe de fonctionnement jusqu’aux matériaux qui les composent et leur évolution technologique. Dans une dernière partie, les procédés de synthèse et de mise en forme utilisés au cours de ces travaux sont décrits.
Chapitre I - Bibliographie
6
I-1.
Les piles à combustible
Une pile à combustible est un convertisseur électrochimique qui transforme directement l’énergie chimique de la réaction entre un combustible (généralement l’hydrogène) et un comburant (généralement l’oxygène de l’air) en énergie électrique. Dans le cas d’une pile "hydrogène/oxygène", la réaction globale est : H2 + ½O2 → H2O et elle est associée à la production d’électricité.
I-1.1.
Historique
C’est dans le milieu du 19ème siècle que Sir William Grove réalise la première pile à combustible en laboratoire [1]. Il s’agit d’une pile hydrogène/oxygène en milieu acide sulfurique dilué en contact avec des électrodes de platine. Mais ce n'est qu'à partir des années 1930 que les piles à combustible deviennent crédibles, grâce aux travaux de l'ingénieur anglais F. T. Bacon qui peut être considéré comme le pionnier de leur développement industriel [1]. En effet, les premiers travaux de Bacon sur une pile à combustible hydrogène/oxygène en milieu KOH aqueux conduisent à la réalisation en 1953 d'un premier prototype de puissance notable (1 A.cm-2 à 0,8V) qui servira de modèle pour les futures piles à combustible utilisées lors des missions spatiales APOLLO.
Les acteurs du domaine énergétique français ne restent pas à l’écart des travaux de l’époque mais pour des raisons de faisabilité technique ou pour des raisons stratégiques (choix d’autres filières de production d’électricité) les programmes sont progressivement arrêtés. Ce n’est que dans les années 1990 que les recherches reprennent, notamment dans le domaine automobile. En 1999, les recherches vont être encouragées (et financées) grâce à la création d’un réseau national de recherche technologique "pile à combustible" [2]. Elles sont poursuivies à l’heure actuelle par l’intermédiaire de projets financés par l’Agence Nationale de la Recherche (ANR) [3] ou d’autres organismes publics comme l’ADEME [4].
I-1.2.
Différents types de piles à combustible
Différents types de pile à combustible existent et leurs principales caractéristiques sont regroupées dans le Tableau I - 1 [1]. Leur dénomination est directement liée à la nature de leur électrolyte. Leur température de fonctionnement varie dans une large gamme (60-1000°C) couvrant ainsi un large champ d’applications. Parmi les applications stationnaires, on peut citer la production électrogène et la cogénération (électricité et chaleur). Dans le domaine des transports, les piles à combustible seraient utilisées comme groupe auxiliaire de puissance (APU : Auxiliary Power Unit) ou comme systèmes couplés à des batteries.
Description Électrolyte Température de fonctionnement Domaines d’application AFC
Alkaline Fuel Cell Pile à combustible alcaline
Hydroxyde
de potassium 60°C à 90°C Transport DMFC
Direct methanol Fuel Cell Pile à combustible au méthanol direct
Membrane
polymère 60°C à 120°C Portable PEMFC
Proton Exchange Membrane Fuel Cell Pile à combustible à membrane
Membrane polymère 60°C à 100°C Portable Stationnaire Transport PAFC
Phosphoric Acid Fuel Cell Pile à combustible à acide phosphorique
Acide
phosphorique 200°C Stationnaire MCFC
Molten Carbonate Fuel Cell Pile à combustible à carbonate fondu
Carbonate de métaux alcalins
650 °C Stationnaire
SOFC
Solid Oxide Fuel Cell Pile à combustible à oxyde solide
Céramique 600°C à 1000°C Stationnaire Transport
Tableau I - 1 : Principaux types de piles à combustible
La filière AFC était la première à être développée (applications spatiales), mais les problèmes liés à la gestion d’un électrolyte liquide corrosif ont limité sa progression. Au niveau actuel de la technologie, les DMFC sont limitées sur le plan de la puissance mais peuvent produire une faible quantité d'énergie sur une longue période. Ce
Chapitre I - Bibliographie
8
fonctionnement rend les DMFC appropriées pour des applications dans les téléphones ou les ordinateurs portables.
Malgré un coût encore élevé, les PEMFC ont un spectre potentiel d'applications très large, ce qui devrait leur ouvrir un marché important, notamment dans le domaine automobile. Les PAFC ont l'avantage de fonctionner à une température suffisamment élevée permettant une cogénération intéressante et un fonctionnement avec du gaz naturel. Cependant, l'utilisation d'un électrolyte liquide limite leur durée de vie (par évaporation de l'électrolyte), et les possibilités de réduire les quantités de métaux nobles utilisées sont faibles.
Pour la filière MCFC, l'utilisation d'un électrolyte très corrosif à haute température et l'évaporation de cet électrolyte limitent sa durée de vie et donc son marché potentiel. Les SOFC bénéficient d'un rendement électrique élevé et leur température de fonctionnement leur permet d'augmenter ce rendement. Par exemple, pour les systèmes de cogénération (électricité et chaleur), le rendement peut atteindre 80%. Nous reviendrons sur ce type de pile dans la suite de ce manuscrit.
I-1.3.
Avantages et inconvénients des piles à combustible
Les avantages et inconvénients des piles à combustible dépendent bien entendu du type de pile considéré, SOFC ou MCFC par exemple, mais aussi du type d’application visée : portable, stationnaire ou transport. Toutefois, des avantages et inconvénients récurrents à ces systèmes de conversion énergétique peuvent être cités.
Tout d’abord, les piles à combustible ont un rendement de conversion énergétique important par rapport à un moteur à combustion (30-35%) par exemple. Grâce à la conversion directe de l’enthalpie libre de la réaction chimique en énergie électrique, les pertes dues normalement à la combustion du combustible, puis à la conversion de cette chaleur de combustion en énergie mécanique et enfin de l’énergie mécanique en énergie électrique sont minimisées. Actuellement, le rendement de conversion en énergie électrique varie selon le type de pile et est généralement supérieur à 50 %. L'énergie non convertie en énergie électrique est émise sous forme de chaleur et est évacuée sous forme d'eau chaude ou de vapeur. Mais alors que, dans les grandes centrales de production
d'électricité, la chaleur est perdue, elle est ici valorisable. De plus le rendement électrique d'une pile à combustible n'est, quant à lui, pas dépendant de la taille de l'installation. Ceci va permettre la construction de petites unités, très proches des utilisateurs, qui non seulement fourniront l'énergie électrique mais également l'eau chaude qui pourra, par exemple, être utilisée pour le chauffage domestique. Le rendement global va alors pouvoir atteindre 80-90 %.
Les piles à combustible ont un avantage majeur qui est leur modularité dans le sens où leur taille peut être ajustée facilement en fonction de l’application visée et des gammes de puissance nécessaires, le rendement électrique étant indépendant de la taille de la pile. Elles peuvent par conséquent être disposées en différents endroits avec un minimum d’encombrement.
De plus, elles ne comportent pas de parties mobiles, leur fonctionnement se fait donc sans nuisances sonores.
Enfin, les piles à combustible sont très peu ou pas polluantes (selon le combustible utilisé).
L’un des problèmes de ces systèmes est leur durée de vie encore limitée, mais l’inconvénient majeur reste le coût. Quel que soit le type de pile, les matériaux utilisés sont onéreux. Pour les PEMFC par exemple, l’utilisation de platine ou autre métal noble comme catalyseur et d’une membrane polymère très coûteuse freinent leur commercialisation. Les cœurs de pile des SOFC sont réalisés à partir de matériaux céramiques qui ont aussi un coût élevé. Un des défis techniques et scientifiques à relever pour permettre le développement industriel de ces filières de conversion énergétique est d’abaisser significativement ces coûts.
I-2.
Les SOFC
Les piles à combustible à oxyde solide sont constituées d’empilements de cellules élémentaires, séparées par des interconnecteurs, formant des stacks (Figure I - 1) et permettant ainsi l’obtention d’une puissance électrique plus importante (proportionnelle au nombre de monocellules empilées). Ces cellules sont composées d'une anode et d'une cathode séparées par un électrolyte.
Chapitre I - Bibliographie
10
Figure I - 1 : La pile à combustible SOFC
Le combustible, l'hydrogène pur ou issu du reformage d’un hydrocarbure naturel ou de synthèse, est oxydé à l'anode, tandis que le comburant, l'oxygène de l'air, est réduit à la cathode grâce aux électrons résultant de l'oxydation du combustible. L'utilisation de réactifs gazeux permet une production autonome et continue de l'énergie. L'électrolyte est isolant électrique et conducteur ionique (conducteur d’anions O2- dans notre cas).
Les deux demi-équations d’oxydo-réduction sont : - à l’anode : H2 + O2- → H2O + 2e
-- à la cathode : ½O2 + 2e- → O
2-La réaction globale de la pile SOFC s'écrit donc : H2 + ½O2 → H2O.
I-2.1.
Eléments constituant les piles SOFC
Cette partie présente les propriétés requises des différents constituants ainsi que les matériaux qui peuvent satisfaire aux critères de fonctionnement d’une pile SOFC.
I-2.1.a. L’électrolyte
L'électrolyte doit être à la fois un parfait isolant électronique et un bon conducteur ionique (conducteur d’anions O2-) aux températures de fonctionnement de la pile. D'ailleurs, la température habituellement imposée aux SOFC est celle permettant d'atteindre une
Anode
Air
Interconnecteur
Electrolyte
Cathode
Combustible
Anode
Air
Interconnecteur
Electrolyte
Cathode
Combustible
conductivité ionique de l'électrolyte suffisante (supérieure à 10-2 S.cm-1) au bon fonctionnement de la pile.
Par ailleurs, l'électrolyte doit être imperméable aux gaz de façon à éviter le mélange des constituants gazeux des compartiments anodiques et cathodiques. Enfin, il doit aussi présenter une stabilité chimique sous une large gamme de pressions partielles d'oxygène, puisque cet électrolyte est en effet soumis à des flux d'hydrogène et d'oxygène. Ce cahier des charges contraignant restreint le choix du matériau d'électrolyte à seulement certains oxydes [5].
Bien que les électrolytes à base de zircone yttriée soient les plus classiques et les plus connus pour cette application, de nouveaux matériaux d’électrolyte sont à l’étude.
Les oxyapatites [6-9] présentent des propriétés de conduction ionique prometteuses et une faible énergie d’activation. De plus, ils présentent une grande stabilité chimique sous différentes atmosphères.
Les matériaux de structure pérovskite tels que La1−xSrxGa1−yMgyO3 présentent également des propriétés de conduction ionique meilleures que la zircone yttriée à 600°C [5, 10] mais posent des problèmes d’interdiffusion avec les électrodes [11, 12].
La cérine gadolinée (CGO) est également utilisée comme matériau d’électrolyte. Elle présente des conductivités ioniques à 500°C, pour Ce0,9Gd0,1O1,95, équivalentes à celles de la zircone yttriée à 700°C (10-2 S.cm-1) [13, 14]. La stabilité chimique de CGO n’est cependant pas satisfaisante à haute température. En effet, sous atmosphère réductrice, il y a une conduction électronique qui est rédhibitoire pour l’application. Seule une température de fonctionnement de la pile inférieure à 600°C permet l’utilisation de CGO comme électrolyte.
Cependant, les matériaux à base de zircone (ZrO2), et notamment la zircone stabilisée à l'yttrium (YSZ), de structure fluorine, demeurent les plus attractifs en terme de propriétés et de coût. En effet, des zircones stabilisées au scandium [15-17] présentent de meilleures conductivités ioniques mais sont plus onéreuses. Le système ZrO2-8%molY2O3 présente une conductivité ionique satisfaisante pour des températures de fonctionnement de 700 à 1000°C et est chimiquement stable. Parce que ce matériau est particulièrement bien connu du point de vue de ses propriétés structurales et que ses propriétés mécaniques sont compatibles avec les autres éléments de la cellule, il est encore aujourd’hui l'électrolyte le plus utilisé [5, 18-20]. Au cours de ces travaux, c’est donc ZrO2-8%molY2O3 (YSZ) qui sera utilisé comme matériau d’électrolyte.
Chapitre I - Bibliographie
12 I-2.1.b. L’anode
L'anode est le siège de la réaction entre l'hydrogène et l'anion oxygène O2-. H2 + O2- → H2O + 2e
-L’anode doit avoir une conductivité électronique suffisante, de plusieurs centaines de Siemens par centimètre aux températures de fonctionnement visées (700-800°C). De manière générale, une conductivité électronique maximale permet de minimiser les pertes ohmiques.
L’activité électrocatalytique de l’anode doit être suffisamment grande pour limiter la polarisation lors de l’oxydation électrochimique du combustible. Les points triples sont ici les points de contact entre l’électrolyte, l’anode et le combustible. Ils sont le siège de la réaction anodique: H2 + O2- → H2O + 2e-. Ils doivent être nombreux pour favoriser les réactions électrocatalytiques.
L’anode doit être chimiquement et morphologiquement stable sous les conditions d’atmosphère réductrice de fonctionnement. Le matériau ne doit pas subir de changement de phase dégradant ses propriétés entre la température ambiante et la température de fonctionnement. Enfin, l’anode doit conserver ses dimensions et sa microstructure en milieu réducteur pour éviter toute dégradation des performances de la cellule au cours du temps.
Une porosité traversante d’au moins 30% en volume est requise pour faciliter l’acheminement du combustible et l’évacuation des produits de la réaction [21]. La porosité doit être interconnectée de manière à augmenter le nombre de points triples où se produit la réaction d’oxydation du combustible et ainsi améliorer l’activité électrocatalytique.
L’anode doit ensuite être chimiquement stable vis-à-vis des autres composants de la pile. La réactivité chimique ou l’inter-diffusion d’éléments entre l’anode et les composants à son contact doivent être limitées pour éviter l’apparition de phases résistives interfaciales ou de phases remettant en cause la stabilité chimique.
Le coefficient de dilatation thermique de l’anode doit être le plus proche possible de celui des autres composants, ceci afin d’éviter les contraintes mécaniques. Le coefficient de dilatation thermique qui est pris comme référence est celui de la zircone yttriée, matériau d’électrolyte, et vaut 10,5.10-6 K-1.
En plus de toutes ces propriétés, une facilité de mise en œuvre et aussi un coût peu élevé sont également ciblés.
Le matériau d’anode est classiquement un cermet c’est-à-dire un composite céramique (matériau d’électrolyte)/métal. Même si de nouveaux matériaux conducteurs mixtes électronique et ionique (MIEC) [22-26], à base de CeO2 ou de SrTiO3, sont étudiés, le cermet Ni-YSZ reste le matériau anodique le plus utilisé [21, 27-29] car il cumule une bonne activité électrocatalytique vis-à-vis de la réaction d’oxydation de H2 et une stabilité satisfaisante au cours du temps dans les conditions de fonctionnement d’une pile à combustible SOFC, à savoir sous atmosphère réductrice et à haute température.
Pour que le cermet soit un bon conducteur électronique, le réseau de nickel doit être interconnecté. Une teneur théorique minimale de 33% volumique de Ni est nécessaire pour avoir un réseau métallique interconnecté (théorie de la percolation). Cependant, la conductivité électrique du matériau anodique dépend certes de la proportion des deux phases (YSZ et Ni) mais aussi de la taille des particules, de la distribution des deux constituants et de la continuité de chaque phase [30, 31]. Un taux volumique de Ni compris entre 40 et 60% semble être satisfaisant. En effet, cette gamme de composition permet d’obtenir des bonnes propriétés de conduction électrique et d’avoir un matériau dont le coefficient de dilatation thermique est relativement proche de celui de l’électrolyte. D’autre part, malgré ses très bonnes propriétés catalytiques pour l’oxydation de l’hydrogène, le nickel a aussi tendance à fritter aux températures de fonctionnement des piles SOFC et si la proportion de Ni est trop importante (87% en volume de nickel [32]), le nickel s’agglomère lors du fonctionnement de la pile et la cellule se dégrade rapidement.
La conductivité électrique du cermet Ni-YSZ est également dépendante de sa microstructure : une distribution homogène et uniforme de la phase nickel dans la matrice de zircone yttriée fournit une meilleure conductivité électrique [33]. Pour obtenir de bonnes performances finales, il est nécessaire d’avoir des contacts granulaires nickel-nickel, YSZ-YSZ et nickel-YSZ très intimes, ce qui implique que le nombre de sites de réaction (points triples) est fortement lié à la microstructure. La taille des particules de nickel et de zircone yttriée joue donc un rôle essentiel sur les performances [29, 34]. Différentes recherches menées sur l’optimisation des tailles des particules de NiO par rapport à celles de YSZ aboutissent à des conclusions assez différentes. C. Lee et al. [35] ont effectué des mesures d’impédance complexe sur différents cermets en faisant varier les tailles des particules de YSZ et de NiO et montrent que si les particules de NiO et de YSZ sont de tailles similaires, le matériau présente les meilleures propriétés de conduction. En revanche, Van Berkel et al. [36], en se basant sur des mesures de pertes de tension et sur le nombre de points triples, proposent une anode avec de meilleures propriétés quand les
Chapitre I - Bibliographie
14
particules de YSZ sont dix fois plus grosses que celle de Ni. Quant à Murakami et al., ils ont trouvé que des particules de NiO cinq fois plus grosses que celle de YSZ amélioraient les performances anodiques [37].
Malgré les bonnes performances du cermet Ni-YSZ, d’autres matériaux de formulation M-YSZ avec M ≠ Ni ont été étudiés pour l’application anodique.
Le cermet Co-YSZ a été étudié en raison de sa tenue mécanique sous atmosphère réductrice [38]. Le potentiel d’oxydation du cobalt étant plus grand que celui du nickel, il ne s’oxyde pas dans une atmosphère contenant de la vapeur d’eau et notamment au cours des cyclages thermiques. Le cobalt présente aussi une meilleure tolérance aux sulfures mais il n’est pas couramment utilisé en raison de son coût plus élevé que celui du nickel. Le ruthénium a une meilleure résistance au frittage car son point de fusion est plus élevé (2310°C) que celui du nickel (1455°C). Il présente une activité électrocatalytique vis-à-vis de l’hydrogène supérieure à celle du nickel [39]. Cependant, son coût très élevé rend son utilisation limitée.
Le nickel a tendance à catalyser la réaction de formation de carbone (craquage) en fonctionnement avec des hydrocarbures. Pour éviter la formation de ces résidus carbonés, Gorte et al. [40] ont remplacé le nickel par le cuivre, inactif du point de vue de son activité catalytique vis-à-vis de la réaction de cokage. De plus, ces anodes à base de Cu présentent également une bonne tolérance à des atmosphères chargées en sulfures. Même si le cermet Cu-YSZ est stable sous atmosphère hydrocarbonée, l’ajout de cérine est nécessaire comme catalyseur de la réaction d’oxydation du combustible pour atteindre des performances raisonnables.
Sur la base de ces recherches, Ni-YSZ reste néanmoins le matériau anodique de référence et c’est celui qui sera synthétisé et mis en œuvre dans le cadre de cette thèse.
I-2.1.c. La cathode
La cathode est le siège de la réaction de réduction de l'oxygène. ½O2 + 2e- → O
2-La cathode doit présenter des conductivités électronique et ionique élevées à la température de fonctionnement de la pile.
Elle doit également avoir des propriétés électrocatalytiques satisfaisantes pour assurer la réduction de l’oxygène de l’air. Elle doit également être poreuse pour permettre la circulation du comburant dans son volume et ainsi augmenter l’activité électrocatalytique de réduction de l’oxygène.
La cathode doit être chimiquement stable vis-à-vis des autres composants de la pile. La réactivité chimique ou l’inter-diffusion d’éléments entre la cathode et les autres matériaux à son contact doivent être limitées pour éviter l’apparition de phases résistives.
Son coefficient de dilatation thermique doit être le plus proche possible de celui des autres composants de la pile afin d’assurer une bonne stabilité thermomécanique.
La cathode devant fonctionner sous atmosphère oxydante à haute température, le choix du matériau se restreint aux métaux nobles et aux oxydes conducteurs électriques.
Les matériaux de cathode SOFC qui ont fait l’objet des plus nombreuses recherches sont des oxydes de structure pérovskites de formule ABO3, où A est une terre rare, en général le lanthane, et B un métal de transition. Parmi ces pérovskites, les manganites de lanthane substitués au strontium (La1-xSrxMnO3+δ - LSM) [41-43] sont les matériaux de cathode les plus largement étudiés du fait de leur forte conductivité électronique [44, 45]. Néanmoins ils ont une faible conductivité ionique, d’où l’étude du composite LSM-YSZ [46-48]. Une autre voie, afin d’envisager une conductivité mixte (électronique et ionique) des oxydes de structure pérovskite, a été étudiée : la substitution du manganèse par du cobalt et/ou du fer [49-51]. Ces nouvelles familles LSMC [52], LSMF [53], LSCF [54-57] sont des matériaux conducteurs mixtes (électronique et ionique) qui présentent des performances électrochimiques intéressantes.
Depuis quelques années, de nouveaux matériaux de cathode prometteurs font l’objet de nombreux travaux de recherche : il s’agit des phases de Ruddlesden-Popper (RP) An+1MnO3n+1 [58-62]. Parmi ces phases RP, les nickelates de lanthanides ont été étudiés en vue de leur application comme cathode SOFC [58, 63]. Nous nous intéresserons plus particulièrement à la composition La2NiO4 [64-67] qui présente à la fois une conductivité ionique et électronique [59]. Les résultats obtenus sur ces matériaux, déposés sur des électrolytes en zircone yttriée, ont montré que leurs propriétés électrochimiques étaient encourageantes avec notamment une résistance de polarisation surfacique (ASR) d’environ 2-3 Ω.cm² à 800°C pour des revêtements d’environ 10 µm d’épaisseur [68, 69].
Chapitre I - Bibliographie
16
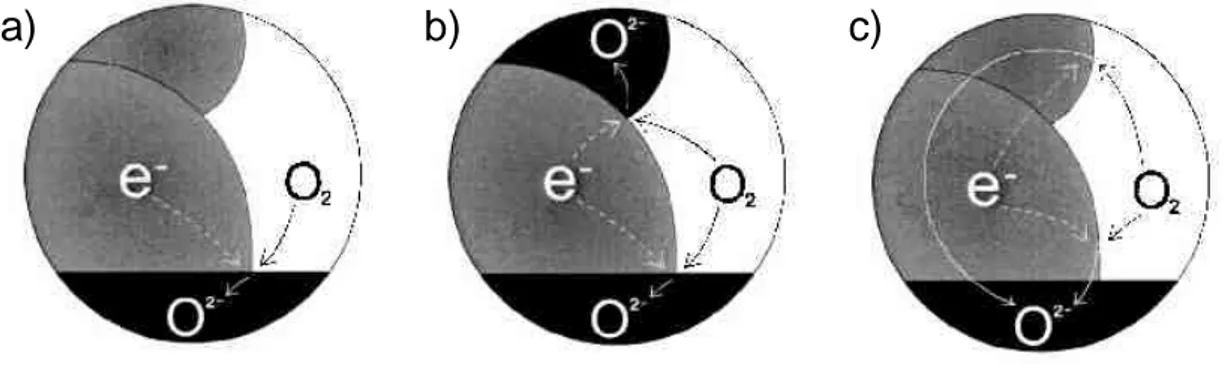
Par rapport à un matériau "classique" de cathode, c’est à dire conducteur électronique seulement, le composé La2NiO4, qui est conducteur mixte (conducteur ionique et électronique, MIEC) présente des surfaces actives considérablement augmentées, puisque, après réduction de l’oxygène, tout le volume de la cathode permet la circulation des ions O2- vers l’électrolyte (Figure I - 2) ; la zone active n’est donc plus limitée à l’ensemble des points de triple contact (interface cathode-électrolyte-oxygène gazeux).
Figure I - 2 : Mécanismes possibles de réduction et de diffusion de l’oxygène dans une cathode SOFC, a) cathode conductrice électronique, b) composite cathode-électrolyte,
c) cathode MIEC [70]
Dans cette thèse, le matériau de cathode utilisé sera La2NiO4 et les travaux s’appuieront sur des études déjà initiées au laboratoire [71, 72] notamment dans le cadre de la thèse de R.F. Cienfuegos [72].
I-2.1.d. L’interconnecteur
L’interconnecteur a pour rôle de collecter le courant et par conséquent doit présenter une conductivité électronique maximale. Les pertes ohmiques dues à l’introduction de l’interconnecteur seront faibles s’il présente une excellente conductivité électronique. Il doit assurer une bonne étanchéité entre les compartiments anodique et cathodique. En effet, celui-ci doit être imperméable aux gaz de manière à séparer combustible et comburant et éviter le mélange de ces constituants gazeux.
L’interconnecteur doit être stable chimiquement mais aussi en termes de dimension et de microstructure aux températures de fonctionnement à la fois sous atmosphères réductrice et oxydante. La plaque d’interconnexion dense doit résister à la corrosion côté cathodique, en
a)
b)
c)
effet il ne doit pas y avoir formation de couche isolante à sa surface issue éventuellement des produits de corrosion. L’interconnecteur doit aussi présenter une bonne tenue sous atmosphère réductrice mais aussi en présence de vapeur d’eau côté anodique.
La réactivité chimique ou l’inter-diffusion d’éléments entre l’interconnecteur et les composants à son contact doivent être faibles pour éviter l’apparition de phases résistives. Celles-ci augmenteraient les pertes ohmiques et donc nuiraient au bon fonctionnement de la cellule SOFC.
D’après Zhu [73], la conductivité thermique de l’interconnecteur ne doit pas être inférieure à quelques W/(m.K). Elle permet de transférer l’excédent thermique produit par la réaction cathodique vers le compartiment anodique de la cellule et donc compenser la diminution thermique liée à la réaction endothermique d’oxydation de l’hydrogène. Ce transfert de chaleur favorise le fonctionnement de la cellule et permet de diminuer sensiblement les coûts énergétiques.
De plus, le coefficient de dilatation thermique de l’interconnecteur doit être le plus proche possible de celui des autres composants, ceci afin de minimiser les contraintes thermo-mécaniques. Une bonne résistance mécanique ainsi qu’une tenue au fluage sont nécessaires pour ce composant de la pile.
L’interconnecteur doit être facile à mettre en œuvre, ce qui favorisera sa production en masse. Les coûts de matières premières aussi bien que le procédé de fabrication doivent être aussi faibles que possible de manière à ne pas être un obstacle à la commercialisation.
Au cours des dernières décennies, les efforts sur le développement d'interconnecteurs ont été principalement axés sur la famille des oxydes complexes à structure pérovskite. Toutefois, seulement quelques systèmes d'oxyde peuvent répondre aux exigences rigoureuses pour les matériaux d'interconnexion dans les SOFC. Les chromites de lanthane (LaCrO3) sont les matériaux les plus communément utilisés puisqu'ils sont stables sous atmosphères réductrice et oxydante. Ils sont aussi compatibles avec les autres composants de la cellule d’un point de vue chimique et en terme de coefficient de dilatation thermique. De plus, la conductivité électrique des chromites de lanthane dopés (Sr, Co, …) [74] n’est suffisante que pour des températures de fonctionnement supérieures à 1000°C. Mais, dans l’optique de diminuer la température de fonctionnement des piles SOFC, ils ne sont plus adaptés. De plus, les matériaux céramiques sont onéreux et leur coût de fabrication est également élevé.
Chapitre I - Bibliographie
18
De nombreuses études sont en cours sur les interconnecteurs métalliques. Ils présentent de nombreux avantages par rapport aux matériaux céramiques, notamment, des meilleures conductivités électrique et thermique et un faible coût de mise en œuvre.
Les alliages à base de chrome sont les plus performants à l’heure actuelle pour des températures de fonctionnement élevée (1000°C) [75], car ils présentent une bonne résistance à la corrosion grâce à la formation d’une couche d’oxyde protectrice (Cr2O3). Leur comportement en dilatation thermique est comparable à celui de YSZ [76]. Cependant le problème majeur de ces interconnecteurs est l’évaporation de chrome en fonctionnement à haute température. Zhu et Yan [73] ont reporté que l’insertion d’éléments comme Y2O3 permettait de limiter l’évaporation de chrome sans détériorer la conductivité électrique.
L’interconnecteur commercial à base de Cr le plus connu est le Ducrolloy de PLANSEE. La composition de base de cet alliage est Cr-5Fe-1Y2O3. Bien que des études sur sa résistance à l’oxydation montrent de bonnes propriétés, la tenue de cet alliage à haute température et dans le temps n’est pas encore suffisante (résistance électrique trop importante après 75h sous air) [76]. L’ajout d’une couche protectrice contre la corrosion semble donc nécessaire [77] pour permettre une utilisation satisfaisante de ces interconnecteurs métalliques (gain de masse inférieur à 5% / 1000 h sous air).
Une autre alternative pour améliorer les caractéristiques des interconnecteurs à base de Cr est de fabriquer des alliages avec un renforcement par dispersion d’oxyde (oxide-dispersion-strengthened ou ODS). Ceux-ci semblent avoir de meilleures propriétés en terme de tenue à la corrosion mais ont un coût encore plus élevé [77].
Les interconnecteurs à base de fer présentent de nombreux avantages par rapport à ceux à base de chrome : ils sont plus ductiles, plus facilement usinables et moins chers. Cependant, ils doivent contenir un minimum de 17% de Cr en masse, pour permettre la formation d’une couche protectrice de Cr2O3 et avoir une tenue correcte vis-à-vis de la corrosion [76]. Il y a donc toujours le problème de l’évaporation de chrome en condition de fonctionnement. L’ajout d’éléments comme du Mn et du Ti permet de diminuer cette évaporation et limite également le gain de masse au cours du temps [78]. De même que pour les bases Cr, l’ajout d’yttrium permet de diminuer la résistance électrique [73].
Le Crofer 22 APU est l’interconnecteur commercial à base de fer le plus communément utilisé. Il contient environ 20 % de Cr et n’est pas totalement satisfaisant en terme de tenue à la corrosion sous atmosphère oxydante [79].
Ainsi, les interconnecteurs métalliques, à base de chrome ou de fer, nécessitent d’être revêtus, d’une part pour les protéger de la corrosion [76, 77] et d’autre part pour éviter la diffusion du chrome dans les électrodes [80-82]. Différents revêtements de type oxydes, à base de lanthane (La2O3 [83, 84] ; LaCrO3 [80, 85, 86]) ou à base de manganèse ((Mn1-xCox)3O4) [84, 87-91], permettent de limiter ces problèmes.
Les alliages à base de nickel sont plus résistants à haute température mais contiennent également du chrome et du fer. Ils ont une faible cinétique d’oxydation. Leur point faible reste leur coefficient de dilatation thermique trop élevé (autour de 15.10-6 K-1).
Les interconnecteurs commerciaux à base de nickel sont principalement des formulations Haynes. Geng et al. [92, 93] ont comparé le Haynes 230 et le Haynes 242. Le Haynes 230 contient 22% en masse de chrome et 14% en masse de tungstène alors que le Haynes 242 contient 8% en masse de chrome et 25% en masse de molybdène. Ils ont des conductivités électroniques satisfaisantes, plus faibles que les bases fer, mais un revêtement protecteur améliore tout de même significativement la tenue à la corrosion. En ce qui concerne les coefficients de dilatation thermique, le Haynes 242 se rapproche plus de celui de YSZ alors que le Haynes 230 est trop important pour assurer la compatibilité thermo-mécanique des éléments de la cellule en fonctionnement.
Un compromis reste encore à trouver pour utiliser ces alliages comme interconnecteurs de pile SOFC. Une couche protectrice contre la corrosion semble être une solution prometteuse pour permettre l’utilisation d’un métal comme interconncteur.
I-2.2.
Evolution des technologies
Le développement des SOFC s’est fait en plusieurs phases, motivé en grande partie par le souhait de réduire le coût du stack (empilement de cellules élémentaires) SOFC. Deux principales technologies ont été développées : la technologie tubulaire et la technologie planaire.
Chapitre I - Bibliographie
20 I-2.2.a. La technologie tubulaire
Depuis plus de 30 ans, Siemens-Westinghouse développe les SOFC de technologie tubulaire avec l’appui de l’US Department of Energy (DOE) [94].
Dans la technologie tubulaire (Figure I - 3), un cylindre en céramique poreuse (environ 50% de porosité) fermée à une extrémité, de diamètre de 15 à 20 mm et de longueur pouvant atteindre 1,5 m sert de support et est recouvert extérieurement de couches successives de cathode, d’électrolyte et d’anode et enfin, un dépôt (souvent obtenu par des techniques de dépôt en phase vapeur) servant d’interconnecteur. L’intérieur du tube support sert à la distribution d’air, tandis que le combustible est acheminé par l’extérieur. Un des avantages de la technologie cylindrique est de pouvoir mettre les joints d’étanchéité dans une zone à température plus basse, réduisant ainsi les conséquences de contraintes mécaniques issues des contraintes thermiques et améliorant ainsi la fiabilité de ces systèmes. La dégradation de performances est très faible, voisine de 0,2%/1000 heures pour une alimentation en air. Les inconvénients majeurs de la technologie cylindrique sont la faible puissance électrique fournie et le coût élevé de fabrication [38].
I-2.2.b. La technologie planaire
La technologie planaire est plus récente (fin des années 1990). Tous ses composants étant actifs (contrairement à la technologie tubulaire où certains composants, comme les supports de tube, ne sont pas actifs), elle permet d’obtenir des blocs plus compacts conduisant aux améliorations suivantes : diminution de la masse, de l’encombrement, et des pertes thermiques. Les configurations des cellules planes SOFC ont également évoluées au cours du temps [95].
La première génération (1G) de SOFC de technologie planaire (Figure I - 4 a) utilise l’électrolyte comme support mécanique de la cellule. Cet électrolyte doit être suffisamment épais (200 – 500 µm) pour assurer son rôle de support mécanique. La conductivité ionique de l’électrolyte (zircone stabilisée à l’yttrium) augmente avec la température et pour permettre une conductivité suffisante de l’électrolyte compte tenu de son épaisseur, la cellule doit fonctionner à une température relativement élevée, proche de 1000°C.
Figure I - 4 : Configurations planaires de cellules de piles à combustible SOFC (I : Interconnecteur, A : Anode, E : Electrolyte, C : Cathode),
a) électrolyte support, b) anode support
La deuxième génération (2G) de cellule SOFC plane (Figure I - 4 b) a une épaisseur d’électrolyte beaucoup plus faible (10-50 µm) afin de conserver une conductivité ionique de l’électrolyte satisfaisante tout en abaissant la température de fonctionnement dans la gamme 600-800°C. Dans cette configuration, c’est l’anode qui sert de support mécanique et a donc une épaisseur plus importante (400-1000µm) que dans le cas de la première génération. De plus, l’abaissement de la température de fonctionnement permet l’utilisation d’interconnecteurs métalliques, qui ont un coût moindre que les interconnecteurs céramiques (LaCrO3) utilisés dans la technologie 1G.
C E A I SOFC 1G SOFC 2G C E A I
a) Electrolyte support b) Anode support C E A I C E A C E A C E A I SOFC 1G SOFC 2G C E A I C E A I
Chapitre I - Bibliographie
22
Dans le but d’une future commercialisation, une SOFC de troisième génération (Figure I - 5) est actuellement à l’étude. Selon des estimations technico-économiques effectuées par le Lawrence Berkeley National Laboratory (LBNL) [96, 97], une SOFC avec un support métallique poreux permettrait d’ouvrir des perspectives de marché pour ces technologies. En effet, cette nouvelle génération de SOFC, qui a comme support mécanique un métal poreux sur lequel sont déposés les matériaux actifs de la cellule (anode, électrolyte, cathode) en faible épaisseur, permet de limiter la quantité de matière céramique au cœur de pile et ainsi de diminuer le coût du stack SOFC tout en conservant une bonne tenue mécanique. Le support métallique, très bon conducteur thermique et électrique, assure un bon collectage du courant. La résistance aux cycles thermiques est améliorée par la bonne tenue mécanique et une meilleure distribution de la température. De plus, le fait d’avoir un support métallique poreux, accolé à la plaque d’interconnexion dense, permettra l’acheminement du combustible et, par la suite ce système pourrait également être utilisé pour le reformage interne d’hydrocarbures (gaz naturel en particulier). Enfin, lors de l’assemblage de cellules élémentaires afin de monter le stack, le support métallique sera plus facile à souder ou raccorder qu’un matériau céramique.
Figure I - 5 : Configuration planaire de cellule de pile à combustible SOFC à métal support (I : Interconnecteur, M : Métal poreux, A : Anode, E : Electrolyte, C : Cathode)
Peu d’équipes travaillent actuellement sur cette nouvelle génération de cellule à métal poreux support. Parmi elles, on peut citer :
- en Europe : Ceres Power [98, 99] au Royaume-Uni, Risoe et Topsoe Fuel Cell [95] au Danemark ainsi que le DLR [80] et Julich [100] en Allemagne
- aux Etats-Unis : l’Université de Californie à Berkeley et le LBNL (Lawrence Berkeley National Laboratory) [101-104]
- et une équipe au Canada (National Research Council Canada) [105, 106], une autre à Pohang [107] en Corée et Fiji Electric [108] au Japon.
SOFC 3G C E A I Métal support M SOFC 3G C E A I Métal support M
A l’exception de Wang et al. [106] qui utilisent un superalliage base nickel (Hastelloy X), Joo et al. [107] et Takenoiri et al. [108] du nickel métal, le support métallique des cellules utilisé par l’ensemble des équipes précitées est un acier ferritique contenant un minimum de 17% de chrome.
Les procédés d’élaboration des revêtements actifs du cœur de pile sont de deux types : - les procédés dits "physiques" tels que la projection thermique atmosphérique (APS)
[100], sous vide (VPS) [80], de poudre ou de suspension (SPS) [106], ou encore le dépôt par pulvérisation laser pulsé (PLD : Pulsed Laser Deposition) [107]
- les procédés dits "voies humides" comme le coulage en bande, la sérigraphie, le dépôt par spray [101] ou encore le dépôt par électrophorèse [99].
Les procédés dits "physiques" restent coûteux pour ce type d’application, avec un contrôle de la microstructure des revêtements assez difficile, cependant ils ne nécessitent pas de traitement thermique post-dépôt ce qui est un avantage pour la réalisation d’une cellule sur support métallique.
Cependant, d’après le LBNL [97], seuls des procédés dits "voies humides" permettraient d’atteindre des coûts acceptables de fabrication rendant envisageable la commercialisation de ces systèmes. Cependant, un traitement thermique à haute température (1000-1400°C) est nécessaire à la densification de l’électrolyte mais est fortement préjudiciable à la tenue mécanique et à la stabilité chimique du métal support.
L’originalité et l’intérêt de mes travaux de thèse sont de mettre au point, par un procédé de chimie douce (la voie sol-gel), un empilement complet de revêtements de matériaux céramiques SOFC (cathode, électrolyte, anode), l’ensemble devant être déposé sur métal support.
I-3.
Procédés d’élaboration mis en œuvre dans ces travaux
Dans cette partie vont être décrites les différentes techniques mises en œuvre au cours de cette thèse afin de réaliser une cellule SOFC à métal support.
Chapitre I - Bibliographie
24
I-3.1.
Métallurgie des poudres
La métallurgie des poudres sera utilisée pour préparer un support métallique poreux.
Ce procédé est basé sur la synthèse de matériaux par chimie douce. C’est une précipitation chimique d’oxalates métalliques [109]. Cette synthèse se déroule en plusieurs étapes : d’abord la précipitation chimique en solution et ensuite après filtration, séchage et tamisage, l’oxalate est préparé. Afin d’obtenir la poudre métallique, une réduction sous flux d’hydrogène à basse température (< 500°C) est ensuite effectuée.
L’ajustement des paramètres de précipitation chimique des précurseurs oxaliques et/ou des paramètres de traitement thermique permet le contrôle de la morphologie, de la taille des particules et des grains élémentaires du métal, également la modification de la porosité inter-particulaire et intra-particulaire [110].
La poudre métallique à morphologie contrôlée est mise sous forme de compact métallique poreux par pressage uniaxial à température ambiante. Ces massifs crus sont ensuite recuits à 800°C sous H2.
La variation de la pression de compactage et/ou de la température de recuit permet la modification du taux de porosité et de la tenue mécanique des compacts crus ou recuits [111, 112].
Ce procédé permet l’élaboration de métaux simples (Fe, Ni, Co, …) [113] ou d’alliages métalliques [114, 115] mais il ne permet pas l’ajout de précurseur chromé, ce qui rend impossible la préparation d’un acier inoxydable qui est pourtant à l’heure actuelle plus performant en terme de tenue à la corrosion et de propriétés mécaniques à haute température. Nous préparerons donc par cette voie un support métallique de cellule en nickel et nous utiliserons en parallèle un acier ferritique inoxydable commercial fourni par la société ArcelorMittal dans le cadre de l’ANR CERAMET.
I-3.2.
Synthèse sol-gel
La synthèse sol-gel sera mise en œuvre dans ces travaux afin de préparer les matériaux actifs du cœur de pile : anode, électrolyte, cathode.
I-3.2.a. Présentation et définitions
Par rapport à une voie de synthèse classique « solide-solide », la voie sol-gel permet l’obtention d’oxydes à basse température et l'excellente homogénéité des précurseurs métalliques en solution rend possible l'élaboration d'oxydes de formulations complexes. Elle offre aussi l'avantage de pouvoir contrôler la morphologie des poudres obtenues après décomposition et calcination du gel. La granulométrie des poudres synthétisées est généralement nanométrique, ce qui leur confère une bonne réactivité. Enfin le coût réduit des précurseurs et la facilité de mise en forme par dip-coating (trempage d'un substrat dans un sol ou dans une barbotine) en font la voie choisie pour ces travaux.
Un sol est défini comme une suspension de nature colloïdale ou polymère dans un solvant tandis qu'un gel est défini comme un réseau solide emprisonnant le solvant.
Au niveau du sol, les éléments métalliques participent à la constitution du réseau colloïdal ou polymère ainsi, leur répartition homogène dans le milieu est assurée lors de la transition sol-gel.
Dans ce travail, nous utiliserons deux voies de la synthèse sol-gel : la voie alcoxyde et la voie polymère (dérivée du procédé Péchini).
I-3.2.b. La voie alcoxyde
Historiquement, cette voie de synthèse trouve son origine lors de recherches sur les silicates au 19e siècle. Au départ, elle a été principalement développée dans l'industrie du verre [116-119].
Les précurseurs alcoxydes sont des précurseurs inorganiques de formule M(OR)n, où M désigne un métal, OR un groupement alcoxy avec R une chaîne alkyle. L'objectif de la méthode est de former soit un polymère inorganique, soit des colloïdes de tailles variables, par hydro-condensation des précurseurs alcoxydes.
Le processus d'hydro-condensation peut se décomposer en plusieurs étapes.
La réaction d'hydrolyse, tout d'abord, est initiée par ajout d'eau à la solution d'alcoxydes. Cette réaction entraîne la création d'un groupement hydroxyle sur le monomère et l'élimination d'alcool (désalcoolation) :
Chapitre I - Bibliographie
26
Ensuite, les réactions de condensation, rendues possibles par l'hydrolyse partielle de l'alcoxyde métallique, conduisent à la formation des liaisons M-O-M qui, après décomposition par un cycle thermique approprié, conduiront à l’obtention de l'oxyde. Il existe 3 catégories de réactions généralement utilisées pour décrire la condensation :
Condensation par déshydratation : M-OH + OH-M → M-O-M + H2O Condensation par désalcoolisation : M-OH + RO-M → M-O-M + R-OH Condensation par dé-éthération : M-OR + RO-M → M-O-M + ROR
Les réactions d'hydrolyse et de condensation sont simultanées et/ou compétitives ; elles mettent en jeu des mécanismes d'addition et de substitution nucléophile impliquant des étapes réactionnelles intermédiaires. Ces réactions conduisent à la formation d’un gel. Ce gel est constitué d’un réseau M-O-M emprisonnant le solvant, avec des liaisons chimiques assurant la cohésion mécanique du matériau.
Nous envisageons de mettre en œuvre la voie alcoxyde décrite ci-dessus pour former le sol précurseur de zircone yttriée auquel le nickel, sous la forme d'un complexe dissous dans un milieu alcoolique, serait introduit avant gélification. Cette synthèse permettra donc l’obtention du matériau d’anode mais sera également utilisée, sans ajout de nickel, pour le matériau d’électrolyte.
Nous travaillerons dans le système n-propoxyde de zirconium, nitrate d'yttrium, acétylacétone, n-propanol et eau. L'alcoxyde de zirconium étant très réactif vis-à-vis de l'eau, les sols seront réalisés sous atmosphère neutre.
Il conviendra néanmoins de contrôler les réactions d'hydrolyse et de condensation afin d'éviter l'obtention d'un précipité, c’est le rôle de l’acétylacétone (acac). Les paramètres de synthèse à contrôler sont donc :
- la concentration : C= [Zr],
- le taux d'hydrolyse : W'= [H2O]/ ([Zr] + [Y]), - le taux de complexation : R'= [acac]/ ([Zr] + [Y]).
A partir du sol, des films peuvent directement être mis en forme par trempage-retrait d’un substrat dans le sol. Après traitement thermique, un revêtement de nature oxyde est obtenu. Pour la synthèse de matériaux pulvérulents, après gélification, le gel peut être séché de deux façons : à l'étuve ou dans des conditions supercritiques.
Dans des conditions de séchage conventionnel (conditions atmosphériques), on observe un retrait important du matériau, dû à la pression capillaire du liquide qui entraîne un
effondrement complet de la structure avec une densification importante. On obtient alors un xérogel.
Un séchage supercritique des gels consiste à porter le gel à une pression supérieure à la pression critique du solvant, puis à augmenter la température au-dessus de sa température critique. Ainsi, la structure du gel est maintenant mouillée par un solvant supercritique, sans effet de tension capillaire. La pression est ensuite abaissée jusqu’à l’évaporation du solvant, et le solide est ainsi récupéré. Les gels obtenus dans les conditions supercritiques sont appelés aérogels, ce sont généralement des solides extrêmement poreux, avec des densités extrêmement faibles.
Les produits de décomposition obtenus, xérogels ou aérogels, sont des précurseurs d’oxyde. Dans chaque cas, une étape de traitement thermique à basse température (600°C) est nécessaire pour obtenir l'oxyde cristallisé, exempt de résidus organiques.
I-3.2.c. La voie polymère
Cette voie repose sur le brevet déposé par Pechini en 1967 [120]. Le principe du procédé consiste, au niveau d'une solution de précurseurs, à incorporer des métaux le long de chaînes polymères organiques. Dans le brevet initial, les chaînes polymères sont obtenues par une réaction d'estérification, entre des acides polycarboxyliques et des polyalcools (éthylène glycol), provoquée par chauffage de la solution vers 80°C. L'obtention d'un polymère "chélatant", qui complexe aléatoirement les cations métalliques le long des chaînes, assure leur distribution homogène à l'échelle moléculaire ce qui favorise, au cours du traitement thermique, l'apparition de la phase oxyde désirée. Ici, c'est l'acide polyfonctionnel qui joue le double rôle d'agent polymérisant (il forme le corps de la chaîne avec le polyalcool) et d'agent chélatant. Dans le brevet de 1967, l'acide polyfonctionnel utilisé est l'acide citrique.
Dans la littérature, d'autres agents chélatants que l'acide citrique tels que l'acide acétique ou polyacrylique sont rencontrés [121]. Certains auteurs utilisent aussi des substituants à l'éthylèneglycol tels que l'acétylacétone [122]. Valente [123] et Maurin [124], utilisent comme agent polymérisant de l'acétylacétone et de l'hexaméthylènetétramine, le solvant n'étant alors plus uniquement aqueux mais composé d'un mélange d'eau et d'acide acétique. Dans ce dernier protocole, la polymérisation n'est plus une réaction d'estérification proprement dite, mais une réaction d'hydrolyse entre les deux agents polymérisants ; les métaux sont complexés le long des chaînes par l'acétylacétone.