THÈSE
Pour l’obtention du Grade de
DOCTEUR DE L’UNIVERSITÉ DE POITIERS (Faculté des Sciences Fondamentales et Appliquées)
(Diplôme National - Arrêté du 7 août 2006)
École Doctorale : Ingénierie Chimique, Biologique et Géologique Secteur de recherche : MICROBIOLOGIE DE L’EAU
Présentée par
Laëtitia ALLERON
ETUDE DE L’ETAT VIABLE NON CULTIVABLE
(VBNC) CHEZ LEGIONELLA PNEUMOPHILA LENS
APRES TRAITEMENTS MONOCHLORAMINE ET
THERMIQUE
Directeur de Thèse : Professeur Jacques FRERE
Soutenue de 08 Février 2008 Devant la Commission d’Examen :
Rapporteurs : Mme Sophie JARRAUD, MCU PH, HDR, Université de Lyon Nord
M. Sam DUKAN, Chargé de Recherche CNRS, HDR, Université de Marseille
Examinateurs : Mme Marie-Hélène RODIER, PU-PH, Université de Poitiers
M. Thierry JOUENNE, Directeur de Recherche CNRS, Université de Rouen M. Jacques FRERE, Professeur, Université de Poitiers
SOMMAIRE
INTRODUCTION GENERALE ... 8
CHAPITRE 1 : SYNTHESE BIBLIOGRAPHIQUE... 10
1. LEGIONELLA ... 10 1.1. Historique ... 10 1.2. La légionellose ... 10 1.3. Présentation de la bactérie... 12 1.3.1. Classification... 12 1.3.2. Description / Morphologie ... 13
1.3.3. Caractères microbiologiques et biochimiques... 14
1.3.4. Caractères culturaux... 14
1.3.5. Facteurs de virulence... 14
1.4. Ecologie des légionelles ... 16
1.4.1. Interaction avec les amibes ... 20
1.4.2. Colonisation des biofilms... 21
1.5. Cycle de vie de L. pneumophila ... 21
1.5.1. La phase de réplication... 23
1.5.2. La phase de transmission... 23
1.5.3. La forme MIF (Mature Intracellular Form)... 24
2. L’ETAT VIABLE NON CULTIVABLE (VBNC)... 25
2.1. Définition ... 25
2.2 L’état VBNC chez L. pneumophila... 28
2.2.1. Carence en nutriments... 29
2.2.2. Influence de la température ... 29
2.2.3. Influence de la teneur en oxygène dissous ... 30
2.2.4. Influence du pH... 30
2.2.5. Influence de la salinité... 30
2.2.6. Traitements oxydants ... 31
2.3 Analyse de l’état VBNC... 31
3. UN NOUVEAU FACTEUR DE RESSUCITATION : LA PROTEINE Rpf (Resuscitation-promoting-factor) ... 36
3.1. Rpf chez les bactéries Gram positives : ... 36
3.2. Rpf chez les bactéries Gram négatif... 38
3.3. Structure et mode d’action ... 40
CHAPITRE 2 : MATERIELS ET METHODES... 42
1. Souches microbiennes, conditions de culture et de conservation ... 42
1.1. Legionella pneumophila... 42
1.2. Acanthamoeba castellanii ... 42
1.3. Escherichia coli... 43
2. Traitement des bactéries en suspension par la monochloramine ... 43
3. Traitement thermique ... 44
4.1. Dénombrement des bactéries cultivables sur gélose ... 44
4.2. Etude de l’intégrité membranaire : LIVE/DEAD® BacLight™... 44
4.3. Etude de l’activité estérase : CHEMCHROME V6 ... 46
4.4. Infection de l’amibe Acanthamoeba castellanii... 46
5. Evaluation du maintien de la synthèse protéique des bactéries à l’état VBNC ... 47
6. Analyse protéomique... 48
6.1. Préparation des échantillons : EXTRACTION DES PROTÉINES... 49
6.2. Electrophorèse bidimensionnelle : 2D-PAGE... 49
6.2.1. Principe... 49
6.2.2. 1ère dimension : IEF... 50
6.2.3. 2NDE DIMENSION : SDS-PAGE... 51
6.2.4. Coloration au nitrate d’argent ... 52
6.2.5. Analyse d’image... 52
6.2.6. Spectrométrie de masse MALDI-TOF... 53
7. Méthodes de biologie moléculaire ... 53
7.1. Plasmides... 53
7.2. Clonage moléculaire et PCR ... 54
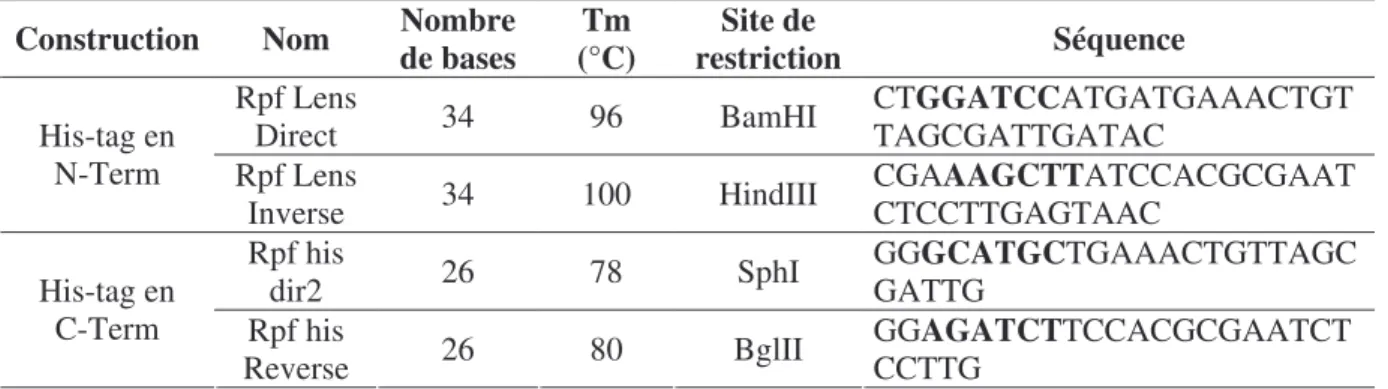
7.2.1. Réactions de PCR et amorces... 54
7.2.2. Ligature du produit PCR dans pCR-Blunt ... 55
7.2.3. Clonage après digestion par les enzymes de restriction... 55
7.3. Transformation d’Escherichia coli... 55
7.4. Expression des protéines recombinantes... 55
7.5. Extraction et purification des protéines recombinantes ... 56
7.5.1. Extraction ... 56
7.5.2. Purification... 56
7.5.3. Vérification des protéines induites par SDS-PAGE... 57
7.5.4. Test de réveil de L. pneumophila par les protéines recombinantes... 57
CHAPITRE 3 : RESULTATS ... 58
1. Impact du traitement par la monochloramine ... 58
1.1. Cultivabilité et viabilité... 59
1.2. Evaluation du maintien de la synthèse protéique des bactéries non cultivables ... 60
1.3. Traitements des bactéries pour l’électrophorèse 2D ... 62
1.4. Analyse protéomique... 64
1.4.1. Analyse par SDS-PAGE... 64
1.4.2. Analyse par électrophorèse bidimensionnelle... 65
2. Impact du traitement thermique ... 76
2.1. Cultivabilité et viabilité... 76
2.2. Analyse par électrophorèse bidimensionnelle... 80
3. Identification du gène Rpf chez L. pneumophila ... 82
3.1. Amplification du gène rpf chez L. pneumophila... 82
3.2. Expression des protéines recombinantes... 84
3.2.1. Protéines recombinantes marquée en N-terminal... 84
3.2.2. Protéines recombinantes marquée en C-terminal... 86
3.2.3. Test de réveil de L. pneumophila non cultivables... 86
ANNEXE 1 : Préparation des milieux de culture pour L. pneumophila et E. coli... 92
ANNEXE 2 : Préparation des milieux de culture pour Acanthamoeba castellanii ... 94
ANNEXE 3 : Préparation des solutions nécessaires au traitement NH2Cl... 95
ANNEXE 4 : Préparation des gels d’électrophorèse 2D ... 97
ANNEXE 5 : Préparation des gels d’électrophorèse pour la SDS-PAGE... 98
ANNEXE 6 : Fixation et coloration des protéines ... 99
ANNEXE 7 : Liste des protéines dont la quantité augmente à l’état VBNC ... 100
ANNEXE 8 : Liste des protéines dont la quantité varie après le stress monochloramine ... 101
ANNEXE 9 : Liste des protéines dont la quantité varie dans le milieu pauvre en nutriments (carence nutritionnelle)... 102
REFERENCES BIBLIOGRAPHIQUES... 103 ARTICLE 1
LISTE DES FIGURES
Figure 1 : Cycle de vie de Legionella pneumophila………...……….17 Figure 2 : schéma d’infection d’une amibe par Legionella... 19 Figure 3 : Cycle de vie de L. pneumophila (Molofsky & Swanson, 2004)... 21 Figure 4 : Expression des phénotypes pendant les phases de réplication et de transmission.. 22 Figure 5 : Alignement partiel de séquences en AA de Rpfs chez les mycobactéries... 35 Figure 6 : comparaison de RpfBc avec d'autres glycosides hydrolases..……….39 Figure 7 : Cultivabilité de L. pneumophila en suspension après traitement à la
monochloramine (moyenne de 3 expériences)... 59 Figure 8 : Autoradiographie de profils protéiques de L. pneumophila obtenus après marquage à différents temps, par un mélange cystéine /méthionine S35... 60 Figure 9 : Comparaison de profils protéiques par SDS-PAGE de L. pneumophila cultivables ou non cultivables restées 0 jours (J0) ou 15 jours (J15) dans le milieu de repos ... 64 Figure 10 : Exemple de gel obtenu en déposant 350 µg de protéines de L. pneumophila traitée par 20 mg/L de monochloramine resté 15 jours dans le milieu de repos... 66 Figure 11 : Analyse protéomique de L. pneumophila traitées ou non par la monochloramine après incubation dans le milieu de repos (150 µg de protéines déposées)... 67 Figure 12 : Exemple de gel obtenu en déposant 150µg de protéines d’un échantillon traité par 20mg/L NH2Cl et prélevé juste après traitement. ... 68 Figure 13 : Localisation des protéines dont la quantité est augmentée d’un facteur supérieur ou égal à 2 à l’état VBNC ... 71 Figure 14 : Dénombrement des L. pneumophila cultivables après traitement thermique... 77 Figure 15 : Observation en microscopie à épifluorescence de l’activité estérase de L.
pneumophila, 169 j après traitement à 57,5°C (Chemchrome V6) ... 79
Figure 16 : Analyse protéomique de L. pneumophila traitées ou non par la chaleur après incubation plusieurs jours dans le milieu de repos... 80 Figure 17 : Comparaison de séquences en AA de Rpf entre L. pneumophila et Salmonella...81 Figure 18 : Résultat de l’amplication du gène rpf chez L. pneumophila... 83 Figure 19 : Expression de la protéine Rpf marquée en N-terminal par une queue
poly-histidine ... 84 Figure 20 : Purification de la protéine Rpf marquée en N-terminal... 85 Figure 21 : Comparaison de séquence en AA de Rpf entre L. pneumophila, Salmonella et
LISTE DES TABLEAUX
Tableau 1 : Conditions de formation et réveil de VBNC chez différentes bactéries ... 26
Tableau 2 : Différentes conditions induisant l’état VBNC chez L. pneumophila... 28
Tableau 3 : Séquence en acides aminés de différentes Rpfs... 35
Tableau 4 : Organismes possédant des gènes rpf-like ... 37
Tableau 5 : Amorces utilisées pour réaliser la PCR... 54
Tableau 6 : Cultivabilité et viabilité de L. pneumophila après traitement par 20 mg/L de monochloramine et incubation dans le milieu de repos ... 62
Tableau 7 : Protéines dont la quantité augmente d’un facteur supérieur ou égal à 2 15 jours apès l’entrée dans l’état VBNC... 70
Tableau 8 : Protéines dont la quantité augmente d’un facteur supérieur ou égal à 2 après traitements par la monochloramine ... 70
Tableau 9 : Protéines dont la quantité augmente d’un facteur supérieur ou égal à 2 après 15 jours dans un milieu pauvre ... 70
Tableau 10 : Viabilité de Legionella pneumophila HL 0350 5056 non cultivable après traitement à 57,5 C pendant une heure... 78
LISTE DES ABREVIATIONS
ACES : N-(2-acétoamido)-2-aminoethanesulfonic acidACP : Acyl Carrier Protein
ADN : Acide Désoxyribonucléique ARN : Acide Ribonucléique APS : Ammonium PerSulfate
BCYE : Buffered Charcoal Yeast Extract BET : Bromure d’Ethidium
BYE : Buffered Yeast Extract
CHAPS : 3-[(3-Cholamidopropyl)dimethylammonio]-1-propanesulfonate hydrate (C32H58N2O7S)
CNRL : Centre National de Référence des Légionelles COT : Carbone Organique Total
CSHPF : Conseil Supérieur d’Hygiène Publique de France
DDASS : Direction Départementale des Affaires Sanitaires et Sociales DFA : Direct Fluorescent Antibody
DMI : Dose Minimale Inhibitrice DO600nm : Densité Optique à 600 nm
DPD : N,N-diéthylphénylène-1,4-diamine DTT : Dithiothreitol
DVC : Direct Viable Count
EDTA : Ethylenediaminetetraacetic acid (acide éthylène-diamine-tétraacétique) EUP : Eau Ultra Pure
FISH : Fluorescent In Situ Hybridization Hsp : Heat shock proteins
IEF : Focalisation IsoElectrique LB: Luria-Bertani
LLAP : Legionella-like amoebal pathogens
MALDI-TOF-MS : Matrix-Associated Laser Desorption Ionisation/Time Of Flight-Mass Spectrometer
MIF : Mature Intracellular Form
MOMP : Major Outer Membrane Protein OMP : Outer Membrane Protein
pb : paire de bases
PCR : Polymerase Chain Reaction PVC : Polychlorure de vinyle
PYG : Peptone Yeast extract Glucose Rpf : Resuscitation-promoting-factor
RT-PCR : Reverse-Transcriptase Polymerase Chain Reaction SDS : Sodium Dodecyl Sulfate
SDS-PAGE : Sodium Dodecyl Sulfate – PolyAcrylamide Gel Electrophoresis TEMED : N,N,N ,N -Tetramethylethylenediamine
UFC : Unité Formant Colonie UV : Ultra Violet
VBNC : Viable But NonCulturable 2D : Bidimensionnelle
INTRODUCTION GENERALE
Les légionelles sont des bactéries hydrotelluriques responsables d’infections pulmonaires chez l’Homme appelées légionelloses (Gaillot, 2004b). Ces bactéries sont présentes dans les réservoirs naturels ou artificiels d’eau douce tels que les réseaux de distribution d’eau chaude sanitaire (ballons de réserve d’eau, douches, robinets), les systèmes de climatisation les tours aéroréfrigérantes, les eaux thermales ou encore les fontaines décoratives où elles prolifèrent dans l’eau stagnante et lorsque la température de l'eau est comprise entre 25 et 43°C (Doleans
et al., 2004; Leoni et al., 2005; Tison & Seidler, 1983).
De nombreux travaux ont été effectués afin d’optimiser les méthodes de décontamination des réseaux de distribution et d’autres installations en vue d’éradiquer ces bactéries.
Par exemple, dans le cas des réseaux d’eau chaude sanitaires et plus particulièrement ceux des établissements de soin (hôpitaux, cliniques, …), lorsqu’une analyse d’eau révèle un taux supérieur à 1 000 UFC/L, une désinfection doit être réalisée. Les deux méthodes reconnues par la Direction Générale de la Santé pour la désinfection des réseaux sont le choc chloré et le choc thermique ((CSHPF), 2001).
D’autres désinfectants ou biocides sont également employés pour la désinfection, tels que d’autres agents oxydants (chloramines, composés bromés, iodés), l’ozone, les ultraviolets ou les ions métalliques (cuivre, argent), ... (Blanc et al., 2005; Cheng et al., 2007; Kim et al., 2002; Landeen et al., 1989; Mietzner et al., 1997).
Cependant, malgré la mise en place de traitements, on observe fréquemment une recolonisation des réseaux par ces légionelles peu de temps après désinfection.
Cette recontamination peut avoir plusieurs causes :
- la première est la présence de biofilms qui constituent des réservoirs pour plusieurs espèces de microrganismes dont les légionelles, et leur fournissent une protection vis-à-vis des agressions extérieures via la matrice extracellulaire. Les bactéries ainsi protégées peuvent survivre à l’action du désinfectant puis reformer un biofilm ou être décrochées de celui-ci et se retrouver dans l’eau circulante.
- la présence de protozoaires dont les amibes peuvent constituer une deuxième cause. En effet, les légionelles sont capables d’infecter des amibes, d’y survivre et de s’y multiplier
(Borella et al., 2005; Bozue & Johnson, 1996). Ces amibes sont capables de résister aux désinfectants, protégeant ainsi les bactéries. Ces dernières peuvent être par la suite libérées dans l’environnement, coloniser des biofilms ou infecter l’Homme.
- cette reprise d'activité peut également s’expliquer par la formation de bactéries viables mais non cultivables (VBNC) suite au traitement. Ces bactéries sont incapables de se développer sur les milieux de culture utilisés en routine dans les laboratoires (A.F.N.O.R., 2003) mais possèdent encore une activité métabolique (Oliver, 1993; Oliver, 2005). Dans certains cas, lorsque les conditions sont favorables, par exemple en présence d’amibes, les légionelles à l’état VBNC sont capables de retrouver leur capacité à se développer et à se multiplier sur milieu gélosé : cette étape est appelée « ressuscitation », « revivification » ou « réveil » (Garcia et al., 2007; Steinert et al., 1997). Les bactéries que l’on pensait mortes, puisque non détectables sur les milieux utilisés, sont de nouveaux détectables dans les réseaux.
L’objectif principal de nos travaux a été d’étudier l’état viable non cultivable chez L.
pneumophila. Pour cela, nous avons produit des VBNC en utilisant la monochloramine et le
traitement thermique. Ensuite, nous avons entrepris une analyse protéomique de façon à rechercher l’existence potentielle de protéines spécifiques de l’état VBNC et d’identifier éventuellement les voies métaboliques utilisées dans cet état.
La dernière partie de notre travail a porté sur une étude préliminaire d’une protéine que nous avons détectée chez L. pneumophila et qui est homologue aux protéines Rpf (Resuscitation promoting factor) décrites chez d’autres bactéries.
CHAPITRE 1 :
SYNTHESE BIBLIOGRAPHIQUE
1. LEGIONELLA
1.1. Historique
En 1976, 182 vétérans de la légion américaine, logeant dans un hôtel de Philadelphie et participant à la 56ème convention de l'American Legion, ont contracté une pneumonie sévère provoquant 34 décès (Fraser et al., 1977).
La bactérie à l’origine de cette épidémie a été isolée en 1977. Compte tenu des circonstances, la maladie causée par ce microorganisme a été appelée la « maladie des légionnaires » (ou légionellose) et la bactérie, Legionella pneumophila.
En 1979, le genre Legionella a été établi. Il s’agit du seul genre composant la famille des Legionellaceae.
Par la suite, des isolats, qui jusque là n’avaient pas été identifiés, ont été caractérisées rétrospectivement. En réalité, les premières souches de Legionella ont été isolées à partir de cobaye en utilisant des procédés destinés à l’isolement de Rickettsia mais ces bactéries n'ont fait l'objet d'aucune étude approfondie jusqu’en 1976 (Fields et al., 2002; Fraser, 2005).
1.2. La légionellose
Les légionelloses se présentent essentiellement comme des infections pulmonaires aigües. Les légionelles sont pathogènes ou potentiellement pathogènes pour l'homme et elles peuvent être isolées de crachats, de liquides de lavage broncho-alvéolaire, du parenchyme pulmonaire, du liquide pleural, du liquide péricardique, du sang, des valves cardiaques, d'abcès et de matériel médical (cathéters, sondes...).
La transmission de cette bactérie s'effectue par voie aérienne (inhalation d'eau contaminée, diffusée en aérosol).
Cliniquement, les infections de l’homme évoluent sous trois formes :
La fièvre de Pontiac : qui est une forme bénigne, analogue à un syndrome grippal, guérissant de façon spontanée en 2 à 5 jours. Elle représenterait 95% des cas (c'est-à-dire que sur 100 personnes contaminées, 95 développent la maladie).
La maladie des légionnaires : qui est une forme grave survenant chez les personnes fragilisées (personnes âgées, immunodéprimés, fumeurs, …) se caractérisant par une infection pulmonaire aiguë. Elle débute, après une incubation de 2 à 10 jours, par un syndrome pseudo-grippal. Ultérieurement, on observe une fièvre élevée, une dyspnée, une toux importante, une pleurésie, la formation d'abcès pulmonaires, des désordres rénaux (protéinurie, hématurie, insuffisance rénale), des troubles gastro-intestinaux (douleurs abdominales, vomissements, diarrhée) et, parfois, des troubles neurologiques (somnolence, délire, confusion). En l'absence de traitement antibiotique adapté, le taux de mortalité est important et peut atteindre 15 à 20%.
Les légionelloses extra-pulmonaires : elles sont rares mais très graves. Elles concernent principalement le cœur (myocardite, péricardite, endocardite), l'appareil digestif (péritonite, colite nécrosante, pancréatite), l'appareil musculaire, le système nerveux ou l'œil (rétinite).
Cette maladie n’est pas contagieuse (transmissible d’un sujet malade à un sujet sain) mais elle fait l'objet, en France, d'une surveillance qui repose sur la déclaration obligatoire instaurée depuis 1987. Le Centre National de Référence des Légionelles (CNRL) assure une activité d'expertise auprès des laboratoires.
En France, depuis le renforcement de la surveillance de la légionellose en 1997 et la sensibilisation des professionnels de santé, le nombre de cas de légionellose déclarés auprès des autorités sanitaires a augmenté. Il s'élève à 1443 cas pour l'année 2006 avec une incidence de 3,3 pour 100 000 habitants. Depuis 1998, plus de 10 épisodes de cas groupés de légionellose (ayant concerné chacun de 8 à 86 personnes) ont donné lieu à des investigations épidémiologiques et environnementales afin d'identifier la ou les source(s) de contamination. Dans de nombreux cas, la contamination de tours aéroréfrigérantes par les légionelles a été mise en cause (Paris 1998, Lens 2003-2004…). Les autres sources de contaminations incriminées dans les épidémies sont les circuits de distribution d'eau chaude sanitaire (douches), les systèmes de climatisation, les eaux thermales chaudes où les Legionella se multiplient à des températures comprises entre 20 et 45°C.
Le risque de contracter la légionellose pour une personne après avoir été exposée à de l'eau contaminée dépend de certains facteurs : les caractéristiques de l'exposition ainsi que l'état de santé de la personne exposée.
Le conseil Supérieur d’Hygiène Public de France a défini en 2005 ((CSHPF), 2005) deux catégories de population à risque :
- Les « personnes à haut risque » : les immunodéprimés sévères ou non suite à une transplantation ou greffe d’organe, ou suite à une corticothérapie prolongée (0,5 mg/kg de prednisone pendant 30 jours ou plus, ou équivalent) ou récente et à haute dose (c’est à dire supérieure à 5 mg/kg de prednisone pendant plus de 5 jours).
- Les « personnes à risque » : les personnes ayant un système immunitaire fortement diminué du fait d’une pathologie (hémopathie maligne, leucémie, cancers surtout bronchopulmonaires) ou d’un traitement immunodépresseur.
D’autres facteurs associés à la maladie ont été incriminés :
• l’âge supérieur à 50 ans, l’incidence augmentant avec l’âge : la maladie du
légionnaire est rare chez les personnes de moins de 20 ans. De très rares cas de légionellose ont été rapportés en pédiatrie chez les enfants immunodéprimés.
• le sexe masculin (3 malades sur 4 sont des hommes),
• les fumeurs (entre 1997 et 1999, 32 à 41 % des malades sont des fumeurs), • certaines maladies comme le sida, le cancer, le diabète …),
• les antécédents d’une intervention chirurgicale récente,
• les pathologies chroniques cardiaques, pulmonaires ou l’insuffisance rénale, • l'alcoolisme n’est pas toujours retrouvé dans la littérature.
Un certain nombre de cas s’observe néanmoins chez des sujets n’ayant pas de facteur de risque rapporté.
1.3. Présentation de la bactérie
1.3.1. Classification
La famille des Legionellaceae ne renferme que le genre Legionella et sa définition est identique à celle de son propre genre.
Les légionelles sont des bactéries de l'environnement, aptes à infecter des protozoaires et susceptibles de provoquer des infections chez l'Homme.
Le genre Legionella a suscité de nombreux travaux et, dès 1980, quatre nouvelles espèces ont été décrites. Actuellement, ce genre rassemble une cinquantaine d’espèces différentes et plus de 70 sérogroupes.
Il existe trois espèces pathogènes principales :
- L. pneumophila est la bactérie la plus importante en pathologie humaine. On connaît à l’heure actuelle 15 sérogroupes pour cette bactérie. Elle est l’agent responsable d’environ 90% des cas de légionelloses diagnostiqués en France. Le sérogroupe 1 est le plus fréquent (70 à 90% des cas) puis le sérogroupe 6 (les autres espèces sont généralement isolées chez les personnes immunodéprimées) (Jarraud et al., 2000).
- L. jordanis et L. bozemani sont à l’origine de moins de 10% et 3% des cas respectivement.
Plusieurs souches de légionelles, qualifiées de LLAP (Legionella-like amoebal pathogens) car elles induisent la lyse amibienne, n'ont pu être cultivées qu’en présence d’amibes et pourraient représenter plusieurs espèces différentes. En mai 2001, Adeleke et al. ont validé les nomenclatures de Legionella drozanskii, de Legionella fallonii et de Legionella rowbothamii pour sept souches de LLAP. Leur pouvoir pathogène, à l’exception de L. lytica, est actuellement inconnu (Adeleke et al., 2001; Hookey et al., 1996).
Le genre Legionella et la famille des Legionellaceae forment un groupe cohérent placé dans l'ordre des Legionellales (classe des Gammaproteobacteria, embranchement des "Proteobacteria"). Phylogénétiquement, les espèces les plus proches des Legionellaceae sont
Coxiella burnetii et Rickettsiella grylli, espèces actuellement exclues de l'ordre des Rickettsiales.
1.3.2. Description / Morphologie
Les légionelles se présentent sous forme de bacilles à Gram négatif (faiblement colorés) de forme coccobacillaire de 0,3 à 0,9 µm de large sur 2 à 20 µm (ou plus) de longueur, devenant filamenteux en culture, aérobies stricts, non sporulés, non acido-résistants, non capsulés. Ces bactéries sont d'origine hydrique et sont généralement mobiles (sauf L. oakridgensis) au moyen d'un ou plusieurs flagelles polaires ou subpolaires.
En culture, les colonies sont grisâtres, polymorphes avec un aspect en verre "brisé" à la loupe binoculaire.
1.3.3. Caractères microbiologiques et biochimiques
Ces bactéries possèdent deux catalases (KatA et KatB), hydrolysent l'hippurate et la gélatine. Ces deux derniers caractères sont variables selon les espèces et les souches d’une même espèce. Elles n'hydrolysent pas les sucres (ni fermentation ni oxydation), ne réduisent pas les nitrates et ne synthétisent pas d’uréase. La plupart des espèces produisent une β-lactamase et
les réactions d’oxydase sont variables selon les espèces.
Elles sont chimio-organotrophes et utilisent les acides aminés comme source d'énergie et de carbone (Benson & Fields, 1998). Ces bactéries synthétisent plus d'acides gras ramifiés que d'acides gras non ramifiés. Elles présentent jusqu’à 90% d’acides gras insaturés dans la paroi (caractère inhabituel pour une bactérie Gram négatif).
Le G + C % des diverses espèces varie de 38 à 52.
1.3.4. Caractères culturaux
Des légionelles ont été isolées dans des eaux de 6 à 66°C mais elles sont plutôt thermophiles avec un optimum compris entre 20 et 45°C.
Leur culture est favorisée en présence de 2,5 % de CO2 et nécessite de la L-cystéine et du fer. La croissance est optimale pour un pH légèrement acide (de l’ordre de 6,8-6,9) et, pour la majorité des espèces, pour une température de 36°C +/- 1°C pendant 3 à 10 jours.
Les cultures sont généralement réalisées sur gélose BCYE (Buffered Charcoal Yeast Extract) supplémenté en L-cytéine, en tampon ACES et en fer (Feeley et al., 1979). La source de fer peut être constituée par du nitrate de fer, du sulfate de fer, du chlorure de fer, de l’hématine ou de l’hémine mais, les meilleurs résultats sont obtenus avec du pyrophosphate de fer.
Les colonies sont grisâtres, de consistance muqueuse, de taille hétérogène et, observée à la loupe binoculaire, elles présentent généralement un aspect en « verre brisé ».
Les légionelles ne cultivent pas sur gélose au sang.
1.3.5. Facteurs de virulence
La virulence s’exprime au travers de facteurs phénotypiques ou génomiques qui peuvent aussi être influencés par l’environnement : ce sont des facteurs de surface, de sécrétion et déterminants périplasmiques et cytosoliques.
Une variété de structures de surface est impliquée dans la pathogénicité de Legionella.
Le Lipopolysaccharide (LPS) est situé à la surface de la bactérie. C’est un déterminant immunogène majeur de la surface des cellules qui intervient dans l’adhésion de
Legionella à la muqueuse respiratoire (Steinert et al., 2002).
La protéine MOMP (Major Outer Membran Protein) est une porine associée au peptidoglycanne, codée par ompS, capable de s’insérer dans les membranes, incluant celles des cellules hôtes, et d’ouvrir des canaux qui vont permettre le passage d’ions (Dowling et al., 1992; Gabay et al., 1985). Cette protéine se lie également aux récepteurs du complément CR1 et CR3 qui se trouvent à la surface des monocytes humains, favorisant l’attachement de la bactérie à la cellule hôte (Steinert et al., 2002).
Le pili de type IV est également produit par L. pneumophila. Il intervient dans le mécanisme d’attachement à la cellule hôte (Rossier & Cianciotto, 2001; Soderberg et al., 2004).
En ce qui concerne les flagelles, le gène de la flagelline est régulé par la température, la phase de croissance, les acides aminés, la viscosité ou la pression osmotique. Bien que les flagelles de Legionella ne soient pas nécessaires à la réplication intracellulaire, ils permettent d’augmenter la probabilité de rencontre avec une cellule hôte et la capacité d’invasion d’une façon indépendante de l’adhérence (Vogel & Isberg, 1999). Les flagelles ne constituent pas des adhésines.
La Protéine Mip (Macrophage infectivity potentiator) codée par le gène mip est une protéine de 24 kDa exprimée à la surface des L. pneumophila, qui est nécessaire pour les premières étapes d’infection intracellulaire des cellules hôtes (Cianciotto, 2001). Cette protéine possède une activité peptidyl-prolyl cis/ trans isomérase (PPIase) (Steinert et al., 2002).
La protéine de choc thermique de 60kDa (Hsp60) serait aussi impliquée dans l’attachement et l’entrée de Legionella dans les cellules épithéliales HeLa (Garduno et al., 1998). La synthèse de cette protéine est induite pendant la croissance dans les macrophages et
Des facteurs de sécrétion sont également impliqués dans la virulence et notamment le système dot/icm (defective for organelle trafficking/intracellular multiplication). C’est le système de sécrétion le plus important, dédié à faciliter l’infection intracellulaire. Il s’agit d’un système de sécrétion de type IV. Il est impliqué dans le mécanisme d’inhibition de la fusion phagosome-lysosome et semble essentiel pour la virulence chez l’animal (Cianciotto, 2001; Zink et al., 2002). Ce système est impliqué dans la virulence et la multiplication intracellulaire.
1.4. Ecologie des légionelles
Les légionelles sont présentes dans tous les environnements humides. Elles ont été isolées dans les écosystèmes naturels (eaux de surface, eaux douces (mares, étangs), rivières, sédiments humides : sol, boues ou les réseaux de distribution d’eaux (chaudes en particulier où elles sont présentes en grand nombre : eaux thermales,…) (Fliermans et al., 1981; Stout et
al., 1985). Elles sont également retrouvées dans des installations générant des aérosols telles
que les tours aéroréfrigérantes, jaccuzzis, installations de production et de distribution d'eau chaude sanitaire (ballons de stockage, réseaux d'eau, pommeaux de douche, robinets, etc) dans les établissements recevant du public, les établissements de santé, les établissements thermaux, les logements collectifs et les maisons individuelles de conditionnement d'air. Les sols non humides et les animaux ne sont pas des réservoirs de germes.
Des études environnementales réalisées essentiellement dans des lieux collectifs ont montré que 37 à 70% des équipements collectifs de distribution d’eau chaude étudiés contenaient des
Legionella, à une concentration variant de 50 à 106 UFC/L ((CSHPF), 2005).
Une autre étude, réalisée en mai 2000 par la DRASS d’Aquitaine et la DDASS de Gironde, sur la prévalence des Legionella dans les réseaux d’eau des établissements recevant du public et des établissements de santé a montré que :
- sur l’ensemble des analyses effectuées (930 au total), environ 32% sont positives ; - 16% des résultats d’analyses sont supérieurs à 1000 UFC/L ;
- 41,8 % des établissements ont au moins une analyse positive ;
- pour les établissements de santé, 34,3% des analyses sont positives et 21,8% des analyses sont supérieures à 103UFC/L ;
- pour les établissements recevant du public, 26,8 % des analyses sont positives et 12,5 % des analyses ont des résultats supérieurs à 1000 UFC/L.
17
Ces éléments sont représentatifs d’une situation globale alors que certains établissements n’ont pas mis en œuvre de plan rigoureux d’entretien des installations. Ces chiffres semblent montrer que la présence des légionelles dans les réseaux est une situation relativement courante. Il s’agit donc d’être vigilant dans la gestion des réseaux pour maîtriser le risque de prolifération des légionelles.
Ces différentes installations ont pour point commun de réunir les conditions favorisant le développement des Legionella et de leur multiplication :
- Caractéristiques propres aux réseaux : présence de bras morts (eau stagnante), nature des matériaux (fer, zinc, aluminium, chlorure de polyvinyle (PVC), …), pH de l’eau compris entre 6,8 et 7,0 (Levi, 2001; Ohno et al., 2003; Stout et al., 1985). La présence de dépôts de tartre ou de corrosion est un facteur favorisant le développement des légionelles.
- Caractéristiques de l’eau : présence de la bactérie plus marquée dans les eaux minéralisées, avec des hydrogénocarbonates, calcium, magnésium, fer, … Le carbone organique total tendrait à promouvoir le développement de L.
pneumophila alors que la présence de cuivre aurait une action inhibitrice (Leoni et al., 2005; States et al., 1985)
- Température de l’eau inférieure à 50°C : Les sources de contamination par les bactéries pathogènes les plus souvent incriminées sont les installations dont la température de l’eau est comprise entre 25 et 42°C (Ohno et al., 2003).
- La présence de biofilms : des prélèvements effectués sur les biofilms des installations ont montré leur colonisation par Legionella jusqu’à des concentrations de 105 UFC/cm2. Ces études montrent que les biofilms représentent un réservoir important de cette bactérie qui peuvent ensuite être détachés et entraînés avec le flux.
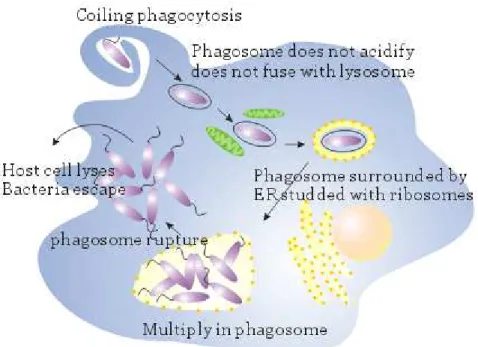
- La présence d’autres microorganismes : les légionelles peuvent en outre coloniser des amibes ou autres protozoaires ciliés dans lesquels elles survivent, se développent et contaminent le milieu après lyse de leur hôte (Figure 1) (Albert-Weissenberger et al., 2007; Fields et al., 2002).
Figure 2 : schéma d’infection d’une amibe par Legionella (http://www.mgc.ac.cn/VFs/Figures/Legionella/Legionella.png)
1.4.1. Interaction avec les amibes
Les légionelles sont les parasites d’au moins 2 espèces de protozoaires ciliés, dont
Tetrahymena, et 13 espèces d’amibes dont Acanthamoeba sp., Didasculus sp., Echinamoeba
sp., Hartmanella sp., Mayorella sp., Naegleria sp., Schizopyrenus sp., Vahlampfia sp. ... qui ont été isolées de systèmes contaminés par Legionella (Abu Kwaik et al., 1998; Bozue & Johnson, 1996; Steinert et al., 2002).
Les légionelles, pour survivre, pénètrent dans ces micro-organismes eucaryotes, en particulier les amibes libres, sont ensuite capables de détourner les systèmes de destruction habituellement mis en place par ces hôtes pour digérer les bactéries, puis se multiplient dans des vacuoles (Bozue & Johnson, 1996) (Figure 2). Après 36 à 48 heures d’infection, la vacuole de phagocytose emplie la quasi-totalité de la cellule hôte et contient un nombre important de bactéries qui vont être libérées dans l’environnement sous forme d’une vésicule remplie de légionelles, ou sous forme libre par lyse de l’amibe (Figure 1) (Abu Kwaik et al., 1998). Les légionelles vont ainsi pouvoir de nouveau coloniser des biofilms, infecter d’autres amibes ou contaminer l’Homme. Le parasitisme des protozoaires par les légionelles permet une pollution importante du milieu extérieur.
Dans les vacuoles, les légionelles sont mobiles, elles ont une taille inférieure à la taille des bactéries cultivées sur les milieux gélosés et elles acquièrent des propriétés particulières car, après avoir été libérées, elles sont plus résistantes aux conditions environnementales défavorables (températures élevées, acidité, pression osmotique, biocides, …) et leur pouvoir infectieux vis à vis des cellules de mammifères est plus important (Abu Kwaik et al., 1998; Philippe et al., 2006; Thomas et al., 2004).
En plus d’augmenter la virulence des légionelles, les amibes constituent une protection et leur permettent de survivre pendant de longues périodes lorsque les conditions sont défavorables comme, par exemple, dans des milieux pauvres en nutriments, des traitements visant à les éradiquer, etc (Bouyer et al., 2007; Neumeister et al., 2000; Thomas et al., 2004). Les amibes sont capables d’expulser des vésicules remplies de légionelles dans l’environnement ; vésicules à l’intérieur desquelles ces bactéries peuvent survivre pendant de longue périodes (Bouyer et al., 2007).
Il convient de remarquer que L. pneumophila est apte à infecter de nombreux micro-organismes eucaryotes ce qui pourrait expliquer que cette espèce soit largement répandue. L’adaptation vis-à-vis des eucaryotes, quant à elle, pourrait expliquer le fait que L.
pneumophila soit l'espèce la plus fréquemment impliquée dans les infections de légionelles
1.4.2. Colonisation des biofilms
Les biofilms sont des communautés de microorganismes enchassées dans une matrice d’exopolymères (Costerton et al., 1994; Donlan, 2002).
Cette communauté peut être constituée de bactéries, de champignons, de protozoaires tels que les amibes, d’algues et d’autres organismes procaryotes ou eucaryotes.
Certaines souches du genre Legionella, dont L. bozemanii et L. pneumophila, sont capables de former des biofilms mono-espèces ou de coloniser des biofilms multi-espèces (Declerck et al., 2007; Fields et al., 2002; Murga et al., 2001; Rogers et al., 1994; Steinert et
al., 2002). Ces biofilms peuvent fournir aux légionelles une protection vis-à-vis des
agressions extérieures, notamment au cours de la désinfection (Green, 1993; Green & Pirrie, 1993; Murga et al., 2001; Rogers et al., 1994).
Ils peuvent également être le siège de la multiplication de ces bactéries, mais il semblerait que les légionelles nécessitent la présence d’amibes telles que Hartmanella
vermiformis ou Acanthamoeba castellanii pour pouvoir s’y multiplier (Declerck et al., 2007;
Kuiper et al., 2004; Murga et al., 2001). Récemment, il a été montré que Legionella était capable d’utiliser les cellules bactériennes mortes des biofilms comme source de nutriments pour se multiplier (Temmerman et al., 2006).
1.5. Cycle de vie de L. pneumophila
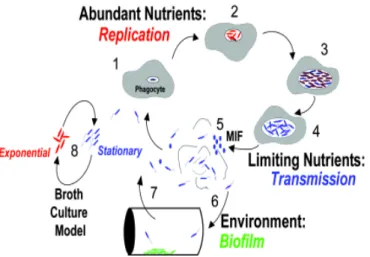
Dans l’environnement, le cycle de vie de L. pneumophila consiste en au moins deux phases (Molofsky & Swanson, 2004) (Figure 3).
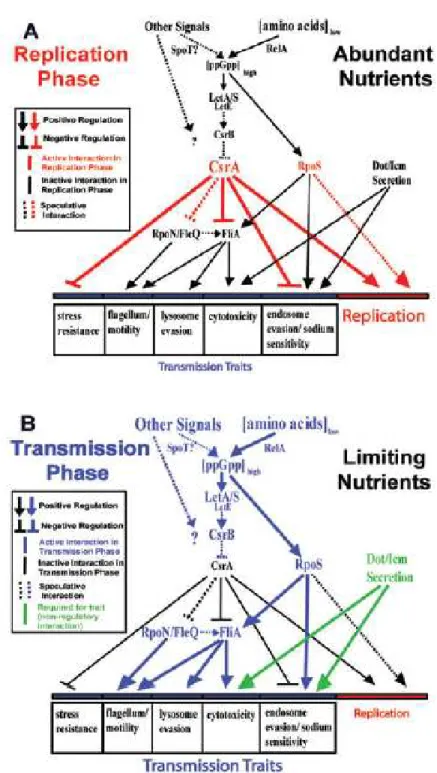
Figure 4 : Expression des phénotypes pendant les phases de réplication (A) et de transmission (B) (Molofsky & Swanson, 2004)
1.5.1. La phase de réplication
Associée à la phase exponentielle de croissance, elle est rencontrée quand les conditions du milieu sont favorables à la croissance (Figure 3). Pendant cette phase, les gènes de virulence sont peu exprimés, la bactérie se multiplie mais est plus sensible aux stress environnementaux (Figure 4A).
Pendant cette phase, au cours de laquelle les nutriments sont abondants, le régulateur post-transcriptionnel CsrA (Carbon Storage Regulator A) est exprimé et joue un rôle important dans l’activation de la réplication et la répression de la phase de transmission (Molofsky & Swanson, 2003). En effet, ce régulateur, en réprimant le facteur sigma flagellaire FliA de façon directe ou indirecte via le facteur sigma RpoN (sigma 54) et/ou FleQ, va aussi réprimer les caractéristiques et les traits de virulence qui sont associées à la phase de transmission, c'est-à-dire : la production de flagelles, l’évasion de la fusion phagosome-lysosome et la cytotoxicité. Il va également réprimer la résistance aux stress environnementaux et l’évasion de l’endosome (Molofsky & Swanson, 2003).
1.5.2. La phase de transmission
Associée à la phase stationnaire, elle est exprimée lorsque le milieu devient défavorable à la croissance (peu de nutriments). Pendant cette phase, L. pneumophila ne se réplique pas mais certains caractères, dont les gènes de virulence, sont exprimés de façon à augmenter la résistance aux stress environnementaux.
Le passage de L. pneumophila de la forme réplicative à la forme transmissive fait intervenir des réactions en cascade impliquant différents médiateurs : ppGpp, LetA/LetS, RpoS, FliA et LetE (Figure 4B).
Lorsque le milieu devient pauvre en nutriments, la diminution de la quantité d’acides aminés stimule la production de l’« alarmone » ppGpp (guanosine 3’, 5’-bipyrophosphate), un second messager (synthétisé par l’enzyme RelA et l’hydrolase/synthase SpoT) qui coordonne l’entrée dans la phase de transmission avec induction des caractères qui y sont associés (Hammer & Swanson, 1999).
L’augmentation de ppGpp induit, entre autres, l’activation du facteur sigma RpoS ( S/ 38) qui, à son tour, active d’autres gènes. L’ensemble de ces phénomènes conduit à une augmentation de la sensibilité de la bactérie vis-à-vis du sodium, la mobilité et la capacité d’évasion de la fusion phagosome-lysosome (Bachman & Swanson, 2001).
En parallèle, une autre voie RpoS-indépendante est activée par le ppGpp : elle fait intervenir le système à deux composantes LetA/LetS et le regulon LetE, qui répriment le régulateur post-transcriptionnel CsrA via CsrB. Ainsi CsrA ne peut plus réprimer le facteur sigma flagellaire FliA, RpoN (sigma 54) et/ou FleQ. Ceci entraîne l’activation des caractères de résistance aux stress environnementaux, la mobilité, la cytotoxicité et l’évasion de l’endosome et du lysosome (Bachman & Swanson, 2004; Molofsky & Swanson, 2004).
La bactérie en phase de transmission, pourra infecter un macrophage et y persister plusieurs jours sans se répliquer (Molofsky & Swanson, 2003). Par contre, si les bactéries ingérées sont en phase réplicative, elles seront plus sensibles aux systèmes de destruction de cet hôte et seront plus facilement détruites.
1.5.3. La forme MIF (Mature Intracellular Form)
Lorsque L. pneumophila est cultivée dans des cellules HeLa, les amibes ou les macrophages, elle peut être présente sous deux formes : la forme réplicative (décrite dans le paragraphe 1.5.1) et, après des cultures prolongées, une forme morphologiquement distincte ressemblant à un kyste : la forme MIF (Mature Intracellular Form) (Garduno et al., 2002). Sous cette forme, la bactérie se présente sous la forme d’un bâtonnet court avec une paroi très épaisse lui donnant un aspect de kyste, possède un métabolisme réduit et plusieurs traits communs avec les cellules en phase stationnaire de croissance en milieu liquide comme la composition de la membrane externe.
Cependant, les légionelles sous la forme MIF possèdent plus de protéines, dont Hsp60 (qui sert d’invasine dans les cellules HeLa), dans leur membrane externe que les cellules en phase stationnaire et expriment un marqueur de transition entre la forme réplicative et la forme MIF appelé protéine MagA (MIF-associated gene), de fonction inconnue mais ressemblant aux alkylhydroperoxide reductases (AhpC), suggérant un rôle possible dans la protection vis-à-vis des stress oxydants (Hiltz et al., 2004).
Ces légionelles sont également 10 fois plus infectieuses que les cellules en phase stationnaire, plus résistantes à certains antibiotiques et détergents et tolèrent des gammes de pH élevés.
Cette forme ne semble être rencontrée que lors d’infection de cellules eucaryotes et est supposée être une forme transmissive de L. pneumophila dans l’environnement.
2. L’ETAT VIABLE NON CULTIVABLE (VBNC)
2.1. Définition
Le cycle de vie bactérien comprend deux parties : l’étape de croissance et l’étape de survie. La capacité des bactéries à survivre dans les environnements hostiles est essentielle pour leur persistance.
Lorsque les conditions de l’environnement sont défavorables, les bactéries sporulantes (telles que Bacillus, Clostridium, Sporosarcina) produisent des structures particulières : les endospores. Ces cellules dites « dormantes », particulièrement résistantes à la chaleur, aux UV, aux agents chimiques ou encore la dessiccation, peuvent maintenir leur viabilité pendant de longues périodes, attendant des conditions favorables pour germer.
Certaines bactéries non-sporulantes, quant à elles, utilisent d’autres voies lorsqu’elles sont exposées à des conditions hostiles. Elles sont capables d’entrer dans un état « végétatif » en modifiant leur métabolisme. Cet état est souvent référencé comme un état « viable non cultivable » (VBNC) (Yamamoto, 2000). Il a été décrit pour la première fois chez Vibrio
cholerae (Xu & al., 1982).
Les bactéries à l’état VBNC sont incapables de cultiver sur les milieux de culture conventionnels mais possèdent néanmoins une activité métabolique (Yamamoto, 2000).
Cet état est complexe et sa définition très controversée. En effet, cette définition s’applique à deux états physiologiques différents et peut correspondre à des bactéries :
- potentiellement réplicatives c'est-à-dire pouvant retrouver leur capacité à cultiver si
des conditions spécifiques sont rencontrées ; ce qui conduit à la « ressuscitation » ou « réveil » des cellules (McDougald et al., 1998). Ce réveil est la démonstration de l’existence d’un l’état VBNC chez l’espèce bactérienne considérée. Dans ce cas, l’état VBNC constituerait donc une stratégie de survie vis-à-vis des conditions défavorables de l’environnement (Colwell, 2000).
- en phase de transition, de la vie vers la mort cellulaire, dans laquelle ces bactéries possèdent encore des signes d’activité métabolique et de respiration mais se dégradent progressivement (Yamamoto, 2000).
Des transformations cellulaires telles que la réduction de la taille des cellules, la diminution de la quantité d’ARN, la condensation du cytoplasme, l’incapacité à se multiplier ou encore la réduction de l’activité métabolique caractériseraient cet état VBNC (Byrd, 2000; McDougald et al., 1998; Tangwatcharin et al., 2006).
Cet état survient majoritairement dans la phase de survie, après la phase stationnaire. Plus de 60 espèces bactériennes sont décrites comme étant capables d’entrer à l’état VBNC, incluant de nombreux pathogènes humain, Gram positifs (Listeria monocytogenes,
Enterococcus, Micrococcus luteus, …) et Gram négatifs (E. coli, Vibrio cholerae, Vibrio vulnificus, Legionella pneumophila, Campylobacter jejuni, Salmonella enterica, Pseudomonas, Helicobacter pylori, …) (Tableau 1) (Oliver, 2005). Cet état intervient lorsque
ces microorganismes sont exposés à différents stress comme la diminution de la quantité de nutriments disponibles, la température, la salinité, la teneur en oxygène, etc (Gauthier, 2000).
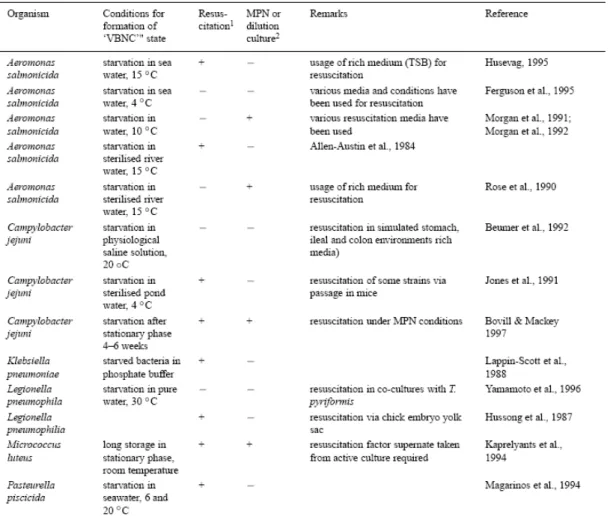
Tableau 1 : Conditions de formation et réveil de VBNC chez différentes bactéries (Kell et al., 1998)
2.2 L’état VBNC chez L. pneumophila
Différentes études ont pu montrer que L. pneumophila était capable de former des VBNC dans diverses conditions et d’être revivifiées (c'est-à-dire retrouver leur caractère cultivable) par différents procédés dont la co-culture avec des protozoaires (Tetrahymena
pyriformis GL, A. castellanii, A. polyphaga).
Les températures élevées, les pH extrêmes (Ohno et al., 2003), la faible quantité de nutriments (Paszko-Kolva et al., 1992; Yamamoto et al., 1996) ou encore les traitements oxydants (Bej et al., 1991; Garcia et al., 2007; Huq et al., 2003) ont été rapportés comme pouvant induire la formation de VBNC chez cette bactérie (Tableau 2).
Tableau 2 : Différentes conditions induisant l’état VBNC chez L. pneumophila
L. pneumophila Strain Stress condition Methods used to prove the VBC state Authors Serogroup 1
(Philadelphia, Stafford 62210)
Starvation in tap water,
4°C and 37°C Yolk sac chick embryo (Hussong et al., 1987) Bloomington
(serogroup 3) Chlorine treatment (100 ppm, 1h) Respiratory activity (Bej et al., 1991) - Environnmental strain
(GIFU 11041) - Clinical (GIFU 9888)
- Avirulent mutant (GIFU 11940)
Ultra pure water (37°C, 35d) - Esterase activity - protozoa ciliated (Tetrahymena pyriformis GL) (Yamamoto et al., 1996)
Philadelphia JR 32 Sterilized tap water (20°C, 125d)
- Acridine Orange Direct Count (AODC)
- Amoeba (Acanthamoeba castellanii)
(Steinert et al., 1997)
Suzuki (sérogroupe 1) Hot water with high mineral content (pH 5, 15d)
- Membrane integrity
(BacLight) (Ohno et al., 2003) Suzuki (sérogroupe 1) (42°C, 65d) Tap water - Membrane integrity (BacLight)
- Amoeba (Ohno et al., 2003) Various serogroup 1 NaOCl treatment - Acanthamoeba polyphaga (Garcia et al., 2007)
2.2.1. Carence en nutriments
Cette condition d’induction de l’état VBNC a fait l’objet d’un grand nombre d’études (Tableau 2).
L’état VBNC a été décrit pour la première fois chez différentes souches de Legionella
pneumophila serogroupe 1 en 1987, suite à la découverte, dans des échantillons provenant du
Stafford District General Hospital très peu de temps après une épidémie de légionellose, de légionelles non détectées sur milieu gélosé mais détectées grâce à une méthode de comptage direct utilisant des anticorps fluorescents (DFA) (Hussong et al., 1987). Cette équipe a supposé que ces bactéries, à l’image de ce qui avait été découvert chez Vibrio cholerae en 1985, devaient être à l’état viable non cultivable (Colwell et al., 1985). Par conséquent, ils ont étudié la croissance et la survie de deux souches de L. pneumophila (Philadelphia et Stafford 62210) dans de l’eau du robinet à 4°C et/ou 37°C. Il s’est avéré que ces bactéries devenaient non cultivables après 74 et 40 jours à 4°C et 37°C respectivement mais étaient toujours fortement détectées par les anticorps fluorescents et semblaient toujours viables. Des tests d’infection d’œufs embryonnaires de poulet ont montré que ces bactéries étaient capables de retrouver leur capacité à cultiver sur milieu gélosé mais que la virulence de ces bactéries à l’état VBNC était, cependant, réduite envers ces œufs embryonnaires par rapport aux cellules cultivables.
Dix ans plus tard, Steinert et al. (1997), en réalisant une expérience similaire à celle de Hussong et al, ont montré que des légionelles incubées dans de l’eau du robinet stérile à 25°C pendant 125 jours perdaient la capacité à former des colonies sur milieu gélosé (<1 UFC/mL); mais possédaient encore une activité métabolique (acridine orange). Ces mêmes cellules co-cultivées à 37°C avec Acanthamoeba castellanii, protozoaire largement répandu dans l’environnement, ont retrouvé leur capacité à cultiver sur milieu gélosé après 24 H d’incubation.
2.2.2. Influence de la température
La température de l’eau est sans doute un des paramètres les plus importants gouvernant la présence de Legionella puisqu’elle influence à la fois sa multiplication et sa survie. En effet, il est admis que cette bactérie se multiplie dans le milieu hydrique à des températures comprises entre 25°C et 42°C et qu’elle a la capacité d’y survivre entre 6 et 66°C (Fliermans et al., 1981; Wadowsky et al., 1985). Lorsque la température atteint des valeurs supérieures à 40°C, la quantité de bactéries cultivables diminue de façon importante en fonction du temps
d’incubation bien qu’une activité métabolique soit maintenue (Ohno et al., 2003; Wadowsky
et al., 1985).
2.2.3. Influence de la teneur en oxygène dissous
Les légionelles sont des bactéries aérobies ; elles exigent pour leur croissance la présence d’oxygène à une teneur supérieure à 2,2 mg/l.
Legionella pneumophila ne se multiplie que dans des conditions aérobies (6,0 à 6,7 mg/l
d’oxygène dissous) (Wadowsky et al., 1985). Dans ces conditions, la population bactérienne augmente de 1 log après 7 jours d’incubation à 35°C. Par contre, pour des teneurs moins élevées en oxygène (1,7 à 2,2 mg/l d’oxygène dissous), aucune multiplication n’a pu être observée ; au contraire, à partir de 7 jours d’incubation à 35°C à ces teneurs, la population bactérienne diminue de 0,5 log, puis de 1,7 log au bout de 28 jours.
2.2.4. Influence du pH
La croissance de Legionella, dans l’eau potable, a été observée à des pH compris entre 5,5 et 9,2 avec un optimal à pH 6,9 (Wadowsky et al., 1985).
Les travaux menés par Ohno et al. en 2003, ont montré qu’il existait une relation entre la température et le pH pour la survie de cette bactérie : plus le pH s’éloigne de la neutralité et moins la survie est importante, et pour un pH donné, la survie baisse quand la température s’élève. Par exemple, à pH 10,0 à 42°C, les légionelles perdent rapidement à la fois leur cultivabilité et leur activité métabolique (les bactéries sont tuées) alors qu’à pH 5,0 à la même température, la cultivabilité est perdue mais l’activité métabolique est maintenue pendant au moins 61 jours (les bactéries sont dans un état VBNC). A pH 6,0 et 8,0, à la même température, la cultivabilité est lentement perdue.
2.2.5. Influence de la salinité
Des travaux portant sur l’effet conjugué de la salinité et de la température sur la croissance de
L. pneumophila ont montré que pour des températures comprises entre 4 et 20°C, les variations de concentration de sels ont peu d’influence sur Legionella (Heller et al., 1998). En réalité, sur cette gamme de température, Legionella peut survivre dans des solutions allant jusqu’à 3% de salinité.
Par contre, pour des températures plus élevées, une corrélation a été observée entre l’augmentation de la concentration en NaCl et la réduction du nombre de cellules. Par
exemple, pour des températures de 30°C et 37°C, les fortes concentrations en sels (supérieures à 1,5%) provoquent une forte diminution du nombre de cellules.
Cependant, dans cette étude, aucun marqueur de viabilité n’a été utilisé. Par conséquent, il est difficile de savoir si les bactéries non cultivables étaient des VBNC.
2.2.6. Traitements oxydants
De nombreuses études ont été menées sur l’impact des traitements (chlore, chaleur, ozone, UV, monochloramine) sur L. pneumophila (Chang et al., 2007; Cunliffe, 1990; Green & Pirrie, 1993; Kool et al., 1999; Muraca et al., 1987). La plupart d’entre elles, basées simplement sur des analyses de cultivabilité, montre une action efficace des traitements sur la réduction et l’inactivation des légionelles (Cunliffe, 1990; Flannery et al., 2006; Green & Pirrie, 1993; Kool et al., 1999; Kuchta et al., 1983; Muraca et al., 1987).
Cependant, Bej et al. (1991), en utilisant un marqueur de viabilité en complément des méthodes de culture sur milieu gélosé, ont montré que des traitements au chlore utilisés pour désinfecter des tours aéroréfrigérantes étaient capables d’induire la production de bactéries viables non cultivables.
Récemment, Garc a et al. en 2007, ont mené une étude sur sept souches de L. pneumophila cliniques et environnementales traitées par 256 mg/L d’hypochlorite de sodium (NaOCl) dans du milieu BYE. Cette étude a montré que des souches qui n’étaient plus cultivables 22 à 46 heures après le traitement par le NaOCl étaient capables de retrouver leur capacité à se multiplier après avoir été mis en présence d’Acanthamoeba polyphaga. Ce qui confirme la présence de VBNC après traitement NaOCl.
2.3 Analyse de l’état VBNC
A notre connaissance, aucun travaux portant sur une analyse moléculaire approfondie de l’état VBNC chez Legionella n’est à l’heure actuelle disponible dans la littérature.
Cependant, ce type d’analyse a été entrepris pour l’étude de l’état VBNC chez d’autres bactéries, telles que Enterococcus feacalis, Vibrio cholerae, Escherichia coli O157 :H7,
Lactobacillus, en utilisant une approche protéomique ou transcriptomique (Asakura et al.,
Heim et al. (2002) ont étudié les variations du protéome chez E. faecalis à l’état VBNC après une incubation de 20 jours dans de l’eau de lac à 4°C. Ils ont montré que les bactéries en carence nutritionnelle mais cultivables et à l’état VBNC présentaient des profils différents. Ces profils différaient également de celui des bactéries en phase exponentielle de croissance.
Dans cette étude, une analyse protéomique partielle a montré une diminution de la quantité de certaines protéines importantes durant l’état VBNC :
- deux protéines de stress, GroEL et DnaK ;
- la fructose biphosphate aldolase, protéine clé dans la voie de la glycolyse, l’enolase (glycolyse), l’ATP synthase (phosphorylation oxydative) et l’enoyl-ACP reductase (biosynthèse des phospholipides), une protéine homologue au système mannose-specific phosphotransferase (PTS) de Clostridium acetobutylicum, le facteur d’élongation EF-Tu, impliqué dans la synthèse protéique, la régulation de la croissance et la réponse au stress ce qui semble être en accord avec la diminution de l’activité métabolique observée durant l’état VBNC ;
En revanche, l’accumulation de la quantité de trois protéines est observée dans les cellules à l’état VBNC :
- une protéine homologue du facteur d’élongation factor Ts (EF-Ts) de Listeria
innocua,
- une protéine homologue de la fructose-bisphosphate aldolase de Streptococcus
pneumoniae,
- une protéine régulatrice de catabolites (putative catabolite regulator protein CRP, CAA09491).
L’analyse de l’expression de ces trois protéines par RT-PCR (Reverse-Transcriptase Polymerase Chain Reaction) a montré qu’elles étaient exprimées dans cet état pendant au moins 14 jours.
Une autre protéine (30 kDa, pI = 6) est observée seulement chez les cellules à l’état VBNC. Cette protéine n’a pas pu être identifiée mais il est possible qu’elle corresponde à une forme modifiée de l’enoyl-ACP reductase, cette hypothèse provenant de la comparaison des gels 2D obtenus à partir de différents états cellulaires.
La comparaison des profils 2D obtenus à partir des différents états cellulaires (carence nutritionnelle, VBNC et phase exponentielle) montre une certaine spécificité pour l’état VBNC. L’enoyl-ACP reductase est réprimée dans l’état VBNC mais aussi en carence
nutritionnelle, ce qui n’est pas le cas du facteur d’élongation EF-Ts, de la fructose biphosphate aldolase et de la mannose-specific PTS dont la variation de synthèse (amplification ou réduction) semble spécifique de l’état VBNC.
Pour Escherichia coli O157 :H7, une perte totale de cultivabilité est observée après 48 heures d’incubation dans du tampon phosphate (PBS) contenant 0,05 % de peroxyde d’hydrogène (H2O2), alors que 11 % de la population possèdent encore une intégrité membranaire. Une incubation de 72 heure conduit à une réduction importante du nombre de cellules à membrane intègre (0,4 %) (Asakura et al., 2007b). Le facteur d’élongation EF-Tu, qui était sous-exprimé chez E. faecalis (Heim et al., 2002), voit son expression maintenue chez E. coli. Ceci laisse supposer un maintien de la synthèse protéique chez cette bactérie (Asakura et al., 2007b). Une accumulation importante de la quantité d’une protéine de la membrane externe, OmpW, a été observée dans l’état VBNC. Cette protéine, bien que possédant une fonction inconnue, pourrait être une protéine de réponse à l’oxydation par le H2O2.
Une accumulation de la quantité d’homosérine kinase (ThrB), impliquée dans la biosynthèse de la thréonine, est également observée à l’état VBNC.
Parmi les protéines dont la synthèse est diminuée après 48 heures d’incubation dans l’H2O2, on retrouve des facteurs de réponse au stress oxydatif : l’Alkyl hydroperoxide reductase (AhpCF) et la Dihydrolipoyllysine-residue Acetyltransferase (AceF).
L’analyse transcriptomique de Vibrio vulnificus à l’état VBNC suite à un stress à 4°C dans une eau de mer artificielle pendant 70 jours, a permis de mettre en évidence l’induction et la répression de centaines de gènes par rapport aux cellules en phase stationnaire (Asakura
et al., 2007a). Ces gènes ont été classés suivant leur fonction : Synthèse protéique,
métabolisme énergétique, enveloppe cellulaire, processus cellulaires, fonction régulatrice, synthèse d’acides aminés, protéines de transport,…
Parmi les gènes sur exprimés à l’état VBNC, on retrouve des gènes codants pour :
- des protéines de transport de métaux : fer, magnésium, potassium et cobalamine
(vitamine B12)
- des protéines impliquées dans la chimiotaxie (qui est le mouvement des cellules
vers ou loin d'une substance en réponse à son gradient de concentration : ceci est important pour la recherche de la nourriture, fuir les toxiques, …)
- des protéines associées au flagelle (flaC : qui code pour un composant intervenant
dans l’assemblage du filament, fliG codant pour une protéine moteur) alors que le gène fliN codant pour une protéine impliquée dans la rotation du flagelle et nécessaire pour la formation du crochet est sous exprimé dans cet état
- protéines associées à l’enveloppe : PilQ impliquée dans l’assemblage du pili de
type IV, la lipoprotéine NlpL, une « outer membran protein »de transport de nitrate/sulfonate/bicarbonate de type-ABC et une UDP-glucose-6-dehydrogénase - une chitinase jouant un rôle majeur dans l’utilisation de la chitine par la bactérie
Nous pouvons constater, au regard des résultats obtenus, que les protéines dont la synthèse est augmentée à l’état VBNC chez ces différentes bactéries semblent différentes. L’état VBNC étant obtenu dans des conditions différentes, il est possible que l’expression du protéome ou du transcriptome des bactéries soit fonction des conditions conduisant à l’état VBNC, du temps passé dans cet état ou encore de l’espèce bactérienne.
Figure 5 : Alignement partiel de séquences en acides aminés de Rpfs chez les mycobactéries. (Zhu et al., 2003) (MluZ96935 est la Rpf de M. luteus ; Rv0867c, Rv1009, Rv1884c, Rv2450c sont des protéines de M. tuberculosis ; ML0240 and ML2030, de M. leprae ; Av27 de M. avium contig27 ; Mptb de M. avium subsp. paratuberculosis contig1289 ; MS3310 et MS3312 de M. smegmatis. Les cadres en grisé indiquent des résidus identiques et les lettres encadrées des résidus similaires).
3. UN NOUVEAU FACTEUR DE RESSUCITATION :
LA PROTEINE Rpf (Resuscitation-promoting-factor)
3.1. Rpf chez les bactéries Gram positives :
En 1994, Votyakova et al., ont observé que des cultures de Micrococcus luteus, devenues non cultivables après être restées en phase stationnaire prolongée (3 à 6 mois), étaient capables de retrouver leur capacité à cultiver sur milieu gélosé après avoir été mises en présence d’un surnageant de M. luteus prélevé en fin de phase exponentielle (Votyakova et
al., 1994).
Les premiers travaux réalisés à partir d’un surnageant de M. luteus ont permis d’isoler et caractériser une protéine de 17 kDa. Cette protéine, nommée Rpf (Resuscitation-promoting factor), est capable de réveiller des cultures de M. luteus non cultivables à très basses concentrations (de l’ordre du picomolaire) et est nécessaire pour la croissance du microorganisme en milieu minimum (Mukamolova et al., 1998a; Mukamolova et al., 1998b). Le gène rpf semble nécessaire au microorganime, car un mutant rpf ne peut pas être obtenu, à moins qu’une seconde copie fonctionnelle du gène rpf soit présente sur un plasmide (Mukamolova et al., 1998a).
Ce facteur, bien que produit chez M. luteus, a aussi la capacité de stimuler la croissance de mycobactéries (Mukamolova et al., 1998a). Rpf est le premier facteur de croissance bactérienne qui ait été identifié.
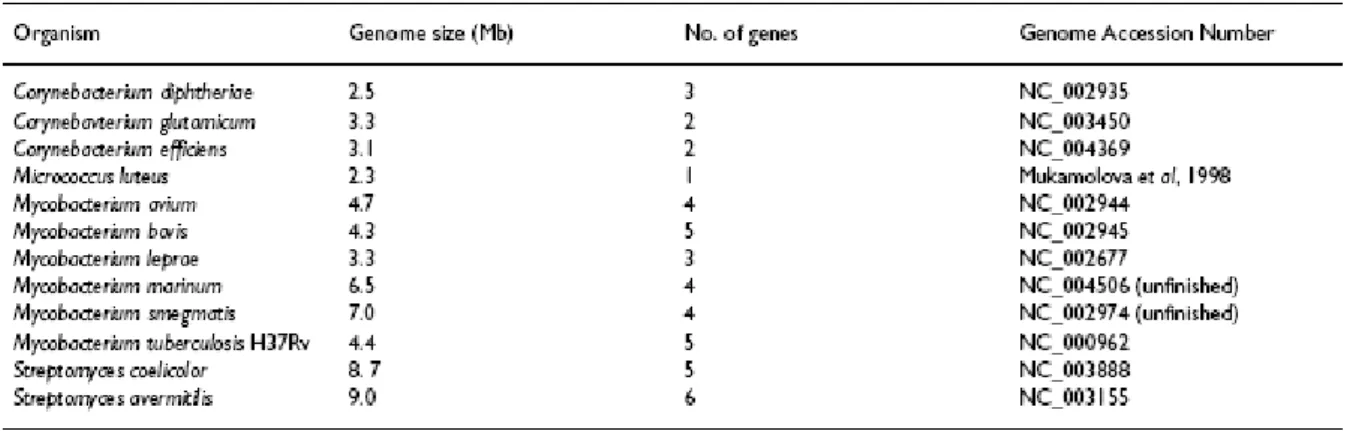
La comparaison de la séquence primaire de Rpf avec les bases de données accessibles en ligne a permis de mettre en évidence l’existence de gènes rpf chez d’autres actinomycètes tels que Mycobacterium tuberculosis (5 rpf) et M. leprae (2 rpf), Corynebacterium
glutamicum, plusieurs espèces de Streptomyces (Mukamolova et al., 1998a; Zhu et al., 2003), Brevibacterium ou encore Rhodococcus (Schroeckh & Martin, 2006) (Figure 5 et Tableau 3).
Contrairement à M. luteus, qui ne possède qu’un gène rpf, la plupart de ces microorganismes en possèdent plusieurs (Ravagnani et al., 2005) (Tableau 4).
Tableau 4 : Organismes possédant des gènes rpf-like (Ravagnani et al., 2005).
Chez M. tuberculosis par exemple, les cinq gènes (rpf A, B, C, D et E) sont exprimés lorsque les cellules sont en phase exponentielle de croissance. Les cinq protéines Rpfs stimulent la croissance de M. luteus, Mycobacterium smegmatis et M. bovis à des concentrations de l’ordre du picomolaire.
L’inactivation d’un seul de ces cinq gènes, quelqu’il soit ( rpf A, B, C, D ou E), ne conduit à aucune différence de croissance in vitro et in vivo de survie à long terme ou de capacité à réveiller les VBNC par rapport à la souche sauvage (Downing et al., 2004; Downing et al., 2005). La perte d’un de ces gènes affecte néanmoins l’expression d’un grand nombre de gènes (groEL 1 et 2, groES, cspA, etc…) chez la bactérie. L’inactivation de trois gènes sur cinq ( rpfA rpfC rpfB ou rpfA rpfC rpfD), quant à elle, conduit à une réduction important de la virulence in vivo, empêche le réveil des VBNC et altère la croissance à long terme du microorganisme (Downing et al., 2005).
Ces cinq gènes sont individuellement dispensables pour la croissance, la survie du microorganisme et le réveil des VBNC mais ils sembleraient tout de même jouer un rôle collectif pour permettre le réveil des VBNC.
Toutes les protéines testées jusqu’à présent montrent, à basses concentrations (de l’ordre du picomolaire), une activité croisée entre les espèces produisant des Rpfs. Par exemple, des essais réalisés avec des protéines produites par R. fascians, A. globiformis et M.
luteus ont montré qu’elles étaient capables de réveiller M. luteus à l’état de dormance. Par
contre, des tests effectués avec R. rhodochrous, R. fascians et M. luteus ont montré un effet stimulant des Rpf produites par les 3 espèces sur les deux Rhodococcus, alors que M. luteus ne peut être ressuscité que par son propre surnageant.