HAL Id: dumas-01880402
https://dumas.ccsd.cnrs.fr/dumas-01880402
Submitted on 25 Sep 2018HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
To cite this version:
Olivier Dardelet. Les métallothionéines : revue de la littérature. Sciences pharmaceutiques. 1988. �dumas-01880402�
AVERTISSEMENT
Ce document est le fruit d'un long travail approuvé par le
jury de soutenance et mis à disposition de l'ensemble de la
communauté universitaire élargie.
Il n’a pas été réévalué depuis la date de soutenance.
Il est soumis à la propriété intellectuelle de l'auteur. Ceci
implique une obligation de citation et de référencement
lors de l’utilisation de ce document.
D’autre part, toute contrefaçon, plagiat, reproduction illicite
encourt une poursuite pénale.
Contact au SID de Grenoble :
bump-theses@univ-grenoble-alpes.fr
LIENS
LIENS
Code de la Propriété Intellectuelle. articles L 122. 4
Code de la Propriété Intellectuelle. articles L 335.2- L 335.10
http://www.cfcopies.com/juridique/droit-auteurANNEE 1986,.
U.F.R. DE PHARMACIE
Domaine de la Merci - La Tronche
TITRE DE LA THESE
LES METALLOTHIONEINES REVUE DE LA LITTERATURE
T H E 5 E
N° d'ORDRE
~
Pr~sentée à
l
1UNIVERSITE SCIENTIFIQUE TECHNOLOGIQUE, e
t
~EDICALEDE GRENOBLE,
pou
r
ob
ten
ir
le
g
rade
de
:
DOCTEUR EN
PHARM~CIE.par
M. DARDELET OLIVIER
Cette Thèse sera soutenue publiquement le 25 MARS 1988
devantM. (Mme) le Professeur
A
FAVIER
, Président du Jurydocteur es sciences pharmaceutiques
et
M. le Professeur
M.
PIERRE JEAN LOUIS
LAFOND JEAN LUC ,praticien hospitalier
1r hcli~rwc.·
[Données à caractère personnel]
t,-
-1-à
ALAIN FAVIER
Combien de fois avons nous parlé de cette thèse?
Vous nous faites l 1honneur de juger ce travail aujourdhui.
Nous vous sommes gré de nous avoir prodigués1 avec humour et
patience ,vos conseils, de nous avoir acceuilli avec simplicité dans votre service.
à JEAN LOUIS PIERRE
Vous avez bien voulu faire partie de mon jury de thèse . Vous nous avez déjà beaucoup. appris dans divers domaines , une fois encore je vous demande de
3
-à JEAN LUC LAFOND
pendant le temps que j'ai passé en Biochimie C vous avez toujours fait preuve de competence et de gentillesse , que cette thèse soit pour cela un remerciement , en toute amitié .
à Monsieur LATURAZ.E
5
-à Brigitte et Florian
INTRODUCTION
1 PROPRIETES DES METALLOTHIONEINES 1.1 STRUCTURE 1.1.1 STRUCTURE PRIMAIRE 1.1.2 STRUCTURE SECONDAIRE 1.1.3 STRUCTURE TERTIAIRE 1.1. 4- STRUCTURE QUATERNAIRE 1.1.5 ISOMETALLOTHIONEINES 1.1.6 STRUCTURE DU GENOME 1.2 PROPRIETES PHYSICO-CHIMIQUES 1.2.1 POIDS MOLECULAIRE 1.2.2 PROPRIETES OPTIQUES
1.2.3 MODIFICATIONS ELECTRIQUES DU MILIEU 1.2.4 RESONANCE MAGNETIQUE NUCLEAIRE 1.2.5 Thermoresistance
1.3 Solubilités
1.3.1 Dans l'eau distillée 1.3.2 Selon la force ionique 1.3.3 Dans les solutions acides 1.3.4 Dans les solutions alcalines
1.3.5 Dans les solutions contenant des métaux 1.3.6 Dans les solvants organiques
1.4 PROPRIETES BIOLOGIQUES 1. 4.1 Cadmium
1.4.2 Le zinc
1. 4. 3 Le cuivre
7
-1.4.4 Autres atomes métalliques
1.4.5 Remplacement d'un métal par un autre 1.5 Clivage de la protéine : action des enzymes 1.6 Propriétés antigeniques
2 METABOL·ISME
2.1 Contrôle de la synthèse des métallothionéines 2.1.1 Synthèse des métallothionéines
2.1.2 Entrée des métaux dans la cellule 2.1.2.1 Entrée du cuivre dans la cellule 2.1.2.2 Entrée du zinc dans la cellule 2.1.3 Régulation de la synthèse
2.1.3.1 Régulation par les métaux 2.1.3.2 Régulation hormonale
2.1.3.2 Autres facteurs de regulation 2.2 Degradation des métallothionéines
2.2.1 Degradation des MT fixant le zinc ou le cadmium 2.2.2 Degradation des MT fixant le cuivre
2.2.3 Devenir du métal libéré
2.3 Répartition des métallothionéines 2.3.1 Répartition dans la cellule 2.3.2 Répartition dans l'organisme 2.4 Evolution des taux des deux isoformes
2. 4.1 Evolution au cours de la V·ie
2.5 Rôle détoxifiant
2.5.1 Vis a vis du cadmium
2.5.2 Vis a vis des métaux lourds 2.5.2 vis a vis du cuivre et du zinc 2.6 Rôle de stockage des métaux
- 9
-3 Méthodes d'extraction et de dosage
3.1Précautions générales
3.2Techniques d'extraction basées sur lessolubilités
3.3Chromatogral)hie d'exclusion-diffusion
3.4Dosage des métallothionéines extraites
3.4.1Dosage du métal fixe
3.4.2Dosage électrochimique
3.4-.3Dosage sl)ectrol)hotométrique
3.4.4 Dosage des groul)ements cystéinyls
3.4.5Dosage immunologique
3.4.6Valeurs normales
3.5Techniques de séparation des deux isoformes
3.5.1Par chromatogral)hie d'échange d'ions
3.5.2Par électrophorèse bidimensionelle
3.5.3Par H.P.L.C. en exclusion-diffusion
3.5.4Par H.P.L.C. en~ se inverse
4· Métallothionéines et pathologies humaines
4.1Maladie de Wilson
4.2Maladie de Menkes
4.2.1Clinique
4·. 2. 2 Données biochimiques
4.2.2.1Etudes sur l'enfantatteint
4.2.2.2Etudes sur cellules cultivées invitro
4.2..3 Hyl)othèses du déficit l)rimaire
INTRODUCTION
Les métallothionéines (MT) sont une famille de protéines connues depuis 1960(1) retrouvées dans prati-quement toutes les espèces animales et chez un grand nombre d'organismes procaryotes tels que les levures ou Neurospora crassa avec une grande sim-ili tude de structure primaire, conservée de façon pratiquement inchangée au cours de l'évolution.
Depuis ce temps de très nombreuses études ont étés menées sur ces protéines et nous allons essayer d'en faire une synthèse .
11
-1 PROPRIETES DES METAL-LOTHIONEINES 1.1 STRUCTURE
1.1.1 STRUCTURE PRIMAIRE
Pour toutes les espèces , les points saillants de ces :molécules sont:
- une seule chaine de 6-1 acides aminés chez les mammifères , 58 chez les vertébrés inférieurs et les végétaux
d'environ
- une forte concentration en groupements cystéinyls 1
3-0 % des amine acides totaux
-1' absence a l'état natif de ponts disulfures intra -caténaires
-l'absence d'acides aminés aromatiques.
Dans tous les tissus de :mammifères 1 il a été :mis en évidence deux
isoformes majeures de cette protéine , et un certain nombre
d'isoformes mineures • Ces deux isoprotéines ne se différenciant que par un ou deux acides aminés entre les deux formes .Dans toutes les espèces ces isoformes ont étés appelées MTl et MT21de façon arbi-traire et selon les techniques de séparation employées.
Les métallothionéines humaines ont étés séquencées depuis 1976 , leur séquence étant parfaitement connue en 1977 (2) (fig 1); la serine, soulignée , en position 54 étant , dans l' isofo.rme 1 remplacée par un résidu leucine .
Nous notons aussi que l'acide aminé N-terminal est acétylé .
A titre d'exemple , nous donnons (fig 2) la séquence comparée de différentes MT animales ou végétales • A ce niveau il est
intéressant de noter la conservation des positions des résidus cystéinyls , et les similitudes de position des AA entre les espèces .
Les différences par exemple entre MT2 humaine et MT1 de cheval pouvant peuvent se concevoir comme de simples substitutions d'une base de l'ADN de façon conser-vatrice(2). KISSLING compare d'ailleurs la lenteur de
l'évolution des métallothionéines à celle du cytochrome
c .
Nous notons ,par ailleurs , que a proximité des résidus cystéinyls se retrouvent fréquemment des groupements donneurs
d'électro-ns constitues par des serines , lysines , arginines , pour créer des enchaînements du type : CYS-X-CYS , ce qui est mis en évidence par la figure 3- pour la MT2 humaine . Ces groupements ne participent pas directement a la liaison entre la protéine et le métal (3) , mais stabilisent les groupements thiols
proches et de ce fait évitent leurs oxydations . Les autres acides aminés de la protéine permettent a la protéine de
12 bis
-10
Acetyl- Met- Asp- Pro- A sn- Cys- Ser-Cys- Al a- Al a- Gly Asp- Ser- Tre-
Lys- Glu- Lys- Ser- Al a- Gln- Gly- Asp- Lys- Ser-
Cys-figure l
- 2 0
Al a- Gly- Ser- Lys-
Cys-30
Tre- Cys- Lys- Lys-
Ser-40
Pro- Val- Gly- Cys- Al a-
Lys-50 54
Ile- Cys- Lys- Gly- Al a-
Ser-60
Cys- Asp-OH
structure primaire de la
prendre sa configuration particulière et de créer deux régions.
Des données de RMN montrent que lors d'une liaison métallique , un site formé du groupement CYS-X-CYS interagit avec un autre
résidu cystéinyl pour former un complexe trimercaptan charge négativement . Nous pouvons donc déjà dire que , dans certains cas , chaque atome de métal sera relie a au moins trois atomes de souffre.
~ ~ c "" 1">
tv
Hum an MT-1 Hum an MT-2 Equine MT-lA Equine M7-tB Rabbit MT-2 Hamster MT-1 Hamster MT-2 Mouae MT-1 Mou se MT-2 Rat MT-1 Rat MT-2 Plaice Se11ZLa MT-1 MT-2 ••11.ro•poraMT 10 20 Ac-M D P N C 5 C A~ GV" G S C T C A G 5 C K C K E T V A Ac-MDPNC5C AAGD 5C T C A G5CKC K E Ac-M D P N C 5 C P T G G S C T C A G S C K C K E Ac-M D PNCSCVA GE SC TC ~ G S C K CK0 A X-MD PNC S CA A0G(S,C,T,C,A,T,S,C)K CKE X-M D PNC S C S TGS T C T C S5S CGC K0 X-M D P N C S C A T D G S C S C A G S C K C K E Ac-M 0PNC S C S TG GS C T CfS S C ACK~ Ac-M 0PNC S C A SD GS C S C AGA CKC K0 X-M D P N C S C S T G G S C T C S S S C G C K N Ac-M 0PNC SCA TD GS C S C AGSCK C K0 30 40 C KC T S C KK 5C CS CC P VG C A KC A0GC CKC T S CK K 5C C SCC P VGC AKC A0GC '>0 r: K ,s ~ K C K G A 5 D K C R CT 5 C K KS C C S C C P GGCAR C A0GCVC K G AS 0 K CR C A S CK K SC CSC C P VGC AKC A0 GCV C KG A S0K C K C T S CK KSCC S C C P SGC AKC A0GC ICKG AS 0 K CKC T S CKKSC C5C C P VGC5 KC A0G C V CKG A5 D K CKC T T CK KSC C 5CCP V GCAKCSQG C V CKE A S0K CKC T5CK KS C C S C C P V G C SKC A0G C V CKG A AD K C K C T SÇK K S C C S C C P V G C A K C S Q G C C K 0 A S 0 K C K C T S C K K S C C S C C P V G C S K C AQG C V C K G A S D K C K cTSC KK SC CS CC P ...(Part.al sequence) 60 C S C C A-OH CSC C A-OH CSC C A-OH C S C C A-OH C S C C A-OH C T C C A-oH C S C CA-QH C T C C A-OH CSC C A-OH C T C C A-OH AC-M 0P CE CS KT G TCNCG G(SJ(CJT(C)K N ·(C)G(C)T..•••(Partial sequence) ...•...••...•..•..!< •(C,T,C)C O-OH P G P C • C N 0 K C V C K E G G C K E G CQC T SCR CSP C E K C S SGC KCA N K E E C S K T CS KA CS C C P T-OH p 0 pc c N D K C DCK E G E C K T G C K C T S C R C P P C E 0 C S S G C K C A NK E 0CR KTCSK PCSC C P-OH H-G 0CGCS GASS C N CGS G C SCSN C G S K-OHOne-letter symbols: A • Alanine Cz Cysteine
M=Meth1onine
N=Asparagine P=Proline References: Human MT-1 Human MT-2 Equine MT-lA Equine MT-lB Rabbit MT-2 Hamster MT-1 Hamster MT-2 Mouse MT-1 Mouse M'I'-2 Rat MT-1
Kissling and Kagi, 1979 K1ssling and Kagi, 1977 KOJima et al., 1979 Kojima et al., 1976 Kimura et al., 1979a Griffith et al., 1983 Griffith et al., 1983 Huang et al., 1977 Huang et al., 1981 Andersen et al., 1983 Kiss1ing et al., 1979 Overnell et al., 1981 Lerch et al., 1982 Lerch et al., 1982 Lerch, 1979 Other symbols: 0= AspartlC Ac1d E = Glutam1c acid G = Glycine I = Iso1eucine K = Lys1ne L = Leucine X =Undetermined Ac =Acetyl Q=Glutamine R =Ar"gînine S =Serine T=Threonine v= Valine
H =Free amino term1nus OH = Free carboxy1 terminus
Rat MT-.2 Plaice MT Scylla MT-1 Scylla MT-2 Neurospora MT
r:ïgure 4.2 Amino acid sequences of metallothioneins (MT). (The numeration refers to the sequence of mammalian metallothioneins. The residues enclosed within parentheses require further identification. Dots between adjacent residucs denote deletions introduced for optimal alignment. Residues 58 and 59 of the human and equine metallothioneins were reassigned following sequence re-examination (M. Kimura and J.H.R. Kagi. unpublished data). Residue 23 of mouse metallothionein-1 was reassigned on the basis of the eDNA sequence (Mbikayet al.,1981).)
....,.
\..>.>
"""'
~
fig 3 structure des métallothionéines
15
-1.1.2 STRUCTURE SECONDAIRE
Il n'y a pas a proprement parler de structure secondaire des métallothionéines avec formation d'hélices alpha ou béta; les
résidus proline et glycine empêchant cette formation et produisent des angulations dans la structure peptidique.
1.1.3 STRUCTURE TERTIAIRE
La structure tertiaire des MT a été étudiée par RMN au niveau des liaisons souffre - métal. Grossièrement , nous pouvons dire
que la protéine présente une structure en forme de " " (oméga grec} , définissant deux domaines dans la protéine : (fig 4). Ces deux parties sont chacune formée d'un repliement de la chaine
peptidique dans lequel. les groupements cystéinyls sont diriges vers l'intérieur de la molécule , réalisant ainsi un site d'interaction particulier avec les métaux .
La structure générale est donc de forme éllipsoidale de grand axe six fois plus important que l'axe médian (4) .
La protéine elle même présente une certaine élasticité montrée par le fait que le rayon de STOKES diminue lorsque l'on place la protéine dans des solutions concentrées en NaCl ( 5)
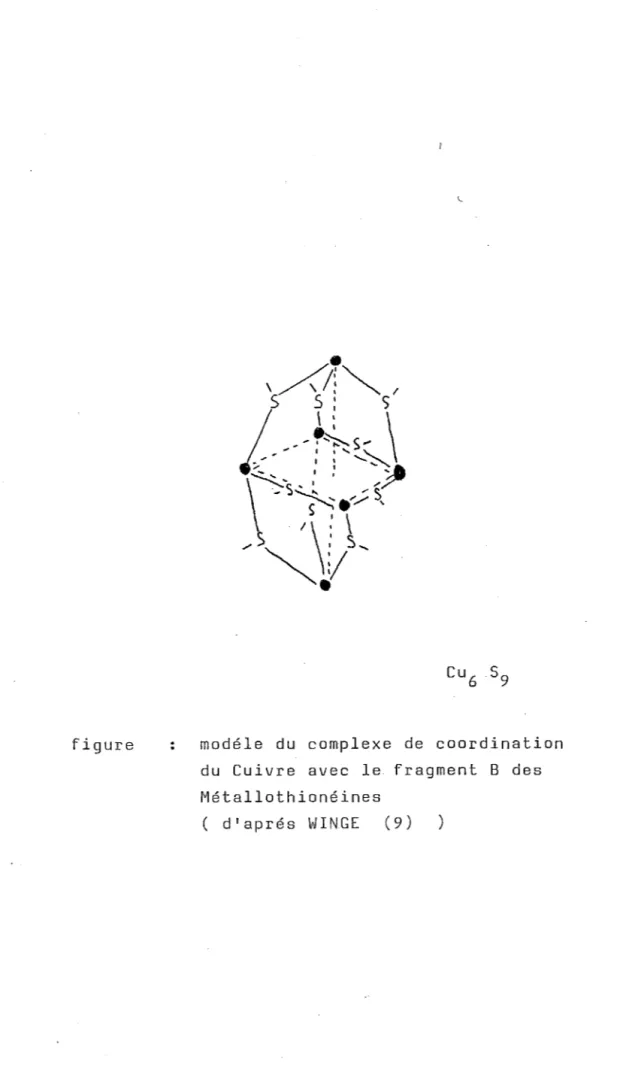
Ces domaines ou fragments ont étés appelles par WINGE Cd3 cluster et Cd4 cluster selon le nombre d'atomes de cadmium susceptibles d'être fixés sur chaque portion (6) .
Le domaine Cd3 comprend l'extrémité N terminale de la chaine jusqu'a la cystéine 29 . Cette portion a été entièrement synthétisée par OKADA en 1985(7)
aussi appelée fragment B.
elle est
Par simulation sur ordinateur , BOULANGER(8) , propose la chaine représentée sur la figure 5 , ou les 2 fragments sont
nettement séparés , et montre bien le point de liaison entre les 2
1 1
s
,
,
@.
1
\
s
-@
/
'
s---
___ @
1'
s
s
1Cd
1CLUSTER
- r-6.bis-coo
-Cd
4CLUSTER
( FRAGMENTa )Hgurc 4.10 Proposed domain structure of metallothionei_n
. ~
Winge and Miklossy,1982).
figure 4 structure des métallothionéines d'aprés WINGE
C-42
C-61
figure : représentation des métallothineines selon
18
-Cette structure communément admise a été reprise par WING(9)
1.1.4 STRUCTURE QUATERNAIRE
Il n'y a pas de structure quaternaire véritable mais ,nous verrons plus loin que ,lors de l'extraction des métallothionéines, il est nécessaire d'éviter leur oxydation , qui conduirait a une
1.1.5 ISOMETALLOTHIONEINES
Par chromatographie liquide haute pression KLAUSER (11) a mis en évidence 2 isoformes majeures et ,au moins , 4
isoformes mineures de structure moins bien connues(12)
Ces deux isoformes se retrouvent avec quelques variations de struc-tures chez tous les mammifères(13) , et donc chez l'homme , alors quelles ne sont pratiquement jamais retrou-vées dans les espèces inférieures 1 ce qui est en faveur
d'un rôle dévolu a chacune 1 rôle apparu au cours de
l'évolution animale •
Par contre 1 les 2 isoformes sont strictement identiques
dans toute l'espèce humaine .
Nous noterons que ces deux isoformes sont suspectées depuis longtemps ; car comme nous le verrons 1 la
chromatographie d'échange d'ions d'un extrait des
métalloprotéines de PM 9 000 montre deux pics nettement séparés.
20
-1.1.6 STRUCTURE DU GENOME
Le genome des MT humaines est fait d'une seule portion d'ADN , sans intron ni exon (KARIN) (14.) {15) . Le genome semble être précédé d'une portion initiatrice de la
synthèse. Le fragment d'ADN codant pour la synthèsedeMT 1 est diffèrent de celui codant pour les MT2 .
Enfin cette information génétique n'est pas portée par le chromosome sexuel , mais chez l'homme ,par le chromosome 16(16) (17) (18) pour Schmidt et pour Lieberman sur le chromosome 4 (19) Ceci est important pour l'étude de la Renvoi (suite) pathogénie de la maladie de MENKES •
D'après Karin 14 gènes au moins sont liés au site de codage des métallothionéines , dont une partie de gènes
pff
i322
~
(PSt 1)
Coding Region
~ BamHI Pvull 100 bp p8R322 Rsa 1 (Pst1) ~~---~---40
.
-ZO . AGUCCCAGCGAACCCGCG UGCAACCUGUCCCGACUCUAGCCGCCUCUUCAGCACGCC riëÏ ïi1niÏ~ 1 ;;;:;ltfttupPro unCV• serCIJ• Al• Al.o Gly upsecCV•TheCys
AUG GAll CCC AAC UGC UCC UGC GCC GCC GGU GAC UCC UGC ACC UGC
ora.1111 r -::;;;;;; -;;;;ï--;ïi;iÏ ïih
zo 40
Al• GliJser cyaLpeva LtJ• Glu CIJ•LtJ•Cv• The secCys LtJ•
GCC GGU UCC UGC MA UGC MA GAG UGC MA UGC ACU UCG UGC MG ollHp.oii
60 80
Gln Gly C!Jol Il•C1J8 LyaGJyAl• SecAap Lya CysSecCys Cys CAA GGC UGC AUC UGC MA GGG GCG UCG GAC AAG UGC AGC i.Xj(UGC
Trn;iiii AëYï p;;;;n- ïiii 140 160 . 180 Al• 7'tlc ~C UGA UGCI.XjGGACAGCCCCGCUCCCAGAUGUAAAGAACGCGACUUCCACAAACCU •I T•c! EcoR 200 220 GGAUUUUUUAUGUACAACCCUGACCGUGACCGUUUGCUAUAUUCCUUUUUCUAUGAAAU ÏÏ 11. ..1 - -240 260 280 AAUGUGAAUGAUAAUAAAA
-
300.
-
-Figure2. Nucleotide sequence of human MT-II mRNA
figure structure du génome des métallothionéines d1aprés KARIN
21
-1.2 PROPRIETES PHYSICO-CHIMIQUES 1.2.1 POIDS MOLECULAIRE
Poids moléculaire de l'apoprotéine :
La somme des masses moléculaires des AA constitutifs des MT donne un poids moléculaire voisin de 6.000 daltons .
Poids moléculaire in vivo :
Dans la réalité , et in vivo, l'apoprotéine n'est jamais retrouvée et le PM des MT est , compte tenu des différents atomes métalliques de la molécule , proche de 6 600 daltons
En chromatographie d' exclusion-diffus.ion (ou gel diffusion}:
La structure tertiaire des MT , légèrement déroulée , fait que, apparemment , en chromatographie d'exclusion, le PM estime est de 10 000 daltons .
En milieu a très haute force ionique
Si la chromatographie d'exclusion est réalisée en milieu urée 6M ,le PM réel de 6 000 daltons est retrouvé
Nous n'avons pas retrouve de constante de sédimentation dans la littérature .
Cette molécule est donc un molécule de petites dimensions , le rayon de Stokes est de l'ordre de 17 A :
KAGI (20) donne un rayon de 16,1 A pour MT1 et 16,2 A pour MT 2 WING pour sa part trouve 16,2 A pour MT 1 , mais 17 A pour MT 2.
1.2.2 PROPRIETES OPTIQUES
Les MT n'absorbent pas dans le domaine du visible en lumière ultra-violette , l'absence d'acides aminés
aromatiques explique la non absorption de la lumière a la longueur d'onde de 280 nm .
Pour les apoprotéines , seule est retrouvée
l'absorption a 208 nm ,longueur d'onde caractéristique de la liaison peptidique.
Par contre , la liaison métal-protéine peut permettre une absorption de la lumière ultra violette : cette absorption dépend du métal en cause et ,pour les 3 plus impor-tant
,c'est a dire cadmium , zinc , et cuivre nous obtenons les spectres suivants :fig {
Il') 'O
ow--5
4
~
Wove
leng
th
(
nm
)
200
300
400
500
- 23-Figure 4.4 UV-absorption spectra of apometallothionein at pH 2 (thin full line) and of metallothionein at pH 8 containing a full complement(7mol per mole) of zinc (thick full line), cadmium (thick broken line), mercury (thick dotted line), bismuth (thin broken line) and lead (thin dotted line) (Bernhard
et al.,1983 ).
ifgure spectre UV comparés des métallothinéines en fonction du métal porté par la protéine
TABLEAU
en nm 254 280
Cu
+
+Cd
l
+
-Zn
-
-3 ABSORPTION DE LA LUMIERE· UV SELON LE METAL FIXE SUR LES MT
25
-1.2.3 MODIFICATIONS ELECTRIQUES DU MILIEU
La présence de métaux dans la protéine entraine une légère modifi- cation de la résitivité électrique du milieu
réactionnel • Ce métal peut être spécifiquement détecté au moyen d'électrodes ce qui permet un dosage éventuel •
1.2.4- RESONANCE MAGNETIQUE NUCLEAIRE
Cette technique a surtout été utilisée pour l'étude de l'arrangement spatial des métaux et du mode d'interaction entre le métal et les protéines par étude du spectre
spécifique de chaque métal (21) (22)
1.2.5 Thermoresistance
Les métallothionéines ont une grande résistance a la dénaturation thermique car un chauffage a 80 degrés pendant 30 minutes ni ne dégrade la molécule , ni ne modifie ses propriétés biochimiques .
1.3 Solubilités
1.3.1 Dans l'eau distillée
Ou elles sont parfaitement solubles
1.3.2 Selon la force ionique
Les métallothionéines supportent une large gamme de force ionique , seules les solutions très concentrées du type urée 6M peuvent
entraîner des modifications de la structure tertiaire de la protéine qui dans ces conditions va relarguer les atomes de métal
dans le m-ilieu et se dérouler mais sans précipiter .
1.3.3 Dans les solutions acides
L'acide trichloroacetique ou trifluoroacetique ne précipite pas les métallothionéines . Cette propriété a été largement mis en oeuvre par de nombreux auteurs pour la séparation des métallothionéines. Mais les solutions acides très fortes peuvent amener une dissociation du complexe MT-métal.
1.3.4 Dans les solutions alcalines
Dans les solutions diluées , les MT sont solubles . Par contre avec de fortes concentrations les protéines sont bien évidemment détruites .
27
-Les sels de métaux lourds ne précipitent pas les MT , en particulier , ces protéines sont solubles dans des solutions contenant des sels mercuriques .Comme nous le verrons cette propriété est utile pour une purification rapide des MT.
1. 3-.6 Dans les solvants organiques
La solubilité des MT a ce niveau est peut être le point le plus remarquable : en effet les métallothionéines sont solubles dans l'Sthanol ou dans une solution comprenant 60% d'acetone
(par contre elles précipitent à partir de 80% d'acetone).
les métallothionéines ne précipitent pas par le frac-tionnement de Cohn classique ( elles sont encore solubles alors que l'albumine précipite).
1.4 Relation avec les métaux
Les métallothionéines fixent un grand nombre d'éléments de
transi-tion parmi lesquels le cuivre , le zinc ,et le cadmium sont les plus frequement rencontres a l'état naturel. De plus
ces éléments ont des particularités biologiques pour le cuivre et le zinc ou toxicologiques pour le cadmium qui les rendent très importants .
1.4.1 Cadmium
In vivo une faible quantité de cadmium est re-trouve au niveau des MT ce qui correspond a une exposition naturelle
au cadmium de l'environnement.Ce fut le premier élément retrouve au niveau des métallothionéines , par KAGI et VALLEE(23}
Il se fixe selon le schéma de la figure 3 ; avec 7 atomes de Cd par molécule. Le complexe formé par chaque métal est du mode tétravalent, chaque atome métallique étant relie a quatre atomes de soufre un de ces atomes réalisant un pont entre deux atomes métalliques. Le com-plexe forme est très stable puisque KLAUSER lui attribut une constante de
dissociation en pH physiologique de l'ordre de 10-15 . Et pour LONTIE la demi dissociatio-n apparait pour un pH de 3,05 .
Nous remarquons que les sept atomes de cadmium sont relies a la protéine par deux types de complexes selon le fragment :
-un complexe M3-Cys9 au niveau du groupe amino terminal -un complexe M4-Cys11 au niveau du groupe carboxy terminal
Ainsi la molécule présente une dissymétrie entre ces deux sites de fixation des métaux.
La fixation des différents atomes de cadmium ne se fait pas au hasard mais commence de façon préférentielle sur le domaine A ,ou fragment Cd4 •
29
-Nous remarquons de plus qu'il existe un effet coopératif de la fixa-tion pour chaque domaine , mais pas entre les
deux domaines.
En effet WINGE (24-) montre que si l'on renature de l' apométallothioneine avec 4 atomes de cadmium par molécule de MT il retrouve le métal
uniquement fixe sur le fragment Cd4 ,et si la quantité de cadmium est inférieure seules quelques protéines auront quatre atomes métalli-ques fixes a ce niveau , les autres protéines n'ayant pas fixe le Cd .
Soit si l'on amène dans le milieu réactionnel une quantité
équimoléculaire de Cd et de MT sous forme d'apoprotéines 2!>% des MT auront 4 atomes métalliques contre 75% d'apoprotéines.
Ce n'est que lorsque tous les domaines A auront étés saturés que la fixation se fe-ra sur le domaine B •
Le compose intermédiaire n'ayant que 4- atomes de Cd par molécule de MT est stable sur les plans thermodynamique et cinétique .
La stabilité du complexe final représente par la protéine entière est assure par huit des vingt résidus cystéinyls qui forment des ponts entre deux atomes métalliques •
Le zinc fait aussi parti des métaux naturellement présents sur les métallothionéines a l'état naturel .
Pour lui aussi sa constante de dissociation est très élevée
puisqu'elle est pour KLAUSER(25) de 10-11 environ a un pH proche de la neutralité ,et nous devons nous placer a un pH de 4,6 pour
atteindre la demi-dissociation.
La réactivité du zinc vis a vis des MT est très proche de celle du cadmium puisque 7 atomes métalliques peuvent se fixer sur la protéine , aux mêmes niveaux , et en formant les mêmes complexes tétravalents avec les atomes de souffre voisins .
Le mode de fixation du zinc sur la protéine semble être identique a celui du cadmium :c'est a dire fixation préférentielle sur le
domaine A , avec un effet coopératif .
1. 4-.3 Le cuivre
Le cuivre est différemment retrouve selon les auteurs dans les protéines natives mais ceci peut être expliqué par les
techniques de séparation utilisées , comme nous le verrons plus loin .
Il n'en reste pas moins que les métallothionéines jouent un rôle particulièrement important dans la physiologie de ce métal et évite de graves dommages a l'organisme en le détoxifiant.
31
-L'interaction entre le cuivre et les MT est particulière car le cuivre a la différence des deux autres métaux , ne se fixe que sous sa forme de cuivre cuivreux (Cu+) et jamais ,dans les conditions physiologi-ques ,sous la forme d'ion cuivrique ( Cu2+).
D'autre part la liaison entre la protéine et les atomes de cuivre ne se fait plus que part une liaison bivalente entre le cuivre et deux atomes de soufre , ce qui permet a 10 atomes de cuivre de se fixer sur la protéine .
Le mode de fixation du cuivre sur la protéine a d'ailleurs été détaillé par NIELSON(26) , qui a montre qu'a partir de l'apoprotéine le cuivre commence par se fixer sur le domaine B (Cd3) avant de se fixer sur le fragment a . La figure ( ) résume le mode de fixation du cuivre sur la protéine .
La liaison cuivre-MT est une des plus fortes puisqu'elle est estimée a 10-17 et que pour atteindre la
dem-i-dissociation du complexe Cu-MT , il faut que le milieu réactionnel soit a un pH inférieur a 0,5(KLAUSER) (27) et de 0,44 pour L.QNTIE .
Le cuivre est d'ailleurs un des métaux possédant la plus forte affinité pour les MT.
Mais le potentiel d'oxydo-réduction du cuivre fait que en présence d'oxygène la liaison entre le cuivre et la protéine s'oxyde et il y a libération du cuivre avec formation de ponts disulfures intra-catenaires ou entre deux molécules de
figure modéle du complexe de coordination du Cuivre avec le fragment B des Métallothionéines
32
-métallothionéines , ceci par suite de l'oxydation du cuivre Cu+ en Cu++.
1.4.4 Autres atomes métalliques
De nombreux métaux sont reconnus comme pouvant se lier aux
métallothionéines avec des affinités. relativement fortes puisque la plupart des métaux bivalents ont une affinité supérieure a celle du zinc .
Pour WINGE(28) ,un métal peut être reconnu comme se liant dans des conditions normales aux MT si il répond a trois des quatre exi-gences suivantes :
-la fixation protège les MT de la protéolyse par la subtilisine ou la protéinase K,
-la fixation entraîne un changement de l'absorption de la lumière ultraviolette
-le métal se retrouve associé a la protéine en chromatographie par gel filtration
-le métal déplace le cadmium ou le zinc des métallothionéines .
Les plus importants de ces métaux sont (29) {30) (31) :
l' or ( .32) ( 3 3) , le platine -(34) , l'argent , le bismuth ,le cobalt , le nickel(35) , le palladium , l'indium , l'antimoine , l'osmium , et le rubidium :tab. ( ) .
Mais cette fixation reste as.sez théorique car la plupart des auteurs ne la retrouvent que dans des conditions expérimentales réalisées in vitro .
Nous noterons que tous les métaux bi- ou trivalents s.e fixent sur les métallothionéines avec un rapport métal 1
protéine de 7 , alors que le cuivre et l'argent ont un rapport métal fixe/protéine de 11 a 12 •
Cette faible fixation in vivo doit être rapportée a la faible
exposition journalière ,en temps normal,a ces éléments.En effet lors de charges intenses par injection de platine chez des rats (sous forme d'un dérivé dichlorodiaminoplatine ),ZELAZOWSKI ,
montre une fixation du platine sur les métallothionéines .
La plupart de ces métaux sont d'ailleurs , a des degrés divers , inducteurs de la synthèse des MT . Nous pouvons ainsi établir une échelle du "potentiel inductif " des différents métaux vis a vis de la synthèse de MT par la cellule a leur contact •
Mais pour tous les métaux autre que le cuivre , le cadmium ou le zinc la fixation se fait de façon aléatoire sur la protéine sans effet coopératif mis en évidence.
34
-1.4.5- Remplacement d'un métal par un autre
Le remplacement d'un métal par un autre est possible in vitro et in vivo.
In vivo ce remplacement est possible en surchargeant un animal par un métal , in vitro ce remplacement est spontanément réalisé en
fonction des affinités- de la protéine pour le métal par rapport a celui déjà porté .
Ce remplacement est réalisé dans un rapport stoichiometrique pour l'interconversion entre le Cd et le Zn ,car ces deux atomes sont lies de façon identiques a la protéine .
Ceci semble être une règle générale pour tous les cations divalents fixes sur les MT , et le ratio métal/protéine et de 7 atomes de métal par molécule protéique .
Cette substitution peut s'accompagner de modifications des
caractéristiques physico-chimiques de la protéine , en particulier , sont modifiées l'absorption de la lumière UV et les propriétés
chromatographiques (SUZUKI ) (36)
Le cas du cuivre est différent car il est fixe sur les MT sous forme d'ion monovalent et le ratio métal/protéine est alors de 10 atomes de Cu par MT. Et la très forte affinité du cuivre pour la molécule fait que le zinc est très facilement déplacé de ses sites
de fixation . Pour SUZUKI ,a rapport Cu/Zn égal a 1 , les
:métallothionéines contiennent trois fois plus de CU que de Zn .
D'autre par la molécule devient alors particulièrement sensible a l'oxydation et il faut pour que ce remplacement puisse avoir lieu sans dénaturer la protéine , soit n'amener que du Cu+ ou opérer en présence d,un agent réducteur tel que le glutathion ou le 2 mercaptoethanol.
1.5 Clivage de la protéine action des enzymes
Nous devons différencier les MT portant du zinc ou du cadmium de celles fixant du cuivre .En effet les métal-lothionéines fixant du cuivre présentent une grande inertie vis a vis des enzymes lysosomiales , a la différence de celles fixant le Cd ou le Zn .
Parmi les enzymes non lysosomiales ,la trypsine et la subtilisine dégradent très facile-ment les MT-Zn en rompant la chaine peptidique au niveau de l'acide aminé 30 et
séparent ainsi les deux fragments de CLUSTER ; alors que ces enzymes sont incapables de cliver une MT-Cu .
Nous retrouvons la aussi une différence de réactivité entre les deux isoformes , puisque pour Mehra les MTl à Zn sont plus
36
-MT2 à Zinc ; cette différence ne se retrouvant pas pour les MT à Cu ( 37) .
La résistance des métallothionéines portant du cuivre se retrouve au niveau des lysosomes ou elles résistent parfaitement au pH
lysosomial.
COUSINS (38) ne peut préciser le mode de dégradation des MT-Cu dans les cellules mais insiste sur le fait que celui ci doit être différent de celui des MT-Zn
La résistance des métallothionéines ,chargées en atomes métalliques ,au enzymes protéolytiques apparait a des
degrés divers quelque soit le métal fixe sur celles-ci • En particulier WINGE , montre que même le cobalt qui est un métal de faible affinité pour les MT protège la protéine de
la dégradation par la subtilisine ; cette dégradation étant complète dans le cas de l'apoprotéine .
De plus le degré de résistance est fonction du nombre d'atomes métalliques portés par la protéine , quelle que soit la
nature de ce métal .
La différence de réactivité vis a vis des enzymes protéolytiques et pour un même métal fonction de son degré d'oxydation ,le cuivre par exemple protège très bien de la dégradation enzymatique sous forme
d'ion Cu+ et moins bien sous forme d'ion cuivrique Cu2+ , ce qui est représenté par le graphe de la figure ( ) (39)
Do 254 nm
·o
1 2 3 figure -38 ---:+Cuso4 Heures 4 5 6 7 8 9 10dégradation protéolytique des métallothionéines selon le dégré d'oxydation du cuivre
Cette différence de sensibilité aux différentes enzymes protéolytiques explique en partie le fait que nous n'isolons
pratiquement pas d'apoprotéine , ou métallothionéines natives des cellules animales .
40
-1.6 Propriétés antigeniques
Les métallothionéines sont antigeniques et peuvent être a ce titre reconnues comme étrangères par un organisme • mais leur petite
taille fait quelles sont hapteniques et doivent , pour provoquer une immunisation être administrées couplées a une protéine
porteuse •
SATO utilise une IgG de lapin pour immuniser des rats afin de produire des anticorps anti MT .
Nous ne connaissons pas le site de reconnaissance de l'anticorps sur la protéine .Mais nous pensons que ce site doit être
relativement bien individualise pour un MT d'une espèce vis a vis d'une espèce animale différente , car les protéines sont
suffisamment proches du point de vue structure entre elles pour qu'il existe un nombre très restreint de sites de
recon-naissance de l'anticorps (40) .
L'injection à un animal d'une métallothionéine étrangère et rendue antigenique provoque la formation d'autoanticorps dirigés contre les propres métallothionéines de l'animal .
D'autre part , il semble peu probable de pouvoir ainsi différencier les deux isoprotéines humaines vu la similitude de leur structure (1 seul AA de différence ) et l'ignorance des points d'action des anti-corps , une réactivité croisée entre les deux isoformes a déjà été mise en évidence . Pour
cette partie , des anticorps monoclonaux pourraient peut--être peut--être utiles.
Les produits de dégradation par les protéases interfèrent d'ailleurs avec la réaction immunologique 1 vis a vis de la
protéine entière.
Enfin 1 il n'existe pas de différence antigenique selon le
42
-2 METABOLISME
2.1 Contrôle de la synthèse des métallothionéines 2.1.1 Synthèse des métallothionéines ,,,
La synthèse des métallothionéines suit le schéma classique de la synthès-e peptidique : à partir de l'ADN 1 la cellule synthétise un
brin d'ARN messager qui va migrer au niveau des ribosomes et entraîner la synthèse de l'apoprotéine .
Ceci a é,té démontre par plusieurs auteurs dont COUSINS ( 41} sur des systèmes acellulaires 1 ou par blocage de la synthèse protéique
au moyen de l'actinomycine D ou du cycloheximide •
Mais nous ne savons pas a quel niveau de la synthèse sont incorpores les métaux 1 par contre , l'apoprotéine n'est jamais
retrouvée au niveau cellulaire.
Il existe un cas particulier ou le sequencage de la protéine n'est pas en concordance avec la séquence de l'ADN : chez la souris 1 l'ADN de la MT1 donne en position 23 une asparagine
1 alors que nous trouvons un acide aspartique à cette.
position sur la protéine finale(42} • Mais cette
transformation post-transcriptionelle est doute-use car
l'étude a été réalisée chez deux souches différentes de souris .
Nous noterons cependant que la régulation du taux de MT est très importante puisque le taux intracellulaire d'apoprotéines reste extrêmement faible (non détectable par les méthodes usuelles dans
les conditions de b-ase ),et est étroitement lié au taux de mRNA cellulaire.
Enfin la synthèse de chaque apoprotéine semble être régulée de façon indépendante •
2.1.2 Entrée des métaux dans la cellule 2.1.2.1 Entrée du cuivre dans la cellule
L·e mécanisme d'entrée du cuivre dans une cellule a été très étudié par COUSINS , en prenant pour modèle les hépatocytes de rats . A ce niveau les métallothionéines jouent un rôle certain mais encore mal défini .
Nous remarquerons que le taux intracellulaire de cuivre est dépendant de la teneur du milieu extérieur , quand le taux de cuivre extracellulaire est bas ,la cellule fixe moins de cuivre •
Le mécanisme· d'entrée du cuivre dans la cellule com.mence à être bien connu : le cuivre fixé a l'albumine ou a un complexe avec l'histidine est libéré de ce complexe au
contact d'un complexe macromoléculaire spécifique réalisant un canal à cuivre au travers de la memb-rane. L'importance de la liaison avec l'albumine ou l'histidine à été mise en évidence par Mac Ardle{43) qui démontre l'inhibition de l'incorporation du cuivre par un excès d'albumine ou d'histidine dans le milieu expérimental .
44
-Le mécanisme exact doit être proche du schéma de la figure ( ) , mécanisme proposé par Waldrop ( 44-) .
J j_ .
e
,..
1-t:..·,tl',.-
·---
·
figure~
-SCv
S --\
hypothése du mécanisme d'entrée du cuivre dans la cellule
46
-Ce mécanisme est capable de concentrer le cuivre contre un gradient de concentration qui est sept fois plus important a l'intérieur de la cellule.
D'après COUSINS l'entrée du cuivre dans la cellule suit une cinétique de premier ordre ,est diminuée lors d'une baisse de la température , mais n'est pas affectée par les groupements bloquant les résidus soufres , ni par le
dinitrophenol .
D'autre part cette accumulation du cuivre dans la cellule n'est pas affectée par la présence de zinc , de nickel , de m-agnésium , de cobalt , ou de fer dans le milieu .
A l'inverse les cyanures ou le N-ethylm-aleimide inhibent fortement l'entrée du cuivre dans la cellule . La cinétique d'entrée est d'abord rapide en une première phase durant m-oins de 12 heures COUSINS , DARDELET(45) , puis se
ralentit pour atteindre un plateau dans l'incorporation qui représente un équilibre entre les différents pools de cuivre
(extracellulaire ,et intracellulaire).
La première phase de cette cinétique est un phénomène saturab1e , COUSINS pense que ,sur des hépatocytes de rats le Km de l'incorporation est de 10,6 MM et le Vmax de
Comme COUSINS trouve une cinétique similaire que le cuivre soit amené sous forme de sel simple ou de complexe avec un acide aminé tel que l'histidine , nous pensons que le
cuivre traverse la memb-rane sous forme d'ion "libre" c'est à dire par un phénomène indépendant d'un ligand éventuel.
Une fois- a 1' intérieur , le Cu est fixe- sur différentes protéine-s avec un fort pourcentage de fixation sur les MT . Il est d'ailleurs possib-le que celles ci soit le premier vecteur intracellulaire- du cuivre , le cuivre ne se fixant que secondairement sur les autres protéines .
2.1.2.2 Entrée du zinc dans la cellule
Pour le zinc ,les variations du taux extracellulaire
n'entrainent que de faibles variations du taux cellulaire . Le mécanisme d'entrée du zinc dans la cellule semble être diffèrent de celui du cuivre . La cinétique d'incorporation montre en effet deux phases , la première correspondant a une accumulation très rapide du zinc se fixant sur des sites spécifiques , la seconde étant une ];}hase ou le zinc rentre- dans la cellule par un mécanisme plus lent en
fonction de la concentration selon une cinétique de premier ordre.
Cette cinétique est saturable pour des concentrations de zinc extracellulaire supérieures a 400 MM .
48
-Cette accumulation est un mécanisme dépendant de la température :les températures inférieures a 20°
c
l'inhibent . Les agents inhibiteurs de la production d'ATP comme le dinitrophenol inhibent cette captation .
D'autre part , la présence. de groupements thiols libres au niveau de la cellule semble indispensable , comme le montre l'inhibition par des agents tels que l'iodoacetate ou le N-ethylmaleimide 1 et ce a au moins un stade de la
captation du zinc par la cellule .
Le cadmium e.st un inhibiteur de la captation du zinc par la cellule 1 très probablement par un mécanisme compétitif 1
car l'accumulation intracellulaire du cadmium est inhibée par les mêmes agents que. le zinc . Pour COUSINS le méca-nisme d'entre dans la cellule est le même pour ces deux métaux .Néanmoins cette inhibition n'intéresse que la première phase de la cinétique d'incorporation du zinc .
Des son entrée dans la cellule , le Zn est pris en charge par les métallothionéines 1 la présence de celles ci étant
indispensable au processus comme le montre les expériences de blocage de la synthèse protéique par le cycloheximide ou l'actinomycine D . Si nous empêchons de cette façon la
synthèse des MT , nous empêchons de ce fait l'entre du zinc dans la cellule et les cinétiques d'incorporation réalisées avec un traceur radioactif ne montrent plus de captation.
Comme pour le cuivre au bout de 12 heures la cinétique d'incorporation atteint un plateau qui représente un état d'équilibre entre les entrées et les sorties du zinc de la cellule.
2.1.3 Régulation de la synthèse
La synthèse des métallothionéines est régulée de deux façons : d'une part par les métaux et d'autre part par une influence hormonale
2.1.3.1 Régulation par les métaux
Ce mode de régulation a été le premier mis en évidence par l'observation de PISCATOR en montrant que le cadmium administre a des rats augmentait la synthèse de
métallothionéines hépatiques . En conclusion de son observation , PISCATOR pense que les MT sont la pour protéger la cellule des effets toxiques du cadmium .
SHAIK nous a montré que , parallèlement a cette augmentation , il y avait une incorporation accrue des acides aminés dans la cellule et donc une synthèse protéique .
WEBB a réalisé une étude similaire avec le cadmium et le zinc et propose une régulation par un mécanisme de
50
-SQUIB et COUSINS , et RICHARD et COUSINS ont montré, par des expériences de double marquage , que le cadmium et le zinc sont tous deux capables d'induire la synthèse de nove de métal-lothionéines et de se fixer sur ces protéines • Le blocage de la synthèse protéique par l'actinomycine D bloque complètement l'incorporation des métaux dans la
cellule(4-6) .
Nous pensons donc que ces mécanismes de régulation passent par une expression de diffé.rents gènes et modifient le
taux intracellulaire du mRNA des métallothionéines (47) (4-8) .
D'après COUSINS , les MT sont induites par le cuivre , le cadmium, ou le zinc rajoutes dans le milieu
extracellulaire .
A l'inverse , les autres métaux lourds ( Bi , Au , Hg , Pt ) n'ont que très peu de pouvoir inducteurs •
Il est aussi possible que le cuivre soit un inducteurs indirecte de la synthèse des MT , en déplaçant le zinc fixe sur celles ci . Le zinc nouvellement libéré pourrait alors activer le gène promoteur de la synthèse des MT .
Pour SQUIBB , la vi tesse de synthèse des MT , e.s.timée par l'incorporation de cystéine marquée au S 35 , est maximale après 5 a 7 heures suivant une administration parenterale
de zinc ,chez des rats .La cinétique d'incorporation du Zn 65- montrant une évolution similaire .
Par étude sur des systèmes acellulaires (lysats
cellulaires comprenant les ribosomes , de l' ARN messager et des acides aminés , en présence d'ATP )COUSINS montre que le taux de mRNA pour les MT est étroitement parallèle a
l'évolution du taux de MT synthétisées en réponse a une administration de zinc .
ANDERSEN et WESER(49) estiment la taille du mRNA a 9 S par centrifugation en gradient de saccharose 1 ce qui
correspond a une taille de 280 a 390 nucleotides soit 181 nucleotides codant pour la protéine elle même et 100 a 200 nucleotides représentant la chaine poly-A.Mais ce qui prouve que la chaine de mRNA ne code que pour une seule protéine et n'est pas polycystronique 1 avec synthèse des 2 MT en même
temps .
2.1.3.2 Régulation hormonale
La régulation hormonale de la synthèse des
métal-lothionéines a été mis en évidence par FAILLA et COUSINS(50) sur des hépatocytes de rats en culture primaire en montrant que les glucocorticoides augmentaient la captation du zinc par les cellules et de ce fait , indusaient la synthèse des métallothionéines .Le fait que la plupart du zinc
nouvel 52 nouvel
-lement accumule par la cellule l'était sur les MT et que l'actinomycine D bloque cette accumulation nous montre que les glucocorticoides agissent par induction directe , au niveau du genome , de la synthèse des MT.
La captation du zinc et la synthèse des métallothionéines sont dépendant de la dose de glucocorticoides dans le milieu .
La dexamethasone augmente l'entrée lente de zinc dans la cellule avec une augmentation du pool labile de zinc :pool a demi-vie courte •
In vivo ,l'administration de corticoides a pour effet d'augmenter le taux de mRNA codant pour les MT puis la synthèse de métallothionéines ,avec parallèlement une diminution du zinc serique ( COUSINS) (51) .
Des études réalisées sur le même modèle montrent que le zinc et les glucocorticoides ont un effet additif sur la synthèse de métallothionéines Nous remarquons que les deux facteurs augmentent le taux de mRNA qui dans les conditions basal est de 13 molécules par cellule et qui peut atteindre des taux de 1350 molécules par cellule au bout de 6 heures en cas de très fortes stimulations. (COUSINS)
de l'incorporation dans les protéines , ou dans la cellule de cystéine marquée au
s
35 .D'autres hormones peuvent aussi stimuler la synthèse des MT parmi lesquels le glucagon . Celui ci augmente la synthèse des MT en synergie avec les glucocorticoides mais par un mécanisme diffèrent car l'induction n'est pas bloquée par les l'actinomycine D , alors quelle l'est par le cyclo-heximide .
L'augmentation de la production de MT sous l'influence du glucagon n'est pas aussi importante que pour les
corticoides ; pour certains auteurs la présence de gluco-corticoides est d'ailleurs indispensab-le pour pouvoir juger de l'effet de celui-ci .
L'epinephrine( apparentée aux catecholamines } semb-le stimuler la synthèse de MT et l'accumulation du zinc ,par un mécanisme proche de celui du glucagon . Ce mécanisme passerait par une production d'AMPc ,fixation spécifique au niveau d'une région particulière du gène de synthèse des MT, ce qui entrainerait la synthèse de MT , par un
mécanisme identique au cas de la phosphoenolpyruvatekinase.
Le cas du cuivre nous semble particulier car les
54
-glucocorticoides , ne semblent pas augmenter de façon significative l'accumulation intracellulaire du cuivre .
2.1.3.2 Autres facteurs de régulation
D'autres facteurs. sont susceptib-les d'entraîner une augmentation de la synthèse des métallothionéines par des mécanismes divers
COUSINS } :ces éléments sont rassemb-lés dans le tableau suivant
METAUX
HORMONES
DIVERS
TABLEAU
CUIVRE
ZINC
CADMIUM
glucocorticoides glucagon catécholamines interleukine 2 stress développement carence en zinc infections endotoxine agents alkylants tétrachlorure de carbone diabète isopropanol turpentineAGENTS INDUCTEURS DE LA S l'NTHESE
DES METALLOTHIONEINES
56
-2.2 Degradation des métallothionéines
2.2.1 Degradation des MT fixant le zinc ou le cadmium
La suscep-tibilité des métallothionéines fixant le cuivre ou le cadmium aux p.rotéases lysosomiales suggèrent que les lysosomes sont les p.rincip.aux si te·s de la dégradation de celles ci{COUSINS) (52) .
WING a démontré que toute la structure de la p-rotéine p.articip.e a la force des liaisons avec les métaux . En effet si nous coup.ons la molécule p.ar la pepsine les deux fragments ont une réactivité beaucoup plus importante vis a vis de l'EDTA 1 c'est a dire une constante de dissociation
plus élevée :le complexe est moins stable.
Par contre pour Cousins 1 les métallothionéines a zinc ont
une demi vie de 18 à 20 heures soit très largement
inférieure au MT à cadmium qui ont une demi vie de 3.5 jours
Il est reconnu que ces deux formes ont une dégradation lysosomiale .
2.2.2 Degradation des MT fixant le cuivre
Pour COUSINS le site exact de la dégradation des MT a cuivre n'est pas connu avec certitude . Certains auteurs admettent néanmoins comme plausible l'hypothèse d'une
dégradation par les lysosomes , :malgré l'inertie chimiques des MT a Cu vis a vis des enzymes et du pH lysoso:mial .La dem-i vie des :métallothionéines a cuivre serait pour cousins la plus faib-le : 12 à 17 heures .
2.2.3 Devenir du métal libéré
Apres la dégradation des MT , le métal est libéré ,est il est soit recapté directement par une autre molécule de
métallothionéine nouvellement synthétisée , soit il ressort de la cellule par un mécanisme d'efflux .
Dans le cas du cadmium l'efflux est un mécanisme très réduit sauf au niveau hépatique ou le métal est éliminé par la bile .
2.3 Répartition des métallothionéines 2.3.1 Répartition dans la cellule
Les métallothionéines sont surtout localisées au niveau cytoplasmique , reparties de façon homogène a ce niveau , avec une forte concentration prés de la :membrane cyto-plasmique , ainsi que l'a montre HORN(53) . Cette présence des :métallothionéines , très au contact de la membrane , donc du milieu extérieur et a rapprocher des expériences de b-locage par les antimitotiques qui empêchent l'entrée du métal dans la cellule par simple inhibition de la synthèse des MT . Celles ci doivent donc interagir de façon très étroite avec le transporteur trans-membranaire du métal de
sa
-telle façon que la présence d'une ,ou plusieurs , molécule de métallothionéine rentre en contact avec un ,ou
plusieurs , transporteurs , et délivre a ce moment le signal de passage de métal au travers de la memb-rane .
Par contre , la concentration de métallothionéine-s au niveau nucléaire est très faib-le , et ne doit jouer qu'un rôle minime de detoxification ou d'apport d'oligoéléments mais il se peut que la prése-nce de MT a ce niveau ait un rôle important dans la regulation de la synthèse de mRNA inducteur de MT.
2.3.2 Répartition dans l'organisme
Les métallothionéines sont reparties de façon très uniforme- dans tous les tissus de mammifères ,tous les organes possédant une certaine concentration de MT , reparties de façon diffus-e au niveau cellulaire • Trois organes sont particulièrement riches en métallothionéines , ce sont le foie , le rein , et l'intestin .
Ces trois organes étant des points importants du méta-bolisme des MT.
Par contre , il nous remarquerons que au niveau du système nerveux , les oligoéléments sont amenés aux neurones par l'intermédiaire des astrocytes . Si le transport de oligo-éléments est perturbé a ce niveau , de graves troubles nerveux , tels que nous les voyons dans les carences
cuivriques pourront apparaitre ,comme c'est le cas dans la maladie de MENKES.
2.4 Evolution des taux des deux isoformes 2.4.1 Evolution au coYrs de la vie
En règle générale ,les métallothionéine-s suivent l'évolution des cellules ; c'est à dire que leur taux cellulaire est maximal lors d'une période de croissance cellulaire et diminue ensuite si le tissu a une croissance ralentie .
Cette variation du taux est très nette si l'on prend comme exemple un tis-su tel que le thymus qui présente au cours du développement d'abord une phase de croissance très importante au cours de la m-ise en place des mécanismes
immunitaires , avec une demande accrue en oligoéléments et en zinc en particulier ; cette période coïncide avec un taux des deux formes de MT important dans les cellules ; puis nous voyons décroitre ce- taux lors de la régression du thymus (54} .
Les métallothionéines sont présentes a tous les stades de l'évolution animale et sont déjà présentés au niveau placentaire et trophoblasique ou leur taux est fonction de la présence d'agents inducteurs de la synthèse
(WAALKES) (55) , (LEHMAN) (56)
Les cellules placentaires sont toutes a fait capables de.reguler leur propre taux de synthèse des MT.
60
-Lors de l'évolution de l'animal le ratio entre les deux isoformes change p-rogressivement , dans le sens d'une
augmentation
du rap-port MT2/MT1 ,et avec une diminution globale des MT au bout de quelques jours de- vie. Nous prendrons comme
modèle d'étude le travail de SUZUKI sur ce sujet(57} , qui en suivant l'évolution des deux is-oformes chez des jeunes rats durant la périod-e post natale trouve un accroissement du ratio MT-II /MT-I avec l'âge .
2.4.2 Evolution selon l'agent inducteur
Selon l'agent inducteur de la synthèse , 1' une- ou l'autre des deux is-oformes e-s-t induite
préférentiellement::
lors de l'injection d'un métal bivalent nous observons une réponse plus importante de MT-I que pour le cuivre ou la réponse à une injection de 1' isoforme- II est très
importante (58.) .
2.5 Rôle détoxifiant
2.5.1 Vis a vis du cadmium
Ce fut le· premier élément trouvé a-u ni veau des
métallothionéine-s et celui pour lequel le rôle- détoxifiant de ces protéines fut suspecté .
Le MT protègent les cellules des effets toxiques du cadmium par chélation de celui_ci et donc piégeage avant
qu'il n'ait pu induire des effets toxiques au niveau cellulaire .
L-'élim-ination du Cd éventuellement rentré dans la cellule se fait ensuite par dégradation lysosomiale des MT et relargage extra-cellulaire .
Le cadmium est ensuite progressive-ment évacué de l'organisme par le rein .
Ce mécanisme d'élim-ination rénale est d'ailleurs un peu particulier car le cadm-ium filtré par le glome-rule se fixe lui aussi· sur le cellules du parenchyme rénal lors du
passage dans l'anse de Henlé ; et par dégradation ces cellules libèrent ensuite les MT qui passent au niveau urinaire sous forme plus ou moins dégradées .
L-ors d'une exposition professionnelle au cadmium le dosage urinaire des mé-tallothionéines serait donc utile pour
déceler une éventuelle intoxication au cadmium .
2.5.2 Vis a vis des métaux lourds
Les métallothionéines protègent les cellule-s des effets toxiques des métaux lourds par capture du métal avant son action au niveau des enzymes ou de l'ADN.
62
-L-e rôle des métallothionéines est ici double : à la fois antitoxique et régulateur puisque ces deux éléments sont indispensables à la cellule .
2.6 Rôle de stockage des métaux
L-es métallothionéines n'ont qu'un rôle de stockage à court terme des métaux car leur demi-vie cellulaire
faible-(de l'ordre de 3 jours ) et donc le relargage. sanguin assez rapide les emp@chent de jouer le rôle d'un site de stockage à long terme ,comparable à la ferritine .
D'autre part , l'alimentation apportant une source
généralement suffisante d'oligoéléments ne nécessite pas , pour l'organisme , des réserves en métaux .
2.7 Transport du métal aux apoenzymes
Plusieurs études réalisées sur différents modèles animaux ou cellulaires montrent que les métallothionéines sont une forme d'échange et de stockage des métaux au niveau cellulaire.
L'étude de SEAGRAVE(59) , réalisée sur des cellules en culture montre bien la fixation préalable du cuivre sur les
métallothionéines ,dans les premières heures de l'incubation , puis le passage du cuivre sur les protéines de haut poids moléculaire , repré-sentant les enzymes cellulaires.
Les métallothionéines transportent directement leur métal aux apoenzymes , sans passage par le milieu extérieur ou le solvant . Des données réalisées en RMN montrent que le schéma d'activation d'une enzyme est :
MT-Me + Enz.
-->
MT + Enz-MeLors de- la cinétique de reconstitution d'une apoenzyme telle que l'anhydrase carbonique (Enz. a zinc ) par une- MT portant du zinc , nous remarquons que l'isoforme 1 réactive beaucoup plus vi te 1 'apoanhydrase carbonique. que 1' isoforme 2 (WING} ce qui est montre sur la fig. ).
64 -1200 '
-
E
"'
p--
--o- ...
- ...
a
"'
···•
1 800c
·-
E
.
~
.~ ~ 400 <] 0 30 6090
Incubation time (min)
Fig. 4.
E.ffects of Incubation on the reactivation of
apo-(carbonic anhydrase)
See the Materials and Methods section for
details.
0,
ZnS0
4;l:l,
Zn(CH
3C0
2) 2; Â,Zn(NOJ
2e,
zinc-thionein,
HoJo-enzyme
activity
=
2500âA
400 •min-
1 •mJ-
1•figure cinétique de reconstitution de l'apoanhydrase carbonique selon WINGE
Nous mettons en parallèle cette différence de réactivité vis à vis de l' anhydrase carbonique avec les différence-s de réac ti vi té des deux isoform-es vis a vis de l' EDTA pour
lesquelles WING trouve une réactivité nettement plus grande pour l'isoforme 1 par rapport a l'isoforme 2 .
Il nous sem-ble donc 1 en se basant sur les différence-s- de demi-vies
1 et sur les possibilités d'échanges plus importantes pour
l'isoforme 1 (chez l'homme ) qu'il existe une différence de rôles biochim-iques entre les deux isométallothionéines .
L' isoforme 1 serait une forme- d'échange du métal lie 1 et notamment
une forme de transfert aux apoenzymes , le surplus de métal étant éliminé après dégradation de la protéine .
L·' isoforme 2 se-rait surtout une forme de stockage du métal.
Nous proposons donc le schéma suivant pour expliquer le métabolisme intracellulaire d'un métal : fig
e. {. ·--. exterieur membrane METAL figure - 66 -MT I ENZYMES