La Phosphodiestérase 10 (PDE10) dans la
physiologie du spermatozoïde, caractérisation,
localisation et fonction
Mémoire
Loïze Maréchal
Maitrise en médecine moléculaire
Maître ès sciences (M.Sc.)
Québec, Canada
La Phosphodiestérase 10 (PDE10) dans la
physiologie du spermatozoïde, caractérisation,
localisation et fonction
Mémoire
Loïze Maréchal
Sous la direction de :
Pierre Leclerc, directeur de recherche
François Richard, codirecteur de recherche
iii
Résumé
Sur onze familles actuellement connues, la phosphodiestérase 10 (PDE10) est une des plus récemment découverte. Si elle est surtout exprimée dans le cerveau (striatum), où elle a beaucoup été étudiée car impliquée dans plusieurs pathologies neurologiques, elle est aussi exprimée dans le testicule. Cette PDE est capable d'hydrolyser à la fois l'AMPc et le GMPc, mais est bien plus efficace sur le premier. Ce mémoire sera consacré à l'étude de la PDE10 dans le spermatozoïde, depuis sa découverte et sa caractérisation, jusqu'à des ébauches de pistes sur sa régulation et son rôle dans la physiologie spermatique. L'étude se concentrera principalement sur un modèle bovin, mais des aspects humains de la PDE10 spermatique y seront également abordés. On y apprendra que l'isoforme retrouvée chez le bovin est celle nommée PDE10X4 et que celle retrouvée chez l'humain lui est très similaire. La protéine est retrouvée dans la région acrosomale du spermatozoïde et semble plutôt cytosolique, même si une association aux membranes n'est pas exclue. La protéine semble faire partie de complexes protéiques de haut poids moléculaire dont les autres membres restent à déterminer. La régulation de PDE10 spermatique semble assez différente de ce que l'on retrouve dans le striatum, puisque dans le gamète mâle, on ne retrouve ni phosphorylation ni palmitoylation de PDE10. L'impact de PDE10 sur la phosphorylation des protéines et la motilité des spermatozoïdes est abordé. Pour terminer, PDE10 semble impliquée dans la réaction d'acrosome, mais son rôle précis reste encore à définir.
iv
Abstract
Eleven phosphodiesterases (PDE) families are actually known and PDE10 is one of the most recently discovered. It is expressed principally in the brain where it is involved in some mental disorders, and then well studied. But it is also expressed in the testis, where less is known. PDE10 can degrade both cAMP and cGMP but is way more potent with the first one. This memoir is about the situation of the PDE10 in the spermatozoa, from its characterization and localization to the first steps toward its regulation and its functions in the sperm physiology. Although we will focus on a bovine sperm model, we will also have a look on the situation in human spermatozoa. We show that the bovine PDE10 isoform found in the spermatozoa correspond to the predicted PDE10X4 sequence and that the one found in human spermatozoa is really similar. The protein localizes in the acrosomal region and is probably cytosolic, although we can't exclude an association to membranes. PDE10 seems to be part of high molecular weight protein complexes but we need to identify the other protein members. The regulation of PDE10 seems different in spermatozoa than in the striatum where the protein is spatially and functionally regulated by phosphorylation and palmitoylation. These two events don't occur in the male gamete. We will consider the impact of the PDE10 on the protein phosphorylation status and on the control of the motility. In the end, we PDE10 seems to have an impact on the acrosomal reaction, but further work is needed to understand its precise role.
v Table des
matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Avant-propos ... xiv 1. Chapitre 1 : Introduction ... 1 1.1 Le spermatozoïde ... 1 1.1.1 Histoire (découverte) ... 1 1.1.2 Structure ... 1 1.1.3 Spermatogenèse ... 4 1.1.4 Maturation épididymaire ... 6 1.2 Ejaculation ... 6 1.3 Capacitation ... 6 1.4 Réaction d’acrosome ... 9 1.5 Fécondation ... 10 1.6 L’AMPc ... 11 1.6.1 Adénylyl-cyclase ... 11 1.7 EPAC ... 11 1.8 CNGC ... 12 1.9 PKA ... 12 1.9.1 Action en aval ... 13 1.10 Les Phosphodiéstérases ... 13
1.11 Problématique, hypothèses et objectifs ... 19
1.11.1 Problématique et hypothèses ... 19
1.11.2 Objectifs ... 20
2. Chapitre 2 : Identification and Localization of the Cyclic Nucleotide Phosphodiesterase 10A in Bovine Testis and Mature Spermatozoa. ... 22
2.1 Abstract ... 22
vi
2.3 Materials & Methods ... 25
2.3.1 RNA isolation, cDNA synthesis and PCR amplification ... 25
2.3.2 Isolation of bull testicular germ cells ... 27
2.3.3 Sperm preparation and subcellular fractioning ... 28
2.3.4 Western blot procedure ... 29
2.3.5 Immunoprecipitation ... 29 2.3.6 Proteomic analysis ... 30 2.3.7 Immunofluorescence ... 30 2.3.8 Immunohistochemistry ... 31 2.3.9 Immunoelectron microscopy ... 31 2.4 Results ... 32 2.5 Discussion ... 43 2.6 Acknowledgments ... 46 2.7 References ... 46 2.8 Supporting Information ... 51
3. Chapitre 3 : Comprendre le rôle et la régulation de PDE10 dans le spermatozoïde 57 3.1 Introduction ... 57
3.2 Matériels et Méthodes ... 59
3.2.1 Préparation de la semence... 59
3.2.2 Obtention et préparation des striata de souris ... 60
3.2.3 Incubation des spermatozoïdes ... 60
3.2.4 Immunoprécipitations ... 61
3.2.5 Immunoprécipitation en présence de PKA exogène ... 61
3.2.6 Western blots ... 62
3.2.7 Détection de la palmitoylation - protocole Acyl-Biotin Exchange (ABE) modifié . 62 3.2.8 Fixation des spermatozoïdes pour la détection des complexes de haut poids moléculaire ... 63
3.2.9 Essais de motilité ... 63
3.2.10 Suivi de la réaction acrosomale ... 64
3.2.11 Mesure de l'activité enzymatique de PDE10 ... 64
vii
3.3 Résultats ... 65
3.3.1 La PDE10 spermatique ne semble pas phosphorylée par PKA ... 65
3.3.2 PDE10 n'est pas palmitoylée ... 67
3.3.3 PDE10 semble appartenir à des complexes protéiques de haut poids moléculaire .. 68
3.3.4 PDE10 pourrait être impliquée dans la motilité cellulaire des spermatozoïdes à faible motilité ... 70
3.3.5 PDE10 n'influence pas la phosphorylation par PKA ni la phosphorylation sur résidus tyrosine. ... 72
3.3.6 PDE10 est impliquée dans la réaction d'acrosome ... 73
3.3.7 L'activité enzymatique de PDE10 ne varie pas lors de la capacitation. ... 75
3.4 Discussion ... 77
3.5 Annexes au chapitre 3 ... 83
4. Chapitre 4 : Caractérisation et localisation de PDE10 dans le spermatozoïde humain éjaculé. ... 85
4.1 Introduction ... 85
4.2 Matériels et Méthodes ... 86
4.2.1 Préparation des échantillons ... 86
4.2.2 Fractionnement des spermatozoïdes ... 87
4.2.3 Incubation des spermatozoïdes en présence d'inhibiteurs de PDE10 ou de PDE ... 87
4.2.4 Immunoprécipitation ... 88
4.2.5 Séquençage par spectrométrie de masse ... 88
4.2.6 Western blot ... 88
4.2.7 Obtention et préparation des striata de souris ... 89
4.2.8 Palmitoylation ... 89
4.2.9 Statistiques ... 89
4.3 Résultats ... 89
4.3.1 Une isoforme de PDE10 homologue de celle exprimée chez le bovin est exprimée dans le spermatozoïde humain éjaculé ... 89
4.3.2 PDE10 est localisée dans le compartiment cytosolique du spermatozoïde humain . 91 4.3.3 PDE10 influence la phosphorylation sur tyrosine dans le spermatozoïde humain, mais pas la phosphorylation par PKA. ... 92
viii
4.4 Discussion ... 94 5. Chapitre 5 : Discussion générale ... 96 Bibliographie ... 99
ix
Liste des tableaux
Tableau 1-1 : Quelques inhibiteurs de PDE. ... 15
Tableau 1-2 : Quelques inhibiteurs de PDE10. ... 18
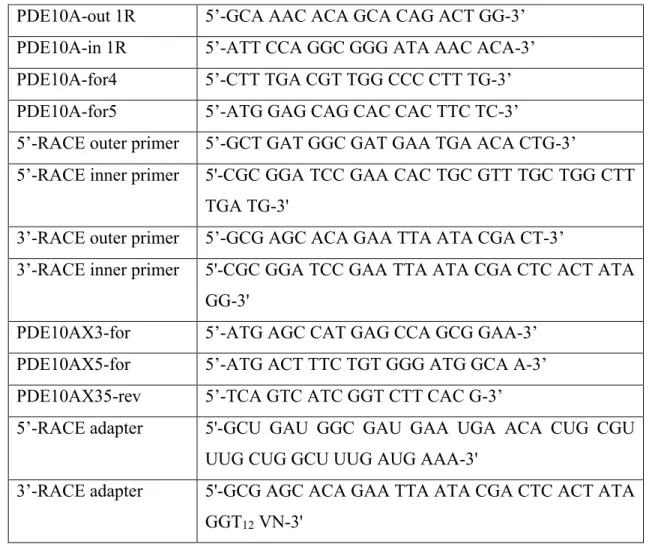
Table 2-1 : Oligonucleotide primers used for PCR amplification. ... 27
x
Liste des figures
Figure 1-1 : Le spermatozoïde de mammifère... 4
Figure 1-2 : La spermatogenèse... 5
Figure 1-3 : Principales voies de signalisation impliquées dans la capacitation. ... 8
Figure 1-4 : La réaction d'acrosome. ... 10
Figure 1-5 : Les différentes familles de PDE. ... 15
Figure 1-6 : Alignement de l'extrémité N-terminale des isoformes protéiques prédites de PDE10 chez le bovin, ainsi que la correspondance des noms des variants d'ARN. ... 16
Figure 1-7 : PDE10 et ses différents domaines fonctionnels. ... 17
Figure 2-1 : 5’-RACE of cDNA encoding PDE10A in bull testis. ... 33
Figure 2-2 : 3’-RACE of cDNA encoding PDE10A in bull testis. ... 35
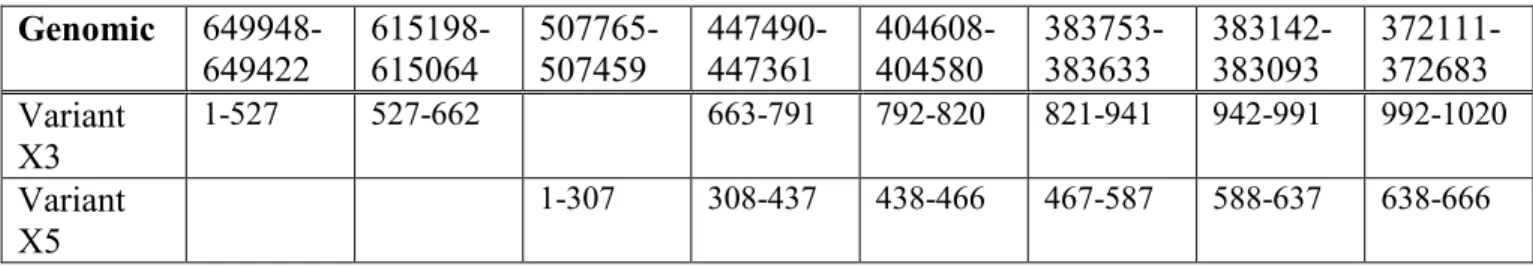
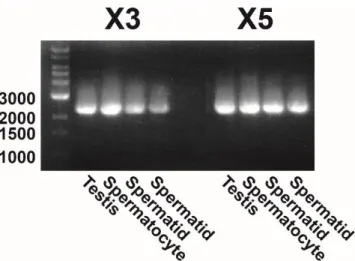
Figure 2-3 : PCR amplification of cDNA encoding PDE10A variants X3 and X5 in bovine testis and spermatogenic germ cells. ... 36
Figure 2-4 : Localization of PDE10A in bovine testis. ... 37
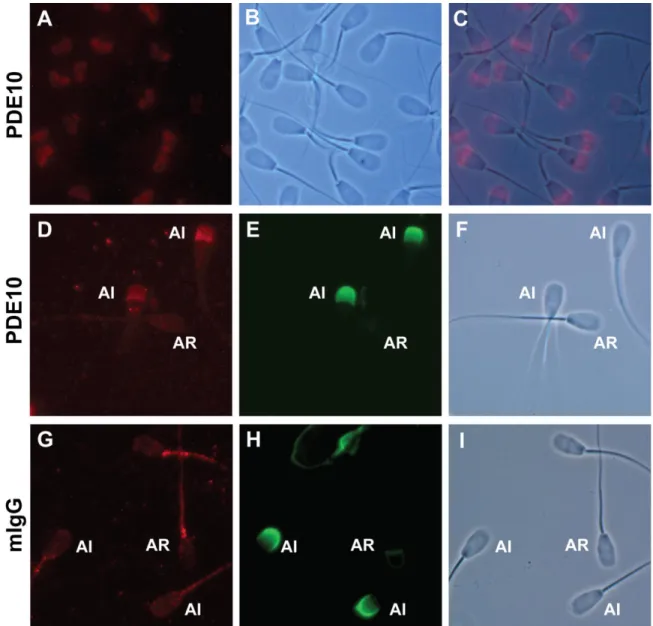
Figure 2-5 : PDE10A in ejaculated bull sperm... 38
Figure 2-6 : Immunolocalisation of PDE10A in acrosome intact and acrosome reacted ejaculated bull spermatozoa... 39
Figure 2-7 : PDE10A in cryopreserved bull spermatozoa. ... 40
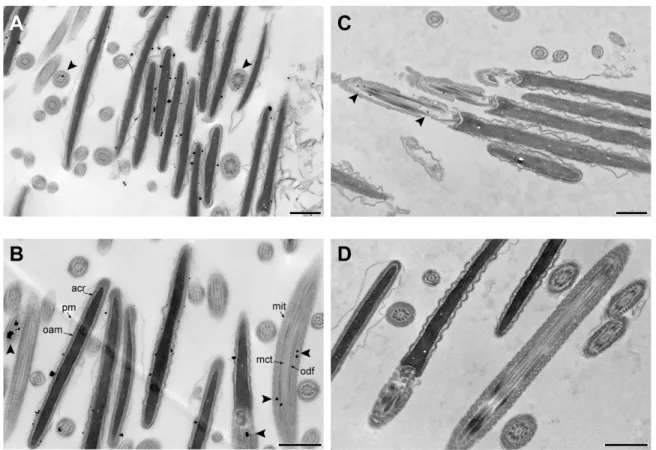
Figure 2-8 : Detection of bull sperm PDE10A at the electron microscopic level. ... 41
Figure 2-9 : Immunoprecipitation and identification of bull sperm PDE10A. ... 42
Figure 2-10 : Putative intron-exon distribution in the 5'- and 3'-ends of bovine PDE10A gene. ... 44
Figure 3-1 : L'interaction de la phosphorylation par PKA et de la palmitoylation régule la localisation de la PD10 dans le striatum murin. ... 58
Figure 3-2 : Phosphorylation de PDE10 par PKA. ... 66
Figure 3-3 : Phosphorylation de PDE10 par PKA en présence de PKA exogène. ... 67
Figure 3-4 : Palmitoylation de PDE10. ... 68
Figure 3-5 : PDE10 semble appartenir à des complexes protéiques. ... 69
Figure 3-6 : PDE10 n'a pas d'impact sur les paramètres de motilité mesurés chez les spermatozoïdes fraîchement éjaculés. ... 71
Figure 3-7 : PDE10 n'a pas d'impact sur les paramètres de motilité mesurés chez les spermatozoïdes fraîchement éjaculés. ... 72
Figure 3-8 : PDE10 n'influence pas la phosphorylation par PKA ni la phosphorylation sur résidus tyrosine. ... 73
Figure 3-9 : PDE10 semble jouer un rôle dans la réaction d'acrosome. ... 74
Figure 3-10 : L’activité de PDE10 n’augmente pas de manière significative pendant la capacitation. ... 76
Figure 3-11 : Les différents paramètres de motilité mesurés au CASA. ... 83
Figure 3-12 : Phosphorylation de PDE10 par PKA. ... 84
xi
Figure 4-2 : PDE10 est présente dans le spermatozoïde éjaculé humain. ... 90 Figure 4-3 : Caractérisation par spectrométrie de masse de l'isoforme PDE10 X4 de PDE10 retrouvée dans le spermatozoïde humain éjaculé. ... 90 Figure 4-4 : Comparaison des séquences prédites de PDE10 X4 humaine et bovine, toutes les deux retrouvées dans les spermatozoïdes éjaculés des deux espèces respectives. ... 91 Figure 4-5 : Localisation de la PDE10 dans le spermatozoïde humain éjaculé fractionné par cavitation à l'azote. ... 92 Figure 4-6 : PDE10 influence la phosphorylation sur résidu tyrosine, mais pas la phosphorylation par PKA. Effet du MP10 et de l'IBMX sur la phosphorylation sur tyrosine, normalisé. N=6 ... 93 Figure 4-7 : Palmitoylation de PDE10. ... 94
xii
Liste des abréviations
ABE : Acyl-Biotin Exchange, protocole de détection des palmitoylations ADN : Acide DesoxyriboNucléique
AKAP : A-Kinase Anchor Protein, protéine d'ancrage de la PKA AMPc : Adénosine MonoPhosphate cyclique
ARN : Acide RiboNucléique ATP : Adénosine TriPhosphate
BWW : Biggers, Whitter and Whittingham, milieu d'incubation des spermatozoïdes humains CASA : Computer Assisted Sperm Analysis, appareil de suivi de la motilité spermatique assistée par ordinateur
CNGC : Cyclic Nucleotide Gated Channel, canal ionique régulé par les nucléotides cycliques Cpm : Coups par minute, unité de mesure de la radioactivité
DDM : n-Dodecyl β-D-Maltoside, détergent DMSO : DiMéthylSulfOxide, diluant
D-PBS, Dulbecco's PBS : tampon PBS sans magnésium ni calcium DTT : Dithiothréitol, molécule redox
EPAC : Exchange protein directly activated by cAMP
GAF : cGMP-specific phosphodiesterases, adenylyl cyclases and FhlA GMPc : Guanosine MonoPhosphate cyclique
HDL : High Density Lipoprotein, lipoprotéine de haute densité, accepteur de cholestérol Hep : héparine
IBMX : 3-IsoButyl-1-MethylXanthine, inhibiteur non spécifique des PDE IgG : Immunoglobuline G
ODF : Outer Dense Fibers, Fibres Denses Externes PBS : Phosphate Saline Buffer, tampon
xiii
PCR : Polymerase Chain Reaction, réaction en chaîne de polymérisation PDE : PhosphoDiEstérase
PKA : Protéine Kinase A
PNA-Fitc : PeaNut Agglutinin couplée à de la Fluorescein isothiocyanate
RACE : Rapid Amplification of cDNA-Ends, technique d'amplification des extrémités d'un ADN complémentaire
SACY : soluble Adenylyl Cyclase, adénylyl cylase soluble
SDS-PAGE : Sodium Dodecyl Sulfate PolyAcrylamidz Gel Electrophoresis, gel dénaturant pour la séparation par électrophorèse de molécules comme des protéines
SNARE : Soluble N-ethylmaliemide-sensitive factor Attachment protein REceptor, protéines transmembranaires ayant la capacité de s’associer entre-elles pour organiser la fusion membranaire.
spTALP : sperm Tyrode's albumin lactate pyruvate : milieu d'incubation des spermatozoïdes bovin
TBS : Tris-Buffered Saline, tampon
TBS-T : TBS additionné de Tween (polysorbate), détergent TP : Température Pièce
VOCC : Voltage-Operated Calcium Channels, Canaux calciques actionnés par le voltage ZP : Zone Pellucide, entourant l'ovoyte
xiv
Avant-propos
Le but de ce mémoire est de présenter les résultats obtenus lors de mes deux années de maîtrise dans le laboratoire du Dr Pierre Leclerc principalement, mais aussi dans le laboratoire du Dr François J. Richard.
Lorsque j'ai commencé ma maîtrise, la caractérisation de la protéine avait déjà été établie chez le spermatozoïde bovin. L'objectif de ces deux années était de mieux comprendre la protéine PDE10 dans la physiologie spermatique, que ce soit sa localisation, sa régulation ou encore sa fonction.
Les similitudes montrées entre le spermatozoïde humain et bovin, que ce soit au niveau de la morphologie ou de la physiologie spermatique nous ont permis de travailler avec un modèle bovin, sans perdre de vue notre objectif humain. Ce modèle offre notamment la possibilité de travailler avec de plus grandes quantités de matériel.
L'article présenté au second chapitre a été soumis pour publication dans la revue Plos One le 19 Mai 2016 et accepté pour publication le 10 Août 2016. Il a été inséré dans ce mémoire sans modifications. Le premier auteur de l'article est Serge Goupil, professionnel de recherche du laboratoire. Hassan El-Hajj, étudiant du Dr Marie-Eve Tremblay nous a aidé à la préparation des échantillons observés en microscopie électronique, sur une modification du protocole du Dr Marie-Eve Tremblay. Le Dr François J. Richard est le patron d'un laboratoire spécialisé dans l'étude des phosphodiestérases et nous a permis de mesurer des activités enzymatiques grâce à ses installations et son protocole. Pour ma part, j'ai réalisé les expériences ayant mené aux figures Figure 2-5, Figure 2-6, Figure 2-7 et Figure 2-9B. J'ai également préparé les échantillons pour l'immuno-microscopie (lavage des spermatozoïdes, fixation à l'acroléine, et incorporation dans l'agarose), ainsi que mesuré les différents paramètres de motilité spermatique décrits en page 43. Enfin, j'ai pris part à la discussion des résultats ainsi qu'à la rédaction initiale de la partie matériels et méthodes des figures Figure 2-6, Figure 2-7 et Figure 2-8. Pour terminer, le Dr Pierre Leclerc est le directeur du laboratoire.
Pour terminer, je voudrais remercier toutes les personnes qui ont rendu ce travail possible. Que ce soit mes deux excellents collègues Serge Goupil et Andrée-Anne Saindon, pour leur soutien et leurs réponses à mes questions bêtes, ainsi que leurs brillantes idées. Mais aussi et bien sûr mon directeur et mon codirecteur, Pierre Leclerc et François J. Richard, pour leur patience à mon égard ainsi que pour m'avoir appris tant de choses. Je remercie également les organismes qui m'ont fait confiance en m'accordant des bourses : Le Centre de recherche en Reproduction, Développement et Santé Intergénérationnelle (CRDSI), le Réseau Québécois en Reproduction (RQR) et la Fondation du CHU de Québec.
xv
Enfin, je n'oublierai pas tous les gens que j'aime, famille et amis, présents ou malheureusement partis, pour leur amour et ce qu'ils ont rendu possible. Ce mémoire leur est dédié.
1
1. Chapitre 1 : Introduction 1.1 Le spermatozoïde
1.1.1 Histoire (découverte)
A la fin du XVIIème siècle Leeuwenhoek, grand contributeur à l’avancée technologique du microscope, découvre les spermatozoïdes qu’il nomme animalcules. Avant lui, de nombreuses théories existaient quant à la conception des enfants. Certains pensaient que le sperme seul servait à activer l’ovocyte, d’autres que l’homme et la femme produisent deux « liqueurs » qui, en se mélangeant, et sous l’action de la chaleur, « modèlent » l’enfant dans le corps de la femme.
Mais la découverte de Leeuwenhoek reste confidentielle pendant longtemps, et c’est seulement au XXème siècle que l’on comprend enfin les rôles complémentaires du
spermatozoïde et de l’ovule dans la conception d’un être vivant animal (Birkhead et al. 2009). 1.1.2 Structure
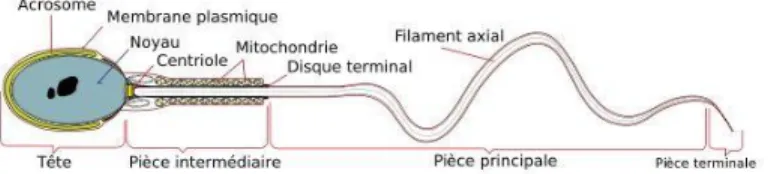
Les spermatozoïdes de mammifères sont d’allure générale très semblables d’une espèce à l’autre (Hafez and Hafez 2000). Ce sont les cellules les plus spécialisées de l’organisme. Elles possèdent trois grandes parties : la tête, comportant principalement le noyau et l’acrosome ; le cou, aussi appelé pièce connective, avec notamment les centrioles et les réserves majeures de calcium de la cellule ; et enfin le flagelle, responsable de la motilité de la cellule (Figure 1-1). Ce dernier peut-être lui-même subdivisé en trois parties : la pièce intermédiaire comprenant le manchon mitochondrial fournissant la grande partie de l’énergie cellulaire ; la pièce principale et la pièce terminale. Chez l’humain, il arrive fréquemment qu’un haut pourcentage de spermatozoïdes soient malformés, même dans un éjaculat dit normal. L’Organisation Mondiale de la Santé (OMS) considère qu’avec seulement 4% des gamètes de morphologie normale, un homme est potentiellement fertile. En deçà on parle de tératozoospermie (World Health Organization 2010). Chez d'autres espèces comme le taureau, on considère qu’un éjaculat est potentiellement fertile à partir du moment où 70% des spermatozoïdes ont une morphologie normale, avec au maximum 20% d’anomalies (Barth and Oko 1989).
1.1.2.1 La tête
La tête du spermatozoïde est essentiellement composée de deux parties : le noyau, qui contient le matériel génétique mâle très condensé qui entrera dans l’ovocyte pour participer à la formation du futur zygote ; et l’acrosome avec son contenu enzymatique.
1.1.2.1.1 Noyau
Le noyau du spermatozoïde contient le matériel génétique paternel. L'ADN y est extrêmement condensé autour de protéines spécifiques au spermatozoïde : les protamines.
2
Ces protéines, majoritaires dans le noyau spermatique, ont plusieurs fonctions putatives comme condenser l'ADN au maximum pour rendre le noyau plus aérodynamique, protéger le matériel génétique des bris (Muratori et al. 2006) ou participer à l'empreinte parentale des gènes (Oliva and Dixon 1991). L'hyper condensation de la chromatine empêche aussi la transcription de l'ADN spermatique. Cependant, la présence d'ARN dans les spermatozoïdes matures a été démontrée (Kramer and Krawetz 1997; Wykes et al. 1997). De plus, certaines études suggèrent que des transcriptases inverses sont actives dans le spermatozoïde et que le gamète peut activer la rétro-transcription de certains ARN stockés au besoin (Li and Zhou 2012). Ces ARN pourraient jouer un rôle dans la protection du génome paternel, et dans le devenir du zygote (Bukowska et al. 2013).
1.1.2.1.2 Acrosome
L'acrosome est un organelle dérivé de l'appareil de Golgi au début de la spermiogenèse (Eddy and O’Brien 1994). Il recouvre la partie antérieure de la tête du spermatozoïde et contient des enzymes nécessaires au spermatozoïde pour pénétrer la zone pellucide de l'ovocyte. La vésicule acrosomale est limitée d'une membrane. Durant la réaction acrosomale, la membrane externe de l'acrosome fusionne avec la membrane plasmique du spermatozoïde et le contenu enzymatique est libéré à l'extérieur (Huang and Yanagimachi 1985). L'acrosine est l'enzyme prédominante dans la matrice acrosomale. Elle est présente à l'état de proacrosine en très grande majorité, puis activée en acrosine lors de la réaction acrosomale. L'acrosine peut alors jouer son rôle de protéase pour aller digérer la zone pellucide, et faciliter le passage du spermatozoïde vers l'espace péri vitellin (Alberts et al. 2008; Zaneveld and De Jonge 2013). D'autres enzymes sont également présentes dans l'acrosome, entre autres des hyaluronidases (Zaneveld et al. 1973) et des neuraminidases (Tulsiani et al. 1998; Ma et al. 2012).
1.1.2.1.3 Pièce connective
Le cou fait le lien entre la tête du spermatozoïde et le flagelle. C'est une partie importante pour le spermatozoïde car elle contient les centrioles et d'importantes réserves de calcium de la cellule.
1.1.2.1.4 Centrioles
Durant la spermatogenèse, et plus précisément l'allongement des spermatides rondes en spermatides, le centriole proximal au noyau reste intact, tandis que le centriole distal donne lieu à l'axonème de la pièce principale pour créer le flagelle. Chez l'Homme ainsi que chez le bovin, le centriole est transmis à l'ovocyte lors de la fécondation et sert à créer le centrosome fœtal (Sathananthan et al. 2001).
1.1.2.1.5 Membranes redondantes nucléaires
Les membranes redondantes du spermatozoïdes sont des replis membranaires provenant du noyau, qui auraient migré vers le col durant la spermiogenèse et la compaction de la tête qui accompagne les changements de la morphologie spermatique (Ho 2010). Elles contiennent
3
les principales réserves de calcium de la cellule (Ho and Suarez 2003). On retrouve d’ailleurs sur ces membranes le récepteur à l’IP3, qui, lorsqu’activé, libère le calcium contenu dans les membranes nucléaires redondantes (Costello et al. 2009; Tapia et al. 2012).
1.1.2.2 Flagelle
De taille variable selon les espèces, le flagelle est le propulseur des spermatozoïdes. Si c'est lors de leur séjour dans l'épididyme que les spermatozoïdes acquièrent leur motilité, ils sont cependant maintenus immobiles par le faible pH intra luminal notamment (Verma 2001). Lors de l'éjaculation, le mélange des fluides sécrétés par les différentes glandes de l'appareil reproducteur masculin permet de diluer les spermatozoïdes épididymaires et de ramener le pH a une valeur physiologique (7,4 environ) ce qui lève l'inhibition de la motilité spermatique. Les spermatozoïdes démontrent alors une motilité progressive, caractérisée par des déplacements rapides en lignes droites.
Les différents éléments du flagelles permettent la mise en place du battement, qui le parcours tout entier (Eddy and O’Brien 1994). Pour la petite anecdote, il a été montré que la motilité des spermatozoïdes bovins cryoconservés était influencée par la gravité (Engelmann et al. 1992).
Le flagelle du spermatozoïde humain mesure environ 55 µm de long (Eddy and O’Brien 1994), celui du bovin environ 60 µm (Sundararaman et al. 2007).
Le flagelle est essentiellement composé d'un axonème, avec une structure de microtubules en "9+2", c’est-à-dire avec neuf paires de microtubules arrangées en cercle, et deux microtubules au centre. Cet axonème part de la base du flagelle, à la jonction entre la pièce connective et la pièce intermédiaire, et se poursuit jusqu'au bout de la pièce terminale. Autour de cet axonème, on retrouve le manchon mitochondrial au niveau de la pièce intermédiaire. Autour de la pièce intermédiaire et de la pièce principale, on retrouve aussi les fibres denses externes, ou ODF (Outer Dense fibers), dont la mise en place a été bien décrite par Clermont chez le rat (Irons and Clermont 1982). Autour des ODF, au niveau de la pièce principale, on retrouve le manchon fibreux (Eddy and O’Brien 1994).
1.1.2.2.1 Pièce intermédiaire
La pièce intermédiaire contient une partie très importante du flagelle : le manchon mitochondrial. La phosphorylation oxydative dans les mitochondries de ce manchon représente la manière la plus efficace de produire de l'ATP pour le spermatozoïde. Pour autant, la glycolyse, autre moyen de production d'ATP pour la motilité cellulaire existe également chez le spermatozoïde. L'importance de la glycolyse par rapport à la phosphorylation oxydative varie selon l'espèce, ainsi que les conditions d'incubation des spermatozoïdes (du Plessis et al. 2015).
4
La pièce principale est, comme son nom le laisse suggérer, la partie la plus grande du flagelle. L'axonème de structure 9+2 est entouré par un manchon fibreux. C'est dans la pièce principale que l'on retrouve les enzymes nécessaires à la glycolyse, source d'ATP la plus importante pour le spermatozoïde, associés au manchon fibreux (du Plessis et al. 2015).
Figure 1-1 : Le spermatozoïde de mammifère.
Les spermatozoïdes de mammifères sont très semblables entre eux. On retrouve deux parties principales : la tête, contenant le noyau et l'acrosome, et le flagelle, dédié à la motilité cellulaire. Le flagelle est découpé en trois parties : la pièce intermédiaire, la pièce principale et la pièce terminale. Tiré de Mariana Ruiz LadyofHats, Wikimedia, domaine public.
1.1.3 Spermatogenèse
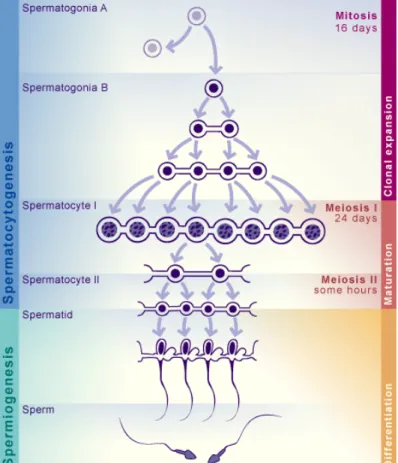
La spermatogenèse est composée de deux étapes : la spermatocytogenèse, étape de divisions cellulaires, et la spermiogenèse, étape de différenciation cellulaire qui se termine par la spermiation, ou détachement des spermatozoïdes formés de l’épithélium vers la lumière du tube séminifère.
1.1.3.1 Spermatocytogenèse
C'est à la puberté que commence la spermatogenèse, dans les tubules séminifères, entre les cellules nourricières de Sertoli. Les cellules souches germinales mâles, appelées spermatogonies A, situées à la base de l'épithélium stratifié des tubules, vont se multiplier par mitose et proliférer. Certaines vont former des spermatogonies B alors que d'autres vont rester à l'état de spermatogonies A et conserver la réserve de cellules souches. Les spermatogonies B vont grossir pour devenir des spermatocytes primaires. Ces cellules vont débuter une méiose menant à des spermatocytes secondaires à l'issue de la première division de méiose, puis des spermatides rondes haploïdes à la fin de la seconde division méiotique. Ces spermatides vont ensuite se différencier en spermatozoïdes sans étapes de division supplémentaires. Ce processus s'appelle la spermiogenèse (Abou-Haila and Tulsiani 2000) (Figure 1-2).
1.1.3.2 Spermiogenèse
Durant cette étape, les spermatides rondes changent de forme pour donner des spermatozoïdes sous la forme qu'on leur connait, sans division. L'ADN se compacte très fortement, notamment par le remplacement des histones par des protéines de transition, puis des protamines (voir section sur le noyau). C’est également pendant la spermiogenèse que l’acrosome se forme à partir de granules provenant de l’appareil de Golgi de la spermatide. Ces granules golgiennes, remplies de glycoprotéines fusionnent (phase « Golgi ») à la fin de la spermiogénèse pour former une grande vésicule aplatie, placée au-dessus du noyau (phase
5
« Cap »). Lors de la phase acrosomale, la vésicule condensée se place immédiatement sous la membrane plasmique de la spermatide. Enfin, diverses modifications peuvent se produire durant la phase de maturation, comme une condensation de l’acrosome ou des modifications protéiques (Abou-Haila and Tulsiani 2000). La condensation du noyau spermatique passe par une réorganisation de organelles, avec notamment un déplacement du noyau vers la périphérie cellulaire et une migration des mitochondries qui viennent s’enrouler autour du futur flagelle en élongation. Ce dernier prend naissance à partir du centriole distal pour s’allonger progressivement dans la direction opposée à celle prise par le noyau.
Le spermatozoïde mature possède très peu de cytoplasme. Ce dernier commence à être éliminé à la fin de la spermiogenèse et l’élimination se poursuit durant la maturation épididymaire. Le cytoplasme s’accumule au niveau du cou du spermatozoïde pour former la gouttelette cytoplasmique. Cette gouttelette est normalement éliminée à l’éjaculation, sans causer de dommage à la membrane plasmique, et certains associent sa rétention à un signe d’infertilité chez les espèces domestiques. Chez l’Humain, une certaine rétention cytoplasmique au niveau du cou est normale mais un excès est une cause d’infertilité (Cooper 2005).
Figure 1-2 : La spermatogenèse.
La spermatogenèse a lieu en deux étapes : la spermatocytogenèse comportant une prolifération des cellules souches germinales mâles (les spermatogonies) par mitose avec renouvellement du stock de cellules souches, et de méiose avec la formation de spermatides rondes. S'en suit la spermiogenèse, étape de différentiation durant laquelle les spermatides rondes vont s'allonger en spermatozoïdes matures. Tiré de (Universités de Fribourg).
6 1.1.4 Maturation épididymaire
Une fois formés, les spermatozoïdes sortent des tubules séminifères par le rete testis, qui se collecte dans l'épididyme. Cet organe est formé par un unique tubule très circonvolué (7 m chez l'Homme, 90 m chez le taureau), qui peut être segmenté en trois parties : tête (caput), corps (corpus) et queue (cauda). Chez certaines espèces dont les rongeurs, on retrouve en plus le segment initial, situé en amont de la tête. Le tubule est rempli de fluide épididymaire, dans lequel nagent les spermatozoïdes. L'épididyme est un lieu de stockage des spermatozoïdes, de concentration ainsi que de maturation. En effet, il a été montré que certaines protéines du fluide épididymaire venaient s'accoler sur les spermatozoïdes, certaines par le biais d'épididymosomes (petites vésicules présentes dans le fluide épididymaire (Sullivan 2015)). L'épididyme a aussi pour rôle de réabsorber une partie du fluide testiculaire. Les spermatozoïdes y acquièrent leur motilité progressive ainsi que leur capacité de se lier à l’ovocyte (Kaji and Kudo 2004; Da Ros et al. 2015), même s’ils sont maintenus immobiles par le pH intra luminal, et qu'ils devront subir d'autres étapes de maturation dans le tractus génital femelle (Robaire et al. 2006; Sullivan 2015).
1.2 Ejaculation
Lors de l'éjaculation, les spermatozoïdes stockés dans l'épididyme sont expulsés dans le vas deferent, qui passe ensuite dans la prostate pour devenir le canal éjaculateur pour enfin rejoindre l'urètre, qui débouche sur le méat urétral. Durant ce transit, plusieurs sécrétions viennent diluer la semence, provenant de l'épididyme, des vésicules séminales, de la prostate et des glandes bulbo-urétrales (Green 1967). C'est ce mélange qui compose le sperme. Les spermatozoïdes n'y représentent qu'environ 3 à 5% du volume final. Le reste, appelé plasma séminal, assure un apport énergétique et favorise la migration des spermatozoïdes dans le tractus génital femelle.
1.3 Capacitation
Découverte par Chang (Chang 1951) et Austin (Austin 1951) au début des années 50, la capacitation est la première grande étape de la maturation des spermatozoïdes, suivant l'éjaculation. Elle a lieu dans le tractus génital de la femelle, au contact des molécules sécrétées par l'utérus. La capacitation a plusieurs conséquences, notamment une hyperactivation des battements flagellaires, mais aussi une augmentation du pH intracellulaire (Vredenburgh-Wilberg and Parrish 1995; Visconti and Moore 1998), de la concentration en calcium, de la concentration en Adénosine MonoPhosphate cyclique (AMPc) menant à une activation de la Protéine Kinase A (PKA) et à une augmentation de la phosphorylation de protéines sur des résidus tyrosine (Visconti and Moore 1998). Au niveau de la surface membranaire, on observe aussi une réorganisation de certaines protéines et glycoprotéines (Yanagimachi 1994), permettant au spermatozoïde capacité de devenir sensible à la réaction d'acrosome initiée au contact du cumulus oophorus (Sun et al. 2011).
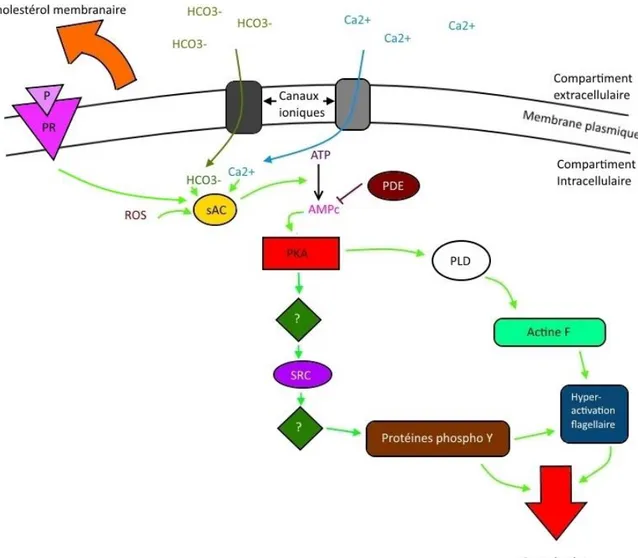
7
La première étape de la capacitation est le retrait du cholestérol des membranes spermatiques. Cela est possible grâce à la présence d'accepteurs du cholestérol dans les voies génitales femelles, telles que les HDL ou les apolipoprotéines (Leahy and Gadella 2000). In vitro, l'albumine est couramment utilisée comme accepteur du cholestérol (Abou-Haila and Tulsiani 2000; Macías-García et al. 2015). Ce retrait de cholestérol va permettre un remaniement des membranes avec, notamment, une redistribution des protéines membranaires et un démasquage de canaux ioniques (Yanagimachi 1994; Thaler et al. 2006). Ces canaux ioniques vont laisser entrer des ions calcium et des ions bicarbonates, présents dans les voies génitales femelles, qui vont activer des adénylyl cyclases intra spermatozoïdes pour former de l'AMPc à partir d'ATP (Okamura et al. 1985; Breitbart 2002; Visconti 2009). Cet AMPc va pouvoir notamment activer la PKA, acteur central de la capacitation, mais aussi le cAMP/cAMP-regulated guanine nucleotide exchange factors (EPAC), jouant un rôle dans la réaction d’acrosome et le Cyclic-Nucleotides Gated Channel (CNGC) en plus faibles proportions. S'en suivra ensuite une cascade de phosphorylation par la PKA, sur des résidus sérine et thréonine, mais aussi sur tyrosine par d'autres kinases (Visconti et al. 1995; Galantino-Homer et al. 1997). Il existe des intermédiaires encore inconnus dans cette cascade, mais l'on sait que les kinases de la famille Src (SFK) pourraient être impliquées (Lawson et al. 2008), ainsi que la phosphatase PP1 et la CAMKII, ainsi que la kinase Pyk2 (Breitbart and Finkelstein 2015). Cette phosphorylation sur tyrosine a été beaucoup étudiée et est considérée comme un marqueur de capacitation (Visconti et al. 1995) (Figure 1-3). Durant la capacitation, on observe également une polymérisation de l'actine dépendante de la Phospholipase D (PLD). PIP2, un cofacteur de la PLD lie la gelsoline et la décroche de l'extrémité des morceaux d'actine pour permettre leur polymérisation. Cette polymérisation d'actine est très importante pour le contrôle et le développement de la motilité hyperactivée (Breitbart and Finkelstein 2015). L'hyperactivation de la motilité est due à un changement au niveau du profil de battement du flagelle spermatique qui présente une amplitude plus grande ainsi qu'une asymétrie des battements (Suarez and Ho 2003). Cette hyperactivation permet aux spermatozoïdes de se décrocher de l'épithélium des oviductes, ainsi que de se diriger plus efficacement vers l'ovule, puis traverser la zone pellucide du gamète femelle (Suarez 2008). Par ailleurs, les gamètes mâles pourraient être attirés par l'ovule via des mécanismes de chimiotaxie et de thermotaxie (Bahat and Eisenbach 2006; Salicioni et al. 2007).
8
Figure 1-3 : Principales voies de signalisation impliquées dans la capacitation.
Suivant le retrait du cholestérol de la membrane plasmique, des ions calcium (Ca2+) et bicarbonate (HCO3-) peuvent traverser la membrane plasmique par des canaux ioniques démasqués. Ces ions vont aller activer principalement l’adénylyl-cyclase soluble (sAC) qui va former de l’AMPc à partir d’ATP. Les phosphodiestérases présentes dans le spermatozoïde peuvent dégrader cet AMPc. L’AMPc va activer la protéine kinase A (PKA) qui va phosphoryler différentes protéines telles que la phospholipase D (PLD) qui va permettre la polymérisation de l’actine F et mener à l’hyperactivation des mouvements du flagelle. En même temps, la PKA va aller phosphoryler d’autres protéines qui nous sont encore inconnues, dont les tyrosines kinases de la famille SRC. Ces dernières vont également participer à l’hyperactivation des mouvements du flagelle, et donc à la capacitation.
Une fois décrochés de l'épithélium de l’oviducte, les spermatozoïdes progressent vers le lieu de la fécondation (l’ampoule, chez l’Homme). Ce transport est facilité d'une part grâce à l'hyperactivation des mouvements flagellaires, mais aussi grâce au péristaltisme des oviductes (Kunz et al. 1996). Arrivés au lieu de fécondation, la présence de l’ovule, et des cellules du cumulus oophorus qui l’entourent, peut déclencher la réaction d’acrosome chez les spermatozoïdes préalablement capacités.
9 1.4 Réaction d’acrosome
La réaction d'acrosome a été d'abord découverte chez les oursins de mer (Dan 1952), avant que sa présence ne soit démontrée chez les mammifères six ans plus tard par Austin et Bishop (Austin and Bishop 1958) qui ont montré que la réaction d'acrosome était nécessaire à la pénétration de la zone pellucide (ZP) de l'ovule (Gervasi and Visconti 2016).
On a longtemps pensé que la réaction d’acrosome se faisait au contact des protéines de la zone pellucide, notamment ZP3 (Yanagimachi 1994). Cependant, ce dogme n’explique pas comment il se fait que de nombreux spermatozoïdes arrivent à la ZP avec leur acrosome déjà réagit. On pense maintenant que les cellules du cumulus oopohorus, entourant la ZP de l’ovocyte, joue un rôle primordial dans le déclenchement de la réaction d’acrosome (Jin et al. 2011). Il semblerait que les spermatozoïdes et les cellules du cumulus interagissent dans un dialogue impliquant notamment la protéine spermatique NYD-SP8. Une partie des spermatozoïdes pourraient réagir au contact des cellules du cumulus, et libérer leurs hyaluronidases pour ainsi ouvrir la voie vers la ZP à d’autres spermatozoïdes (Sun et al. 2011). Néanmoins, les protéines de la ZP restent importantes pour la liaison du spermatozoïde à l’ovocyte et la protection contre la polyspermie (Hoodbhoy and Dean 2004). La liaison du spermatozoïde à la ZP est espèce-dépendante (Schmidt et al. 1997), et résulte dans l'activation du spermatozoïde via un signal calcique, qui va déclencher la fusion de la membrane externe de l'acrosome et de la membrane plasmique sus-jacente (Abou-Haila and Tulsiani 2000). Cela va mener à la formation de pores qui vont permettre la maturation de la pro-acrosine en acrosine, ainsi que l'exocytose du contenu acrosomal (Figure 1-4). Les enzymes libérées, ainsi que l’acrosine, fonctionnelle à la surface de la membrane interne de l’acrosome, vont permettre de dégrader localement la ZP et le spermatozoïdes à l'acrosome réagit pourra ainsi avoir accès à la membrane plasmique de l'ovocyte où le segment équatorial du spermatozoïde ira fusionner (Ickowicz et al. 2012).
D'un point de vue moléculaire, il a été montré que la réaction d'acrosome était liée à de fortes concentrations d'AMPc (Leclerc and Kopf 1995). La liaison à la ZP va activer l'adénylyl-cyclase, qui va produire de l'AMPc qui va lui-même aller activer la PKA qui va pouvoir enfin activer des canaux calciques voltage-dépendants (Breitbart and Spungin 1997) (Voltage-Operated Calcium Channels, VOCC) qui vont laisser entrer des ions calcium en provenance du milieu extracellulaire. Chez l'humain, la progestérone peut aussi activer les VOCC (Morales et al. 2000). Il a cependant été montré chez l'humain que CatSper est le principal canal calcique du spermatozoïde (Navarrete et al. 2015). Ce canal est également capable de répondre à la progestérone pour laisser entrer du calcium dans le cytosol spermatique (Lishko et al. 2011; Strunker et al. 2011; Tamburrino et al. 2014). Le calcium va activer la Phospholipase C (PLC) qui va transformer du Phosphatidylinositol biphosphate (PIP2) en DiacylGlycérol (DAG), en formant au passage de l'inositol triphosphate (IP3). Cet IP3 va lier
10
des récepteurs sur les réserves de calcium intracellulaire (comme l'acrosome) et libérer le cation dans le cytosol. C'est cette augmentation de la concentration en calcium intracellulaire qui déclenche l'exocytose acrosomale, par le réarrangement des SNARE (Soluble N-éthylmaleimide-sensitive-factor Attachment protein REceptor) présents sur la membrane plasmique et la membrane externe de l'acrosome, menant à la création de pores (De Blas et al. 2005). La réaction d'acrosome dépend aussi de la dépolymérisation de l'actine, par le relargage de la gelsoline par le PIP2 (Breitbart and Finkelstein 2015).
L’EPAC (exchange protein directly activated by cAMP) est le plus récent effecteur de l’AMPc découvert. S’il a été établi qu’un contexte de fortes concentrations d’AMPc déclenche la réaction acrosomale, il a longtemps été pensé que la signalisation passait par l’activation de la voie PKA. On sait maintenant que l’EPAC est un acteur indispensable de la réaction d’acrosome. Il a en effet été montré qu’une séquestration de l’EPAC bloquait l’exocytose acrosomale, au même titre que l’ajout de PDE exogènes (Branham et al. 2006).
Figure 1-4 : La réaction d'acrosome.
L'exocytose acrosomale est déclenchée par la liaison du spermatozoïde aux cellules du cumulus oophorus entourant l'ovocyte. Cette liaison déclenche une fusion de la membrane acrosomale externe et de la membrane plasmique, formant des pores par lesquels s'échappe le contenu acrosomal, riche en enzymes capable de digérer la ZP et ainsi permettre au spermatozoïde d'accéder à la membrane plasmique de l'ovocyte. Tiré de (Yanagimachi 1994).
1.5 Fécondation
Suivant la fusion des membranes, puis le mélange des pronoyaux des deux gamètes mâle et femelle (caryogamie), la reconnaissance de deux protéines, Juno (sur l'ovocyte) et Izumo (sur le spermatozoïde), permet un changement de polarité des membranes de la ZP et de la membrane plasmique de l’ovocyte, pour empêcher la liaison d'un second spermatozoïde (Bianchi et al. 2014). La pénétration du spermatozoïde dans l’ovocyte induit également une
11
reprise de la division ovocytaire pour compléter la méiose ainsi qu'une exocytose des granules corticaux de l'ovocyte, qui relarguent du calcium ainsi que des enzymes qui vont modifier la membrane plasmique et la ZP de l'ovule pour le rendre imperméable à d'autres spermatozoïdes et ainsi éviter la polyspermie (Gardner and Evans 2006).
Une fois le contenu nucléaire du spermatozoïde entré dans l'ovocyte, les deux pronoyaux se décondensent et les pronucléi mâle et femelle vont se combiner pour reconstituer un zygote diploïde. Les divisions cellulaires vont ensuite pouvoir commencer. Comme mentionné plus haut, l'idée que les spermatozoïdes pourraient transmettre certains ARN en plus de leur ADN commence à émerger.
1.6 L’AMPc
Acteur majeur de la capacitation, le 3’,5’-Adénosine MonoPhosphate cyclique (3’, 5’-AMPc) est un second messager ubiquitaire impliqué dans de nombreuses situations de communications intercellulaires. Il est formé à partir de l'ATP par les enzymes adénylyl-cyclases, et dégradé par les phosphodiestérases en 5'AMP.
1.6.1 Adénylyl-cyclase
On connait deux types d'adénylyl-cyclases : les transmembranaires, les plus communes, et les solubles. Chez les mammifères, dix types d’adénylyls-cyclases sont connus, nommés de AC1 à AC10.
1.6.1.1 Transmembranaire
Ces enzymes sont des protéines intégrales à douze domaines transmembranaires. Leur activité est régulée par les protéines G hétérotrimériques et peut être activée par la forskoline. On retrouve notamment l’adénylate-cyclase 3 (AC3) dans la tête du spermatozoïde (Livera et al. 2005). Ce type d'adénylyl-cyclase participe au stock d'AMPc en plus faibles proportions (Ricart et al. 2015). On sait que l'EPAC est située dans la tête du spermatozoïde, du moins chez l'Homme. L'EPAC étant impliquée dans la réaction acrosomale, l'AMPc produit par les adénylyl-cyclases transmembranaires pourrait servir à la réaction d'acrosome (Wertheimer et al. 2013).
1.6.1.2 Soluble (soluble Adenylyl-CYclase, SACY ou AC10)
C'est l'adénylyl-cyclase la plus retrouvée dans le spermatozoïde, puisqu'on estime que plus de 90% de l'AMPc formé l'est par SACY. Cette forme d'adénylyl-cyclase est activée par les ions calcium et bicarbonate qui entrent dans le spermatozoïde lors de la capacitation (Marquez and Suarez 2008). La SACY, malgré son nom, ne semble pas "flotter" dans le cytoplasme, mais plutôt être liée au flagelle. Une telle localisation permettrait de produire de l'AMPc de manière très localisée, proche de son effecteur principal qu'est la PKA (Wertheimer et al. 2013).
12
L'EPAC, ou Exchange protein directly activated by cAMP, est une protéine échangeuse de nucléotides cycliques pour la petite GTPase Rap1. Elle stimule l'échange du GDP vers du GTP pour Rap1, en amont de la phospholipase C (Branham et al. 2009). La PLC va ensuite produire de l'IP3 qui va se lier à son récepteur IP3R présent sur la membrane des réserves intracellulaires de calcium, ce qui va libérer du calcium présent dans ces réserves, et la réaction d'acrosome va pouvoir se produire (voir partie 1.4). EPAC 1 a été montrée dans le spermatozoïde éjaculé humain (Branham et al. 2006), équin (Branham et al. 2006) et porcin (Miro-Moran et al. 2012). EPAC 2 a été montrée dans le spermatozoïde éjaculé équin (Branham et al. 2006) et porcin (Miro-Moran et al. 2012).
1.8 CNGC
Les Cyclic-Nucleotides Gated Channel, ou CNGC, sont des canaux ioniques présents dans la membrane plasmique des spermatozoïdes. Comme leur nom l’indique, ils sont activés par les nucléotides cycliques, et surtout le GMPc (Kraus-Friedmann 2000). Ils ont d'abord été découverts chez l'oursin, où ces canaux peuvent être activés pour stimuler la production de GMPc et augmenter la concentration en calcium. Chez les mammifères, les canaux CGNC semblent être sensibles et spécifiques au calcium. Ils pourraient être impliqués dans l'augmentation des concentrations en calcium via l'augmentation des concentrations en GMPc, et ainsi intervenir dans le contrôle de la motilité, la chimiotaxie, ou la réaction acrosomale, mais ceci reste sujet à caution (Kaupp and Seifert 2002).
1.9 PKA
La Protéine Kinase A, ou PKA est une sérine-thréonine kinase, acteur majeur de la capacitation dans le spermatozoïde. C'est en effet le principal effecteur de l'AMPc produit durant la capacitation. Cet AMPc va activer la PKA qui va ensuite aller phosphoryler de nombreux substrats sur des résidus sérine et/ou thréonine.
La PKA est composée de quatre unités : deux unités catalytiques (C) et deux sous-unités régulatrices (R). A l'état inactif, les deux sous-sous-unités C sont liées aux deux R. Lorsque l'AMPc est présent en concentrations suffisantes, il vient se fixer aux sous-unités R (deux par sous-unité) et les détachent des deux C qui peuvent aller phosphoryler sur des résidus sérines et/ou thréonines en présence d'ATP (Gupta 2005). L'activation de PKA est un phénomène relativement rapide puisque cette activation prend environ 90 secondes à être effective après l'initiation de la production d'AMPc par la SACY après activation par des ions HCO3-.
Parallèlement, la phosphorylation sur tyrosine est un événement beaucoup plus lent, pouvant prendre jusqu'à une heure (Visconti 2009).
Il existe deux types de sous-unités R : RI et RII, donnant respectivement lieu à la PKA I et la PKA II. Les deux types de PKA sont présents dans le spermatozoïde, mais pas à la même localisation (RI dans la tête, RII dans le flagelle), ce qui suggère des rôles différents pour ces
13
deux types de PKA (Gupta 2005). Pour ce qui est de la sous-unité C, il en existerait quatre isoformes : Cα, Cβ Cs et Cγ. Cα2 semble spécifique au spermatozoïde et joue un rôle important dans la production d'AMPc par la SACY et l'entrée de calcium par CatSper (Nolan et al. 2004).
Les sous-unités régulatrices peuvent se lier à des protéines d'ancrage, les AKAP (A-Kinase Anchorage Protein), pour une régulation spatiale des PKA et une activation très locale. Les AKAP se lient aussi d'autres protéines comme des PDE (Stangherlin and Zaccolo 2011), des phosphatases, d'autres kinases comme les MAPK, ou des protéines possédant un domaine d'homologie avec RII (domaine R2D2) (Fiedler et al. 2008).
Dans les spermatozoïdes, la présence des AKAP1, 3 et 4, 8, 11, et 12 a notamment été montrée (Hillman et al. 2013). Les AKAP3 et 4 sont spécifiques au spermatozoïde. On retrouve AKAP4 dans le flagelle, comme protéine principale du manchon fibreux (Eddy et al. 2003), et AKAP3, localisée dans la pièce principale du spermatozoïde bovin (Bajpai et al. 2006) a un rôle à jouer dans la capacitation (Hillman et al. 2013). Il a été montré récemment que la PDE4, présente en grande quantité dans le spermatozoïde, pouvait se lier à AKAP 3 (Bajpai et al. 2006).
1.9.1 Action en aval
La PKA est nécessaire au processus de capacitation dans le spermatozoïde. Elle est l’effecteur de l'action de la PI3K (Breitbart et al. 2010) et de la PLD (Breitbart et al. 2006), et module l'action de canaux calciques comme CatSper (Wennemuth 2003). Une inhibition de la PKA inhibe la phosphorylation sur tyrosine, marqueur de la capacitation (Visconti et al. 1995). Cette phosphorylation sur tyrosine n'est pas directement obtenue par PKA, qui est une sérine-thréonine kinase, mais par une cascade de phosphorylation dont certains maillons sont encore inconnus. On pense par exemple que des tyrosines de la famille Src (SFK) sont impliquées (Baker et al. 2006; Lawson et al. 2008). L'activation de la PKA durant la capacitation mène également à une polymérisation de l'actine F, nécessaire à l'hyperactivation de la motilité et dépolymérisée juste avant la réaction d'acrosome.
La PKA joue aussi un rôle dans la réaction d'acrosome. En effet, la liaison du spermatozoïde à la ZP cause une augmentation de l’activité PKA et de la PKC. Cette activation de PKA cause une ouverture de canaux calciques, ce qui participe à l'augmentation du calcium intracytoplasmique, à la dépolymérisation de l'actine, et donc au déclenchement de la fusion entre la membrane externe de l'acrosome et la membrane plasmique (Breitbart 2002). 1.10 Les Phosphodiéstérases
Les PhosphoDiEstérases (PDE) sont des enzymes capables de dégrader les nucléotides cycliques (AMPc et GMPc) en leurs nucléotides monophosphate respectifs (5'AMP et 5'GMP), en hydrolysant le lien phosphodiester (Richter et al. 1999). L'histoire de ces
14
enzymes commence en 1886, avec Henry Hyde Salter, un scientifique travaillant sur l'asthme, et lui-même asthmatique, qui avait noté qu'en buvant une tasse de café à jeun, sa condition respiratoire s'améliorait. Si on pensait à l'époque que cela était dû à l'effet bronchodilatateur de la caféine, on sait désormais que cela s'explique en réalité par le faible pouvoir inhibiteur de la caféine sur les phosphodiestérases (Salter 1864; Boswell-Smith et al. 2006).
On connait actuellement onze familles de PDE (Figure 1-5), qui diffèrent par leurs extrémités N-terminales (Soderling and Beavo 2000). L'extrémité C-terminale est, elle, conservée entre les familles et contient le domaine catalytique. Ces PDE possèdent des affinités différentes pour les nucléotides cycliques, certaines étant capables d'hydrolyser uniquement l'AMPc (PDE 4, 7 et 8), ou bien le GMPc (PDE 5, 6 et 9), ou les deux (PDE 1, 2, 3, 10, 11) (Baxendale and Fraser 2005; Francis et al. 2011a). Les PDE présentes dans les spermatozoïdes semblent être impliquées dans le maintien des concentrations en nucléotides cycliques, la capacitation, la motilité ou encore la réaction acrosomale (Gearon et al. 1994; Jaiswal and Majumder 1996; Leclerc et al. 1996). On reconnait par exemple l’effet des inhibiteurs spécifiques de PDE1 (8-methoxy-isobutylmethylxanthine) et PDE4 (RS-25344, Rolipram) sur le déclenchement de la réaction d’acrosome et la motilité, respectivement (Fisch et al. 1998). Cette étude a aussi pu montrer que ces deux PDE étaient situées dans deux compartiments spermatiques différents.
Si presque tous les transcrits des 11 familles de PDE ont été retrouvés par PCR dans les spermatozoïdes de mammifères, quelques protéines ont été détectées immunologiquement, comme les PDE 1, 3, 4, 6, 8 et 11 (Fisch et al. 1998; Lefièvre et al. 2002; Fournier et al. 2003; Baxendale and Fraser 2005; Beavo et al. 2006). La présence de la protéine PDE10 a été montrée par immunohistochimie dans les spermatozoïdes éjaculés de certaines espèces comme le chien ou la souris (Coskran et al. 2006).
Différents inhibiteurs de phosphodiestérases sont utilisés pour étudier l'effet de ces enzymes. Quelques exemples sont listés au Tableau 1-1 ci-dessous.
15 Tableau 1-1 : Quelques inhibiteurs de PDE.
IBMX : 3-isobutyl-1-methylxanthine ; IC50 : concentration inhibitrice 50%.
Inhibiteur Cible IC50 Référence
IBMX Toutes sauf PDE8 et
PDE9 2-50µM (Beavo et al. 2006) (Soderling and Beavo 2000)
Rolipram PDE4 PDE4A = 3 nM,
PDE4B = 130 nM, PDE4D = 240 nM
(Beghè et al. 2013) (Omori and Kotera 2007)
(Baxendale and Fraser 2005) (Group and Buildings 2000)
Milrinone PDE3 2 µM (Cone et al. 1999)
MP10 PDE10 0,18 nM (Albert and Wood
2012)
Figure 1-5 : Les différentes familles de PDE.
On peut voir que le domaine catalytique en C-terminal est conservé entre les différentes familles de PDE. En revanche, l'extrémité C-terminale varie d'une famille à l'autre, lui apportant sa spécificité. Tirée de (Maurice et al. 2014).
La protéine PDE10 est une des phosphodiestérases les plus récemment découverte. Elle a été observée simultanément par trois groupes en 1999 (Fujishige et al. 1999; Loughney et al. 1999; Soderling et al. 1999). Elle est surtout exprimée dans le cerveau (striatum), où elle a été bien étudiée car elle serait impliquée dans certaines pathologies neurologiques ; mais aussi dans le testicule. Cette protéine est codée par le gène PDE10A, situé sur le chromosome 9 bovin (NCBI 2016a) et 6 humain (NCBI 2016b). Même si elle est encodée par un seul gène, elle donne lieu à plusieurs variants d'épissage (Yuasa et al. 2001).
16
Chez le bovin, en date du 8 août 2016, on prédit cinq variants d'ARN (Figure 1-6), nommés de X1 à X5. Ils codent pour quatre isoformes protéiques nommées de X1 à X4. Les variants X2 et X3 codent tous les deux pour l'isoforme X2. Les isoformes protéiques diffèrent en N-terminales, sauf X2 et X3 qui ont une extrémité N-terminale identique. L'isoforme X2 possède seize acides aminés de plus, un peu plus loin dans la séquence (NCBI 2016a).
Figure 1-6 : Alignement de l'extrémité N-terminale des isoformes protéiques prédites de PDE10 chez le bovin, ainsi que la correspondance des noms des variants d'ARN.
Les séquences de cinq variants d'ARN prédites codent pour quatre isoformes protéiques. On remarque que les variants X2 et X3 codent tous les deux pour l'isoforme protéique X2. Les isoformes protéiques X2 et X3 diffèrent par un "gap" de six acides aminés plus loin dans la séquence de X3.
Chez l'humain, en date du 8 août 2016, trois variants d'épissage sont connus : PDE10A1, PDE10A2 et PDE10A19. PDE10A1 possède un site de phosphorylation pour la kinase PKA en N-terminal, contrairement à PDE10A2, d'après la nouvelle nomenclature, alors qu'il s'agissait du contraire auparavant (Kotera et al. 1999). PDE10A19 a été récemment découverte et est supposée être une forme tronquée de PDE10, interagissant avec PDE10A2 dans le striatum des primates (MacMullen et al. 2016). On suppose aussi la présence de six autres isoformes protéiques (X1, X4, X5, X6, X7, X8), mais ce ne sont que des séquences prédites par des algorithmes (NCBI 2016b).
La protéine PDE10 a été détectée dans les spermatozoïdes épididymaires de certaines espèces comme le chien ou la souris (Coskran et al. 2006). On ne sait cependant pas quelles sont les isoformes présentes, ni si la protéine est présente dans le spermatozoïde éjaculé.
1.10.1.1 Structure de PDE10 – différents domaines
La protéine PDE10A possède son domaine catalytique à l'extrémité C-terminale conservée avec les autres familles de PDE. Plus en amont, elle possède deux domaines GAF (cGMP-specific phosphodiesterases, adenylyl cyclases and FhlA), GAF A et GAF B (Figure 1-7). Comme on l'a mentionné précédemment, chez l'humain, le variant d'épissage PDE10A2 possède un site de phosphorylation pour la kinase PKA en N-terminal qui n'a pas été observé chez PDE10A1 (Kotera et al. 1999; Charych et al. 2010). On ne retrouve pas ce site de phosphorylation chez le bovin pour le moment, d’après les logiciels de prédiction de sites de phosphorylation (GPS).
17 Figure 1-7 : PDE10 et ses différents domaines fonctionnels.
On retrouve le domaine catalytique en C-terminal, conservé entre les différentes familles de PDE, deux domaines GAF régulateurs : GAF A et GAF B, qui peut lier l'AMPc et potentiellement stimuler l'activité catalytique de PDE10. En N-terminal, un site de phosphorylation PKA putatif a été marqué. Il a été retrouvé chez certaines espèces comme la souris, le chien ou l'Homme, sur certaines isoformes. Adapté de (Maurice et al. 2014).
1.10.1.2 Mécanismes d’action de PDE10 1.10.1.2.1 Spécificité
Si PDE10 a une plus grande affinité pour l'AMPc (Km AMPc = 0,26 µM et Km GMPc = 7,2
µM) (Kotera et al. 1999), elle a cependant une Vmax 2 à 5 fois moins importante pour l'AMPc
que pour le GMPc (Jäger et al. 2012). En construisant des chimères du tandem GAF de PDE10 et de cyclases bactériennes, (Gross-Langenhoff et al. 2006) ont montré que l'AMPc était un ligand des domaines GAF de PDE10 et que l'activité catalytique de PDE10 était stimulée par la liaison de l'AMPc sur le domaine GAF B de la protéine. Cette information a été confirmée (Jäger et al. 2012) et montre une activation d'au moins trois fois le niveau basal. 1.10.1.2.2 Régulation
En dehors d'une potentielle régulation par la liaison de l'AMPc sur le domaine GAF B de PDE10, on a vu que certaines isoformes possédaient un domaine de phosphorylation par PKA.
Cela a été vérifié sur PDE10A2, variant d'épissage de PDE10 présent notamment chez la souris et chez l'humain (Kotera et al. 1999). Dans le striatum de souris, la phosphorylation de la thréonine 16 contrôle la migration de PDE10A2 de la membrane au cytosol par ajout d'un groupement palmitate sur le résidu cystéine 11 (Charych et al. 2010). Une phosphorylation de PDE10A2 par la PKA est aussi responsable d'un détachement de l'enzyme d'un complexe notamment formé par AKAP150 (AKAP5) dans le striatum de souris (Russwurm et al. 2015).
Depuis 2016, le variant PDE10A2 a été renommé PDE10A1 et le variant précédemment nommé PDE10A1 est maintenant nommé PDEA2 (NCBI 2016b).
Contrairement à PDE1, l’activité de la PDE10A ne semble pas régulée par le calcium (Goraya and Cooper 2005). Une régulation de son activité par le pH n'a pas encore été montrée dans la littérature.
18 1.10.1.3 Inhibiteurs de PDE10A
PDE10A est sensible à l'IBMX, un inhibiteur général des PDE (sauf PDE8 et PDE9) (Soderling and Beavo 2000). Plusieurs inhibiteurs spécifiques de PDE10 ont été développés au cours des dernières années. Les caractéristiques de quelques-uns d'entre eux sont résumées dans le
Tableau 1-2.
Tableau 1-2 : Quelques inhibiteurs de PDE10.
IBMX : 3-isobutyl-1-methylxanthine ; IC50 : concentration inhibitrice médiane.
Inhibiteur PDE10 IC50 Remarque Références
IBMX 3 µM Inhibiteur non spécifique des
PDE (sauf la 8 et la 9) (Hatzelmann et al. 1995) (Francis et al. 2011b) Papavérine 40 nM Premier à être découvert.
9x plus que les autres PDE (Chappie et al. 2012) MP10 0,18 nM >1000x sélectif contre les autres
PDE (Schmidt et al. 2008)
TP10 0,3 nM >3000x sélectif contre les autres
19 1.11 Problématique, hypothèses et objectifs 1.11.1 Problématique et hypothèses
La capacitation est une étape de maturation très importante pour le spermatozoïde, durant laquelle ce dernier acquiert son pouvoir fécondant. Comme décrit plus haut, une des premières étapes de la capacitation est une augmentation de la concentration de l'AMPc intracellulaire, formé par les adénylyl-cyclases. Cet AMPc est un élément central de la capacitation puisqu'il est impliqué dans le contrôle de la motilité, la suite de la capacitation avec l'activation de la PKA, et la réaction d'acrosome.
En termes de reproduction, le taureau et l’Homme partagent des similitudes intéressantes, notamment d’un point de vue de l’anatomie du spermatozoïde, mais aussi des étapes de capacitation et de réaction d’acrosome. De plus, de par son volume d’éjaculation (environ 7,8 ml, 1,5 M spermatozoïdes/ml) important (Kirton et al. 1964) et par la grande qualité de sa semence, le taureau est un modèle très intéressant pour étudier la physiologie spermatique. Pour les expériences traitées aux chapitres 2 et 3, la PDE10 est étudiée chez le spermatozoïde bovin. Un rapide survol de la situation chez l'humain est fait au chapitre 4.
Si l’on sait que PDE10 est exprimée dans le testicule, et les spermatozoïdes épididymaires chez le chien ou la souris,on ne sait cependant pas quelles sont les isoformes présentes, ni si la protéine PDE10 est retrouvée dans le spermatozoïde éjaculé.
Ma première hypothèse est que la protéine PDE10 est exprimée dans le spermatozoïde éjaculé chez le taureau. Comme beaucoup de PDE, je pense que PDE10 est une protéine présente dans le compartiment cytosolique. Cette hypothèse sera adressée au chapitre 2. En considérant que PDE10 est exprimée dans le spermatozoïde éjaculé, comme l'on observe une augmentation des concentrations en AMPc durant la capacitation et que PDE10 dégrade l'AMPc, mon hypothèse est que l'augmentation de cette concentration pourrait être due à un changement dans l'activité enzymatique de PDE10, ou dans sa localisation ou ses interactions protéiques. Je répondrai à cette hypothèse au chapitre 3.
Une des conséquences de l'augmentation des concentrations d'AMPc durant la capacitation est l'hyperactivation des mouvements du flagelle. PDE10 régulant les concentrations d'AMPc, je pense qu'elle pourrait être impliquée dans le contrôle de la motilité spermatique, de la même manière que PDE4. A défaut d'avoir un rôle dans la motilité, PDE10 pourrait être impliquée dans la réaction d'acrosome, comme le sont certaines PDE tel que PDE1. Ces questions seront étudiées au chapitre 3.
Parce que PDE10 a été grandement étudiée dans le striatum de souris, certains éléments de sa régulation sont connus ; on sait notamment que la protéine peut changer de compartiment cellulaire grâce à une phosphorylation par PKA et une palmitoylation, en fonction de la concentration en AMPc. La phosphorylation par PKA permet également de réguler les interactions cellulaires de PDE10. J’estime que des mécanismes similaires pourraient être retrouvés dans le spermatozoïde. J’en discuterai au chapitre 3.
Enfin, au vu de la présence de la protéine PDE10 dans le spermatozoïde, et au vu des ressemblances qui existent entre le spermatozoïde bovin et humain, j’estime que la protéine
20
PDE10 pourrait être présente dans le spermatozoïde humain éjaculé, et qu'une isoforme proche de celle exprimée chez le taureau pourrait être retrouvée. J’éluciderai ce point au chapitre 4.
1.11.2 Objectifs
Pour répondre à ces hypothèses, j’ai posé des objectifs plus concrets pour organiser mon travail.
Dans un premier temps, je chercherai la présence de PDE10 dans le testicule ainsi que dans différentes cellules de la lignée germinale chez le taureau par des expériences de PCR 3' et 5' RACE. Grâce à des immunohistochimies, la protéine PDE10 sera localisée dans le testicule, puis la présence de la présence de la protéine PDE10 dans le spermatozoïde éjaculé sera vérifiée par western blot. Pour compléter la caractérisation de PDE10 dans le spermatozoïde bovin, je déterminerai par immunoprécipitation et spectrométrie de masse quelle(s) isoforme(s) est (sont) présente(s).
Par la suite, grâce à des expériences de fractionnement cellulaire par cavitation, d'immunofluorescence et de microscopie électronique, je localiserai la protéine dans le spermatozoïde éjaculé. Des spermatozoïdes cryoconservés seront séparés en deux populations de qualité différentes, puis les acrosomes de ces deux populations seront marqués pour déterminer l’état acrosomal relatif à la qualité spermatique. En parallèle, la quantité de PDE10 retrouvée dans chacune de ces populations sera mesurée pour mettre en relation l'association entre PDE10 et l'acrosome.
Une fois la localisation de PDE10 précisée dans le spermatozoïde bovin, je m’intéresserai à son rôle. Je vérifierai son impact sur différents paramètres de motilité dans le spermatozoïde fraichement éjaculé ou cryopréservé par des mesures au CASA (Computer Assisted Sperm Analysis).
Comme la capacitation est un préalable à la réaction d'acrosome, j’observerai la capacité des spermatozoïdes à achever leur réaction d'acrosome dans différentes situations d'inhibition de PDE10 dans le but d’identifier le rôle global de la protéine sur le déroulement de la capacitation. L’état acrosomal sera observé par marquage de l'acrosome.
Je tenterai ensuite de comprendre la régulation de la localisation et de l’activité de la protéine en faisant des parallèles avec la situation de PDE10 dans le striatum. La phosphorylation de PDE10 par PKA sera recherchée par immunoprécipitation de PDE10, ou des protéines phosphorylées par PKA. Des immunoprécipitations de PDE10 en présence de PKA exogène seront aussi tentées.
21
De même, je chercherai à déterminer si la protéine peut subir une palmitoylation par le protocole ABE (Acyl-Biotin Exchange).
Enfin, j’observerai l'appartenance de PDE10 à des complexes protéiques par une fixation des spermatozoïdes fraîchement éjaculés puis une solubilisation avant de les déposer sur un gel d'acrylamide.
Pour ce qui est de l'activité enzymatique de PDE10, elle sera mesurée après immunoprécipitation chez de spermatozoïdes incubés en conditions capacitantes ou non.
22
2. Chapitre 2 : Identification and Localization of the Cyclic Nucleotide Phosphodiesterase 10A in Bovine Testis and Mature Spermatozoa.
Cette section du mémoire est présentée sous la forme d'un article publié le 22 Août 2016 dans la revue "Plos One".
Authors: Serge Goupil1,3,5, Loïze Maréchal1,3,5, Hassan El Hajj4,5, Marie-Ève Tremblay4,5,
François J. Richard2,3, Pierre Leclerc1,3,5,*
1Département d’obstétrique, gynécologie et reproduction, 2Département des sciences
animales, 3Centre de recherche en reproduction, développement et santé intergénérationnelle
(CRDSI), 4Département de médecine moléculaire, Université Laval, and 5Centre de
recherche du CHU de Québec-Université Laval, G1V 4G2, Québec, QC, Canada
*Corresponding author:
E-mail: pierre.leclerc@crchudequebec.ulaval.ca (PL)
2.1 Abstract
In mammals, adenosine 3’, 5’-cyclic monophosphate (cAMP) is known to play highly important roles in sperm motility and acrosomal exocytosis. It is known to act through protein phosphorylation via PRKA and through the activation of guanine nucleotide exchange factors like EPAC. Sperm intracellular cAMP levels depend on the activity of adenylyl cyclases, mostly SACY, though transmembrane-containing adenylyl cyclases are also present, and on the activity of cyclic nucleotide phosphodiesterases (PDE) whose role is to degrade cAMP into 5’-AMP. The PDE superfamily is subdivided into 11 families (PDE1 to 11), which act on either cAMP or cGMP, or on both cAMP and cGMP although with different enzymatic properties. PDE10, which is more effective on cAMP than cGMP, has been known for almost 15 years and is mostly studied in the brain where it is associated with neurological disorders. Although a high level of PDE10A gene expression is observed in the testis, information on the identity of the isoforms or on the cell type that express the PDE10 protein is lacking. The objective of this study was to identify the PDE10A isoforms expressed in the testis and germ cells, and to determine the presence and localization of PDE10A in mature spermatozoa. As a sub-objective, since PDE10A transcript variants were reported strictly