W
LftLL
lf?£
L SIC
THESE PRESENTEEA L'ECOLE DES GRADUES DE L'UNIVERSITE LAVAL
POUR L'OBTENTION
DU GRADE DE MAITRE ES SCIENCES (M.Sc.)
PAR
JEAN-MARC LE GOFF
INGENIEUR
DE L'ECOLE CENTRALE DES ARTS ET MANUFACTURES DE PARIS
CONTENU ET METABOLISME DES C-19 A5-STEROIDES DANS LES TUMEURS MAMMAIRES SHIONOGI (ANDROGENO-DEPENDANTES OU -INDEPENDANTES) :
HYPOTHESE D'ADAPTATION ENZYMATIQUE
DE CANCERS HORMONO-REGULES LORS DE LA CASTRATION
>'r . ).
DANS LES TUMEURS MAMMAIRES SHIONOGI (ANDROGENO-DEPENDANTES OU -INDEPENDANTES) :
HYPOTHESE D'ADAPTATION ENZYMATIQUE
DE CANCERS HORMONO-REGULES LORS DE LA CASTRATION
JEAN-MARC LE GOFF
Laboratoire d* Endocrinologie Moléculaire Le Centre Hospitalier de 11 Université Laval
e t
Département de Physiologie Faculté de Médecine
RESUME
Nous avons étudié la mêtabolisation des C-19 stéroïdes tritiês: androstenedione (A^-dione), déhydroépiandrostérone (DHEA) et androst-5-ene-3g,17g-diol (A^-diol) lors d’une incubation de 3 heures à 37°C avec des homogênats de tumeurs mammaires murines
Shionogi androgêno-dépendantes et androgêno-indêpendantes. L’ana lyse et la mesure des métabolites par chromatographie sur colonnes de Séphadex LH-20 puis chromatographie sur couche mince avec gel de silice a prouvé l’existence dans les 2 types de tumeurs d’enzy mes (170-dëhydrogênase, 3g-déhydrogënase A5,A^-isomêrase et 5a-ré- ductase) qui assurent la conversion des androgènes surrénaliens en androgènes actifs, principalement T (testostérone) et A (androsté- rone) à partir du A^-dione, 3o-diol (androstane-3u,170-diol) à
partir du A5-diol, androstêrone à partir du DHEA. Les tumeurs indépendantes présentaient une activité 5a-réductase significati vement plus élevée (p < 0.01) que les tumeurs dépendantes alors que ces dernières seulement ont conduit à la formation de produits identifiés comme catêcholestrogènes, à partir du A5-diol presque exclusivement.
Par ailleurs, nous avons mesuré par radioimmunoëtalonnage les niveaux plasmatiques de P (progestérone), DHEA, A5-diol, A4, T, DHT (dihydrotestostêrone), 3a-diol, 3g-diol (androstaene-3g,17g- diol) chez des souris mâles DD/Sio intactes ou castrées et dans des tumeurs qui se sont développées chez des animaux intacts et castrés, à la suite de l'inoculation de 10G cellules de la même tumeur androgéno-dêpendante Shionogi SC 115. Il est apparu que si 2 jours après castration, la testostérone et le A^-dione avaient pratiquement disparu de la circulation, des précurseurs (A5-diol) ou des androgènes puissamment actifs (DHT, 3a-diol) y étaient encore présents (plus de 30%). De plus, alors que les concentra tions tumorales de testostérone et de A^-dione étaient réduites de plus de 90% chez les castrés, celles du A5-diol ne l'étaient que de 70%, celle du DHEA que de 30%. Les concentrations de 3a-diol et de DHT chez les castrés (60% et 7% des concentrations mesurées chez les normaux) étaient suffisantes pour induire une réponse androgénique dans ces tumeurs. De fortes corrélations enfin ont
été trouvé liens et d p < 0.001, Ces rés dans cette un milieu adaptation mes qui co riques (C- gènes acti
es dans ce s mêmes tumeurs entre des précurseurs surréna- es androgènes actifs (DHEA et 3a-diol, r ■ 0.97,
par exemple).
ultats viennent étayer une hypothèse que nous proposons thèse d'adaptation de tumeurs androgêno-dépendantes à "privatif” dépourvu d'androgènes testiculaires. Cette
consisterait en un démasquage ou une activation d'enzy- nvertissent in situ des précurseurs stéroïdiens périphê- 19 stéroïdes surrénaliens en particulier) en des andro- f s.
AVANT-PROPOS
Lors du partage des langues qui eut lieu, si l'on en croit la Bible, à Babel, le monde de l'édition scientifique hérita essen
tiellement de l'anglais alors que l'Ecole des Gradués de l'Univer sité Laval héritait du français, qui est aussi ma langue maternel le.
C'est pourquoi les résultats présentés dans cette thèse qui ont été soumis pour publication dans différents périodiques sont pré sentés sous formes d'articles rédigés dans leur langue d'édition, soit l'anglais. Ils sont complets en eux—êmes et comprennent une introduction, une description de la méthode expérimentale, une présentation des résultats, une discussion et une bibliographie propre au texte. Par ailleurs, un résumé de ces résultats est
s ainsi qu'une introduction générale qui situe le flque dans lequel le sujet vient s'inscrire, de tre qui précise l'hypothèse sur laquelle nous
Les références relatives aux textes rédigés en la fin de ce manuscrit, dans la partie réservée è donné en françai
contexte scient! même qu'un chapi avons travaillé, français sont à cet usage.
REMERCIEMENTS
Mes remerciements s'adressent, pour commencer, à mon directeur de thèse, le Dr Alain Bélanger. Sa disponibilité, sa compétence, son humour sont autant de qualités que j'ai pu apprécier chez lui et qui m'ont enco uragé à effectuer cette thèse loin des miens.
Je tiens aussi à remercier tout particulièr ement le docteur Fernan d Labrie d' avoir bien voulu m'accueillir dans son laboratoi re et de m'avoir donné toutes les facilités pour mener à bien cette thèse, tant sur le plan technique que sur le plan pécuniai re. Son ouverture d'esprit, ses capacités de synthèse et son dyna misme peu communs m'ont favorablement impressionné et devraient
lui permettre d'atteindre, je le souhaite, le but qu'il poursuit.
Je tiens à remercier aussi Monsieur Jean-Pierre Raynaud, de Roussel-UCLAF, France, sans qui cet échange n'aurait jamais eu lieu et à lui exprimer toute ma reconnaissance pour l'appui qu'il continue de m'apporter ainsi que son assistante Mademoiselle
0jasoo.
Je remercie très chaleureusement Monsieur Simon Caron pour l'aide précieuse et les conseils judicieux qu'il a su m'apporter tout au long de mes expérimentations. Je ne vanterai jamais assez sa compétence technique et sa disponibilité.
J'exprime toute ma gratitude à Madame Elaine Leclerc qui m'a permis de réaliser promptement et efficacement ce manuscrit.
Je suis reconnaissant envers Mesdames Dorothée Mathieu, Rodrigue et Karen Horth pour les nombreux services qu'elle rendus.
Merci à Daniel, Martin, Françoise, Marie-Luce, José et de m'avoir si efficacement encouragé tout au long de cette
Merci enfin et surtout à Lydia Kerkerian d'avoir montré l'esprit cartésien que je suis ce que l'intuition de la re peut être. C'est à elle que je dédie cette thèse avec tout admiration et tout mon amour.
Hélène s m'ont Jocelyne thèse. à cherche e mon
TABLE DES MATIERES
Page
RESUME ... II AVANT-PROPOS... IV REMERCIEMENTS... V TABLE DES MATIERES... VII ABREVIATIONS... IX
CHAPITRE I. INTRODUCTION
1-1. Les hormones stéroïdes ... 1
1-2 . Cancers et dépendance hormonale... ... 3
1-3. Les traitements hormonaux . ... 6
I- 4 . L ' échappement... 10
1-4.a. La sélection de populations . . ... 10
1-4.b. Actions des androgènes surrénaliens... 11
CHAPITRE II. HYPOTHESE DE TRAVAIL ET TRAVAUX EFFECTUES.. 13
II- l Le modèle animal... 13
I1-2 Quelques résultats intrigants obtenus avec SC115... 14
II-3 Activité paraendocrine du sein et de la prostate... 14
II-4 L'hypothèse de travail: une adaptation des cellules tumorales androgêno-dêpendantes à un milieu "priva tif" comparable à celle rencontrée chez E. coli avec l’opéron tryptophane... ... 16
CHAPITRE III. ETUDE COMPAREE DU METABOLISME DES C-19 STEROÏDES TRITIES DHEA, A4-DIONE, As-DIOL PAR DES TUMEURS MAMMAIRES SHIONOGI ANDRO-
GENO-SENS IBLES ET ANDROGENO-INSENSIBLES... 19
CHAPITRE IV. ETUDE DE LA CROISSANCE D'UNE LIGNEE SC115 ANDROGENO-DEPENDANTE CHEZ DES SOURIS MALES ET DES SOURIS MALES CASTREES (DD/SIO) AINSI QUE DU CONTENU HORMONAL DES TUMEURS
OBTENUES. MESURE DES NIVEAUX PLASMATIQUES DE CES MEMES STEROÏDES CHEZ DES SOURIS MALES
ET DES SOURIS MALES CASTRES (DD/SIO)... 31
CHAPITRE V. RESUME ET CONCLUSION... 50
ABREVIATIONS Hormones et prod A^-dione A 5-diol DHEA T DHT A 3a—diol E2 FSH LH LHRH its Androstènédlone (4-androsten-3,17- Andros t-5-ene-3S,17 B-diol
(5-androstene-3B,17 g-diol) Déhydroépiandrostérone (3B-hydroxy-5-andro s tene-17-one) Testostérone (17 B-hydroxy-4-androstene-3-one) Dihydrotestostêrone (17 B-hydroxy-5a-androstane-3-one) Androstérone (3a-hydroxy-5a-androstane-17-one) Androstane-3a,17B~diol Estradiol (1-3-5 (10) estratriene-3,17B-diol) Hormone folliculo-stimulante Hormone "lutéinisante
Hormone hypothalamique libératrice
I.1 Les hormones stéroïdes
Ce sont des composés de faible poids moléculaire (250 à 350 kDa) qui dérivent du cholestérol.
Le noyau cyclopentanoperhydrophênanthrène (Fig. 1) constitue leur squelette, une caractéristique qu'elles partagent avec le cholestérol et la vitamine D.
/3
CH3
H
a
Fig. 1. Noyau cyclopentanoperhydrophênanthrène.
La conversion du cholestérol en hormones stéroïdes met en jeu de nombreuses enzymes (Table 1) et conduit à des produits très divers dont les activités physiologiques sont variables (minéralocorti coïdes, glucocorticoïdes, androgènes, estrogènes...).
La production relative - ou la non-production - de stéroïdes finaux dont l'activité physiologique est bien connue (corticostê- rone, cortisol, aldostérone, testostérone, estradiol. . . ) ou d'in termédiaires dont 1’activité physiologique reste encore souvent à étudier, varie avec les organes ou s'effectue la transformation du cholestérol.
PRINGIPAjtESEtpMES IMPLIQUEES DANS LA CONVERSION DU CHOLESTEROL EN HORMONES STEROÏDES
ESTRONE
ANOROSTANS-Jct.tJJKHX.
ANOROSTANE- ifi, 17/KStOt
Ces organes sont essentiellement les gonades (testicules, ovaires) et les corticosurrénales.
Mais d’autres organes comme la peau (1-3), le cerveau (4) ou des cellules comme les érythrocytes (5, 6) contiennent de nombreu ses enzymes capables de transformer activement des produits impli qués dans les voies métaboliques décrites précédemment. On assiste aussi à une tranformation périphérique des produits issus des
gonades ou des surrénales dans des organes cibles tels que la prostate ou le sein (un exemple connu est la conversion de la testostérone en dihydrotestostérone dans la prostate) (7-10).
Les hormones stéroïdes sont connues pour agir à distance, après transport par le sang, sur des organes cibles (prostate, utérus, sein...) , via des récep
laite pl us élevé (100 à 200,000 fiquemen t et vie nnent Int eragir la matri ce nuclê aire ( H) •
Des résultat s réce nt s plaid tion par acrlne d e ces hormones, sur les organes mêmes qui les p tostërone par exemple). (12).
1-2. Cancers et dépendance hormonale
Les cancers apparaissent aujourd’hui comme des maladies géni ques de la différentiation cellulaire.
Différents gènes dont on connaît peu de choses sont impliqués dans cette différentiation et dans son contrôle. Des séquences promotrices ou des "enhancers" influent sur la lecture de ces gènes en ARN messagers qui seront traduits en protéines plus ou moins actives.
Le particularisme de certains organes tels que la prostate, qui sont des organes cibles pour les hormones stéroïdes, est
qu’ils présentent des cellules dont la multiplication est déjà, en temps normal, sous contrôle hormonal, au même titre que les fonc tions de sécrétion ou de synthèse des produits qui entrent dans l’activité fonctionnelle normale de la glande.
C'est ainsi que la castration qui abolit la production de testostérone à 95% conduit chez un patient normal à la cessation des fonctions prostatiques et à une atrophie notable du tissu épithélial de la glande.
En particulier, si l'on considère que ce sont les cellules épithéliales qui semblent impliquées dans le cancer proprement dit de la prostate, les androgènes stimulent en permanence leur divi sion . Le maintien d'une taille normale de la glande serait assuré par des contraintes homéostatiques externes dues à la rupture du collagène dont la production par les fibroblastes est pourtant stimulée en parallèle par les mêmes androgènes, ruptures qu* effec tueraient des enzymes collagênolytiques sécrétées par les cellules épithéliales fonctionnelles (13).
De nombreux types de cancérisations de telles cellules sont envisageables. Les événements suivants ou leur combinaison peuvent conduire à 1 ' apparition d'une cellule dont la multiplication est aberrante (cette liste n'est pas exhaustive):
- Mutation(s) dans un ou plusieurs gènes impliqué nisme de division cellulaire (conduisant par exem tion d'un "facteur de croissance" hyperactif) ou son contrôle (par perte d'un produit de rêgulaton niveau des membranes basales par exemple).
- Mutation dans un promoteur d'un tel gène ou une séquence "enhan cer" qui lui est associée, conduisant à une baisse (voire une perte) ou une augmentation excessive de la lecture de ce gène.
- Introduction (virus par exemple) de séquences promotrices ou
d'"enhancers" actifs près d'un gène cellulaire comme ceux présents dans les LTRs (long terminal repeats) du MMTV (mouse mammary tumor virus) par exemple.
- Introduction par des virus d'oncogènes très semblables à ces gènes à des endroits favorables du génome ou démasquage de tels oncogènes.
s dans le méca- ple à la produc- impliquëes dans
- Pertes de contraintes homéostatiques extérieures à la cellule, ce qui conduit à sa division non réprimée suite à la stimulation hormonale.
Du mécanisme impliqué dans la cancérisation va dépendre la dépendance ou 1’indépendance hormonale du (des) clones cellulaires affectés .
Si l'on admet que les hormones agissent comme des modulateurs sur des mécanismes cellulaires qui existent à un niveau de base dans la cellule vivante, la notion de dépendance et d*indépendance hormonale pourrait s'exprimer de la façon suivante.
L'indépendance hormonale correspondrait à une dissociation complète entre le système de modulation hormonale et le système anciennement modulé. Ce dernier exprimerait alors en permanence un niveau de base indépendant des hormones présentes dans le milieu. Une hypothèse intéressante présentée ces dernières années propose que 1'action des hormones stéroïdes se ferait par 1'interaction d'une structure protéique, "le récepteur", qui une fois activé par la liaison de 1'hormone viendrait interférer avec 1'ADN nucléaire. Cette interaction se ferait au niveau de séquences dites "enhan cers" situées parfois loin des gènes régulés par les hormones et aurait pour conséquence de faciliter l'accès de l'ARN polymérase et la reconnaissance des séquences promotrices où elle s'attache.
L'action du récepteur hormonal activé serait donc de faciliter la transcription du gène modulé. On peut alors envisager des modi fications de la séquence "enhancer" qui maintiendrait en permanen ce le système dans la position "ouverte" où il se trouvait lorsque le récepteur interagissait et ceci maintenant indépendamment de 1'action de ce dernier. De même, une modification du récepteur (mutations dans le ou les gènes qui codent pour sa structure) peut rendre ce dernier actif en permanence qu'il ait lié ou non l'hor mone, ou sans action sur le gène même lorsqu'il lie cette dernière
(ce dernier cas de figure expliquerait pourquoi certains cancers de la prostate ont perdu leur capacité sécrétoire). Ce s cas théo riques montrent que 1'indépendance hormonale totale est possible et doit être envisagée. Heureusement, dans la foule d'événements
susceptibles de conduire à la cancérisation de telles cellules, une forte probabilité existe pour que le système hormonal de modu lation reste actif sur le système de division cellulaire, bien que celui-ci soit maintenant modifié. D'où l'idée de ralentir au maxi mum la croissance de ces tumeurs hormono-sensibles par un traite ment hormonal qui bloque la stimulation hormonale et ramène le système à son niveau de base en permanence. Notons bien, cepen dant, que ce niveau de base peut être anormal dans la cellule cancéreuse et qu'en aucun cas, on ne peut remédier définitivement ainsi aux anomalies géniques qui constituent le cancer lui-même. On voit donc que le but de tout traitement hormonal est d'empêcher l'interaction gène-récepteurs. Il s’agit donc de réduire au
maximum les stéroïdes libres dans la circulation susceptibles d'activer le récepteur (castration médicale ou chimique) et/ou d'utiliser des agents chimiques capables d'empêcher l'activation du récepteur (antiandrogène, antiestrogènes) soit parce qu'ils entrent en compétition avec les stéroïdes actifs au niveau d'un même site, soit parce qu’ils modifient suffisamment le récepteur pour le rendre inactif.
1-3 . Les traitements hormonaux
Le problème rencontré dans le traitement d'un cancer est de toucher les cellules cancéreuses spécifiquement sans affecter les cellules environnantes ni les autres cellules de l'organisme qui doivent garder une division normale. Lorsque le cancer étudié affecte un organe cible des hormones (prostate, sein) toutes les conditions se trouvent requises naturellement pour agir directe ment sur les cellules cancéreuses soit en supprimant les hormones endogènes qui les influençaient spécifiquement, soit en bloquant l'action de ces dernières à l'aide de composés (analogues, agonis tes, antagonistes) qui interagissent spécifiquement avec les
récepteurs présents dans ces cellules.
Dans le cas du cancer de la prostate, diverses thérapies ont été employées pour tenter de bloquer la stimulation exercée par les androgènes. C'est ainsi que dès 1941, Huggins et coll., par tant de l'observation physiologique que tous les types
d'épithé-Hums prostatiques connus chez l'adulte subissent une atrophie quand les androgènes sont réduits fortement ou Inactivés, prati quent les premières castrations chez des sujets atteints de can cers avancés de la prostate. La castration en enlevant les andro gènes testiculaires réduit drastiquement les androgènes connus pour influencer les activités prostatiques (le principal étant la dihydrotestostêrone qui provient essentiellement de la transforma tion dans la prostate même, par l’enzyme 5a-rëductase, de la tes tostérone en circulation, dont 95% est issue en temps normal des testicules). Les indices de la forte diminution de la stimulation hormonale dans un carcinome prostatique (stade D2) suite à la castration, sont une recalcification des lésions ostéoblastiques et une diminution des niveaux de phosphatase acide prostatique (PAP) en circulation (que l'on trouve anormalement élevés dans 75% des stades D2), et ce parfois jusqu'à des niveaux normaux. Cette enzyme est un des principaux produits synthétisés sous contrôle androgénique dans la prostate et est sécrété en temps normal dans le liquide séminal. Lors d'une prolifération maligne, on assiste dans la plupart des cas à la conservation de l'activité de synthè se de cette enzyme par la tumeur mais à sa sécrétion anormale dans le sang. De plus, on a constaté une bonne corrélation entre la modulation hormonale de l'activité de synthèse du PAP et celle de division, comme si la modulation hormonale s'exerçait sur les deux activités simultanément. Autrement dit, la réponse ou la non
réponse à un traitement hormonal (castration ici) d'un cancer prostatique est souvent relié à la diminution ou non de la synthè se de PAP suite à ce même traitement.
Les résultats de Huggins (14-16) se sont avérés encoura geants. Chez 70% des patients, en effet, on a assisté à une
régression momentanée de la tumeur accompagnée le plus souvent par une chute des taux circulants de PAP. Cependant, la castration seule s’est avérée très vite comme une thérapie non universelle et seulement palliative. En effet, on assiste très vite à des phéno mènes d'échappements des tumeurs dont les causes seront discutées dans un prochain paragraphe et les courbes de survie globale des patients castrés ne diffèrent guère de celle des patients non traités.
D'autres thérapies visant à bloquer la production d'androgènes testiculaires ont été essayées en parallèle. Elles reposent essen tiellement sur le contrôle qu'exerce l'hypophyse sur l'activité testiculaire par l'intermédiaire des hormones gonadotropes LH (luteinizing hormone) et FSH (follicular stimulating hormone) et sur le contrôle qu'exerce l'hypothalamus sur la sécrétion de ces hormones hypophysaires par des "releasing factors" dont le princi pal est la LHRH (luteinizing hormone-releasing hormone), lui-même sous rétrocontrôle négatif des hormones testiculaires (testostéro ne) ou ovariennes (estrogènes) (Fig. 2).
C'est ainsi qu'une administration massive chez l'homme d'oes trogènes (estradiol: E2) ou de composés estrogéniques (diethyl- stilbestrol-DES) conduit entre autres à une inhibition de la sécrétion de LH hypophysaire et par suite à une forte diminution de l’activité testiculaire. Le principal inconvénient rencontré dans cette thérapie est une action secondaire marquée des estrogè nes au niveau cardiovasculaire qui contrebalance les effets béné
fiques obtenus (17, 18).
Une approche similaire consiste à effectuer l'ablation de l'hypophyse. Cette opération drastique conduit à des résultats similaires à ceux obtenus avec un traitement aux estrogènes (60 à 70% des patients traités présentent une amélioration objective et/ou subjective de durée variable).
On lui préfère aujourd'hui des traitements avec des agonistes du LHRH qui conduisent à une castration médicale (19, 20). Le mécanisme d'action de ces agonistes semblent être d'induire la
sécrétion au niveau de l'hypophyse d'une LH rendue biologiquement inactive (5% de bioactivité après 1 mois de traitement).
FIGURE 2
PRINCIPAUX CONTROLES EXERCES PAR L’AXE HYPOTHALAMO-HYPOPHYSAIRE SUR L’OVAIRE ET LE TESTICULE
HYPOTHALAMUS
U
PITUITARY
GLAND
OVARY
TESTIS
ESTROGENS
PROGESTINS
ANDROGENS
INHIBIN
1-4.L'échappement
Des études ont montré que si ces thérapies amenaient des amé liorations passagères dans la maladie avec régression ou arrêt momentané des tumeurs, elles étaient globablement sans effet sur
le taux de survie des malades. On assiste en effet à une reprise de la croissance tumorale dans les deux années qui suivent le début du traitement et dans les 6 mois qui suivent la rechute la survie tombe à 50% (21, 22). Deux grands mécanismes sont proposés entre autres pour expliquer cet échappement et beaucoup de travaux restent à faire pour évaluer leur importance relative.
1-4.a. La sélection de populations
Les cancers sont connus pour être des clones cellulaires ori ginaires d'une ou plusieurs cellules mères qui se sont tranfor- mées. L'échappement pourrait provenir de l'existence dans une
tumeur d'un mélange de deux populations, l'une hormono-dépendante, l'autre -indépendante. En temps normal, la stimulation hormonale assume le développement préférentiel de la population dépendante et on peut aller jusqu'à supposer que cette croissance favorisée va jusqu'à réprimer en grande partie la croissance de la popula
tion indépendante. Lors d'un traitement hormonal la sélection s'inverse et conduit à la prédominance, au bout d'un temps de rémission variable, de la population indépendante.
Nous voudrions apporter quelques réflexions personnelles sur la pertinence de l'existence d'un tel mélange de populations dans une tumeur jugée au départ comme hormono-dépendante.
La probabilité pour que des mécanismes aussi divers que ceux présentés aux pages 4 et 5 donnent naissance quasi simultanément à deux cellules mères l’une dépendante l'autre indépendante nous paraît infime. Une tumeur susceptible de répondre à un traitement hormonal est donc très certainement composée à son début d'une population homogène de cellules dépendantes. Lors de la proliféra tion aberrante de ces cellules transformées cependant, on assiste
à une grande Instabilité génomique comme le laisse supposer la forte variabilité des karyopes observés. Il n'est pas impossible que lors de ces réarrangements génomiques un système semblable à ceux décrits aux pages 4 et 5, apparaisse dans une cellule et lui confère un caractère d'indépendance. La probabilité d'un tel évé nement augmentant avec le nombre de divisions, ce sont des tumeurs à un stade avancé de développement qui risquent le plus d'échapper au traitement hormonal à cause de ce mécanisme d'hétérogénéité de population. Ceci coroborre la constatation que les effets du
blocage testiculaire sur la croissance de tumeurs androgêno-dëpen- dantes diminuent lorsque la taille de ces tumeurs augmente (cf.
II-l).
Par contre, lorsque la castration est effectuée à un stade relativement précoce et qu'on assiste à une réponse, nous pensons que la tumeur est composée quasi exclusivement de cellules dépen dantes et que la probabilité de voir apparaître une cellule indé pendante dans une population de cellules en division lente est très faible. En aucun cas, ce mécanisme ne peut rendre compte de la singulière synchronicitê de la reprise de la croissance tumora le observée dans les modèles animaux (cf. II.1). Le mécanisme décrit ci-après nous semble plus apte à expliquer le phénomène dans de tels cas.
1-4.b. Actions des androgènes surrénaliens
Alors qu'on assiste à une réduction de 90 à 95% des niveaux de testostérone circulants suite à une hypophysectomie ou à l'admini stration d'estrogènes ou d'agonistes du LHRH, les niveaux intra- prostatiques de dlhydrostérone (DHT) ne chutent eux que de 55% environ (23, 24) et de fortes concentrations de DHT et de 3a~diol
(5a-androstane-3a,17g-diol) sont détectées dans les carcinomes prostatiques après castration médicale.
La Table 1 (P.2) montre que des androgène de faible activité sont sécrétés en tout temps par les corticosurrénales (stéroïdes soulignés) et qu’ils constituent des précurseurs de la synthèse d’androgènes de forte activité (DHT, 3a-diol). Cette conversion nécessite des enzymes spécifiques et s’effectuerait dans des orga nes paraendocrines périphériques ou dans la tumeur elle-même. Des organes aussi divers que la peau, le sein, la prostate possèdent l’infrastructure enzymatique nécessaire à ces conversions (8-10, 25, 26).
Les androgènes surrénaliens et leur production relative par le cortex surrénalien varient d'une espèce à l'autre (27). Les prin cipaux androgènes surrénaliens rencontrés et qui sont susceptibles d'être incriminés dans l'étiologie chez l'homme sont les stéroïdes C-19 suivants: le déhydroépiandrostérone (DHEA) et son sulfate (DHEAS), 1'androstenedione (A^-dione), 1'androstenediol
(A5-diol).
Une hypothèse tentante pour expliquer l'échappement des tu meurs aux traitements hormonaux qui bloquent la production d'an drogènes testiculaires est de supposer que les tumeurs trouvent des androgènes actifs propres à stimuler leur croissance dans une conversion périphérique ou intratumorale d'androgènes surréna liens. Cette dernière hypothèse, ainsi que le but de notre étude, est discutée en détail dans le chapitre suivant.
CHAPITRE II - HYPOTHESE DE TRAVAIL ET TRAVAUX EFFECTUES
II.1. Le modèle animal
Le problème de toute expérimentation scientifique est de
trouver un modèle animal le plus proche possible de l'humain. Nous nous sommes intéressés pour notre étude au carcinome Shionogi 115 (SC 115), une tumeur mammaire murine développée en 1965 par
Yamaguchi et Minesita qui présente des caractères d'androgéno-dé- pendance très comparables à ceux observés dans les cancers prosta tiques humains (29, 30). SC 115, loin d'être un cancer spontané, a été obtenu après 19 transplantations successives chez des mâles, à partir d'une tumeur originelle apparue chez une femelle vieillis sante (28). Alors que les premières tumeurs poussaient indifférem ment chez des mâles et des femelles, SC 115, lui, ne poussait plus que chez des mâles. Des résultats surprenant ont été obtenus en castrant des animaux (souris DD/Sio) porteurs de tumeurs. Il sem blerait que les petites tumeurs (<j> < 14 mm) régressent et dispa raissent, que les moyennes régressent ou se stabilisent momentané ment puis repoussent, que les grosses enfin ( 28 mm) voient leur croissance quasiment non affectée (29). Le premier résultat ( <f> < 14 mm) n'a jamais pu être retrouvé dans notre laboratoire. Il
apparaît par ailleurs que la castration des souris préalablement à leur inoculation avec SC 115 retarde 1'apparition des tumeurs mais ne la prévient pas (37). De plus, on peut constater que la courbe de croissance chez les animaux castrés est parallèle à celle
observée chez les animaux contrôle, comme si, après une période de latence ou d'adaptation, le mécanisme de croissance des tumeurs qui repoussent redevenait semblable à celui qui existait chez des animaux contrôles.
II-2» Quelques résultats intrigants obtenus avec SC 15 (29, 30).
SC115 Inoculé chez des souriceaux attend la maturation sexuel le , soit 40 jours environ, avant de se développer normalement. Inoculé chez des femelles, on assiste à une survie de la tumeur allant jusqu'à 150 jours, date à laquelle des injections de pro- prionate de testostérone initient le développement attendu. Ces expériences mettent en évidence 1'existence de facteurs de soutien de la croissance tumorale autres que les hormones testiculaires. Dès 1965, Yamaguchi et Minesita évoquent la possibilité d'une action des androgènes surrénaliens. Des études plus récentes (31) sur des cultures de lignées cellulaires clonêes à partir de SC 115 montrent que 1'androst-5-ene-3g , 17g-diol (A5-diol), 1'androstane- diol (A-diol) et 1'androstenedione (A^-dione) ont des activités comparables, de même que la testostérone (T) et la dihydrotestos-
térone (DHT), sur la stimulation de la croissance de ces clones. Les auteurs soulignent que les études étant faites sur des cellu les vivantes, la possibilité d'une métabolisâtion de ces stéroïdes in situ n'est pas exclue.
II-3. Activités paraendocrlnes du sein et de la prostate
Il a été démontré que la prostate ou le sein métabolisent sur place des stéroïdes en circulation (principalement les C-19 sté roïdes d'origine surrénalienne) en des androgènes actifs (T, DHT), voire des estrogènes. Le sein et la peau semblent avoir une origi ne embryologique commune (9). Le sein aurait évolué à partir de glandes sudoripares modifiées. La Table 2 montre les principales voies métaboliques déjà mises en évidence dans ces deux tissus (extrait de "Steroid Hormones and Breast Cancer" J.B. Adams, Cancer 40: 327, 1977).
Le métabolisme du DHEA (8, 25), du Alt~dione (7, 26) et du A5- diol (10) en des androgènes connus pour avoir une grande affinité pour les récepteurs androgéniques (T, DHT, A, 3 a-diol) a été mis en évidence aussi bien dans le sein que la prostate. L'existence des enzymes nécessaires à ces conversions aussi bien dans la pros tate que dans SC 115 nous a donc conduit à formuler 1’hypothèse suivante que nous avons testée en partie par les expériences dont les résultats figurent aux chapitres III et IV et qui constituent le corps de cette thèse.
Métabolisme des stéroïdes
dans un tissu de carcinome mammaire humain
DHEAS *
* DHEA
A-ANDROSTENEDIONE
TESTOSTERONE
i
DI HYDROTESTOSTERONE &
5a-REDUCTI ON PRODUCTS
Za-HYDROXY DHEA
16a-HYDROXY DHEA
5-
andr
É
stenetriôl
5-ANDROSTENEDIOL
ESTROGENS
Métabolisme des stéroïdes dans la peau chez l'homme
DHEA
A-ANDROSTENEDIONE 7=-HYDROXY DHEA I
TESTOSTERONE
i
DI HYDROTESTOSTERONE & 5a-REDUCTI0N PRODUCTS
DHEAS- - - ► 16a-HYDR0XY DHEA
\ " I
\
;
5-ANDR0STENEDI0L \ 5-ANDR0STENETRI0L 4-ANDROSTENEDIONE i TESTOSTERONEREDUCTION PRODUCTS & ESTROGENS
II-4 L'hypothèse de travail: une adaptation des cellules tumorales androgêno-dépendantes à un milieu "privatif" comparable à celle rencontrée chez E. Coll avec l'opéron tryptophane
Une cellule bien différenciée possédant une activité fonction nelle spécifique dégénère si cette activité est supprimée. En d'autres termes, il lui faut fonctionner pour survivre. L'exemple le plus frappant est donné par le système nerveux. Lorsqu'on
supprime un neurotransmetteur ou une afférence qui provoque en temps normal 1'activité d'un neurone, on assiste à des adaptations spectaculaires de ce dernier avec apparitions de nouveaux contacts neuronaux et apparition ou démasquage de nouveaux systèmes de
transmission parfois très différents du premier et dont le seul but semble être de maintenir une activité fonctionnelle (quelcon que) du neurone. Lors d'une castration chirurgicale ou chimique, la chute drastique des androgènes circulants met en danger, si elle est brutale, la survie des cellules prostatiques ou mammaires puisqu'elle risque d'empêcher définitivement une activité fonc tionnelle de ces cellules.
Il est très tentant de supposer qu'on assiste alors à une adaptation de la cellule comparable à celle décrite chez la bacté rie E. Coll dans le cas de l'opéron tryptophane. E. Coli possède différentes enzymes qui interviennent dans la biosynthèse d'un acide aminé essentiel à la bactérie, le tryptophane. Lorsque ce dernier élément est en quantité suffisante dans le milieu, on assiste à une régulation de sa biosynthèse intracellulaire soit par une action directe du tryptophane qui vient inactiver une enzyme au début de la voie métabolique, soit par une action indi recte du tryptophane qui vient activer un répresseur qui se lie à une séquence de 1'ADN, le promoteur, et empêche la lecture des gènes codant pour ces enzymes et donc leur synthèse. Il existe même un système d'atténuation de la lecture de ces gênes en pré
Lorsque la bactérie est mise en présence d’un milieu privatif, à la suite d’une diminution brutale des quantités de tryptophane, on assiste à une levée de ces contrôles, au démasquage de ces enzymes à différents niveaux et à une reprise de l'activité intra cellulaire de biosynthèse du tryptophane à partir de précurseurs présents dans le milieu.
Nous proposons ici un mécanisme similaire d'adaptation des cellules tumorales androgêno-dëpendantes à un milieu devenu priva tif par suite de la forte diminution des androgènes testiculaires en circulation.
Cette adaptation se ferait par un démasquage d'enzymes pré existantes dans la tumeur et/ou par une augmentation de leur acti vité. Ces enzymes conduiraient à la biosynthèse intratumorale d'androgènes actifs à partir des précurseurs que constituent les androgènes surrénaliens (C-19 stéroïdes) en circulation. Si l'on considère que des récepteurs stéroïdiens peuvent être déjà pré sents à l'état libre dans le noyau (32, 33) et que certaines des enzymes essentielles de ces mêtabolisations peuvent être en grande partie nucléaires (50% pour les 5a-rêductases dans la prostate ventrale de rat (34)), on comprend qu'une formation, près des récepteurs, de stéroïdes actifs peut devenir la source majeure d'activation de la croissance tumorale. De plus, ce phénomène peut diminuer considérablement l'influence de stéroïdes ou de produits provenant de la circulation. Certaines tumeurs considérées comme indépendantes pourraient ainsi n'être que des tumeurs dépendantes très adaptées. Des résultats récents mettant en évidence l'exis tence de récepteurs chez des clones indépendants (35) ainsi qu'un résultat qui date de 1974 et qui montre que les 5a-réductases sont paradoxalement plus élevées dans des tumeurs indépendantes vien nent appuyer cette idée (3).
II-5. Les travaux effectués
Ils ont consisté en deux séries d’expériences.
D’une part, le métabolisme des trois C-19 stéroïdes A^-dione, DHEA et A^-diol par des tumeurs androgêno-sensibles SC 115 et des tumeurs androgéno-Insensibles dérivées in vivo des précédentes par passages répétés chez des mâles castrés et traités avec un antian drogène, a été étudié. Pour ce faire, chacun des C-19 stéroïdes
tritiês a été incubé avec des homogênats de tumeurs. Les diffé rents métabolites obtenus ont ensuite été séparés par chromatogra phie sur colonne de Sëphadex LH-20 suivi de chromatographie en couches minces (CCM) sur gel de silice. Leur pourcentage relatif a été calculé. On a pu ainsi mettre en évidence 1'existence des
enzymes impliquées dans la conversion de C-19 stéroïdes en andro gènes actifs dans les deux types de tumeurs ainsi qu’une augmenta tion de leur activité (en particulier les 5a-rëductases) dans les tumeurs indépendantes. Les détails de 1'expérimentation et les résultats obtenus sont présentés au chapitre III.
Par ailleurs, pour étudier 1'adaptation d'une tumeur dépendan te lors d'une castration, une même lignée SC 115 a été inoculée chez des souris mâles DD/Sio et chez des mâles castrés. La crois sance de cette tumeur dans ces deux milieux hormonaux a été mesu rée et comparée. Le contenu des stéroïdes a été mesuré dans les tumeurs apparues dans les deux cas. les taux plasmatiques de ces mêmes stéroïdes ont été mesurés chez des mâles et des mâles cas trés. De la comparaison du contenu des tumeurs et des niveaux
plasmatiques ainsi que des corrélations trouvées entre les niveaux de certains C-19 stéroïdes (DHEA) et ceux d'androgènes actifs
(3a~diol) dans les tumeurs, des conclusions ont été tirées qui sont présentées au chapitre IV avec le détail de 1'expérimenta tion .
CHAPITRE III
ETUDE COMPAREE DU METABOLISME DES C-19 STEROÏDES TRITIES DHEA, A4-DI0NE, A5-DIOL PAR DES TUMEURS MAMMAIRES SHIONOGI
ANDROGENO-SENSIBLES ET ANDROGENO-INSENSIBLES
■
V
METABOLISM OF TRITIATED 019 STEROIDS BY ANDROGEN-SENSITIVE AND -INSENSITIVE SHIONOGI MOUSE MAMMARY TUMORS
Jean-Marc LE GOFF and Alain BELANGER
Department of Molecular Endocrinology, Le Centre Hospitalier de 1'Université Laval,
Québec GlV 4G2, Canada. ABSTRACT
In the present study, we report that androgen sensitive and androgen insensitive Shionogi tumors metabolize déhydro épiandrostérone, androst-5-ene-3S,17S“diol and androstenedio- ne differently. Our data clearly show that both the sensitive and insensitive tumors contain 3 8-hyd roxys teroid A5-A1+ isome- rase which causes the transformation of adrenal C-19 steroids into potent androgenic steroids. However, the androgen sensi tive tumor is able to convert androst-5-ene-3£,17 g-diol into 2-hydroxyestrogens while the rate of conversion is extremely low in the insensitive tumor. Most interestingly, the produc tion of 5a-reduced steroids observed in both tissues was clearly higher in insensitive tumor homogenates.
INTRODUCTION
Recent data obtained by Labrie et al. (1) have shown that chemical or surgical castration in combination with the administration of an antiandrogen for the treatment of pros tatic cancer leads to a 8— to 10—fold improvement in survival when compared to castration alone. It was postulated that the antiandrogen blocked the action of testosterone and dihydro testosterone (DHT), both of which are converted from adrenal C-19 steroids, such as déhydroépiandrostérone (DHEA) and its sulfate (DHEAS). Metabolism of either DHEA or androstenedione (A^-dione) to potent androgens had been demonstrated to occur in the human prostate (2, 3).
shown that castration of male mice three days before inocula tion with androgen sensitive Shionogi tumor cells (SC 115) (4, 5) does not prevent but only delays the appearance of tumors (6). Furthermore, treatment of castrated mice with an antiandrogen further delays the tumor growth and reduces the incidence of tumors (6). Since they possess androgen recep tors and grow rapidly in intact male mice (7), Shionogi tumor cells (SC 115) represent a good model for studying prostatic cancer. In addition, Desmond et al. (8) have shown that these tumors are able to respond to adrenal steroids such as andro- stenedione and androst-5-ene-38,178-diol (A5-dlol).
In the present study, we have examined the metabolism of DHEA, A 5-diol and A^-dione in incubates of tumor homogenates. We show that differences in the metabolism of these androgens exist between the androgen sensitive tumors grown in intact animals and the androgen insensitive tumors established in castrated animals.
MATERIALS AND METHODS
Chemicals. (1,2,6,7-3H)-dehydroepiandrosterone (89 Ci/mmole), (1,2,6,7-3 H)-androstenedione (92 Ci/mmole) were obtained from Amersham. (1,2-3H)-andro8t-5-ene-38,17g-diol (49 Ci/mmole) was purchased from New England Nuclear. Before incubation,
these labeled steroids were purified on LH-20 columns (9) and by silica gel thin-layer chromatography. Non-radioactive
steroids were purchased from Steraloids and from Research Plus Steroid Laboratories, Inc.
Tumors. DD/S male mice raised in our laboratory were inocula ted subcutaneously on the back with 106 viable cells of the two different cell lines. The androgen-sensitive SC115 cell line was obtained from Dr. Yvonne Lefebvre, University of Calgary and was carried in normal male mice. The
androgen-the androgen-sensitive SC 115 tumor cells in a castrated + antiandrogen (Flutamide) treated animal. This androgen-insen sitive cell line has now been carried for about 6 months in such animals.
Incubation and extraction. Five sensitive and 5 insensitive tumors weighing about 2
g
each were dissected at room tempe rature, carefully excised of adhering fat, sliced and homoge nized individually in 0.25M sucrose containing ImM EDTA. The homogenate was then diluted to 300 mg wet weight per ml with the sucrose solution.Buffer co-factor solution (0.1 ml, 300 mM potassium phos phate, 60 mM nicotinamide and 2 mM magnesium chloride, pH 7.4) was introduced into 2 x 10 cm glass tubes. Buffer cofac tor solution (0.5 ml) containing 0.8 mg NADPH was then added to each tube before starting the reaction with the addition of 0.5 ml of the tumor homogenate. The samples were incubated 3h in a shaking water bath under air atmosphere at 37 °C. To stop the reaction, the incubates were acidified with 0.1 ml of IN HC1 and placed in a water bath at 4 ° C. Each incubation was performed in triplicate.
Identification of metabolites. Ethanol (0.1 ml) containing 10 yg of each of the following carrier steroids were added to each tube : déhydroépiandrostérone, androst-5-ene-38,17g-diol, androstenedione, testosterone, androstanedione, dihydrotesto sterone, androsterone, 5a-androstane-3a,17g-diol, epiandrost- erone, 5u-androstane-3g,17g-diol, estrone, estradiol and
estriol.
Incubation media were extracted three times with ether and dried under a nitrogen stream. The residue obtained from the ether extraction was dissolved in 0.2 ml of isooctane- benzene-methanol (90:5:5) and eluted on LH-20 columns, as previously described (11).
The eluate was separated in the following fractions: a)androstenedione + androstanedione (0-15 ml); b) déhydroépi androstérone + androsterone + dihydrotestosterone (16-30 ml);
c) testosterone + 5ct-androstane-3ct, 17 8-diol (31-50 ml). Pola rity of the solvent was then changed to 80: 15: 15 (isoocta ne-benzene-methanol) for the elution of fraction d): 5a-an- drostane-38,178-diol + androst-5-ene-36,176-diol (51-75 ml). Using the system 60:20:20 (isooctane-benzene-methanol) we have obtained fraction e): estrone + estradiol + 2-hydroxyes-
trone + 2-hydroxyestradiol.
An aliquot of each fraction was then counted to calcula te the percentage of total radioactivity in each zone. The total radioactivity was routinely 90% of the radioactivity added at the time of incubation. All fractions were acetylat- ed in acetic anhydride-pyridine (2:3) at room temperature overnight and chromatographed on 0.25 mm thin-layer plates (Merck Silica gel; GF-254).
Fractions were chromatographed as follows : Fraction a) hexane-ether (1:3): androstenedione (Rf : 0.29),
androstane-dlone (Rf: 0.45); fraction b), hexane-petroleum ether-ether (1:1:2) : dihydrotestosterone (Rf: 0.60) , déhydroépiandro stérone (Rf : 0.64), androsterone (Rf: 0.66). To separate déhydroépiandrostérone from androsterone, the zone correspon ding to these metabolites was scraped, extracted with ether
(an aliquot being counted) and rechromatographed with ethyl acetate-petroleum ether (1:9): dehydroepiandrosterone (Rf : 0.31), androsterone (Rf : 0.36). Fraction c) was chromatogra phed in ethyl acetate-petroleum ether (1:1): testosterone (Rf
: 0.63), 5a-androstane-3ct , 17 g-diol (Rf: 0.73). In fraction d) 5a-androstane-3g,17g-diol and androst-5-ene-3g,17g-diol were not separated. Fraction e) was separated with ethyl acetate- petroleum ether (1:1): estrone (Rf: 0.68) , estradiol (Rf: 0.73), 2-hydroxyestrone (Rf: 0.61), 2-hydroxyestradiol (Rf : 0.70). Radioactivity was detected with a Berthold thin-layer
scanner and radioactive zones were scraped off, eluted with methanol, counted in a liquid scintillation counter. Radioac
tive material isolated which carrier steroids was further analyzed by crystallisation to constant specific activity. Identification of 2-hydroxyestrone and 2-hydroxyestradiol was only confirmed by thin-layer chromatography.
RESULTS
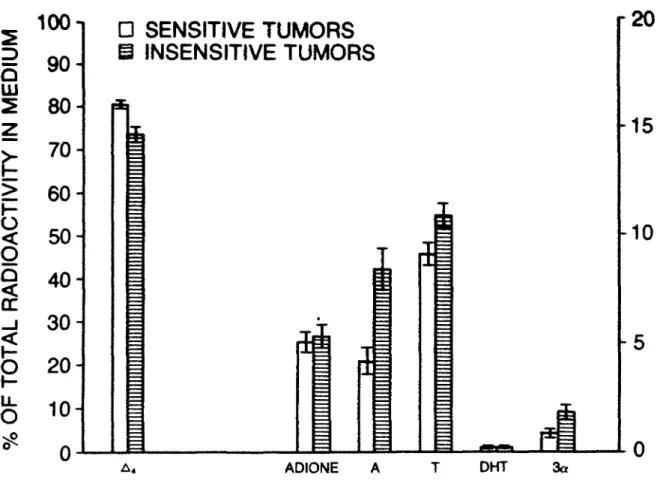
Figure 1 demonstrates that testosterone is a major pro duct of metabolism of androstenedlone in both the androgen- sensitive and -insensitive tumors, accounting for approxima tely 10% of the total radioactivity after 3 hours of incuba tion. In addition, there is active conversion to andros tane- dione, androsterone and 5a-androstane-3a,17g-diol. Most inte
restingly, the insensitive tumors demonstrate a greater capa city to form the Sa-reduced products androsterone and 5a-an- drostane-3a,17g-diol (p < 0.01). These data would therefore suggest that the insensitive tumors have greater 5a-reductase activity.
□ SENSITIVE TUMORS
S INSENSITIVE TUMORS
ADIONE
Fig. 1. In vitro conversion of androstenedione (&"+) to
androstanedione (Adione), androsterone (A), testosterone (T), dihydrotestosterone (DHT) and 5a-androstane-3a,17g-diol (3a) by insensitive and sensitive tumor homogenates.
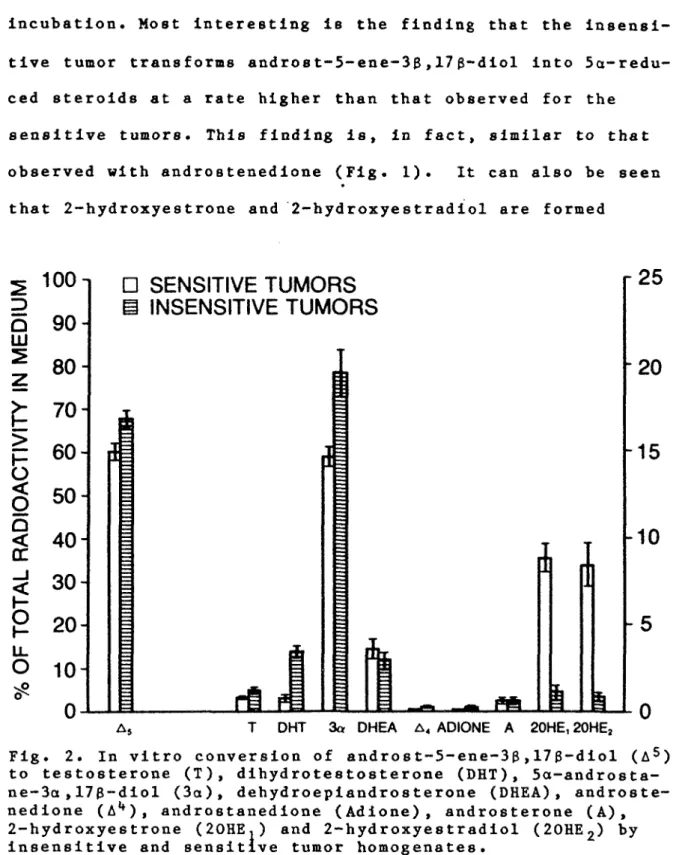
Figure 2 illustrates the conversion of radioactive an- drost-5-ene-30,170-diol by sensitive and insensitive tumor homogenates. The presence of 30-hydroxysteroid dehydrogenase
in both tumors is confirmed by the formation of testosterone and So-reduced steroids. After the three hour incubation,
testosterone, dihydrotestosterone and androstane-3a,17g-diol together comprise almost 20% of the total radioactivity. While it was not possible to achieve a separation between androst-5-ene- 30,170-diol and 5a-androstane-3g,17g-diol, we
diol Is most likely formed In very small amounts during the Incubation. Most Interesting Is the finding that the Insensi tive tumor transforms androst-5-ene-3g,17g-diol Into 5a-redu- ced steroids at a rate higher than that observed for the
sensitive tumors. This finding is, in fact, similar to that observed with androstenedione (Fig. 1). It can also be seen that 2-hydroxyestrone and 2-hydroxye stradiol are formed
□ SENSITIVE TUMORS
m
INSENSITIVE TUMORS
T DHT 3<* DHEA A. ADIONE A 20HE, 20HE;
Fig. 2. In vitro conversion of androst-5-ene-3g,17g-diol (A5) to testosterone (T), dihydrotestosterone (DHT), Sa-androsta- ne-3a,17g-diol (3a) , dehydroepiandrosterone (DHEA), androste nedione (A1*), androstenedione (Adlone) , androsterone (A), 2-hydroxyestrone (20HE,) and 2-hydroxyestradiol (20HE2) by insensitive and sensitive tumor homogenates.
□ SENSITIVE TUMORS
B INSENSITIVE TUMORS
DHT 3a 20HE, 20HE, A, ADIONE A
DHEA
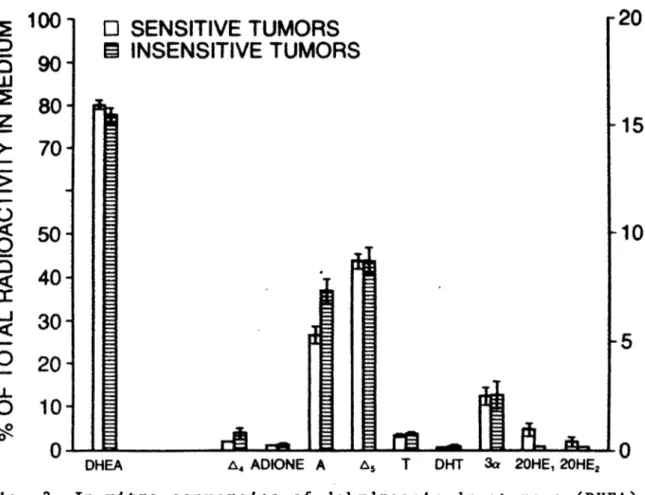
Fig. 3. In vitro conversion of déhydroépiandrostérone (DHEA) to androstenedione (A1*) , androstanedione (Adione) , androste- rone (A), androst-5-ene-3g,17g-diol (A5), testosterone (T), dihydrotestosterone (DHT), 5a-androstane-3a,17g-diol (3a), 2-hydroxyestrone (20HE,) and 2-hydroxyestradiol (20HE2) by insensitive and sensitive tumor homogenates.
during the incubation period with the sensitive tumors and, unexpectedly, this is strongly inhibited when insensitivie tumors homogenate is used for the incubation (from 17±1.4% to 2± 0.04 Z , p < 0.01).
As demonstrated in Fig. 3, 20% of the radioactive déhy droépiandrostérone is converted during incubation with the tumor homogenates. Androsterone, androst-5-ene-3g,17g- diol and 5a-androstane-3a,17g- diol are the main metabolites form ed from dehydroepiandrosterone. As we observed above, the
amount of 2-hydroxyestrogens formed during incubation with the sensitive tissue is greater when compared to the amount formed by the insensitive tissue (1.41 ± 0.19% to 0.24 ± 0.03%, p < 0.01). Furthermore, the amount of the Sa-reduced steroid androsterone is also significantly higher in the insensitive tumor homogenates (p < 0.01) which is consistant with the results obtained when androstenedione was utilized
as the radiolabeled precursor (Fig. 1).
DISCUSSION
These experiments show that adrenal C-19 steroids Such as androst-5-ene-30,17 0-diol and androstenedione can be con
verted into potent androgenic steroids by homogenates of the Shionogi SC 115 tumors. Our data are in agreement with pre vious observations obtained with tumor cells in culture which indicate that androst-5-ene-30,17S-diol and androstenedione markedly stimulate the growth of tumor cells (8). Furthermo
re, since the conversion of déhydroépiandrostérone into tes tosterone and dihydrotestosterone is extremely low, our data also explain the inability of déhydroépiandrostérone to in
fluence the growth of tumor cells. Yamaguchi et al. (11) have shown that the formation of 5a-reduced steroids from testos terone is markedly elevated in insensitive tumors when compa red to that observed in the sensitive tissues. This result is
reduced steroids obtained from androst-5-ene-3g,17g-diol or androstenedione is greater when insensitive tumor homogenate is used. It thus appears that, in castrated animals, the dramatic decrease in the levels of circulating androgens leads to a change in the regulation of the tumor enzymes. Since the 5a-reductase activity is greater in the androgen- insensitive tumors, these data suggest that during the deve lopment of the insensitive cell line, these cells acquired the ability to synthesize, from the precursor steroids pre sent in the circulation, more potent androgens which are known to have higher affinities for the androgen receptor.
Our study also demonstrates the production of 2-hydroxy estrogens from C-19 A5-steroids during incubation with the androgen-sensitive tumor homogenates and furthermore the production is markedly reduced in androgen-insensitive tumor homogenate. Our data support an earlier report on the regu lation of estrogen 2-hydroxylase action by testosterone (12-14). In fact, it has been demonstrated that this enzyme activity is markedly reduced after castration. The dramatic decrease in estrogen 2-hydroxylase activity in insensitive tissue could be caused by the low amount of androgens in the tumor
steroids metabolism in androgen-sensitive and -insensitive Shionogi tumor lines. In addition to the observation that both tumor types are capable of producing potent androgens, a significant difference in the 5<x-reductase activity has been found between the two tumors.
Trivial names: Androstenedione: 4-androsten-3,17-dione, androst-5-ene-3g,17g-diol: 5-androstene-3g,17g-diol, déhy droépiandrostérone: 3g-hydroxy-5-androstene-17-one, testoste
rone : 17g-hydroxy-4-androstene-3-one; dihydrotestosterone: 17g-hydroxy-5a-androstane-3-one; androstanedione: 5a-andro- stane-3,17-dione, androsterone: 3a-hydroxy-Sa-androstane- 17-one; epiandrosterone: 3g-hydroxy-5a-androstane-17-one; estradiol : 1-3-5(10)-estratriene-3,17g-diol, estrone: 3-hy- droxy-l,3,5(10)-estratriene-17-one, 2-hydroxyestradiol :
1,3,5(10)-estratriene-2,3,17g-triol, 2-hydroxyestrone: l,3,5(10)-estratriene-2,3-diol-17-one.
REFERENCES
1. Labrie, F., Bélanger, A., Dupont, A., Emond, J., Lacoursière, Y. and Moufette, G. The Lancet 1090
(1984).
2. Harper, M.E., Pike, A., Peeling, W.B. and Griffiths, K. J. Endocrinol. 6_0: 117 (1974).
3. Perel, E. and Killinger, D.W. J. Biochem. 19: 1135 (1983).
4. Hatsumoto, K., Sato, B. and Kitamura, Y. In: Hormonal Regulation of Mammary Tumors, Eden Press Inc., vol. 1, chap. 8, 216 (1982).
5. Yamaguchi, K., Sato, B. , Okamoto, S., Kitamura, Y. and Mat sumo to, K. JUa : Hormones, Receptors and Breast Cancer, Raven Press, New York, p. 281 (1978).
6. Proulx, L., Leblanc, G., Lêtourneau, F. and Labrie, F. Excerpta Medica ICS 652 : no. 2247, p. 1384 (1984).
7. Minesita, T. and Yamaguchi, K. Cancer Res. 25: 1168 (1965) .
8. Desmond, W.J., Wolbers, S.J. and Sato, G. Cell 8: 79 (1976).
1_3: 185 (1980).
10. Bélanger, A., Auclair, C., Ferland, L J. Steroid Biochem. ,1_3: 191 (1980) . 11. Yamaguchi, K., Kasai, H., Minesita, T
Matsumoto, K. Endocrinology 9 5: 1424 12. Hoffman, A.R., Paul, S.M. and Axelrod
3_3: 4584 (1979) .
13. Barbiéri, R.L., Canick, J.A., Ryan, K 529 (1978).
14. Hoffman, A.R., Paul, S.M., Axelrod, J Pharmacol. 23: 83 (1980). . and Labrie, F. . , Kotoh, K. and (1974). , J. Cancer Res. .J. Steroids 32 : . J. Biochem.
CHAPITRE IV
ETUDE DE LA CROISSANCE D'UNE LIGNEE chez des souris mâles et des souris que du contenu hormonal des tumeurs plasmatiques de ces mêmes stéroïdes souris mâles castrés (DD/Sio).
SC 115 androgéno-dêpendante mâles castrées (DD/Sio) ainsi
obtenues. Mesure des niveaux chez des souris mâles et des
PRESENCE OF C-19 STEROIDS IN MAMMARY SHIONOGI CARCINOMA (SC115) IN CASTRATED MICE
Jean-Marc Le Goff, Alain Bélanger1, Louise Proulx, Simon Caron and Fernand Labrie
Department of Molecular Endocrinology,
Le Centre Hospitalier de l'Université Laval, Quebec GIV 4G2, Canada.
Footnote
1. To whom request for reprints should be adressed.
2. Le Goff, J.M., and Bélanger, A., Metabolism of tritiated steroids by androgen-sensitive and -insensitive Shionogi mammary tumors. Submitted.
C-19 mouse
ABSTRACT
Intact and castrated DD/S male mice were inoculated with androgen-dependent cells (SC 115). While all intact animals deve loped tumors after day 12, 6 of 7 castrated animals presented tumors 48 days post-inoculation. The levels of steroids in both tumors were then examined. In castrated mice, déhydroépiandrosté rone and androst-5-ene-3g,17g-diol levels were diminished by 30% and 70%, respectively, while the amounts of testosterone and androstenedione were reduced by more than 90%. Our data also
demonstrate that androstane-3a,17S-diol and androstane-38,17S-diol were decreased to 60% and dihydrotestosterone decreased to 6% of their normal value, respectively. This latter level (0.48 nM) was sufficient to still effect a potent androgenic response in the tumor. Besides, a highly significative correlation was found in these tumors between various C-l9 steroids (DHEA and 3ot-diol, r ** 0.97, p < 0.01), suggesting a possible conversion of C-l9 precur sors into potent androgens in the tumors. Determination of the plasma steroid levels in the castrated animals clearly confirmed that potent androgenic steroids and precursors were still in the circulation three days after castration. It thus appears that C-19 steroids from adrenal origin may be also involved in "independent" tumor growth
INTRODUCTION
Extensive studies have been performed with the androgen-de pendent Shionogi SC 115 mammary carcinoma developed by Minesita and Yamaguchi (12, 18). It has been shown that this tumor which rapidly grows in intact males contains androgen receptors (7). Proulx et al. (14) have recently reported that castration of male mice three days before inoculation with androgen-dependent tumor
cells does not prevent but only delays the appearance of tumors. Since the SC 115 tumor that regrew after androgen removal could be transplanted into female mice, it has been suggested that SC 115 tumors change during the absence of androgen from androgen depend ency to androgen independency (12). However, the presence of cyto sol androgen receptor has been demonstrated in these androgen- independent tumors (10, 16).
It had been first postulated by Minesita and Yamaguchi that C-19 steroids from adrenal origin may also have a positive effect on tumor growth (13). In fact, androst-5-ene-38,178-diol has been
shown to stimulate the growth rate of androgen dependent cells in culture (3). Furthermore, we have recently demonstrated that
androgen-dependent and independent tumors may convert déhydroépi androstérone and androst-5-ene-3 8,17 8-diol into potent androgens.2 In the present study, we have compared the levels of steroids in androgen-dependent tumors grown in intact animals to those in
tumors grown in animals castrated two days before inoculation with the androgen-dependent cells. Since some potent androgenic ste roids were found in both tumors, we also examined the levels of plasma steroids in intact and castrated mice.
MATERIALS AND METHODS
Animals and tumors. DD/S male mice raised in our laboratory were used at 2 months of age. In the first experiment, 14 male mice were inoculated subcutaneously on the back with approximately 106 viable cells of SC 115 cell line, kindly provided by Dr. Yvonne Lefebvre, University of Calgary. Seven animals had been previously bilaterally gonadectomized 2 days before the Inoculation. The
growth of the tumors in each animal was estimated by measuring every 3 days their average area (product of the 2 longest perpen dicular dimensions). Six surviving intact mice were sacrificed 3 weeks after the inoculation and the tumors were carefully excised of adhering fat and dead tissues. They were then weighed and kept frozen at -20°C. Forty-eight days post-inoculation, six castrated animals presented tumors. They were sacrificed and the same proce dure for the isolation of tumors was followed. In the second expe riment, 50 animals were equally separated in 2 groups and 25 mice were bilaterally gonadectomized. Three days later, the animals were bled from the retroorbital plexus using capillary tubes and blood samples were pooled 3 by 3 to obtain 6-8 samples of 1 ml plasma in each group.
Steroid assays. Progesterone, déhydroépiandrostérone (DHEA), androst-5-ene-3g,17g-diol (A^-diol) , androstenedione (A^-dione),
testosterone, dihydrotestosterone (DHT), androstane-3a,17g-diol (3a-diol) and androstane-3g,17g-diol (3g-diol) were measured in tumor and plasma as described previously (1, 2).
In brief, the steroid levels were measured by radioimmunoas say after chromatography on LH-20 columns using antisera developed and characterized in our laboratory (2).
Calculations. Radioimmunoassay data were analyzed using a program based on model II of Rodbard and Lewald (15). Statistical signifi cance was measured according to the multiple range test of Duncan- Kramer (8). All results are shown as the means ± SEM of duplicate determinations of individual samples.
RESULTS
Normal mice presented with tumors by day 12 in 100% of the animals inoculated with 106 viable Shionogi SC 115 tumor cells. In castrated mice, 6 of 7 animals presented tumors 48 days post-ino culation, the first tumor having appeared at day 32. One intact mouse died before sacrifice and its tumor content could not be
analyzed. Chart 1 illustrates the growth rate of SC 115 tumors in intact animals and in animals castrated 2 days before inoculation. It can be seen that a delay of 20 days occurs in the appearance of tumors in castrated animals. However, from day 32, it seems that the growth rate of SC 115 tumors Is not significantly different in the intact and castrated animals.
The levels of progesterone, testosterone, DHT, DEEA, A5-diol, A^-dione, 3a-diol and 3g-diol in the tumors are shown in chart 2. While the progesterone levels are comparable in intact and castra ted mice, it can be seen that all C-19 steroids are decreased in tumors from castrated animals. While DHEA and A5-diol concentra tions are diminished by 30% and 70%, respectively, the amounts of testosterone and A^-dione in the tumors grown in castrated animals are more than 90% (p < 0.01) reduced. Furthermore, castration
markedly decreases the content of dihydrotestosterone (from 2.21 ± 0.25 to 0.14 ± 0.04 ng/g; p < 0.01) while the levels of 3a-diol
and 38-diol are only decreased by 40%. The relationship between the tumor steroid concentrations in castrated animals of DHEA and 3a-diol is depicted graphically in chart 3. There is a highly significant positive correlation between these 2 C-19 steroids (r - 0.97, p < 0.001). Statistical analysis of other steroid levels
in the tumor shows that there are also significant correlations for A5-diol and DHEA (r ■ 0.81, p < 0.02), A^-diol and testostero ne (r = 0.94, p < 0.002), testosterone and 3o-diol (r = 0.85, p < 0.02) and finally 3a-diol and A^-dlol (r » 0.80, p < 0.02).
When examining the plasma steroid levels in DD/S male mice, we have observed that castration causes a decrease in the plasma levels of all steroids except DHEA (chart 4). However, while tes tosterone and A^-dione are reduced to less than 50 pg/ml, the concentration of DHT, 3a-diol and 3g-diol are only decreased by 50-60%.
DISCUSSION
The present findings clearly demonstrate that several C-19 steroids are still present in the plasma from castrated DD/S male mice. In fact, the concentration of dehydroepiandrosterone remains unchanged after castration while those of androst-5-ene-3g,170- diol as well as dihydrotestosterone and androstane-3a,178-diol are only reduced by 50%. It is most likely that the adrenal glands are the source of the residual steroids. This is in agreement with the finding that mouse adrenals can transform pregnenolone into C-19 steroids (4).
We have recently observed that androgen-dependent as well as androgen-Independent Shionogi tumors are able to convert déhydro épiandrostérone and androst-5-ene-33,173~diol into potent andro gens . 2 Furthermore, in independent tumors, we and others (17) have reported that the 5a-reductase activity is markedly increased. The present data thus strongly suggest that the Shionogi tumors in the presence of plasma déhydroépiandrostérone are able to accumulate potent androgens. Moreover, it should be mentioned that a concen tration of dihydrotestosterone reduced to 6% of the normal value (from 7.6 to 0.48 nM) can still exert a potent androgenic action. The correlation observed between the tumor concentrations of C-19
precursors such as déhydroépiandrostérone and C-19 metabolites such as androstane-3a,17 8-diol suggests that these insensitive
tumors are in fact able to transform déhydroépiandrostérone into androstane-3a,178~diol. Furthermore, since the androgen receptors are still present in independent tumors (16), these C-19 steroids and their metabolites may play an important role in the growth of the tumors.
It is well established that surgical or medical castration of patients with prostatic cancer causes in 70-80% of the cases a remission of their disease (11). Since the level of C-19 steroids such as déhydroépiandrostérone or its sulfate in human plasma is much higher than that observed in the mouse, it is even more likely that they can play a positive effect in prostate cancer growth following castration. The conversion of déhydroépiandrosté rone and its sulfate into potent androgens in the human prostatic tissue is most likely responsible for the relatively high concen tration of dihydrotestosterone (1-2 ng/ml) found in this tissue following castration (5).
The marked difference in the survival recently reported by Labrie et al. (9) in patients receiving the combined treatment with a pure antiandrogen and an agonist of LHRH can find at least part of their explanation in such an important role of androgens of adre nal origin. In fact, the antiandrogens could block the action of potent androgens formed in the prostate. Such a transformation of déhydroépiandrostérone and androst-5-ene-3S,17S-diol has been already reported in this human tissue (6). In the present study, although the concentration of steroids in mouse plasma is much less important than in the human, we could easily demonstrate the presence of potent androgens in the tumor tissue.
Our data indicate that C-19 steroids may be involved in "in dependent" tumor growth in agreement with the previous suggestion of Desmond et al. (3). In fact, it thus appears that some tumors called "independent" remain sensitive to androgens and grow more slowly due to the decreased endogenous level of androgens follow ing removal of the testicular influence.
0-0 INTACT MICE CASTRATED MICE
CHART 2 □ INTACT MICE B CASTRATED MICE 7000-8000 £ 5000-f? 4000-2000 1000 -»CA A, A, 500 450 400 350 300 250 200 150 100 50 0
CHART 3 r 097 p<0 001 n = 6 I 200 DHEA PG/G TUMOR
CHART 4
□ INTACT DO'S MALE MICE
CASTRATED DD/S MALE MICE
5000- 4000- 3000-2000 -1000 -DHEA A. 500 400 300 200 100 0
LEGENDS TO CHARTS
Chart 1. Growth of tumors in intact animals or animals that have been castrated two days before inoculation with SC 115 cells. All
intact animals developed tumors at day 12 while 6 of 7 castrated animals showed tumors 48 days post-inoculation.
Chart 2. Determination of progesterone (Prog), testosterone (T), dihydrotestosterone (DHT), déhydroépiandrostérone (DHEA), androst- 5-ene-3g ,17g-diol (A5), androstenedione (A1*), andro s tane-3 a , 17 g- diol (3a) and androstane-3 g,17 g-diol (3 g) in tumors that grew in
intact animals or animals that have been castrated two days before inoculation with SC 115 cells.
Chart 3. Correlation between the concentration of androstane-3a,- 17 g-diol (3a-diol) and déhydroépiandrostérone measured in the same tumors that grew in castrated mice.
Chart 4. Determination of progesterone (Prog), testosterone (T), androstane-3a,17g-diol (3a-diol), dihydrotestosterone (DHT), déhy droépiandrostérone (DHEA), androst-5-ene-3g,17g-diol (A5), andros tenedione (A**), dihydrotestosterone (DHT) and androstane-3 8,17 g- diol (3g-diol) levels in plasma obtained from intact mice and mice which had been castrated two days prior to blood sampling.
REFERENCES
1. Bélanger, A., Labrle, F., Lemay, A., Caron, S., and Raynaud, J.P. Inhibitory effects of a single intranasal administration
of [D-Ser(TBÜ)6, des-Gly-NH210]LHRH ethylamide, a potent LHRH agonist, on serum steroid levels in normal adult men. J.
Steroid Biochem., 13: 123-126, 1980.
2. Bélanger, A., Caron, S., and Picard, V. Simultaneous
radioimmunoassay of progestins, androgens and estrogens in rat testis. J. Steroid Biochem., 13: 185-190, 1980.
3. Desmond, W.J. Jr., Wolbers, S.J., and Sato, G. Cloned mouse mammary cell lines requiring androgens for growth in culture.
Cell, 8: 79-86, 1976.
4. Edery, M., Carreau, S., Simon, M.-J., and Drosdowsky, M.A. In vitro pregnenolone metabolism by mouse adrenal gland. II. Biosynthesis of androgens. Steroids, 39: 191-200, 1982.
5. Geller, J., Albert, J.D., Nachtsheim, D.A., and Loza, D. Comparison of prostatic cancer tissue dihydrotestosterone levels at time of relapse following orchiectomy or estrogen therapy. J. Urol., 132: 693-696, 1984.
6. Harper, M.E., Pike, A., Peeling, W.B., and Griffiths, K. Steroids of adrenal origin metabolized by human prostatic tissue both in vivo and in vitro. J. Endocrinol., 60:
7. Jung-Testas, J., Desmond, W. , and Beaulieu, E.-E. Two sex steroid receptors in SC-115 mammary tumor cells. Exp. Cell. Res., 97: 219-232, 1976.
8. Kramer, C.Y. Extension of multiple-range tests to group means with unique numbers of replications. Biometrics, 12: 307-310, 1956.
9. Labrie, F., Bélanger, A., Dupont, A., Emond, J., Lacoursière, Y., and Moufette, G. Combined treatment with LHRH agonist and pure antiandrogen in advanced carcinoma of the prostate. The Lancet 1: 1090, 1984.
10. Lefevre, Y.A., Caskey, J.J., and Kline, L.D. Characterization of androgen uptake by purified nuclei from an androgen-depen- dent and two androgen-independent cell lines of the Shionogi mouse mammary carcinoma. J. Steroid Biochem., 17: 609-614, 1982.
11. Nesbit, R.M., and Baum, W.C. Endocrine control of prostatic carcinoma : clinical and statistical survey of 1818 cases. JAMA, 143: 1317-1320, 1950.
12. Matsumoto, K., Sato, B., and Kitamura, Y. Roles of androgen and its receptors in mouse mammary tumors. In: B.J. Leung
(ed.), Hormonal Regulation of Mammary tumors, vol. 1, pp. 216-244, Eden Press, Inc., 1982.