Évaluation visuelle des arbres feuillus sur pied et
valeur des produits transformés
Thèse
Filip Havreljuk
Doctorat en sciences forestières
Philosophiae doctor (Ph.D.)
Québec, Canada
Résumé
Les forêts feuillues tempérées du sud du Québec ont une grande importance économique, car elles sont la principale source d’approvisionnement des industries des produits d'apparence en bois. Toutefois, la difficulté de relier l’apparence externe d’un arbre à la qualité interne de son bois engendre des incertitudes liées à l’approvisionnement, puisque la qualité des bois sélectionnés pour la récolte peut ne pas correspondre aux besoins réels des usines de transformation. L’objectif principal de ce projet était d’améliorer les prévisions des caractéristiques des approvisionnements de bois feuillu en reliant l’évaluation de la qualité des arbres sur pied à la composition du panier de produits transformés et à sa valeur monétaire. Un des facteurs internes qui affecte la valeur des sciages d’érable à sucre (Acer saccharum Marsh.) et de bouleau jaune (Betula alleghaniensis Britt.) est la présence d’une zone de couleur brun-rougeâtre au centre de la tige, appelée coloration de cœur. Un échantillonnage dans 12 localisations de la zone tempérée du sud du Québec a montré que les différences régionales de la proportion radiale de la zone colorée chez ces deux espèces étaient principalement attribuables à des facteurs liés au développement des arbres, tels que l’âge et les accroissements autour de la zone colorée. Une partie de la variabilité chez l’érable à sucre était aussi associée à la température minimale annuelle d'une localisation. Par ailleurs, l’étude de 64 érables à sucre et 32 bouleaux jaunes abattus, tronçonnés et sciés en planches a mis en évidence le fait que parmi tous les types de défaut qui doivent être pris en considération lors du marquage des arbres, les signes visibles d’infection fongique et les fentes avaient la plus grande influence négative sur la valeur des deux espèces. L’analyse des sciages a montré que la proportion des meilleurs grades augmentait avec la longueur et le diamètre des billes, ce qui fait qu’elle était plus élevée dans le bas de l’arbre. Les billes présentant une grande zone colorée ont produit davantage de bois de moindre valeur. Dans leur ensemble, ces résultats permettent d’établir des liens entre le classement visuel des arbres sur pied et la qualité de produits transformés permettant une meilleure prise de décisions liée à l’approvisionnement en bois feuillu.
Abstract
Temperate deciduous forests of southern Quebec are of great economic importance because they are the main supply source of the appearance wood products industries. However, the difficulty of linking the external characteristics of a tree to the internal quality of its wood creates supply-related uncertainties, since the quality of selected trees for harvest may not correspond to the real needs of these processing industries. The main objective of this study was to improve the supply forecasts of hardwood processing industries by linking the quality assessment of standing trees to their products assortment and their monetary value. One of the most important internal factors affecting the value of sugar maple (Acer saccharum Marsh.) and yellow birch (Betula alleghaniensis Britt.) lumber is the presence of a reddish-brown colored area in the center of the stem called red heartwood. Samples from 12 locations throughout the temperate zone in southern Quebec showed that regional differences in the radial proportion of the colored area in both species were mainly due to factors related to tree development, such as age and radial growth around the colored area. Part of the variability in sugar maple was also associated with the annual minimum temperature of a sampling location. In addition, the study of 64 sugar maple and 32 yellow birch trees that were harvested, bucked into logs and processed into lumber showed that among all defect types that need to be considered for tree marking, visible evidence of fungal infections and cracks had the largest negative influence on value in both species. The analysis of the lumber products assortment showed that the proportion of the best grades increased with the length and the diameter of the logs, so that it was higher at the bottom of the stem. Logs with a large red heartwood area produced more wood of lesser value. Overall, these results link the visual assessment of standing trees to the quality and value of processed products to allow better decision making in the hardwoods supply chain.
Table des matières
Résumé ... iii
Abstract ... v
Table des matières ... vii
Liste des tableaux ... ix
Liste des figures ... xi
Remerciements ... xiii
Avant-propos ... xvii
Introduction générale ... 1
Démarche méthodologique ... 6
Chapitre 1 Regional variation in the proportion of red heartwood in sugar maple and yellow birch ... 9
Abstract ... 10
Résumé ... 11
Introduction ... 12
Materials and methods ... 14
Results ... 21
Discussion ... 26
Conclusion ... 30
Acknowledgments ... 31
Chapitre 2 Integrating standing value estimations into tree marking guidelines to meet wood supply objectives ... 33
Abstract ... 34
Résumé ... 35
Introduction ... 36
Material and methods ... 38
Results ... 47
Discussion ... 54
Conclusion ... 57
Chapitre 3 Predicting lumber grade occurrence and volume recovery in sugar maple and
yellow birch logs ... 59
Abstract ... 60
Résumé ... 61
Introduction ... 62
Material and methods ... 64
Results ... 73 Discussion ... 83 Conclusion ... 87 Acknowledgements ... 87 Conclusion générale ... 89 Bibliographie ... 95
Annexe 1 : Données utilisées pour le chapitre 1 ... 109
Liste des tableaux
Table 1.1 Summary of sampling locations used in the study. ... 15
Table 1.2 Mean sample tree characteristics. SD is the standard deviation. ... 16
Table 1.3 List of explanatory variables screened in the modeling process. ... 20
Table 1.4 Comparison of the multiple linear regression models for sugar maple red heartwood proportion (RHP). ... 24
Table 1.5 Parameter estimates and their standard errors (±SE) for the final models. ... 25
Table 1.6 Comparison of the multiple linear regression models for yellow birch red heartwood proportion (RHP). ... 26
Table 2.1 Mean sample tree characteristics for the sugar maple and yellow birch data. ... 41
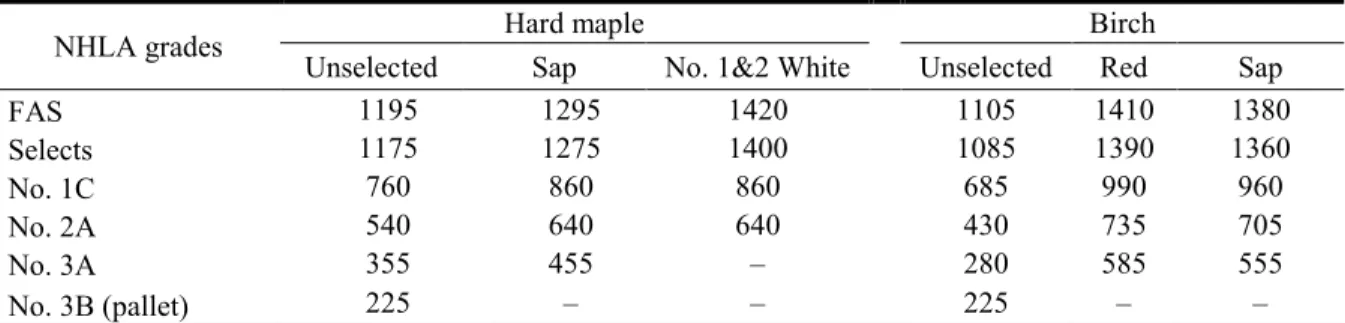
Table 2.2 Lumber grade distribution among the sawn boards. ... 44
Table 2.3 Distribution of NHLA grades among tree quality classes. ... 44
Table 2.4 Mean sugar maple and yellow birch lumber values from 2008 to 2012. ... 45
Table 2.5 Proportion of study trees (%) affected by a given defect category. ... 50
Table 2.6 Parameter estimates (± SE) and p-values for the model including DBH, fungal infections, and cracks given by eq. (3). ... 50
Table 2.7 Comparison of the linearized models for predicting the value per unit volume (VAL) of each stem. ... 52
Table 3.1 Mean log characteristics for the sugar maple and yellow birch data. ... 65
Table 3.2 Lumber grade distribution among the sawn boards. ... 67
Table 3.3 Mean sugar maple and yellow birch lumber values from 2008 to 2012. ... 72
Table 3.4 Proportion of NHLA lumber grades and colors among log grades. ... 73
Table 3.5 List of models predicting the VRG of sugar maple and yellow birch. ... 74
Table 3.6 Parameter estimates (and standard errors) for the best model to predicting VRG (model 8). ... 76
Table 3.7 List of models predicting the VRC of sugar maple. ... 78
Table 3.8 List of models predicting the VRC of yellow birch. ... 79
Table 3.9 Parameter estimates (and standar errors) for the best model to predicting VRC of sugar maple (model 4) and yellow birch (9). ... 81
Liste des figures
Figure 1.1 Location of the sampling regions across Québec. ... 14 Figure 1.2 Illustration of the red heartwood separation procedure performed using ImageJ. (A) Initial image. (B) The resulting image after applying the threshold function. (C) The final image after the noise from the threshold function was removed. ... 17 Figure 1.3 Mean red heartwood proportion (RHP) for sugar maple and yellow birch in the 12 sampling regions. Two study sites are included in each region and eight trees were sampled from each site. Error bars represent standard errors. ... 21 Figure 1.4 Mean red heartwood proportion (RHP) for sugar maple and yellow birch across bioclimatic subdomains. Eastern Balsam fir – Yellow birch subdomain (n = 92), Western Balsam fir – Yellow birch subdomain (n = 64), Eastern Sugar maple – Yellow birch subdomain (n = 92), and Western Sugar maple – Yellow birch subdomain (n = 128). Error bars represent standard errors. ... 22 Figure 1.5 Number of discoloured wood rings as a function of the total number of rings at 1.3 m. ... 23 Figure 1.6 Model-averaged predictions and unconditional 95% confidence intervals for the best-fit model parameters for sugar maple. ... 24 Figure 1.7 Model-averaged predictions and unconditional 95% confidence intervals for the best-fit model parameters for yellow birch. ... 26 Figure 2.1 Location of the study areas. ... 38 Figure 2.2 Predicted VAL (US$·m−3) in relation to vigor classification. Trees are classified
by harvest priorities: moribund trees (M), surviving trees (S), growing trees to be conserved (C), and reserve stock trees (R) (Boulet 2007). ... 48 Figure 2.3 Predicted VAL (US$·m−3) in relation to quality classification. The four grades
(A, B, C, and D) are used to describe the potential for sawlog production, with grade A being the highest and grade D the lowest (i.e., trees with no sawlog potential) (Monger 1991). ... 49 Figure 2.4 Predicted VAL (US$·m−3) of sugar maple and yellow birch in relation to the
presence of the main tree defects. ... 51 Figure 2.5 Predicted VAL (US$·m−3) in relation with sound wood depth for quality
classification (Monger 1991). ... 53 Figure 2.6 Predicted VAL (US$·m−3) in relation with sound wood depth for main defects.
... 53 Figure 3.1 Observed (bars) versus predicted (points) frequencies of the lumber volume recovery of lumber grades (VRG). ... 68
Figure 3.2 Observed (bars) versus predicted (points) frequencies of the lumber volume recovery of the lumber colors (VRC). ... 69
Figure 3.3 Predicted lumber volume recovery for each lumber grade (VRG) plotted against
the small-end diameter of the log (cm) of the best model (model 8). Lines represent loess smoothing functions with standard error through the predictions. ... 75 Figure 3.4 Predicted lumber volume recovery for each color category (VRC) plotted against
the covariates of the best model for sugar maple (model 4). Lines represent loess smoothing functions with standard error through the predictions. ... 80 Figure 3.5 Predicted lumber volume recovery for each color category (VRC) plotted against
the covariates of the best model for yellow birch (model 9). Lines represent loess
smoothing functions with standard error through the predictions. ... 80 Figure 3.6 Predicted value recovery against log net volume established from the predicted VRG (model 8). Lines represent linear smoothing functions with standard error plotted
Remerciements
Ce doctorat n’aurait pas été possible sans la contribution financière du Fonds de recherche du Québec – Nature et technologies (FRQNT) qui m’a accordé une bourse et qui a financé ce projet de recherche. Je tiens à remercier cet organisme pour sa confiance et son appui. Ce fut un privilège de pouvoir travailler avec mon directeur de recherche et véritable mentor, Alexis Achim, qui a toujours eu confiance en moi et qui a été le premier à me donner la chance de poursuivre mes études graduées sur un sujet qui me passionne. Il a toujours été disponible pour m’aider à avancer dans mon projet et faire de moi un meilleur chercheur. J’aimerais aussi remercier mon codirecteur de recherche, David Pothier, pour sa disponibilité, ses commentaires constructifs et sa rigueur qui ont permis de mener à terme ce projet. Merci Alexis et David pour l’opportunité que vous m’avez donnée, par votre encadrement et votre support dans mes travaux, autant du point de vue logistique, financier et scientifique, que moral avec votre sens d’humour!
J’aimerais aussi remercier du fond du cœur tous mes assistantes et assistants de terrain et de laboratoire : Amélie Denoncourt, Élisabeth Dubé, Frauke Lenz, Marine Bouvier, Julia Maman, Stéphanie Cloutier, Marie-Pier Arsenault et Louis Gauthier. La motivation, l’énergie et la bonne volonté que vous avez mise dans votre travail m’ont aidé à mener à terme ce projet. J’ai eu beaucoup de plaisir à travailler avec vous. Merci également à mes collègues et amis qui m’ont aidé au cours du projet : Julie Barrette, Simon Delisle-Boulianne, Emmanuel Duchateau, Louis-Vincent Gagné, Normand Paradis et Charles Ward.
Un grand merci aussi aux personnes suivantes pour leur soutien scientifique à travers mon doctorat: David Auty (analyses statistiques et révisions linguistiques des textes), Marc J. Mazerolle (conseils en statistiques et programmation), Ann Delwaide (aide en dendrochronologie), Rémi St-Amant et Jacques Régnière (aide avec BioSIM et l’analyse des données météorologiques), Jean McDonald (conseils en transformation des feuillus), Martine Lapointe et Jean-Philippe Gagnon (aide sur le terrain) et S.Y. Zhang (pour ses idées originales qui ont permis d’orienter le projet de recherche).
Un projet de cette envergure n’aurait pas été possible sans la participation de nombreux partenaires industriels qui ont collaboré aux différents volets du projet de recherche permettant ainsi d’augmenter la portée de cette étude. J’aimerais remercier Steve Bédard, François Guillemette ainsi que leur équipe de la Direction de la recherche forestière du Ministère des Forêts, de la Faune et des Parcs du Québec pour leur appui et leur collaboration au projet de recherche. De plus, mes sincères remerciements vont au Centre de recherche sur les matériaux renouvelables (CRMR), à la Coopérative Forestière des Hautes-Laurentides (CFHL), à l’École de foresterie et de technologie du bois de Duchesnay, au Groupement forestier de Portneuf, au Ministère des Forêts, de la Faune et des Parcs (MFFP), à la Station touristique de Duchesnay (SÉPAQ) et à FPInnovations. Merci infiniment à toutes les personnes de ces organismes qui ont collaboré de près ou de loin à cette étude.
Merci au Centre d’étude de la forêt (CEF) pour le financement des formations de perfectionnement et des conférences auxquelles j’ai participé tout au long de mon projet de recherche. Merci à Malcolm Cecil-Cockwell et John Caspersen pour leur accueil à l’Université de Toronto et à la forêt de Haliburton lors de l’été 2011. Ce séjour fut très agréable et formateur.
J’aimerais aussi remercier les membres de mon comité de thèse qui ont accepté d’examiner ce document : Julie Cool, Ph.D. (The University of British Columbia), Myriam Drouin, Ph.D. (FPInnovations) et Robert Beauregard, Ph.D. (Université Laval).
Je tiens à remercier particulièrement mes trois collègues de bureau et biologistes préférés, Kaysandra Waldron, Emmanuel Duchateau et Sébastien Lavoie. Que ce soit pour parler du travail, boire une bière ou socialiser, j’ai adoré vous côtoyer et vous avez rendu mes études plus agréables.
Merci à tous mes autres amis avec qui j’ai pu passer de bons moments tout au long de mes études : Anne Allard-Duchêne, Juliette Boiffin, Geneviève Bourgeois, Robin Colette, Joanie Couture, Roxane Hamel St-Laurent, Étienne Hubert-Legault, Antoine Marcoux, Édith Lachance, Claude Lefrançois, Pierre-Étienne Messier, Sacha Nandlall, Caroline Plante, Mylène Savard, Annie-Claude Taillon, Valérie Packwood-Vignet et Célia Ventura-Giroux.
Enfin, je veux remercier mes parents et ma famille qui m’ont toujours appuyé dans mon cheminement. Leur support inconditionnel est à la source de ma réussite.
Je garde un excellent souvenir de ces dernières années et je remercie du fond du cœur tous ceux et celles qui y ont contribué. Merci!
Avant-propos
Insertion d’articles
La présente thèse est composée de trois chapitres rédigés en anglais et présentés sous forme d’articles scientifiques dont je suis le premier auteur. En tant que candidat au doctorat, j'ai effectué une revue de littérature sur le sujet de recherche, établi les objectifs et les hypothèses de recherche, planifié et réalisé l'échantillonnage sur le terrain, réalisé les analyses statistiques et l’interprétation des résultats et rédigé l’ensemble de la thèse et des articles scientifiques qui y sont rattachés.
Chapitre 1
Havreljuk, F., Achim, A. and Pothier, D. 2013. Regional variation in the proportion of red heartwood in sugar maple and yellow birch. Can. J. For. Res. 43(3), 278–287. doi:10.1139/cjfr-2012-0479
Chapitre 2
Havreljuk, F., Achim, A., Auty, D., Bédard, S. and Pothier, D. 2014. Integrating standing value estimations into tree marking guidelines to meet wood supply objectives. Can. J. For. Res. 44(7), 750–759. doi: 10.1139/cjfr-2013-0407
Chapitre 3
Havreljuk, F., Achim, A. and Pothier, D. Predicting lumber grade occurrence and volume recovery in sugar maple and yellow birch logs. L’article sera soumis sous peu.
Les données brutes ayant servi à la réalisation de cette thèse ont été ajoutées sous forme de sommaires en annexe du document.
Coauteurs des chapitres
La rédaction de cette thèse de doctorat a été encadrée par Alexis Achim et David Pothier, mon directeur et mon codirecteur de thèse, respectivement. Ils sont les coauteurs de tous les chapitres puisqu’ils ont supervisé les travaux de recherche, m’ont conseillé et ont bonifié les
articles scientifiques. David Auty est le coauteur du second chapitre puisqu’il a participé aux analyses statistiques et à la révision grammaticale du texte. Steve Bédard est également coauteur du second chapitre car une partie de l’étude a pu être réalisée dans un dispositif de recherche du Ministère des Forêts, de la Faune et des Parcs du Québec sous sa responsabilité. Il a également apporté ses révisions au manuscrit.
Alexis Achim : Département des sciences du bois et de la forêt, Université Laval, 2405
rue de la Terrasse, Québec, Québec, Canada. G1V 0A6. Courriel : Alexis.Achim@sbf.ulaval.ca
David Pothier : Département des sciences du bois et de la forêt, Université Laval, 2405
rue de la Terrasse, Québec, Québec, Canada. G1V 0A6. Courriel : David.Pothier@sbf.ulaval.ca
David Auty : School of Forestry, Northern Arizona University, 200 East Pine Knoll
Drive, PO Box: 15018, Flagstaff, Arizona, USA. AZ 86011. Courriel : David.Auty@nau.edu
Steve Bédard : Direction de la recherche forestière, Ministère des Forêts, de la Faune et
des Parcs du Québec, 2700 rue Einstein, Québec, Québec, Canada. G1P 3W8. Courriel : Steve.Bedard@mffp.gouv.qc.ca
Diffusion des résultats
Il est à noter que les résultats présentés dans cette thèse ont été diffusés lors des conférences suivantes :
Havreljuk, F., Achim, A., Auty, D., Bédard, S. and Pothier, D. 2014. Integrating standing value estimations into tree marking guidelines to meet wood supply objectives. 7è Congrès Est du Canada et États-Unis d’Amérique en sciences forestières (eCANUSA). Rimouski, Québec. 16-18 octobre 2014.
Havreljuk, F., Achim, A. and Pothier, D. 2013. Variation régionale de la coloration de cœur chez l’érable à sucre et le bouleau jaune. Colloque du CEF (Centre d’étude de la forêt). Montebello, Québec, Canada. 24 avril 2013.
Havreljuk, F., Achim, A. and Pothier, D. 2012. Variation régionale de la coloration de cœur chez l’érable à sucre et le bouleau jaune. Colloque III (FOR-8001). Université Laval, Québec. 27 novembre 2012.
Havreljuk, F., Achim, A. and Pothier, D. 2012. Distribution régionale de la coloration de cœur chez l’érable à sucre et le bouleau jaune. Colloque facultaire FFGG, Université Laval, Québec. 15 novembre 2012.
Havreljuk, F., Achim, A. and Pothier, D. 2011. Peut-on ramener des considérations pour la qualité du bois dans nos stratégies sylvicoles en forêt feuillue ? Journée du CRB (Centre de recherche sur le bois), Université Laval, Québec, Canada. 25 novembre 2011. Havreljuk, F., Achim, A. and Pothier, D. 2011. Integrating Standing Value Estimations
into Québec's Tree Marking System for Hardwoods. International Scientific Conference on Hardwood Processing (ISCHP 3), Virginia Tech, Blacksburg, VA, USA. http://woodproducts.sbio.vt.edu/ischp2011/index.php. October 17, 2011.
Havreljuk, F., Achim, A. and Pothier, D. 2010. Distribution régionale de la coloration de cœur de l’érable à sucre. Journée du CRB (Centre de recherche sur le bois), Université Laval, Québec, Canada. 26 novembre 2010.
Havreljuk, F., Achim, A. and Pothier, D. 2010. Distribution régionale de la coloration de cœur de l’érable à sucre. Colloque du CEF (Centre d’étude de la forêt), Orford, Québec, Canada. 14 mars 2010.
Introduction générale
Les forêts feuillues du sud du Québec ont une grande importance économique en raison de leurs utilisations multiples, de la valeur de leurs bois et de la proximité des usines de transformation et des marchés. Les principales espèces utilisées par l’industrie des feuillus durs sont l’érable à sucre (Acer saccharum Marsh.) et le bouleau jaune (Betula alleghaniensis Britt.) (MRNFPQ et CRIQ 2003; MRNFQ et CRIQ 2007). Entre 2008 et 2012, la consommation totale de feuillus durs par les secteurs de transformation primaire du déroulage, du sciage, des panneaux, des pâtes et papiers et du bois de chauffage était en moyenne de 6 461 000 m³ (MRNQ 2013). Toutefois, cette industrie a dû composer avec un contexte économique défavorable, ce qui a contribué à ralentir les activités de ce secteur ces dernières années. D’ailleurs, durant cette période, la récolte des feuillus dans les forêts publiques et privées du Québec ne s’est élevée qu’au tiers de la possibilité forestière totale (CIFQ 2008, 2012).
Outre les problèmes associés au contexte économique, ceux liés à l’approvisionnement des entreprises œuvrant dans le domaine des feuillus durs pourraient aussi être responsables de la diminution de la récolte du bois. Depuis plusieurs années déjà, l’industrie des feuillus durs fait face à la rareté des sciages de qualité supérieure des bois traditionnellement utilisés, comme l’érable à sucre et le bouleau jaune (CRIQ 2002; MRNFPQ et CRIQ 2003; MRNFQ et CRIQ 2007, 2008). À la fin des années 1980, les coupes à diamètre limite, qui ont eu pour effet de dégrader le massif forestier et de réduire la qualité des bois sur pied (Metzger et Tubbs 1971; Robitaille et Roberge 1981; Nyland 1992; Bédard et Majcen 2001; Bureau du Forestier en chef 2012), ont été remplacées par les coupes de jardinage. En permettant de régénérer et d'éduquer le peuplement tout en récoltant un certain volume de bois, la coupe de jardinage vise à maintenir, voire améliorer, la productivité des forêts feuillues en prélevant les arbres en perdition qui mourront avant la prochaine intervention (Arbogast 1957; Majcen et al. 1990; Nyland 1998). Par conséquent, les taux d’accroissement et de survie, ainsi que la qualité des arbres du peuplement résiduel dépendent de la stratégie de sélection des tiges destinées à la récolte. Pour cette raison, il importe de pouvoir relier l’évaluation visuelle des arbres effectuée lors des inventaires forestiers à la répartition du volume de bois par type
d’usine et à la qualité des produits transformés. Cette tâche est toutefois complexifiée par la difficulté de relier l’apparence externe d’un arbre à la qualité interne de son bois.
Chez l’érable à sucre et le bouleau jaune, l’apparence visuelle du bois est une variable déterminante de sa qualité puisqu’il sert surtout à la fabrication de meubles ou de parquets (CRIQ 2002). La coloration de cœur est une des caractéristiques du bois de ces espèces qui peut affecter leur qualité pour de tels usages. Elle fait référence à la modification uniforme ou irrégulière de la couleur originale du bois d’une espèce donnée vers des teintes rougeâtres ou brunâtres (Campbell et Davidson 1941; Shigo 1967). Techniquement, la coloration de cœur est uniquement un critère visuel et esthétique n’affectant pas les propriétés mécaniques de l’arbre (Shmulsky and Jones 2011). Par contre, dépendamment des tendances du marché, des modes et des traditions, elle peut avoir un impact important sur la valeur du bois d’érable à sucre et de bouleau jaune. Cette caractéristique est généralement considérée comme indésirable puisqu’elle diminue la valeur des produits (Erickson et al. 1992; Hardwood Market Report 2011).
Chez l’érable à sucre et le bouleau jaune, la coloration de cœur est d’origine traumatique (Shigo 1966; Shigo 1967; Davidson et Lortie 1969; Shigo et Hillis 1973; Boulet 2007; Belleville et al. 2011; Drouin et al. 2009), contrairement à certaines autres espèces pour lesquelles un processus de coloration relié à la formation de duramen est en place. Chez les deux espèces ciblées par ce projet, elle serait le résultat d’une série de processus liés aux blessures, à l’oxydation des tissus et à l’action des microorganismes dans le bois (Shigo 1966; Shigo 1967; Shigo et Larson 1969; Shigo et Hillis 1973; Solomon et Shigo 1976; Basham 1991). Les blessures, qu’elles soient causées par les branches mortes, les animaux ou l’exploitation forestière, constitueraient une porte d’entrée potentielle pour la coloration en exposant le bois du tronc aux conditions atmosphériques externes. Cette hypothèse est appuyée par des études récentes qui ont établi des liens étroits entre les défauts externes (nombre de branches mortes, nœuds, blessures et fourches) et la présence de coloration du cœur (Knoke 2003; Wernsdorfer et al. 2005; Belleville et al. 2011). La réaction initiale d’un arbre à la suite d’une blessure serait seulement liée à des processus chimiques impliquant, d’une part, la production des composés phénoliques et, d’autre part, l’oxydation du bois
hyménomycètes peuvent infecter la blessure et amplifier le processus de coloration (Campbell et Davidson 1941; Shigo 1966; Shigo et Hillis 1973; Sorz et Hietz 2008). Dans certains cas, la coloration de cœur peut être suivie par un envahissement des champignons hyménomycètes qui causent une dégradation du bois (Shigo 1966; Shigo 1967; Shigo et Hillis 1973; Basham 1991).
Les études menées depuis une quarantaine d’années sur les feuillus durs de l’est de l’Amérique du Nord et en Europe ont permis de mieux comprendre le développement de la coloration de cœur à l’échelle de l’arbre. La coloration est influencée par l’âge, la sévérité et la taille de la blessure (Shigo 1966), ainsi que par le diamètre, la hauteur et l’âge des arbres (Campbell et Davidson 1941; Knoke 2003; Wernsdorfer et al. 2006; Giroud et al. 2008; Drouin et al. 2009). La vigueur des arbres semble aussi jouer un rôle déterminant (Shigo et Hillis 1973; Drouin et al. 2009; Baral et al. 2013). La coloration du bois est un processus lent dont le développement prend des semaines (Sorz et Hietz 2008). Le bois qui est formé à la suite d’une blessure ne sera généralement pas coloré, la coloration se limitant plutôt aux tissus formés avant la blessure et se propageant vers l’intérieur de l’arbre (Solomon et Shigo 1976; Basham 1991). Le développement de la coloration est plus rapide selon l’axe longitudinal que l’axe radial de la tige, ce qui crée typiquement une colonne de coloration dans le tronc (Campbell et Davidson 1941; Shigo et Larson 1969). Elle suit rarement une disposition uniforme dans la tige, étant donné qu’elle est produite par la fusion de plusieurs colonnes de coloration créées à des moments différents et selon diverses proportions (Campbell et Davidson 1941; Shigo 1966). Toutefois, des études récentes ont permis de montrer que le diamètre de la zone colorée diminue en montant dans l’arbre et prend un aspect généralement fusiforme (Hallaksela et Niemisto 1998; Wernsdorfer et al. 2006; Giroud et al. 2008; Belleville et al. 2011).
Malgré les nombreuses avancées dans la compréhension des facteurs affectant le développement de la coloration à l’échelle de l’arbre, nous sommes toujours confrontés aux incertitudes face aux facteurs qui influencent sa présence à une échelle plus vaste. Bien qu’elle ait un impact majeur sur la qualité des approvisionnements, la distribution de la coloration chez l’érable à sucre et le bouleau jaune entre les différentes régions du Québec demeure peu documentée. Nous ne sommes donc pas en mesure de déterminer si le processus
de coloration de cœur peut être lié à des facteurs caractérisant les échelles du peuplement ou de la région. Pourtant, des éléments nous font penser que l’influence du milieu et des conditions de croissance pourraient effectivement avoir un effet important sur son développement. En effet, plusieurs intervenants du milieu forestier prétendent que la coloration de cœur chez l’érable à sucre et le bouleau jaune varie selon la provenance des bois. Certains documents en font vaguement mention (Davidson et Lortie 1969; Boulet 2007; Wiedenbeck et al. 2004), même si l’effet régional de la coloration n’a pas été observé chez l’érable à sucre (Yanai et al. 2009). Quelques rares études (Climent et al. 2002) ont aussi montré que le climat et le milieu de croissance pouvaient influencer le développement de la coloration chez les espèces où un vrai processus de formation du duramen était en place. Cependant, à notre connaissance, aucune étude précise n’a permis de démystifier le rôle joué par le milieu de croissance dans la coloration de cœur de l’érable à sucre et du bouleau jaune. En plus du manque de connaissances sur la distribution de la coloration de cœur des principales espèces feuillues au Québec, l’industrie forestière fait aussi face aux incertitudes liées à l’approvisionnement en bois feuillu qui découlent directement du système actuel de marquage de tiges pour la récolte. Même si plusieurs variantes de la coupe de jardinage ont vu le jour depuis son instauration en 1987, le mode de récolte est principalement axé vers le jardinage par pied d’arbre ou par petit groupe d’arbres (Majcen et Richard 1992; Bédard et Majcen 2001). Cette façon de faire vise à imiter le régime de perturbations naturelles des forêts feuillues du Nord-Est de l’Amérique du Nord, produisant surtout une mortalité à l’échelle de l’arbre ou du groupe d’arbres (Lorimer et Frelich 1994; Seymour et al. 2002). Ainsi, depuis l’utilisation de normes de marquage associées au jardinage et aux autres types de coupe partielle, les industries s’approvisionnant sur terres publiques n’ont pas accès à l’ensemble des arbres d’un peuplement. Ces règles, jumelées à l’état des peuplements, déterminent donc la qualité des approvisionnements pour les différents produits de transformation envisagés (déroulage, sciage, pâte). Ainsi, même si un volume de bois est alloué à une usine, son approvisionnement n’est pas assuré puisque la qualité des bois marqués peut ne pas correspondre aux besoins réels de cette usine. Pour assurer l’approvisionnement des usines de transformation de bois feuillu, le défi ne consiste donc pas seulement à garantir un volume de bois récoltable, mais bien à déterminer un volume
mesure de relier le classement visuel des arbres sur pied effectué lors des inventaires forestiers et la répartition du volume de bois par type d’usine et, idéalement, par classe de qualité de produits transformés.
Depuis l’instauration des coupes de jardinage, le système de classement visuel utilisé pour sélectionner les arbres destinés à la récolte a subi de nombreux changements. Jusqu’au milieu des années 2000, c’est un système de marquage hybride (I-II-III-IV), tenant compte de la vigueur et de la qualité des arbres, qui fût appliqué (Majcen et al. 1990). Le jardinage basé sur le marquage de tiges selon ce système a fait ses preuves à l’échelle expérimentale (Majcen et Richard 1992; Majcen 1996; Bédard et Majcen 2001; Coulombe et al. 2004; Majcen et al. 2006). Par contre, son application à l’échelle industrielle n’a pas permis d’atteindre les objectifs visés. Coulombe et al. (2004) ont souligné que les pratiques de marquage de l’industrie de transformation étaient non conformes aux principes de la coupe de jardinage visant à améliorer la productivité des forêts et à augmenter la production en bois d’œuvre de feuillus durs. Dans leur suivi des effets réels des coupes de jardinage dans les forêts publiques du Québec de 1995 à 1998, Bédard et Brassard (2002) ont mis en évidence le fait que l’accroissement net des peuplements jardinés dans les dispositifs de recherche du Ministère des Forêts, de la Faune et des Parcs du Québec (MFFPQ) était plus de deux fois supérieur à celui enregistré dans les peuplements jardinés dans le cours normal des opérations des entreprises forestières. Ces difficultés d’application à l’échelle industrielle ont été associées au choix inadéquat des arbres à prélever. Selon plusieurs intervenants, le système de sélection de Majcen et al. (1990) laissait trop de latitude et d’interprétation aux marteleurs. Face à cette problématique et aux recommandations de la Commission d'étude sur la gestion de la forêt publique québécoise (Coulombe et al. 2004), le MFFPQ a raffiné le système de classification des arbres feuillus du Québec.
La nouvelle classification est issue d’un système basé sur des connaissances pathologiques appliquées surtout pour déterminer la vigueur des arbres (Boulet 2007). Quatre priorités de récolte (M-S-C-R) guident l’ordre de sélection des tiges en fonction de défauts pathologiques, morphologiques ou mécaniques précis. Ces défauts sont reliés à une évaluation de la probabilité de mortalité d’un arbre avant la prochaine rotation (Boulet 2007). La classification priorise la récolte des arbres mourants et dont la survie semble être
compromise (classes M et S). Ainsi, ce système vise la restauration des forêts feuillues, mais il ne considère pas directement les variables déterminant la qualité des arbres. Fortin et al. (2009b) ont déterminé que la capacité du système de classification MSCR à établir la répartition du volume des arbres par classe de qualité est globalement faible. Conséquemment, l’instauration de ce système est venue exacerber le problème d’approvisionnement décrit plus haut. La situation pourrait être améliorée en jumelant des classes de qualité au système MSCR (Fortin et al. 2009b). Des efforts ont été consentis en ce sens avec l’intégration de classes de qualité additionnelles (classes O et P) (MRNFQ 2006), mais le gain en précision apportée par ces nouvelles classes n’a jamais été quantifié. Dans une perspective d’amélioration des prévisions d’approvisionnements, l’apport de nouvelles variables prédictives, à l’échelle de l’arbre et du peuplement, devrait aussi être évalué. Afin d’atteindre le plein potentiel de mise en valeur des forêts feuillues, le système de marquage doit permettre l’atteinte de l’objectif sylvicole, par le prélèvement des arbres dépérissants, mais aussi celui d’approvisionnement qui affecte la viabilité des usines de transformation. Une part des éléments déterminant la qualité du bois des feuillus durs est reliée à des facteurs morphologiques facilement évaluables par des systèmes de classification visuelle. D’autres facteurs, comme la coloration de cœur, sont reliés à des facteurs internes. Il importe, dans un premier temps, de mieux comprendre les facteurs faisant varier la qualité des approvisionnements et, dans un second temps, d’inclure ces derniers dans nos systèmes guidant la sélection des tiges.
Démarche méthodologique
L’objectif général de ce projet de recherche était d’améliorer les prévisions d’approvisionnement des usines de transformation de bois feuillu à partir d’une meilleure évaluation de la qualité des arbres feuillus sur pied. L’approche proposée par cette étude vise à préciser la répartition géographique de la coloration de cœur tout en établissant des liens étroits entre l’évaluation visuelle des arbres sur pied, leur vigueur et la valeur des produits transformés en usine. L’ensemble du projet de recherche porte sur l’étude de deux principales espèces feuillues du Québec, l’érable à sucre et le bouleau jaune.
Le premier chapitre de la thèse porte sur la distribution régionale de la coloration de cœur de l’érable à sucre et du bouleau jaune. Douze localisations couvrant l'ensemble de la forêt tempérée du sud du Québec ont été échantillonnées afin de quantifier la variation de la proportion de la coloration de cœur à l’échelle de la province.
L’objectif du second chapitre était d’améliorer les directives de martelage, présentement axées uniquement sur la vigueur, en déterminant les principales variables qui affectent la valeur monétaire de l’érable à sucre et du bouleau jaune sur pied. Afin d’identifier les arbres moribonds pouvant produire au moins une bille de sciage, un mesurage détaillé, incluant une caractérisation de tous les défauts externes, a été effectué sur 96 arbres répartis dans deux stations. Ce même échantillonnage a également servi à réaliser le troisième volet de cette thèse.
Le troisième chapitre de la thèse vise à décrire le lien entre les caractéristiques des billes destinées au sciage et les planches produites. Plus précisément, le but de ce volet était de bâtir un modèle de prévision de l’occurrence et du volume des grades et des catégories de couleur des planches sciées en fonction des caractéristiques des billes d’érable à sucre et de bouleau jaune. Les résultats de ce volet permettent de caractériser le panier de produits découlant du sciage et peuvent servir à établir la valeur monétaire des bois.
Afin de prendre en considération les principales variables liées à la valeur des arbres feuillus sur pied, les aspects de qualité de l’érable à sucre et du bouleau jaune, traités dans cette thèse, sont abordés à deux échelles. Le premier volet aborde la distribution de la coloration de cœur à l’échelle régionale. Les chapitres deux et trois, pour leur part, sont axés sur une évaluation visuelle aux échelles des arbres et des billes, en établissant des liens étroits avec la valeur et la qualité des produits transformés en usine. Le dernier chapitre permet également de faire le lien avec les deux premiers volets de la thèse, en caractérisant l’effet de la coloration de cœur sur le panier de produits et, ultimement, sur la valeur monétaire des arbres. Ainsi, les ajustements proposés fourniront un outil d’aide à la décision au MFFPQ lui permettant d’attribuer, avec plus de précision, des volumes de bois aux différents types d’usines de transformation (déroulage, sciage, pâte). De plus, ces résultats permettront de mieux caractériser les peuplements forestiers lors de l’éventuelle vente aux enchères de leur bois.
Chapitre 1
Regional variation in the proportion of red heartwood in
sugar maple and yellow birch
1
1 Version intégrale d’un article publié / Intergral version of a published paper:
Havreljuk, F., Achim, A. and Pothier, D. 2013. Regional variation in the proportion of red heartwood in sugar maple and yellow birch. Can. J. For. Res. 43(3), 278–287. doi:10.1139/cjfr-2012-0479
Abstract
Stems of sugar maple (Acer saccharum Marsh.) and yellow birch (Betula alleghaniensis Britt.) trees often contain a column of discoloured wood known as red heartwood, which reduces lumber value. To quantify the regional-scale variation in red heartwood, 192 trees of each species were sampled in 12 locations across the temperate forest zone of southern Québec, Canada. Large regional variation in the radial proportion of red heartwood (RHP) at breast height (1.3 m) was observed in both species. Statistical modeling showed that such variation was mainly attributable to factors related to tree development. Cambial age had a strong positive effect on RHP in both species, suggesting that the occurrence of red heartwood ultimately might be unavoidable. There was also a positive effect of ring area increment at the limit of the discoloured zone. In the case of sugar maple, there was an added effect of the trend in ring area increments observed in the same zone, with a negative trend being generally indicative of a larger RHP. Further variability in this species was also associated with the annual minimum temperature of the sampling locations. The models developed for each species explained around 60% of the variance in RHP and could be used to improve forest management and wood procurement decisions.
Keywords: sugar maple, yellow birch, red heartwood, wood discoloration, appearance wood products, regional climate.
Résumé
Les tiges d'érable à sucre (Acer saccharum Marsh.) et de bouleau jaune (Betula alleghaniensis Britt.) contiennent fréquemment une colonne de bois brun-rougeâtre, appelée coloration de cœur, qui réduit la valeur des produits du bois. Afin d'en quantifier la variation à l'échelle régionale, 192 arbres de chaque espèce ont été échantillonnés dans 12 localisations couvrant l'ensemble de la forêt tempérée du sud du Québec, Canada. Une variation régionale élevée de la proportion radiale de la zone colorée (PRC) à hauteur de poitrine (1,3 m) a été observée chez les deux espèces. La modélisation statistique a révélé que cette variation était principalement attribuable à des facteurs liés au développement des arbres. L'âge cambial avait un effet positif sur la PRC des deux espèces, ce qui indique que l'occurrence de la coloration de cœur serait ultimement inévitable. Un effet positif de la superficie des anneaux de croissance à la limite de la zone colorée a aussi été observé. Dans le cas de l'érable à sucre, il y avait un effet additionnel de la tendance de l’accroissement en superficie des anneaux dans la même zone, les tendances négatives étant généralement indicatrices d'une PRC plus élevée. Une partie de la variabilité chez cette espèce était aussi associée à la température minimale annuelle d'une localisation. Les modèles mis au point pour chaque espèce expliquent près de 60 % de la variance et pourront être utilisés pour améliorer les décisions liées à l'aménagement forestier et aux approvisionnements en bois.
Mots-clés : érable à sucre, bouleau jaune, cœur rouge, coloration du bois, produits d’apparence, climat régional.
Introduction
Sugar maple (Acer saccharum Marsh.) and yellow birch (Betula alleghaniensis Britt.) are dominant components of the North American temperate deciduous forests. Both tree species are commercially important, especially as raw material for appearance wood products such as furniture, flooring, cabinets, and interior finishing (CRIQ 2002). Accordingly, the wood quality and market value of sugar maple and yellow birch depend on the visual characteristics of sawn boards.
Red heartwood is one of the most important appearance criteria for such products. Also referred to as red heart, heartwood discolouration, staining heart, traumatic heartwood, false heartwood, pathological heartwood, and, mistakenly, as mineral stain, it consists of a uniform or irregular change of the original wood colour to a darker reddish-brown colour (Campbell and Davidson 1941; Shigo 1966, 1967; Hillis 1987; Basham 1991; Erickson et al. 1992; Hallaksela and Niemisto 1998; Drouin et al. 2009). Although the presence of uniform red heartwood is desirable for some end-uses, the simultaneous presence of light-coloured sapwood and red heartwood is generally considered unappealing by consumers. As a result, heartwood discolouration significantly reduces lumber value (Erickson et al. 1992; Hardwood Market Report 2011).
Whereas coloured heartwood in some other species, like oak and cherry, is part of a normal aging process (Hillis 1987), heartwood discolouration in sugar maple and yellow birch is believed to originate from trauma (Shigo 1966; Davidson and Lortie 1969; Shigo and Hillis 1973). Injuries to the stem may induce wood oxidation and microbial activity, which can result in discolouration (Shigo 1967; Solomon and Shigo 1976). Red heartwood does not affect wood mechanical properties (Shmulsky and Jones 2011), but could be followed by an invasion of hymenomycete fungi that cause wood decay (Basham 1991).
To date, research has focused on the development and within-tree distribution of red heartwood. Some studies have found a relationship between the proportion of red heartwood and tree diameter, height, and age (Campbell and Davidson 1941; Knoke 2003; Wernsdorfer
size of bole injuries induced by logging (Shigo 1966), further supporting the trauma hypothesis. Recent studies on European beech (Fagus sylvatica L.) and paper birch (Betula papyrifera Marsh.) provided more evidence by demonstrating direct relationships between external defects (e.g., number of dead branches, knots, injuries, and forks) and the occurrence and extent of red heartwood (Knoke 2003; Wernsdorfer et al. 2005; Belleville et al. 2011). Little scientific attention has been paid to the factors that may explain regional-scale variation, despite the potential benefits that might accrue to members of the wood products supply chain, where these variations are understood. Some stand-level variation in red heartwood occurrence has been reported for several hardwood species (Davidson and Lortie 1969; Wiedenbeck et al. 2004). Soil fertility might be responsible for site-to-site differences, although this was not found to be the case in a study conducted in the northern United States (Yanai et al. 2009). Regional differences might also be attributable to variation in radial growth rate, which is related to the size of defects and the time to wound closure (Solomon and Blum 1977; Vasiliauskas 2001). Alternatively, regional differences in red heartwood development might originate from climatic factors, which are known to regulate tree growth and physiological processes (Pither 2003; Klos et al. 2009). Some observations suggest that the proportion of red heartwood generally increases in colder climates (Wiedenbeck et al. 2004). This could be related to the increased occurrence of external stem defects towards the northern limit of the sugar maple distribution range (Burton et al. 2008). For example, defects such as frost cracks are frequently accompanied by discoloured and decayed wood (Shigo 1966, 1967; Davidson and Lortie 1969).
The reasons for initiating this study were first to describe the variation in red heartwood proportion at a regional scale and second to attempt to explain the observed differences. Our underlying hypothesis was that, if regional variation in red heartwood proportion actually exists, it can be explained by differences in tree age and radial growth rate alone. Rejection of this hypothesis would imply an additional influence of other factors, such as stand-level variables (e.g., basal area, number of stems per hectare, etc.). Red heartwood was found to propagate longitudinally along the annual rings forming a column of discoloured wood (Hallaksela and Niemisto 1998; Wernsdorfer et al. 2005; Giroud et al. 2008). The diameter of the heartwood zone has also been positively related to the number and size of dead branch
scars (Solomon and Shigo 1976; Belleville et al. 2011), which are factors closely related to tree age and radial growth rate.
Materials and methods
Study sites and field measurements
Twelve sampling regions were selected across the temperate forest zone of southern Québec, Canada (Figure 1.1). The sites were all located on public land, within the sugar maple – yellow birch or the balsam fir (Abies balsamea [L.] Mill.) – yellow birch bioclimatic domains (Saucier et al. 1998) (Table 1.1).
Table 1.1 Summary of sampling locations used in the study.
Region
ID Name Bioclimatic domain Bioclimatic subdomain Ecological region Elevation range (m)
1 Témiscamingue Sugar maple – yellow birch West 3a 325-385
2 Rapides-des-Joachims Sugar maple – yellow birch West 3a 245-315
3 Réservoir Cabonga Balsam fir– yellow birch West 4b 395-405
4 Outaouais Sugar maple – yellow birch West 3b 325-410
5 Ste-Véronique Sugar maple – yellow birch West 3b 345-370
6 Mauricie Sugar maple – yellow birch East 3c 275-345
7 Portneuf Balsam fir– yellow birch West 4c 375-495
8 Duchesnay Balsam fir– yellow birch East 4d 225-295
9 Lac Mégantic Sugar maple – yellow birch East 3d 545-590
10 Montmagny Sugar maple – yellow birch East 3d 360-380
11 Charlevoix Balsam fir– yellow birch East 4d 295-345
12 Squatec Balsam fir– yellow birch East 4f 365-415
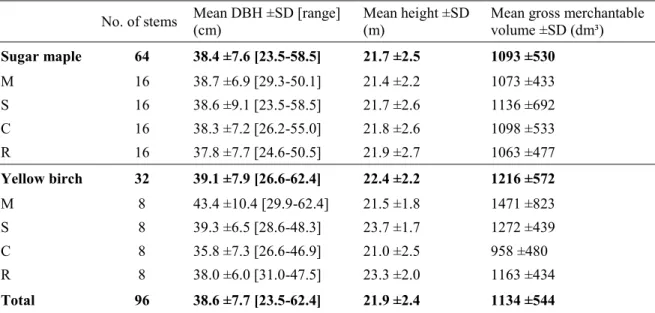
We restricted the choice to uneven-aged stands with a main canopy dominated by mature sugar maple and (or) yellow birch trees established on glacial tills deeper than 50 cm, and characterized by mesic conditions (average fertility and drainage). Recently harvested sites (<10 years) and those with severe past biotic and abiotic disturbances were rejected from the sampling. Once these criteria were defined, we collaborated with local authorities to create a bank of potential sampling sites in each region using forest cover maps. A random list of potential sites was then generated and these were either rejected or retained based on field validations of the criteria, until two study sites were selected for each species in each region. Sampling of both species was possible at eight sites that met the selection criteria. Stand structure and composition were measured using variable-radius plots. Two plots were established for sampling sites covering less than one hectare and one additional plot was established for each additional hectare.
To minimize variability between trees and focus on regional variation, the sampling was limited to trees with a diameter between 23.1 and 33.0 cm at breast height (DBH, 1.3 m above the ground). This range corresponds to the small sawlog timber category of the hardwood tree grading system (Hanks 1976; Monger 1991). To limit the variability associated with factors other than regional climate, site properties, and tree growth, only vigorous trees were selected using the tree-marking criteria of Boulet (2007). To facilitate the sampling of undamaged cores, trees with pathogens and severe wounds were avoided, since these are
often associated with stem decay. Trees were also rejected if they had an abnormal number of dead branches or other obvious external initiation points for red heartwood (Belleville et al. 2011) on the lower 5 m of the stem. The sampling was also limited to trees with a dominant and codominant position in the main canopy. Following these criteria, eight sample trees per species per site were randomly selected for sampling.
On each sample tree, DBH and total tree height were recorded (Table 1.2) and then an increment core sample was taken at breast height. To control for any potential effects of trees growing on an incline, cores were consistently sampled from the uphill side of each tree. The core samples provided an assessment of red heartwood and radial growth rate in the butt log, which is the most valuable part of the tree (Fortin et al. 2009b). In addition, maximum heartwood area is located around breast height (Hillis 1987; Giroud et al. 2008).
Table 1.2 Mean sample tree characteristics. SD is the standard deviation.
Sugar maple Yellow birch
Variable Mean ± SD Range Mean ± SD Range
Dbh (cm) 28.3 ± 2.8 23.1 – 33.0 28.0 ± 2.7 23.1 – 33.0
Height (m) 20.6 ± 2.2 15.1 – 26.1 19.7 ± 2.1 14.6 – 26.4
Age (years) 93 ± 22 57 – 155 83 ± 23 31 – 153
Sample core processing
All cores were air-dried and progressively sanded down to allow a clear identification of growth rings. A total of 192 sugar maple and 192 yellow birch cores were processed and scanned at high resolution using an optical scanner (Epson GT-15000, Japan).
The distinction between discoloured heartwood and light-coloured wood was in most cases abrupt but was harder to detect in some samples owing to a gradual transition. To avoid subjectivity, the limit between discoloured and noncoloured wood was determined in a two-step method using the image-processing software ImageJ (Abramoff et al. 2004). First, a threshold function was executed to divide the scanned image into either features of interest (i.e., red heartwood and sapwood) or background. An iterative threshold selection procedure was applied (Ridler and Calvard 1978). In the second step, the noise generated by the
threshold method was removed to obtain a clear boundary between red heartwood and sapwood area (Figure 1.2).
Figure 1.2 Illustration of the red heartwood separation procedure performed using ImageJ. (A) Initial image. (B) The resulting image after applying the threshold function. (C) The final image after the noise from the threshold function was removed.
All samples were processed individually using the same procedure. They were calibrated and corrected for any artifacts and (or) breakages, to ensure that accurate lengths were used in subsequent analyses. Some samples were soaked in water to improve the contrast between the discoloured and noncoloured wood. The total radial core length (from pith to bark) and the length of discoloured wood were measured on each sample.
Tree-ring increments were measured using the semiautomatic image analysis system WinDendro (Guay et al. 1992). To ensure accuracy, samples were first analyzed under a magnifying glass and the less discernible rings were marked with a pencil. Annual ring width increments were converted into ring area increments using the method described by LeBlanc (1996). Following previous studies (Shigo 1966, Hallaksela and Niemisto 1998; Wernsdorfer et al. 2005), red heartwood was assumed to be symmetrically distributed around the pith, and, therefore, the radial measurements on each core were converted into area values that assumed circularity of the stems.
Climatic characterization
The climatic data used in our analyses were generated by BioSIM (Régnière et al. 2012). This software computes annual climatic variables for a given site using the North American Normals database (Canada–USA 1981–2010), which contains monthly statistics over the most recent 30-year period before the trees were sampled. Geographic coordinates of latitude, longitude, and elevation from all study sites were set as BioSIM inputs. The software was parameterized to generate climate information using an interpolation between the eight
closest available weather stations. BioSIM is a simulator that generates a series of daily values with a random component. Averages are reported along with their mathematical expectation of average, variance, autocorrelation, and cross-correlation of minima and maxima. All simulations were conducted in a single operation with 500 iterations to ensure regular results. More than 20 climatic variables were generated using this method.
Statistical analysis
The dependent variable used in this study was the red heartwood proportion (RHP) at 1.3 m in height, representing the ratio of the discoloured wood radius to the total radius of the core. This choice was made to reflect the typical grade sawing of hardwoods (Steele 1984), which consists of extracting noncoloured wood boards from the bark towards the pith until the discoloured core is reached. The radial proportion of discoloured wood was preferred to the cross-sectional area proportion as it was found to be normally distributed.
All statistical tests were performed using the R statistical programing software (R Development Core Team 2012). Mixed linear models were developed for each species separately using the nlme package. Region and site nested in region were considered as random effects, in accordance with the sampling strategy (Gelman and Hill 2007). The initial steps of the analysis aimed to describe the local and regional patterns of variation in red heartwood. To assess the importance of different variables associated with RHP, models were compared using the corrected Akaike information criterion (AICc) (Burnham and Anderson 2002). This statistic was used to guide model development by balancing the fit (i.e., log-likelihood) and parsimony (i.e., number of parameters) of each model. To avoid over-fitting and reporting spurious effects, a limited set of candidate models were used to test biologically plausible hypotheses (Burnham and Anderson 2002; Anderson 2008).
Model development
Twenty a priori multilevel linear models were developed and compared to identify the main factors related to RHP in sugar maple and yellow birch. The first group of candidate models included individual tree descriptors such as tree height and age (i.e., cambial age at 1.3 m),
which are known to be associated with red heartwood size in other hardwood species (Wernsdorfer et al. 2006; Giroud et al. 2008).
A second group of candidate models was created to describe tree development. The explanatory variables “growth rate”, or periodic annual increment, and “growth trend”, representing the rate of change in mean annual growth within a given time period (Bigler and Bugmann 2003), were derived from annual ring increments. Such variables have been used successfully in mortality models because of their link with tree vigor (Bigler and Bugmann 2003; Hartmann et al. 2008). Both variables were represented using ring area increments (RAI, cm2/year), which are recognized as a more meaningful indicator of tree growth and
vigor than ring width (LeBlanc 1996). Five year growth rate was measured on each sample in a period that ended at the discoloured wood boundary (RAIBC5). This variable was deemed
to be representative of the size of the live crown (Valentine and Mäkelä 2005) and hence the number and size of live branches at the time when the ring at the edge of the discoloured zone was formed. Likewise, the slope of a local linear regression applied to ring area over a period of 10 years spanning the current boundary between discoloured and noncoloured wood (i.e., five rings on each side) (SLR10) was used as a potential explanatory variable. This
was deemed to represent the growth trend at the time when the ring at the limit of the discoloured zone was formed. If RAIBC5 can be considered as an indicator of the number and
size of the live branches present at that time, SLR10 could be indicative of further growth
prior to branch death. A 10 year time interval was chosen in this case to increase the number of points in the regression and limit the influence of unusually large or narrow rings on the obtained value. Average annual tree increment (AAI) over the whole pith-to-bark profile was used as a long-term measure of tree vigor. Because this variable was not normally distributed, a logarithmic transformation was applied prior to model fitting.
The third set of candidate models included the basal area of the stand (StandBA, m2/ha). It
was hypothesized that RHP would be positively correlated with basal area because increased competition for light may lead to faster crown recession and, therefore, to increased branch mortality (Shmulsky and Jones 2011).
Climatic variables were then added to the fourth group of candidate models. Only a limited number of climatic variables generated by BioSIM and those relevant to our hypotheses were chosen based on preliminary analyses and data exploration. Explanatory variables related to temperature (annual means and extremes) and precipitation (annual sums) were included in the final set of candidate models.
Finally, an intercept-only model was added to ensure it did not perform better than more complex models. A summary of all candidate variables is presented in Table 1.3.
Table 1.3 List of explanatory variables screened in the modeling process. Variable Description
Age (years) Cambial age at 1.3 m
Height (m) Height of the tree
AAI (cm2/year) Log-transformed mean ring area increment
RAIBC5 (cm2/year) 5-year mean ring area increment at the limit of the red heartwood zone
SLR10 Linear regression slope of ring area values over 10 years spanning the limit of the red
heartwood zone (i.e., 5 rings on each side) StandBA (m2/ha) Stand basal area
LTMin (°C) Annual lowest daily minimum temperature
MTMean (°C) Annual mean daily average temperature
Precip (mm) Annual total precipitation
Autocorrelation between variables was checked during the model construction process using a variance inflation factor (VIF) (Zuur et al. 2010). The usual assumptions for regression analysis were checked and no problems were detected. All selected models presented normally distributed errors, homogeneous variances and no extreme values. For the simplification of interpretation and to limit the number of candidate models, only additive effects were considered (i.e., no interactions). Before model comparison, four sugar maple and five yellow birch trees were rejected from the analyses because of missing discoloured heartwood and thus RAIBC5 and SLR10 data. Model selection was performed using the
AICcmodavg package in R (Mazerolle 2012). This allowed uncertainties regarding the selection of the best model to be assessed using a model averaging technique (also referred to as “multimodel inference”). The package computes the weighted estimates of the predictions for a given predictor variable across all models. The weighting of parameter estimates is given by the model probabilities, which are derived from Akaike's weights. For
a detailed description of this approach see Burnham and Anderson (2002) or Mazerolle (2006).
Results
Of the 192 samples per species, only four sugar maple and five yellow birch cores did not contain discoloured heartwood. The mean radial proportions (±SD) of red heartwood were 36.4 ± 14.9% and 36.8 ± 15.5% for sugar maple and yellow birch, respectively. Important variations of RHP were observed between the sampling regions (Figure 1.3).
Figure 1.3 Mean red heartwood proportion (RHP) for sugar maple and yellow birch in the 12 sampling regions. Two study sites are included in each region and eight trees were sampled from each site. Error bars represent standard errors.
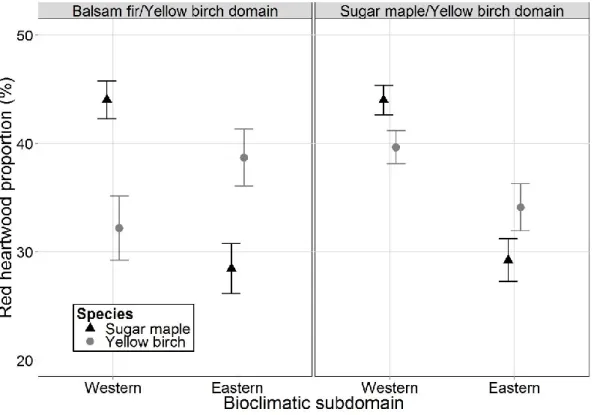
There were no differences in RHP between bioclimatic domains, but significant differences (p < 0.05) were detected between subdomains. In sugar maple, mean RHP was approximately 44% in the western bioclimatic subdomains, compared with 29% in the eastern subdomains. However, no such trend was observed for yellow birch (Figure 1.4).
Figure 1.4 Mean red heartwood proportion (RHP) for sugar maple and yellow birch across bioclimatic subdomains. Eastern Balsam fir – Yellow birch subdomain (n = 92), Western Balsam fir – Yellow birch subdomain (n = 64), Eastern Sugar maple – Yellow birch subdomain (n = 92), and Western Sugar maple – Yellow birch subdomain (n = 128). Error bars represent standard errors.
The mean age of trees sampled in the western subdomains was greater (97 and 86 years for sugar maple and yellow birch, respectively) than in their eastern counterparts (88 and 78 years for sugar maple and yellow birch, respectively). Annual ring measurements on the sample cores revealed that (i) age varied substantially between the samples despite the limited range of DBH and (ii) RHP was strongly related to age for both species (Figure 1.5).
Figure 1.5 Number of discoloured wood rings as a function of the total number of rings at 1.3 m.
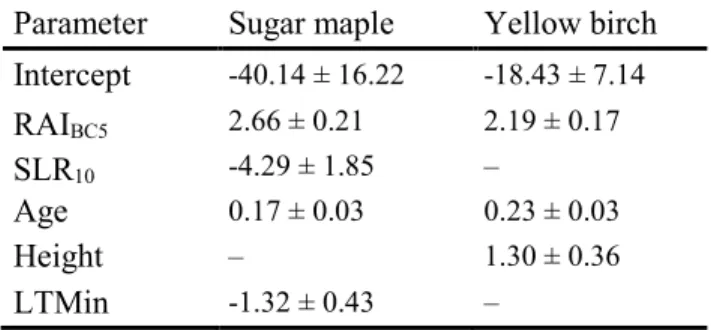
The best model for predicting RHP in sugar maple was model 13 (AICc = 1335.06, wi = 0.75), which included tree, growth, and climate variables, followed by model 17 with a difference in AICc of 3.72 units (Table 1.4). The uncertainty regarding the best model (model 13) was assessed using model averaging. According to the 95% confidence intervals (CI) for the model-averaged regression estimates, RAIBC5 (CI = 2.25–3.08), SLR10 (CI = −7.89 to
−0.66), Age (CI = 0.11–0.23), and LTMin (CI = −2.12 to −0.57) all showed strong evidence of having a significant influence (effect ≠ 0 with p < 0.05) on RHP (Figure 1.6). However, there was insufficient evidence for Height (CI = −0.87 to 0.34) and StandBA (CI = −0.38 to
0.35) to be included in model 17. The adjusted R2 of model 13 was 0.67, but this decreased
to 0.60 when calculated from the fixed effects only. Parameter estimates are presented in Table 1.5.
Table 1.4 Comparison of the multiple linear regression models for sugar maple red heartwood proportion (RHP).
Model group Explanatory variables ID likelihood Log- K AICc ∆i wi
Intercept only Null 1 -725.98 4 1460.17 125.11 0.00
Tree Age 2 -720.12 5 1450.56 115.50 0.00 Age + Height 3 -719.99 6 1452.44 117.38 0.00
Tree + Growth AAI 4 -724.82 5 1459.98 124.92 0.00 RAIBC5 5 -684.32 5 1378.96 43.90 0.00
RAIBC5 + SLR10 6 -680.47 6 1373.41 38.35 0.00
Age + Height + RAIBC5 7 -665.12 7 1344.87 9.81 0.01
Age + Height + RAIBC5 + SLR10 8 -662.43 8 1341.66 6.60 0.03
Age + RAIBC5 + SLR10 9 -662.80 7 1340.21 5.15 0.06
AAI + Height 10 -723.85 6 1460.17 125.11 0.00
Tree + Growth +
Stand Age + Height + RAIAAI + Height + StandBC5BA + SLR10 + StandBA 11 12 -723.58 -662.42 9 7 1461.78 1343.86 126.72 8.80 0.01 0.00
Tree + Growth +
Climate Age + RAIAAI + LTMin BC5 + SLR10 + LTMin 13 14 -720.17 -659.13 8 6 1452.79 1335.06 117.73 0.00 0.75 0.00 Age + RAIBC5 + SLR10 + Precip 15 -662.39 8 1341.58 6.52 0.03
AAI + Precip 16 -723.91 6 1460.28 125.22 0.00
Full model Age + Height + RAIBC5 + SLR10 + StandBA + LTMin 17 -658.77 10 1338.78 3.72 0.12
AAI + Height + StandBA + LTMin 18 -719.26 8 1455.33 120.27 0.00
Age + Height + RAIBC5 + SLR10 + StandBA + Precip 19 -662.01 10 1345.26 10.20 0.00
AAI + Height + StandBA + Precip 20 -722.71 8 1462.22 127.16 0.00
Note: K is the total number of parameters (including an intercept and random terms), ∆i is the difference in
AICc with the best model, wi is the ratio of the ∆i for a given model to that of the whole set of candidate models.
A description of the abbreviations used is given in Table 1.3.
Table 1.5 Parameter estimates and their standard errors (±SE) for the final models. Parameter Sugar maple Yellow birch
Intercept -40.14 ± 16.22 -18.43 ± 7.14 RAIBC5 2.66 ± 0.21 2.19 ± 0.17 SLR10 -4.29 ± 1.85 – Age 0.17 ± 0.03 0.23 ± 0.03 Height – 1.30 ± 0.36 LTMin -1.32 ± 0.43 –
Note: A description of the abbreviations used is given in Table 1.3.
For yellow birch, the best model for predicting RHP was model 7 (AICc=1361.03; wi =0.52), which included tree and growth variables, but several more complex models had very similar AICc values (Table 1.6). There was sufficient empirical support for models 8 (∆i = 1.72; wi = 0.22), 19 (∆i = 3.34; wi= 0.10), 17 (∆i = 3.66; wi = 0.08) and 11 (∆i = 3.92; wi= 0.07) as the choice of the best model. Through model averaging, RAIBC5 (CI = 1.86−2.54), Age (CI
= 0.18−0.30) and Height (CI = 0.58−1.98) were confirmed to have a significant effect on RHP (Figure 1.7). However, there was insufficient evidence for SLR10 (CI= −2.04 to 4.29),
StandBA (CI = −0.49 to 0.69), MTMean (CI = −0.47 to 4.92) and Precipitation (CI = 0−0.02)
to be included. The competing models all had the same basic structure as model 7, but contained additional explanatory variables. Model averaging showed that the inclusion of these additional covariates did not substantially improve the model fit. The adjusted R2 of
model 7 was 0.65, decreasing to 0.60 when calculated from the fixed effects only. Parameter estimates are presented in Table 1.5.