CARACTÉRISATION DES EFFETS DE
L’ÉRYTHROPOÏÉTINE SUR LA SENSIBILITÉ
CHIMIQUE À L’O
2et AU CO
2CHEZ LA
SOURIS
Thèse en cotutelle
Doctorat en neurobiologie
Hanan Khemiri
Université Laval
Québec, Canada
Philosophiæ Doctor (Ph.D.)
ET
Université Aix-Marseille
Marseille, France
Docteur
© Hanan Khemiri, 2015
III
Résumé
L’érythropoïétine (EPO) est une cytokine ayant un rôle important dans l’homéostasie de l’oxygène (O2). Lors d’une hypoxie chronique, l’EPO stimule la maturation des
progéniteurs érythroïdes en globules rouges augmentant ainsi le transport de l’O2 aux
tissus. Outre cet effet érythropoïétique, l’EPO module la réponse ventilatoire à l’hypoxie (RVH) par une action directe sur la commande centrale respiratoire (CCR) et les chémorécepteurs périphériques. Cet effet a été principalement caractérisé chez des souris mutantes surexprimant l’EPO. Cependant, plusieurs aspects de l’effet de l’EPO sur l’activité du réseau respiratoire demeurent inconnus. Nous avons utilisé des approches électrophysiologiques, pharmacologiques et pléthysmographiques pour caractériser 1) les effets aigus d’EPO exogène sur la chémosensibilité à l’O2 chez la souris au cours du
développement post-natal, période où la CCR et les chémorécepteurs périphériques sont en pleine maturation, 2) les effets de traitements aigu et chronique d’EPO et de son dérivé non érythropoïétique, l’EPO carbamylée (C-EPO), sur la réponse ventilatoire induite par des variations des niveaux d’O2 inspirés chez la souris adulte. 3) les effets de l’EPO sur
la sensibilité chimique au CO2, le CO2 étant un puissant stimulus de la CCR, chez des
souris adultes qui surexpriment l’EPO au niveau central et/ou plasmatique. Nos résultats montrent qu’une application aigüe d’EPO diminue la dépression centrale hypoxique mesurée in vitro chez le nouveau-né. En revanche, elle n’affecte pas la RVH mesurée in vivo au cours du développement postnatal mais diminue la fréquence des apnées survenant en hypoxie sévère à 6% d’O2. Aussi, chez la souris adulte, l’administration
chronique d’EPO et de C-EPO augmente la sensibilité des chémorécepteurs périphériques à l’O2 et maintient la ventilation durant la phase tardive de la RVH. Enfin, l’EPO diminue
la sensibilité ventilatoire à l’hypercapnie grâce à des effets périphériques et centraux. L’ensemble de nos résultats montrent que l’EPO module la respiration et contribue à l’homéostasie de l’O2 et du CO2 grâce à ses effets plasmatiques et centraux. Elle
représente un candidat à fort potentiel thérapeutique pour les pathologies respiratoires où la sensibilité chimique à l’O2 et au CO2 sont altérés telles que l’apnée du nouveau-né ou
V
Abstract
Erythropoietin (EPO) is a cytokine that plays a major role in O2 homeostasis. Upon
chronic hypoxia, EPO stimulates the maturation of erythroid progenitors into red blood cells, contributing to increased O2 carrying to tissues. Besides this well-known
erythropoietic effect, EPO also modulates the respiratory response to hypoxia by interacting with the central respiratory network in the brainstem and the peripheral chemoreceptors. This effect was mainly characterized in adult mutant mice that overexpress EPO. Several aspects regarding EPO’s effect on breathing regulation remain unknown. By using electrophysiological, pharmacological and plethysmographic approaches, we characterized 1) the acute effect of exogenous EPO on the respiratory network during the postnatal period, in which this system undergoes profound changes, 2) the effects of acute and chronic exogenous EPO administration and its non erythropoietic derivative carbamylated EPO (C-EPO) on ventilatory response to varying O2 levels in adult wild type mice (WT), 3) the EPO’s effect on the CO2 sensitivity at
central and/or peripheral levels in adult mutant mice which overexpress EPO, the CO2
being a strong stimulus of the central respiratory network. Our results show that acute EPO treatment increases the O2 sensitivity of the central respiratory network in newborn
mice in vitro. However, EPO does not impact the hypoxic ventilatory response to hypoxia in vivo, but decreases the apneic events during severe hypoxia in mice at postnatal day 7. In WT adults, chronic but not acute EPO and C-EPO treatment increases the O2 sensitivity
by stimulating both the peripheral chemoreceptor and the central respiratory network. Finally, both cerebral and plasmatic EPO blunt the ventilatory response to increased CO2
levels in adult mice. Taken together, these results imply that EPO, by acting on the ventilatory system, plays a key role in the modulation of the chemical sensitivity to O2
and CO2. Thus, EPO may have a potential clinical interest in the treatment of some
chronic respiratory diseases where O2 and CO2 homeostasis are altered, such as neonatal
VII
Tables des Matières
Résumé --- III Abstract --- V Tables des Matières --- VII Tables des Figures --- XI Abréviations --- XIII Remerciements --- XVII Avant-propos --- XXI
Chapitre I Introduction Générale --- 1
I. Le système respiratoire --- 2
I.1 Aspects mécaniques de la ventilation--- 2
I.2 Innervation motrice des muscles impliqués dans la ventilation --- 5
I.3 Commande Centrale Respiratoire (CCR) --- 5
I.3.1 Caractérisation électrophysiologique des neurones respiratoires --- 6
I.3.2 Description anatomo-fonctionnelle du réseau centrale respiratoire --- 7
a. Groupes respiratoires bulbaires --- 9
b. Groupes respiratoires pontique (PRG) --- 12
I.3.3 Mécanismes de la rythmogenèse --- 12
a. Emergence du rythme respiratoire --- 12
b. Propriétés de réseau et/ou modèle hybride pacemaker-réseau --- 14
I.3.4 Maturation post-natale du réseau respiratoire --- 15
I.4 Adaptation de la CCR à des variations d’O2 et de CO2 --- 15
I.4.1 Description des chémorécepteurs --- 15
a. Chémorécepteurs centraux--- 16
b. Chémorécepteurs périphériques --- 17
I.4.2 Réponse ventilatoire à des variations d’O2 et de CO2 --- 22
a. Réponse ventilatoire à l’hypoxie --- 22
b. Réponse ventilatoire à une hyperoxie (RVHx) --- 25
c. Réponse ventilatoire à une hypercapnie (RVHc) --- 26
I.5 Modulation de la chémosensibilité --- 27
I.5.1 Modulation par des neurotransmetteurs conventionnels --- 27
I.5.2 Modulation par des neurotransmetteurs non conventionnels --- 29
II. Le système époïétique --- 31
II.1 Description des acteurs du système époïétique --- 31
II.1.1 Érythropoïétine : Caractérisation génétique et structurale --- 31
a. Caractéristique génétique --- 31
b. Structure protéique --- 32
c. Régulation du gène de l’EPO --- 32
II.1.2 Récepteurs à l’EPO --- 34
a. Caractérisation génétique et structurale --- 34
b. Récepteur transmembranaire --- 36
c. Activation du récepteur et cascades intracellulaire --- 36
d. Récepteur soluble --- 39
II.2 Fonction du système époïétique --- 39
VIII
a. Historique --- 39
b. Action érythropoïétique --- 40
c. Indication thérapeutique chez l’Homme --- 41
II.2.2 Le système époïétique dans le Système nerveux central --- 42
a. Rôle développemental : --- 43
b. EPO exogène et barrière hématoencéphalique --- 43
c. Effets neuroprotecteurs du système époïétiques chez l’animal--- 44
d. Essais cliniques chez l’Homme --- 45
e. Dérivées cytoprotecteurs non érythropoïétiques --- 46
III. Système époïétique et modulation de la ventilation --- 49
III.1 Rôle érythropoïétique dans l’adaptation à l’hypoxie chronique --- 49
III.2 Effets non–érythropoïétiques et modulation de la ventilation --- 51
III.2.1 Expression des récepteurs de l’EPO dans le système respiratoire --- 51
III.2.2 Implication fonctionnelle de l’EPO dans l’activité respiratoire basale chez l’adulte - 52 III.2.3 Implication fonctionnelle de l’EPO dans la chémosensibilité à l’O2 chez l’adulte --- 53
III.2.4 Implication fonctionnelle de l’EPO dans la chémosensibilité au CO2 --- 55
III.2.5 EPO et maturation de la CCR --- 57
IV Objectifs de la thèse --- 58
Chapitre II L’érythropoïétine et son antagoniste régulent la sensibilité à l’O2 de la commande centrale respiratoire chez la souris nouveau-né --- 59
I. Introduction --- 64
II. Methods --- 65
III. Results --- 69
IV. Discussion --- 76
Chapitre III Effet aigu de l’érythropoïétine exogène sur la réponse ventilatoire à l’hypoxie chez la souris au cours du développement post-natal. --- 85
I. Introduction --- 89
II. Matériels et Méthodes --- 91
III. Résultats --- 95
IV. Discussion --- 100
Chapitre IV Caractérisation des effets aigus et chroniques de l’érythropoïétine et son dérivé carbamylé sur la réponse ventilatoire induite par une variation d’O2 chez la souris adulte --- 107
I. Introduction --- 112
II. Material and Methods --- 114
III. Results --- 119
IV. Discussion --- 132
V. Conclusion --- 136
Chapitre V Caractérisation des effets de l’érythropoïétine sur la sensibilité chimique au CO2 chez la souris adulte --- 141
IX
1. Introduction --- 147
2. Material and Methods --- 149
3. Results --- 154 4. Discussion --- 164 5. Author contribution --- 168 6. Acknowledgments --- 168 7. Bibliography --- 169 Chapitre VI Discussion--- 175
I. EPO et sensibilité chimique à l’O2 --- 177
I.1 EPO et sensibilité à l’O2 chez la souris au cours du développement post-natal --- 177
I.1.1 Les effets de l’EPO observés in vivo et in vitro ne sont pas directement comparables -- ---177
I.1.2 Les doses d’EPO utilisées in vivo pourraient ne pas être suffisantes pour stimuler la RVH ---179
I.1.3 Les effets de l’EPO diffèrent selon le stade de développement testé --- 180
I.1.4 L’absence d’effet aigu de l’EPO sur la réponse ventilatoire à l’hypoxie pourrait être due à une absence de stimulation chronique de ses récepteurs --- 181
I.1.5 Mécanismes sous-tendant les effets de l’EPO sur la sensibilité chimique à l’O2 chez le nouveau-né --- 183
a. Hypothèse catécholaminergique : --- 183
b. Hypothèse du NO --- 184
II. Effets de l’EPO et son dérivé carbamylé sur la sensibilité chimique à l’O2 chez la souris adulte in vivo --- 186
II.1 Le traitement chronique avec l’EPO et son dérivé carbamylé module la sensibilité chimique à l’O2 in vivo --- 187
II.2 La C-EPO est aussi efficace que l’EPO pour moduler la sensibilité chimique à l’O2 chez la souris adulte --- 187
II.3 Mécanismes sous tendant les effets de l’EPO et son dérivé carbamylé sur la sensibilité chimique à l’O2 chez la souris adulte --- 188
a. Hypothèse catécholaminergique --- 188
b. Modulation par le NO --- 189
III. Effet de l’EPO sur la sensibilité chimique au CO2 --- 190
III.1 L’érythropoïèse diminue la sensibilité chimique au CO2 --- 191
III.2 L’EPO diminue la sensibilité chimique au CO2 par des effets non-érythropoïétiques, plasmatiques et centraux --- 192
III.3 Mécanismes sous tendant les effets de l’EPO sur la sensibilité chimique au CO2 chez la souris adulte --- 192
IV. Effets de l’EPO sur les variations en O2 et en CO2 --- 194
Conclusion générale --- 197
XI
Tables des Figures
Figure 1 : Anatomie générale de l’appareil respiratoire. D’après Feldman & Del Negro, 2006. --- 4 Figure 2 : Représentation des différents types de neurones respiratoires. --- 7 Figure 3 : Populations de neurones respiratoires du tronc cérébral selon une vue horizontale (A) ou sagittale (B). --- 8 Figure 4 : Organisation anatomique d’un corps carotidien. --- 19 Figure 5 : Cascade de transduction du signal des cellules sensibles à l’O2 dans les
corps carotidiens en hypoxie. --- 21 Figure 6 : Décours temporel de la réponse ventilatoire à l’hypoxie chez le raton âgé de 4 jours. --- 23 Figure 7 : Décours temporel de la réponse ventilatoire à l’hypoxie chez le rat adulte.
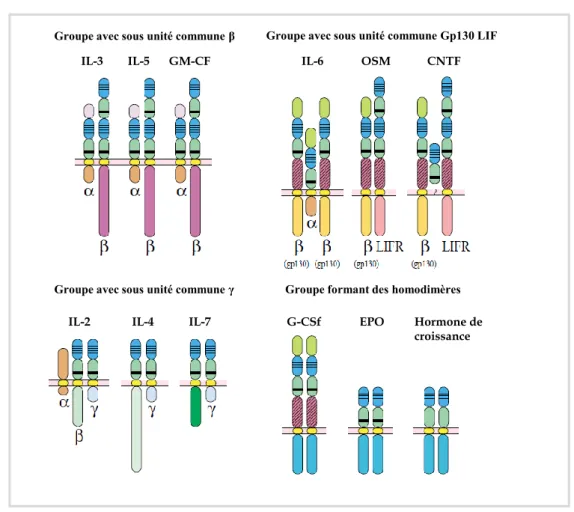
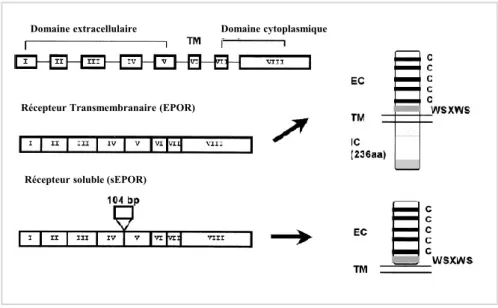
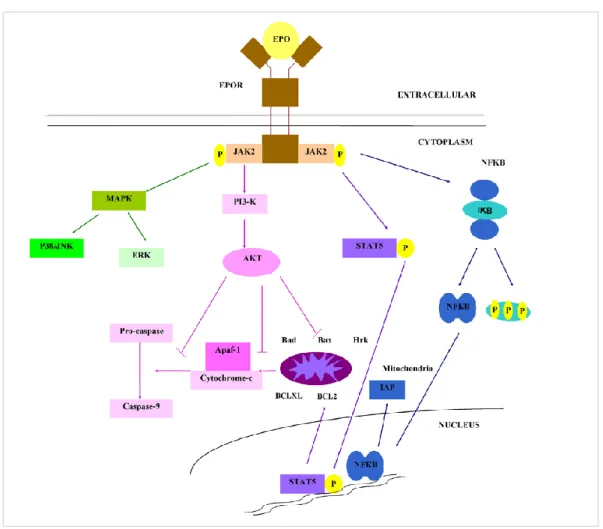
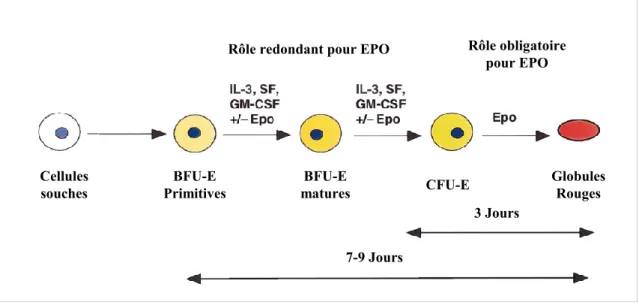
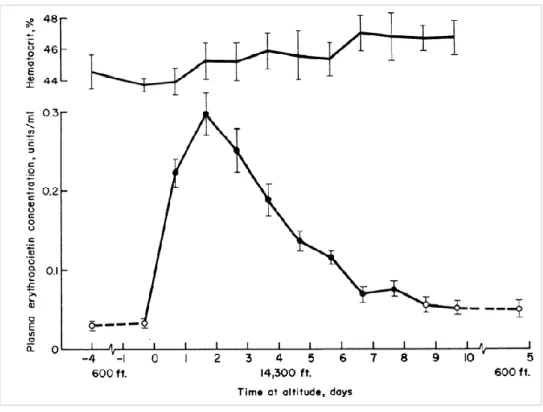
---25 Figure 8 : Réponse ventilatoire à l’hypercapnie chez le rat au cours du développement post-natal. --- 27 Figure 9 : Structure de l’érythropoïétine (EPO). --- 32 Figure 10 : Mécanisme de régulation de HIF1 α en condition normoxique et hypoxique. --- 34 Figure 11 : Représentation schématique des différentes sous familles des récepteurs aux cytokines. --- 35 Figure 12 : Représentation schématique de différentes formes de l’EPOR issues du même gène : le récepteur transmembranaire et le récepteur soluble. --- 36 Figure 13 : Représentation des voies de signalisation intracellulaire activées par la fixation de l’EPO sur l’EPOR. --- 38 Figure 14 : Schéma illustrant la différenciation d’une cellule souche hématopoïétique en globule rouge mature. --- 41 Figure 15 : Évolution temporelle du taux d’hématocrite (%) et d’EPO plasmatique (mUI/ml) en haute altitude. --- 50 Figure 16 : Immunomarquage des récepteurs de l’EPO chez la souris adulte. --- 52 Figure 17 : Représentation de la ventilation mesurée en normoxie et en condition hypoxiques (à 10% et 6%) chez la souris adulte Tg21 et son contrôle.. --- 54 Figure 18 : Mesures de l’expression des ARN messagers du récepteur à l’EPO dans le tronc cérébral chez des souris Tg21 et contrôles à P3, P7, P14 et P21. --- 183
XIII
Abréviations
ACh : Acétylcholine
ATP: Adénosine triphosphate BFU: Bursting forming unit
BHE : Barrière hématoencéphalique BötC : Complexe de Bötzinger CBF : Flux sanguin cérébral CC : Corps Carotidien
CCR : Commande centrale respiratoire C-EPO : érythropoïétine carbamylée CFU : Colony forming unit
CO2 : Dioxyde de carbone
DA : Dopamine
DRG : Groupe respiratoire dorsale EPO : Érythropoïétine
EPOR : Récepteur à l’érythropoïétine GR : Globule rouge Hb : Hémoglobine I.p : intrapéritonéale ICV : intracérébroventriculaire LCR : Liquide céphalorachidien NA : Noradrénaline
NK1R : Récepteurs aux neurokinines de type 1 NM : Neuromodulateur
NO : Monoxyde d’azote
XIV
NT : Neurotransmetteur
NTS : Noyau du tractus solitaire O2 : Dioxygène
PaCO2 : pression partielle artérielle en CO2
PaO2 : pressions partielle artérielle en O2
pfRG : Groupe respiratoire parafacial PréBötC : complexe de préBötzinger
rhEPO : Érythropoïétine recombinante humaine RTN : Noyau rétrotrapézoïde
RVH : Réponse ventilatoire à l’hypoxie RVHc : Réponse ventilatoire à l’hypercapnie RVHx : Réponse ventilatoire à l’hyperoxie sEPOR : Récepteur soluble à l’érythropoïétine SNC : Système nerveux central
TC : Tronc cérébral TH :Tyrosine hydroxylase
VRC ; Colonne respiratoire ventrale VRG : Groupe respiratoire ventrale PRG : Groupe respiratoire pontique
XV
XVII
Remerciements
J’ai eu la chance d’effectuer ma thèse en cotutelle Franco-Québécoise et de profiter de l’encadrement de deux directeurs, le Dr Jorge Soliz et le Dr Christian Gestreau. Mes premiers remerciements leurs sont adressés. Jorge, tu m’as accueillie au sein de ton laboratoire à Québec et permis de vivre une expérience très enrichissante tant au niveau scientifique qu’humain. Je te remercie sincèrement pour ton implication et ton sens de la pédagogie. Christian, tu m’encadres depuis ma première année de Master, je te remercie de m’avoir fait bénéficier de ton savoir scientifique et technique. Je te remercie également pour tes encouragements dans les moments difficiles, ta confiance et ta disponibilité sans faille.
Je tiens à adresser également mes remerciements aux Dr Kinkead, Dr Morin, Dr Straus et Dr Vinay d’avoir accepté de faire partie de mon jury de doctorat et d’avoir pris le temps d’examiner ce travail.
A Québec, j’ai eu la chance de rencontrer plusieurs personnes dont l’aide m’aura été précieuse. Merci Tommy d’avoir facilité mon arrivée à Québec. Malgré notre désaccord quant à la température optimale pour travailler, nous aurons passé de bons moments! Merci à toi Céline, bon courage pour ta fin de thèse et à très bientôt à la maison! Raphael, merci pour ta disponibilité, ta gentillesse et ton aide technique. J’espère que nous aurons bientôt l’occasion de se revoir ! Merci au Dr Richard Kinkead pour l’aide théorique et technique que tu m’as toujours apportée. Merci également au Dr Vincent Joseph pour ton avis toujours éclairé sur la pléthysmographie et ses mystères. Merci également au Dr Aida Bairam, Sébastien, Lalah, Mélanie, Sylvie, Stéphanie et Roumi.
Merci Alexandra, ma super colocataire qui aura réussi à me supporter pendant plus d’une année ! J’espère que ton prochain passage à Marseille durera plus longtemps que 30 min
A Marseille, je tiens à adresser un grand merci au Dr Sébastien Zanella. Ta gentillesse, ton humilité et ton écoute m’ont aidé à traverser les moments compliqués de la thèse. Tes qualités humaines et scientifiques m’auront toujours été d’une aide plus que précieuse. Michelle, tu as été celle qui m’a appris l’anatomie du réseau respiratoire, je te remercie pour ta pédagogie et ta patience. Merci aussi d’avoir veillé à ce que je me nourrisse convenablement tous les jours. Je remercie également les membres de l’équipe du Dr
XVIII
Fabien Tell pour leur accueil. En particulier, Abde, je suis contente d’avoir partagé le bureau avec toi durant mes derniers mois de thèse. Je te souhaite une très belle fin de thèse et un super post-doc après ! Je remercie l’équipe du PPSN, pour leur bienveillance. Merci au Dr Marc Maresca, tes compétences ont rendu possible une étude à laquelle je tenais beaucoup. Ça a été un réel plaisir de te travailler avec toi
Merci à tous mes collègues étudiants et post-doctorants, Clément, Keda et Nicolas, c’était un plaisir de passer mes années de Master avec vous. Même si depuis tout le monde s’est dispersé aux quatre coins du monde, je ne désespère pas de vous revoir bientôt. Théodora, je suis ravie de t’avoir eu comme co-stagiaire pendant 2 ans. Merci pour ton soutien et j’espère qu’on arrivera bientôt à se synchroniser géographiquement
Merci à mes amis pour leur présence et leur soutien. Merci Anahid, ta présence au quotidien n’a pas de prix. Adeline, en attendant de te retrouver très bientôt autour d’un plat de pâtes au beurre, je te dis un grand merci pour tous nos moments, en particulier ceux où tu m’as aidé à éclaircir mon ciel !! Delphine, ta présence inconditionnelle de jour comme de nuit, malgré les milliers de kilomètres qui nous ont rapidement séparés, m’aura aidée au-delà de ce que tu ne pourras jamais imaginer ! Merci pour ta patience, ta générosité, nos longues nuits de travail, les relectures infinies, les multiples répétitions et tes compétences McGyveresques ! Ma petite Wala, merci pour tout. Je te souhaite bon courage pour la dernière ligne droite, même si je sais qu’après tu iras vivre ton rêve et que ta douceur va beaucoup me manquer. Emilie, merci pour cette année formidable passée en ta compagnie, je suis contente d’avoir pu profiter de toi avant que tu ne t’envole à l’autre bout du monde ! Aida je n’ai pas été très disponible dernièrement j’espère qu’on pourra se rattraper très bientôt ! Sabrina, merci pour ton soutien moral et tes petites visites improvisées (même si elles se faisaient souvent en mon absence)! Merci à la team parisienne, Laura, Flé, Rémy et surtout à toi Juju et ton fameux flegme qui m’aura souvent inspiré. Ça a été un plaisir de passer un petit bout de rédaction avec vous au studio du bonheur ! Thomas, un grand pkh et vivement la suite !
Enfin, aux membres de ma famille : Merci ptiteMimi d’avoir toujours été à l’écoute malgré ma tendance au radotage , Nayoul pour tout ce que tu auras fait pour moi-même si c’était souvent réalisé à l’insu de ton plein gré ! Mohamed et Hamed de m’avoir régulièrement servi de taxi, Tima de m’avoir supporté gentiment depuis ton retour et Bébé
XIX pour ton humour ! Enfin un énorme MERCI à mes parents pour tout ce qu’ils ont toujours fait pour moi.
XXI
Avant-propos
En ce qui concerne l’ensemble des travaux présentés dans cette thèse, j’ai contribué à l’élaboration du plan expérimental, j’ai effectué la majorité des expériences et analysé les données recueillies. J’ai également contribué à la réalisation des figures et des tableaux ainsi qu’à la rédaction des manuscrits. Une première partie de ce travail doctoral a donné lieu à la publication d’un article et la rédaction de deux autres articles qui seront bientôt soumis. Ces travaux constituent les 4 chapitres de résultats de ma thèse.
Chapitre II : L’érythropoïétine et son antagoniste régulent la sensibilité à l’O2 de la
commande centrale respiratoire chez la souris nouveau-né. Article publié dans respiratory, physiology and neurobiology.
Chapitre III : Effet aigu de l’érythropoïétine exogène sur la réponse ventilatoire à l’hypoxie chez la souris au cours du développement post-natal
Chapitre IV : Caractérisation des effets aigus et chroniques de l’érythropoïétine et son dérivé carbamylé sur la réponse ventilatoire induite par une variation d’O2 chez la souris
adulte
Chapitre V : Caractérisation des effets de l’érythropoïétine sur la sensibilité chimique au CO2 chez la souris adulte
1
Chapitre I
2
I.
Le système respiratoire
Chez les Mammifères, la respiration est une fonction vitale qui participe à l’homéostasie en maintenant un niveau constant des gaz du sang. En particulier, les mouvements rythmiques de l’appareil respiratoire, ou ventilation, assurent la convection et le renouvellement de l’air alvéolaire nécessaires aux échanges gazeux alvéolo-capillaires. En effet, l’activité ventilatoire entretient les différences de pressions partielles en dioxygène (O2) et en dioxyde de carbone (CO2) entre l’air et le sang, indispensables à
la diffusion de ces gaz entre ces deux compartiments. Au niveau cellulaire, l’O2 est
ensuite utilisé au sein de la chaîne respiratoire mitochondriale dans les réactions de phosphorylation oxydative afin de produire l’Adénosine triphosphate (ATP), le substrat énergétique nécessaire aux besoins métaboliques de l’organisme. Ce processus s’accompagne d’une production de CO2, un déchet métabolique toxique devant être
éliminé par la ventilation. Ainsi, l’activité ventilatoire doit être ajustée en permanence selon les besoins métaboliques du sujet et/ou selon les variations environnementales en O2 et CO2, de façon à assurer la constance du milieu intérieur (homéostasie) et par là
même, la survie de l’organisme.
I.1 Aspects mécaniques de la ventilation
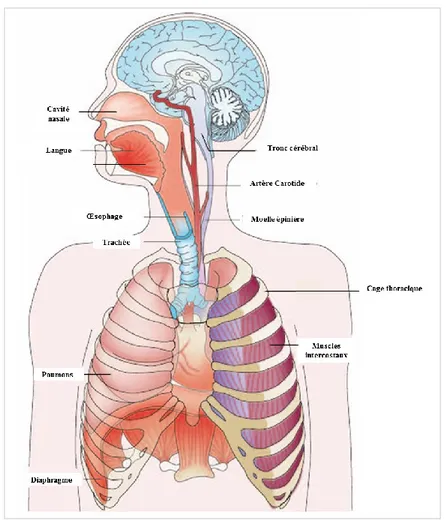
La ventilation repose sur la contraction de plusieurs dizaines de muscles striés squelettiques qui permettent de mobiliser l’appareil respiratoire. Cet appareil correspond à un ensemble d’organes classiquement subdivisé en 2 parties. On distingue d’une part, les voies aériennes supérieures (VAS) (Figure 1), constituées des cavités nasale, buccale, du pharynx et du larynx, dont les rôles sont de conditionner l’air atmosphérique lors de l’inhalation (filtration, humidification et réchauffement) et de contrôler la résistance au flux d’air aussi bien lors de l’inspiration que de l’expiration. Les principaux muscles des VAS sont les protruseurs et rétracteurs de la langue, les dilatateurs et les constricteurs du pharynx, ainsi que les abducteurs et les adducteurs du larynx. L’action conjuguée des muscles protruseurs, dilatateurs et abducteurs lors de l’inspiration diminue la résistance au flux d’air et facilite ainsi l’inhalation pulmonaire. A l’inverse, l’action conjuguée des rétracteurs, des constricteurs et des adducteurs augmente la résistance au flux d’air au cours de l’expiration précoce (ou phase de post-inspiration, voir plus loin). Au total, les
3 muscles des VAS ont un rôle de valve qui régule l’écoulement de l’air dans les poumons. D’autre part, on distingue les voies aériennes inférieures (VAI), constituées de l’arbre trachéo-bronchique et des poumons (Figure 1). Les principaux muscles permettant de mobiliser l’air contenu dans les poumons sont le diaphragme, les intercostaux externes et internes, ainsi que les abdominaux. Ces muscles sont qualifiés de muscles de la pompe thoraco-abdominale et jouent un rôle indispensable dans la genèse des gradients de pressions intra-pulmonaires.
L’activité ventilatoire physiologique, encore appelée eupnée, se déroule en 3 phases : l’inspiration, la post–inspiration (ou expiration précoce) et l’expiration tardive (Bianchi et al. 1995; Richter & Spyer 2001; Bianchi & Gestreau 2009; Smith et al. 2009; Lindsey et al. 2012). Lors de l’inspiration, le diaphragme, principal muscle inspiratoire, et les muscles intercostaux externes se contractent et entraînent un étirement des poumons vers le bas et une élévation des côtes. Il en résulte une expansion de la cage thoracique et des poumons qui entraine une dépression intra-pulmonaire permettant l’entrée d’air dans les poumons. Il est à noter que l’activité inspiratoire des muscles des VAS débute un peu avant (protruseurs de la langue) ou en même temps (dilatateurs du pharynx et abducteurs du larynx) que l’activité du diaphragme et des muscles intercostaux externes de manière à faciliter le passage de l’air vers les poumons et limiter le risque d’apnée obstructive (ou collapse des VAS).
La phase post-inspiratoire se traduit par un relâchement progressif du diaphragme associé à un rétrécissement du conduit pharyngo-laryngé (augmentation de la résistance des VAS, voir plus haut). Cette phase importante du cycle ventilatoire permet une transition « souple » entre l’inspiration et l’expiration. En effet, la post-inspiration vise à contrecarrer les forces de recul élastique de l’appareil thoraco-pulmonaire sollicitées pendant l’inspiration, lesquelles sont maximales en fin d’inspiration. Il s’agit d’un véritable frein à l’exhalation qui permet de limiter l’affaissement soudain du thorax et ainsi éviter l’atélectasie pulmonaire (collapse alvéolaire). Enfin, la phase expiratoire tardive permet l’exhalation de l’air alvéolaire appauvri en O2 et chargé en CO2.
Généralement l’expiration est une activité passive, les forces de recul élastique du thorax étant suffisantes pour créer une augmentation de pression intra-pulmonaire et engendrer l’exhalation. L’expiration peut devenir active, ce qui est le cas lors de la respiration forcée, et dépend alors du recrutement des muscles intercostaux internes et des muscles abdominaux (Hilaire & Pásaro 2003; Bianchi et al. 1995). Ainsi, il apparaît clairement
4
que les activités musculaires de la pompe (VAI) et de la valve (VAS) doivent être parfaitement coordonnées pour assurer une ventilation efficace. Un défaut de cette coordination est mis en cause dans certaines pathologies comme le syndrome de l’apnée obstructive ou encore la mort subite du nouveau-né. Concernant le contrôle nerveux de ces muscles respiratoires, il suppose que l’activité des motoneurones respiratoires soit finement contrôlée par le réseau neuronal respiratoire.
Figure 1 : Anatomie générale de l’appareil respiratoire. D’après Feldman & Del Negro, 2006.
5
I.2 Innervation motrice des muscles impliqués dans la ventilation
Les motoneurones impliqués dans la distribution de la commande respiratoire aux différents muscles respiratoires sont étagés le long de l’axe cérébrospinal (Monteau & Hilaire 1991). Les muscles striés des VAS sont innervés par des motoneurones localisés dans les noyaux moteurs crâniens situés dans le tronc cérébral (TC). En particulier, le noyau moteur hypoglosse (XII), situé dans le bulbe rachidien dorsomédian, contient les motoneurones qui commandent les muscles de la langue via le nerf moteur hypoglosse (XIIn), tandis que le noyau moteur ambigu (AMB), situé dans la région bulbaire ventrolatérale, contient les motoneurones innervant les muscles du pharynx et du larynx via les nerfs glossopharyngien (IX), plusieurs branches du nerf vague (X) dont la branche pharyngienne (Ph-X) et les nerfs laryngé supérieur (NLS) et récurrent (NLR). En revanche, l’innervation des muscles striés de la pompe thoraco-abdominale est d’origine spinale. En effet, les motoneurones phréniques qui contrôlent le diaphragme via le nerf phrénique sont localisés au niveau de la corne ventrale de la moelle épinière cervicale entre C3 et C5. Les motoneurones innervant les muscles intercostaux, via les nerfs intercostaux, sont situés dans la corne ventrale de la moelle épinière thoracique entre les segments T2 et T6. Enfin, les motoneurones qui contrôlent la sangle abdominale sont localisés dans la corne ventrale de la moelle épinière lombaire entre les segments L1 et L5 et donnent naissance au nerf iliohypogastrique (Gaytán et al. 2002; Hilaire & Pásaro 2003).
I.3 Commande Centrale Respiratoire (CCR)
On sait depuis les expériences de lésion cérébrale réalisées chez le lapin par Lorry en 1760, que le réseau respiratoire est localisé dans le tronc cérébral. En 1851, Flourens réalise des sections entre la moelle épinière et le bulbe qui lui permettent de localiser le « nœud vital », centre générateur du rythme respiratoire. Depuis, le développement de différentes approches expérimentales (électrophysiologiques, biochimiques, anatomiques, pharmacogénétiques etc.) a permis de grandes avancées dans la caractérisation anatomique et fonctionnelle des différents groupes constituant le réseau neuronal respiratoire, qui sera appelé ici commande centrale respiratoire (CCR).
6
I.3.1 Caractérisation électrophysiologique des neurones respiratoires
Les neurones respiratoires sont des neurones dont la décharge est rythmique et synchrone avec une phase du cycle respiratoire. Des expériences réalisées chez le chat adulte ont permis d’identifier 6 types de neurones respiratoires caractérisés par leur patron de décharge (croissant, constant et décroissant) et par la phase du cycle respiratoire durant laquelle ils sont actifs (Bianchi et al. 1995; Hilaire & Pásaro 2003; Bianchi & Gestreau 2009; Smith et al. 2009) (Figure 2).
Les neurones pré-inspiratoires (pré-I) : Ils sont actifs lors de la transition entre la fin de
l’expiration tardive et le début de l’inspiration.
Les neurones inspiratoires précoces (early-I) : La décharge de ces neurones est
décroissante. Ils sont actifs du début jusqu’à la moitié de la phase inspiratoire.
Les neurones inspiratoires (I) : Ils sont actifs durant toute l’inspiration, avec une
fréquence de décharge qui est croissante.
Les neurones inspiratoires tardifs (late-I) : Ils sont actifs à la fin de l’inspiration. Les neurones expiratoires précoces (Post-I) : Ils sont actifs dès la fin de l’inspiration
jusqu’au début de l’expiration tardive et ont un patron de décharge décroissant.
Les neurones expiratoires (E-Aug) : Ils sont actifs pendant la phase expiratoire tardive
7 Figure 2 : Représentation des différents types de neurones respiratoires.
Représentation des patrons de décharge du nerf phrénique (zone grise en haut) et des neurones respiratoires du tronc cérébral (tracé du bas). 3 phases du cycle respiratoire ont été définies (inspiratoires (I), post-inspiratoire (E1) et expiratoire (E2)) et 6 types de neurones respiratoires ont été caractérisés (Pré-I, Early-I, Late-I, Early-E et E). D’après Hilaire & Pasaro, 2003.
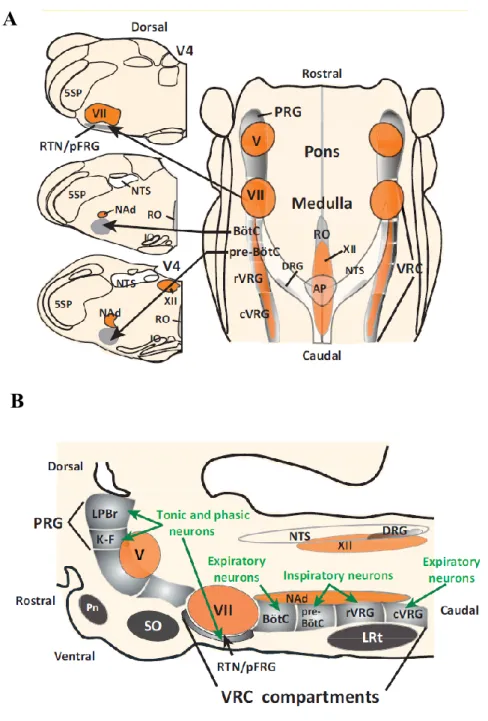
I.3.2 Description anatomo-fonctionnelle du réseau centrale respiratoire La CCR est constituée de trois principaux groupes de neurones répartis au niveau bulbo-pontique. Le groupe respiratoire dorsal (DRG), la colonne respiratoire ventrale (VRC), et le groupe respiratoire pontique (PRG) (Bianchi & Gestreau 2009; Richter & Spyer 2001; Alheid & McCrimmon 2008; Lindsey et al. 2012) (Figure 3).
8
Figure 3 : Populations de neurones respiratoires du tronc cérébral selon une vue horizontale (A) ou sagittale (B).
Abréviations: VRC, colonne respiratoire ventrale; rVRG, groupe ventral respiratoire rostral; cVRG, groupe ventral respiratoire caudal; DRG, groupe respiratoire dorsal; PRG, groupe respiratoire pontique; KF, noyau de Kölliker‐Fuse; LPBr, complexe parabrachial latéral; NTS, noyau du tractus solitaire; AP, Area postrema; préBötC, complexe de préBötzinger; BötC, complexe de Bötzinger; pfRG, groupe respiratoire parafacial; RTN, noyau rétrotrapézoïde; SO, Olive supérieure; V, noyau moteur du nerf trigéminal; VII, noyau facial; XII, noyau moteur hypoglosse; 4V, 4ème ventricule; D’après Smith et al. 2013.
A
9
a. Groupes respiratoires bulbaires
Groupe respiratoire Dorsal (DRG) :
Le DRG a été identifié chez le chat dans le noyau du tractus solitaire (NTS) ventrolatéral. Le NTS, en particulier sa portion caudale, est le premier relai des afférences pulmonaires qui cheminent dans le nerf vague et de celles provenant des chémorécepteurs périphériques qui empruntent le nerf glossopharyngien (Kubin et al. 2006 ; Lahiri et al. 2006). Le DRG contient surtout des interneurones inspiratoires dont l’axone reste confiné dans le bulbe rachidien (neurones propriobulbaires, 40%) ou projette vers la moelle épinière (neurones bulbospinaux, 60%). Ces neurones bulbospinaux peuvent être qualifiés de neurones inspiratoires prémoteurs phréniques puisqu’ils établissent des projections monosynaptiques excitatrices sur les motoneurones phréniques (Fedorko et al. 1983). L’existence de ce groupe n’est pas confirmé chez le rat ou encore la souris (Bianchi et al. 1995; Hilaire & Pasàro 2003).
Colonne respiratoire ventrale (VRC) :
La VRC forme une colonne qui s’étend depuis le bord caudal jusqu’au bord rostral du bulbe rachidien ventrolatéral. Elle comprend différents groupes fonctionnellement distincts décrits ci-dessous.
Le groupe respiratoire ventral (VRG):
Le VRG s’étend du segment cervical C1 jusqu’au noyau facial (Planche 1970). Classiquement ce groupe est subdivisé, sur la base des caractéristiques électrophysiologiques des neurones qui le composent, en une partie rostrale (rVRG) et une partie caudale (cVRG) (Feldman & Del Negro 2006). Le cVRG contient des prémotoneurones glutamatergiques principalement expiratoires qui innervent les motoneurones abdominaux et intercostaux internes (Iscoe 1998; Ezure et al. 2003b). Le rVRG est majoritairement composé de prémotoneurones inspiratoires bulbospinaux (I-Aug) qui projettent sur les motoneurones phréniques et intercostaux externes au niveau de la moelle épinière (Dobbins & Feldman 1994; Iscoe 1998; Guyenet et al. 2002; Stornetta et al. 2003). Ces neurones sont glutamatergiques et peuvent libérer plusieurs co-transmetteurs tels que l’enképhaline (Stornetta et al. 2003; Feldman & Del Negro 2006) ou le monoxyde d’azote (NO) (Marsala et al. 2002).
10
Le complexe de Bötzinger (BötC)
Le BötC est localisé dans la région ventrolatérale du bulbe rachidien en position caudale au noyau facial. Ce groupe est impliqué dans le contrôle de l’activité expiratoire, en particulier dans les transitions de phases entre post-inspiration et expiration et entre expiration et inspiration (Smith et al. 2009; Alheid & McCrimmon 2008). Il contient principalement des neurones expiratoires glycinergiques inhibiteurs (Schreihofer et al. 1999; Ezure et al. 2003a). Ces derniers projettent sur des motoneurones respiratoires aux niveaux crâniens et spinauxainsi que sur des structures de la VRC telles que le cVRG ou le noyau rétrotrapézoïde, et des structures pontiques (Jiang & Lipski 1990; Tian et al. 1998). Ces neurones expriment les récepteurs à la neurokinine 1 (NK1R) (Makeham et al. 2001). L’injection de substance P (agoniste endogène des NK1R) ou de glutamate, modifie l’activité respiratoire en prolongeant la durée de la phase expiratoire et en provoquant une bradypnée. A l’inverse, le blocage de ces mêmes récepteurs réduit le temps expiratoire et augmente la fréquence respiratoire (Monnier et al. 2003; Fong & Potts 2008).
Le complexe de pré-Bötzinger (PréBötC)
Situé caudalement au BötC, le PréBötC contient essentiellement des neurones inspiratoires. Ces neurones sont essentiellement actifs dans la transition de phase entre l’expiration tardive et l’inspiration (neurones pré-I) ( Guyenet & Wang 2001). Chez le rat nouveau-né, de nombreuses études in vitro ont démontré l’existence de neurones autorythmiques dans cette région, ce qui le positionne comme noyau essentiel à la genèse du rythme respiratoire (Smith et al. 1991) (ce point sera détaillé dans le paragraphe I.3.3a « émergence du rythme respiratoire »). Les neurones du préBötC expriment NK1R et les récepteurs µ-opioïdes (Gray et al. 1999; Guyenet & Wang 2001). L’application de substance P augmente la fréquence respiratoire fictive in vitro sur des préparations en tranche tandis que l’application d’agoniste opioïde diminue la fréquence respiratoire (Gray et al 1999). De même, la destruction pharmacologique de ces neurones chez l’adulte entraine une interruption de la respiration plus ou moins sévère (Gray et al. 2001). Certains neurones NK1R+ coexpriment le transporteur vésiculaire de type 2 du glutamate
( Guyenet et al. 2002), la somatostatine (Stornetta et al. 2003; Tan et al. 2008), ou encore les récepteurs à la sérotonine (5-HT) (Manzke et al. 2003).
11 Le noyau rétrotrapézoïde (RTN) / Groupe respiratoire parafacial (pfRG)
Le RTN/pfRG, localisé au niveau de la surface ventrale bulbopontique, est situé en dessous du noyau facial et s’étend caudalement sous le BötC (Figure.3). La ségrégation entre ces deux groupes repose sur des différences fonctionnelles et non anatomiques. En effet, les fonctions de cette structure diffèrent selon l’âge, le pfRG étant défini chez l’animal nouveau-né tandis que le RTN est défini chez l’adulte (Smith et al. 2009; Guyenet & Mulkey 2010).
Le pfRG a été identifié par Onimaru et Homma dans une préparation tronc cérébral moelle épinière isolés chez le raton. Il contient des neurones glutamatergiques ayant une activité Pré-I (Onimaru & Homma 1987). Contrairement aux neurones du préBötC, ces neurones ne possèdent pas de récepteurs µ aux opioïdes et y sont donc insensibles (Feldman & Negro 2006). Fonctionnellement, ce groupe est impliqué dans la genèse du rythme respiratoire, en particulier dans l’activité expiratoire (nous développerons ce point dans la partie I.3.3.a) (Onimaru & Homma 2003; Onimaru & Homma 2006). Chez l’adulte, le RTN ne constituerait pas un oscillateur expiratoire mais plutôt une structure clé de la chémosensibilité centrale au CO2/pH (et indirectement de la
chémosensibilité périphérique) capable de réguler plusieurs paramètres fondamentaux de la ventilation (Mulkey et al. 2004; Guyenet et al. 2010; Guyenet et al. 2012). Les neurones du RTN sont aujourd’hui considérés comme les chémorécepteurs centraux les mieux caractérisés, nous décrirons plus précisément ce rôle dans la partie sur la chémosensibilité centrale (cf. partie I.4.1.a, chémorécepteurs centraux). Les neurones du RTN déchargent essentiellement de manière tonique. Ils sont glutamatergiques et expriment NK1R, Atoh1, le facteur de transcription Phox2B et les canaux TASK2 (Li & Nattie 2002; Stornetta et al. 2006; Dubreuil et al. 2008; Gestreau et al. 2010; Wang et al. 2013a; Wang et al. 2013b).Le RTN reçoit des afférences en provenance du NTS, de la VRC et du PRG, des neurones sérotoninergiques des raphés bulbaires et pontiques ainsi que des chémorécepteurs périphériques (Otake et al. 1992; Bodineau et al. 2000; Mulkey et al. 2007a, Mulkey et al. 2007b; Rosin et al. 2006; Takakura et al. 2006). Il est intéressant de noter que le RTN intègre indirectement, via le NTS, les informations chémosensibles périphériques (notamment celles issues des corps carotidiens). Les neurones du RTN projettent largement sur différentes structures de la VRC et de PRG et peuvent donc influencer considérablement l’activité du réseau respiratoire (Connelly et al. 1990; Gang et al. 1995; Rosin et al. 2006).
12
b. Groupes respiratoires pontique (PRG)
Le groupe respiratoire pontique (PRG) se situe dans le pons dorsolatéral en position rostrale par rapport au RTN/pfRG, dans la continuité de la VRC (Alheid et al. 2004; Alheid & McCrimmon 2008). Il comprend le noyau kölliker-Fuse (KF), et le complexe parabrachial (médian (MPB) et latéral (LPB)). La population neuronale du PRG est très hétérogène sur le plan électrophysiologique et neurochimique. Une variété de neurones aux patrons de décharge différents y est représentée avec des neurones inspiratoires (I, I-E, E-I) et expiratoires (E, E-Dec, E-Aug) (Ezure & Tanaka 2006; Song et al. 2006). Le complexe parabrachial reçoit des projections directes du PréBötC (Tan et al. 2010). Le KF projette massivement vers la VRC, le NTS ou encore les motoneurones phréniques (Ezure & Tanaka 2006; Yokota et al. 2007; Song et al. 2012). Fonctionnellement, les groupes pontiques, en particulier le KF, jouent un rôle important dans le contrôle des VAS, notamment dans le contrôle de la phase post-inspiratoire (Alheid et al. 2004; Dutschmann et al. 2004). Les noyaux du PRG sont également impliqués dans le contrôle de la ventilation en réponse à l’activation des chémorécepteurs centraux et périphériques. (Okada et al. 1998; Damasceno et al. 2014).
I.3.3 Mécanismes de la rythmogenèse
Les différents groupes de neurones respiratoires présentés plus haut génèrent une activité respiratoire rythmique et robuste dont les mécanismes semblent faire l’objet d’une maturation. En effet, les mécanismes de la genèse du rythme respiratoire chez le nouveau-né reposeraient essentiellement sur les propriétés autorythmiques de deux oscillateurs couplés, le préBötC et le pfRG. En revanche, chez l’adulte en condition in vivo, les mécanismes de la rythmogenèse respiratoire reposeraient davantage sur les propriétés de réseau, plutôt que sur les propriétés endogènes.
a. Emergence du rythme respiratoire
L’utilisation de préparations expérimentales réduites telle que la préparation en bloc a permis de grandes avancées quant à l’identification des structures à l’origine du rythme respiratoire. En particulier, la découverte que le préBötC possède des neurones ayant des propriétés autorythmiques, a permis de le considérer comme oscillateur indispensable à la genèse de l’activité inspiratoire (Smith et al. 1991). En effet, chez le
13 nouveau-né, l’activité inspiratoire persiste dans des cellules de tranches de bulbe maintenues dans un milieu appauvri en ca2+ et qui bloque donc la transmission synaptique
(Johnson et al. 1994). De plus, l’abolition de ce groupe supprime l’activité respiratoire (Smith et al. 1991). L’activité autorythmique des neurones du préBötC repose sur la mise en jeu d’un courant sodium persistant (INap) et d’une conductance calcium non spécifique (ICAN) (Thoby-Brisson & Ramirez 2001; Del Negro et al. 2005; Ptak et al.
2005). L’inactivation pharmacologique des courant ICAN et INap abolit l’eupnée en
normoxie (Peña et al. 2004; Del Negro et al. 2005). Les neurones autorythmiques du préBötC joueraient également un rôle dans l’activité de « gasping » et la genèse du soupir (Lieske et al. 2000; Tryba et al. 2008).
Une deuxième structure, nommé pfRG, contient également des neurones autoryhtmiques qui sont actifs avant l’inspiration (Onimaru & Homma 1987; Onimaru & Homma 2003). Son abolition par transsection supprime l’activité expiratoire (Janczewski & Feldman 2006). Ainsi le pfRG formerait un oscillateur impliqué dans la genèse de l’activité expiratoire. L’activité de cet oscillateur apparait tôt durant le stade embryonnaire E14.5 soit avant celle des neurones du préBötC qui se met en place à E15 chez la souris (Thoby-Brisson et al. 2005). L’activité des neurones autorythmiques du pfRG repose sur un courant INap (Fortin & Thoby-Brisson 2009; Thoby-Brisson et al. 2009).
La découverte du pfRG a créé un vif débat au sein de la communauté scientifique visant à déterminer lequel de ces groupes est le principal générateur du rythme respiratoire. Pour clarifier la contribution de ces deux oscillateurs, une expérience utilisant les récepteurs opioïdes a été mise en œuvre. En effet, comme nous l’avons vu plus haut, les récepteurs opioïdes sont présents dans le préBötC mais pas dans le pfRG, permettant ainsi de les découpler fonctionnellement (Gray et al. 1999; Takeda et al. 2001). L’hypothèse émise postule que, si le pfRG n’a aucun rôle dans la rythmogenèse respiratoire, le blocage des neurones du préBötC par des opioïdes ne devrait avoir le même effet en tranche (technique qui conserve l’intégrité du préBotC) et en en-bloc (technique qui conserve les deux groupes). Les résultats obtenus ont infirmé l’hypothèse testée (Mellen et al. 2003). Actuellement, la théorie dite pacemaker, postule que les deux oscillateurs coexistent. Le préBötC en tant qu’oscillateur inspiratoire et le pfRG en tant qu’oscillateur expiratoire pour le pfRG seraient couplés pour générer une activité
14
respiratoire synchrone (Mellen et al. 2003; Janczewski & Feldman 2006; Feldman & Del Negro 2006; Pagliardini et al. 2011).
Cependant la théorie pacemaker ne suffit pas à expliquer l’origine du rythme respiratoire in vivo. En effet, les pacemakers sont souvent révélés dans des préparations réduites, de tranche de bulbe ou encore dans la préparation en bloc, réalisées le plus souvent chez l’animal nouveau-né (Onimaru et al, 1989; Smith et al, 1991; Smith et al. 1991; Peña et al. 2004). Del Negro et al. ont montré que le blocage du courant pacemaker INap par le Riluzole n’affectait pas la respiration (Del Negro et al. 2002) Le blocage simultané des courants INap et ICAN supprime le rythme respiratoire, mais ce dernier est
restauré après application de substance P (Del Negro et al. 2005). Aussi, d’autres auteurs ont montré in vivo et in situ que le blocage des courants pacemakers n’affecte plus l’eupnée chez les animaux après la période de maturation (St John 2008). En conclusion, il semble que les propriétés endogènes des neurones du préBötC ne soient pas indispensables à la genèse de la phase inspiratoire de l’eupnée.
b. Propriétés de réseau et/ou modèle hybride pacemaker-réseau
On a longtemps considéré que les propriétés du réseau respiratoire étaient le produit d’une activité de réseau. L’activité respiratoire rythmique résulterait de la mise en jeu de connections synaptiques principalement inhibitrices entre les différents neurones respiratoires (Hilaire & Pásaro 2003). Ces propriétés de réseau sont mises en évidence principalement chez l’adulte aussi bien in vivo qu’in situ (Funk & Feldman 1995; Paton & St-John 2007). Le blocage de la transmission gabaergique et/ou glycinergique chez la souris adulte abolit l’activité phrénique (Paton & Richter 1995). Toujours chez l’adulte, l’inhibition de la transmission glycinergique sur des tranches sagittales de tronc cérébral de rat compromet sévèrement le rythme enregistré dans la VRC (Paton et al. 1994).En revanche, la lésion des VRC et des DRG ne suffit pas à abolir le rythme respiratoire (Speck & Feldman 1982). Chez le rat nouveau-né, le blocage pharmacologique des récepteurs GABA et Glycine ne supprime pas la respiration fictive dans le tronc cérébral isolé ou en tranche de bulbe (Brockhaus & Ballanyi 1998; Ballanyi et al. 1999). Ainsi ce modèle ne suffit pas à expliquer la genèse du rythme.
15 Aujourd’hui la théorie la plus communément admise est la théorie hybride qui concilie le modèle pacemaker et réseau. Cette théorie postule que chez l’animal immature la respiration est dépendante des propriétés endogènes des neurones pacemakers. Avec la maturation post-natale de la CCR, la respiration deviendrait dépendante de propriétés de réseau. Les pacemakers seraient toujours responsables de la génèse du rythme, alors que la fréquence et le patron respiratoire seraient dépendants des connections synaptiques établies au sein du réseau (Koshiya & Smith 1999; Del Negro et al. 2005; Del Negro et al. 2008).
I.3.4 Maturation post-natale du réseau respiratoire
L’activité de la CCR apparait tôt au cours du développement embryonnaire. Des mouvements respiratoires sont détectés in utéro dès la 20ème semaine de grossesse chez
l’Homme et au 15ème jour de gestation chez la souris (Rigatto 1992, Fortin &
Thoby-Brisson 2009). A la naissance, le réseau respiratoire est fonctionnel, afin de permettre au nouveau-né d’assurer ses échanges gazeux, mais immature. Les caractéristiques électrochimiques (modification dans le contenu en neurotransmetteurs (NT) et la composition des récepteurs) et anatomiques (les connections synaptiques ainsi que le nombre de neurones du cerveau mature) évoluent. Par exemple, les sous-unités composant les récepteurs au glutamate de type NMDA sont modifiées au cours du développement post-natal (Ohtake et al. 2000). Les sous-unités composant les récepteurs au GABA sont également modifiées dans le PréBötC et le NTS (Wong-Riley & Liu 2005). Cependant ce réseau est immature et produit une respiration irrégulière qui peut être marquée par des épisodes de bradypnée, d’hyperpnées ou d’apnées (Cross 1949; Fisher et al. 1982; Hilaire & Duron 1999). La durée de cette phase de maturation post-natale dépend de l’espèce étudiée.
I.4 Adaptation de la CCR à des variations d’O2 et de CO2
I.4.1 Description des chémorécepteurs
La respiration doit maintenir l’homéostasie des concentrations sanguines en oxygène (O2) et en dioxyde de carbone (CO2) dans les limites physiologiques. Toute
16
CCR qui ajuste la commande destinée aux motoneurones. Ces variations sont détectées par des structures spécialisées, localisées au niveau périphérique et central, nommées chémorécepteurs.
a. Chémorécepteurs centraux
Au niveau du système nerveux central (SNC), il existe des chémorécepteurs qui détectent principalement les variations de CO2 et dans une moindre mesure celle d’O2. Le
CO2 constitue, en effet, un des stimuli majeurs de la CCR (Guyenet et al. 2010; Nattie &
Li 2012). Pendant longtemps, la question de savoir si les variations de CO2 étaient
détectées directement via le CO2 dissous ou indirectement via les variations de pH qu’il
entraine, a fait débat. Actuellement, c’est la deuxième hypothèse qui fait consensus au sein de la communauté scientifique (Loeschcke 1982; Guyenet et al. 2010). Dans les années 60, l’application focale de solutions acides sur la région ventrale du TC chez l’animal anesthésié et décortiqué, permet d’identifier le bulbe ventrolatéral comme structure chémosensible (Severinghaus 1998). Les recherches ultérieures ont permis de préciser plusieurs structures chémosensibles distribuées dans le TC (Branco et al. 2009; Nattie & Li 2008; Guyenet et al. 2010). Parmi elles, on retrouve le NTS (Coates et al. 1993; Berquin et al. 2000), le préBötC (Solomon et al. 2000; Krause et al. 2009), les noyaux du raphé (Wang & Richerson 1999; Wang et al. 2002), le locus coeruleus (Filosa et al. 2002; Nichols et al. 2008) ou encore le RTN (Li & Nattie 2002; Guyenet & Mulkey 2010). Actuellement, le RTN est la structure dont le rôle de chémosenseur est le mieux caractérisé.
Comme nous l’avons brièvement abordé dans la description anatomo-fonctionnelle de la CCR (I.3.2.a), le RTN est principalement impliqué dans la détection des variations de CO2/pH. Sa localisation à la surface ventrale du bulbe lui permet d’être
en contact direct avec le LCR et de pouvoir rapidement y détecter les variations chimiques des gaz du sang et du pH. L’augmentation du CO2 entraine l’augmentation de décharge
des neurones du RTN qui augmente l’activité rythmique respiratoire (Li & Nattie 2002). L’utilisation du marqueur d’activation cellulaire c-Fos montre que les cellules de cette région présentent une augmentation de l’expression de ce marqueur en réponse à un stimulus hypercapnique (Sato et al. 1992). Ces cellules, activées par le CO2, peuvent être
17 l’activité calcique augmente dans les astrocytes du RTN en réponse à des variations de pH et s’accompagne par l’augmentation de l’activité phrénique(Gourine et al. 2010). De plus, une étude récente a mis en évidence que 79% des neurones du RTN sont sensibles aux variations de CO2 (Wang et al. 2013a). Les neurones chémosensibles du RTN sont
glutamatergiques et expriment le facteur de transcription Phox2b (Guyenet et al. 2010; Onimaru et al. 2008). La photostimulation des neurones RTN-Phox2b augmente le volume courant et la fréquence respiratoire aussi bien chez l’animal éveillé qu’anesthésié (Abbott et al. 2009; Kanbar et al. 2010). La mutation de ce facteur de transcription, Phox2b, est fortement impliquée dans la disparition de la chémosensibilité chez les souris (Dubreuil et al. 2008; Amiel et al. 2009; Ramanantsoa et al. 2011; Ramanantsoa & Gallego 2013). Chez l’Homme, cette mutation est responsable du syndrome d’hypoventilation congénitale ou syndrome d’Ondine, qui se caractérise par un défaut de sensibilité au CO2 à l’origine de troubles respiratoires (Dubreuil et al. 2008; Amiel et al.
2009).
La chémosensibilité dans le RTN implique les canaux potassium sensibles à l’acide de la famille TASK (Mulkey et al. 2004; Mulkey et al. 2007b), en particulier les TASK2. L’étude de Gestreau et al. a montré que les canaux TASK2 sont exclusivement exprimés par les neurones du RTN dans le tronc cérébral, et que des souris mutantes TASK2-/- présentent des réponses ventilatoires à l’hypoxie et à l’hypercapnie altérée avec
une réponse ventilatoire à l’hypoxie chronique potentialisée et une réponse ventilatoire a l’hypercapnie atténuée (Gestreau et al. 2010).
b. Chémorécepteurs périphériques
On retrouve parmi les chémorécepteurs périphériques, les corps aortiques situés au niveau de l’arc ascendant de l’aorte (Lahiri et al. 1981; Piskuric & Nurse 2013) ainsi que les corps neuro-épithéliaux qui sont présents au niveau des voies aériennes et qui ont un placement stratégique permettant la mesure des variations d’O2 directement dans l’air
ambiant (Cutz & Jackson 1999).
Les principaux chémorécepteurs périphériques sont les corps carotidiens (CC). En 1930, Heymans montre chez le chien que les CC sont impliqués dans la réponse ventilatoire à l’hypoxie et sont responsables de la première phase d’hyperventilation.
18
Cette découverte lui vaudra le prix Nobel en 1938 (König & Seller 1991). Les CC sont des organes de petite taille dont le poids est de 13 mg et le diamètre de 2 à 3 mm chez l’Homme adulte. Situés bilatéralement à la bifurcation de l’artère carotide commune, ils reçoivent un débit sanguin très élevé comparativement à leur masse (201 L.kg-1.min-1
chez l'Homme) (Gonzalez et al. 1995). Cette vascularisation importante permet aux CC de détecter rapidement les changements des paramètres chimiques sanguins. En particulier, ils détectent principalement les variations de pression artérielle en oxygène (PaO2) et dans une moindre mesure celles en dioxyde de carbone (PaCO2) et de pH (Lahiri
& Forster 2003; Izumizaki et al. 2004). Les CC sont composés de deux types cellulaires : les cellules glomiques de type I et II (Figure4).
Les cellules glomiques de type II :
Nommées également cellules sus-tentaculaires, elles possèdent une origine conjonctive et sont proches des cellules gliales du système nerveux central (SNC). Elles représentent 15-20% de la population cellulaire des CC. Ces cellules sont non excitables (López-Barneo et al. 2010). Classiquement, on leur décrit un rôle de soutien et de support métabolique pour les cellules de type I (Kumar & Prabhakar 2012).
Les cellules glomiques de type I :
Elles dérivent des crêtes neurales et constituent le type cellulaire le plus abondant dans les CC. Elles sont excitables et sont considérées comme les cellules chémoréceptrices du CC. Elles répondent à des variations en O2, CO2 et pH en libérant
différents NT. Elles établissent des connexions synaptiques avec les axones sensitifs du nerf du sinus carotidien, une branche du nerf glossopharyngien (IX), dont les corps cellulaires se trouvent dans le ganglion pétreux. Les projections centrales du nerf glossopharyngien se trouvent essentiellement dans le NTS caudal (subdivisons commissurale et médiane) mais également dans la région du noyau ambigüe située dans la région ventrolatérale du bulbe (Finley & Katz 1992; Chen et al. 1992; Gonzalez et al. 1994; Donnelly 2007). Le message nerveux est alors intégré et relayé à la CCR.
19
Figure 4 : Organisation anatomique d’un corps carotidien.
A) Photomicrographie d’un corps carotidien isolé chez le rat nouveau-né. CSN, nerfs du sinus carotidien ; CB, Corps carotidiens ; PG, ganglion petrosal ; ICA, artère carotide interne ; ECA, artère carotide externe ; IX CN, nerf crânien IX ; X CN, nerf crânien X (Gauda & Lawson 2000). B) Schéma de l’organisation cellulaire d’un corps carotidien. Les cellules de types I contiennent des vésicules remplies de neurotransmetteurs. Elles forment un cluster entouré de cellules de type II. NF, fibre nerveuse ; V, Vaisseaux. D'après Pardal et al. 2010.
20
Les cellules glomiques de type I contiennent plusieurs NT/neuromédiateurs telles que les bioamines (l’acétylcholine (ACh); la dopamine (DA) la noradrénaline (NA); la sérotonine (5-HT)), les neuropeptides (la substance P (SP), les enképhalines), les purines (ATP, Adénosine) ou encore des molécules gazeuses (monoxyde d’azote (NO)), monoxyde de carbone (CO) (Gonzalez et al. 1994; Lahiri et al. 2001; Bairam & Carroll 2005; Iturriaga & Alcayaga 2004). Le rôle fonctionnel de chacune de ces substances n’est pas entièrement identifié. Parmi les mieux caractérisés, l’ACh et l’ATP sont décrits comme excitateurs et sont impliqués dans la réponse des CC à une hypoxie (Niane, et al. 2009; Iturriaga et al. 2009; Piskuric & Nurse 2013). La DA, quant à elle, exerce un effet inhibiteur sur la décharge du nerf du sinus carotidien via sa liaison à des autorécepteurs (D2) présynaptiques. La DA permettrait ainsi d’éviter une surexcitation nerveuse lors de l’activation des CC par l’hypoxie (Gonzalez et al. 1994; Bairam & Marchal 2003; Iturriaga et al. 2009). Dans le cadre de cette thèse, il est important de noter que les CC expriment également les récepteurs à l’EPO, nous développerons ce point dans la troisième partie de cette introduction (cf. III.2.1). De plus, les cellules glomiques expriment une grande diversité de canaux potassium dont l’activité est inhibée par l’hypoxie. On y retrouve des canaux potassium voltage dépendants, des canaux potassium à conductance large BKca et des canaux potassium sensibles à l’acide TASK (Acker 2005; Buckler 2007; Duprat et al. 2007; Peers et al. 2010).
L’élément moléculaire à l’origine de la détection de l’O2 reste controversé. Un
consensus s’établit sur l’existence de senseurs multiples plutôt qu’un senseur unique. Ces senseurs pourraient être incarnés par des hémoprotéines, des canaux potassiums sensibles à l’O2 (hypothèse membranaire), la Cytochrome C oxydase ou la NADPH oxydase
(hypothèse mitochondriale) (Acker 1994; Prabhakar & Overholt 2000; Prabhakar 2000, Teppema & Dahan 2010).
La séquence supposée de transduction du signal en réponse à une hypoxie se déroulerait comme suit : ladiminution des niveaux d’O2 entraine la fermeture des canaux
potassiums. Il s’ensuit une dépolarisation de la membrane des cellules de type I, qui provoque l’ouverture des canaux calcium voltage dépendants et l’entrée de ca2+. Cette
entrée calcique entraine la libération d’ACh et/ou d’ATP qui se fixent sur leurs récepteurs post-synaptiques dépolarisant les afférences du nerf du sinus carotidien, initiant ainsi la réponse à l’hypoxie (Teppema & Dahan 2010) (Figure 5).
21 Figure 5 : Cascade de transduction du signal des cellules sensibles à l’O2 dans les corps
carotidiens en hypoxie.
La baisse de la PaO2 est détectée au niveau des cellules glomiques par un senseur d’O2 qui
provoque la fermeture des canaux potassuims. La dépolarisation de la membrane qui en résulte entraine l’ouverture de canaux calcium voltage dépendants. L’influx d’ions ca2+ permet la
libération de NT, parmi lesquels l’acétylcholine et l’ATP, qui se fixent sur leurs récepteurs post-synaptiques. Teppema & Dahan, 2010.
22
I.4.2 Réponse ventilatoire à des variations d’O2 et de CO2
a. Réponse ventilatoire à l’hypoxie
L’O2 étant indispensable à la vie, toute variation de sa concentration sanguine doit
être rapidement corrigée. L’apport d’O2 vers les tissus peut diminuer pour plusieurs
raisons, environnementales (en haute altitude) ou métaboliques (anémie). La CCR adapte alors son activité pour ajuster la ventilation aux nouveaux besoins de l’organisme. On distingue différentes sortes d’hypoxie selon la durée et le profil de l’exposition : une hypoxie aigüe dure quelques minutes, une hypoxie chronique dure plusieurs heures à plusieurs jours et enfin une hypoxie intermittente se caractérise par une alternance de période hypoxique et normoxique. Les mécanismes adaptatifs mis en jeu diffèrent selon l’hypoxie en question. En condition d’hypoxie chronique, on observe, en plus des ajustements ventilatoires, d’autres modifications d’ordre vasculaire ou hématologique (ce point sera abordé dans le prochain chapitre). Le tout concourt à maintenir l’homéostasie de l’O2.
Au cours d’une hypoxie aigüe, la ventilation est augmentée. Cette réponse ventilatoire à l’hypoxie (RVH) est dite biphasique. Durant la première phase on observe un pic d’hyperventilation attribué à l’action des CC, suivi d’une deuxième phase où la ventilation diminue tout en restant au-dessus des valeurs de ventilation préhypoxique. Cette dernière phase est nommée dépression ventilatoire ou roll off et sa mise en place est d’origine centrale (Neubauer & Sunderram 2004; Powell et al. 1998; Teppema & Dahan 2010). La RVH connait une maturation post-natale. Chez le nouveau-né, on observe une augmentation initiale rapide de la ventilation suivi d’un roll off marqué par la diminution des valeurs de ventilation qui redescend en dessous des valeurs pré-hypoxiques, on parle alors de dépression vraie (Figure 6).
23 Figure 6 : Décours temporel de la réponse ventilatoire à l’hypoxie chez le raton âgé de 4 jours.
La réponse ventilatoire à une hypoxie aigüe chez le nouveau-né est biphasique. Après un pic d’hyperventilation initiale la ventilation diminue en dessous des valeurs préhypoxiques (dépression vraie). D'après Simakajornboon et al. 2004.
Plusieurs hypothèses, non exclusives les unes des autres, sont avancées pour expliquer les mécanismes de cette dépression. Chez le nouveau-né, l’organisme diminue sa demande métabolique en réponse à un stress hypoxique (Bonora & Gautier 1987). Cette stratégie permet de diminuer la demande d’O2 en diminuant le métabolisme aérobie.
Le ratio VE/VO2, qui permet de mesurer l’efficacité de la ventilation, est augmenté en
dépit de la diminution de la ventilation. Ceci indique que chez les nouveaux nés, il y a une hyperventilation relative (Mortola et al. 1989; Mortola 2004; Teppema & Dahan 2010). Un autre mécanisme qui pourrait expliquer la diminution de la RVH serait lié aux variations de CO2 qui ont lieu pendant l’hypoxie. En effet l’hyperventilation augmente
l’élimination du CO2 et diminue sa concentration dans le sang entrainant une hypocapnie
ou alcalose respiratoire. Cette dernière diminue l’excitabilité des chémorécepteurs périphériques et centraux et pourrait diminuer la RVH après le premier pic (Neubauer et al. 1990). Enfin, parmi les mécanismes responsables de l’immaturité de RVH, on retrouve l’immaturité fonctionnelle de la CCR, que nous avons décrit plus haut, mais aussi celle des CC. En effet, les CC passent par une étape de maturation postnatale. A la naissance
Dépression vraie Hyperventilation Temps (min) Hypoxie V en ti lat ion ( % d es val eu rs p ré h yp oxi q u es )
24
les CC subissent un « resetting ». Les niveaux d’O2 nécessaire pour les activer passent de
25 à 55 Torr.Cette étape est suivie par une augmentation graduelle de la sensibilité à l’O2
du sinus des nerfs carotidiens ainsi qu’une augmentation de sa capacité à maintenir une décharge élevée en réponse à une hypoxie prolongée (Donnelly 2000; Carroll 2003; Carroll & Kim 2013). D’autres modifications d’ordre morphologiques, anatomiques et biochimiques ont également lieu. On observe une augmentation des terminaisons nerveuses afférentes, une prolifération des cellules de type I et II, une modification de la densité des canaux potassium impliqués dans la sensibilité à l’O2 ainsi qu'une
modification du contenu en NT(Hatton et al. 1997; Wang & Bisgard 2005; Wasicko et al. 2006; Bairam & Carroll 2005; Carroll & Kim 2005). La maturation de la RVH est
complétée à P21 chez la rat, elle alors similaire à celle observée chez l’adulte. Elle garde son caractère biphasique, mais la diminution de la ventilation durant le roll off est beaucoup moins marquée. La ventilation demeure au-dessus des valeurs préhypoxiques (Niane et al. 2011) (Figure 7).