JASMIN HANNA
CAPTURE ENZYMATIQUE DU DIOXYDE DE
CARBONE PAR L'HCA H IMMOBILISÉE :
ÉTUDE CINÉTIQUE DE L'HYDRATATION
CATALYTTQUE
Mémoire présenté
à la Faculté des études supérieures et postdoctorales de l'Université Laval dans le cadre du programme de maîtrise en génie chimique
pour l'obtention du grade de Maître es sciences (M. Se.)
DEPARTEMENT DE GENIE CHIMIQUE FACULTÉS DES SCIENCES ET DE GÉNIE
- UNIVERSITÉ LAVAL QUÉBEC
Résumé
Le réchauffement climatique est un problème de plus en plus préoccupant pour la communauté scientifique. La plupart des experts affirment qu'une solution temporaire à ce problème consiste à réduire les émissions de CO2. Un moyen efficace permettant de réduire les émissions de CO2 tout en continuant à exploiter les ressources mondiales de pétrole et de charbon est la capture du CO2. La dernière décennie a vue naître une technologie des plus novatrices dans le domaine de la capture du CO2 soit l'utilisation de l'anhydrase carbonique, une enzyme catalysant la réaction d'hydratation du CO2 de façon très efficace (kh » ÎOV1 ). Ce projet de maîtrise présente une étude cinétique de l'hydratation du CO2 en
présence de l'anhydrase carbonique humaine de type II (l'hCA II) immobilisée, réalisée à l'aide d'un microréacteur enzymatique. Présentement, l'utilisation de cette enzyme à des fins industrielles est très limitée. Le travail présenté ici est innovateur; à notre connaissance, aucune étude similaire impliquant l'enzyme immobilisée n'est disponible dans la littérature ouverte. Cette étude cinétique contribuera ultérieurement au design d'un réacteur monolithique enzymatique destiné à la capture du CO2. La réalisation de cette étude cinétique a nécessité plusieurs étapes préliminaires : la production de l'enzyme, l'immobilisation de l'enzyme et la caractérisation de l'immobilisation. Les résultats expérimentaux ont démontré que la contribution du biocatalyseur sur la réaction globale d'hydratation du CO2 augmente avec l'augmentation du débit volumétrique et l'augmentation de la concentration initiale en molécules de tampon non protonées, ainsi qu'avec la diminution de la concentration initiale en CO2. Un modèle cinétique de l'hydratation catalytique du CO2 par l'hCA II immobilisée basé sur un mécanisme Quad Quad Iso Ping-pong aléatoire a aussi été développé grâce aux résultats expérimentaux.
Abstract
The global warming is an increasingly worrying issue for the international community. Most experts agree that a temporary solution for this problem is to reduce CO2 emissions. An effective way to reduce CO2 emissions while continuing to leverage the global resources of oil and coal is the CO2 capture. An innovative method to capture CO2 is the utilization of carbonic anhydrase as a biocatalyst. Ex-vivo applications of human carbonic anhydrase II (hCA II) for its potential in CO2 capture technologies are emerging due to the formidably large hydration turnover number, k^, ~ lu s" that Nature endowed this enzyme with to catalyze aqueous hydration of CO2 near diffusion limits. Binding of hCA II enzyme on a solid support is an attractive way to perform CO2 capture and has several advantages, including easier separation of the reaction products without catalyst contamination, ability to recover and reuse the enzyme, increase of the enzyme stability and operational lifetime, continuous operation of enzymatic processes and flexibility of the reactor design. For the design of the scrubber for CO2 capture, a kinetic study of the enzymatic hydration of CO2 in the presence of immobilized hCA-II was performed in this work using an intensified microreactor. hCA II was immobilized on the inner surface of a nylon tube. The enzyme immobilization was carried out by a sequence of several chemical reactions to generate covalent bonds between the enzymes and the inner surface of the tube. The Bradford method and the esterase activity test were performed to estimate the quantity of enzymes attached and the quantity of active proteins. The effect of several operational parameters like CQ2 and unprotoned buffer concentrations and volumetric flow was studied. The experimental results showed that the contribution of the enzyme on global reaction of CO2 increases with the increase in the volumetric flow and unprotoned buffer concentration and with the decrease in CO2 concentration. Experimental data allowed to develop a kinetic model of the catalytic hydration of CO2 by the immobilized hCA II based on pseudo random Quad Quad Iso Ping-Pong mechanism. To the best of our knowledge, no similar kinetic study is available in the open literature on immobilized hCA II.
Table des matières
Résumé i Abstract ii Table des matières iii
Liste des tableaux v Liste des figures vi 'inclus dans l'article viii Remerciements xi
Avant-propos1 xii
L Introduction 1 1.1 Problématique et mise en contexte 1
1.1.1 Réchauffement climatique 1 1.1.2 Capture et stockage du CO2 2 1.1.3 Survol des technologies enzymatiques de capture du CO2 3
1.2 Enzyme - anhydrase carbonique humaine de type II 13
1.2.1 Généralité sur l'hCA II 13 1.2.2 Les isoenzymes de l'hCAII 14 1.2.3 Structure de l'hCA II 15 1.2.4 Mécanisme catalytique 24 1.2.5 Modèles cinétiques 28 2. Objectifs 41 3. Méthodologie 43 3.1 Production de l'enzyme 43 3.2 Immobilisation de l'enzyme 46 3.3 Quantification protéique 49 3.4 Activité esterase 50 3.5 Hydratation catalytique du CO2 52
4. Enzymatic CO2 capture by immobilized hCA II in an intensified microreactor - kinetic
study of the catalytic hydration 57
4.2 Materials and methods 60
4.2.1. Materials 60 4.2.2. Enzyme preparation and immobilization 61
4.2.3. Quantification of immobilized enzyme 61 4.2.4. Quantification of active immobilized enzymes 62
4.2.5. Carbon dioxide catalytic hydration 62
4.2 Theoretical background 65 4.3.1. Catalyzed CO2 hydration kinetics 65
4.3.2. Intensified microreactor model 67 4.3.3. Uncatalyzed CO2 hydration kinetics 70
4.4 Results and discussion 71
4.5 Conclusion 78 5. Conclusions générales et recommandations 81
Références 85
Liste des tableaux
Tableau 1. Liste des acides aminésTableau 2. Structure secondaire de l'hCA II. Tableau 3. Nomenclature des réactifs
Tableau 4. Nomenclature des formes de l'enzyme Tableau 5. Base de données expérimentales. Tableau 6. Milieu de culture
Tableau 7. Experimental conditions tested for kinetic study1
Tableau 8. The rate constant aggregates, turnover, apparent Michaelis and inhibition constants - immobilized human carbonic anhydrase II1
Tableau 9. The equilibrium constants1
Tableau 10. The rate constant aggregates, turnover, apparent Michaelis and inhibition constants - solution-phase human carbonic anhydrase II1
Liste des figures
Figure 1. Principe de fonctionnement d'un procédé membranaire. Figure 2. Réacteur membranaire type tubes/calandre.
Figure 3. Contacteur à membranes tubulaires. Figure 4. Colonne garnie co-courant croiser. Figure 5. Tour de pulvérisation.
Figure 6. Colonne à bulle.
Figure 7. Catégories d'acides aminés. Figure 8. Liaison peptidique.
Figure 9. Séquence d'acides aminés de l'hCA II. Figure 10. Hélice-a.
Figure 11. Feuillet p.
Figure 12. Feuillet-P central.
Figure 13. Feuillet-P central, moitié supérieure et inférieure. Figure 14. Moitié inférieure.
Figure 15. Résidus N-terminus et C-terminus. Figure 16. Site actif.
Figure 17. Conformation de l'ion de zinc. Figure 18. Liaison du substrat.
Figure 20. Libération du bicarbonate.
Figure 21. Transfert intramoléculaire du proton. Figure 22. Transfert intermoléculaire du proton.
Figure 23. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Steiner et al. (1976).
Figure 24. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Steiner et al. (1975).
Figure 25. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Rowlett et Silverman(1982).
Figure 26. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle c/de Larachi (2010).
Figure 27. Cellule d'ultrafiltration Amicon. Figure 28. Schéma du montage d'immobilisation.
Figure 29. Droite d'étalonnage, test de Bradford (standard BSA). Figure 30. Droite d'étalonnage, test d'activité esterase.
Figure 31. Schéma de 1TEAD modifié. Figure 32. Mixeurs statiques.
Figure 33. Cellule de détection.
Figure 34. Droite d'étalonnage, étude cinétique de l'hydratation catalytique du CO2 (tampon imidazole/H2S04 30 mM, pH 7.5).
Figure 36. Schematic experimental flowsheet for kinetic study: [1] syringe pumps; [2] intensified microreactor; [3] flow cell; [4] spectrophotometer; [5] computer.1*
Figure 37. Exit HC03 concentration vs. liquid velocity: microreactor coated with
enzymes and free-enzymes microreactor. Feed conditions: C ^ =17 mM, Cg =20 m M , C"H+=10mM,pH=7.5.1
Figure 38. Exit HCOj concentration vs. CO2 concentration: microreactor coated with enzymes and free-enzymes microreactor. Feed conditions: ^=0.005 irrs, CB1=20mM,
CB^=10mM,pH=7.5.1
Figure 39. Exit H C 03 concentration vs. liquid velocity: microreactor coated with
enzymes and free-enzymes microreactor. Feed conditions: C^=17 mM, CB =10 m M ,
q ^ O m M , PH=6.89.1
Figure 40. Exit HC03 concentration vs. CO2 concentration: experimental and modeling.
Feed conditions: vrf=0.005rrys,C^=20mM , C™H+=10mM, PH=7.5.1
Figure 41. Exit HCOj concentration vs. liquid velocity: experimental and modeling. Feed conditions: Q = 1 7 m M , C ^ O m M , C"H+=10mM,pH=7.5.1
Figure.42. Exit HCO3 concentration vs. liquid velocity: experimental and modeling. Feed
conditions: C^=17mM, C^=10mM, C^H+=20mM,pH=6.89.1
Figure 43. Exit HCOj concentration vs. liquid velocity - effect of buffer concentration: experimental and modeling (C^, =17 mM).1
Notations1
as specific surface area, m /m reactor
CEO enzyme load, kmol/m^,,
Cj concentration of speciesy in liquid phase, kmol/m3
Dr radial dispersion coefficient in liquid phase, m /s
Di axial dispersion coefficient in liquid phase, m2/s
L microreactor length, m
r radial position within microreactor, m R microreactor radius
Rj reaction rate, kmol/m3s
t time, s vt liquid velocity, m/s z axial coordinate, m Subscripts/Superscripts c catalyzed in microreactor inlet itc uncatalyzed
Remerciements
Je tiens à remercier ma directrice de recherche la Dre. Maria-Cornelia Iliuta pour le support (moral et financier), la liberté et la confiance qu'elle m'a accordées tout au long de ce projet de recherche. Je tiens aussi à remercier mon codirecteur de recherche le Dr. Faïçal Karachi pour son support financier ainsi que pour ces précieux conseils. Je voudrais aussi remercier le Dr. Ion Iliuta pour son immense contribution à l'article (partie modélisation). Je tiens aussi à remercier le Dr. Alain Gamier de m'avoir donné accès à ses laboratoires afin de pouvoir produire l'enzyme. Finalement, je tiens à remercier ma mère pour son écoute, sa disponibilité et sa grande générosité.
Avant-propos
1Le présent mémoire a été rédigé en cinq parties : (1) introduction qui porte sur la mise en contexte et la problématique du projet de recherche ainsi qu'une revue de la littérature portant sur l'anhydrase carbonique humaine de type II (structure, mécanisme catalytique et modèle cinétique), (2) objectifs, (3) méthodologie (production de l'enzyme, immobilisation de l'enzyme, caractérisation de l'immobilisation et étude cinétique de l'hydratation catalytique), (4)1 manuscrit de l'article, ainsi que (5) conclusions générales et
recommandations.
Le manuscrit de l'article a été soumis au journal scientifique International Journal of Greenhouse Gas Control le 28 août 2012:
Hanna, J.; Iliuta, L; Larachi, F.; Iliuta, M.C. "Enzymatic CO2 capture by immobilized hCA n in a microreactor - kinetic study of the catalytic hydration".
Je suis l'auteur principal de cet article. J'ai effectué l'ensemble des travaux expérimentaux et interprété les données sous la supervision des deux directeurs de recherche. Le Dr. Ion Iliuta a réalisé tous les travaux de modélisation. À l'exception de la partie portant sur la modélisation rédigée par le Dr. Ion Iliuta, j'ai rédigé cet article en tenant compte des suggestions et corrections des coauteurs.
Ce projet de maîtrise a été réalisé sous la direction de la professeure Maria Iliuta et sous la codirection du professeur Faïçal Larachi.
' Ce mémoire a été rédigé en français à l'exception de la quatrième partie (manuscrit de l'article), qui a été rédigée, selon les exigences, dans la langue de Shakespeare.
1. Introduction
1.1 Problématique et mise en contexte
1.1.1 Réchauffement climatique
Le réchauffement climatique est de plus en plus au cœur des préoccupations de la communauté scientifique internationale car il s'agit d'une problématique qui touche la terre entière et tous ses habitants, peu importe leur nationalité ou leur classe sociale.
Le réchauffement climatique est dû à une augmentation de l'effet de serre naturel. L'effet de serre se définit comme étant le piégeage par l'atmosphère de la partie du rayonnement solaire normalement retournée dans l'espace sous forme de rayons infrarouges. L'augmentation de la quantité de gaz à effet de serre dans l'atmosphère limite les possibilités d'échappement des rayons infrarouges en réduisant la fenêtre atmosphérique par laquelle ceux-ci s'échappent normalement ce qui entraîne une augmentation de l'effet de serre naturel et du même coup une augmentation de la température terrestre.
Selon l'IPCC (2005), il y a quatre principaux gaz à effet de serre d'origine anthropique. On y retrouve le méthane (CH4), les gaz fluorés, les oxydes nitreux (NOx) et le dioxyde de
carbone (CO2). En 2004, 1,1% des émissions totales des gaz à effet de serre d'origine anthropique étaient attribuables aux gaz fluorés, 7,9% aux oxydes nitreux, 14,3% au méthane et 76,7 % au CO2 (IPCC, 2005). On remarque ici que le CO2 est de loin le gaz à effet de serre d'origine anthropique dont les émissions sont les plus abondantes. Les émissions de CO2 proviennent de différentes sources, les principales étant l'utilisation de combustibles fossiles (production, distribution et consommation) et la production de ciment. Vient ensuite les émissions de CO2 provenant du déboisement et de la décomposition de la biomasse.
Entre la période préindustrielle et 2005 la concentration atmosphérique de CO2 a augmentée de 280 à 379 ppm (IPCC, 2005). Cette augmentation est supérieure aux variations naturelles des 650 000 dernières années (180 à 300 ppm). Entre 1995 et 2005, on
assiste à une augmentation de la concentration atmosphérique de CO2 de 1,9 ppm par an, ce qui est supérieur à celle enregistrée entre 1960 et 2005 qui se chiffre à 1,4 ppm par an. Selon le dernier rapport IPCC sur les énergies renouvelables et les changements climatiques (IPCC, 2012), la concentration atmosphérique en CO2 à la fin de l'année 2010 se situe à environ 390 ppm, ce qui signifie 39% supérieur à la valeur correspondante au niveau préindustriel (novembre 2012). Cette augmentation de la concentration atmosphérique en CO2 et surtout les conséquences en découlant expliquent pourquoi de nombreux groupes de recherche essaient de trouver de nouvelles méthodes de capture du CO2 efficaces et peu onéreuses.
1.1.2 Capture et stockage du C0
2La capture et le stockage du CO2 comportent plusieurs éléments. Il existe trois méthodes pour capturer le CO2 des émissions industrielles (ex., fumées de combustion du gaz naturel, charbon, pétrole) : la capture en postcombustion, précombustion et oxycombustion (Abu-Khader, 2006).
Les procédés précombustion consistent à gazéifier le combustible fossile primaire dans un premier réacteur, en y injectant de la vapeur et de l'air afin de produire un mélange de monoxyde de carbone et d'hydrogène. Par la suite, le mélange est introduit dans un second réacteur où de la vapeur y est ajoutée. La réaction entre la vapeur et le monoxyde de carbone a pour effet de produire un mélange composé principalement de CO2 et d'hydrogène. Ce mélange peut être séparé en un flux de CO2 et un flux d'hydrogène. Le flux d'hydrogène peut servir de combustible « vert » ne contenant aucun carbone et le flux de CO2 peut être stocké ou utilisé à des fins industrielles.
Les procédés en oxycombustion ont comme particularité l'utilisation dé l'oxygène pur comme comburant, à la place de l'air, afin d'effectuer la combustion du combustible fossile primaire, ce qui fait en sorte que le produit de combustion est uniquement composé de vapeur d'eau et de CO2, un mélange facilement separable. Suite à l'oxycombustion, la vapeur d'eau est récupérée en refroidissant et en compressant le flux gazeux, ce qui permet d'obtenir un flux gazeux ayant une concentration très élevée en CO2 (plus de 80% en volume).
Les procédés postcombustion consistent à séparer le CO2 des autres produits gazeux suite à la combustion d'un combustible fossile primaire. Plusieurs catégories de procédé peuvent être appliquées à cet effet tel que l'absorption par solvant chimique (ex., solutions d'aminés) (Barzagli et al., 2010), l'adsorption sur des solides (Wang et al., 2011), des membranes (Li et Chen, 2005), etc. Or la dernière décennie a vu naître une toute nouvelle catégorie de procédé postcombustion, les procédés de capture par voie enzymatique utilisant l'anhydrase carbonique humaine de type deux (hCA II).
Une fois le CO2 piégé, celui-ci doit être transporté vers les lieux de stockage. Le transport s'effectue généralement par gazoduc ou par navire. Il existe différentes méthodes pour le stockage du CO2, le stockage géologique et le stockage sous l'océan étant les deux principales méthodes. Le CO2 peut aussi être stocké sous forme stable, inerte et solide suite à une carbonatation minérale. Finalement, le CO2 peut aussi être utilisé à des fins industrielles comme dans la fabrication de boissons gazeuses ou la synthèse des produits à haute valeur ajoutée.
1.1.3 Survol des technologies en zym a tiques de capture du CO2
Les procédés de capture du CO2 par voie enzymatique par l'intermédiaire de l'anhydrase carbonique (CA) sont très diversifiés. Deux tendances se démarquent pour les procédés utilisant la CA comme biocatalyseur : les procédés membranaires et les contacteurs gaz liquide de type colonne (colonne garnie, tour de pulvérisation et colonne à bulle).
Procédés membranaires
Un brevet déposé par Trachtenberg (Trachtenberg, 2000) propose un procédé membranaire permettant d'absorber le CO2 d'un effluent gazeux en le mettant en contact avec une membrane liquide (liquid-containing membrane, LCM) sur laquelle est immobilisée la CA et par la suite de le désorber de l'autre côté de la membrane grâce à un gaz de balayage ou vacuum (figure 1). La membrane liquide est composée d'une solution tampon de phosphate de sodium 20 mM prise en sandwich entre deux membranes de polymère. La CA est immobilisée sur la surface externe des membranes polymériques et est recouverte d'une fine couche de polymère. L'enzyme est aussi présente en solution dans la
phase liquide de membrane. L'effluent gazeux à traiter s'écoule du bas vers le haut parallèlement à la membrane liquide, alors que l'effluent gazeux riche en CO2 s'écoule en sens contraire. En entrant en contact avec la membrane, le CO2 absorbé est hydraté en bicarbonate grâce aux propriétés catalytiques de la CA. Un gradient de concentration est maintenu par le balayage du gaz riche en CO2, ce qui fait en sorte que le bicarbonate est transporté vers le côté perméat de la membrane où il est reconstitué en CO2 moléculaire afin d'être entraîné par balayage. La solution tampon interne est agitée permettant ainsi la présence de tampon libre en bicarbonate du côté de l'alimentation et d'une solution riche en bicarbonate du côté perméat. Mbad Gas OUT Immobilization Support - B Up» n m - 28 Hollow Center / Muted Q w - 10 M? o> HrO
î
Immobilized Second Pnase - Carbonic Anhydrase • 121 6 . Aqueoua Riosphate
à Buflw Syetem 7 ^ B x J V¥a« - 6 I :"■". l ; : ; ; : ; < t f - ^ Toroidal Recovery Zone - 22 immobilization Support - 8 4-Purified Qu • 24 \ Stirrer • \W 002 Hi r*0 Permeable Waï - 9 Chamber Lipid Film - 26 - Vessel Wall - 2 002
Figure 1. Principe de fonctionnement d'un procédé membranaire (Trachtenbeg, 2000).
Des publications plus récentes de Trachtenberg laissent croire que l'idée d'immobiliser les enzymes sur les parois des membranes a été abandonnée pour laisser place aux enzymes libres dans la phase liquide de la membrane (Trachtenberg et al. 2003; Bao et al. 2005; Bao et al. 2006). Ces travaux proposent une nouvelle configuration de réacteur s'apparentant à un échangeur de chaleur de type tubes/calandre (figure 2). Ce réacteur se compose de plusieurs membranes tabulaires positionnées perpendiculairement les unes aux autres. En
fonction de leur direction, les membranes contiennent soit le gaz à traiter soit le gaz riche en CO2. La calandre est chargée d'une solution tampon contenant la CA libre.
Liquid Membrane (Shell Side) Feed Fiber* (Flue C M ) Sweep Fiber* (Vacuum, Steam, Ar)
Figure 2. Réacteur membranaire type tubes/calandre (Bao et Trachtenberg, 2006).
Les réacteurs utilisant des membranes liquides (LCM) offrent certains avantages : ils ne sont aucunement limités par la gravité (engorgement) et permettent une grande sélectivité. En revanche, ce type de réacteur comporte aussi certains désavantages: un mouillage des pores inapproprié une perte de charge élevée à travers les fibres et entre les différentes fibres (réacteur LCM tubes/calandre), ainsi qu'une défaillance due à l'encrassement.
Un autre type de procédé membranaire utilisant la CA comme biocatalyseur est celui proposé par Dziedzic et al. (2006). Il s'agit d'un procédé comprenant trois modules distinct, chacun correspondant à une étape du procédé (figure 3) : (i) un contacteur à membranes tubulaires, (ii) un module de conversion et (iii) un module de minéralisation. Dans un premier temps, le CO2 contenu dans l'effluent gazeux à traiter est absorbé par le liquide absorbant circulant dans les membranes tubulaires. La solution absorbante peut être de l'eau, une solution d'hydroxyde de potassium (20 mM, pH 12,) ou une solution d'hydroxyde de potassium à laquelle 10 g/L de CA a été ajoutée. En sortant des membranes tubulaires, le liquide absorbant riche en CO2 se dirige vers le module de conversion qui contient une matrice supportant la CA pour catalyser l'hydratation du CO2. Le pH du liquide absorbant riche en CO2 est alcalinisé grâce à une solution basique alimentant le module de conversion. La solution basique utilisée est une solution aqueuse contenant 1M
de NaOH ou de KOH. L'effluent sortant du module de conversion alimente par la suite le module de minéralisation où des cations de calcium (Ca+) sous forme d'une solution 1 M
de CaCl2 • 2H20 sont ajoutés au liquide absorbant afin de former un précipité solide de
CaCQ3
Ftowmalef
i . . i < . , . . .
Hovwnelt»
R-P u r p W»tw*8as«
Water* Base <CA > Beee ' ) — j r—<~ CA ■:' Conversmn Mo<M« t Pump o F 7 Mnsratush C*CO>
Figure 3. Contacteur à membranes tubulaires (Dziedic et al., 2006).
L'utilisation des contacteurs à membranes, tel que celui proposé par Dziedic et al. (2006) offre plusieurs avantages : ils ne sont pas limités par l'engorgement, permettent un accès direct au liquide absorbant et combinent la capture et la séquestration du CO2 grâce à la production de carbonate de calcium. Les désavantages pour ce type de réacteurs sont les mêmes que pour les réacteurs utilisant des membranes liquides.
Colonnes garnies
Les colonnes garnies classiques ont aussi fait l'objet de brevets portant sur le développement de nouvelles plateformes technologiques pour l'utilisation de la CA à des fins de capture du CO2. Biais et Rogers (2003) ont proposé l'utilisation d'une colonne garnie fonctionnant à contre courant et dont le garnissage est recouvert de CA immobilisée. Le flux gazeux à traiter est alimenté via un distributeur de gaz situé en pied de colonne, alors que le liquide absorbant constitué d'un tampon 12 mM de 2amino22
(hydroxymethyl)-l,3-propanediol (AHPD) est alimenté en tête de colonne. Cette configuration de colonne peut servir tant pour l'absorption que pour la désorption du CO2. Par contre, lorsque la colonne est utilisée pour la désorption, elle doit être plus grande car la réaction inverse de l'hydratation du CO2 est plus lente que la réaction directe. De plus, un vacuum doit aussi être appliqué afin d'obtenir une désorption adéquate. Une configuration alternative à la colonne de désorption précédemment décrite consiste à utiliser deux colonnes remplies de résines échangeuses d'ions en alternance, une permettant l'adsorption des ions de bicarbonate et l'autre permettant la régénération des résines ayant absorbé des ions de bicarbonate.
Un autre procédé basé sur l'utilisation d'une colonne garnie à contre-courant, très similaire à celui décrit précédemment, a été proposé par Anctil et Gaudreault (2006). La principale différence consiste en l'ajout d'un réservoir agité alimenté en Ca(OH)2 dans lequel le liquide absorbant riche en bicarbonate se déverse afin de former un précipité solide de CaC03. Ce procédé a l'avantage de combiner la capture et la formation d'un précipité solide inerte qui peut être entreposé, réutilisé ou éliminé.
Plusieurs éléments font en sorte que les colonnes garnies à contre courant sont intéressantes pour la capture du CO2 : coefficient de transfert de matière élevé et surface de transfert élevée. Cependant, plusieurs facteurs rendent l'utilisation des colonnes garnies à contre-courant laborieuse :
• Lorsqu'elles sont utilisées pour la désorption, elles libèrent du CO2;
• L'utilisation des résines échangeuses d'ions pour la désorption nécessite de l'équipement additionnel;
• Afin d'utiliser l'enzyme immobilisée de façon efficace, il faut être en mesure d'obtenir des valeurs élevées de coefficient de transfert de matière du côté liquide aux interfaces gaz-liquide et liquide-solide car le CO2 moléculaire peut réagir avec l'eau, les ions hydroxyles et/ou les amines pour former du bicarbonate ou des carbamates avant de réagir avec l'enzyme immobilisée.
Une colonne garnie à co-courant croisé a aussi fait l'objet d'un brevet (Bhattacharya et al. 2004) (figure 4). Le garnissage de la colonne est composé de limailles de fers (0,35-0,6
liquide absorbant et alimente la colonne par le haut grâce à un distributeur de liquide. Le gaz à traiter est introduit radialement en tête de colonne et est purgé horizontalement en pied de colonne.
Liquid Distributor
Liquid Outlet Figure 4. Colonne garnie co-courant croisé
(Bhattacharya et al., 2004).
Ce type de colonne comporte certains avantages : coefficient de matière élevé et surface de transfert de matière élevé (garnissage submillimétrique). Par contre, l'utilisation de garnissage submillimétrique entraîne des pertes de charge très élevées, ce qui pourrait causer beaucoup de problèmes pour la mise à l'échelle industrielle.
Tours de pulvérisation
Des contacteurs gaz-liquide moins conventionnels que les colonnes garnies ont aussi fait l'objet de brevets comme le démontre la tour de pulvérisation proposée par Fradette (2004) (figure 5). Ce procédé utilise la CA libre ou immobilisée sur de fines particules. Le liquide absorbant (tampon 12 mM AHPD) est atomisé sous forme de petites gouttelettes en tête de colonne et le gaz est introduit en pied de colonne. Un éliminateur de brouillard est utilisé pour déshumidifier le gaz avant qu'il sort de la colonne. Deux configurations sont proposées pour ce procédé, chacune d'entre elles comprenant un module de séparation, un système de renouvellement des réactifs (make-up) et un contrôle de pH. Dans la première
configuration, des résines échangeuses d'ions sont utilisées pour adsorber le bicarbonate, le système de renouvellement des réactifs alimente la phase liquide en enzymes libres ou immobilisées et le module de séparation consiste en une unité d'ultrafiltration ou de nanofiltration permettant de récupérer un maximum de CA, de bicarbonate et de résine échangeuse d'ions. Dans la seconde configuration, le système de renouvellement des réactifs alimente la phase liquide introduite dans la tour en enzymes libres ou immobilisées et en ions de calcium (Ca+2, sous forme de Ca(OH)2) afin de faire précipiter le bicarbonate
en carbonate de calcium. L'unité de séparation est alors utilisée pour filtrer ou décanter le liquide sortant de la tour de pulvérisation.
WafcoM») M * t t * - U » Cor**gura4>on 1 (tcmnQutaNem t **■> * wmammt 5* f * m v >w^ iiitiurf <«* * * e»r* Semi Q . t O u O M • Ettmtrwtor pHCHawlll « n d U e » * U» Uauiii , Q . t O u O M • »> .4 «*. 4» Jwj* " " ■ » ! H I ■ U | LB>4BWI Hm ^^•paee» **^fWw Hm U M ^^•paee» **^fWw ■ZÎeTS. 1 ConflvkvaBoR 1 y*»e* * — - OaaliMM* t et ii a. t Baaaaiei ■«M tmtmtmim ? Lkjute 1 > , V aaaesf
Figure 5. Tour de pulvérisation (Fradette, 2004).
L'avantage majeur de la tour de pulvérisation provient du fait que l'enzyme est présente à l'interface gazliquide. Toutefois, la mise à l'échelle industrielle est loin d'être évidente car les débits gazeux sont fortement limités par l'entraînement des gouttelettes.
Un autre type de contacteur gaz-liquide peu conventionnel a aussi fait l'objet d'un brevet (Parent et Dutil, 2007) et consiste dans une colonne à bulle fonctionnant à contre courant et dont la phase liquide contient de la CA (figure 6). L'enzyme peut être utilisée libre, encapsulée dans un substrat poreux de silice d'alginate ou immobilisée sur un support solide. Un agitateur peut être installé afin d'améliorer le mélange si le débit gazeux est trop faible pour engendrer un mélange suffisant. Le réacteur est opéré à pression élevée contrôlée par deux valves, une située au niveau du distributeur de gaz et l'autre au niveau du distributeur de liquide. La colonne comprend un dispositif permettant la rétention du biocatalyseur qui peut être soit une membrane d'ultrafiltration, une membrane de nanofiltration ou simplement une cartouche de filtration, dépendant si la CA est libre ou immobilisée. Deux dispositions de membranes sont décrites pour ce procédé, une première dans laquelle la membrane est positionnée au fond de la colonne et une seconde où la membrane est située à l'extérieur du réacteur et positionnée tangentiellement au débit de liquide.
Cette configuration de procédé permet la présence d'enzymes à l'interface gaz-liquide. Malheureusement, beaucoup d'inconvénients sont rattachés à ce procédé : les membranes d'ultrafiltration et de nanofiltration peuvent facilement se colmater, les pertes de charges sont élevées, l'utilisation des membranes filtrantes limite le procédé aux faibles débits liquides. De plus, les colonnes à bulles sont habituellement utilisées pour les procédés comportant des réactions lentes en phase liquide où le transfert de matière à l'interface gaz-liquide n'est pas limitant, mais ce n'est pas le cas pour l'hydratation enzymatique du CO2.
Gas Distributors Liquid Pressure In et Regulating Valve Gas Outlet
'*■
Retention Device: F fee Soluble CA Ultrafilvaton Nanonlration immobilaetJCA Fitter Cartridge Gas. Inlet Pressure Regulating Liquid Valve OutletFigure 6. Colonne à bulle (Parent et Dutil, 2007).
La capture du CO2 demeure un énorme défi technologique. Bien que la CA possède un turnover rate extrêmement élevé, son efficacité pour la capture du CO2 n'est pas garantie car l'exploitation optimale du pouvoir catalytique de cette enzyme n'est pas encore très évidente. Afin d'utiliser l'anhydrase carbonique efficacement, trois facteurs doivent être pris en compte : (i) aucune limitation par le transfert de matière aux interfaces (idéalement, un fonctionnement en régime contrôlé par les réactions chimiques), (ii) l'enzyme devra être facilement separable du milieu réactionnel, (iii) le produit (HCO3) devra être soutiré in-situ afin d'éviter l'inhibition de l'enzyme par celui-ci, étant donné la réversibilité de la réaction.
Les technologies énumérées précédemment n'ont pas encore démontré leur potentiel à une échelle commerciale. Néanmoins, certaines configurations de réacteurs sont plutôt prometteuses, comme le réacteur monolithe gaz-liquide (Lacroix et Larachi, 2010). Ce type de réacteur permet de diminuer significativement la résistance aux transferts de masse en comparaison aux réacteurs à lit fixe et aux colonnes garnies. Le transfert de matière en régime d'écoulement de Taylor diphasique est accru par le film gazeux entourant le train de bulles (Vandu et al., 2005), entraînant ainsi des coefficients de transfert de matière très élevés pour le réacteur monolithique, soit deux ordres de grandeurs supérieur à ceux d'un réacteur à lit fixe (Vandu et al. 2005, Liu et al. 2005). Toutefois, peu- d'études ont été menées sur l'utilisation du monolithe pour la capture enzymatique du CO2 Dans ce contexte, le présent projet vise à réaliser une étude cinétique de l'hydratation du CO2 dans un microréacteur intensifié en présence d'enzymes immobilisées. Cette étude permettra ainsi de mieux comprendre les phénomènes régissant l'hydratation du CO2 en phase liquide dans un microcanal.
1.2 Enzyme - anhydrase carbonique humaine de type II
1.2.1 Généralité sur l'hCA IIL'anhydrase carbonique de type II (hCA-II) est une métalloenzyme ayant comme cofacteur un ion de zinc (Zn2+) situé au fond de son site actif. Certaines enzymes
nécessitent de petites molécules non protéiques afin d'être actives; ces molécules sont nommées cofacteurs. Dans le cas d'une métalloenzyme, le cofacteur est un ion métallique. Certaines enzymes peuvent nécessiter plus d'un ion métallique. La partie protéique de l'enzyme est quant à elle nommée apoenzyme. L'ensemble formé par l'apoenzyme et son (ou ses) cofacteur(s) est nommé holoenzyme.
L'intérêt porté par les ingénieurs œuvrant dans le domaine de la capture du CO2 pour cette enzyme provient du fait que celle-ci catalyse la réaction d'hydratation du CO2 à une vitesse phénoménale (k^ = 106s_1). Le taux d'hydratation maximal ou kcat correspond au
nombre de moles de produit formés par moles d'enzymes par unité de temps lorsque les enzymes sont saturés en substrat.
L'hCA-II catalyse aussi la réaction d'hydrolyse du nitrophényl d'acétate en p-nitrophénol. Étant plus facile à observer que la réaction d'hydratation du CQ2, cette réaction est souvent utilisée afin d'effectuer des tests d'activité. Ces tests sont nommés tests d'activité esterase et consiste à déterminer la vitesse d'hydrolyse du p-nitrophényl d'acétate en présence d'hCA-II par spectrophotométrie.
Selon l'Enzyme Commission, l'hCA-II se dénote selon la nomenclature suivante E.C.4.2.1.1. Le premier chiffre (4) indique la classe dont l'enzyme fait partie. Il correspond à la classe des lyases; les lyases catalysent les réactions non-hydrolytique d'enlèvement du groupement fonctionnel d'un substrat. Le deuxième chiffre (2) indique le type de liaison qui est brisée. Dans le cas de l'anhydrase carbonique, il signifie qu'une liaison covalente entre un atome de carbone et un atome d'oxygène est brisée (C-O). Le troisième chiffre (1) indique le type de groupement fonctionnel qui est enlevé. Il correspond à l'enlèvement d'un groupement carboxyle (-COOH). Le quatrième chiffre (1) indique la nature du substrat
auquel le groupement carboxyle est enlevé. Dans le cas de l'anhydrase carbonique, il s'agit d'un ion de bicarbonate.
1.2.2 Les isoenzymes de l'hCA II
Chez l'humain, on retrouve sept isoenzymes d'CA distinctes (hCA I, II, III, IV,V, VI, VII) génétiquement (Lindskog, 1997). La plus connue d'entre-elles est l'hCA-II. C'est l'enzyme la plus étudiée car elle possède un taux d'hydratation du CO2 très élevé, soit 106 s" 1 à un pH de 9 et à une température de 25 °C. L'hCA-II est distribuée dans une très grande
variété de tissus; on la retrouve dans plusieurs cellules et organes. Certaines maladies sont associées à un déficit de cette isoenzyme telles que l'ostéoporose, l'acidose tubulaire rénale ainsi que la calcification cérébrale. Les personnes atteintes d'acidose tubulaire rénale produisent une urine beaucoup plus acide que la moyenne des gens. Afin de palier à ce problème, les personnes atteintes de cette maladie doivent boire plusieurs fois par jours de solution de bicarbonate de sodium (NaHCOs).
L'hCA I se retrouve dans plusieurs tissus tels que le colon. Cependant, elle n'est pas aussi répandue dans le corps humain que l'hCA IL Celle-ci est aussi un peu moins active que l'hCA II, son taux d'hydratation du C02 étant de 2 105sec_1à 25 °C. Son rôle
physiologique n'est pas clairement défini; un déficit de cette enzyme dans le corps humain n'est pas encore associé à aucun symptôme clinique.
L'hCA III est l'isoenzyme possédant la plus faible activité des sept isoenzymes, son taux d'hydratation du CO2 à 25 degrés Celsius étant de 8 • 103 s"1. On la retrouve principalement
dans les fibres rouges musculaires à contraction lente où elle facilite la diffusion du CO2 vers les capillaires des tissus.
L'hCA IV se situe sur le plasma des cellules endothéliales qui tapissent les vaisseaux sanguins, des capillaires des poumons et de certains autres organes.
L'hCA V est localisée sur la matrice des mitochondries de certains tissus. Cette isoenzyme participe à l'uréogenèse (synthèse de l'urée) et à la gluconéogenèse (synthèse du glucose).
Finalement, l'hCA VI et VII sont sécrétées par les glandes salivaires et ont pour rôle physiologique de réguler le pH de la salive.
1.2.3 Structure de l'hCA II 1.23.1 Structure primaire
La structure primaire d'une protéine, dans le cas présent d'une enzyme, est composée d'une séquence d'acide aminé. Un acide est composé d'un carbone alpha, d'un atome d'hydrogène, d'un groupement amine, d'un groupement carboxyle et d'un résidu (side chain). Il existe 20 acides aminés naturels. Les acides aminés sont classés selon leur résidu et se divisent en quatre catégories (figure 7) : non polaire, polaire, acides (résidu chargé négativement) et basique (résidu chargé positivement).
0 II HjM—CH-C—OH 0 n HjN—CH-C—OH
U
T
Histidine, Basique Serine, Polaire
o n HjN-CH-C-OH 0 II
£r
£o CHLeucine, Non polaire Aspartate, Acide
Figure 7. Catégories d'acides aminés. (http://www.online-vitamins-guide.com)
La structure primaire de l'anhydrase carbonique humaine de type II (HCA-II) est formée d'une chaîne de 260 acides aminés (figure 8) liés entre eux par des liaisons peptidiques (figure 9). Une liaison peptique est une liaison formée suite à une réaction de condensation entre le groupement peptide carboxyle d'un acide aminé et le groupement peptide amine d'un autre acide aminé.
MSHHWGYGKH10NGPEHWHKDF2oPIAKGERQSP3o
VDIDTHTAKY40 DPSLKPLSVS50 YDQATSLRILÔO
NNGHAFNVEF70 DDSQDKAVLK80 GGPLDGTYRL90
IQFHFHWGSL100 DGQGSEHTVDno KKKYAAELHL120 VHWNTKYGDFno GKAVQQPDGL140 AVLGIFLKVG150
SAKPGLQKVV160 DVLDSIKTKGno KSADFTNFDP180
RGLLPESLDY190 WTYPGSLTTP200 PLLECVTWIV210 LKEPISVSSE220 QVLKFRKLNF230 NGEGEPEELM240 VDNWRPAQPL25o KNRQIK ASFK26o
Figure 8. Séquence d'acides aminés de l'hCA II flittp://www.uniprot.org/uniprot/P009181
U n i l é p . p t i c i i f l ' " *
Figure 9. Liaison peptidique (http://coursenligne.ustrasbg.fr)
À des fins d'économie d'espace, seul les lettres représentant chacune des acides aminés seront notées afin de représenter la structure primaire de l'hCA-II. La couleur des différentes lettres indique la catégorie dont fait partie l'acide aminé qu'elle représente (tableau 1). Le brun représente les acides aminés non polaires, le bleu les acides aminés polaires, le vert les acides aminés basiques et le rouge les acides aminés acides.
Tableau 1. Liste des acides aminés Non polaire AA Abr Glycine G Alanine A Valine V leucine L Isoleucine I Methionine M Phenylalanine F Tryptophane W Proline P Polaire AA Abr Serine S Cysteine C Asparagine N Glutamine Q Tyrosine Y Threonine T Basique AA Abr Lysine K Arginine R Histidine H Acide AA Abr Aspartate D Glutamate E 1.23.2 Structure secondaire
La structure secondaire d'une protéine est définie par les différentes conformations (ou patrons répétitifs) qu'adopte certains tronçons de la séquence d'acides aminés composant la protéine. Ces conformations peuvent être classées en trois catégories principales : les hélices, les feuillets beta et les tours.
En termes de structure secondaire, les hélices (figure 10) désignent la conformation hélicoïdale qu'adopte une série d'acides aminés. Les hélices alpha ou 3,6o désignent une série d'acides aminés adoptant une conformation hélicoïdale dont chacun des tours compte 3,6 résidus et dont 13 atomes composent l'anneau formé par les liaisons hydrogènes entre les groupements peptides NH et CO des acides aminés composant l'hélice. Les hélices 3io ont aussi une conformation hélicoïdale, par contre chaque tour compte 3 résidus et seulement 10 atomes composent l'anneau formé par les liaisons hydrogènes entre les groupements peptides NH et CO des acides aminés composant l'hélice.
'c_.; N ** ■ JL ' c ■ N
é y
^ Figure 10. : Hélicea. (http://www.chusa.jussieu.fr)Les feuilletsp (figure 11) sont un autre type de structure secondaire. Ils sont formés à partir de chaînes d'acides aminés étirés, nommées brins beta, qui se lient entre eux par des liaisons hydrogène entre les groupements peptides NH et CO. Les feuilletsp peuvent être parallèles, antiparallèles ou mixtes, dépendant de la direction des brins. Les tours représentent un autre type de structure secondaire. Ils sont courts et très souvent connectés à deux brinsp. Il existe sept types de tours distincts qui se différencient par leurs angles de conformation et par les résidus d'acides aminés qu'ils préfèrent.
Parallel p Sheet C-termmus u n u n y ^ J < J L y ^ J L >*>L y ^ N-tenninus C-tcrm mus ^ r L ■ c H A c N-terrainus c-^^y^y N--^ ~*-y^y N--" ^-^ Antiparallel p Sheet O H O H
JL y~^ y-^ JL .J y^. ^<L y^
C-lcrmi™*/ ^ V ^ f ^ Y ï ^*«—f— Q H Ç H H i H 0 N
-
tomiDU5\ „ ^ ^ L „ J L / ^ / ' L X.,/
c*
T 1
N T V >çT
y Y
C-tenronusTableau 2. Structure secondaire de l'hCA II. (Eriksson et al., 1988)
hélice-a hélice-3i0 brin-p tour Positionnement des résidus
aA 13-18 aB 21-24 VIb 28-31 Pa 32-33 PJ 39-40 pb 47-50 PB 56-61 PC 66-70 PPc 78-81 II' 81-84 PD 88-97 Pd 108-109 pE 116-124 aC 125-128 aD 131-134 I 134-137 I 137-140 PF 141-150 aE 155-157 aE 158-163 aE 163-167 PA 173-175 oF 181-184 PH 191-196 Via 200-203 PG 207-212 Pe 216-218 aG 220-226 D 233-236 PI 257-258
La structure secondaire de l'hCA II (tableau 2) est principalement composée de feuillets-P, ceux-ci étant composés de brins-p tel que mentionné précédemment. L'hCA II compte en tout quinze brins-p. Les dix brins-P identifiés par une lettre majuscule (PA à pj) forment le plus imposant feuillet-p antiparallèle présent dans la structure secondaire de l'enzyme. Les brins Pc, pb et une partie du brin PD forment eux aussi un feuillet-p antiparallèle. Quant aux brins pe et PF (seulement une partie de PF), ils forment un feuillet-p parallèle. Pour ce qui est des brins pa et pd, leur implication dans un quelconque feuillet beta n'a pas été clairement identifié. Outre les tours et les brins-P, l'hCA II est aussi composée d'hélices, dont deux hélices-a (aD et aG), quatre hélices-3io (aA, aB, <xC et aF) et une hélice mixte (aE). En fait, l'hélice mixte aE est composée d'une hélice- a prise en sandwich entre deux hélices-3io.
1.233 Structure tertiaire
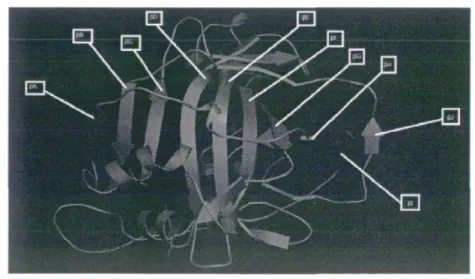
La structure tertiaire d'une protéine est définie comme étant la structure tridimensionnelle de celle-ci. La molécule d'hCA II est un ellipsoïde de dimension 55 x 42 x 39 Â3 et a une masse molaire de 29 300 g mol"1. En observant la structure
tridimensionnelle de l'hCA II (figure 12) on remarque que la protéine est divisée en deux par un feuillet-P antiparallèle composé de dix brins-P (PA à PJ), ce feuillet-P étant nommé feuillet-P central. La moitié contenant le site actif de l'enzyme est nommée moitié supérieure, alors que l'autre partie est nommée moitié inférieure (figure 13).
Figure 13 : Feuillet-P central, moitié supérieure et inférieure de l'hCA-II (http://uniprot.org/uniprot/P00918)
La moitié inférieure de l'enzyme est composée de trois brins-P (Pb, Pc et PD) formant un feuillet-p antiparallèle, d'une hélice-3io (aF), d'une hélice-a (aG) et d'une hélice mixte (aE) (figure 14). Cette moitié inférieure forme un noyau hydrophobe composé des structures secondaires à la surface de l'enzyme et du feuillet-p central. Trente-quatre résidus sont impliqués dans ce noyau hydrophobe, dont dix sont aromatiques. Huit de ces résidus aromatiques sont regroupés ensemble.
Figure 14 : Moitié inférieure de l'hCA-II (http://uniprot.org/uniprot/P00918)
La moitié supérieure de l'enzyme est principalement composée du site actif (lieu où la réaction est catalysée), du résidu N-terminus et du résidu C-terminus (figure 15). Le résidu N-terminus correspond au groupement amine (lié au carbone alpha) du premier acide aminé composant la structure de l'hCA II, alors que le groupement C-terminus correspond au groupement carboxylique (lié au carbone alpha) du dernier acide aminé de la structure primaire.
Figure 15. Résidus N-terminus et C-terminus de l'hCA-II (http://uniprot.org/uniprot/P00918)
Le site actif de l'hCA II est une cavité amphiphile de forme conique dont l'entrée se trouve à la surface de l'enzyme (figure 16). Le diamètre de cette cavité est de 15 Â et sa profondeur de 15 Â. L'ion de zinc, élément essentiel à l'activité catalytique de l'enzyme, est situé au fond de cette cavité. Cet ion métallique est retenu à l'intérieur du site actif grâce à trois résidus histidyles et une molécule d'eau vient s'ajouter à cet amalgame afin de former une conformation tétraédrique (figure 17). Les trois résidus histidyles font parties des trois acides aminés histidines distinctes, soit 94, 96 et
l'histidine-119. L'histidine-94 et l'histidine-96 font parties du brin-pD alors que l'histidine-119 fait partie du brin-pE. Au-dessus de l'ion de zinc on retrouve les résidus thréonyles des acides aminés threonine-198 et threonine-199 se situant plus ou moins à l'entrée de la cavité du site actif (Henderson et al., 1976). L'acide aminé thréonine-199 a une fonction très importante dans le mécanisme catalytique de l'hCA II, le CO2 se liant au groupement peptide amine de celui-ci. Du côté opposé de l'entrée de la cavité on retrouve le résidu de l'histidine-64, celui-ci prenant position sur la fin du brin-pC. L'histidine-64 occupe aussi un rôle primordial dans le mécanisme catalytique de l'anhydrase carbonique; il agit comme
une navette à proton, en permettant le transfert intermoléculaire de proton. Ces résidus additionnés aux résidus des acides aminés tyrosine-7, asparagine-62, asparagine -67, glutamine-92, et glutamate-106 forment la partie hydrophile de la cavité du site actif. La partie plus hydrophobe du site actif est composée des extensions des brins PE, PF et de deux petites hélices aC et aD. En excluant la molécule d'eau liée à l'ion de zinc, le site actif compte huit molécules d'eau formant un réseau de ponts hydrogène (jîroton-wire) menant aux molécules d'eau en solution (bulk).
Figure 16. Site actif (http://uniprot.org/uniprot/P00918)
Figure 17. Conformation de l'ion de zinc (Silverman et McKenna, 2007)
1.2.4 Mécanisme catalytique
Le mécanisme catalytique de l'hCA II se compose de cinq étapes distinctes (Lindskog, 1997). Le mécanisme catalytique exposé ici sera celui de l'hydratation du CO2 catalysée par l'hCA II à un pH de 8 et à une température de 25 °C. Il est important de spécifier ces conditions car pour un pH de 8 la molécule d'eau liée à l'ion de zinc se trouve plutôt sous la forme d'un ion hydroxyle (le pKa de cette molécule d'eau est de 7.1).
La première étape de ce mécanisme consiste en la liaison d'une molécule de CO2 à l'enzyme (figure 18). La molécule d'eau liée au groupement peptide NH de l'acide aminé threonine-199 est remplacée par une molécule de CO2 et la molécule de CO2 est liée à l'enzyme par une liaison hydrogène.
Figure 18. Liaison du substrat (Lindskog, 1997)
La deuxième étape consiste en la formation d'une molécule de bicarbonate (figure 19). Celle-ci est formée suite à une attaque nucléophile de l'ion hydroxyle lié à l'ion de zinc sur la molécule de CO2. La molécule de bicarbonate est liée grâce à trois liaisons, deux liaisons hydrogène et une liaison ionique. Le première liaison hydrogène a lieu avec le résidu du groupement peptide NH de l'acide aminé threonine-199 et la deuxième avec le groupement alcool du résidu de l'acide aminé threonine-199. Quant à la troisième liaison, il s'agit d'une liaison ionique entre un atome d'oxygène de la molécule de bicarbonate et l'ion de zinc.
Figure 19. Formation du bicarbonate (Lindskog, 1997)
La troisième étape consiste en la libération de la molécule de bicarbonate et la régénération partielle du site actif (figure 20). Lorsque la molécule de bicarbonate est libérée, celle-ci laisse de l'espace à deux molécules d'eau : une première vient se lier à l'ion de zinc afin de régénérer la conformation tétraédrique de celui-ci et une deuxième vient se lier au groupement peptide NH de l'acide aminé threonine-199.
Figure 20. Libération du bicarbonate (Lindskog, 1997)
Figure 21. Transfert intramoléculaire du proton (Lindskog, 1997)
La quatrième étape peut être qualifiée d'étape d'isomérisation ou étape de transfert intramoléculaire du proton (figure 21). Afin que l'enzyme soit active, un ion hydroxyle doit être lié à l'ion de zinc, mais suite à la libération du produit une molécule d'eau est liée à l'ion de zinc. En conséquence, un proton doit être expulsé, la première étape de cette expulsion consistant en un transfert intramoléculaire du proton. Ce transfert de proton s'effectue via le "proton-wire"; le proton glisse tout au long de celui-ci et est cueilli par le résidu histidyle de l'histidine-64. Ce résidu histidyle peut prendre deux conformations : lorsque celui-ci n'est pas protoné, il est orienté vers l'ion de zinc, alors que lorsqu'il est protoné, il est orienté vers le sein de la solution (bulk).
La cinquième et dernière étape du mécanisme consiste au transfert intermoléculaire du proton (figure 22). Cette étape contrôle la vitesse de la réaction lorsque la concentration en tampon non protoné est inférieure à 10 mM. Le transfert intermoléculaire est effectué par une molécule de tampon cationique non protoné qui vient récupérer le proton lié au résidu histidyle de l'histine-64. La réaction est alors complétée, une molécule de bicarbonate est produite, une molécule de tampon est protoné et l'enzyme retrouve sa forme active.
Figure 22. Transfert intermoléculaire du proton (Lindskog, 1997)
1.2.5 Modèles cinétiques
Sept modèles cinétiques pour l'hydratation réversible du CO2 catalysée par l'hCA II seront présentés dans cette section : le modèle de Steiner et al. (1975), le modèle de Steiner et al. (1976), le modèle de Rowlett et Silverman (1982) et quatre modèles de Larachi (2010). La nomenclature utilisée pour les réactifs est présentée au tableau 3.
Tableau 3. Nomenclature des réactifs
Réactif Symbole
Eau, H20 W
Dioxyde de carbone, CO2 S
Bicarbonate, HCO3" p
Tampon, forme basique B
Tampon, forme acide conjugué BIT
La nomenclature utilisée pour les différentes formes de l'enzyme est présentée au tableau 4. La base de données expérimentales utilisée pour tester les sept modèles (Larachi, 2010) est incluse au tableau 5.
Tableau 4. Nomenclature des formes de l'enzyme
Forme de l'enzyme Symbole
Quantité totale d'enzyme Eo
Complexe transitoire ES
His64-Enz-Zn2+-OH E
His64-Enz-Zn2+-OH2 Ew
ON CN v>
1
D . X O vi U VU c c o T3 -a <u en 03 ir, 3J
3
O o ta CN o o o t-» m vn — ro O o CN° T
*I
vo m es 1 "3- vn vn vn m r s - " ' ^ " r, r. r. ^ H ,. i n i n m m o i -S 2 «
o o «•» m - H r o o i nsf
t>. i n vo « N ^ — oo i n r t r n vn oo" vn oo < < < *"* « s a"'if
CN CN CN CN CN CN « ^ j « S o O O O O O U ^s h O ^ K U") T t ■ * ON 0 0 m K eu oo OO 0 0 0 0 f - oo eu ». s -** es ,-», is U m • vn i n i n m i n & ° w CN CN CN CN CN CN & v H /— . U CS© es vo r>- CN — CN CS© oo I-»" r> oo" r> oo <s N « ^ u j u o u o "o " H o1
C C1
c1
" O " 2 • w* T J o •ai
ïL
* 0 T"1gg
J
j—i /-^1
1
§£<
gg
>>< J3 —' J3 J3 w1
| •S Z J VU Ë r2 ■%>g
•3e
c JE T J CN F Ë T J CN CN T J CN of ^* . ■ H ""' § § ç VO VO VO C g ^ « t i CN n g ^-s c r- C f - v- r-» « C CN O t i CN <U E <N O ON O ON O ON "S « oo U 00 j > ON "S « oo SE > ON Kl V i w-1 Vi .S ~*Modèle de Steiner et al. (1975)
Le modèle proposé dans Steiner et al. (1975) est une cinétique classique de type Michaelis-Menten réversible. Seulement deux réactifs sont compris dans ce modèle, soit le CO2 (le substrat) et le bicarbonate (le produit). Quant à l'enzyme, elle se présente sous deux formes : la forme active (E) et la forme d'un complexe transitoire (ES). Plusieurs étapes du mécanisme réactionnel sont omises dans ce modèle; seulement deux étapes y sont représentées, notamment la liaison du CO2 (1) et la libération du bicarbonate (2).
[*M*=r*s] d)
[ES]^=4E]
+[P] (2)
La vitesse de la réaction définie par la production de bicarbonate s'exprime par l'équation différentielle suivante :
^ = k2[ES]-k_2[P][ES] (3)
En substituant les termes [ES] et [E] (difficilement quantifiable) par des concentrations quantifiables ([S], [P] et [EQ]), grâce à la méthode de King et Altman (1956), on obtient
l'équation différentielle suivante :
m K
[ s ]
'^
l P ]
M* (M
+
M
+
,l
jyh jyd
7E-HW 6E+05 5E+05 4E+05 3E+05 2E+0S 1E+Û5 0E4flO
Figure 23. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Steiner et al. (1975) (dans Larachi, 2010)
En considérant les cinq ensembles de données expérimentales (tableau 5), le modèle de Steiner et al. (1976) présente une erreur relative absolue moyenne (AARE, « average absolute relative error ») de 82,4 %. Ce modèle ne représente pas très bien les données expérimentales (figure 23), ceci étant probablement dû au fait que ce modèle omet beaucoup d'étapes du mécanisme réactionnel, principalement le transfert intramoléculaire et intermoléculaire, deux étapes critiques du mécanisme réactionnel.
Modèle de Steiner et al. (1976)
Le modèle proposé par Steiner et al. (1976) est une cinétique classique de type MichaelisMenten réversible auquel ils ont ajouté une étape d'isomérisation (transfert intramoléculaire du proton). Encore une fois, seulement deux réactifs sont inclut dans le modèle, soit le CO2 (le substrat) et le bicarbonate (le produit). Dans ce modèle, l'enzyme se présente sous trois formes différentes : la forme active (E), la forme d'un complexe transitoire (ES) et la forme où une molécule d'eau est liée à l'ion de zinc. Ce modèle inclut trois étapes du mécanisme réactionnel : la liaison du CO2 (5), la libération du bicarbonate (6) et le transfert intramoléculaire du proton (7).
[£]
+[S]ç£i{13] (5)
[£S]<4=>[Jv]+[/>] (6)
K1<==H*] (7)
La vitesse de la réaction définie par la production de bicarbonate s'exprime par l'équation différentielle suivante :
ï ¥ l = k2[ E S ] k _2[ P ] [ E S ] (8)
En substituant les termes [ES] et [E] (difficilement quantifiable) par des concentrations quantifiables ([S], [P] et [Eo]), grâce à la méthode de King et Altman (1956), on obtient l'équation différentielle suivante :
V0 Km * ■ _ ( Q )
7E+05 6E+0S 5E+0S 4E+05 3E+05 2E-HW 1E+05 OE-HW dIPl/IEOIdKs'XCALC. ♦ ♦ ♦ > D X
•
D / • ♦ + ♦ 4 * # a \- *" r
■ • ++ + + ♦ ♦ ♦ ♦ • +• y
+ ++ + + ++ 4+ -T Au/
• ♦ « ► ♦ •A/
• A AJTABjC Steiner el ai. (1976) Isoracruation kinetic Model
• A AJTA ♦ 1.1 I>\U. Rowlelt & Silverman 1962 • A AJTA
+ TEA, Rtmlrtt A. Silverman. 1982 *l,2-DMI,Jonssanetal..l9~6
h
¥
• 2,2 D E M . Jormcm et al., 1976D l^-DMI, SteJner et al.. 1976
d|P)/liCO|dt(s1X EXIJ
Figure 24. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Steiner et al. (1976) (Larachi, 2010)
En considérant les cinq ensembles de données (tableau 5), le modèle de Steiner et al. (1976) obtient une AARE de 75%, ce qui est légèrement inférieur à leur modèle antérieur (figure 24). Par contre, on constate que le modèle de Steiner et al. (1976) représente très bien l'ensemble de données 1,2DMI (Steiner et al., 1976) (figure 24). Ceci s'explique par le fait que les conditions expérimentales de cet ensemble de données implique une inhibition par le produit (10) ([P]>0) et une vitesse de réaction contrôlée par le transfert intramoléculaire du proton (11) ([B] > 50 mM) et que ces deux phénomènes sont représentés dans ce modèle.
(10)
Modèle de Rowlett et Silverman (1982)
Le modèle de Rowlett et Silverman (1982) est représenté par une cinétique Ter Bi Ping Pong ordonnée. Le terme Ter signifie que le modèle inclut trois substrats, soit le CO2, l'eau et le tampon sous forme basique. Le terme Bi signifie que modèle inclut deux produits, soit le bicarbonate et le tampon sous forme d'acide conjugué. Dans ce modèle, l'enzyme se retrouve sous trois formes : la forme active (E), la forme d'un complexe transitoire (ES) et la forme où le résidu de l'histidine-64 est protoné (HE). Le modèle de Rowlett et Silverman (1982) est divisé en trois étapes, soit la liaison du CO2 (12), la libération du bicarbonate (13) et le transfert intermoléculaire du proton (14) (non réversible) :
[£]
+[S]^[£S]
*-I * - 2 (12) (13) (14) Les auteurs de ce modèle ont décidé d'exprimer la vitesse de la réaction de leur modèle en fonction de la vitesse de consommation du tampon sous sa forme basique qui s'exprime selon l'équation différentielle suivante :d[B]
dt
= K[B][E
H]
(15)Grâce à la méthode de King et Altman (1956), il est possible d'obtenir l'équation de vitesse sous les formes suivantes :
d[B]_ [E0]dt Ka,[B] Ki
tfl [s]
+W
1 + K s\ (16)M.
7 E - H » 6K+05 SE-HM 3 E + 0 5 Î E + « 5 1K+05 OE-HM d|Pl^KOldl (r>X C A L C
Rowlett and Silverman 0 9 8 2 ) Kinetic M o d
♦ l , M ) M I . Rowtclt a Silverman, 1 9 8 Z ( | P l - 0 ) * TEA, Rowlett A Sllvcrnwn. 1 'J82 (| P| 0) X TEA, RowtetI « SUve-nan, 1982 (|P]>0) -M.2 O M I . J o i m o u e l a l . , t 9 7 S ( | P ) - 0 ) P l , 2 DMI, S t r i n e r e t a l . . 1976<IPl-0>
clll'MKOlUK» ' ) . E X P .
OE-HK) 1E-HW JE+OS 3 E + 0 5 4E-MJ5 3 E + 0 5 6E-MW
Figure 25. Vitesse d'hydratation du CO2 mesurée versus vitesse calculée à l'aide du modèle de Rowlett et Silverman(1982)
(Larachi, 2010)
Ce modèle représente nettement mieux les cinq ensembles de données expérimentales (tableau 5) que les deux modèles précédents, avec une AARE de 22,7%. On remarque que le modèle représente très bien les ensembles de données expérimentales 1,2DMI, Rowlett & Silverman (1982) ([P]=0), TEA, Rowlett & Silverman (1982) ([P]=0) et TEA et Rowlett & Silverman (1982) ([P]>0) (figure 25). L'explication est simple; ces trois ensembles de données expérimentales ont été obtenus dans des conditions où le transfert intermoléculaire contrôle la vitesse de la réaction ([B] < 10 mM) et ce phénomène est inclut dans le modèle cinétique. Or l'ensemble de données 1,2DM et Steiner et al. (1976) ([P]=0) a été obtenu dans des conditions où le transfert intramoléculaire du proton contrôle la vitesse de la réaction ([B]>10 mM). Le fait que cette étape du mécanisme réactionnel soit absente du modèle cinétique explique pourquoi cet ensemble de données expérimentales est moins bien représenté par ce modèle.
Modèles (a), (b), (c), (d) de Larachi (2010)
Le modèle (a) est représenté par une cinétique Ter Bi Iso Ping Pong ordonnée. Le modèle compte trois substrats, soit l'eau, le CO2 et le tampon sous forme basique, ainsi que deux produits, notamment le bicarbonate et le tampon sous forme d'acide conjugué. Dans ce modèle, l'enzyme est présente sous trois formes : la forme active (E), la forme où une molécule d'eau est liée à l'ion de zinc (Ew) et la forme où le résidu de l'histidine-64 est
protoné (HE). Ce modèle n'inclut pas de complexe transitoire (^ES). Les étapes incluses dans ce modèle sont les suivantes : la liaison du CO2 et la libération du produit (17), le transfert intramoléculaire du proton (isomérisation) (18) et le transfert intermoléculaire du proton (19). La nouveauté de ce modèle provient du fait qu'il inclut le transfert intramoléculaire ainsi que le transfert intermoléculaire.
frfe#-M
* - 3[B]
+[
HE]^=^BW]
+[E]
(17) (18) (19)La vitesse de la réaction définie par la production de bicarbonate s'exprime par l'équation différentielle suivante :
^ - t M M M r U a V ]
(20)Grâce à la méthode de King et Altman (1956), on obtient l'équation de vitesse sous la forme suivante :
d [ P ] _ k,kt '[S][B]-%L[P][BH-]\
-*•-* *
3[
2[
5]
+|^[/>]]
+^ *
4[ [
B]
+2|^[^]]
+*J
5p]^
4[|^[
5]
+| ^ [ ^ ] ] [ P ]
Ce modèle représente relativement bien les cinq ensembles de données expérimentales avec une AARE de 18,6%.
Le modèle (b) est représenté comme une cinétique Quad Quad Iso Ping Pong aléatoire. Le premier terme Quad indique que le modèle comprend quatre substrats, soit le CQ2, l'eau, le tampon sous sa forme basique et le bicarbonate. Quant au deuxième terme Quad, il indique que le modèle comprend quatre produits, soit le bicarbonate, le tampon sous sa forme d'acide conjuguée, l'eau et le CO2. Aucun complexe transitoire (ES^) n'est inclus dans ce modèle. Ce modèle comprend trois étapes : la liaison du CO2 et la libération du bicarbonate (22), le transfert intramoléculaire du proton (isomérisation)(23) et le transfert intermoléculaire du proton (25). La nouveauté de ce modèle provient du fait que celui-ci propose l'hypothèse que le transfert intermoléculaire du proton puisse se faire via une molécule de tampon sous sa forme basique ou via un ion de bicarbonate, d'où le terme « aléatoire » à la fin du nom du modèle.
M+[S]+[£]^[-1+[-V] (22)
[3r]?#U-5] (23)
[B]+[HE]+=^[BH+]+[E](24) OU [ P ] + [HE ] ^ ± [ S ]+[ W ]+ [ E ] (25)
La vitesse de la réaction définie par la production de bicarbonate s'exprime par l'équation différentielle suivante :
- ^ = ^ [ r F ] [ 5 ] [ £ ] - ^ [ P ] K ] + [rF]*.5[5][£]-*5[P]U£]
(26)
Grâce à la méthode de King et Altman (1956) on obtient l'équation de vitesse sous la forme suivante :
('
""i^r™
+*AM(27)
Ce modèle représente bien les cinq ensembles de données expérimentales avec une AARE de 16,2%.
Le modèle (c) est une cinétique Ter Bi Iso Ping Pong ordonnée. Ce modèle est similaire au modèle (a) de à l'exception du fait qu'il inclut un complexe transitoire :
[£]
+[S]ç^[£S]
[B]+[
ME]T^[mr]
+[E]
(28) (29) (30) (31)La vitesse de réaction définie selon la production de bicarbonate s'exprime par l'équation différentielle suivante :
r^-*i[«I*1-*.[*Vl'l
(32)Grâce à la méthode de King et Altman (1956), on obtient l'équation de vitesse sous la forme suivante : *>[[s][B}-j£[P][Bir]
+
(ë
w+
è(è
+1
)
[5//+]
)
[/>1+
lt
[51[BlM
i + * 3 l kiW) kjk^Kgim+f*£[s][p]
(33)Ce modèle représente relativement bien les cinq ensembles de données expérimentales avec une AARE de 18,4%.
Le modèle (d) est représenté par une cinétique Quad Quad Iso Ping Pong aléatoire. Ce modèle est très similaire au modèle (b) à l'exception du fait qu'il inclut un complexe