THÈSE
En vue de l'obtention du
DOCTORAT DE L’UNIVERSITÉ DE TOULOUSE
Délivré par l'Université Toulouse III - Paul SabatierDiscipline ou spécialité : Microbiologie
Présentée et soutenue par Sylvain CANTALOUBE
Le Mardi 26 Janvier 2010
Architecture et essentialité des complexes de biosynthèse
des acides mycoliques de la bactérie pathogène
Mycobacterium tuberculosis
JURY
Dr. Emmanuelle BOUVERET ( LISM-Marseille) Rapporteur
Pr. Nicolas BAYAN (Université Paris Sud) Rapporteur
Dr. Alain BAULARD (Institut Pasteur Lille) Rapporteur
Dr. Lionel MOUREY (IPBS-Toulouse) Examinateur
Pr. Matthieu ARLAT (Université Paul Sabatier-Toulouse) Président
Dr. Didier ZERBIB (IPBS-Toulouse) Directeur de Thèse
Ecole doctorale : Biologie-Santé-Biotechnologies de Toulouse
Unité de recherche : Institut de Pharmacologie et de Biologie Structurale du CNRS (UMR 5089 UPS-CNRS)
Remerciements
Je souhaite tout d’abord remercier le Dr. Emmanuelle BOUVERET (LISM-Marseille), le Pr. Nicolas BAYAN (Université Paris Sud) et le Dr. Alain BAULARD (Institut Pasteur-Lille) d’avoir accepté d’être les rapporteurs de ce travail de thèse ainsi que le Dr. Lionel MOUREY (IPBS-Toulouse) et le Pr. Matthieu ARLAT (Université Paul Sabatier-Toulouse) d’avoir examiné mon travail.
Je tiens à remercier Didier ZERBIB qui a dirigé ma thèse durant quatre années. Il a été enthousiasmant, tant humainement que scientifiquement, de travailler avec une personne audacieuse, brillante et désintéressée. Didier a tenté de m’apprendre l’obstination et la patiente mais également la rigueur dans la recherche scientifique. Je lui en suis reconnaissant.
Merci également à tous ceux qui ont contribué à ce travail et qui ont partagé leur paillasse avec la mienne : Romain, Sandrine, Géraldine, Maxime, Marina, Annie, Mitko, Nabila, Cheikh, Julien, Clément, Mélanie, merci à vous.
Enfin, mes sincères remerciements à tous ceux avec qui j’ai pu collaborer scientifiquement : Valérie et Lionel pour les structures de protéines, Jean-Yves et Jérome pour la microscopie, Wladimir pour la chromatographie d’affinité et Renaud pour les petis problèmes informatiques du quotidien.
Je salue chaleureusement l’ensemble de l’équipe de Mamadou DAFFE pour m’avoir acueilli au sein de leur équipe : Fabienne, Kaymeuang, Nathalie, Anne, Marielle, Mamadou, Gilles, Sabine, Mathieu, Julien, Annaîk, Hédia, Emilie, Nawel, Françoise, Patricia,… De même, mes sincères salutations à Odile, Clara, Isabelle, Nana avec qui j’ai partagé mon bureau.
1. INTRODUCTION BIBLIOGRAPHIQUE... 8
1.1. LA TUBERCULOSE... 9
1.1.1. Le genre Mycobacterium... 10
1.1.2. Données immunologiques de la tuberculose ... 11
1.1.2.1. Cycle infectieux de Mycobacterium tuberculosis... 11
1.1.2.2. Interaction hôte/pathogène : la phagocytose... 15
1.1.2.3. Granulome : formation et rôle... 16
1.1.2.4. Contournement de l’activité bactéricide... 19
1.1.3. Traitements et prévention... 24
1.1.3.1. La vaccination : le BCG ... 24
1.1.3.2. Traitement de la tuberculose ... 25
1.2. STRUCTURE DE L’ENVELOPPE MYCOBACTERIENNE... 30
1.2.1. Organisation générale ... 30
1.2.2. La membrane plasmique ... 33
1.2.3. La paroi... 33
1.2.3.1. Le peptidoglycane... 34
1.2.3.2. L’arabinogalactane ... 34
1.2.3.3. La membrane externe ou mycomembrane ... 34
1.2.4. La capsule ou couche externe ... 37
1.3. BIOSYNTHESE DES ACIDES MYCOLIQUES... 38
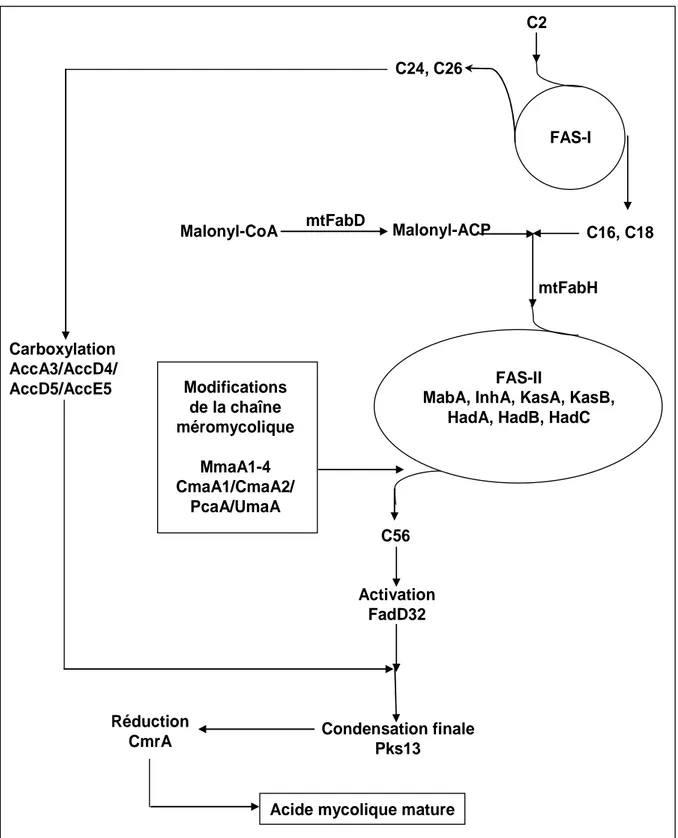
1.3.1. Organisation générale ... 38
1.3.2. FAS-I ... 40
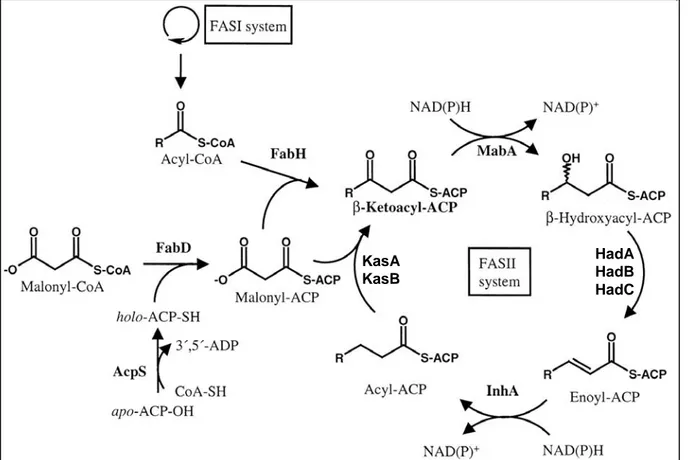
1.3.3. FAS-II... 41
1.3.3.1. Initiation du cycle FAS-II ... 43
1.3.3.2. Les condensases ... 45
1.3.3.3. Les réductases ... 47
1.3.3.4. Les déshydratases... 50
1.3.4. Modifications de la chaîne méromycolique ... 51
1.3.4.1. Généralités sur les modifications de la chaîne méromycolique... 51
1.3.4.2. Formation des doubles liaisons cis... 54
1.3.4.3. Introduction de fonctions cyclopropanes et méthyles ... 54
1.3.4.4. Introduction de fonctions oxygénées... 56
1.3.5. Etape de condensation (figure 18) ... 56
1.3.5.1. Activation de la chaîne méromycolique... 56
1.3.5.2. Carboxylation de la chaîne α ... 58
1.3.5.3. Condensation mycolique par Pks13 (figure 18)... 62
1.3.5.4. Réduction finale et transfert ... 62
1.3.6. Les antibiotiques ciblant spécifiquement la biosynthèse des acides mycoliques ... 63
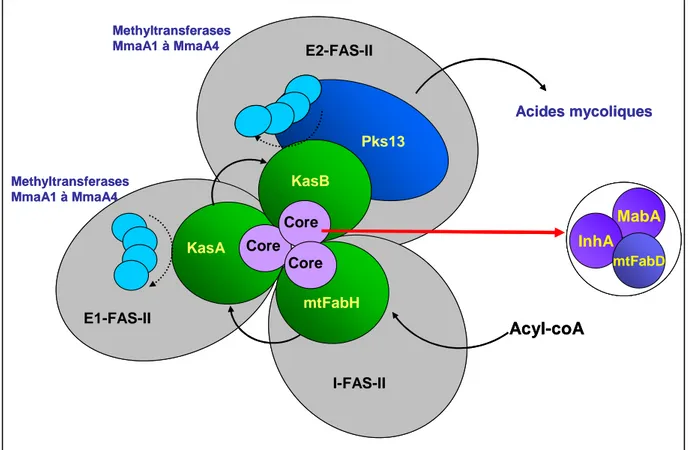
1.4. FAS-II, UNE ORGANISATION COMPLEXE : STRUCTURE ET REGULATION... 66
1.4.1. Interactions protéine-protéine au sein de la voie de biosynthèse des acides mycoliques. ... 66
1.4.3. Des interactions essentielles, cibles privilégiées dans la recherche de nouveaux
antituberculeux ? ... 70
1.5. HYPOTHESES DE TRAVAIL... 72
2. DETERMINATION DE L’INTERACTOME DE LA BIOSYNTHESE DES ACIDES MYCOLIQUES ... 74
2.1. METHODE EXPERIMENTALE :LE DOUBLE HYBRIDE CHEZ LA LEVURE... 77
2.2. LES PROTEINES RESPONSABLES DE L’ACTIVATION DES SUBSTRATS DE PKS13... 81
2.2.1. Etude en double hybride chez la levure ... 81
2.2.2. Détermination des interactions en Co-IP ... 86
2.3. LES METHYLTRANSFERASES... 94
2.3.1. Etude en double hybride chez la levure ... 94
2.3.2. Détermination des interactions en Co-IP ... 97
2.4. LES DESHYDRATASES... 101
2.4.2. Etude en triple hybride des interactions protéine-protéine entre les complexes déshydratases et les enzymes de FAS-II ... 104
2.4.3. Etude en triple hybride des interactions entre les complexes déshydratases et les huit méthyltransférases ... 106
2.5. MODELISATION DU COMPLEXE FAS-II BASEE SUR LA STRUCTURE DE LA MEGA-ENZYME MFAS-I 111 2.5.1. Méthodes et choix d’analyse ... 111
2.5.2. Modélisation des structures inconnues... 114
2.5.3. Alignements structuraux des enzymes de la biosynthèse des acides mycoliques sur la structure de mFAS-I... 116
2.5.4. Validation et amélioration du modèle d’interactome de la biosynthèse des acides mycoliques chez Mtu... 121
3. ETUDE DES INTERACTIONS HOMOTYPIQUES ESSENTIELLES DES REDUCTASES MABA ET INHA... 125
3.1. STRUCTURES ET CONSTRUCTIONS DE MUTANTS DES REDUCTASES MABA ET INHA ... 127
3.1.1. Caractéristiques structurales de MabA et InhA ... 127
3.1.2. Mutations aux interfaces d’interaction de MabA (Veyron-Churlet et al., 2004) ... 129
3.1.3. Mutations aux interfaces d’interaction d’InhA... 129
3.2. RESULTATS PRELIMINAIRES ET OBJECTIFS... 131
3.2.1. Résultats préliminaires et objectifs pour MabA ... 131
3.2.2. Résultats préliminaires et objectifs pour InhA ... 132
3.3. ETUDE DE LA PROTEINE MABA ... 135
3.3.1. Purification... 135
3.3.1.1. Surexpression ... 135
3.3.1.2. Purification... 135
3.3.2.1. Cinétique de la protéine MabAWT... 137
3.3.2.2. Tests d’activité (figure 46, tableau 14)... 139
3.3.3. Chromatographie d’exclusion... 140
3.3.3.1. Calibrations... 140
3.3.3.2. Gel filtration... 142
3.3.4. Structure du mutant MabA G162L ... 145
3.3.5. Conclusions ... 146
3.4. ETUDE DE LA PROTEINE INHA ... 150
3.4.1. Construction du mutant A252R ... 150
3.4.2. Dominance négative ... 150
3.4.3. Etude des interactions homotypiques en double hybride chez la levure... 151
3.4.4. Purification... 152 3.4.4.1. Surexpression ... 153 3.4.4.2. Extraction ... 153 3.4.4.3. Purification... 153 3.4.5. Chromatographie d’exclusion... 155 3.4.6. Conclusions ... 155
3.5. ETUDE IN VIVO DES PROTEINES TRONQUEES ET DES DOMAINES DE MABA ET D’INHA ... 158
3.5.1. Protéines tronquées et domaines de MabA... 159
3.5.1.1. Stabilisation des protéines tronquées en C-terminal de MabA et dominance négative ... 159
3.5.1.2. Stabilisation des domaines internes de MabA et dominance négative... 161
3.5.2. Protéines tronquées d’InhA ... 163
4. CONCLUSIONS GENERALES ET PERSPECTIVES ... 166
4.1. ARCHITECTURE DE L’INTERACTOME DE LA BIOSYNTHESE DES ACIDES MYCOLIQUES... 167
4.2. VERS DE NOUVEAUX ANTITUBERCULEUX INHIBITEURS D’INTERACTIONS ESSENTIELLES... 171
4.2.1. Essentialité de l’interface d’homomultimérisation α4α5 des réductases MabA et InhA ... 171
4.2.2. De nouvelles interfaces d’interactions hétérotypiques essentielles ?... 172
4.3. VERS LA LOCALISATION CELLULAIRE DE L’INTERACTOME DE LA BIOSYNTHESE DES ACIDES MYCOLIQUES... 174
5. MATERIEL ET METHODES ... 180
5.1. MATERIEL UTILISE... 181
5.1.1. Souches utilisées... 181
5.1.2. Plasmides utilisés et construits... 181
5.1.3. Milieux et conditions de culture... 185
5.1.3.1. Cultures d’E. coli ... 185
5.1.3.2. Cultures de S.cerevisiae AH109 et S.cerevisieae MAV203 ... 185
5.1.3.3. Cultures de M.smegmatis mc²155... 186
5.2. CONSTRUCTION DE VECTEURS ET TRANSFORMATION... 187
5.2.1. Construction de vecteurs ... 187
5.2.1.2. Digestion de l’ADN ... 187
5.2.1.3. Purification de l’ADN... 187
5.2.1.4. Déphosphorylation de l’ADN linéaire... 188
5.2.1.5. Ligation de l’ADN ... 188
5.2.1.6. Extraction d’ADN plasmidique... 188
5.2.1.7. Constructions des vecteurs dérivés de pGAD-T7, pGBK-T7 et pBridge pour étude dans les systèmes double et triple hybride chez la levure... 188
5.2.1.8. PCR et mutagenèse dirigée... 189
5.2.2. Transformation d’E.coli... 190
5.2.2.1. Préparation de cellules compétentes ... 190
5.2.2.2. Transformation... 190
5.2.3. Electrotransformation de M. smegmatis... 191
5.2.3.1. Préparation de cellules compétentes ... 191
5.2.3.2. Transformation... 191
5.3. SUREXPRESSION ET ANALYSE DES PROTEINES... 193
5.3.1. Analyse des protéines sur gel SDS-PAGE ... 193
5.3.2. Test de surexpression des protéines chez E.coli ... 193
5.3.3. Surexpression et préparation d’extraits protéiques des réductases MabA et InhA... 194
5.3.3.1. Surexpression chez E.coli ... 194
5.3.3.2. Préparation des extraits protéiques... 194
5.3.4. Purification des protéines MabA et InhA sur colonne NiNTA... 195
5.3.4.1. Préparation de la colonne ... 195
5.3.4.2. Purification avec le système ACKTA-FPLC ... 196
5.3.4.3. Concentration des protéines sur colonne Vivaspin... 197
5.3.5. Analyse des protéines en gel filtration ... 197
5.3.5.1. Gel filtration avec la colonne Superdex S75... 197
5.3.5.2. Gel filtration avec la colonne Superdex S200... 197
5.3.6. Test d’activité de MabA ... 197
5.3.7. Cristallographie de MabAG162L... 198
5.4. MESURE DES INTERACTIONS PROTEINE-PROTEINE... 199
5.4.1. Double hybride et triple hybride chez la levure ... 199
5.4.1.1. Préparation des cellules compétentes... 199
5.4.1.2. Transformation par électroporation... 199
5.4.2. Détermination de la force des interactions en double et triple hybride chez la levure... 200
5.4.2.1. Tests qualitatifs : stries... 200
5.4.2.2. Tests quantitatifs : dilutions spots ... 201
5.4.2.3. Evaluation de la force des interactions ... 201
5.4.3. Tests biochimiques en Co-Immunoprécipitation (Co-IP) ... 202
5.4.3.1. Transcription/traduction in vitro... 202
5.4.3.2. Fixation de l’anticorps anti-HA sur les billes... 202
5.4.3.3. Co-immunoprécipitation... 202
5.5. MODELISATION ET ALIGNEMENTS STRUCTURAUX... 204
5.5.2. Alignements structuraux ... 204
5.5.3. Représentation 3D ... 204
5.6. MICROSCOPIE... 205
5.6.1. Préparation des échantillons... 205
5.6.2. Observations au microscope... 205
1.1.
La tuberculose
La tuberculose, maladie infectieuse provoquée par l’agent Mycobacterium tuberculosis (Mtu), est l’un des principaux problèmes de santé mondial. Avec près d’un tiers de la population mondiale infectée (porteurs sains) et 1.7 millions de décès chaque année, la tuberculose est la première cause de mortalité due à un agent étiologique unique (Bloom and Murray, 1992). On a estimé à 9,2 millions le nombre de nouveaux cas de tuberculose en 2006. En 2007, l’Afrique, l’Asie du Sud Est et le Pacifique occidental, totalisaient 83% des cas notifiés (Rapport mondial sur la lutte contre la tuberculose, OMS, 2008) (figure 1). Cette situation alarmante amène l’OMS à en faire une priorité en terme de santé mondiale.
Figure 1 : Taux d’incidence estimé de tuberculoses, 2007, OMS
La vaccination par le BCG, (Calmette et Guérin, 1921), la découverte d’antituberculeux majeurs comme l’isoniazide (INH) en 1952, mais aussi l’amélioration de l’hygiène et des conditions de vie (l’accès à l’eau potable, la construction de logements sains…) ont permis de faire reculer la pandémie dans les pays industrialisés. On assiste cependant à une certaine recrudescence de la tuberculose depuis plusieurs années dans les milieux défavorisés ou sous forme de maladies nosocomiales en milieu hospitalier chez des patients immunodéprimés.
Dans les pays en voie de développement, la situation ne s’est jamais résorbée. Les conditions de vie misérables, le faible accès aux traitements et la coïnfection tuberculose/VIH expliquent
la progression de la maladie. La prise partielle des traitements entraîne l’apparition de nouvelles formes résistantes, multi-résistantes (MDR) ou ultra-résistantes (XDR) aux antibiotiques les plus efficaces. On estime à 0.5 million le nombre de tuberculoses MDR, essentiellement en Afrique mais aussi en Europe de l’Est.
L’apparition de ces souches résistantes rend urgente la découverte de nouveaux traitements antituberculeux en se focalisant si possible sur des voies pouvant amener vers des composés rendant l’émergence de résistances plus difficile.
1.1.1. Le genre Mycobacterium
Mycobacterium tuberculosis appartient au genre Mycobacterium qui comprend plusieurs
espèces faisant toutes parties de l’ordre des Actinomycetales. Les mycobactéries sont des bacilles qui mesurent de 2 à 5µM de longueur et de 0.2 à 0.5µM de largeur. Elles sont non-motiles. Elles ont longtemps été considérées comme non-sporulantes mais une étude récente effectuée sur M.marinum suggère le contraire. En effet, les mycobactéries formeraient des endospores et des gènes majeurs responsables de la sporulation chez Bacillus subtilis ont été retrouvés dans différents génomes de mycobactéries (Ghosh et al., 2009). Leur ADN est à haut pourcentage en GC (61 à 71 %). Elles survivent en milieu aérobie ou micro-aérobie (mais pas anaérobie). Les mycobactéries sont des bacilles dits acido-alcoolo-résistants (BAAR) car ils sont mis en évidence par la coloration à la fuschine de Ziehl-Neelsen, où ils apparaissent rouges sur fond bleu (figure 2). Elles sont mal colorées par la coloration de Gram mais elles ont été classées dans les bactéries Gram-positives.
On peut classer les différentes mycobactéries en fonction de leur pouvoir pathogène. On distingue les pathogènes stricts comme Mtu (découvert par Koch en 1882), M.Leprae (agent de la lèpre – découvert par Hansen en 1873), M.ulcerans ou M.marinum (par exemple) ; les pathogènes opportunistes (M.avium, M.marinum, M.Kansasii,…) ; les non pathogènes et saprophytes (M.smegmatis, M.phlei, M.gastri, M.gordonae,…).
Un classement peut aussi être réalisé en fonction de leur vitesse de croissance. Les mycobactéries à croissance rapide comme M.smegmatis (2 à 3 heures de temps de génération). Celles à croissance lente comme Mtu ou M.bovis (de 24h à 2 semaines de temps de génération).
De nombreuses séquences complètes du génome d’espèces de mycobactéries ont été déterminées dans les dix dernières années. Les séquençages complets des génomes de mycobactéries pathogènes et non-pathogènes ont été réalisés : à titre d’exemples, nous pouvons citer : Mtu H37Rv (Cole et al., 1998), Mtu CDC1551 (Fleischmann et al., 2002),
Mtu F11 and Mtu C (www.broad.mit.edu/seq/msc/), M.leprae (Cole et al., 2001), M.smegmatis mc²155 (www.tigr.org), M.bovis AF2122/97 (Garnier et al., 2003), M.avium subspecies paratuberculosis K-10 (Li et al., 2005) et M.marinum (www.sanger.ac.uk). Ces séquençages ouvrent la voie à de nouvelles avancées vers la découverte de nouveaux antituberculeux ou de nouveaux vaccins plus performants. Le séquençage du génome de
M.leprae a montré que ce pathogène intracellulaire strict a perdu plus de 2000 gènes au cours
de l’évolution. Les gènes conservés sont retrouvés chez les autres mycobactéries pathogènes, notamment ceux qui codent pour la biosynthèse de l’enveloppe. Ainsi, le génome de M.leprae peut être considéré comme le génome minimal mycobactérien (Cole et al., 2001; Vissa and Brennan, 2001).
1.1.2. Données immunologiques de la tuberculose
1.1.2.1. Cycle infectieux de Mycobacterium tuberculosis
Mtu, parasite intracellulaire facultatif, infecte l’homme par voie aérienne. Mtu peut rester en
vie plusieurs heures dans l’atmosphère. L’infection se fait par inhalation de gouttelettes contenant un faible nombre de bacilles (Kaufmann, 2001) qui vont atteindre les alvéoles
Guérison spontanée Maladie active (immunodépression) Phase de latence (> 90%) Granulome Dissémination Réactivation (< 10%) Guérison spontanée Maladie active (immunodépression) Phase de latence (> 90%) Granulome Dissémination Réactivation (< 10%) Guérison spontanée Maladie active (immunodépression) Phase de latence (> 90%) Granulome Dissémination Réactivation (< 10%)
pulmonaires (figure 3). Les bacilles sont phagocytés par les macrophages alvéolaires via l’interaction entre différents ligands de la bactérie et récepteurs du macrophage. Dans 70% des cas, les bactéries sont lysées par les défenses immunitaires. Cependant, la mise en place de différentes stratégies pour contrer l’activité bactéricide de l’hôte va permettre à Mtu de persister dans 30% des cas.
Figure 3 : Infection, latence, réactivation et dissémination. Le devenir de l’infection après l’inhalation de Mycobacterium tuberculosis (d’après Kaufmann, 2001). Dans 70% des cas, Mtu est lysée par les défenses
immunitaires de l’hôte. Dans 30% des cas, Mtu persiste dans l’organisme. Dans 90% des cas de persistance, l’infection reste à l’état latent dans des granulomes. La maladie se développe dans 10% des cas de persistance, immédiatement ou après une phase de latence.
Dans 90% des cas de persistance (Kaufmann, 2001), l’infection reste à l’état latent dans l’organisme jusqu’à la mort naturelle du porteur (figure 3). Les bacilles vont se développer rapidement dans les macrophages, conduisant au recrutement de cellules dendritiques puis de Lymphocytes T. Des structures appelées granulomes vont alors se mettre en place. Elles sont formées de macrophages infectés entourés de cellules géantes poly-nucléées puis de Lymphocytes T (figure 4). À ce moment-là, un équilibre se crée entre les défenses immunitaires et le développement du bacille. Une fois cet équilibre atteint, l’hôte n’est pas contagieux, le processus pathologique peut s’arrêter et les bactéries peuvent rester à l’état
70%
Voies respiratoires Macrophage alvéolaire Mycobacterium Macrophages alvéolaires infectés Vaisseau sanguin Cellules mononucléaires Macrophage infecté Lymphocyte Foamy macrophage Foamy macrophage Lymphocyte Macrophage Macrophage Vaisseau sanguin Gaine fibreuse Voies respiratoires Granulome Mycobactéries libres Centre du granulome nécrotique et caséeux Voies respiratoires Macrophage alvéolaire Mycobacterium Macrophages alvéolaires infectés Vaisseau sanguin Cellules mononucléaires Macrophage infecté Lymphocyte Foamy macrophage Foamy macrophage Lymphocyte Macrophage Macrophage Vaisseau sanguin Gaine fibreuse Voies respiratoires Granulome Mycobactéries libres Centre du granulome nécrotique et caséeux
quiescent pendant de nombreuses années. À ce stade, il n’y a pas d’expression clinique de la maladie même si le virage des tests tuberculiniques permet de détecter la primo-infection.
Figure 4 : Pathologie du granulome (d’après Russell, 2007). Le bacille tuberculeux infecte son hôte via des gouttelettes en suspension dans l’atmosphère. Dans le poumon, Mtu est phagocytée par les macrophages alvéolaires et induit une réponse pro-inflammatoire qui conduit au recrutement de cellules phagocytaires mononucléaires présentes dans les vaisseaux sanguins adjacents. Ces cellules sont la base du granulome qui est constitué d’un noyau de macrophages infectés, entourés de foamy macrophages et d’autres phagocytes mononucléaires, puis de lymphocytes associés à une gaine fibreuse de collagène qui délimitent la périphérie de la structure. A ce stade l’infection est contenue, l’hôte ne présente aucun signe de maladie et n’est pas contagieux. Suite à une immunodépression, le granulome se caséifie puis se rompt libérant ainsi dans l’organisme et dans l’atmosphère de nombreux bacilles tuberculeux.
C’est dans 10% des cas d’infection que les patients développent une tuberculose (figure 3). La phase de latence peut être rompue au moment, par exemple, d’un changement de statut immunologique de l’hôte (personnes âgées, malnutrition, immunodépression, co-infection avec le VIH). Il y a alors multiplication intense des bacilles, une réaction immunitaire importante et une réponse inflammatoire localisée qui conduit au recrutement des cellules du système immunitaire (monocytes, cellules dendritiques et Lymphocytes T) par l’intermédiaire des interleukines IL-10 et IL-12 (Sadek et al., 1998) sécrétées par les macrophages. Ces cellules vont sécréter des cytokines pro-inflammatoires comme l’interféron-γ qui vont conduire à l’activation des macrophages (Gordon, 2003). La réactivation de la maladie entraîne une caséification des lésions (caséum : lésion spécifique de la tuberculose) qui entraîne la nécrose totale des cellules. Les lésions caséeuses solides (nodules) peuvent évoluer vers la liquéfaction et se vider, le plus souvent dans les bronches, avec formation de cavernes. Les cavernes sont les lésions les plus riches en bacilles (de l’ordre de 108 bacilles/caverne). Le malade devient très contagieux pour son entourage (15 contaminations par an en moyenne). À cette étape de l’infection, si aucun traitement n’est adopté, la maladie entraîne la mort du patient.
Les symptômes de la tuberculose pulmonaires sont la toux prolongée (plus de 15 jours) avec fièvre, les hémoptysies et les douleurs thoraciques. Symptômes généralement associés à un ensemble de signes non spécifiques comme l’asthénie, l’amaigrissement, l’anorexie ou encore la fièvre vespérale.
Dans moins de 10% des cas de tuberculose, on peut observer des formes extra-pulmonaires provoquées par une dissémination hématogène des bacilles. Ces formes de tuberculose entraînent généralement des lésions fermées et peu riches en bacilles. Quand la tuberculose pulmonaire est accompagnée d’une atteinte hématogène et hépatique, on parle de tuberculose miliaire. Finalement, la forme de tuberculose la plus dangereuse est méningée (méningite à liquide clair). Elle est due à la présence de Mtu dans le liquide céphalo-rachidien.
Les associations du VIH (Virus d’Immunodéficience Humaine) avec Mtu, M.avium, ou certaines mycobactéries opportunistes à croissance rapide forment des combinaisons extrêmement mortelles (Corti et al., 2009). En affaiblissant les défenses immunitaires, le VIH multiplie par 30 le risque de développer la tuberculose (Goletti et al., 1996; Murray, 1996).
Chez les patients co-infectés, les localisations extra pulmonaires de la maladie sont plus fréquentes. La tuberculose reste la première cause de décès chez les patients atteints du VIH.
1.1.2.2. Interaction hôte/pathogène : la phagocytose
La phagocytose de Mtu par les macrophages correspond à l’enchaînement d’invagination de la membrane, de protrusion et d’évènements de fusion qui aboutissent à la formation d’un phagosome (Aderem and Underhill, 1999). Les phagosomes sont de petites vésicules qui permettent à la cellule d’internaliser des fluides (pouvant contenir des bactéries) provenant de l’environnement extérieur (Schmid, 1997). Le matériel phagocyté dans le phagosome peut-être distribué à l’intérieur de la cellule ou délivré au Complexe Majeur d’Histocompatibilité de classe II (CMH-II) afin d’induire une réponse immunitaire adaptative par présentation d’antigènes aux lymphocytes T. La destination finale du phagosome est le lysosome dans lequel les agents extérieurs seront dégradés via, entre autre, l’intervention de protéines antimicrobiennes ou l’abaissement du pH du milieu. On parle de fusion du phagosome et du lysosome aboutissant à la formation du phagolysosome.
La surface de Mtu est d’une grande complexité (Brennan and Nikaido, 1995; Daffe and Draper, 1998; Dover et al., 2004a), ce qui lui permet de « pénétrer » dans les cellules phagocytaires via de nombreux récepteurs (Cambi and Figdor, 2005; Ernst, 1998). On distingue l’entrée par voie opsonique ou par voie non opsonique.
La phagocytose non opsonique correspond aux cas où le ligand est reconnu directement par un récepteur du phagocyte. On distingue principalement le récepteur au mannose et le récepteur DC-SIGN (Tailleux et al., 2003). Le récepteur DC-SIGN semble être l’unique récepteur permettant aux cellules dendritiques de se lier au bacille tuberculeux. Le récepteur au mannose est présent à la surface des macrophages. Pour la phagocytose opsonique, l’entrée dans les macrophages se fait par l’intermédiaire des récepteurs spécifiques du fragment Fc des immunoglobulines et les récepteurs du complément dont notamment le récepteur au complément de type 3 (CR3).
Le type de récepteurs par lequel Mtu pénètre dans le macrophage a des conséquences importantes sur la survie du bacille. Par exemple, l’internalisation dans les macrophages humains via le récepteur au mannose ne déclenche ni la production de réactifs oxygénés, ni la
maturation du phagosome (Astarie-Dequeker et al., 1999). C’est donc une voie d’entrée relativement sûre pour le bacille tuberculeux. En ce qui concerne la phagocytose opsonique, l’entrée par le récepteur Fc implique une réaction oxydative et une réponse inflammatoire du macrophage. A contrario, l’internalisation via CR3 prévient l’activation des macrophages (Caron and Hall, 1998). De plus, l’entrée CR3-dépendante nécessite la présence de cholestérol sur la paroi de l’hôte (Gatfield and Pieters, 2000), (Peyron et al., 2000). Dans le même ordre d’idée, la présence de cholestérol dans la phagosome contenant Mtu est nécessaire pour l’inhibition de la fusion du phagosome et du lysosome (Gatfield and Pieters, 2000).
1.1.2.3. Granulome : formation et rôle
Le granulome est aussi appelé tubercule. C’est cette appellation qui a donné son nom à la tuberculose. Jusqu’à présent, la formation du granulome était interprétée uniquement comme une réponse de l’hôte et décrite comme suit : la phagocytose du bacille par les macrophages alvéolaires entraîne une réponse pro-inflammatoire forte avec stimulation des Toll Like Receptors (TLR) par des agonistes des TLR de l’hôte très abondants à la surface des mycobactéries. S’en suit une production importante de Tumor Necrosis Factor α (TNF- α) et de différentes chémokines qui vont conduire au recrutement de cellules mononuclées (neutrophiles) à partir des vaisseaux sanguins les plus proches. Ces cellules mononuclées forment la base du granulome (Russell, 2007). Différentes cellules immunitaires sont ensuite recrutées par vagues successives : les natural killer (NK), CD4+ T Cell, CD8+ T Cell. Chacune d’entre elles produisent leurs propres chémokines et cytokines qui vont amplifier le recrutement cellulaire. La cascade cellulaire est régulée par l’interféron-γ (IFN- γ) et remplacée par une réponse immunitaire spécifique. À cette étape, le granulome est stable et peut être décrit comme un noyau de macrophages infectés (au centre) entouré de foamy macrophages et d’autres cellules mononucléaires de phagocytose. Le tout est enveloppé d’un manteau de lymphocytes T mobiles autour du granulome afin d’explorer la matrice formée par les macrophages infectés immobiles au centre. Le TNF-α joue un rôle important dans le recrutement de ces lymphocytes T (Egen et al., 2008). Les macrophages et les Lymphocytes T CD4+ produisent du TNF-α et de la lymphotoxine α3 (Roach et al., 2001) qui assurent le recrutement de fibroblastes responsables de la formation d’une couche fibreuse périphérique composée de collagène et de composants de la matrice extracellulaire. Cette couche maintient l’intégrité du granulome. À ce stade, l’infection est confinée. Le centre du granulome est
hypoxique. Dans une phase plus tardive, le centre se nécrose et on observe une perte de la vascularisation (Russell, 2007) (figure 4). Les foamy macrophages constitueraient un réservoir lipidique utilisé par le bacille tuberculeux dans la persistance à l’intérieur de l’hôte. Les acides mycoliques oxygénés de l’enveloppe mycobactérienne joueraient un rôle important dans la différenciation des macrophages en foamy macrophages (Peyron et al., 2008).
Des études récentes ont permis d’avancer dans la compréhension de la structuration du granulome. Jusqu’à récemment, le TNF-α était donné comme responsable du recrutement des cellules phagocytaires qui forment la base du granulome. Cependant, des expériences de microscopie intra-vitale chez le poisson zèbre (zebrafish, Danio rerio) infecté par M.
marinum (Mm) – un système qui permet d’étudier les étapes précoces du développement de la
tuberculose - montrent qu’en l’absence de sécrétion de TNF-α par le système immunitaire du zébrafish la mortalité de l’hôte augmente, la croissance des mycobactéries est plus rapide et la formation du granulome ainsi que la nécrose et la décomposition de celui-ci est accélérée (Clay et al., 2008). Ces travaux laissent donc penser que le TNF-α n’est pas nécessaire à la formation du granulome mais permet le maintien de son intégrité en limitant la croissance bactérienne et en prévenant la nécrose des macrophages infectés.
On a longtemps considéré que le granulome correspondait à une réponse de l’hôte pour contenir la maladie (Ulrichs and Kaufmann, 2006). L’intérêt pour Mtu dans la formation et l’évolution du granulome a été sous-estimé. Tout d’abord, la formation du granulome coïncide avec une accélération de la croissance du bacille (Volkman et al., 2004). Par ailleurs, il a été récemment montré, toujours par des techniques de microscopie intra-vitale chez le poisson zèbre infecté par Mm, que les bactéries qui ne possédaient pas le locus de virulence RD1 (Région de différence 1) codant pour le système de sécrétion ESX-1 provoquaient des infections atténuées (DiGiuseppe Champion and Cox, 2007) avec un diminution de la formation de granulomes (Volkman et al., 2004). Ces résultats suggèrent que la formation du granulome est utilisée par les mycobactéries pour accroître l’infection. La comparaison de souches de Mm sauvages et Mm sans le locus RD1 (∆RD1 Mm) a permis de déterminer l’impact de RD1 sur les différentes étapes de la pathogénie (Davis and Ramakrishnan, 2009). Les mycobactéries pathogènes intracellulaires utilisent le locus de virulence ESX-1/RD1 pour induire le recrutement de nouveaux macrophages et augmenter la motilité de ceux-ci dans le granulome naissant. L’augmentation de la motilité permet l’arrivée de multiples macrophages qui vont phagocyter les débris de macrophages infectés ayant subit une apoptose. Le nombre
de macrophages infectés est ainsi fortement augmenté et par conséquent le nombre de bacilles croit considérablement. Nous voyons ainsi comment la mycobactérie peut se servir de la réponse immunitaire de l’hôte pour se propager et infecter un grand nombre de cellules pendant la réponse immunitaire innée (figure 5). C’est le recrutement des Lymphocytes T qui va conduire à la stabilisation du granulome et à la phase d’équilibre entre les mycobactéries virulentes et la réponse immunitaire de l’hôte (Egen et al., 2008).
Figure 5 : Stades de la formation du granulome (d’après Bold, 2009). La première étape correspond à l’expansion bactérienne en l’absence de réponse immunitaire adaptative. La croissance et la dissémination des bacilles est facilitée durant la formation du granulome précoce. Les macrophages infectés subissent l’apoptose et recrutent ainsi des macrophages non infectés qui vont phagocyter les débris des cellules lysées ainsi que les bacilles libérés lors de l’apoptose. Lorsque la réponse immunitaire adaptative se met en place, les Lymphocytes T arrivent sur le site de l’infection et vont limiter la croissance bactérienne. Même si elle est essentielle pour le contrôle de l’infection, la réponse adaptative ne peut l’éradiquer. Le granulome mature représente un état d’équilibre entre l’infection mycobactérienne et la réponse immunitaire de l’hôte.
Macrophage Corps apoptotiques
Lymphocyte T
Signal chémotactique
Mycobactérie
Expansion bactérienne Contrôle immunitaire Équilibre
Macrophage Corps apoptotiques
Lymphocyte T
Signal chémotactique
Mycobacérie
1.1.2.4. Contournement de l’activité bactéricide
La survie de Mtu dans le macrophage est due à plusieurs facteurs. Les bacilles mettent en œuvre une série de mécanismes et nous présenterons ici les plus importants sachant qu’il en existe d’autres.
- Inhibition de la fusion du phagosome avec le lysosome
L‘enveloppe des mycobactéries a une structure unique en terme de lipides et de glycolipides (Brennan and Nikaido, 1995; Daffe and Draper, 1998; Daffe and Etienne, 1999) (voir paragraphe 1.2) et sa composition a une importance cruciale dans la virulence de Mtu. En effet, la perte de l’un de ses composants entraîne souvent une perte de virulence (Glickman et
al., 2000), (Makinoshima and Glickman, 2005). Par exemple, certains glycolipides jouent un
rôle dans l’inhibition de la synthèse du phagolysosome. Le phosphatidylinositol 3-phosphate (PI3P) est un composant de la membrane de l’hôte essentiel à la fusion du phagosome et du lysosome (Roth, 2004). Mtu prévient l’accumulation de PI3P dans la membrane du phagosome (Fratti et al., 2003) via deux mécanismes. Tout d’abord les lipoarabinomannanes (LAM) inhibent la phosphatidylinositol 3-kinase, enzyme de biosynthèse du PI3P (Vergne et
al., 2003). De plus, Mtu sécrète une phosphatase, SapM (Rv 3310), qui hydrolyse le PI3P
(Vergne et al., 2005) (figure 6).
Mtu possède 11 sérine/thréonine protéines kinases « eucaryotic-like » (Cole et al., 1998). Les
sérine/thréonine kinases interviennent dans la modulation des cascades de transduction de signaux. La majorité d’entre elles sont des protéines transmembranaires et deux sont solubles : PknG (Rv0410c) et PknK (Rv3080c). PknG est la seule kinase maintenue dans toutes les mycobactéries pathogènes. PknG est impliquée dans le métabolisme de la glutamine (Niebisch et al., 2006). Il a été montré que les mutants « knock out » pour le gène pknG de
Mtu perdent leur virulence car la fusion du phagosome et du lysosome est restaurée (Majlessi et al., 2007), (Walburger et al., 2004), (Cowley et al., 2004). PknG est relarguée dans le
cytosol du macrophage et son action demeure inconnue mais son essentialité dans l’inhibition de la fusion du phagosome et du lysosome a été démontrée (Walburger et al., 2004) (figure 6). De plus, la présence de PknG dans le cytosol la rend facilement accessible aux antibiotiques et un inhibiteur spécifique a été mis en évidence (Scherr et al., 2007).
Figure 6 : Inhibition de la fusion du phagosome et du lysosome par Mtu (d’après Pieters, 2008). Mtu sécrète la phosphatase SapM qui hydrolyse le PI3P, composant de la membrane du phagosome essentiel à la fusion. Par ailleurs, les LAM de la surface de Mtu inhibent la biosynthèse de PI3P. Mtu sécrète également la sérine/thréonine kinase PknG qui est essentielle à l’inhibition de la fusion du phagosome et du lysosome. Enfin, la Coronin 1 est recrutée et retenue à la surface du phagosome par Mtu. Elle active la calcineurine qui, une fois activée, participe à l’inhibition de la fusion du phagosome et du lysosome.
Enfin, Mtu recrute activement la Coronin 1 (aussi connu sous les noms P57 ou TACO pour « Tryptophan Aspartate Containing coat protein ») à la surface du phagosome. Il s’agit d’une protéine qui lie le cytosquelette à la membrane plasmique des leucocytes (Gatfield et al., 2005). La Coronin 1 s’accumule sur la membrane des phagosomes (Ferrari et al., 1999; Itoh
et al., 2002) et y est retenue activement par les mycobactéries qui résident dans le phagosome.
joue un rôle dans l’inhibition de la fusion du phagosome et du lysosome (Ferrari et al., 1999; Nguyen and Pieters, 2005). Elle est relarguée lorsque le bacille est dégradé dans le macrophage (Ferrari et al., 1999), (Gatfield et al., 2005). De plus, la Coronin 1 est essentielle à l’activation de la Ca2+-dependante phosphatase, la calcineurine qui une fois activée inhibe la fusion du phagosome et du lysosome (Jayachandran et al., 2007). En absence de Coronin 1, la calcineurine n’est pas activée, il y a fusion du phagosome et du lysosome et le bacille est éliminé. La Coronin 1 est donc un facteur essentiel de survie pour les mycobactéries dans le macrophage à travers l’activation de la calcineurine (figure 6).
- Résistance au stress oxydatif
La capacité de Mtu à bloquer la fusion du phagosome avec le lysosome est vraie uniquement dans les macrophages non-activés. L’activation des macrophages conduit au déclenchement d’une réponse oxydative. Les macrophages sont activés par le Tumor Necrosis Factor α (TNF- α) et l’interféron-γ (Adams and Hamilton, 1984), (Bogdan and Schleicher, 2006). L’interféron-γ induit la génération de réactif oxygénés (ROI) et nitrogénés (RNI) responsables de l’activité bactéricide de l’hôte (MacMicking et al., 1997). Mtu peut persister dans cet environnement grâce à plusieurs mécanismes qui agissent conjointement. La structure particulière de sa paroi est fortement responsable de la survie et de la réplication du bacille dans le macrophage : par exemple, il a été montré que les acides mycoliques α, acides mycoliques cyclopropanés, jouaient un rôle important dans l’adaptation de Mtu au stress oxydatif (Yuan et al., 1995). Ce n’est pas la seule explication. Mtu produit la protéine KatG (Rv 1908c) qui peut inactiver, dans le phagosome, les dérivés oxygénés (Li et al., 1998). De plus, le protéasome de Mtu joue un rôle dans l’adaptation au stress des oxydes nitriques. Il a été montré qu’une souche de Mtu déficiente pour une adénosine triphosphatase du protéasome était atténuée chez la souris et que l’exposition à des inhibiteurs des protéases du protéasome rendait très sensible Mtu sauvage aux RNI. (Darwin et al., 2003).
- Inhibition de l’apoptose
Lorsqu’une cellule hôte est confrontée à un pathogène qui utilise ses ressources propres pour survivre et se développer, l’une des stratégies de défense est d’activer l’apoptose. L’apoptose, ou mort cellulaire programmée, est un type de mort cellulaire qui laisse la membrane de la cellule intacte. C’est un mode de défense classique de l’hôte contre les virus intracellulaires
d’une part et contre certaines bactéries pathogènes d’autre part. L’apoptose permet de limiter la multiplication bactérienne et facilite la présentation d’antigènes. L’apoptose est un processus hautement régulé de déconstruction cellulaire qui confine les constituants cytoplasmiques dans des vésicules appelées « corps apoptotiques ». Ces vésicules seront ensuite reconnues et engouffrées par des phagocytes via de multiples récepteurs de surface. L’activation des caspases (aspartate-specific cysteine protease) permet le déclenchement de l’apoptose. Elle peut se faire par deux voies principales. La voie extrinsèque met en jeu la liaison de ligands, le TNF-α ou FasL par exemple, à leurs récepteurs (Fas ou TNFR1) (Oddo
et al., 1998). La voie intrinsèque, impliquant la translocation du cytochrome c des mitochondries dans le cytosol.
Les souches atténuées de Mtu (H37Ra) et de Mycobacterium bovis (Mycobacterium bovis BCG) induisent l’apoptose naturelle des macrophages à un faible niveau d’infection. À l’inverse, Mtu supprime la réponse apoptotique des macrophages via l’induction de la production d’IL-10. Cette cytokine bloque la synthèse de TNF-α par les macrophages et induit le décrochage du récepteur soluble au TNF, inhibant ainsi la voie extrinsèque de mise en place de l’apoptose (Balcewicz-Sablinska et al., 1998; Koul et al., 2004). Par ailleurs, les lipoarabinomannanes à coiffes mannosyles (ManLAM), lipoglycannes de l’enveloppe des mycobactéries à croissance lente,stimulent la phosphorylation de la protéine apoptotique Bad du macrophage, ce qui l’empêche de se lier aux protéines anti-apoptotiques Bcl-2 et Bcl-X. La protéine Bcl-2, libérée de son inhibiteur, bloque le cytochrome c dans les mitochondries et inhibe l’activité des caspases (Koul et al., 2004; Maiti et al., 2001). Pour finir, Gan et coll. ont récemment montré que Mtu bloquait la formation de l’enveloppe apoptotique, ce qui conduit à la nécrose et donc à la dissémination de l’agent pathogène dans les poumons (Gan et al., 2008).
- Échappement du bacille du phagosome vers le cytosol
Il a été montré que les mycobactéries pathogènes pouvaient passer du phagosome au cytosol dans les cellules non apoptotiques (McDonough et al., 1993; van der Wel et al., 2007). Par ailleurs, des expériences de microscopie intravitale chez le zébrafish infecté par Mm montrent que le bacille est capable de s’échapper du phagosome vers le cytosol, d’activer des facteurs qui induisent la polymérisation de l’actine, et ainsi de conduire à sa dissémination de cellule en cellule (Stamm et al., 2003).
Il semblerait que le système spécialisé de sécrétion de protéines ESX-1 joue un rôle dans cette faculté de dissémination des mycobactéries. Les protéines qui constituent ESX-1 sont codées par la région RD1 (Hsu et al., 2003; Stanley et al., 2003) qui comporte neuf gènes dans Mtu qui ne sont pas présents chez le vaccin atténué Mycobacterium bovis BCG (Behr et
al., 1999). La restauration de ces gènes chez BCG entraîne une restauration partielle de la
virulence (Pym et al., 2002). Mtu et M.marinum utilisent ESX-1 pour exporter des protéines de virulence (Gao et al., 2004; Stanley et al., 2003; Xu et al., 2007). La région RD1 comporte 15 gènes impliqués dans la sécrétion de facteurs de virulence via le système de sécrétion ESX-1 chez Mtu. Les principales protéines sécrétées, dont les gènes sont présents dans la région RD-1, sont ESAT-6 (Early secretory antigenic target-6) (Rv3875) et CFP-10 (Culture filtrate protein-10) (Rv3874). Ces deux protéines sont co-sécrétées sous forme d’hétérodimère (Renshaw et al., 2002). De nombreuses fonctions sont proposées pour CFP-10 et ESAT-6. Les protéines codées par RD1, dont CFP-10 et ESAT-6, joueraient un rôle dans le recrutement de macrophages non infectés et la propagation du bacille dans ceux-ci lors de la formation du granulome (voir chapitre 1.1.2.3). Il semblerait également que le complexe stable CFP-10/ESAT-6 se lierait aux cellules de l’hôte (Renshaw et al., 2005) et entraînerait une régulation négative des mécanismes de défense de l’hôte ainsi que de la réponse immunitaire (Ganguly et al., 2008).
Enfin, et c’est l’objet de ce chapitre, il a aussi été montré qu’ESAT-6 interagit avec les biomembranes après s’être séparé de CFP-10, sa chaperone potentielle, dans l’environnement acide du phagolysosome (de Jonge et al., 2007). Cette interaction permettrait au bacille pathogène de s’échapper de l’environnement hostile du phagolysosome. Cette hypothèse est confirmée par une étude en microscopie à fluorescence sur des macrophages murins infectés par Mm (Smith et al., 2008). Ces travaux suggèrent qu’ESAT-6, sécrétée par ESX-1, joue un rôle direct dans la formation de pores dans la membrane des vacuoles qui contiennent la mycobactérie. Ces pores permettraient alors au bacille de s’échapper et de se disséminer dans d’autres cellules.
1.1.3. Traitements et prévention
1.1.3.1. La vaccination : le BCG
En 1921, Calmette et Guérin ont fini de mettre au point un vaccin vivant à partir d’une souche atténuée de M.bovis non virulente qui porte leur nom (Calmette A, 1927 La vaccination préventive contre la tuberculose, Masson, Paris) : le Bacille de Calmette et Guérin (BCG). L’utilisation de ce vaccin au niveau international s’est généralisée à partir de 1940. À travers le monde, on compte 3 Milliards de personnes vaccinées. Cependant, en France, compte tenu du faible taux d’incidence et d’un accès aisé aux traitements antituberculeux les plus efficaces, la vaccination BCG obligatoire a été suspendue en 2007. Il n’y a jamais eu aucun exemple de réversion de cette souche vers une forme virulente (Orme, 1995).
De façon surprenante, le degré de protection varie selon les souches, les populations, le mode d’administration de 0 à 80% (une protection moyenne de 50% est admise). Cependant, la protection est plus importante en ce qui concerne les formes méningées de la tuberculose chez les jeunes enfants (70 à 80%). Plusieurs raisons peuvent expliquer l’efficacité variable de la vaccination BCG. Tout d’abord, il se pourrait que la souche vaccinale ait muté de façon différente selon les différents pays producteurs du vaccin (Oettinger et al., 1999). Par ailleurs, certaines populations sont en contact régulier avec des mycobactéries non pathogènes possédant des motifs antigéniques communs avec la souche vaccinale. La vaccination est ainsi amenée à échouer car la souche BCG est éliminée rapidement sans mise en place d’une réponse immunitaire mémoire. De nombreuses études sont en cours pour trouver un nouveau vaccin plus efficace (Kaufmann, 2005). Deux types d’approches sont développées : la mise en place d’une nouvelle souche vaccinante (BCG modifié ou Mtu atténuée) ou la mise en place d’un rappel de vaccination avec un vaccin sous-unitaire composé d’un nombre restreint de motifs anti-géniques.
1.1.3.2. Traitement de la tuberculose
- La stratégie « Halte à la tuberculose » de l’OMS
En 1995, l’OMS met en place la stratégie DOTS (Directly Observed Treatment, Short-course) qui implique un engagement politique, des services d’examens microscopiques, un approvisionnement en médicaments, des systèmes de surveillance et l’utilisation de schémas thérapeutiques hautement efficaces sous surveillance directe. Cette stratégie vise à enrayer l’épidémie et à prévenir l’apparition de nouvelles souches résistantes aux traitements connus. Elle est adoptée par 155 pays et a pour objectif de détecter 70% des nouveaux cas dans le monde et d’en guérir 85%. Bien qu’en deçà des objectifs fixés (61% des cas détectés en 2006), cette stratégie est néanmoins un succès avec 84,7% des cas détectés soignés en 2005.
En 2006, l’OMS lance une nouvelle stratégie « Halte à la tuberculose ». Cette stratégie repose essentiellement sur le DOTS, en intégrant les difficultés essentielles que posent la co-infection tuberculose/VIH et l’émergence des souches multi-résistantes. De plus, cette méthode préconise de donner les moyens d’agir aux personnes et aux communautés touchées, de renforcer les systèmes de santé et de promouvoir la recherche.
- Traitements classiques (figure 7)
Le diagnostic de la tuberculose se fait par détection du bacille soit à l'examen direct d'un échantillon (expectoration) au microscope, soit après mise en culture de ce même échantillon. Cette dernière procédure est cependant longue (plusieurs semaines), ce qui retarde d'autant le diagnostic. Le premier antibiotique actif contre la tuberculose a été découvert par Waksman en 1943. Il s’agit de la streptomycine. Ensuite, l’acide para-amino-salicylique est découvert en 1949. Dans les 20 années qui suivent, les antituberculeux les plus courants seront découverts : l’Isoniazide, la Rifampicine (antibiotique à large spectre), l’Ethambutol et la Pyrazinamide sont les antibiotiques de première ligne les plus utilisés. La stratégie DOTS prévoit deux phases pour le traitement de la tuberculose. La première repose sur la prise de quatre médicaments pendant deux mois (Isoniazide, Rifampicine, Ethambutol et Pyrazinamide). La seconde phase dure quatre à six mois avec prise de deux médicaments (Isoniazide et Rifampicine). Durant chaque étape, un contrôle médical est nécessaire et l’analyse des expectorations permet d’évaluer l’efficacité du traitement.
Figure 7 : Structures, cibles et mutations associées aux résistances des principaux antibiotiques antituberculeux (d’après Sacchettini et al., 2008)
La streptomycine est un antibiotique qui appartient à la classe des aminosides (ou aminoglycosides). Il a été isolé à partir d'une souche d'actinobactérie Streptomyces griseus. Les antibiotiques de cette classe agissent en se fixant sur le ribosome. Une fois l'antibiotique fixé sur le ribosome, la bactérie produit des protéines non fonctionnelles et meurt rapidement. Plus précisément, la streptomycine inhibe l’initiation de la traduction des ARN messagers, facilite les erreurs du code de lecture et diminue l’activité « proofreading » du ribosome (Hash, 1972). Il a été montré que Mtu devenait résistant à la streptomycine (Blanchard, 1996) après mutation dans le gène codant pour une sous-unité du ribosome. La mutation de situe sur le gène rpsL (Rv0682) qui code pour la protéine ribosomale S12 (Finken et al., 1993). Cet antibiotique n’est aujourd’hui plus utilisé en raison de sa toxicité en dehors de rares situations (résistances, insuffisance hépatocellulaire ne permettant pas l’utilisation de la pyrazinamide, forte contagiosité).
La rifampicine est un antibactérien à large spectre qui diffuse à travers la paroi hydrophobe de la bactérie. Il appartient à la famille des ansamycines lipophiles. La rifampicine interfère avec la synthèse des ARN messagers en se fixant sur l’ARN polymérase ADN-dépendante de la bactérie (Hash, 1972). Il est très efficace contre le bacille tuberculeux et a une toxicité faible car il est inefficace sur l’ARN polymérase humaine. Mtu développe des résistances à la rifampicine notamment par des mutations localisées dans une région précise du gène de la sous-unité β de l’ARN polymérase (rpoB-Rv0667) (Telenti et al., 1993).
La pyrazinamide (PZA), un analogue du nicotinamide, est une pro-drogue qui requiert l’hydrolyse de la fonction amide par une pyrazinamidase mycobactérienne pour donner un acide pyrazinoïque (Konno et al., 1967). La PZA a la capacité d’inhiber une population de bacilles en « semi-dormance » dans un environnement acide (Mitchison, 1985) (par exemple durant la phase active de l’inflammation), une propriété qui n’est pas présente chez les autres antituberculeux. L’utilisation de la PZA a permis de réduire fortement la durée de traitement des patients atteints de tuberculose. La pyrazinamidase est codée par le gène pncA (Rv2043c) et la résistance à la PZA est généralement due a des mutations dans pncA qui abolie l’activité amidase (Scorpio and Zhang, 1996) (Scorpio et al., 1997). Il a été montré que FAS-I était l’une des cibles de la PZA (Zimhony et al., 2000).
L’éthambutol inhibe spécifiquement la biosynthèse de l’arabinogalactane, polysaccharide majeur de la paroi, et celle du lipoarabinomannane. Ceci est la conséquence de l’inhibition des activités arabinosyl-transférases. Les phénomènes de résistance sont associés avec des mutations dans les gènes de la famille emb (Sreevatsan et al., 1997; Telenti et al., 1997). D’autres gènes doivent cependant également rentrer en compte (Alcaide et al., 1997).
Le mécanisme d’action de l’INH, antituberculeux majeur dans le traitement des patients atteints de la tuberculose, sera décrit dans le paragraphe 1.3.6.
- Développement de nouvelles molécules
Les années 90 ont vu l’apparition des premières souches résistantes (MDR-TB, multidrug-resistant TB). Les MDR-TB sont résistantes, au moins à la rifampicine et à l’isoniazide et on les trouve essentiellement en Afrique, en Asie et dans les états de l’ex-URSS. De plus, de nouvelles souches, extrêmement résistantes (XDR-TB), ont fait leur apparition chez des
patients HIV positifs en Afrique du Sud. Les XDR-TB sont résistantes à tous les antituberculeux de la stratégie DOTS et à plusieurs traitements de seconde ligne. Le spectre des souches que l’on n’arrive pas à traiter n’a jamais été aussi large. Les raisons qui expliquent l’apparition de ses souches résistantes sont multiples : traitements inadéquats, antituberculeux de mauvaise qualité ou inefficaces, durée de la prise d’antibiotiques trop courte. En effet, la disparition des symptômes est rapide mais l’élimination du bacille nécessite plusieurs mois de traitements. Ceci conduit, chez beaucoup de patients démunis, à un arrêt du traitement de façon prématurée. Le second facteur qui rend difficile le traitement de la tuberculose est le phénomène de dormance du bacille qui peut faire échouer le traitement chez des souches qui ne présentent pas de résistance. Ce phénomène de persistance est complexe. Les bacilles sont « protégés » des antituberculeux dans les tissus à l’intérieur du granulome. Ils pourraient alors modifier leur métabolisme et adopter un état physiologique qui les rend insensibles aux traitements. En effet, le développement cellulaire pourrait être ralenti et les antibiotiques qui agissent sur la croissance ou la division cellulaire être inefficaces (Stewart et al., 2003). L’état de dormance est la principale raison qui rend nécessaire des traitements de plusieurs mois. Un antituberculeux actif contre les bacilles en dormance permettrait de diminuer considérablement la durée de la thérapie. Cependant, un tel antibiotique semble difficile à mettre au point si le bacille est réellement en dormance.
Les propriétés désirables pour de nouvelles molécules, la méthode d’investigation ainsi que les principaux candidats pour de nouveaux traitement ont récemment fait l’objet de revues (Cole and Alzari, 2007) (Sacchettini et al., 2008). Les antituberculeux recherchés devront répondre à un certains nombre des critères suivants : être actif contre les MDR-TB, tuer les bacilles tuberculeux latents, être compatibles avec les antituberculeux existants, ne pas interagir ou montrer d’antagonisme avec les agents anti-rétroviraux, être suffisamment « petits » pour accéder à leur cible in vivo. De nombreuses approches existent pour la découverte de nouveaux agents antituberculeux. La principale est l’identification de cibles, le plus souvent des enzymes, essentielles à la survie de Mtu. Ce travail a été rendu possible par les progrès en génomique (Cole et al., 1998) et l’obtention de données sur l’essentialité de gènes par des approches de mutants conditionnels de et de mutagenèse à haut débit (Sassetti et
al., 2001, 2003). Les cibles peuvent ensuite être testées contre des librairies d’agents
chimiques, inhibiteurs potentiels, d’une part. D’autre part, les progrès en biologie structurale pourraient permettre de déterminer la structure des cibles potentielles et ensuite de prédire des inhibiteurs potentiels. D’autres approches essayent d’améliorer des antituberculeux déjà
existants comme par exemple la thiolactomycine ou l’éthambutol. On peut noter aussi des tentatives de tester des composés antimicrobiens à large spectre comme les fluoroquinolones ou d’étendre des classes d’antibiotiques comme les dérivés nitroimidazoles. Enfin, une étude a révélé, in vitro et in vivo dans un modèle murin, une nouvelle molécule capable de tuer Mtu
in vitro, ex vivo et dans la souris avec une efficacité supérieure à l’INH : Les benzothiazinones
(BTZ) (Makarov et al., 2009). Les BTZ ciblent la décaprénylphosphoryl-b-D-ribose 2’-épimérase, enzyme responsable de la formation du décaprénylphosphoryl arabinose qui est un précurseur de l’arabinane de la paroi. Cet antibiotique cible donc la biosynthèse de l’arabinogalactane de la paroi mycobactérienne. Toutes ces approches sont cependant limitées car les tests d’inhibitions in vitro s’avèrent souvent infructueux in vivo. Il a récemment été mis au point un test de criblage à haut débit pour déterminer, in vivo, l’activité antituberculeuse de molécules qui viendraient tuer Mtu à l’intérieur du macrophage sans avoir de toxicité pour l’hôte (Christophe et al., 2009). Cette technique, rapide et prometteuse, a déjà permis d’identifier plusieurs molécules, actives contre les mycobactéries et non toxiques pour le macrophage, candidates à l’élaboration d’une nouvelle génération d’antibiotiques antituberculeux.
1.2.
Structure de l’enveloppe mycobactérienne
Les premiers travaux sur l’enveloppe mycobactérienne ont eu lieu dans les années 60 et 70 à l’université d’Osaka (Japon) et au CNRS (France) par Yamamura, Kato, Azuma, Lederer… Les développements des techniques analytiques (RMN, Spectrométrie de masse…) et le séquençage complet du génome de Mtu ont permis d’avancer dans la connaissance précise de la structure et de l’architecture de l’enveloppe du bacille. Pourtant, il a été difficile d’arriver à un modèle cohérent qui rende correctement compte de l’organisation des nombreuses molécules complexes de l’enveloppe des mycobactéries.
L’étude de la membrane mycobactérienne est une priorité dans la lutte contre la tuberculose car elle constitue la première barrière de perméabilité conférant à Mtu une résistance à de nombreux antibiotiques hydrophiles (Jarlier and Nikaido, 1994). De plus, elle est aussi impliquée dans l’adhésion, l’internalisation et la survie intra-macrophagique. Beaucoup de ces composantes sont des facteurs de virulence. Au-delà de l’aspect fondamental, comprendre la biosynthèse, la structure et le rôle de l’enveloppe mycobactérienne, est primordial dans l’optique de découvrir de nouveaux traitements antituberculeux ou de nouveaux vaccins.
Les mycobactéries, considérées comme appartenant à la famille des GRAM+ à haut GC% (~70%), sont plus spécifiquement classées dans le groupe des CMN (Corynebacterium,
Mycobacterium, Nocardia, Rhodococcus, Gordona, Dietzia, Tsukamurella) qui se
caractérisent par une enveloppe complexe et riche en lipides.
1.2.1. Organisation générale
L’enveloppe mycobactérienne est classiquement décrite, du cytoplasme vers le milieu extracellulaire de la façon suivante (figure 8) : une membrane plasmique, suivie de la paroi et enfin de la couche externe, ou capsule, qui forme la dernière strate de l’enveloppe. La description de la structure de la paroi des mycobactéries provient essentiellement d’un modèle proposé par Minnikin (Minnikin et al., 1982). Dans ce modèle, le peptidoglycane est lié de façon covalente à l’hétéropolysaccharide arabinogalactane, lui-même estérifié par des acides mycoliques. Ces acides mycoliques s’orientent parallèlement les uns aux autres et
perpendiculairement à l’enveloppe (Nikaido et al., 1993). Ils formeraient la partie interne d’une bicouche asymétrique. D’autres lipides extractibles par des solvants organiques constitueraient la partie externe de cette bicouche asymétrique. Cependant, cette structure asymétrique n’a jamais été réellement démontrée directement que ce soit par microscopie ou par d’autres moyens.
Figure 8 : Schéma de l’enveloppe mycobactérienne (d’après J. Vaubourgeix, thèse de l’Université Paul Sabatier, 2009). La membrane plasmique est composée d’une bicouche de phospholipides (bleu) et de protéines (vert). La couche granulaire (bleu clair) est accolée à la membrane plasmique dans le périplasme. Le peptidoglycane (rectangles noirs) et lié à l’arabinogalactane, lui-même lié à la mycomembrane (rouge). La couche externe est essentiellement composée de polysaccharides et de protéines.
Mycomembrane Couche externe Couche Granulaire AG/PG Membrane plasmique 7.1 nm 7.5 nm PERIPLASME Cytosol PG Mycomembrane Couche externe Couche Granulaire AG/PG Membrane plasmique 7.1 nm 7.5 nm PERIPLASME Cytosol PG
Des études récentes, chez M.smegmatis, M.bovis BCG et C.glutamicum, ont permis de visualiser directement une membrane externe analogue à celle des bactéries GRAM négatives formée d’une bicouche lipidique (Hoffmann et al., 2008; Zuber et al., 2008). Ces données ont été obtenues par la technique de CEMOVIS (Cryo-Electron Microscopy of Vitreous Section). Cette technique a l’avantage de permettre l’observation de l’enveloppe dans un état proche de l’état natif contrairement aux autres techniques de microscopie classiques dont les traitements préalables aux observations altèrent la structure de l’enveloppe. Les travaux de Zuber et coll.
et de Hoffmann et coll. aboutissent aux conclusions suivantes : l’enveloppe des mycobactéries comprend une membrane plasmique sur laquelle est accolée une couche granulaire, communément observée chez les bactéries GRAM positives, qui se situerait dans l’espace périplasmique dont l’existence était jusque là controversée. De plus, cette technique a permis d’observer directement une membrane externe, ou mycomembrane, composée probablement d’une bicouche lipidique qui comprendrait les acides mycoliques.
Figure 9 : Modèles d’organisation des acides mycoliques dans l’enveloppe des mycobactéries. A : modèle en W (d’après Zuber et al., 2008). Noir : acides mycoliques ; Bleu foncé : phospholipides ; Bleu clair : Glycophospholipides (GPL) ; Gris clair : Porine ; Orange : Tréhaloses dimycolates (TDM) ; Rouge : Tréhaloses monomycolates (TMM). B : modèle de Hoffmann (d’après Hoffmann et al., 2008). Rouge : acides mycoliques ; Noir et blancs : autres lipides ; Gris : Porine.