Synthèse de nouveaux composés substitués par les
groupements trifluorométhyle et pentafluorosulfanyle
Thèse
Justine Desroches
Doctorat en chimie
Philosophiae doctor (Ph.D.)
Québec, Canada
© Justine Desroches, 2017
Synthèse de nouveaux composés substitués par les
groupements trifluorométhyle et pentafluorosulfanyle
Thèse
Justine Desroches
Sous la direction de :
iii
Résumé
Le substituant trifluorométhyle est le groupement alkyle fluoré le plus étudié. Il possède de nombreuses applications, et est particulièrement utilisé en chimie médicinale et en agrochimie. Malgré la multitude de méthodes déjà disponibles pour l’insertion de ce groupement dans une molécule, le fort intérêt qu’il suscite justifie la création de nouvelles voies de synthèse de composés trifluorométhylés.
Le groupement pentafluorosulfanyle, quant à lui, a attiré l’attention dès sa découverte en 1950 grâce à ses propriétés exceptionnelles. Cependant, l’intérêt qui lui est porté s’estompe rapidement en partie à cause de la difficulté d’obtention des composés pentafluorosulfanylés. Plus récemment, et suite à la découverte de nouvelles méthodes pour son introduction, le substituant SF5 a refait surface et fait ses preuves dans des domaines
variés allant de la chimie des matériaux à l’industrie pharmaceutique. Toutefois, la chimie du groupement pentafluorosulfanyle reste peu explorée et le développement de nouvelles méthodes de synthèse pour leur obtention est, de nos jours, toujours nécessaire.
Ainsi, le développement de plusieurs conditions réactionnelles autorisant l’accès à de nouveaux composés trifluorométhylés et pentafluorosulfanylés est présenté dans ce manuscrit. Celles-ci ont permis la formation de diarylméthanes, diarylméthanols, indolines, 2,3-dihydrobenzofuranes, indoles et benzofuranes portant un groupement CF3 ou SF5.
Aussi, des réactions de substitution nucléophile et de Tsuji-Trost, par des amines, phénols, malonates et thiols, sur des dérivés portant les chaînes 4,4,4-trifluorobut-2-ène et 3-(pentafluorosulfanyl)allyle ont été réalisées. Enfin, la réactivité d’alcènes substitués par un groupement pentafluorosulfanyle a été étudiée.
iv
Abstract
On the one hand, the trifluoromethyl substituent is the most studied fluorinated alkyl group. It has a number of applications and is especially used in fields like medicinal chemistry and agrochemistry. Despite the large amount of methods available for the insertion of the trifluoromethyl group in a molecule, the forever growing interest for this substituent motivates the invention of new synthetic routes for the formation of trifluoromethylated compounds.
On the other hand, the pentafluorosulfanyl group has attracted attention ever since its discovery in 1950 thanks to its remarquable properties. However, the interest invested in it quickly faded as pentafluorosulfanylated compounds were hard to access. More recently, and following new discoveries regarding the introduction of a SF5 moiety on alkenes, the
pentafluorosulfanyl group regains interest and its efficiency in various fields is demonstrated. Indeed, a large number of SF5–containing compounds with applications in
fields ranging from medicinal chemistry to material sciences were synthesized. However, the chemistry of the pentafluorosulfanyl group remains little explored and the development of new synthetic pathways for the formation of pentafluorosulfanylated compounds is still necessary.
Thus, reaction conditions for the synthesis of new trifluoromethylated and pentafluorosulfanylated compounds were developed and are reported herein. They allow the formation of new CF3– and SF5–containing diarylmethanes, diarylmethanols, indolines,
2,3-dihydrobenzofurans, indoles and benzofurans. Moreover, nucleophilic substitution and Tsuji-Trost reactions on 4,4,4-trifluorobut-2-ene and 3-(pentafluorosulfanyl)allyl derivatives, using amines, phenols, malonates and thiols as nucleophiles, were performed. Finally, the reactivity of pentafluorosulfanyl-substituted alkenes was studied.
v
Table des matières
Résumé ... iii
Abstract ... iv
Table des matières ... v
Liste des tableaux ... ix
Liste des figures ... x
Liste des schémas ... xi
Liste des abréviations ... xiv
Remerciements ... xvi
Avant-Propos ... xviii
Chapitre 1 Introduction... 1
1.1. Généralités sur le fluor ... 2
1.2. Les groupements fluorés ... 4
1.2.1. Le groupement trifluorométhyle ... 4
1.2.1.2. Synthèse ... 5
1.2.1.3. Applications ... 10
1.2.2. Le groupement pentafluorosulfanyle ... 12
1.2.2.1. Propriétés ... 13
1.2.2.2. Résonance magnétique nucléaire ... 16
1.2.2.3. Applications ... 17
1.2.2.4. Synthèse de composés aliphatiques ... 18
1.2.2.4.1. Origine accidentelle ... 19
1.2.2.4.2. Addition de SF5X ... 19
1.2.2.5. Synthèse de composés vinyliques ... 23
1.2.2.5.1. Méthode générale ... 23
1.2.2.5.2. Synthèse du 3-hydroxypropénylpentafluorure de soufre ... 24
1.2.2.6. Synthèse de composés aromatiques ... 25
1.2.2.6.1. Première synthèse... 25
1.2.2.6.2. Fluoration vigoureuse en deux étapes ... 25
1.2.2.6.3. Fluoration par F2 ... 27
vi
1.3. Objectifs de la thèse ... 29
Chapitre 2 Réaction de Friedel-Crafts sur des alcools benzyliques ... 31
2.1. Introduction ... 32
2.2. Optimisation... 35
2.3. Étude de l’étendue de la réaction ... 37
2.4. Discussion ... 43
2.5. Conclusions ... 46
2.6. Partie expérimentale ... 47
2.6.1. General information ... 47
2.6.2. Preparation of benzyl alcohols ... 48
2.6.2.1. By reduction of carbonyl compounds ... 48
2.6.2.2. Synthesis of 4-(hydroxymethyl)phenyl acetate ... 50
2.6.2.3. Synthesis of (2,5-dimethylphenyl)(phenyl)methanol ... 51
2.6.3. General procedure for the Friedel-Crafts benzylation ... 52
2.6.3.1. Benzylation of 4-tert-butylbenzyl alcohol with various arenes ... 53
2.6.3.2. Benzylation of various benzyl alcohols with p-xylene ... 58
2.6.3.3. Synthesis of 1,1,1-triarylmethanes ... 66
2.6.4. General procedure for reactions in the presence of a base ... 68
2.6.5. Mechanistic investigations using triflic anhydride ... 68
Chapitre 3 Arylation 1,2 de benzaldéhydes substitués par un groupement pentafluorosulfanyle ... 70
3.1. Introduction ... 71
3.2. Résultats et discussion ... 73
3.2.1. Diarylméthanols racémiques ... 73
3.2.2. Diarylméthanols énantioenrichis ... 79
3.3. Partie expérimentale ... 93
3.3.1. Materials and methods ... 93
3.3.2. General procedure for the racemic 1,2-arylation of 3- and 4-pentafluorothiobenzaldehyde ... 94
3.3.2.1. Addition of boronic acids on 4-pentafluorothiobenzaldehyde... 94
3.3.2.2. Addition of boronic acids on 3-pentafluorothiobenzaldehyde... 104
3.3.3. Asymmetric 1,2-arylation of 4-pentafluorothiobenzaldehyde ... 115
3.3.3.1. General procedure ... 115
3.3.3.2. Addition on 4-pentafluorothiobenzaldehyde ... 115
vii
3.3.4.1. General procedure ... 122
3.3.4.2. Addition of boronic acids on 3-pentafluorothiobenzaldehyde... 123
3.3.4.3. CF3- and t-Bu-analogs of (S)-3.2 ... 128
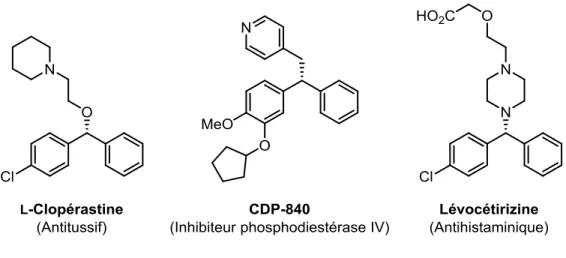
3.3.5. SF5-containing L-Cloperastine analogs ... 129
Chapitre 4 Insertion de la chaîne 4,4,4-trifluorobut-2-ène ... 131
4.1. Introduction ... 132
4.2. Réaction de Tsuji-Trost ... 134
4.3. Réaction de substitution nucléophile ... 144
4.4. Partie expérimentale ... 155
4.4.1. Materials and methods ... 155
4.4.2. Tsuji-Trost reaction ... 156
4.4.2.1. Synthesis of amines ... 156
4.4.2.1.1. Synthesis by reductive amination ... 157
4.4.2.1.2. Synthesis of N-methylaniline derivatives ... 161
4.4.2.2. Synthesis of malonates ... 163
4.4.2.3. Synthesis of the acetate and carbonate derivatives ... 164
4.4.2.4. Insertion of the 4,4,4-trifluorobut-2-ene chain ... 166
4.4.2.4.1. General procedure using the acetate 4.8 ... 166
4.4.2.4.2. General procedure using the carbonate 4.9 ... 167
4.4.2.4.3. Use of phenols, amines and malonates as nucleophiles ... 167
4.4.2.5. Isomerization reaction ... 188
4.4.2.6. Further transformations... 189
4.4.3. Nucleophilic substitution reaction ... 192
4.4.3.1. Synthesis of the tosylate derivative ... 192
4.4.3.2. SN2 reaction ... 192
Chapitre 5 Insertion de la chaîne 3-(pentafluorosulfanyl)allyle ... 198
5.1. Introduction ... 199
5.2. Optimisation des conditions réactionnelles ... 201
5.3. Résultats et discussion ... 206
5.4. Conclusions ... 211
5.5. Partie expérimentale ... 212
5.5.1. General information ... 212
viii
5.5.3. General procedures ... 215
5.5.4. Insertion of the (E)-3-(pentafluorosulfanyl)allyl chain ... 215
Chapitre 6 Réactivité d’alcènes trifluorométhylés et pentafluorosulfanylés ... 237
6.1. Introduction ... 238
6.2. Addition 1,4 sur un ester insaturé ... 240
6.3. Cyclisation radicalaire intramoléculaire ... 242
6.3.2. Alcènes trifluorométhylés ... 245
6.3.3. Alcènes pentafluorosulfanylés... 252
6.3.4. Conclusions ... 258
6.4. Formation d’indoles et de benzofuranes... 259
6.4.1. Par oxidation d’indolines et de 2,3-dihydrobenzofuranes ... 259
6.4.2. Par réaction de Heck intramoléculaire ... 261
6.5. Isomérisation d’une double liaison pentafluorosulfanylée ... 264
6.6. Conclusions ... 267
6.7. Partie expérimentale ... 268
6.7.1. General information ... 268
6.7.2. Radical cyclization reactions ... 269
6.7.2.1. Synthesis of the phenols ... 269
6.7.2.2. Synthesis of the amines ... 271
6.7.2.3. SN2 reaction of trifluoromethylated compounds ... 274
6.7.2.4. SN2 reaction of pentafluorosulfanylated compounds ... 283
6.7.2.5. Cyclization of trifluoromethylated compounds... 291
6.7.2.6. Cyclization of pentafluorosulfanylated compounds ... 298
6.7.3. Formation of indoles and benzofurans ... 307
Chapitre 7 Conclusions et perspectives ... 309
7.1. Retour sur les objectifs ... 310
7.1.1. Synthèse de composés trifluorométhylés ... 310
7.1.2. Synthèse de composés pentafluorosulfanylés ... 311
ix
Liste des tableaux
Tableau 1.1. Table comparative des propriétés des groupements CF3 et SF5., ... 13
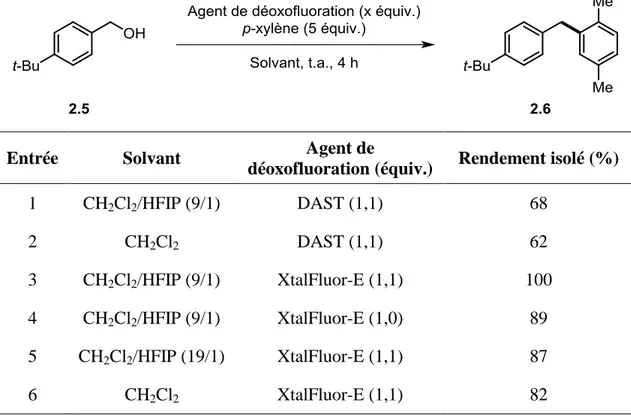
Tableau 2.1. Optimisation de la benzylation de Friedel-Crafts, résultats sélectionnés. ... 36
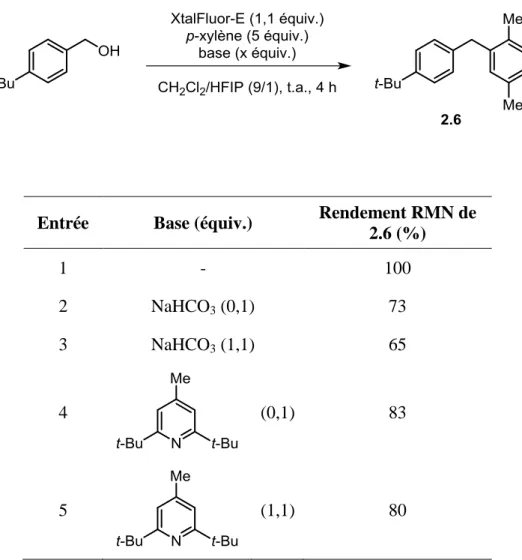
Tableau 2.2. Influence de l’ajout d’une base sur la réaction. ... 44
Tableau 3.1. Optimisation de l’arylation 1,2 du 4-pentafluorothiobenzaldéhyde par l’acide phénylboronique, résultats sélectionnés.a ... 75
Tableau 3.2. Optimisation de l’arylation 1,2 asymétrique du 4-pentafluorothiobenzaldéhyde par l’acide phénylboronique, résultats sélectionnés. ... 82
Tableau 4.1. Premiers résultats. ... 136
Tableau 4.2. Réaction de Tsuji-Trost avec des thiols. ... 142
Tableau 4.3. Optimisation de la réaction de SN2, résultats sélectionnés. ... 147
Tableau 4.4. Réaction entre le tosylate 4.4 et les malonate et méthylmalonate de dibenzyle. ... 154
Tableau 5.1. Optimisation de la réaction de Tsuji-Trost, résultats sélectionnés. ... 202
Tableau 5.2. Optimisation de la réaction de substitution nucléophile sur le tosylate 5.3, résultats sélectionnés. ... 204
Tableau 6.1. Cyclisation d’éthers allyliques trifluorométhylés. ... 248
Tableau 6.2. Cyclisation d’amines allyliques trifluorométhylés. ... 250
Tableau 6.3. Cyclisation d’éthers allyliques pentafluorosulfanylés. ... 254
Tableau 6.4. Cyclisation d’amines allyliques pentafluorosulfanylées. ... 257
Tableau 6.5. Optimisation des conditions réactionnelles, résultats sélectionnés. ... 262
Tableau 6.6. Optimisation du système catalytique, résultats sélectionnés. ... 263
x
Liste des figures
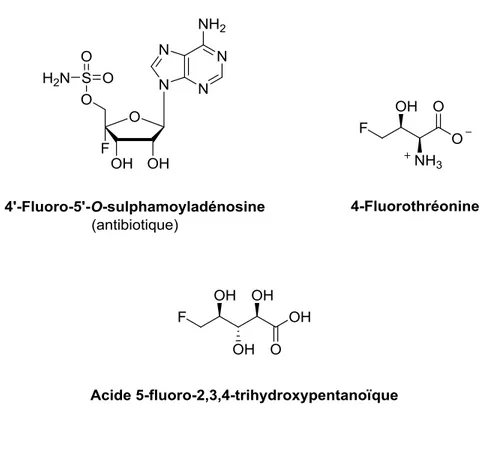
Figure 1.1. Exemples de composés naturels fluorés. ... 3
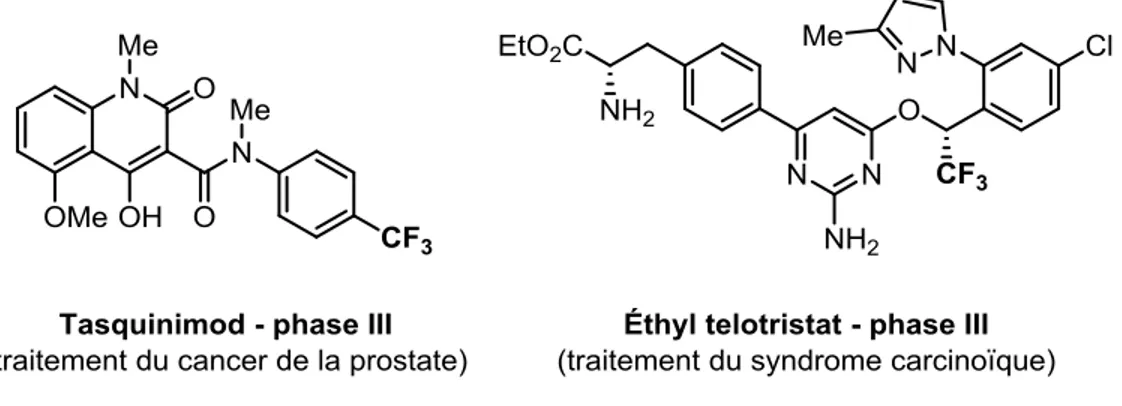
Figure 1.2. Exemples de composés trifluorométhylés en essai clinique. ... 5
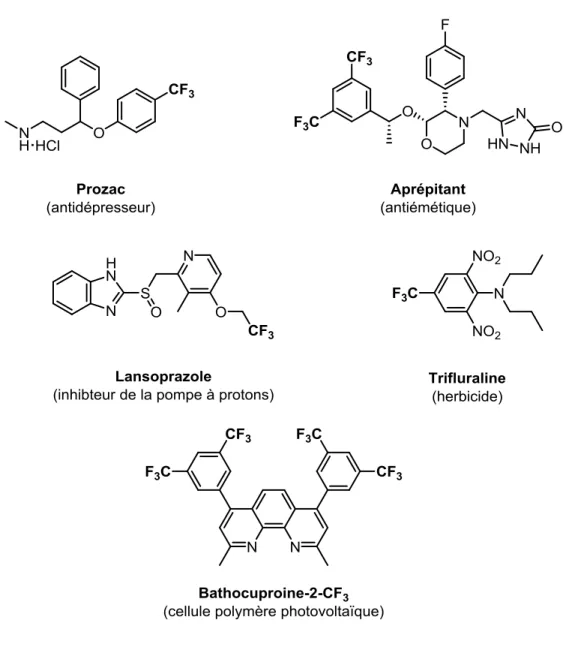
Figure 1.3. Exemples de composés trifluorométhylés ayant des applications dans les domaines pharmaceutique, agrochimique et des matériaux. ... 11
Figure 1.4. Conformation du groupement SF5 en série aliphatique. ... 14
Figure 1.5. (a) Comparaison du volume entre un groupement SF5 (en orange) et t-Bu (en violet). (b) Comparaison du volume entre un groupement SF5 (en orange) et CF3 (en violet). ... 15
Figure 1.6. Exemple de spectre RMN 19F d’un groupement SF5 aromatique. ... 16
Figure 1.7. Composés d’intérêt substitués par un groupement pentafluorosulfanyle. ... 18
Figure 2.1. Exemples de diarylméthanols présentant une activité biologique. ... 33
Figure 3.1. Dérivés de diarylméthanols d’intérêt. ... 72
Figure 3.2. Ligand phosphoramidite bidentate : (R,R)-Me-BIPAM. ... 80
Figure 3.3. Structure cristallographique de (R)-3.8. ... 81
Figure 4.1. Composés comportant une chaîne 4,4,4-trifluorobut-2-ène... 132
xi
Liste des schémas
Schéma 1.1. Exemples de méthodes d’insertion d’un groupement trifluorométhyle. ... 6
Schéma 1.2. Trifluorométhylation catalysée au ruthénium. ... 7
Schéma 1.3. Trifluorométhylation d’un iodoalcène catalysée au cuivre. ... 7
Schéma 1.4. Trifluorométhylation d’acides boroniques vinyliques. ... 8
Schéma 1.5. Formation de la chaîne 4,4,4-trifluorobut-2-ène par métathèse. ... 8
Schéma 1.6. Synthèse du (E)-(((4,4,4-trifluorobut-2-èn-1-yl)oxy)méthyl)benzène. ... 9
Schéma 1.7. Réaction de Mitsunobu pour la formation d’un éther de phénol... 10
Schéma 1.8. Première synthèse de composés pentaflurorosulfanylés... 19
Schéma 1.9. Mécanisme de l'addition radicalaire de SF5Cl. ... 21
Schéma 1.10. Intérêt de la présence de triéthylborane. ... 22
Schéma 1.11. Utilisation de triéthylborane. ... 22
Schéma 1.12. Déshydrohalogénation., ... 24
Schéma 1.13. Synthèse du 3-hydroxypropénylpentafluorure de soufre. ... 24
Schéma 1.14. Première synthèse du pentafluorothiobenzène. ... 25
Schéma 1.15. Synthèse de Ar–SF4Cl. ... 26
Schéma 1.16. Synthèse du pentafluorothiophénol. ... 27
Schéma 1.17. Formation des 3- et 4-nitrophénylpentafluorures de soufres. ... 28
Schéma 1.18. Synthèse des 3- et 4-pentafluorothiobenzaldéhydes à partir des nitrophénylpentafluorures de soufre correspondants. ... 28
Schéma 2.1. Substitution nucléophile grâce à l’activation de lien carbone-fluor par liaison hydrogène. ... 32
Schéma 2.2. Réaction de Friedel-Crafts de fluorures benzyliques. ... 32
Schéma 2.3. Différentes voies de synthèse de fluorures benzyliques. ... 34
Schéma 2.4. Réaction de Friedel-Crafts d’alcools benzyliques activée par le XtalFluor-E. ... 35
Schéma 2.5. Réaction de Friedel-Crafts entre l’alcool 4-tert-butylbenzylique et divers nucléophiles aromatiques. ... 38
Schéma 2.6. Polymérisation de 2.5 en présence de nucléophiles pauvres en électrons. ... 39
Schéma 2.7. Réaction secondaire de dimérisation. ... 40
Schéma 2.8. Réaction de Friedel-Crafts entre divers alcools benzyliques et le p-xylène. ... 41
Schéma 2.9. Synthèse de 1,1,1-triarylméthanes. ... 42
xii
Schéma 2.11. Mécanisme proposé pour l’arylation de Friedel-Crafts d’alcools benzyliques en présence de
XtalFluor-E. ... 45
Schéma 2.12. Réactivité d’un triflate de benzyle généré in situ. ... 46
Schéma 3.1. Synthèse de diarylméthanols pentafluorosufanylés en position 3. ... 72
Schéma 3.2. Arylation 1,2 d’aldéhydes pentafluorosulfanylés. ... 73
Schéma 3.3. Effet du ligand sur l’arylation du 4-pentafluorothiobenzaldéhyde. ... 74
Schéma 3.4. Arylation 1,2 du 4-pentafluorothiobenzaldéhyde avec différents acides boroniques. ... 77
Schéma 3.5. Arylation 1,2 du 3-pentafluorothiobenzaldéhyde avec différents acides boroniques. ... 78
Schéma 3.6. Arylation 1,2 énantiosélective du 4-pentafluorothiobenzaldéhyde avec différents acides boroniques. ... 84
Schéma 3.7. Arylation 1,2 asymétrique et réaction de Meerwein–Ponndorf–Verley. ... 85
Schéma 3.8. Optimisation de l’arylation 1,2 asymétrique du 3-pentafluorothiobenzaldéhyde par l’acide phénylboronique, résultats sélectionnés. ... 86
Schéma 3.9. Arylation 1,2 énantiosélective du 3-pentafluorothiobenzaldéhyde avec différents acides boroniques. ... 88
Schéma 3.10. Arylation 1,2 énantiosélective des 3-trifluorométhyl et 3-tert-butylbenzaldéhydes avec l’acide phénylboronique. ... 90
Schéma 3.11. Synthèse des analogues pentafluorosulfanylés racémique et énantioenrichi de la L-Clopérastine. ... 92
Schéma 4.1. Approche pour la synthèse de composés comportant un groupement 4,4,4-trifluorobut-2-ène. 133 Schéma 4.2. Réaction de Tsuji-Trost pour la formation de dérivés du 4,4,4-triflurobut-2-ène. ... 134
Schéma 4.3. Synthèse des substrats trifluorométhylés à partir du 4,4,4-trifluorocrotonate d’éthyle. ... 135
Schéma 4.4. Réaction de Tsuji-Trost avec différents phénols. ... 138
Schéma 4.5. Réaction de Tsuji-Trost avec différentes amines. ... 139
Schéma 4.6. Réaction de Tsuji-Trost avec des malonates. ... 141
Schéma 4.7. Fonctionnalisation de 4.12.a. ... 143
Schéma 4.8. Réactions de SN2. ... 145
Schéma 4.9. Synthèse du 4-méthylbenzènesulfonate de (E)-4,4,4-trifluorobut-2-èn-1-yle 4.4... 146
Schéma 4.10. Premier essai de SN2 avec l’alcool benzylique. ... 148
Schéma 4.11. Mécanisme proposé pour la formation de 4.52. ... 149
Schéma 4.12. Résultat prometteur pour la substitution nucléophile par l’alcool benzylique. ... 149
Schéma 4.13. Réactions entre le tosylate 4.4 et le dodécanethiol ou le thiophénol. ... 150
Schéma 4.14. Réactions entre le tosylate 4.4 et des amines aliphatiques. ... 151
Schéma 4.15. Réactions entre le tosylate 4.4 et des amines aromatiques... 152
xiii
Schéma 4.17. Réaction entre le tosylate 4.4et l’indole dans des conditions différentes. ... 153
Schéma 5.1. Réactions de Tsuji-Trost et SN2 pour l’introduction d’un substituant pentafluorosulfanylé. ... 200
Schéma 5.2. Synthèse du carbonate et du tosylate pentafluorosufanylés... 201
Schéma 5.3. Réaction secondaire d’isomérisation de l’insaturation. ... 205
Schéma 5.4. Dérivés du phénol comme nucléophiles. ... 207
Schéma 5.5. Amines comme nucléophiles. ... 209
Schéma 5.6. Réaction de substitution nucléophile avec des thiols. ... 210
Schéma 5.7. Réaction de Tsuji-Trost avec des malonates. ... 211
Schéma 6.1. Fonctionnalisation de l’alcène 5.5. ... 238
Schéma 6.2. Réduction par l’azodicarboxylate de potassium. ... 239
Schéma 6.3. Réarrangement de Claisen. ... 240
Schéma 6.4. Synthèse du (E)-3-(pentafluorosulfanyl)acrylate de méthyle 6.7. ... 241
Schéma 6.5. Schéma général de l’addition 1,4 sur l’ester 6.7. ... 241
Schéma 6.6. Précédents sur la synthèse d’indolines et dihydrobenzfuranes. ... 243
Schéma 6.7. Cyclisation radicalaire intramoléculaire. ... 245
Schéma 6.8. Préparations des éthers trifluorométhylés. ... 246
Schéma 6.9. Préparation des amines trifluorométhylées. ... 247
Schéma 6.10. Étude de la sélectivité de la cyclisation. ... 251
Schéma 6.11. Synthèse d’éthers allyliques pentafluorosulfanylés... 252
Schéma 6.12. Synthèse d’amines allyliques pentafluorosulfanylées. ... 254
Schéma 6.13. Formation d’indoles et de benzofuranes. ... 260
Schéma 6.14. Oxydation d'un 2,3-dihydrobenzofurane trifluorométhylé. ... 260
Schéma 6.15. Réaction de Heck intramoléculaire sur le composé 6.10. ... 261
Schéma 6.16. Formation de l’aldéhyde 6.75 à partir de l’alcool allylique 5.1. ... 265
Schéma 6.17. Isomérisation de la double liaison de l’éther allylique 5.5. ... 266
xiv
Liste des abréviations
Ac : acétyleAIBN : azobisisobutyronitrile aq. sat. : solution aqueuse saturée Ar : aryle BHT : 2,6-di-tert-butyl-4-méthylphénol BINAP : 2,2'-bis(diphénylphosphino)-1,1'-binaphtyle Bn : benzyle Boc : tert-butyloxycarbonyle Bu : butyle
cat. : quantité catalytique
CuTc : thiophène-2-carboxylate de cuivre (I) Cy : cyclohexyle
DAST : diéthylaminotrifluorure de soufre DBU : 1,8-diazabicyclo[5.4.0]undéc-7-ène DCE : 1,2-dichloroéthane DMAP : N,N-diméthyl-4-aminopyridine DMF : N,N-diméthylformamide DMSO : diméthylsulfoxyde dppe : 1,2-bis(diphénylphosphino)éthane dppf : 1,1'-bis(diphénylphosphino)ferrocène dppp : 1,2-bis(diphénylphosphino)propane ee : excès énantiomérique équiv. : équivalent ex. : exemple h : heure HFIP : 1,1,1,3,3,3-hexafluoro-2-propanol hν : irradiation par la lumière
xv
Hz : hertz
i-Pr : iso-propyle
j : jour
LDA : diisopropylamidure de lithium Me : méthyle
Mes : mésitylène (1,3,5-triméthylbenzène) min : minute Ms : méthanesulfoxyle Nap : naphtyle NFP : N-formylpipéridine Nu : nucléophile p-cymène : 1-méthyl-4-(1-méthyléthyl)benzène phen : 1,10-phénantroline ppm : partie par million
Red-Al : dihydrobis(2-méthoxyéthanolato)aluminate (I) de sodium RMN : résonance magnétique nucléaire
SN2 : substitution nucléophile de type 2
t.a. : température ambiante
TBACl : chlorure de tétrabutylammonium TBAF : fluorure de tétrabutylammonium TBAI : iodure de tétrabutylammonium TBS : tert-butyldiméthylsilyle
TEABr : bromure de tétraéthylammonium TEACl : chlorure de tétraéthylammonium TEMPO : (2,2,6,6-tétraméthylpipéridin-1-yl)oxy Tf : trifluorométhanesulfonyle
TFA : acide trifluoroacétique Ts : para-toluènesulfonyle
TTMSS : tris(triméthylsilyl)silane v/v : volume/volume
xvi
Remerciements
Tout d'abord je tiens à remercier le Pr Jean-François Paquin pour m'avoir accueillie au sein de son laboratoire et m'avoir guidée tout au long de ces quatre dernières années. Merci pour ta disponibilité, ta compréhension et ta patience surtout envers mes problèmes de santé. J'ai beaucoup appris au cours de ce doctorat grâce à tes conseils et à la liberté dont tu nous laisses disposer au laboratoire.
Je voudrais aussi mentionner les employés du département de chimie, notamment Pierre Audet, Jean Laferrière, Christian Côté, Mélanie Tremblay, Denyse Michaud et Marie Tremblay, qui assurent le bon fonctionnement de celui-ci.
Merci à mes stagiaires, Ariane Tremblay et Marie-Jade Lucier, pour leur contribution, leur motivation et leur volonté d'apprendre.
Je remercie également mes collaborateurs, Pier Alexandre Champagne, Yasmine Benhassine, Dr Rémy Hemelaere, Elsa Forcellini et Audrey Gilbert, pour le travail acharné qu'ils ont fourni. Merci Pier Alexandre pour m'avoir accompagnée pendant que je découvrais la vie d'étudiante au doctorat au début de ma thèse. Yasmine, je te suis reconnaissante d'avoir été mon amie avant même le début de cette longue épreuve et de continuer à l'être. Je te remercie de tout cœur pour ta joie de vivre et la main que tu m'as tendue quand j'en avais besoin. Je remercie aussi Rémy pour les fous rires, la bonne musique, les pauses Kit Kat, la compagnie pendant les vacances de Noël et surtout ton aptitude à bien viser lorsque je te demande de me passer une seringue. Elsa, je te remercie un peu pour tout, mais surtout pour tes jeux de mots hilarants. Merci aussi à Audrey pour m'avoir permis de découvrir de si nombreux animaux aquatiques nocturnes ainsi que leurs cris caractéristiques.
xvii
J'aimerais accorder une mention spéciale aux membres passés et présents du groupe Paquin, en particulier Myriam, Mathilde, Thomas, Jean-François et les petits derniers mais pas les plus jeunes Majdouline et Marius, sachez que j'ai fortement apprécié votre compagnie quotidienne ces dernières années. Merci aussi aux collègues des autres groupes de recherche, je pense notamment à Jean-Daniel, Marc-Alexandre, Clément, pour leur sourire et les fêtes de Noël passées entre expatriés.
Tout simplement merci à David, mais aussi à Nus, Marie, Choupa, Pyoup, Fraid, Hiros, Lovepopo, un certain poisson rouge et tous les autres potes pour votre bonne humeur, même pour les QQ et les RQ, mais surtout parce que vous m'aidez à lutter contre la faim dans le monde. Et ça c'est important. C'est aussi grâce à vous que j'ai survécu à ces années dans le froid.
Je souhaite, bien sûr, remercier de tout cœur ma famille pour leur soutien inconditionnel dans mes choix. Merci d'être fiers de moi, merci de m'apporter du soleil quand il neige. Merci à mes parents d'être si formidables et de m'avoir montré que l'on pouvait surmonter toutes les épreuves. Merci à ma sœur d'être là pour moi et de me faire rire quand j'en ai besoin. Je remercie aussi ma tante, mes cousins, mon parrain et ma marraine de prendre le temps de venir me voir les rares fois où je suis en France.
Pour finir, je tiens à remercier Vincent, d'abord pour avoir choisi de venir vivre cette aventure avec moi au Québec, ensuite pour m'avoir supportée tout au long de cette épreuve. Merci pour ta présence, ton incessant sourire, les nombreux moments de bonheur, pour ta patience, ton optimisme sans failles et tes niaiseries.
xviii
Avant-Propos
Les travaux de recherche présentés dans cette thèse ont été réalisés au sein du laboratoire de recherche en chimie organique et médicinale du Pr Jean-François Paquin à l’Université Laval. Le présent document est divisé en 7 chapitres dont 5 constituent la recherche originale. Quatre des chapitres (chapitres 2 à 5) sont basés sur des articles scientifiques publiés dont le contenu a été adapté et complété lorsque nécessaire. Le texte original des publications a été écrit par le Pr Jean-François Paquin et révisé critiquement par les co-auteurs et moi-même. J'ai rédigé le texte des parties expérimentales des chapitres 2, 3 et 6 tandis que celui des chapitres 4 et 5 a été écrit en collaboration avec le Dr Rémy Hemelaere et Elsa Forcellini respectivement.
Le chapitre 2 est inspiré de l’article intitulé "In situ activation of benzyl alcohols with XtalFluor-E: formation of 1,1-diarylmethanes and 1,1,1-triarylmethanes through Friedel– Crafts benzylation" paru dans Organic & Biomolecular Chemistry le 16 janvier 2015. Des résultats complémentaires ont été ajoutés dans ce document. J'ai effectué la quasi-totalité des expériences. Les co-auteurs de cet article, Yasmine Benhassine et Pier Alexandre Champagne, ont réalisé, respectivement, les réactions de Friedel-Crafts sur l'alcool tert-butylbenzylique en utilisant le DAST comme agent activant et les tests mécanistiques employant l'anhydride triflique.
Le chapitre 3 est basé sur l'article "Racemic and enantioselective metal-catalyzed synthesis of SF5-containing diarylmethanols" publié, lui aussi, dans Organic & Biomolecular
Chemistry le 30 août 2016. Au cours de son stage, Ariane Tremblay a travaillé sur ce projet
sous ma supervision. Elle a contribué majoritairement à l'optimisation des conditions réactionnelles de la réaction d'arylation 1,2 pallado-catalysée. Elle a aussi effectué 8 des réactions d'arylation catalysées au palladium des 3- et 4-pentafluorothiobenzaldéhydes avec différents acides boroniques dans le but d'étudier l'étendue de cette transformation. Ces résultats sont inclus dans la section 3.2.1. J'ai effectué toutes les autres manipulations.
xix
Le quatrième chapitre est tiré des articles "Introduction of the 4,4,4-trifluorobut-2-ene chain exploiting a regioselective Tsuji−Trost reaction catalyzed by palladium nanoparticles" paru dans Organic Letters le 25 mars 2015 et " Systematic study of the reactivity of (E)-4,4,4-trifluorobut-2-en-1-yl 4-methylbenzenesulfonate towards different classes of nucleophiles" publié le 8 octobre 2015 dans Journal of Fluorine Chemistry. J'ai effectué l'optimisation de la réaction de Tsuji-Trost ainsi que l'étude de l'étendue de la réaction sur l’acétate de 4,4,4-trifluorobut-2-ène tandis que les manipulations utilisant le carbonate de (E)-éthyl(4,4,4-trifluorobut-2-en-1-yle) ont été réalisées par le Dr Rémy Hemelaere. Ce dernier a aussi contribué à l'optimisation de la réaction de substitution nucléophile et l'étendue de cette réaction a été étudiée majoritairement par Elsa Forcellini et complétée par moi-même. Plusieurs résultats non publiés ont été ajoutés dans ce chapitre.
Le chapitre 5 est basé sur l'article intitulé "Complementary methods for the introduction of the (E)-3-(pentafluorosulfanyl)allyl chain unto O-, N-, S-, and C-based nucleophiles" publié le 23 août 2015 dans European Journal of Organic Chemistry. L'optimisation et l'étude de l'étendue de la réaction de substitution nucléophile ont été réalisées majoritairement par Elsa Forcellini. J'ai complété ces résultats et ai mené à bien une étude similaire pour la réaction de Tsuji-Trost.
Le chapitre 6, quant à lui, n'est pas tiré d'un article scientifique. Il est constitué entièrement de travaux non publiés auquels j'ai majoritairement contribué. Les expériences sur la réaction d'addition de Michael ont été effectuées par Marie-Jade Lucier (section 6.2), une stagiaire sous ma supervision tandis que celles sur la cyclisation réductrice radicalaire de composés pentafluorosulfanylés ont été réalisées par Audrey Gilbert (section 6.3.3). Toutes les autres manipulations ont été réalisées par moi-même.
1
Chapitre 1
Introduction
2
1.1. Généralités sur le fluor
Le fluor, neuvième élément du tableau périodique, est l’atome le plus électroattracteur de celui-ci avec une électronégativité de 3,98 sur l’échelle de Pauling. Il s’agit du deuxième atome le plus petit après l’hydrogène, avec des rayons de Van der Waals respectifs de 1,47 et 1,20 Å.1 Son fort caractère électroattracteur ainsi que sa petite taille font du fluor un atome très peu polarisable. Ainsi, le lien carbone–fluor, liaison la plus forte entre un atome de carbone et un hétéroatome, possède un caractère peu covalent et presque électrostatique.2 L’atome de fluor est un élément aux propriétés remarquables. Il s’agit de l’halogène le plus présent dans la croute terrestre, il est environ cinq fois plus abondant que l’atome de chlore. Les sources principales de fluor sont la fluorine (CaF2), la cryolite
(Na3AlF6) ou encore la phosphorite.1
Malgré ses caractéristiques exceptionnelles et sa forte abondance naturelle (13ème rang), moins de vingt produits naturels fluorés ont été identifiés (Figure 1.1).3 En revanche, la communauté scientifique s’est rapidement aperçue du potentiel des composés fluorés et le 20ème siècle a été marqué par de nombreuses avancées dans le domaine de la chimie du fluor. En effet, la synthèse industrielle de composés fluoroaromatiques a été rendue possible grâce à la réaction de Balz-Schiemann4 et la fluoration de composés halogénés par le fluorure d’antimoine a permis la synthèse de nombreux composés organofluorés. D’autres domaines que la chimie organique ont aussi été impactés par des découvertes comme le rôle du fluorure d’uranium (UF6) dans l'énergie nucléaire ou la fabrication du
poly(tétrafluoroéthène) : le Teflon.1
1 Hiyama, T.; Yamamoto, H., General Introduction. Dans Organofluorine Compounds: Chemistry and
Applications, Yamamoto, H., Éd. Springer Berlin Heidelberg: Berlin, Heidelberg, 2000; pp 1-23.
2
O'Hagan, D. Chem. Soc. Rev. 2008, 37, 308-319.
3 (a) Carvalho, M. F.; Oliveira, R. S. Crit. Rev. Biotechnol. 2017, 1-18; (b) Harper, D. B.; O’Hagan, D.;
Murphy, C. D., Fluorinated natural products: occurrence and biosynthesis. Dans The Handbook of
Environmental Chemistry, Gribble, G., Éd. Springer Berlin Heidelberg: Berlin, Heidelberg, 2003; pp 141-169;
(c) O’Hagan, D.; B. Harper, D. J. Fluorine Chem. 1999, 100, 127-133.
3
Figure 1.1. Exemples de composés naturels fluorés.3
Aujourd’hui, les composés organofluorés sont présents dans de nombreux domaines et environ 25 % des composés pharmaceutiques et agrochimiques portent au moins un atome de fluor.5 Car l’introduction d’un, ou plusieurs, de ces derniers dans une molécule peut entraîner des modifications importantes de ses propriétés telles que sa lipophilie, son acidité ou encore sa stabilité thermique ou métabolique.6 Il est aussi possible de moduler l’activité catalytique de catalyseurs ou de ligands en insérant des groupements fluorés afin d’altérer leur profil électronique.7
5 Zhou, Y.; Wang, J.; Gu, Z.; Wang, S.; Zhu, W.; Aceña, J. L.; Soloshonok, V. A.; Izawa, K.; Liu, H. Chem.
Rev. 2016, 116, 422-518.
6 Reddy, V. P., General Aspects of Organofluorine Compounds. Dans Organofluorine Compounds in Biology
and Medicine, Elsevier: Amsterdam, 2015; pp 1-27.
7
Surya Prakash, G. K.; Wang, F.; O'Hagan, D.; Hu, J.; Ding, K.; Dai, L.-X., Flourishing Frontiers in Organofluorine Chemistry. Dans Organic Chemistry – Breakthroughs and Perspectives, Wiley-VCH Verlag GmbH & Co. KGaA: 2012; pp 413-476.
4
À cause de la rareté des molécules naturelles fluorées, de nombreux moyens pour l'insertion d'un atome de fluor ou d'un groupement fluoré ont été développés.8 Cependant, la synthèse de nouveaux composés fluorés et la découverte de méthodes de synthèses toujours plus efficaces et utilisant des conditions toujours plus douces pour leur obtention restent des problèmatiques d’actualité.
1.2. Les groupements fluorés
Grâce à ses caractéristiques remarquables, le fluor est devenu un élément de choix à insérer dans un composé pour en modifier les propriétés. Cet atome peut être inséré seul, ou sous forme d’un groupement polyfluoré. Ces derniers sont nombreux, mais, à cause de l’intérêt grandissant pour ces deux substituants ces dernières années, seuls les groupements trifluorométhyle (CF3) et pentafluorosulfanyle (SF5) seront présentés dans ce manuscrit.
1.2.1. Le groupement trifluorométhyle
Le groupement trifluorométhyle est le substituant alkyle fluoré le plus investigué.9 Il s’agit d’un substituant très présent en chimie médicinale et ce depuis 1928.10
Les majeurs groupes pharmaceutiques n’ont pas moins de 20 composés comportant au moins un groupement trifluorométhyle présentement en essais cliniques de phase II ou III (Figure 1.2).5
8
Exemples de revues sur la fluoration : (a) Champagne, P. A.; Desroches, J.; Hamel, J.-D.; Vandamme, M.; Paquin, J.-F. Chem. Rev. 2015, 115, 9073-9174. (b) Furuya, T.; Kamlet, A. S.; Ritter, T. Nature 2011, 473, 470-477. (c) Campbell, M. G.; Ritter, T. Chem. Rev. 2015, 115, 612-633.
9
Barata-Vallejo, S.; Lantaño, B.; Postigo, A. Chem. Eur. J. 2014, 20, 16806-16829.
10
(a) Lehmann, F. Arch. Exp. Pathol. Pharmakol. 1928, 130, 250-255; (b) Yale, H. L. J. Med. Pharm. Chem.
5
Figure 1.2. Exemples de composés trifluorométhylés en essai clinique.5
1.2.1.2. Synthèse
En considérant l’intérêt toujours grandissant des industries pharmaceutique et agrochimique pour le groupement trifluorométhyle, la recherche d’une transformation permettant son introduction de manière efficace, sélective, peu coûteuse et pouvant s’effectuer sur des composés fortement fonctionnalisés est toujours d'actualité. D’innombrables méthodes de natures variées pour insérer un substituant trifluorométhyle dans un composé ont déjà été reportées dans la littérature (Schéma 1.1). Par exemple, le groupement trifluorométhyle peut être introduit sur une molécule en utilisant une source électrophile (ex. : sels de Umemoto, réactif de Togni),9 nucléophile (ex. : TMSCF3)11 ou même radicalaire (ex. :
CF3I) de CF3.12 Il peut, cependant, aussi résulter de la transformation d’un groupe
fonctionnel déjà présent (ex. : trifluoration d'un groupement carboxyle).13
Le motif trifluorométhylé qui est investigué dans ce manuscrit est la chaîne (E)-4,4,4-trifluorobut-2-ène (voir Chapitre 4). Celle-ci se retrouve dans certains composés d’intérêt mais ses méthodes de préparation restent limitées.
11
Liu, X.; Xu, C.; Wang, M.; Liu, Q. Chem. Rev. 2015, 115, 683-730.
12
Ma, J.-A.; Cahard, D. J. Fluorine Chem. 2007, 128, 975-996.
6
Schéma 1.1. Exemples de méthodes d’insertion d’un groupement trifluorométhyle.14
L’une d’elles implique la trifluorométhylation d’un alcène terminal. Différentes conditions réactionnelles ont été développées. Certaines entraînent la formation d’un mélange E/Z (< 8/1)de l’alcène trifluorométhylé,15 tandis que d’autres permettent l’obtention de l’oléfine
14 (a) Egami, H.; Shimizu, R.; Usui, Y.; Sodeoka, M. Chem. Commun. 2013, 49, 7346-7348; (b) Miyake, Y.;
Ota, S.-I.; Nishibayashi, Y. Chem. Eur. J. 2012, 18, 13255-13258; (c) Sato, K.; Omote, M.; Ando, A.; Kumadaki, I. Org. Lett. 2004, 6, 4359-4361.
7
(E) uniquement (Schéma 1.2).16 Une alternative à cette méthode est l’addition d’un halogénure de trifluorométhyle puis élimination d’halogénure d’hydrogène par l’action d’une base.17
Dans ce cas, le composé trifluorométhylé désiré est obtenu en deux étapes.
Schéma 1.2. Trifluorométhylation catalysée au ruthénium.16
La trifluorométhylation d’alcènes fonctionnalisés de configuration (E) est aussi employée. Le groupe d’Hartwig a décrit la trifluorométhylation d’un iodoalcène grâce à une catalyse au cuivre (Schéma 1.3).18 Dans ces conditions, une quantité stœchiométrique de cuivre est nécessaire.
Schéma 1.3. Trifluorométhylation d’un iodoalcène catalysée au cuivre.18
16 Iqbal, N.; Choi, S.; Kim, E.; Cho, E. J. J. Org. Chem. 2012, 77, 11383-11387. 17
(a) Liu, Z.-Q.; Liu, D. J. Org. Chem. 2017, 82, 1649-1656; (b) An, W.; Ha, N.; Lee, H. M.; Malpani, Y. R.; Lee, D.-H.; Jung, Y.-S.; Han, S. B. Adv. Synth. Catal. 2015, 357, 3949-3960.
8
Chu et Qing ont développé une méthode similaire avec le trifluorométhyltriméthylsilane comme agent de trifluorométhylation, un catalyseur de cuivre en quantité stœchiométrique et un alcène substitué par un acide boronique (Schéma 1.4).19
Schéma 1.4. Trifluorométhylation d’acides boroniques vinyliques.19
La réaction de métathèse entre le 3,3,3-trifluoroprop-1-ène et un composé comportant un groupement allyle terminal permet aussi de former la chaîne 4,4,4-trifluorobut-2-ène en employant un catalyseur à base de ruthénium (Hoveyda-Grubbs II; Schéma 1.5).20
Schéma 1.5. Formation de la chaîne 4,4,4-trifluorobut-2-ène par métathèse.20
19
Chu, L.; Qing, F.-L. Org. Lett. 2010, 12, 5060-5063.
9
Les méthodes de formation de la chaîne 4,4,4-trifluorobut-2-ène présentées précédemment entraînent surtout l’obtention de composés trifluorométhylés sans hétéroatomes. Aucune méthode générale n’a été reportée dans la littérature pour la synthèse de composés comportant le groupement trifluorométhylé désiré lié à un atome d’oxygène ou d’azote. Cependant, le groupe de Qing a décrit trois voies de synthèse pour la formation du (E)-(((4,4,4-trifluorobut-2-èn-1-yl)oxy)méthyl)benzène (Schéma 1.6).21 Deux d’entre elles effectuent une réaction de substitution nucléophile du (E)-4,4,4-trifluorobut-2-èn-1-ol sur le bromure de benzyle tandis que la troisième méthode contient une étape de trifluorométhylation d’un bromoalcène.
Schéma 1.6. Synthèse du (E)-(((4,4,4-trifluorobut-2-èn-1-yl)oxy)méthyl)benzène.21
Des composés comportant une chaîne (E)-4,4,4-trifluorobut-2-ène peuvent aussi être obtenus par réaction de substitution nucléophile sur le (E)-4-bromo-1,1,1-trifluorobut-2-ène par un amidure22 ou sur son analogue tosylé par des amines.23-25 Une réaction de
21 Wang, B.-L.; Yu, F.; Qiu, X.-L.; Jiang, Z.-X.; Qing, F.-L. J. Fluorine Chem. 2006, 127, 580-587.
22 Liu, N.; Wang, H.-Y.; Zhang, W.; Jia, Z.-H.; Guzei, I. A.; Xu, H.-D.; Tang, W. Chirality 2013, 25,
805-809.
23
Ates, C.; Lurquin, F.; Quesnel, Y.; Scule, A. 4-Substituted pyrrolidin-2-ones and their uses, WO2007031263, 22 mars 2007.
10
Trost sur le carbonate de (E)-tert-butyl-(4,4,4-trifluorobut-2-èn-1-yle) utilisant des alcools aliphatiques a aussi été reportée précédemment.26 Les produits ainsi formés présentent une activité antifongique. Enfin, une réaction de type Mitsunobu a permis la formation d’un éther de phénol portant la chaîne (E)-4,4,4-trifluorobut-2-ène (Schéma 1.7).27
Schéma 1.7. Réaction de Mitsunobu pour la formation d’un éther de phénol.27
1.2.1.3. Applications
Outre le fameux Prozac (chlorhydrate de fluoxétine), il existe de nombreux médicaments sur le marché contenant un, ou plusieurs, groupement(s) trifluorométhyle.28 Ce substituant se retrouve aussi sur des herbicides ou encore des matériaux (Figure 1.3).29,30 C’est son
24 Lurquin, F.; Driessens, F.; Callaert, M. Process for preparing 2-oxo-1-pyrrolidine derivatives by
intramoleculat allylation, WO2005121082, 22 décembre 2005.
25
Estev o, M. S.; Duarte, F. J. S.; Fernandes, E.; Santos, A. G.; Marques, M. M. B. Tetrahedron Lett. 2012,
53, 2132-2136.
26 (a) Lalonde, R.; Kerrick, J.; Wilmot, J.; Bravo-Altamirano, K.; Lu, Y.; Meyer, K.; Yao, C.; Dekorver, K.;
Li, F.-Z.; O’Callaghan, I. Macrocyclic picolinamides as fungicides, WO2014105817, 3 juillet 2014; (b) Yao, C.; Wilmot, J.; Rigoli, J.; Meyer, K. G.; Loy, B. Use of picolinamide compounds with fungicidal activity, WO2016109303, 7 juillet 2016.
27 Briner, K.; Miller, S. C.; Xu, Y.; Winneroski, L. L. Jr.; Thompson, D. C.; Reinhard, M. R.; Mullaney, J. T.;
Gritton, W. H.; Burkhart, J. P.; Burkholder, T. P.; Cunningham, B. E.; Fisher, M. J. Benzofurylpiperazines and benzofurylhomopiperazines: serotonin antagonists, WO0109111, 8 février 2001.
28 Wang, J.; Sánchez-Roselló, M.; Aceña, J. L.; del Pozo, C.; Sorochinsky, A. E.; Fustero, S.; Soloshonok, V.
A.; Liu, H. Chem. Rev. 2014, 114, 2432-2506.
29
Lim, D. S.; Choi, J. S.; Pak, C. S.; Welch, J. T. J. Pestic. Sci. 2007, 32, 255-259.
30
Zhao, Y.; Schwab, M. G.; Kiersnowski, A.; Pisula, W.; Baumgarten, M.; Chen, L.; Mullen, K.; Li, C. J.
11
efficacité dans ces domaines d’applications variés qui font du substituant trifluorométhyle un groupement si étudié.
Figure 1.3. Exemples de composés trifluorométhylés ayant des applications dans les domaines pharmaceutique,28 agrochimique29 et des matériaux.30
12
1.2.2. Le groupement pentafluorosulfanyle
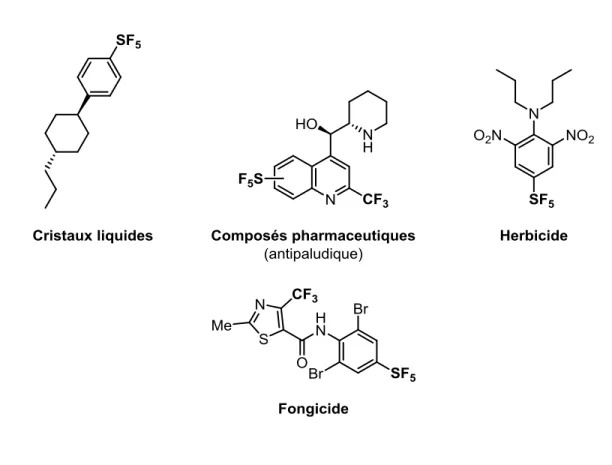
Les composés trifluorométhylés sont trouvés en abondance dans de nombreux domaines de par leurs propriétés remarquables. Cependant, depuis sa découverte, et plus particulièrement ces dernières années, un autre groupe fluoré gagne en popularité : le groupement pentafluorosulfanyle. Ce substituant remplace peu à peu le motif trifluorométhyle dans certains composés d’intérêt dans l’espoir d’en améliorer les propriétés. C’est le cas, par exemple, de l’analogue pentafluorosulfanylé de la fenfluramine qui présente une affinité pour le récepteur sérotoninergique 5-HT6 dix fois supérieure à
celle de la fenfluramine.31 Le remplacement d’un groupement CF3 par un SF5 a aussi été
effectué sur des cristaux liquides.32
La chimie du groupement pentafluorosulfanyle reste, encore à ce jour, peu explorée, et ce malgré l’intérêt grandissant pour ce substituant.33
En effet, depuis sa découverte celui-ci a trouvé des applications dans de nombreux domaines et ces dernières années ont vu apparaître les premiers métaux, superconducteurs, semi-conducteurs et isolants substitués par un SF5. De grandes avancées ont été faites dans la synthèse de dérivés
pentafluorosulfanylés, mais leur utilisation tels quels ou en tant que synthons n’a encore été qu’effleurée.34
31 Welch, J. T.; Lim, D. S. Bioorg. Med. Chem. 2007, 15, 6659-6666. 32
Kirsch, P.; Binder, J. T.; Lork, E.; Röschenthaler, G.-V. J. Fluorine Chem. 2006, 127, 610-619.
33
Savoie, P. R.; Welch, J. T. Chem. Rev. 2015, 115, 1130-1190.
13
1.2.2.1. Propriétés
Le substituant pentafluorosulfanyle est un groupement fluoré avec des propriétés extrêmes, que ce soit en termes de taille, de lipophilie, d’électronégativité etc. (Tableau 1.1).35-37 Il a été nommé le « substituant du futur » et est parfois considéré comme un « super CF3 ».38 Ce
substituant est lipophile et possède un fort moment dipolaire. Le pouvoir attracteur d'un groupement pentafluorosulfanyle (σp = 0,68) est supérieur à celui d'un trifluorométhyle
(σp = 0,53) et s'approche de celui du substituant nitro (σp = 0,78).39 En revanche, l'effet de
résonance du groupement SF5 est légèrement moindre que celui du CF3.40
Tableau 1.1. Table comparative des propriétés des groupements CF3 et SF5.36,37
Propriété R = SF5 R = CF3
Hydrophobie de Hansch (π) 1,23 0,88
Moment dipolaire dans C6H5R (µ) 3,44 D 2,60 D
Caractère électroattracteur (σp) 0,68 0,53
Volume de van der Waals de C6H5R 152,9 Å3 129,0 Å3
Aire transversale 32,6 Å2 29,0 Å2
35 Kirsch, P. The Pentafluorosulfuranyl Group and Related Structures In Modern Fluoroorganic Chemistry:
Synthesis, Reactivity, Applications; Wiley-VCH: Weinheim, 2004; pp 146-156.
36
Matsuzaki, K.; Okuyama, K.; Tokunaga, E.; Saito, N.; Shiro, M.; Shibata, N. Org. Lett. 2015, 17, 3038-3041.
37 Bassetto, M.; Ferla, S.; Pertusati, F. Future Med. Chem. 2015, 7, 527-546. 38
Thayer, A. M. Chem. Eng. News 2006, 84, 27-32.
39
Sheppard, W. A. J. Am. Chem. Soc. 1962, 84, 3072-3076.
14
Au sein du groupement SF5, l'atome de soufre adopte une conformation bipyramidale à
base carrée légèrement déformée (Figure 1.4)41 ce qui fait de lui un substituant possédant une taille intermédiaire entre celle du groupement trifluorométhyle et celle du tert-butyle (Figure 1.5).42 Son volume important peut induire des restrictions de conformation de la chaîne carbonée portant le groupement SF5 : une des nombreuses raisons pour lesquelles ce
groupement suscite un fort intérêt en chimie médicinale.41 De plus, à cause de la géométrie du groupement pentafluorosulfanyle, la barrière de rotation du lien carbone–soufre est inférieure à celle d’un lien carbone–carbone. La flexibilité ainsi induite peut être un atout pour la création d’interactions avec un récepteur.43
Figure 1.4. Conformation du groupement SF5 en série aliphatique.41
41
Savoie, P. R.; Higashiya, S.; Lin, J.-H.; Wagle, D. W.; Welch, J. T. J. Fluorine Chem. 2012, 143, 281-286.
42
Dalvit, C.; Ko, S. Y.; Vulpetti, A. J. Fluorine Chem. 2013, 152, 129-135.
15
Figure 1.5. (a) Comparaison du volume entre un groupement SF5 (en orange) et t-Bu
(en violet). (b) Comparaison du volume entre un groupement SF5 (en orange) et CF3
(en violet).42
Après sa découverte au milieu du vingtième siècle, l'intérêt qu'il suscite s'estompe rapidement en partie à cause de sa difficulté d'obtention et en raison de préjugés infondés quant à sa stabilité. Depuis quelques années, il est de plus en plus étudié en chimie médicinale car son incorporation dans une molécule confère des propriétés uniques à celle-ci.41 Il s'agit d'un groupement stable qui permet de favoriser les interactions hydrophobes avec les protéines.44
L’intérêt général croissant pour le groupement pentafluorosulfanyle s’explique aussi par sa stabilité. En effet, celui-ci est inerte face à de nombreuses transformations, son principal point faible étant sa réactivité envers les dérivés d’alkyllithium.35
Il est remarquablement stable métaboliquement,45 thermiquement ainsi qu’en milieux acide ou basique concentré.46 Cependant, la chimie du groupement SF5 est encore en pleine expansion et peu
44
Dalvit, C.; Vulpetti, A. ChemMedChem, 2011, 6, 104-114.
45
Ilardi, E. A.; Vitaku, E.; Njardarson, J. T. J. Med. Chem. 2014, 57, 2832-2842.
16
d’informations sont disponibles sur la toxicité ou l’impact environnemental des composés pentafluorosulfanylés.47
1.2.2.2. Résonance magnétique nucléaire
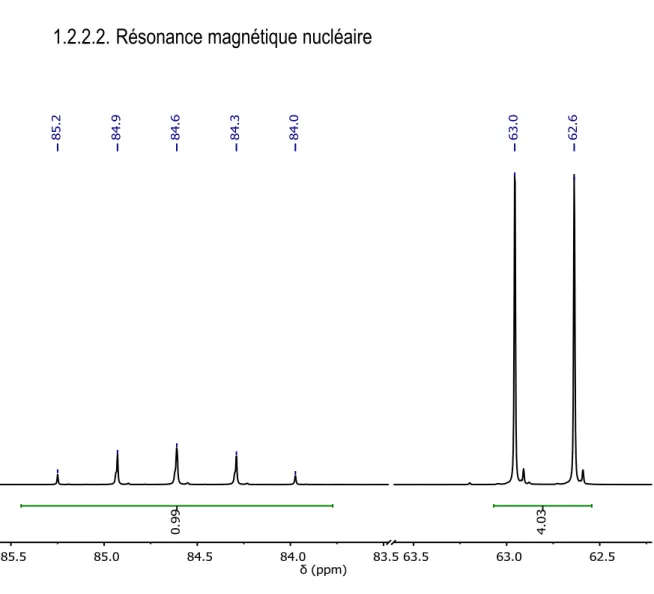
Figure 1.6. Exemple de spectre RMN 19F d’un groupement SF5 aromatique.
En analyse par résonance magnétique nucléaire (RMN) du fluor, les atomes de fluor du groupement pentafluorosulfanyle sont très déblindés. Contrairement au substituant
17
trifluorométhyle et à cause de la géométrie adoptée par l’atome de soufre, tous les atomes de fluor du groupement pentafluorosulfanyle ne sont pas équivalents. Ceux en position équatoriale sortent sous la forme d'un doublet vers +60 ppm tandis que l'atome de fluor en position axiale apparaît sous la forme d'un quintuplet apparent vers +90 ppm (Figure 1.6). La constante de couplage F–F entre les atomes équatoriaux et axiaux est de l’ordre de 140 – 160 Hz.48 En RMN du proton, la présence d'un groupement –SF5 peut entraîner
l'observation de protons diastéréotopiques en γ (non visibles dans le cas du substituant trifluorométhyle).41
1.2.2.3. Applications
Grâce à leurs propriétés uniques, les composés comportant un substituant pentafluorosulfanyle trouvent des applications en tant que, par exemple, polymères,49 herbicides,29 pesticides,50 fongicides,51 composés pharmaceutiques,31,52 cristaux liquides32,53
48 Dolbier, W. R., Compounds and Substituents with Fluoride Directly Bound to a Heteroatom. In Guide to
Fluorine NMR for Organic Chemists, John Wiley & Sons, Inc.: 2008; pp 211-232.
49 Winter, R.; Nixon, P. G.; Gard, G. L., Castner, D. G.; Holcomb, N. R.; Hu, Y.-H.; Grainger, D. W. Chem.
Mater. 1999, 11, 3044-3049.
50 Banks, B. J. Parasiticidal pyrazoles. EP933363, 4 août 1999.
51 Alt, G. H.; Pratt, J. K.; Phillips, W. G.; Srouji, G. H. Substituted thiazoles and their use as fungicides.
EP371950, 6 juin 1990.
52
(a) Wipf, P.; Mo, T.; Geib; S. T.; Caridha, D.; Dow, G. S.; Gerena, L.; Roncal, N.; Milner, E. E. Org.
Biomol. Chem. 2009, 7, 4163-4165; (b) Mo, T.; Mi, X.; Milner, E. E.; Dow, G. S.; Wipf, P. Tetrahedron Lett.
2010, 51, 5137-5140; (c) Chia, P. W.; Brennan, S. C.; Slawin, A. M. Z., Riccardi, D.; O'Hagan, D. Org.
Biomol. Chem. 2012, 10, 7922-7927; (d) Hendriks, C. M. M.; Penning, T. M.; Zang, T.; Wiemuth, D.;
Gründer, S.; Sanhueza, I. A.; Schoenebeck, F.; Bolm, C. Bioorg. Med. Chem. Lett. 2015, 25, 4437-4440; (e) Zhang, Y.; Wang, Y.; He, C.; Liu, X.; Lu, Y.; Chen, T.; Pan, Q.; Xiong, J.; She, M.; Tu, Z.; Qin, X.; Li, M.; Tortorella, M. D.; Talley, J. J. J. Med. Chem. 2017, 60, 4135-4146.
53
(a) Kirsch, P.; Bremer, M.; Heckmeier, M. Tarumi, K. Angew. Chem. Int. Ed. 1999, 38, 1989-1992; (b) Ponomarenko, M. V.; Kalinovich, N.; Serguchev, Y. A.; Bremer, M.; Röschenthaler, G.-V. J. Fluorine Chem.
18
ou encore comme matériaux énergétiques.54 Quelques exemples représentatifs sont illustrés en Figure 1.7.
Figure 1.7. Composés d’intérêt substitués par un groupement pentafluorosulfanyle.
Pour obtenir ces composés pentafluorosulfanylés d'intérêt, il est essentiel de posséder les outils de synthèse nécessaires à l'introduction d'un groupement pentafluorosulfanyle dans une molécule, aussi bien en position aliphatique ou vinylique qu'en position aromatique.
1.2.2.4. Synthèse de composés aliphatiques
54
(a) Martinez, H.; Zheng, Z.; Dolbier Jr., W. R. J. Fluorine Chem. 2012, 143, 112-122; (b) Xiao-Hong, L.; Hong-Ling, C.; Wei-Wei, J.; Tong-Wei, L.; Rui-Zhou, Z.; Yong-Liang, Y. J. Chem. Sci. 2014, 126, 1163-1172.
19
1.2.2.4.1. Origine accidentelle
Le groupement pentafluorosulfanyle a été reporté pour la première fois en 1950 quand le groupe de Cady a tenté de préparer l'hypofluorothioite de trifluorométhyle (CF3SF) à partir
du méthanethiol selon leur méthode pour obtenir l'hypofluorite de trifluorométhyle (CF3OF) par fluoration du méthanol.55 Seulement, lorsqu’ils ont effectué cette
transformation sur le thiol, le produit obtenu n'est pas celui attendu. Une suroxydation de l'atome de soufre a lieu et le trifluorométhylpentafluorure de soufre (CF3SF5) est récupéré
(Schéma 1.8).56
Schéma 1.8. Première synthèse de composés pentaflurorosulfanylés.56
Depuis cette découverte, la préparation de composés aliphatiques pentafluorosulfanylés a beaucoup évolué et la fluoration vigoureuse a été abandonnée au profit d'une méthode plus douce : l'addition radicalaire d'halogénures de pentafluorosulfanyle (SF5X).
1.2.2.4.2. Addition de SF
5X
Les réactifs les plus utilisés pour l'introduction d'un groupement –SF5 dans une molécule
sont le chlorure et le bromure de pentafluorosulfanyle (SF5Cl et SF5Br). Ils réagissent par
55
Kellogg, K. B.; Cady, G. H. J. Am. Chem. Soc. 1948, 70, 3986-3990.
20
addition radicalaire sur une double liaison. Le dimère S2F10 est moins employé, car il est
moins réactif et très toxique.57
SF5Cl, découvert en 1959,58 est stable thermiquement jusqu'à 400 °C sous atmosphère
inerte et ne s'hydrolyse pas en présence d'eau ou d'acides aqueux. Cependant, il se décompose dans des solutions alcalines soumises à un rayonnement ultraviolet. SF5Br,
obtenu pour la première fois en 1965,59 est moins stable thermiquement (sa décomposition commence à 150 °C), mais est plus réactif.60 Le chlorure de pentafluorosulfanyle est le plus utilisé des deux et peut être préparé de manière industrielle à partir du tétrafluorure de soufre (SF4) ou du soufre élémentaire en présence d’une source d’ion fluorures et de chlore
gazeux.61
57 Altomonte, S.; Zanda, M. J. Fluorine Chem. 2012, 143, 57-93. 58 George, J. W.; Cotton, F. A. Proceed. Chem. Soc. 1959, 317-318. 59
Cohen, B.; MacDiarmid, A. G. Inorg. Chem. 1965, 4, 1782-1785.
60
Winter, R.; Gard, G. L. J. Fluorine Chem. 2000, 102, 79-87.
21
Schéma 1.9. Mécanisme de l'addition radicalaire de SF5Cl.62
L'addition de SF5Cl repose sur un mécanisme radicalaire impliquant la formation du radical
SF5•. Ce dernier peut être généré par photo-irradiation ou par chauffage en présence d'un
initiateur radicalaire.57 L'attaque d'un radical sur le chlorure de pentafluorosulfanyle se fait sur l'atome de chlore plutôt que l'atome de soufre à cause de l'effet d'écran des atomes de fluor portés par ce dernier.62 SF5Br et SF5Cl s'additionnent selon le même mécanisme
(Schéma 1.9).63
Dans certains cas, et en particulier pour les alcènes terminaux, les conditions classiques d'addition d’halogénure de pentafluorosulfanyle sur une double liaison ne fonctionnent pas toujours (Schéma 1.10). En effet, SF5Br préfère réagir comme un électrophile face à la
double liaison, en permettant la formation d'un pont bromonium et de l'anion SF5−. Ce
dernier libère un ion fluorure qui vient ouvrir le pont et ainsi former le produit dihalogéné et le tétrafluorure de soufre.64 De nouvelles conditions réactionnelles sont donc nécessaires pour effectuer cette transformation. Celles-ci, développées par Dolbier Jr. et Aït-Mohand en 2002 (Schéma 1.10) consistent en l'ajout d'une quantité catalytique de triéthylborane dans le milieu réactionnel.65
62 Case, J. R.; Ray, N. H.; Roberts, H. L. J. Chem. Soc. 1961, 2066-2070. 63 Berry, A. D.; Fox, W. D. J. Org. Chem. 1978, 43, 365-367.
64
Dolbier Jr.,W. R., Aït-Mohand, S., Schertz, T. D., Sergeeva, T. A.; Cradlebaugh, J. A.; Mitani, A.; Gard, G. L.; Winter, R. W.; Thrasher, J. S. J. Fluorine Chem. 2006, 127, 1302-1310.
22
Schéma 1.10. Intérêt de la présence de triéthylborane.64
Le triéthylborane permet d'initier rapidement, et à basse température, l'addition radicalaire d’un groupement SF5 et d’un atome d’halogène (Schéma 1.11).32,64 En effet, il est
nécessaire de travailler à des températures inférieures à −30 °C pour pouvoir utiliser commodément le réactif gazeux (SF5Cl) en solution à pression atmosphérique.65
23
Contrairement à l'activation par la lumière, l'utilisation de triéthylborane permet d'effectuer l'addition d’halogénures de pentafluorosulfanyle sur des alcènes aliphatiques simples en plus d'améliorer les rendements obtenus et de faciliter les conditions expérimentales.60,66,67
L'ordre d'addition des réactifs semble jouer un rôle important. Il a été remarqué que l'ajout de SF5Br à une solution d'alcène et de triéthylborane donne le produit désiré avec de faibles
rendements et accompagné de produits secondaires. Tandis que l'addition de l'alcène à une solution de SF5Br et de triéthylborane augmente considérablement le rendement et rend le
milieu réactionnel plus propre.66
1.2.2.5. Synthèse de composés vinyliques
1.2.2.5.1. Méthode générale
L'accès aux composés portant un groupement pentafluorosulfanyle en position vinylique peut s'effectuer facilement par addition d'un halogénure de pentafluorosulfanyle sur un alcène puis par déshydrohalogénation en présence d'une base organique66 ou inorganique67 (Schéma 1.12). L'élimination de la molécule de HX ne s'effectue que si les atomes d'hydrogène et d'halogène sont en position antipériplanaire.63
66
Lim, D. S.; Ngo, S. C., Lal, S. G., Minnich, K. E.; Welch, J. T. Tetrahedron Lett. 2008, 49, 5662-5663.
67
Ponomarenko, M. V.; Serguchev, Y. A.; Röschenthaler, G.-V. Synthesis 2010, 3906-3912; Erratum-ibid.
24
Schéma 1.12. Déshydrohalogénation.66,67
1.2.2.5.2. Synthèse du 3-hydroxypropénylpentafluorure de soufre
Le précurseur pentafluorosulfanylé commercial utilisé dans ce manuscrit pour introduire la chaîne 3-(pentafluorosulfanyl)allyle sur divers composés est le 3-hydroxypropénylpentafluorure de soufre. Il est obtenu à partir du 2-propénol en deux étapes : addition de chlorure de pentafluorosulfanyle sur la double liaison puis élimination de chlorure d’hydrogène (Schéma 1.13).68
Schéma 1.13. Synthèse du 3-hydroxypropénylpentafluorure de soufre.68
25
Il est aussi possible de synthétiser cet alcool allylique en effectuant l’addition de chlorure de pentafluorosulfanyle sur l’acétate d’allyle.65
En utilisant une solution d’hydroxyde de sodium dans l’éthanol, l’élimination de chlorure d’hydrogène et la déprotection de l’acétate sont alors réalisables en une seule étape.69
1.2.2.6. Synthèse de composés aromatiques
1.2.2.6.1. Première synthèse
La première synthèse d'un composé pentafluorosulfanylé aromatique a été effectuée par Sheppard en 1960.40 Il a observé que le chauffage du trifluorothiobenzène (Ph-SF3), obtenu
par fluoration du diphényl disulfure à l’aide du fluorure d’argent, en présence du même agent de fluoration permettait l'obtention du pentafluorosulfanylbenzène en faible quantité (Schéma 1.14).
Schéma 1.14. Première synthèse du pentafluorothiobenzène.40
1.2.2.6.2. Fluoration vigoureuse en deux étapes
69
Winter, R.; Nixon, P. G.; Gard, G. L.; Radford, D. H.; Holcomb, N. R.; Grainger, D. W. J. Fluorine Chem.
26
La pentafluoration directe de (Ar–S)2 ou de Ar–SH ne permet, habituellement, l'obtention
des produits désirés qu'avec de faibles rendements,70 excepté lors de l'utilisation d'un microréacteur où les rendements peuvent atteindre 75 %.71
Une amélioration à la pentafluoration a alors été proposée par Umemoto et al.72 Celle-ci implique le passage par un intermédiaire de type chlorotétrafluoroaryle de soufre. Ce dernier est synthétisé à partir du thiol ou du thioéther correspondant en présence de dichlore et de fluorure de potassium (Schéma 1.15).
Schéma 1.15. Synthèse de Ar–SF4Cl.72
Umemoto et al.72 ont développé de nombreuses conditions pour obtenir les pentafluorothioaryles à partir des chlorotétrafluoroaryles de soufre correspondants. Toutes nécessitent une source de fluorures (HF, KHF2, etc.) et permettent l'obtention du composé
pentafluoré avec des rendements allant de 55 à 75 %. Récemment, une nouvelle méthode
70
Kirsch, P.; Hahn, A. Eur. J. Org. Chem. 2005, 3095-3100.
71
Chambers, R. D.; Spink, R. C. H. Chem. Commun. 1999, 883-884.
27
utilisant le bifluorure de potassium a été développée par Lummer et al.73 entraîne l'obtention du pentafluorothiophénol avec un rendement de 82 % (Schéma 1.16).
Schéma 1.16. Synthèse du pentafluorothiophénol.73
1.2.2.6.3. Fluoration par F
2Une méthode alternative a été décrite en 2000 par le groupe de Philp.74 Elle utilise aussi des thiophénols ou leurs disulfures afin d’obtenir les composés pentafluorosulfanylés en une seule étape, mais nécessite l’emploi de difluor à 10 % dans le diazote (Schéma 1.17).
73 Lummer, K.; Ponomarenko, M. V.; Röschenthaler, G.-V.; Bremer, M.; Beier, P., J. Fluorine Chem. 2014,
157, 79-83.
74
Bowden, R. D.; Comina, P. J.; Greenhall, M. P.; Kariuki, B. M.; Loveday, A.; Philp, D. Tetrahedron 2000,
28
Schéma 1.17. Formation des 3- et 4-nitrophénylpentafluorures de soufres.74
1.2.2.6.4. Synthèse des 3- et 4-pentafluorothiobenzaldéhyde
Les précurseurs commerciaux portant un groupement pentafluorosulfanyle en position aromatique utilisés dans les transformations développées au cours de cette thèse de doctorat sont des benzaldéhydes pentafluorosulfanylés. Ils sont obtenus à partir du 3- ou 4-nitrophénylpentafluorure de soufre en trois étapes (Schéma 1.18) : une réduction du groupe nitro par le fer avec de l’acide chlorhydrique, suivie d’une réaction de bromation à l’aide du dibromure de cuivre et du tert-butylnitrite et enfin une formylation par le tert-butyllithium en présence de N-formylpipéridine (NFP).75 Le substrat de cette synthèse porte déjà un groupement pentafluorosulfanyle et peut être obtenu par fluoration du thiol ou disulfure correspondant par chacune des méthodes décrites précédemment.72,74
Schéma 1.18. Synthèse des 3- et 4-pentafluorothiobenzaldéhydes à partir des nitrophénylpentafluorures de soufre correspondants.75
75
Zarantonello, C.; Guerrato, A.; Ugel, E.; Bertani, R.; Benetollo, F.; Milani, R.; Venzo, A.; Zaggia, A. J.
29
1.3. Objectifs de la thèse
Il est clair que le développement de nouvelles méthodes de synthèse de composés trifluorométhylés et pentafluorosulfanylés est nécessaire, en particulier pour ces derniers. Aucune méthode générale pour la formation de molécules comportant un groupement (E)-4,4,4-trifluorobut-2-ène sur un atome d’oxygène, d’azote, de soufre ou sur le carbone en β des malonates ne précédait ces travaux. Tandis que le groupement 3-(pentafluorosulfanyl)allyle était quasiment absent de la littérature.
La fluoration vigoureuse pour la formation d’un groupement pentafluorosulfanyle demande des conditions réactionnelles assez drastiques et peut ne pas convenir à des substrats fortement fonctionnalisés. Dans ce cas, il devient préférable d’effectuer l’insertion d’un groupement plus élaboré qui porte déjà un substituant SF5 appelé « bloc ». Quelques
exemples de cette approche par composantes ont déjà été reportés dans la littérature,34 mais l’étendue des réactions disponibles reste, encore à ce jour, limitée. En effet, les propriétés si particulières du groupement SF5 font que ces blocs ne se comportent pas forcément comme
leurs analogues non pentafluorosulfanylés. C’est pourquoi le développement de nouvelles méthodes d’introduction de groupements aromatiques comportant un substituant pentafluorosulfanyle est nécessaire. La problématique est similaire dans le cas des composés comportant un groupement SF5 en position aliphatique ou vinylique. Bien que les
conditions de réaction pour l’addition d’halogénures de pentafluorosulfanyle soient plus douces que pour la fluoration vigoureuse, la présence de certains groupements n’est pas tolérée. De plus, la manipulation de ces gaz toxiques demande un certain nombre de précautions. Enfin, l’utilisation d’une approche par blocs peut permettre d’insérer une composante contenant un groupement SF5, sur une molécule déjà fortement fonctionnalisée
et présentant, par exemple, des doubles liaisons.
En partant de travaux effectués précédemment dans le laboratoire sur l’activation de liens carbone–fluor benzyliques pour des réactions de substitution nucléophile et d’arylation de