Analyse de la composition corporelle et de la
distribution du tissu adipeux par tomodensitométrie
dans la maladie pulmonaire obstructive chronique
(MPOC)
Mémoire
Mickaël Martin
Maîtrise en kinésiologie
Maître ès sciences (M. Sc.)
Québec, Canada
© Mickaël Martin, 2017
Analyse de la composition corporelle et de la
distribution du tissu adipeux par tomodensitométrie
dans la maladie pulmonaire obstructive chronique
(MPOC)
Mémoire
Mickaël Martin
Sous la direction de :
François Maltais, directeur de recherche
Didier Saey, codirecteur de recherche
RÉSUMÉ
L’obésité est une comorbidité de plus en plus fréquent dans la maladie pulmonaire obstructive chronique (MPOC). À l’instar des autres maladies chroniques, les études épidémiologiques ont mis en évidence que les patients MPOC avec un surpoids ou une obésité vivent plus longtemps que les patients de poids normal. L’objectif de l’étude est donc de d’évaluer l’impact de la composition corporelle mesurée par tomodensitométrie axiale commandée par ordinateur (TACO) sur la fonction pulmonaire, la capacité fonctionnelle et la survenue d’évènements cliniques tels que les exacerbations et la mortalité chez les patients atteints d’une MPOC. Au terme de l’étude, nous avons constaté que, pour un même indice de masse corporelle (IMC), les patients ayant une MPOC ont plus de tissus gras viscéral et sous-cutané, moins de masse musculaire et une plus grande infiltration graisseuse au niveau du muscle que le groupe témoin. Ces altérations de la composition corporelle s’accentuent avec l’augmentation de la sévérité de la maladie. Ainsi, une plus grande quantité de graisse ectopique et un plus faible volume musculaire sont associés à une capacité fonctionnelle plus faible en plus de réduire la qualité de vie.
ABSTRACT
Obesity is a phenomenon increasingly common in COPD. Like in other chronic diseases, epidemiological studies have reported the paradoxical observation that COPD patients with overweight or obesity live longer than normal weight patients. The objective of this study is to measure body composition by using a very precise method, the computer controlled axial tomography (CT-scan), and to assess its impact on lung function, functional capacity and the prevalence of clinical outcomes such as exacerbations and mortality in patients with COPD. At the end of the study, we found that, for a same body mass index (BMI), COPD patients have more visceral and subcutaneous adipose tissue, less muscle mass and a lower muscle attenuation than the control group. These alterations in body composition increase with disease severity. Thus, a greater amount of ectopic fat and lower muscle volume are associated with lower functional capacity and reduce the quality of life.
RÉSUMÉ ... III ABSTRACT ... V LISTE DES TABLEAUX ... X LISTE DES FIGURES ... XII LISTE DES ABRÉVIATIONS ... XIV REMERCIEMENTS ... XVIII AVANT-PROPOS ... XX CHAPITRE 1 : LA MALADIE PULMONAIRE OBSTRUCTIVE CHRONIQUE
(MPOC) ... 1 1.1DÉFINITION ... 1 1.1.1BRONCHITE CHRONIQUE ... 1 1.1.2EMPHYSÈME ... 1 1.2PRÉVALENCE ... 2 1.3MORTALITÉ ... 2 1.4FACTEURS DE RISQUE ... 3 1.5PATHOGENÈSE ... 5 1.5.1DIAGNOSTIC ... 6 1.6PATHOPHYSIOLOGIE ... 9 1.6.1MÉCANISMES DE LA DYSPNÉE ... 9 1.6.2SPIRALE DE DÉCONDITIONNEMENT ... 10 1.6.3FONCTION MUSCULAIRE ... 11 1.6.4TOLÉRANCE À L’EXERCICE ... 12 CHAPITRE 2 : L’OBÉSITÉ ... 15 2.1DÉFINITION ... 15
2.2PRÉVALENCE ET IMPACT SOCIO-ÉCONOMIQUE ... 15
2.3MORTALITÉ ... 16
2.4FACTEURS DE RISQUE ... 17
2.5PATHOGENÈSE ... 18
2.5.1DIAGNOSTIC ... 19
2.5.2AUTRES MÉTHODES DE QUANTIFICATION DE L’OBÉSITÉ ... 20
2.6PATHOPHYSIOLOGIE ... 23
2.6.1COMORBIDITÉ ... 23
CHAPITRE 3 : PARADOXE DE L’OBÉSITÉ DANS LES MALADIES CHRONIQUES ... 25
CHAPITRE 4 : ARTICLE SCIENTIFIQUE ... 29
CHAPITRE 5 : DISCUSSION ... 69
5.1ANALYSE DE LA COMPOSITION CORPORELLE ... 69
5.2CONSÉQUENCES D’UNE COMPOSITION CORPORELLE ALTÉRÉE ... 70
5.3LIMITES DE L’ÉTUDE ... 71
CHAPITRE 6 : PERSPECTIVE ... 73
LISTE DES TABLEAUX
Tableau 1 : Niveau de sévérité de la maladie selon la stratification du Global
Initiative for Chronic Obstructive Lung Disease (GOLD) ... 7 Tableau 2 : Classification du poids en fonction de l’IMC ... 19 Tableau 3 : Densité de différentes matières en unité Hounsfield ... 22
LISTE DES FIGURES
Figure 1: Schématisation des différents volumes et capacités pulmonaires ... 8
Figure 2 : Spirale de déconditionnement dans la MPOC ... 11
Figure 3 : Principe de la balance énergétique ... 17
LISTE DES ABRÉVIATIONS
ATS : American Thoracic Society CRF : Capacité résiduelle fonctionnelle CI : Capacité inspiratoireCPT : Capacité pulmonaire totale CV : Capacité vitale
CVF : Capacité vitale forcée
ERS : European Respiratory Society
FFMI : Fat Free Mass Index ou Indice de masse maigre GOLD : Global Initiative for Chronic Obstructive Lung Disease IMC : Indice de masse corporelle
MCV : Maladie cardiovasculaire
MPOC : Maladie pulmonaire obstructive chronique MT : Muscle tissues ou Tissu musculaire
OMS : Organisation mondiale de la santé
SCAT : Subcutaneus adipose tissues ou Tissu adipeux sous-cutané TACO : Tomodensitométrie axiale contrôlé par ordinateur
TDM6 : Test de marche de 6 minutes
VAT : Visceral adipose tissues ou Tissu adipeux viscéral VEMS : Volume expiratoire maximal en 1 seconde VR : Volume résiduel
VRE : Volume de réserve expiratoire VRI : Volume de réserve inspiratoire
« La plus grande gloire n'est pas de ne jamais tomber, mais de se relever à chaque chute. »
REMERCIEMENTS
L’aboutissement d’un projet de maîtrise est un travail de longue haleine qui nécessite la contribution d’une multitude de personnes. Tant sur le plan professionnel que personnel, j’ai eu la chance d’être appuyé par des gens remarquables qui ont su, chacun à leur façon, m’aider à avancer sur ce parcourt sinueux. Bien qu’au départ mon intention de débuter une maîtrise n’ait été que purement opportuniste, mon directeur François Maltais a su éveiller ma curiosité et mon engouement pour la recherche. À l’aide de son équipe et de ses collaborateurs, comme Didier Saey, j’ai été totalement séduit par l’univers de la maladie pulmonaire.
Par la présente, je tiens donc à remercier mon directeur, pour sa rigueur et la latitude qu’il a su m’accorder. Merci de m’avoir permis de me faire valoir non seulement sur la scène locale, mais aussi internationale. Mes réussites comme mes échecs ont fait de moi quelqu’un de meilleur professionnellement et personnellement. J’en sors grandi et j’espère que j’aurai l’opportunité de continuer à contribuer à l’équipe pour plusieurs années.
J’en profite aussi pour remercier mon codirecteur Didier Saey, pour son sens critique et ses réflexions qui souvent me ramènent à remettre en questions certaines conclusions ou idées préconçues. Par nos débats, parfois philosophiques, j’ai énormément développé mon sens critique et mon esprit d’analyse. J’en garde donc un excellent souvenir et peut-être aurons-nous la chance de collaborer de nouveau pour une étude commune.
conseiller externe et aussi de mentor afin de parfaire mes habiletés techniques et mon jugement clinique.
Finalement, un merci bien spécial à ma copine Mylène avec qui je me marierai bientôt. Bien que ces deux dernières années aient été parfois difficiles, tu as toujours su être présente et à l’écoute dans les moments où j’en avais le plus besoin.
AVANT-PROPOS
L’article inséré dans ce mémoire qui a été soumis pour publication découle d’une idée originale du Dr François Maltais et a été possible grâce à la banque de données élaborée à partir de l’étude observationelle internationale intitulée Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE). Ayant collaboré au projet principal, l’équipe de Dr Maltais a obtenu l’approbation du comité d’éthique du CRIUCPQ pour la conduite de cette sous-étude. Mon rôle en tant qu’étudiant à la maîtrise a été de consolider les banques de données cliniques et de segmenter l’ensemble des images obtenues par tomodensitométrie en collaboration avec l’Imaging Core Lab du Centre de recherche de l’Institut universitaire de cardiologie et de pneumologie de Québec, Université Laval (CRIUCPQ) chapeauté par les Dr Jean-Pierre Desprès et Dre Nathalie Alméras. Par la suite, j’ai agi à titre de coordonnateur et principal rédacteur du présent article avec l’aide de mon directeur Dr François Maltais et co-directeur Dr Didier Saey.
Plusieurs collaborateurs ont contribué à cette étude. Mickaël Martin, Natalie Alméras, Jean-Pierre Després, Harvey O Coxson, George R Washko, Isabelle Vivodtzev, Emiel FM Wouters, Erica Rutten, Michelle Williams, John Murchison, William MacNee, Don D Sin et François Maltais ont contribué à sa conception. Les images furent analysées par Mickaël Martin, Natalie Alméras, Jean-Pierre Després et François Maltais. Le manuscrit a été préparé par Mickaël Martin, Natalie Alméras, Jean-Pierre Després et François Maltais. Tous les co-auteurs ont contribué à la révision du manuscrit. Didier Saey a été impliqué dans la supervision du travail de l’étudiant ainsi que dans les discussions scientifiques qui sous-tendent cette étude.
Chapitre 1 : La maladie pulmonaire obstructive chronique
(MPOC)
1.1 Définition
La maladie pulmonaire obstructive chronique (MPOC) possède plusieurs définitions. En 2004, l’American Thoracic Society et l’European Respiratory Society ont, à partir d’un consensus, établi une définition unique pour cette pathologie. Selon cette définition, la MPOC est une maladie évitable et traitable caractérisée par une limitation des débits expiratoires qui n’est pas complètement réversible suite à l’administration de bronchodilatateurs. Cette diminution des débits expiratoires, principalement induite par la fumée de cigarette, est habituellement progressive et associée à une réponse inflammatoire anormale des poumons aux particules ou gaz nocifs.1 Les deux
principaux phénotypes de la MPOC sont la bronchite chronique et l’emphysème.
1.1.1 Bronchite chronique
La bronchite chronique est caractérisée par une sécrétion accrue de mucus résultant d’une réponse inflammatoire importante au niveau de l’arbre bronchique. Ce mucus réduit le calibre des voies respiratoires contribuant ainsi à la diminution des débits expiratoires.1-3
1.1.2 Emphysème
L’emphysème s’attaque à la structure distale du poumon soit le parenchyme pulmonaire. Le parenchyme pulmonaire est le tissu qui assure les échanges gazeux pulmonaire. En plus de limiter la capacité du poumon à assurer le échanges gazeux, l’altération des structures du parenchyme pulmonaire contribue à diminuer le recul élastique des alvéoles qui ont alors tendance à
se perdre leur capacité de se vider, ce qui peut occasionner un emprisonnement de l’air appelé hyperinflation ou «rétention gazeuse».1-3
1.2 Prévalence
La MPOC est une maladie du poumon qui est chronique, dégénérative et invalidante. Sa prévalence mondiale estimée se situe autour de 9-10% des adultes âgés de plus de 40 ans.4 Au Canada, on dénombrait 329 500
hommes (4,4%) et 425 300 femmes (4,8%) vivant avec un diagnostic de MPOC en 2005.5 Il faut toutefois rester critique face à ces données puisque
selon certains auteurs, seulement 20-50% des patients atteints d’une MPOC seraient diagnostiqués.6,7
En plus d’avoir un impact considérable sur la qualité de vie des patients, cette maladie est très couteuse pour les systèmes de santé8 puisqu’elle est une
des causes principales d’hospitalisation et qu’elle s’accompagne de plusieurs comorbidités.9 Selon un rapport publié en 2007 par l’agence de santé du
Canada, les maladies pulmonaires (en excluant le cancer du poumon) représentent à elles seules 6,5% des coûts liés aux soins de santé. De façon plus concrète, cela représente 5,70 milliards de dollars en coûts directs; c’est-à-dire les soins immédiats et la prise en charge du patient. À ceci s’ajouterait un montant supplémentaire de 6,72 milliards de dollars pour des coûts indirects liés à l'invalidité et à la mortalité.5 En ce sens, il devient important de
mieux comprendre l’évolution de cette pathologie complexe afin d’en ralentir la progression et de prévenir l’apparition de comorbidités augmentant le fardeau personnel et sociétal de cette maladie.
maladies non transmissibles confondues, la MPOC était la 4e cause de
décès mondial en 2000 et les prédictions laisse à croire qu’elle occupera la 3e place d’ici 2020.10 Bien que par le passé cette maladie semblait plus
mortelle chez les hommes que chez les femmes, aujourd’hui l’écart s’amenuise et on observe une diminution de la mortalité chez les hommes et une augmentation chez les femmes. Au Canada, 4,6% des décès en 2009 sont directement attribuables aux maladies chroniques des voies respiratoires inférieures dont la MPOC.11 Malgré l’amélioration de la prise en
charge du patient12 et des traitements pharmacologiques plus efficaces mais
qui se sont surtout concentrés sur la préservation de la fonction pulmonaire et la réduction du taux d’exacerbation, la mortalité dans la MPOC ne semble que faiblement améliorée.9 Ce faible taux de réussite pourrait être attribuable
au fait que la MPOC est un facteur de risque important pour plusieurs autres pathologies. Tel que démontré par l’étude TORCH,13 celle-ci est associée à
un nombre accru de comorbidité comme les maladies cardiovasculaires et le cancer qui sont des causes de décès très fréquentes dans cette maladie.
1.4 Facteurs de risque
Les facteurs de risque de la MPOC sont considérés, pour la plupart, comme étant modifiables. Le tabagisme est le facteur étiologique le plus prédominant en étant le principal précurseur de 80-90% des cas.14
Dans les pays en voie de développement, le nombre d’utilisateurs des produits du tabac est en croissance et dépasserait même celui des pays industrialisés où la prévalence diminue graduellement15 Afin de quantifier
l’histoire tabagique d’un fumeur, le paquet-année est l’unité de mesure la plus couramment utilisée. Cette valeur est obtenue en multipliant le nombre
un paquet.16 À partir de ce calcul, il est possible d’estimer l’exposition globale
d’un individu à la fumée de cigarette. Étant bien établi dans la littérature qu’il existe un lien « dose-réponse » entre l’exposition au tabac et la MPOC,17,18
toutes mesures facilitant l’arrêt tabagique permettraient d’éviter l’apparition et la progression de la maladie.1,7,17,19 À ce propos, l’Organisation mondiale de
la santé (OMS) prévoit que le nombre total de décès attribuables à la MPOC pourrait augmenter de plus de 30% dans les 10 prochaines années si aucune mesure n’est prise pour réduire les facteurs de risque, notamment le tabagisme.20
Au Canada, plusieurs stratégies dissuasives ont été mises en place depuis la fin des années ’60. Au cours de ces 50 années de lutte contre le tabagisme, la prévalence de fumeurs est passée de 35% en 1985 à 16% en 2012.21
Toutefois, malgré une réduction de l’exposition au principal facteur de risque, la prévalence de la maladie ne semble pas suivre cette tendance. En fait, étant une maladie à développement tardif, les projections laissent à croire que l’âge moyen de la population qui ne cesse d’augmente serait le principal déterminant de l’évolution de la prévalence à court et moyen terme.18 En ce
sens, il faudra attendre quelques décennies avant de constater un impact réel de la lutte au tabagisme sur la prévalence de la MPOC.
Outre le tabac, d’autres facteurs prédisposant au développement de la maladie ont été identifiés et viennent combler les 10-20% des cas restants. L’exposition aux gaz toxiques tels que la fumée secondaire, la pollution urbaine et les produits industriels en sont des exemples17 Certaines
altérations génétiques plus rares, comme un déficit en alpha1-antitrypsine17,22,23 dans 1 à 3% des cas peuvent aussi expliquer la survenue
1.5 Pathogenèse
La MPOC résulte d’une interaction complexe entre des facteurs intrinsèques, propres à l’individu (susceptibilité génétique), et des facteurs extrinsèques, liés à des expositions environnementales telles que l’inhalation de substances toxiques comme le tabac.17 Ces interactions entrainent un dérèglement des réactions inflammatoires et c’est cette accentuation de la production de cellules inflammatoires qui serait à l’origine du début de la maladie. Un premier mécanisme impliqué dans la pathogénèse est celui de l’obstruction des voies aériennes. Par leurs travaux Di Stefano et al.24 ont
démontré que le tissu bronchique des patients atteints de MPOC présente une infiltration accrue d’un grand nombre de cellules inflammatoires (p. ex. : neutrophiles et lymphocytes) qui sont responsables de la libération d’une multitude de médiateurs pro-inflammatoires (IL4, IL5, IL6, IL8, TNF-α). Ces anomalies sont à l’origine des dommages structuraux bronchique ainsi qu’a une hypersécrétion de mucus qui sont responsables de l’obstruction bronchique et de la diminution du débit expiratoire.25
Un autre mécanisme impliqué dans la pathogénése de la maladie est celui du dérèglement de la balance protéase-antiprotéase. Les protéases sont des molécules responsables de la dégradation de certains tissus tels que le tissu conjonctif pulmonaire qui assure la fonction du recul élastique des sacs alvéolaires. Une augmentation de la sécrétion de protéase non compensée par la sécrétion d’antiprotéase, des inhibiteurs de la dégradation des protéines, entraîne une dégradation du tissu élastique, appelé élastine, contenu dans le parenchyme pulmonaire. Ce mécanisme serait à l’origine du développement de la composante emphysémateuse de la MPOC.25
1.5.1 Diagnostic
Selon l’American Thoracic Society (ATS) et l’European Respiratory Society (ERS) le diagnostic de la MPOC devrait être considéré chez tout patient présentant des symptômes tels que toux, sécrétion bronchique, essoufflement (dyspnée) et/ou un historique d’exposition aux facteurs de risque (p. ex. : tabac, pollution, etc.).1 Le diagnostic doit être confirmé de façon objective à l’aide d’un test de spirométrie pré et post inhalation d’un bronchodilatateur. Si le ratio volume expiratoire maximal en 1 seconde (VEMS) / capacité vitale forcée (CVF), plus communément appelé coefficient de Tiffeneau, est inférieur à 0,7, ceci confirme une obstruction non complètement réversible des voies aériennes.26 Dans l’éventualité d’une
réversibilité complète ou partielle, un diagnostique d’asthme doit être considéré.
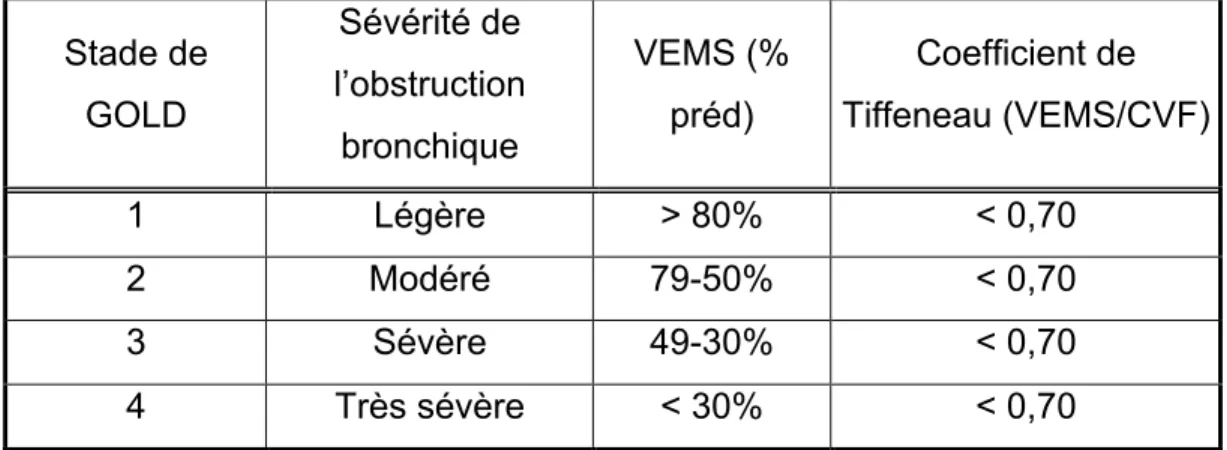
En tenant compte du pourcentage de la prédite atteinte au niveau du VEMS, il est possible de déterminer le niveau de sévérité (voir Tableau 1) de l’obstruction bronchique à l’aide de la classification du Global Initiative for Chronic Obstructive Lung Disease (GOLD).10
Tableau 1 : Niveau de sévérité de l’obstruction bronchique selon la stratification du Global Initiative for Chronic Obstructive Lung Disease (GOLD) Stade de GOLD Sévérité de l’obstruction bronchique VEMS (% préd) Coefficient de Tiffeneau (VEMS/CVF) 1 Légère > 80% < 0,70 2 Modéré 79-50% < 0,70 3 Sévère 49-30% < 0,70 4 Très sévère < 30% < 0,70
Bien que le VEMS soit la mesure diagnostique étalon, elle évalue principalement la composante obstructive de la maladie. Ainsi, il est nécessaire de quantifier les autres volumes pulmonaires notamment le volume résiduel (VR), volume non mobilisable ne participant pas aux échanges gazeux, afin de déterminer l’importance de la rétention gazeuse, souvent associée à la composante emphysémateuse de la MPOC (voir figure 1). Plusieurs méthodes permettent de mesurer ce volume, la plus rependue due à son faible coût et sa rapidité d’administration étant la pléthysmographie.27 À l’aide de calculs tenant comptent des variations de
pressions et de volumes dans un espace confiné à volume et pression connus, il est possible de déterminer la capacité résiduelle fonctionnelle (CRF). À partir de cette CRF et de la mesure de la capacité vitale (CV), le volume total mobilisé lors d’une inspiration maximale suivant une expiration maximale, il est possible de déduire les autres volumes pulmonaires comme le VR, soit l’air restant dans le poumon même après une expiration complète
(voir figure 1). Plus le VR est élevé, plus importante est la dilatation des alvéoles donc plus l’emphysème est avancé.
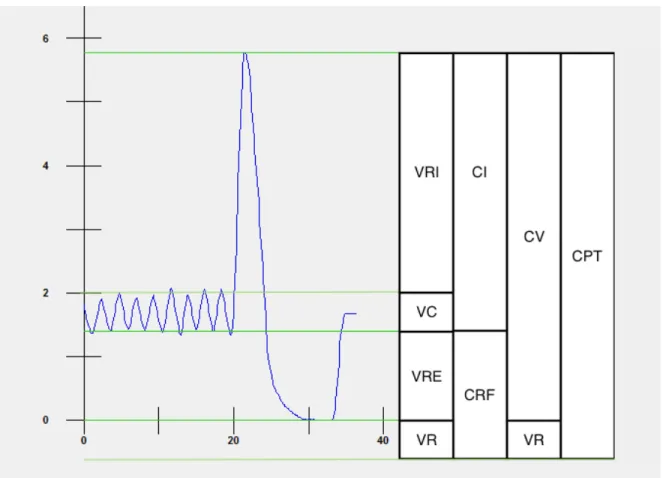
Figure 1: Schématisation des différents volumes et capacités pulmonaires
Définition des abréviations : VRI = volume de réserve inspiratoire, VC = volume courant, VRE = volume de réserve expiratoire, VR = volume résiduel, CI = capacité inspiratoire, CRF = capacité résiduelle fonctionnelle, CV = capacité vitale et CPT = capacité pulmonaire totale.
En plus de la quantification des volumes, il est possible de confirmer le degré de sévérité d’emphysème par imagerie médicale. La tomodensitométrie axiale commandée par ordinateur, plus communément appelé TACO ou Scan, permet de visualiser les régions atteintes d’emphysème.28,29 Toutefois,
couteux n’est pas nécessairement prescrit de façon routinière chez tous les patients MPOC.
1.6 Pathophysiologie
Il est plutôt rare qu’une personne soit 100% emphysémateuse ou 100% bronchite chronique. Chacune des composantes sont présentes avec un certain degré de sévérité.2 La plupart du temps, la réduction du calibre des
bronches est le résultat d’une combinaison variable d’accumulation de mucus et/ou de destruction du parenchyme pulmonaire qui, en diminuant le recul élastique et en favorisant la fermeture précoce des bronches, retarde l’expiration occasionnant ainsi l’hyperinflation pulmonaire par une augmentation des volumes pulmonaires. Cette hyperinflation présente au repos (hyperinflation statique) chez certains patients s’aggrave à l’effort (hyperinflation dynamique) et contribue de façon importante à l’essoufflement des patients ayant une MPOC.
1.6.1 Mécanismes de la dyspnée
La réduction du VEMS marquant la limitation du patients à générer des débits expiratoires limite l’aptitude à bien expulser l’air des poumons, notamment des voies distales. Cette incapacité à vider complètement l’air contenu dans les poumons qui peut déjà être présente au repos (hyperinflation statique) peut s’amplifier à l’effort physique lorsque le rythme respiratoire s’accélère et le temps expiratoire diminue, causant ainsi un phénomène appelé hyperinflation dynamique.30-32 Ainsi, plus la respiration s’accélère, moins la
ventilation est efficace et plus il devient difficile d’expulser l’air riche en dioxyde de carbone (CO2)et d’y faire entrer l’air riche en oxygène (O2). Étant
un puissant stimulateur de la ventilation, l’augmentation de la concentration en CO2 au niveau sanguin accélère la ventilation qui perd de plus en plus de
induite par l’inefficacité de la ventilation.33,34 Il a été démontré que cette
accumulation de CO2 est fortement lié à la «soif d’air» c’est-à-dire que le
patient perçoit son essoufflement comme besoin d’air.35
Une autre altération responsable de la perception accrue d’essoufflement est le repositionnement du diaphragme induit par l’hyperinflation pulmonaire qui modifie la mécanique respiratoire. Étant incapable de reprendre sa position initiale à la fin de l’expiration, le muscle diaphragmatique perd sa forme concave qui lui confère une plus grande force et excursion lors de sa contraction entrainant l’inspiration.36 L’efficacité et la compliance pulmonaire
se retrouvent alors diminuées et le cout énergétique lié à la respiration est de beaucoup augmenté.31 À un effort donné, cette inaptitude des muscles respiratoires à combler la demande ventilatoire fait en sorte que les centres respiratoires doivent augmenter la commande neurale pour augmenter la ventilation qui perd de plus en plus de son efficacité. Cette inadéquation entre la commande respiratoire et la réponse musculaire est appelée découplage neuromusculaire. L’augmentation du travail respiratoire alors perçu comme une incapacité à inspirer suffisamment est un autre aspect de la dyspnée dans la MPOC.37
1.6.2 Spirale de déconditionnement
Bien évidemment, cet essoufflement qui est de plus en plus présent avec l’augmentation de la sévérité de la maladie limite la capacité des patients à faire de l’exercice et même leur capacité à réaliser leurs activités de la vie quotidienne (AVQ) et domestique (AVD). Cet limitation ventilatoire contribue à l’adoption d’un mode de vie plus sédentaire et à leur déconditionnement.38
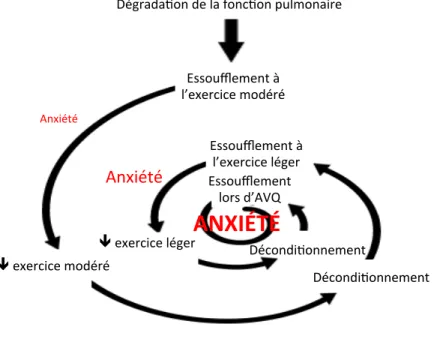
Casaburi et al. ont été les premiers à bien imager ce cercle vicieux qualifié de spirale de déconditionnement39 (voir figure 2) qui affecte les patients atteints
maladie, mais aussi à la durée de celle-ci. Même si les traitements pharmacologiques actuels améliorent la symptomatologie et réduisent les exacerbations, le fait de vivre longtemps avec cette maladie affecte considérablement la capacité fonctionnelle du patient.
Figure 2 : Spirale de déconditionnement dans la MPOC
1.6.3 Fonction musculaire
Outre l’effet du déconditionnement induit par la sédentarité, l’inflammation systémique, l’hypoxie chronique, la malnutrition, l’usage de corticostéroïde et la récurrence des exacerbations découlant de la pathologie elle-même affectent de façon significative la fonction musculaire du patient.40 La MPOC
est associée à une réduction de la masse musculaire, appelée atrophie, qui contribue à la diminution de la tolérance à l’exercice et de la qualité de vie de
AVQ$=$Ac'vité$de$la$vie$quo'dienne$ Dégrada'on$de$la$fonc'on$pulmonaire$ Essoufflement$à$ l’exercice$modéré$ Anxiété$ !$exercice$modéré$ Décondi'onnement$ Essoufflement$à$ l’exercice$léger$
!$exercice$léger$
ANXIÉTÉ'
Décondi'onnement$ Essoufflement$lors$d’AVQ$ Anxiété$
Adapté$de:$Casaburi$R,$PeFy$TL,$eds.$Principles*and*Prac-ce*of*Pulmonary*Rehabilita-on.$Philadelphia,$Pa;$Sanders;$1993$
35% des patients.40 Une des mesures permettant d’estimer le volume
musculaire est l’indice de masse maigre ou «Fat Free Mass Index» (FFMI) qui représente le ratio de masse maigre total en kilos divisés par la taille en mètre au carré (kg/m2). Indépendamment de l’indice de masse corporelle
(IMC), le FFMI est un fort prédicteur de la mortalité dans la MPOC.44
En plus des changements observés au niveau du volume musculaire, des altérations de la composition du tissu lui-même est généralement documenté chez ces patients.45 Les types de fibres contenues dans le tissu musculaire
changent, passant du type I, fibre à grande capacité aérobie et grande tolérance à la fatigue, au type IIx, fibre à très faible capacité aérobie et plus grande fatigabilité.46,47 Ce phénomène s’opère à l’inverse du processus de vieillissement naturel qui habituellement accroit la proportion de fibre de type I.48 En ce sens, du point de vue cellulaire, le muscle, devenant plus
dépendant de ses filières glycolytiques perd de son efficacité métabolique à utiliser l’oxygène ce qui accroit sa production de métabolites (CO2, H+, etc.)
stimulant d’autant plus l’augmentation de la ventilation et la sensation d’essoufflement.49,50 En plus, d’une plus grande présence de métabolite, la
signalisation entre le muscle et le système nerveux central par les afférences musculaires sont également altérées dans la MPOC. Gagnon et al.51 ont
observé qu’en bloquant le signal de retour au cerveau, les patients atteints d’une maladie pulmonaire percevaient moins d’essoufflement et était en mesure d’effectué des efforts de plus longue durée malgré la présence d’une concentration similaire de CO2.
1.6.4 Tolérance à l’exercice
L’ensemble de ces dysfonctions tant musculaire que ventilatoire associées aux phénomènes de déconditionnement et de dyspnée font en sorte que la
En ce sens, la mesure de la tolérance à l’effort doit faire partie de l’évaluation de base du patient au même titre que la mesure des fonctions pulmonaires afin de bien identifier le niveau de sévérité de la maladie. Le «Global Initiative for Chronic Obstructive Lung Disease (GOLD)» tient maintenant compte de la symptomatologie des patients lors de la stratification de la sévérité de la maladie.10
Bien que stratification GOLD se serve de questionnaires pour mesurer la tolérance à l’exercice, il existe une multitude de tests d’effort permettant de quantifier la capacité fonctionnelle dans la MPOC. Le plus rependu est le test de marche de 6 minutes (TDM6), un test qui consiste à mesure la distance maximale parcourue par un individu en 6 minutes.52 Ce test validé et accepté par l’ATS et l’ERS est utilisé afin de 1) évaluer l’effet pré/post traitement53 2)
évaluer la capacité fonctionnelle du patient54 et 3) prédire la morbidité et
mortalité ainsi que la survenue d’évènements cliniques indésirables tels que les exacerbations. De ce fait, il existe plusieurs valeurs de référence ou valeurs critiques dépendamment de l’évènement clinique que l’on désire prédire à partir de ce test. De façon générale, une distance de marche inférieure à 350m correspond à une faible capacité à l’effort qui indique un risque plus élevé d’hospitalisation, d’exacerbation et de décès.55 De plus,
bien qu’il n’y ait pas de consensus quant à la valeur précise, il existe une variation minimale de la distance de marche qui permet de suggérer une différence du statut clinique du patient pré/post intervention. Plus communément appelé MCID pour « minimal clinically important difference », celle-ci tourne autour d’une trentaine de mètres en ce qui à trait aux risques d’hospitalisation et de décès.56 Ainsi, un patient qui améliore sa distance de
marche de 30 mètres sur 6 minutes réduit sont risque de complication de son état de santé de façon significative tandis qu’un patient qui réduit sa distance de marche trouve son risque augmenté.
Comme mentionnés précédemment et démontrés par Spruit et al., les facteurs déterminants d’un faible résultat au test de marches sont à la fois propres à l’appareil pulmonaire et aussi externes à celui-ci.57 Ainsi, il devient
important de considérer la MPOC comme une pathologie de l’organisme en entier et non seulement comme l’atteinte d’un seul organe.58 C’est pourquoi, iI est donc nécessaire d’évaluer le patient sous plusieurs aspects avec des outils de mesure validés et standardisés afin de dresser un portrait clinique le plus précis qui soit. Notamment en ce qui à trait à la composition corporelle. L’obésité, de plus en plus présente dans la MPOC, augmente la quantité de travail nécessaire afin d’effectuer les tâches de la vie quotidienne. Ainsi, l’ensemble des activités sans aide au support du poids corporel tel que la marche, l’ascension d’escalier et les soins corporelles exigent une plus grande quantité d’oxygène donc une augmentation de la ventilation.59
L’obésité devient alors contributoire au phénomène de déconditionnement dans la MPOC puisqu’elle entraine une limitation de la capacité fonctionnelle du patient.
Chapitre 2 : L’obésité
2.1 Définition
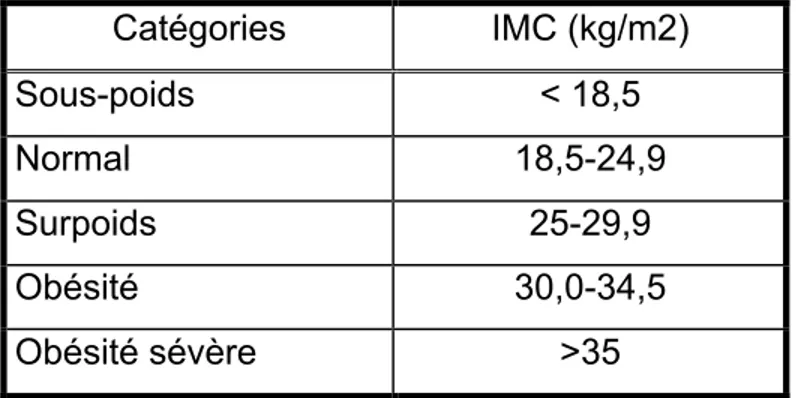
À travers l’histoire, le surpoids et l’obésité a été définie de plusieurs façons. L’Organisation mondiale de la santé définit, aujourd’hui, le surpoids et l’obésité comme étant une accumulation excessive ou anormale de gras pouvant porter atteinte à la santé de l’individu.60 La distinction entre le surpoids et l’obésité est déterminée par l’indice de masse corporelle (IMC).61 Cet indice est obtenu à partir du calcul du ratio du poids en kilogramme (kg) par rapport à la taille en mètre (m) élevé au carré (IMC = poids/taille2,
kg/m2).62 Selon les lignes directrices actuellement en vigueur au Canada, une
personne possédant un IMC ≥25 kg/m2 mais <30 kg/m2 présente un surpoids
tandis qu’une personne ayant un IMC ≥30 kg/m2 est considérée comme
obèse.61 Bien que cette mesure soit facilement accessible pour des analyses
épidémiologiques, elle comporte plusieurs limites dont il sera question plus tard.
2.2 Prévalence et impact socio-économique
La prévalence de l’obésité ne cesse d’augmenter dans les pays industrialisés et est un phénomène émergeant dans les pays en voie de développement. Selon les dernières estimations, 39% de la population mondiale âgée de plus de 18 ans présentait un surpoids alors que 13% étaient considéré comme obèse.61 Depuis 1980, la prévalence de l’obésité à l’échelle planétaire a
quasiment doublée, ce qui correspond à près d’un demi-milliard d’être humain aux prises avec cette problématique.61
Bien évidemment, certaines régions du monde possèdent une prévalence beaucoup plus élevée de l’obésité que d’autres. C’est en Amérique du Nord
l’obésité en 2014.61 Le Canada n’échappe pas à cette épidémie mondiale
d’obésité qui sévit en se situant légèrement sous les États-Unis, mais tout de même autour de cette moyenne.63,64
Étant un catalyseur pour plusieurs autres maladies appelées comorbidités, l’obésité est très couteuse en ce qui a trait aux soins de santé. D’après le dernier rapport émis par statistique Canada en 2011,64 les coûts de santé
directs imputés à la prise en charge de l’obésité et des complications qui y sont reliés sont estimés à presque 2 milliards de dollars. À ceux-ci s’ajoutent les coûts indirects dus à la perte de productivité et l’invalidité et qui sont évaluées à 2,6 milliards de dollars. Dépendamment, du type d’analyse effectué et du nombre de comorbidités prises en compte, le coût total combiné varie donc entre 4,6 et 7,1 milliards de dollars annuellement.64
2.3 Mortalité
Il est très difficile d’évaluer la mortalité attribuable à l’obésité puisque les gens ne décèdent pas directement de l’obésité, mais plutôt des comorbidités associées. Ainsi, lors du calcul du taux de mortalité, il faut tenir compte de plusieurs causes de décès ainsi que des autres variables confondantes65 En
utilisant le risque relatif de mortalité et la prévalence de l’obésité selon les années, Katzmarzyk et Ardern ont évalué qu’au Canada, le taux de décès par 100 000 habitants serait passé de 2 514 en 1985 à 4 321 en 2000, ayant presque doublé en 15 ans.66
Malgré l’avancement des connaissances et les stratégies misent en place afin de réduire et d’endiguer l’épidémie d’obésité, ce phénomène poursuit sa croissance tant au niveau national que mondial.61,67,68
2.4 Facteurs de risque
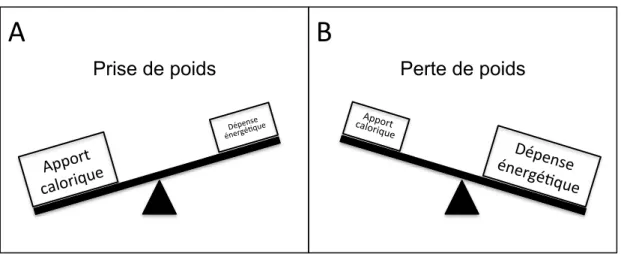
La variation du poids est un phénomène naturel d’adaptation de l’organisme résultant d’un déséquilibre entre l’apport calorique et la dépense énergétique. Lorsque l’apport en calorie est plus élevé que ce que l’organisme arrive à consommer, le surplus énergétique est essentiellement stocké sous diverse forme notamment en graisse afin de permettre une utilisation ultérieure (Figure 3-A). À l’inverse, lorsque la dépense énergétique est plus élevée que l’apport, l’organisme puise dans ses réserves afin d’assurer sa survie (Figure 3-B). La capacité à emmagasiner l’énergie est donc la résultante d’un mécanisme adaptatif permettant la survie.
Figure 3 : Principe de la balance énergétique
Le déséquilibre de la balance énergétique au profit de l’apport calorique est un élément clé de l’embonpoint et de l’obésité. Les facteurs de risque menant à l’obésité favorisent l’entreposage de l’excédant énergétique et/ou limitant la dépense énergétique. Parmi ceux-ci, on retrouve l’inactivité physique, l’âge, l’état émotionnel, le bagage génétique et l’histoire familiale, le tabagisme, l’état de santé, le manque de sommeil, la grossesse ainsi que certains
Apport calorique Apport calorique Dépense énergé3que Dépense énergé3 que
A
B
Les comités d’expert s’entendent pour dire que la meilleure façon d’intervenir afin de diminuer l’incidence de l’obésité et son l’impact sur la santé passe par la modification des habitudes de vie.67,70 Par une approche multidisciplinaire,
les différents intervenants doivent œuvrer de concert afin de favoriser un mode de vie plus actif et une alimentation équilibrée à teneur calorique plus faible. Dans certains cas, les approches pharmaceutiques et chirurgicales doivent aussi être considérées chez les patients présentant des comorbidités.67,70
2.5 Pathogenèse
Comme pour la MPOC, l’obésité résulte d’une interaction complexe entre la prédisposition de l’individu et son environnement.67,69 La définition de
l’obésité au sens large tel que statué par l’OMS ne tient cependant pas compte des différentes manifestations de l’obésité aussi appelées phénotypes. Dépendamment de la localisation de l’accumulation du tissu gras chez un individu, les conséquences sur l’organisme peuvent être plus ou moins néfastes.
Durant, plusieurs années, le tissu adipeux a été considéré comme un tissu métaboliquement neutre, c’est-à-dire, non contributoire et peu sensible à la sécrétion de régulateur au sein de l’organisme.71 Aujourd’hui, nous savons
que certains tissus adipeux sont plus actifs que d’autres. Par exemple, la graisse brune possède une capacité thermogénique impressionnante qui permet de maintenir l’homéostasie est bénéfique pour la santé.72 À l’inverse,
le tissu adipeux viscéral, principalement situé au niveau de l’abdomen, contribue significativement aux maladies cardiovasculaires et métaboliques
2.5.1 Diagnostic
Le critère diagnostique utilisé afin de déterminer la présence d’obésité s’est modifié avec l’avancement des connaissances. Passant d’un simple calcul de déviation par rapport à la moyenne/médiane d’un groupe de référence à des mesures plus complexe comme les plis cutanés, ou de l’IMC, ces mesures ont toujours postulé une répartition et composition uniforme du poids total faisant fi des différents types de tissu le composant (p. ex. masse musculaire, masse grasse, masse hydrique, masse osseuse, etc.) et de leur localisation.
Malgré que l’IMC soit toujours utilisé aujourd’hui dans les études épidémiologiques pour sa simplicité et son accessibilité, il est maintenant reconnu qu’il faut être prudent avec son interprétation. Il est maintenant établi que l’IMC ne suffit pas à lui seul à établir une évaluation précise du niveau de risque et du pronostic associés à l’obésité.74 Malgré tout, les lignes directrices
établies61 conservent l’IMC comme seul critère diagnostique et stratifient le
dégrée de sévérité des modifications du poids selon l’échelle présentée dans le tableau 2.
Tableau 2 : Classification du poids en fonction de l’IMC
Catégories IMC (kg/m2) Sous-poids < 18,5 Normal 18,5-24,9 Surpoids 25-29,9 Obésité 30,0-34,5 Obésité sévère >35
2.5.2 Autres méthodes de quantification de l’obésité
Le tour de taille et ratio taille/hanche
Le tour de taille est une mesure qui permet d’évaluer rapidement s’il y a accumulation de graisse au niveau de l’abdomen. Combiné à la mesure de l’IMC, le tour de taille apporte une précision supplémentaire quant à l’estimation du risque de la maladie cardiovasculaire relié à l’obésité.75 Bien
que son utilisation dans la pratique clinique soit relativement récente, les premières études faisant état de l’importance de la localisation graisse remontent à près de 60 ans. Jean Vague est l’un des premiers chercheurs à avoir publié des résultats sur les différents types d’obésité. Vulgarisé sous les termes «forme pomme» et «forme poire», il en est arrivé à la conclusion que les personnes ayant une obésité abdominale (forme pomme ou androïde) présentent un profile métabolique perturbé avec une prévalence accrue d’athérosclérose précoce et de diabète, lorsque comparée aux individus ayant une obésité localisée aux pourtour des hanches (forme poire ou gynoïde).76 Au même moment, Morris et al. publiaient un article mettant en
relation le tour de taille des pantalons et le niveau de sédentarité de travailleurs, en fonction du type d’emploi qu’ils occupaient.77 Dans leur
discussion, les auteurs émettaient l’hypothèse qu’il existait une relation entre la taille des pantalons et le risque de décès par maladie cardiovasculaire qui fût par la suite confirmé. Depuis, même si la mesure s’est quelque peu diversifiée avec certaines variantes, celle-ci demeure un moyen rapide et peu couteux d’évaluer la présence d’obésité abdominale.78 Cependant, malgré
ces avantages cliniques évidents, cette mesure ne permet pas d’estimer la quantité totale de tissus adipeux n’y sa nature.
L’impédancemètrie ou bio-impédance
Il existe une multitude d’appareils permettant d’estimer le pourcentage de tissu graisseux par la mesure de la conductance électrique.79 Bien que les
formules d’estimation diffèrent d’un instrument à un autre, le principe de la mesure reste sensiblement le même. L’appareil décompose le poids en deux compartiments soit la masse grasse à faible conductivité électrique et la masse maigre à grande conductivité électrique. En faisant circuler des signaux électriques à différentes fréquences, l’appareil calcule la résistance au signal et à l’aide de formule estime le pourcentage de masse grasse totale.80 Bien que ce type d’équipement soit légèrement plus couteux
comparativement aux plis cutanées et au tour de taille, la mesure de la composition corporelle par bio-impédance demeure rapide (temps requis < 1 minute), relativement précise,81 malgré plusieurs limitations, et permet aussi une mesure de la masse maigre totale. Même si certains modèles plus récents permettent d’évaluer la répartition de la masse maigre, les appareils disponibles actuellement ne permettent pas d’évaluer la localisation ou répartition du tissu gras.78
L’imagerie par résonnance magnétique (IRM)
La résonnance magnétique permet d’étudier la répartition des tissus en 2D et la composition corporelle par reconstruction 3D à l’aide du spectre de résonnance des différents tissus. Les principaux avantages de cette méthode résident en sa très haute précision82 sa capacité de mesurer la quantité et la
répartition des différents tissus en ne produisant pas de radiations ionisantes. De plus, la capacité de l’IRM, d’objectiver les dommages induits aux différents organes et aux systèmes vasculaires en fait une des méthodes les plus complètes et polyvalente pour étudier la composition corporelle.83 D’un
autre côté, ce type d’examen est très dispendieux et peu accessible. De plus, elle nécessite des équipements de fine pointe et un personnel hautement
contexte clinique ou même dans des études populationnelles de grande échelle.84
Tomodensitométrie axiale commandée par ordinateur (TACO)
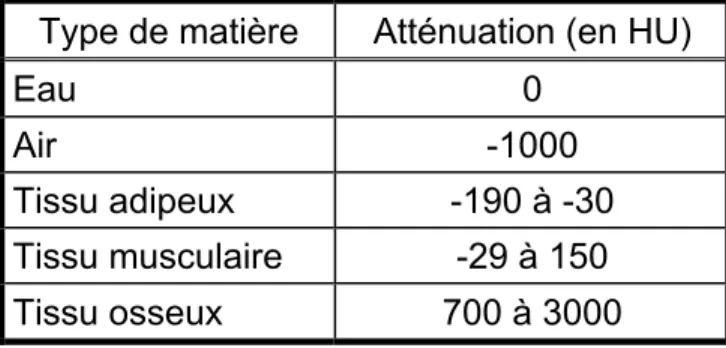
Une autre méthode d’imagerie permettant d’évaluer la distribution du tissu adipeux est la tomodensitométrie axiale commandée par ordinateur (TACO). À partir des images obtenues et l’utilisation de logiciel appliquant des filtres d’atténuation, il est possible de compartimenter et de différencier les différents tissus. En partant du principe que les différents tissus du corps possèdent des niveaux d’atténuation de rayon X différents,85 il est possible de
distinguer les tissus, mais aussi d’estimer leur densité à partir du niveau d’atténuation mesuré en unité Hounsfield. De façon générale, plus un tissu est dense, plus son atténuation sera grande.86 À l’inverse, plus un tissu est
de faible densité, plus son atténuation en unité Hounsfield sera faible (Tableau 3). À l’instar de l’IRM, cette méthode de mesure est précise82 mais
peu accessible et coûteuse. Malgré tout, elle peut applicable à grande échelle dans certaines populations, comme dans la MPOC, où des TACO complets du thorax sont souvent prescrits afin de mesurer les atteintes pulmonaire (i.e. Fibrose, Nodule, Hyperinflation, etc.).29 De cette façon, à partir d’un seul
examen d’imagerie réalisé dans un contexte de dépistage ou de suivi de la maladie, il deviendrait possible pour le clinicien d’obtenir une évaluation précise distribution des tissus du patient.
Tableau 3 : Densité de différentes matières en unité Hounsfield Type de matière Atténuation (en HU)
Eau 0
Air -1000
2.6 Pathophysiologie
L’obésité entraine une multitude de complications affectant non seulement le système cardiovasculaire, mais aussi tout le système inflammatoire et métabolique. L’ensemble des désordres engendrés par le surplus pondéral est appelé comorbidités. Du point de vue de la biomécanique ventilatoire, une des principales conséquences de l’accumulation de graisse au niveau de l’abdomen, réside dans le repositionnement du diaphragme qui est repoussé plus haut dans la cage thoracique. Ceci limite son excursion lors de l’inspiration, diminuant ainsi son efficacité mécanique et contribuant ainsi à l’augmentation de l’effort inspiratoire.87,88 De plus, le poids supplémentaire
devant être déplacé lors du soulèvement et de l’expansion de la cage thoracique sollicitent le travail des muscles accessoires à l’inspiration89. Bien évidemment, en raison de l’augmentation du poids corporel, la demande en oxygène de repos et lors des efforts nécessitant de se mouvoir dans les activités de la vie quotidienne est aussi augmentée.90 Ceci crée alors une
plus grande demande ventilatoire qui doit être assuré par l’appareil pulmonaire.
2.6.1 Comorbidité
L’obésité en soi, excepté dans les cas d’obésité sévère, ne met pas nécessairement en péril la survie de l’organisme à court terme. Ce sont plutôt les comorbidités qui en découlent qui, à long terme, réduisent l’autonomie et peuvent même être fatales. Lorsque présent en excès, le tissu adipeux dérègle le métabolisme et précipite la survenue de plusieurs maladies. Par la libération d’adipokines, le tissu adipeux influence la balance pro- et anti-inflammatoire ce qui entraine des dommages tant au niveau des structures vasculaires qu’aux organes eux-mêmes91 Parmi les plus fréquentes, on
cérébrovasculaire, l’apnée du sommeil, le cancer, etc.92 De plus, il n’est pas
rare de retrouver plusieurs de ses comorbidités à la fois qui interagissent alors entre elles pour favoriser l’apparition d’une autre. En ce sens, l’obésité réduit grandement l’espérance de vie93 et la qualité de vie d’un l’individu.94
Chapitre 3 : Paradoxe de l’obésité dans les maladies
chroniques
3.1 Définition
L’obésité qui, historiquement, ne semblait toucher que les populations les mieux nanties s’étend maintenant dans toutes les sphères de la société,95
allant même jusqu’aux populations atteintes de maladies chroniques. Étonnamment, contre toute attente, il semblerait que l’obésité augmente la survie dans plusieurs pathologies chroniques. Ce phénomène a été nommé «paradoxe de l’obésité».
3.2 Courbe de survie et IMC
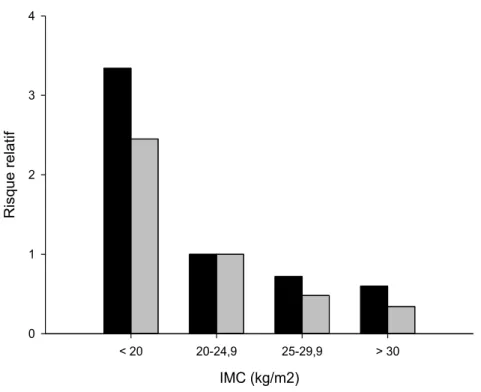
Le «paradoxe de l’obésité» a été constaté dans plusieurs pathologies comme l’insuffisance cardiaque96, l’insuffisance rénale97 et la MPOC.98 Les études épidémiologiques chez ces populations ont conclu que les personnes aux prises avec ces maladies chroniques et qui présentent un surpoids ou même une obésité d’après le calcul de leur IMC, vivent plus longtemps que leurs comparses de poids normal. Un exemple du risque relatif de mortalité selon l’IMC dans la MPOC est montré à la figure 4. Ces résultats sont contre-intuitifs puisque, l’obésité étant un facteur de risque de plusieurs comorbidités, on s’attendrait à ce que sa présence soit néfaste et réduise l’espérance de vie.
Figure 4 : Risque relatif de mortalité selon l’IMC dans la MPOC
Figure élaborée à partir des résultats de : Landbo C. et al. Am J Respir Crit Care Med 1999;160:1856–1861
Légende : Noir = Homme, Gris = Femme 3.3 Paradoxe de l’obésité dans la MPOC
Dans la MPOC, le paradoxe de l’obésité est encore plus surprenant. Ayant longtemps été caractérisée par la présence de cachexie, la MPOC est maintenant de plus en plus associée à l’obésité.99 Ainsi, dans une étude populationnelle menée par Liu et al., près de 70% des 1033 individus ayant rapporté avoir reçu un diagnostic de MPOC, présentaient un surpoids alors que seulement 2,4% étaient en sous-poids.100 On pourrait ainsi dire que
l’obésité est devenue la norme dans cette maladie.99 De plus, la maladie
cardiovasculaire et les autres comorbidités liées à l’obésité sont fréquemment en cause dans la mortalité reliée à la MPOC.9,13,101
IMC (kg/m2) < 20 20-24,9 25-29,9 > 30 R is que r elat if 0 1 2 3 4
Dans les études précédentes, 98,100 un indice de masse corporelle élevée a
été paradoxalement associé à un meilleur taux de survie dans les maladies chroniques comme la MPOC. Toutefois, l’interprétation de l’impact de l’obésité sur la MPOC a pu être confondue en ne tenant pas compte de la composition corporelle ou de la distribution du tissu gras. Ainsi, en raison de sa prévalence importante dans la MPOC et à l’image de ce qui se passe dans d’autres maladies chroniques, il est probable que la distribution du tissus adipeux associée à l’obésité influence significativement le tableau clinique et la survie des individus qui souffrent de MPOC.102 Il est donc
important de mieux caractériser la nature de l’accumulation de tissu adipeux dans la MPOC afin de mieux en cerner les conséquences et d’éventuellement améliorer la prise en charge clinique des patients présentant un surpoids.
Objectif de l’étude
Étudier la distribution du tissu adipeux des patients atteints d’une MPOC et vérifier son degré d’association à des évènements cliniques en lien avec l’état de santé de ces patients et/ou la progression de la maladie telle que le déclin de la fonction pulmonaire, le taux annuel d’exacerbation, la distance marchée en 6 minutes, la qualité de vie, les comorbidités et la mortalité.
Hypothèse
Nous croyons que l’adiposité intra-abdominale sera plus prévalente dans la MPOC et que cette adiposité sera associée à une plus grande détérioration du statut clinique du patient ainsi qu’à une prévalence accrue de comorbidités.
Chapitre 4 : Article scientifique
Titre de l’article : L’adiposité et de la composition corporelle évaluées par TACO sont associées aux comorbidités et à un faible état de santé dans la MPOC. Une sous-étude ECLIPSE.
Rationnel : Un indice de masse corporelle élevé a été paradoxalement associé à un meilleur taux de survie dans les maladies chroniques comme la MPOC. Toutefois, l’interprétation de l’impact de l’obésité sur la survie dans la MPOC a pu être influencée par la distribution du tissu gras qui n’as pas été prise en compte dans ces études. Cette sous-étude ECLIPSE teste l’hypothèse selon laquelle l’adiposité intra-abdominale serait augmentée dans la MPOC et serait associée aux comorbidités et à des évènements cliniques néfastes.
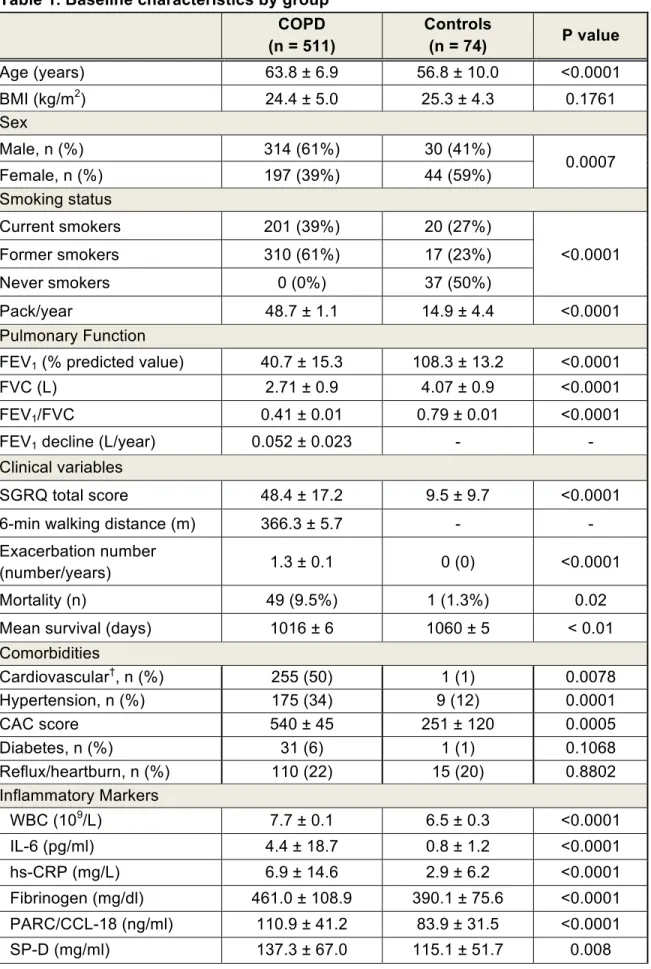
Méthodes : Des images de tomodensitométrie axiale contrôlée par ordinateur (TACO) au niveau des vertèbres L2-L3 obtenues à partir de l’étude ECLIPSE ont été utilisées pour quantifier la surface de tissu adipeux viscéral (TAV) et de tissu musculaire (TM) ainsi que de l’atténuation musculaire, un reflet de l’infiltration lipidique du muscle, chez les patients atteints de MPOC et chez les sujets témoins. Des modèles de régression ont été utilisés pour investiguer les possibles relations entre les indices d’adiposité ainsi que la surface de tissu musculaire, avec les comorbidités et les manifestations cliniques de la MPOC.
Résultats : À partir de la cohorte ECLIPSE, nous avons identifié 585 sujets pour qui nous avions des images de TACO à L2-L3 permettant l’analyse de la composition corporelle. La surface de TAV est augmentée (p<0.0001) et la surface musculaire ainsi que l’atténuation réduite (indication d’une infiltration lipidique accrue) chez les patients avec une MPOC comparativement aux témoins. Bien que la sévérité de la maladie ne soit pas associée au TAV augmenté, l’atténuation musculaire diminue en fonction de la progression de la limitation du débit expiratoire. La surface de TAV est associée à une
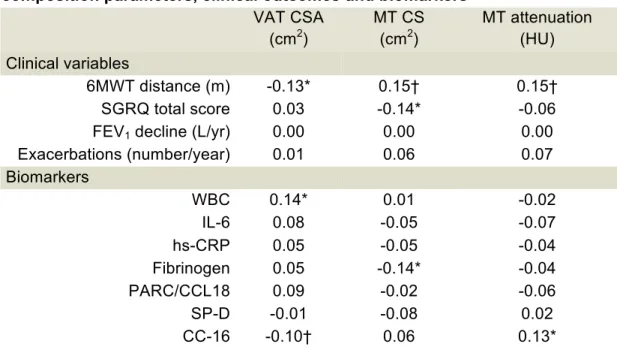
probabilité accrue de retrouver des comorbidités cardiovasculaires (p = 0.042). Des corrélations ont été établies entre les variables mesurées par TACO et le test six minutes de marche, le score total au St. Georges’ Respiratory Questionnaire et certains biomarqueurs.
Conclusion : Notre étude confirme que l’accumulation de tissu adipeux viscéral, ainsi que l’augmentation de gras intramusculaire et la diminution de la surface de tissu musculaire dans l’abdomen sont associées à plusieurs comorbidités et à des évènements cliniques significatifs dans la MPOC.
Computed tomography-derived adiposity and body composition are associated with comorbidities and poor outcomes in COPD. An
ECLIPSE substudy Authors:
Mickaël Martin1, Natalie Almeras1, Jean-Pierre Després1, Harvey O Coxson2,
George R Washko3, Isabelle Vivodtzev4, Emiel FM Wouters5, Erica Rutten6,
Michelle C Williams7, John T Murchison8, William MacNee7, Don D Sin2,
François Maltais1 for the Evaluation of COPD Longitudinally to Identify
Predictive Surrogate Endpoints (ECLIPSE) investigators.
Affiliations:
1Centre de recherche, Institut universitaire de cardiologie et de pneumologie
de Québec, Université Laval, Québec Canada; 2University of British
Columbia, Vancouver, Canada; 3Division of Pulmonary and Critical Care
Medicine, Department of Medicine, Brigham and Women’s Hospital, Harvard Medical School, Boston, Massachusetts, United States; Grenoble Alps University, Inserm U1042 Hypoxia Pathophysiology laboratory and Grenoble University Hospital, Grenoble, France; 5Maastricht University Medical Center,
Maastricht, The Netherlands; 6Research and development, CIRO, Horn, The
Netherlands; 7University of Edinburgh, Edinburgh, UK; 8Royal Infirmary of
Edinburgh, Edinburgh, UK. Short title: Adiposity and COPD Corresponding author:
Dr. F. Maltais
Centre de Pneumologie
Institut Universitaire de cardiologie et de pneumologie de Québec, 2725 Chemin Sainte-Foy
Fax: 1 418 656 4762
E-Mail: Francois.Maltais@fmed.ulaval.ca
Key words: metabolic syndrome, obesity, abdominal adiposity, muscle Word count: 3463 (max: 3500)
COMPETING INTERESTS
MM, NA, IV, ER, MCW and JTM have no conflicts of interest to declare. JPD reports personal fees from Abbott Laboratories; AstraZeneca; GlaxoSmithKline; Merck; Pfizer Canada Inc.; Sanofi; Torrent Pharmaceuticals Ltd. outside the submitted work. EFMW reports personal fees from Nycomed; AstraZeneca; GlaxoSmithKline; Novartis outside the submitted work. GRW reports other from GlaxoSmithKline, other from Genentech, outside the submitted work. HOC reports personal fees from GSK, grants from GSK during the conduct of the study; personal fees from Samsung, grants from Spiration Inc outside the submitted work. WM reports personal fees and other from GlaxoSmithKline, personal fees and other from Pfizer, personal fees and other from AstraZeneca, personal fees and other from Boehringer Ingelheim, grants from British Heart Foundation, grants from Chief Scientist Office, grants from MRC, outside the submitted work. DDS reports personal fees from Amgen, grants and personal fees from AstraZeneca, personal fees from Boehringer Ingelheim, grants from Novartis, outside the submitted work. FM
personal fees from GlaxoSmithKline, grants from Nycomed, grants and personal fees from Novartis, outside the submitted work. All fees are pooled with other revenues of the group of pulmonologists to which FM is a member and then shared among members of the group. FM holds a CIHR/GSK research Chair on COPD at Université Laval.
FUNDING
GlaxoSmithKline. MM was recipient of a research training award from the Fonds de la recherche Québec - Santé. FM holds a GSK/CIHR Research Chair on COPD at Université Laval. JPD is the scientific director of the International Chair on Cardiometabolic Risk which is based at the Faculty of medicine, Université Laval.
This work has been presented as an abstract at the 2015 meeting of the American Thoracic society
ABBREVIATIONS LIST
6MWD: 6-min walking distance AT: adipose tissue
BMI: body mass index
CC-16: club cell secretory protein
COPD: chronic obstructive pulmonary disease CSA: muscle tissue cross-sectional area CT: computed tomography
ECLIPSE: Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints
FEV1: Forced expiratory volume in 1 second
GOLD: Global initiative for Chronic Obstructive Lung Disease hs-CRP: high-sensitivity C-reactive protein
HU: Hounsfield units
ICC: intraclass correlation coefficient IL-6: interleukin-6
MT: muscle tissue
PARC/CCL-18: pulmonary and activation-regulated chemokine SCAT: subcutaneous adipose tissue
SGRQ: St. Georges’ Respiratory Questionnaire SP-D: surfactant protein
VAT: visceral adipose tissue WBC: white blood cell count
ABSTRACT
Background : Increased body mass index has been paradoxically associated with prolonged survival in COPD. However, interpreting the impact of obesity on COPD has been confounded by not considering body composition or fat distribution. This ECLIPSE substudy tested the hypothesis that COPD is associated with increased intra-abdominal adiposity and that this would be associated with comorbidities and adverse clinical outcomes. Methods: Computed tomography images of the thorax obtained in the ECLIPSE study were used to quantify, at L2-L3, visceral adipose tissue (VAT) and muscle tissue (MT) cross-sectional areas (CSA) and MT attenuation, a reflection of muscle fat infiltration. Regression models were used to investigate possible relationships between CT body composition indices, comorbidities and COPD-related outcomes. Results: From the entire ECLIPSE cohort, we identified 585 subjects with valid CT images at L2-L3 to assess body composition. VAT CSA was increased (p<0.0001) and muscle CSA and attenuation decreased (indicating more muscle fat accumulation) in COPD compared to controls. Whereas disease severity was not associated with more VAT, muscle attenuation decreased as airflow limitation worsened. VAT CSA was associated with increased probability of diabetes (p = 0.024) and gastroesophageal reflux (p = 0.0048) at baseline while MT attenuation predicted an increased probability of finding cardiovascular comorbidities (p = 0.042). Correlations were found between CT-derived adiposity and body
Respiratory Questionnaire total scores and selected biomarkers. Conclusion: CT-derived adiposity and body composition variables were associated with comorbidities and with relevant clinical outcomes in COPD.
What is the key question?
Is there an increased visceral adipose tissue accumulation in patients with COPD and does this contribute to COPD-related outcomes and comorbidities?
What is the bottom line?
An increased intra-abdominal (visceral) fat accumulation/muscle fat infiltration was observed in COPD and this was associated with diabetes, cardiovascular comorbidities and gastroesophageal reflux and with relevant COPD-related outcomes such as reduced walking capacity and quality of life.
Why read on?
Intra-abdominal (visceral) fat accumulation being a risk factor for cardiovascular diseases, a leading mortality cause in COPD, regional body fat distribution and ectopic fat deposition should be properly assessed to optimally manage patients with COPD in clinical practice.
INTRODUCTION
Obesity is becoming a major health issue in COPD, as it is in the general population. Several studies have reported an increased proportion of patients with COPD who are either overweight or obese.1-4 Based on the well
established link between obesity and hypertension, type 2 diabetes, cancer, and cardiovascular diseases,5 and on the fact that COPD is an independent
risk factor for cardiovascular diseases,6 one would assume that COPD
patients who are obese are characterized by an increased mortality rate. Consistent with these observations, all-cause and cardiovascular mortality are also increased in patients with COPD.7 Depending on COPD severity, cardiovascular diseases are the primary causes of mortality in 20 to 27% of patients with COPD.8,9
In this context, it is somewhat counterintuitive that overweight and obesity paradoxically prolonged survival in COPD10 as well as in other chronic diseases,11 a phenomenon referred to as the “obesity paradox” or “reverse
epidemiology”.12 Many studies have reproduced this finding which appears to
be robust and observed up to very high body mass index (BMI) values (above 40 kg/m2).12
It has been proposed that this paradox may be a “BMI paradox” rather than an “obesity paradox”.13 Indeed, BMI does not provide precise information
consider in the interpretation of the relationship between obesity and COPD. For instance, it is very well documented that the inflammatory, metabolic and cardiovascular consequences of obesity are largely explained by the presence of excess visceral adipose tissue which is also partly a marker of unwanted lipid accumulation in normally lean tissues such as the liver, the heart and the skeletal muscle, this phenomenon being described as ectopic fat accumulation.14 Individuals with a selective accumulation of abdominal
(visceral) fat are at increased risk of developing features of the metabolic syndrome, diabetes, an atherogenic dyslipidemia, inflammation or cardiovascular diseases compared to those who preferentially accumulate lipids in subcutaneous “healthy” adipose tissue.14 We therefore put forward
the hypothesis that the paradoxical relationship between COPD and obesity has been largely confounded by the absence of body composition and regional adipose tissue distribution data.
The Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints (ECLIPSE) was an internationnal multicenter, observational and longitudinal study to identify surrogate markers of COPD progression.15
ECLIPSE enrolled current or former smokers with Global initiative for Chronic Obstructive Lung Disease (GOLD) stage 2 - 4 COPD, smokers with normal lung function and never smokers.16 Interestingly, all ECLIPSE participants
abdominal fat distribution, and muscle tissue area and attenuation, an expression of fat infiltration..17
We therefore took advantage of this unique COPD cohort with a 3-year follow-up to address the following question: i) is COPD associated with increased visceral obesity? ii) does visceral obesity and muscle fat infiltration modify the expression of COPD in being associated with reduced functional and health status, cardiovascular and other comorbidities, as well as with forced expiratory volume in 1 second (FEV1) rate of decline, exacerbations
and mortality? Our overarching hypothesis was that COPD would be associated with increased intra-abdominal fat accumulation compared to controls with normal lung function and that this would be associated with adverse clinical outcomes.
METHODS
Study design and patients
ECLIPSE (Clinicaltrials.gov, NCT00292552) enrolled 2164 current or former smokers (≥ 10 pack-years) with GOLD stage 2-4, as well as 337 smokers with normal lung function and 245 never smokers.16 Patients’ characteristics (age,
race, gender, smoking history), chest CT scan, pulmonary function tests, St. Georges’ Respiratory Questionnaire (SGRQ) scores, 6-min walking distance (6MWD), serum inflammatory biomarkers (white blood cell count [WBC], interleukin-6 [IL-6], high-sensitivity C-reactive protein [hs-CRP], fibrinogen, pulmonary and activation-regulated chemokine [PARC/CCL-18], surfactant protein [SP-D], club cell secretory protein [CC-16]) were obtained at baseline and yearly for the 3-year study duration as previously reported15,18,19
Standardized questionnaires were used to record comorbidity at baseline. COPD exacerbations and mortality were also recorded. All patients provided written informed consent and the study were approved by ethics committees of participating centres. ECLIPSE steering and scientific committees approved the protocol for this substudy.
Imaging assessment
All ECLIPSE participants underwent a low-dose volumetric CT scan of the chest at baseline with the following protocol: 120-kV peak, 40 mA, and 1.00- or 1.25-mm slice thickness, at full inspiration. For the purpose of this
contained images at L2-L3 intervertebral space. Measures of fat and muscle (psoas, paraspinal and abdominal wall muscles) tissues cross-sectional areas and of muscle tissue (MT) attenuation were performed by the same investigator (MM) using the CT imaging Core Lab Unit at the Institut Universitaire de cardiologie et de pneumologie de Québec and a specialized image analysis software (Slice-O-Matic, Tomovision, Montréal, Québec, Canada) according to standardized techniques (Figure 1).17 Adipose and
muscle tissue cross-sectional areas (CSA, cm2) were measured using an
attenuation range of –190 to –30 Hounsfield units (HU) and of -29 to 130 HU, respectively. The mean attenuation value in HU of each structure was generated. To avoid subjectivity in the separation between subcutaneous (SCAT) and visceral (AT) adipose tissues, these two fat tissues were separated from each other midway in the thickness of abdominal wall muscles. Subjects for whom a tissue surface area > 1 cm2 fell outside the
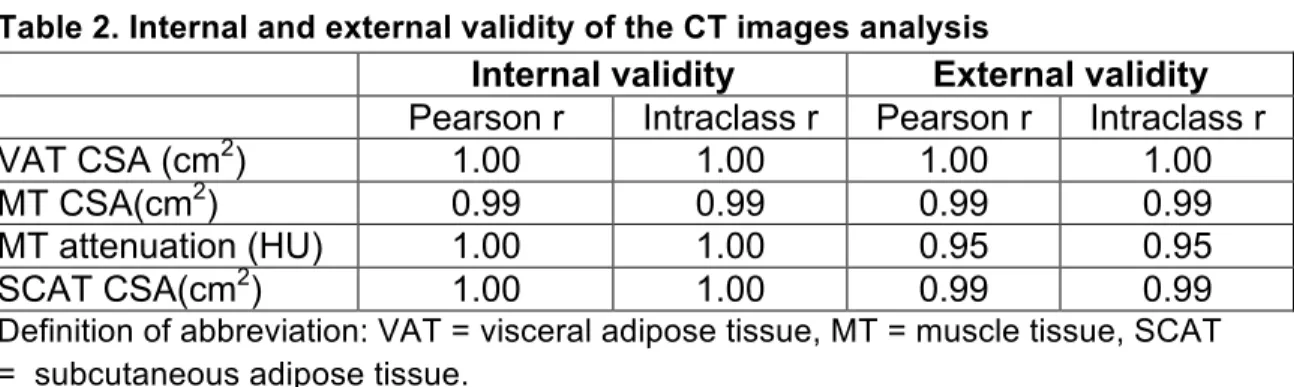
field of view of the scope were excluded from further analysis. A random selection of 10% of all segmented images were redone by the same evaluator to assess for intra-observer variation. Inter-observer variation was evaluated on a random sample of 10% of the segmented images that were also analysed by a second imaging expert.
Statistical analyses