Recrutement des symbiotes dans un contexte
d'ensemencement. Cas du Saumon atlantique
(Salmo salar)
Mémoire
Camille Lavoie
Maîtrise en biologie - avec mémoire
Maître ès sciences (M. Sc.)
Québec, Canada
Recrutement des symbiontes dans un contexte
d’ensemencement. Cas du Saumon atlantique
(Salmo salar)
Mémoire
Camille Lavoie
Département de Biologie de l’Université Laval,
Institut de Biologie Intégrative et des Systèmes (IBIS) de l’Université Laval
Sous la direction de :
ii
Résumé
Ce projet s’est intéressé à l’impact qu’exerce l’ensemencement du Saumon atlantique sur le processus de recrutement des souches microbiennes commensales en milieu naturel. Puisque le taux de survie des saumons ensemencés reste faible par rapport à celui des individus sauvages de la même population génétique, il est essentiel d’évaluer dans quelle mesure l’acclimatation du microbiote aux conditions de pisciculture persiste après l’introduction des individus en milieu naturel.
L’objectif de ce projet était de comparer la composition du microbiote de tacons de saumons, nés en pisciculture, deux mois suivant leur introduction en rivière avec celle des tacons sauvages. L’hypothèse était que l’élevage en pisciculture induit un effet à long terme sur le microbiote des individus ensemencés. Différents sites corporels ont été comparés; le mucus cutané, trois sections de l’intestin (proximale, médiane, et distale) ainsi que le bol alimentaire associé à chacune de ces trois sections, en plus du contenu stomacal. Enfin, tous les individus ont été génotypés à l’aide de 17 marqueurs microsatellites.
Les résultats présentés montrent que les individus ensemencés ont un microbiote différent de celui de leurs congénères sauvages. Ces résultats mettent en évidence une empreinte sur le microbiote des conditions précoces. Une capacité d’acclimatation du microbiote cutané ainsi qu’une forte résistance à la colonisation du microbiote intestinal aux bactéries sauvages ont été notés. Ce projet génère des connaissances inédites dans le domaine de l’écologie microbienne, utilisables pour l’optimisation des méthodes de conservation et supporte les recommandations de reconstituer le plus possible l’environnement naturel lors de l’élevage de poissons destinés à la restauration de populations naturelles. Des études complémentaires seront nécessaires afin d’approfondir notre compréhension des processus moléculaires liés au recrutement du microbiote et sur la relation entre la faible survie des individus ensemencés et l’impossibilité de recruter certaines fonctions bactériennes clés après l’ensemencement.
iii
Abstract
Here we examine the impact exerted by the Atlantic salmon stocking methods on the microbiota recruitment processes of microbial commensals in the wild. Because mortality rate of stocked salmon remains higher than that of wild ones despite sharing the same genetic background, it becomes essential to assess to which extent the acclimation of the microbiota in hatchery persists after the introduction of fishes in the wild.
Our objective was to compare hatchery reared and stocked parrs with wild parrs’ microbiota belonging to the same genetic population, two months after stocking. We hypothesized that rearing conditions in hatcheries had long-term effects on the microbiota of stocked parrs after stocking. To do so, we examined the microbiota composition from various samples of stocked and wild parrs; the cutaneous mucus, three sections of the intestine (proximal, median and posterior) and the food bowl associated to these sections, as well as the stomach content. In addition, all specimens were genotyped with 17 microsatellites markers.
The results show that stocked parrs’ microbiota differs than that from their wild relatives and suggest that hatchery conditions have long term effects on the microbiota. Moreover, our results suggest an imprinting on the microbiota associated with early conditions. Moreover, a high adaptive capacity of the cutaneous mucus microbiota and a high colonization resistance of the intestinal microbiota were observed. In addition to generate knowledge regarding the long-term effects of early life conditions on the microbiota composition, this project support previous recommendation to mimic the natural environment (including the microbial environment) in hatchery for conservation programs. Further studies on the molecular processes occurring during the microbiota ontogeny in hatchery as well as on the contribution of the microbiota for stocked parrs’ survival after their introduction in the wild and their incapacity to recruit key symbionts in the wild would be needed.
iv
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Définitions ... v
Remerciements ... vii
Avant-propos ... viii
Introduction ... 1
1. Définition et rôle du microbiote 1 2. Facteurs qui influencent l’ontogenèse et la composition du microbiote 3 3. Effet à court et long terme des bactéries pionnières sur le métabolisme 6 4. L’étude du microbiote chez le Saumon atlantique 7 4.1. Description de l’espèce à l’étude ... 7
4.2. Développement du système digestif et du microbiote intestinal de S. salar... 8
4.3. Adaptations locales relatives au cours d’eau ... 10
4.4. Bilan de S. salar au Québec ... 11
4.5. La conservation de Salmo salar par l’ensemencement ... 11
5. Objectifs et hypothèses 15 Chapitre 1 : Artificial rearing of Atlantic salmon juveniles for supportive breeding programs induces permanent effects on the microbiota after stocking ... 18
1.1 Résumé 18 1.2 Abstract 18 Introduction 19 Materials and methods 21 Results 25 Discussion 28 References 33 List of tables and figures 38 Conclusion ... 46
Bibliographie ... 49
v
Définitions
16S SSU rRNA
Désigne la petite sous-unité de l’ARN ribosomal 16S des bactéries. Cette petite sous unité est utilisée comme biomarqueur universel pour la caractérisation des communautés bactériennes, puisqu’elle est composée de plusieurs régions hyperconservées flanquées de régions
hypervariables. Ces régions hypervariables permettent l’assignation taxonomique au niveau du genre bactérien.
Acclimatation
Processus d’ajustement de la physiologie et du phénotype d’un organisme en réponse à un changement environnemental.
Alevins
Stade larvaire du saumon suivant l’éclosion des œufs où le sac vitellin est toujours présent.
Dysbiose
État de déséquilibre du microbiote pouvant être engendré par des événements perturbateurs, ponctuels ou chroniques.
COI
Cytochrome Oxydase I. Il est utilisé comme biomarqueur universel pour la caractérisation des communautés eucaryotes.
Ensemencement
Méthode utilisée chez différentes espèces aquatiques qui consiste à produire des juvéniles en pisciculture et de les introduire en milieu naturel. Cette méthode peut être utilisée à des fins de mise en valeur des cours ou plans d’eau ou à des fins de conservations afin de restaurer les stocks d’une population en déclin.
Épigénétique
Mécanismes qui modifient l’expression des gènes sans en modifier la séquence de l’ADN.
Eubiose
État d’équilibre entre l’hôte et le microbiote. Lors de l’eubiose, le microbiote participe au maintien de l’homéostasie du métabolisme de l’hôte.
Génotype
Composition allélique de tous les gènes d’un individu.
Hologénome
Génome de l’hôte et de son microbiote.
Madeleinaux
Jeune saumon ayant atteint la maturité sexuelle et qui revient de la mer pour remonter la rivière une première fois.
vi
Communauté de microorganismes colonisant les surfaces corporelles d’un organisme hôte. Dans ce projet de recherche, nous nous focalisons sur les microorganismes bactériens.
Ontogenèse (du microbiote)
Processus de formation du microbiote qui implique le recrutement actif et passif des bactéries tout au long du cycle de vie de l’organisme hôte.
Œufs verts
Œufs de saumon nouvellement fertilisés dont l’embryon n’est pas encore visible.
Œufs oeillés
Œufs de saumon où le développement de l’embryon permet de discerner ses yeux.
PCR
Réaction de polymérase en chaine, « Polymerase Chain Reaction ».
Phénotype
Ensemble des traits observables/mesurables d’un organisme résultant de l’expression du génome.
Rédibermarin
Saumon adulte qui a passé plus d’un hiver en mer avant de remonter les rivières pour se reproduire.
Sac vitellin
Annexe embryonnaire riche en réserves présente sur les larves de Poissons suite à leur éclosion. Les larves de saumons conservent habituellement cette annexe de 7 à 8 semaines et utilisent ces réserves pour se nourrir. La nutrition exogène débute lorsque le sac vitellin est complètement résorbé.
Saumoneau
Jeune saumon qui amorce le processus de dévalaison vers la mer pour y atteindre la maturité sexuelle et se nourrir activement. La dévalaison vers la mer est accompagnée de changements physiologiques et morphologiques importants que l’on nomme la « smoltification ». Le terme anglais « smolt » est également utilisé à ce stade.
Tacon
Jeune saumon qui a perdu son sac vitellin et qui se nourrit activement en rivière. Lors de la première année en eau douce, les tacons sont nommés « tacons 0+ », alors que les tacons qui entament leur deuxième année de vie se nomment « tacons 1+ » et ainsi de suite.
Unités désignables
Ou unité de conservation. Désigne un groupe d’individus suffisamment isolé pour identifier des différences en termes de répartition géographique, de besoin de température, de biologie de l’espèce et de génotype par rapport aux autres groupes.
vii
Remerciements
La réalisation de ce projet a été rendue possible premièrement grâce à mon directeur, M. Nicolas Derome, qui m’a permis de découvrir le merveilleux monde du Saumon atlantique ainsi que la complexité qui se cache derrière les principes fondateurs de l’écologie microbienne. La confiance qui m’a été accordée tout au long de ce projet a permis le développement d’une passion face à la vie aquatique et a su nourrir ma curiosité intellectuelle qui pousse tous les scientifiques à vouloir aller au fond des choses. Mon passage dans ce laboratoire aura été tout autant formateur que passionnant grâce au support de M. Derome.
Ce projet n’aurait également pas été rendu possible sans la collaboration de la Société Saumon de la Rivière Romaine (SSRR) et des nombreuses personnes ayant séjourné au sein de cette société, notamment François Caron, Geneviève Ouellet-Cauchon, Étienne St-Michel et Yves Richard. De plus, je tiens à remercier le personnel technique de WSP, prestataire de service de la SSRR, qui a su apporter un soutien inestimable lors des travaux de terrain. L’aide de Carl Gauthier, Antoine Therrien, Stéphane Geissel, Dominick Cuerrier, Nicolas Rathé et William Rondeau et tout autre personnel de soutien technique ayant participé aux différentes campagnes de terrain aura été très précieuse.
Je tiens également à remercier le personnel du Laboratoire de Recherche en Sciences Aquatiques (LARSA) de l’Université Laval, le personnel de la pisciculture de la SSRR, située à Havre-Saint-Pierre, pour leur aide considérable et leur participation à ce projet, de même que le personnel du laboratoire de M. Louis Bernatchez de l’Université Laval pour leur participation aux analyses génétiques.
Finalement, le soutien financier du Fond de Recherche Québec – Nature et Technologies (FRQNT), du Conseil de Recherche en Sciences Naturels et en Génie (CRSNG) ainsi que de la SSRR aura permis l’élaboration de ce projet.
viii
Avant-propos
L’article joint à ce mémoire de maîtrise ne fait office d’aucun état de publication au moment de la soumission de ce document. Les modifications proposées dans le cas d’une révision suite à la soumission de l’article seront visibles dans la version finale de l’article publiée dans le journal choisi. L’auteure principale de l’article est également l’auteure de ce mémoire. La récolte des échantillons, la préparation en laboratoire, l’analyse des données ainsi que la rédaction ont été effectués par cette même personne, à l’exception des analyses génétiques. Les co-auteurs de l’article ont participé à la préparation des échantillons (Laurence Auger et Aurélie Boilard) ou aux analyses génétiques (Alysse Perreault et Kyle Wellband – appartenance au laboratoire de Louis Bernatchez). Le directeur de ce projet, également co-auteur, est M. Nicolas Derome.
1
Introduction
1. Définition et rôle du microbiote
En écologie, une communauté est définie par un assemblage multiple de différentes espèces dans laquelle les organismes vivent et interagissent ensemble dans un espace contigu (Komopka et al., 2009.). Les différentes composantes d’une communauté comprennent les organismes qui la composent en plus des facteurs biotiques et abiotiques propres à la communauté. Dans le domaine de l’écologie microbienne, une telle communauté est appelée « microbiote » et est définie par les microbes qui interagissent fortement entre eux à une échelle locale. Puisque les communautés microbiennes (qui comprennent les Bactéries, Virus, Archées, Eucaryotes unicellulaires et Champignons) sont étroitement liées aux facteurs physicochimiques de leur environnement, quatre types de systèmes microbiens ont été décrits; les écosystèmes planctoniques (océans, lacs, rivières), les écosystèmes de surfaces saturés (biofilms, sédiments), les écosystèmes de surfaces non saturés (zones vadoses, sols) et les écosystèmes associés à des macroorganismes (tractus digestif, voies respiratoires, peau, mucus, rhizosphère, épiphytes) (Konopka et al., 2009).
Le rôle essentiel que jouent les communautés microbiennes dans l’environnement est bien établi; sans les microorganismes, la remise en circulation de la matière organique morte de même que la fixation de l’azote atmosphérique seraient impossibles. En effet, les bactéries qui participent à la minéralisation des nutriments permettent le recyclage et la libération de ces derniers dans la chaîne trophique, lesquels seront ensuite utilisés par les producteurs primaires. Ce processus de recirculation permet la création de nouvelle biomasse, conférant aux microorganismes un rôle clé dans les réseaux trophiques (Daufresne et Laureau, 2001; Ehrlich, 1998; Fenchel et al., 2012). Les Bactéries sont également associées à de nombreux organismes (i.e. les hôtes de ces bactéries) avec lesquels elles ont coévolué et établi des relations très étroites. Colonisant toutes les surfaces corporelles de leur hôte, les Bactéries forment le microbiote et participent activement au maintien du métabolisme de ce dernier, qui à son tour offre des nutriments ainsi qu’une niche écologique propice à l’établissement et la croissance des communautés microbiennes qui lui sont associées (Bäckhed et al., 2005). D’ailleurs, les évidences de coévolution entre l’hôte et le microbiote ont mené à l’établissement d’une vision holistique du système hôte-bactéries, puisque l’expression de
2
certains gènes est contrôlée par des bactéries du microbiote et que la physiologie et le métabolisme de l’hôte sont fortement influencés par celui-ci (Bäckhed et al., 2005; Rosenberg et Zilber-Rosenberg, 2011). Les évidences de coévolution et d’interdépendance entre l’hôte et le microbiote ont d’ailleurs mené à l’établissement des termes « holobionte » et « hologénome » (Margulis, 1991), où l’entité hôte-microbiote est considérée dans sa globalité au point de vue métabolique et génomique. Finalement, les résultats recueillis sur les fonctions du microbiote ont permis d’identifier le rôle essentiel que joue ce dernier sur le développement et le bon fonctionnement du métabolisme de l’hôte.
Le microbiote est un acteur majeur dans le développement du système immunitaire et digestif, tant chez l’Humain que chez les Poissons téléostéens comme le Saumon atlantique. Lors de la formation du système immunitaire, le microbiote stimule la fabrication et la sécrétion d’immunoglobulines, l’assemblage du tissu lymphoïde intestinal, la maturation des lymphocytes T et la prolifération de lymphoblastes (Pérez et al., 2010; Webb et al., 2012). Plus directement, le microbiote constitue une barrière physique qui empêche l’établissement de bactéries opportunistes et pathogènes sur les surfaces corporelles (Balcazar et al., 2007). Certaines bactéries sont notamment reconnues pour sécréter des composés antimicrobiens tels que l’entérocine et la bactériocine, en plus d’inhiber l’adhérence de souches indésirables aux parois intestinales par le mécanisme d’exclusion (Pérez et al., 2010; Webb et al., 2012). Dans le système digestif, le microbiote permet l’assimilation de nombreux nutriments autrement non assimilables par la sécrétion de nombreuses enzymes digestives, en plus de favoriser le développement des cellules intestinales et l’angiogenèse du système digestif (Conlon et Bird, 2014; Hooper et al., 2001; Rawls et al., 2004; Stappenbeck et al., 2002; Tremaroli et Bäckhed, 2012). De nombreuses recherches ont également mis en lumière l’implication des Bactéries sur le développement de maladies immunitaires et de divers désordres métaboliques lorsque celui-ci est perturbé. Dans un état d’équilibre, appelé eubiose, le microbiote maintient l’homéostasie du métabolisme de l’hôte. Lors de l’eubiose, des bactéries potentiellement bénéfiques prédominent dans le système digestif (Iebba et al., 2016). Toutefois, une dysbiose peut être causée par certains évènements perturbateurs, ponctuels ou chroniques, comme une mauvaise alimentation, une prise de médicaments et d’antibiotiques, la consommation d’alcool excessive, le tabagisme, le stress, ou certaines conditions environnementales (Nakayama et al., 2017; Scanlan et al., 2008). Lors d’une
3
dysbiose, la communauté bactérienne est négativement affectée, facilitant l’établissement de souches potentiellement nuisibles pouvant mener à plusieurs dérèglements métaboliques. Chez l’Humain, la dysbiose du microbiote a été associée à diverses maladies du foie, à l’inflammation du tube digestif, au syndrome du côlon irritable, au cancer colorectal, à la polypose, au développement du diabète de type 2 et à l’obésité (Conlon et Bird, 2014; Keszthelyi et al., 2012; Liu et al., 2012; Scanlan et al., 2008; Tremaroli et Backhed 2015; Wu et Lewis, 2013). Chez les poissons piscivores tels que le Saumon atlantique, la Truite mouchetée et la Truite arc-en-ciel, une dysbiose microbienne à la suite d’une augmentation de la température de l’eau, l’exposition à des conditions hypoxiques ainsi qu’un changement de diète a été mise en évidence (Boutin et al., 2014; Krogdahl et al., 2000; Landeira-Dabarca et al., 2012). L’équilibre du microbiote est donc influencé par différents facteurs biotiques et abiotiques, qui auront une incidence sur le recrutement bactérien et la composition microbienne. En retour, ces changements sont associés à une modification du métabolisme bactérien et de la physiologie de l’hôte.
2. Facteurs qui influencent l’ontogenèse et la composition du microbiote
Le recrutement des différents taxons bactériens qui font partie du microbiote est le résultat de l’interaction de multiples facteurs environnementaux, développementaux et génétiques. Premièrement, les bactéries pionnières sont acquises dès les premiers stades de vie, soit par transfert vertical, par les parents (Bäckhed et al., 2015; Bokulich et al., 2016; Mackie et al., 1999; Nagpal et al., 2017; Sylvain et Derome, 2017), ou par transfert horizontal, par l’environnement (Stephens et al., 2016; Wong et Rawls, 2012). Chez l’Humain et les autres Mammifères placentaires, le transfert vertical domine; les premières bactéries sont transmises de la mère au nouveau-né potentiellement de manière intra-utérine (Collado et al., 2016; Perez-Muñoz et al., 2017) et lors de l’accouchement par le passage dans les voies génitales. Le contact entre la peau de la mère et celle du nouveau-né permet également le transfert de nombreuses bactéries essentielles lors de l’allaitement. La colonisation des premières bactéries sera modifiée dans le cas où l’accouchement aura lieu par césarienne ou si le nourrisson est nourri au biberon ou avec du lait synthétique (Bokulich et al., 2016; Dominguez-Bello et al., 2019). Chez les organismes aquatiques non Mammifères, et dont le soin parental est limité ou absent, le transfert des bactéries est essentiellement horizontal (Wong et Rawls, 2012). En effet, les bactéries sont majoritairement acquises par
4
l’environnement, les organismes aquatiques étant directement en contact avec ce dernier. L’établissement des bactéries pionnières est donc étroitement lié aux conditions biotiques et abiotiques associées à un hôte, lesquelles affecteront le recrutement et les interactions bactériennes ultérieures lors du développement de l’hôte et de son microbiote.
Suite à l’acquisition des premières bactéries, le microbiote amorce un processus de maturation appelé ontogenèse, où diverses souches bactériennes seront recrutées activement (c.-à-d. par des processus moléculaires) ou passivement pour répondre aux conditions de leur environnement (Webb et al., 2016). Ainsi, tout au long du cycle de vie de l’organisme hôte, l’assemblage de son microbiote est régi par deux types de processus évolutifs : stochastiques, tels que la dérive taxonomique et la dispersion passive et déterministes, tels que la sélection. Chez les Mammifères, une faible diversité de bactéries est acquise lors des premiers stades de vie et s’accroît au fur et à mesure que l’hôte recrute des bactéries bénéfiques via le transfert horizontal, par la diète et par l’environnement. Chez les organismes aquatiques, la situation inverse se produit; une grande diversité de bactéries est acquise au tout début du cycle de vie. Lors de la maturation du microbiote, les bactéries essentielles sont conservées par un processus de sélection actif et par filtration environnementale (Yan et al., 2016). En effet, par le biais de certains gènes, le recrutement de souches bactériennes spécifiques est favorisé, permettant la maturation sélective du microbiote (Boutin et al., 2014). Dans le cas de la filtration environnementale, les bactéries qui présentent un profil de tolérance adéquat selon le compartiment biologique sont sélectionnées. Dans les intestins, le processus est illustré par la théorie appelée « gut island theory », qui stipule que les bactéries sont spécifiques aux conditions qui caractérisent le tube digestif (Yan et al., 2016).
La théorie de l’îlot intestinal peut également s’appliquer pour les communautés qui colonisent les autres surfaces corporelles, soit la peau, le mucus, le système respiratoire ou les branchies. Ce phénomène témoigne notamment de la capacité du microbiote à répondre aux conditions associées à l’environnement immédiat en modifiant sa composition bactérienne. C’est donc processus d’adaptation puisque que le microbiote change son répertoire fonctionnel en recrutant de nouvelles souches possédant des fonctions qui permettent d’exploiter les nouvelles conditions environnementales. De manière générale, la
5
composition est affectée par le ratio des macronutriments ingérés (sucre, protéines, lipides) et de l’ingestion de polyphénol (Bakke-McKellep et al., 2000; Conlon et Bird, 2014; Desai et al., 2012; Gajardo et al., 2017; Hartviksen et al., 2014). Parallèlement, l’activité métabolique du microbiote est modifiée afin de répondre aux changements de diète. Chez les poissons piscivores élevés en aquaculture, une présence accrue de bactéries produisant de l’acide lactique a été mise en évidence chez les individus soumis à une diète riche en protéines végétales contenant une forte teneur en glucides (Desai et al., 2012; Gajardo et al., 2017; Hartviksen et al., 2014; Lavoie et al., 2018). Toujours en aquaculture, l’utilisation d’antibiotiques est reconnue comme étant un facteur majeur pour modifier la composition bactérienne (Conlon et Bird, 2014; Desai et al., 2012; Gajardo et al., 2017; Hartviksen et al., 2014). Il a été démontré que leur utilisation a pour conséquence de diminuer la diversité bactérienne des bactéries commensales qui jouent un rôle important dans l’immunité des individus (Vrieze et al., 2013). Par exemple, l’utilisation à long terme des contrôles sanitaires dans les piscicultures exerce un effet notable sur la résistance aux maladies que confère le microbiote aux Poissons en affaiblissant le système immunitaire de même que la résistance à la colonisation de souches halogènes, qui sont normalement neutralisées par la synthèse de métabolites à effet bactériostatique et de molécules antimicrobiennes (Carlson et al., 2017; Nakayama et al., 2017).
En plus du stade de vie, du génotype, la diète et de la prise de médicaments, le microbiote des espèces aquatiques est également affecté par la densité, le pH, la quantité d’oxygène dissout, la température et la salinité de leur environnement (Dehler et al., 2015; Llewellyn et al., 2014; Sylvain et al., 2016; Wong et Rawls, 2012). En effet, les conditions environnementales dans lesquelles croissent les organismes aquatiques affectent grandement la composition bactérienne, par le même principe de la théorie de l’îlot intestinal. Par exemple, au sein d’une même espèce hôte, il est possible d’identifier des différences dans la composition du microbiote selon les conditions auxquelles les individus sont soumis (Lavoie et al., 2018; Webster et al., 2018; Wong et Rawls, 2012). Des études effectuées sur le Saumon atlantique visant à comparer le microbiote d’individus nés pisciculture et sauvages provenant de la même population génétique ont démontré que les conditions environnementales induisent un microbiote différent (Lavoie et al., 2018; Webster et al., 2018). Étant donné le rôle du microbiote sur la physiologie de l’hôte, de tels résultats
6
deviennent pertinents dans un contexte de conservation. En effet, un changement dans le microbiote aurait un effet notable non seulement sur ses fonctions propres, mais également en modifiant directement ou indirectement le métabolisme de l’hôte par la sécrétion de métabolites secondaires.
3. Effet à court et long terme des bactéries pionnières sur le métabolisme
Il importe de s’attarder à l’impact des bactéries acquises lors des premiers stades de vie puisque ces dernières ont des effets majeurs à court et long terme sur la physiologie de l’hôte. Des études sur l’épigénétique, terme qui définit l’ensemble des processus qui influencent le patron d’expression des gènes sans modifier les séquences d’ADN, ont démontré que la composition du microbiote modifie le patron épigénétique par le biais des métabolites sécrétés par les bactéries (Paparo et al., 2014). Par exemple, le patron de méthylation, la compaction des histones, de même que l’activité de plusieurs enzymes associées à la modification du patron épigénétique peuvent être affectées par ces métabolites (Alenghat et al., 2015; Cortese et al., 2016; Indrio et al., 2017; Krautkramer et al., 2017). La production de métabolites tels que le folate par les Lactobacillaceae ainsi que les Bifidobacteriaceae acquises chez le nourrisson auraient l’effet de modifier le patron de méthylation (Rossi et al., 2011). Il a également été démontré qu’un ratio élevé de Firmicutes/Bacteroidetes chez l’Humain modifie l’expression de gènes pro-inflammatoires, en plus d’augmenter les risques de développer le diabète de type 2 et d’altérer la catalyse des acides gras insaturés en acides gras monoinsaturés (Kumar et al., 2014; Remely et al., 2014). D’autres métabolites influenceraient également l’activité enzymatique des acétylases, désacétylases, ADN méthylases et déméthylases, toutes des enzymes associées à la régulation des patrons d’expression des gènes (Fofanova et al., 2016; Krautkramer et al., 2017). Par le biais des différentes bactéries acquises lors des premiers stades de vie, les effets de la modification du patron d’expression génétique en lien avec le phénotype du système digestif et immunitaire peuvent être visibles jusqu’à l’âge adulte (Hanley et al., 2010). Également, de nombreuses évidences indiquent que les Bactéries sont impliquées dans le processus d’imprégnation métabolique, aujourd’hui rebaptisé par le terme « programmation épigénétique », qui a lieu lors du développement d’un individu (Hanley et al., 2010; Krautkramer et al., 2017; Lucas 1991; Waterland et Garza 1999). Ce terme a été établi suite aux évidences qui associent l’environnement des premiers stades de vie, le microbiote et le profil métabolique à l’âge
7
adulte, en faisant référence aux phénomènes biologiques qui sous-tendent une relation entre les expériences nutritionnelles et toutes autres conditions qui ont un effet sur le microbiote (Waterland et Garza 1999).
Considérant le rôle substantiel que joue le microbiote sur la physiologie, le métabolisme et le développement de l’hôte, il devient alors très pertinent de parfaire nos connaissances dans le domaine de l’écologie microbienne dans un contexte de conservation des espèces menacées. En effet, des programmes de restauration de nombreuses espèces en péril ou en situation préoccupante sont mis en place afin de palier leur déclin. Toutefois, de nombreuses questions sont soulevées en ce qui a trait à l’introduction et à l’adaptation au milieu naturel d’individus provenant d’un milieu contrôlé pour restaurer les populations naturelles. C’est d’ailleurs le cas des populations de Saumon atlantique dans la Province de Québec, pour lesquelles il a été mis en évidence que le microbiote des individus nés en pisciculture est très différent de ceux nés en milieu naturel, bien que partageant la même origine génétique (Lavoie et al., 2018).
4. L’étude du microbiote chez le Saumon atlantique
4.1. Description de l’espèce à l’étude
Le Saumon atlantique, Salmo salar, est une espèce de salmonidé anadrome connue pour sa grande force et son agilité légendaire à remonter les rivières au moment de la fraie. Son mode de vie lui permet d’exploiter les milieux d’eau douce et d’eau salée, le confrontant à différentes pressions environnementales auxquelles il doit faire face et s’adapter. Le cycle de vie de S. salar débute dans les rivières, en eau douce, où les adultes se rencontrent pour la reproduction. À l’automne, les femelles fabriquent des nids dans les fonds de gravier pour loger les œufs fécondés par plusieurs mâles en compétition pour assurer la fécondation d’un nombre d’œufs maximal. Suite à la ponte, les œufs continuent leur croissance durant l’hiver pour éclore au printemps et donner naissance aux alevins. Lors des premières semaines suivant l’éclosion, les alevins puisent les réserves de leur sac vitellin. Lorsqu’il est complètement résorbé, ils amorcent l’alimentation exogène, en se nourrissant de larves d’insectes et de plancton (COSEPAC, 2010). Durant le premier été, les juvéniles sont nommés « tacons 0+ » et « tacons 1+ » pour l’été suivant et se nourrissent activement. La migration vers la mer (dévalaison) est amorcée à la deuxième ou troisième année de
8
croissance, au stade « saumoneau » ou « smolt ». À ce moment, les juvéniles subissent d’importantes modifications physiologiques leur permettant de tolérer le changement de salinité du milieu (McCormick et al., 1997; Nilsen et al., 2007). En mer, les jeunes saumons continuent de croître en s’alimentant de petits crustacés et poissons (Youngson et Hay, 1996). Après l’alimentation en mer, qui dure en moyenne de 1 à 4 ans, mais qui peut durer jusqu’à 8 ans pour certains individus, les adultes sexuellement matures retournent pour la première fois dans leur rivière natale pour s’y reproduire et se nomment « madeleineaux ». Le taux de mortalité lors de la reproduction est relativement haut au moment de la ponte (~75 %), notamment par le fait que les adultes cessent de s’alimenter dès leur entrée en rivière. Pour les survivants, un cycle de retour en mer suivi d’une autre remontée et d’une reproduction s’ensuit. (COSEPAC, 2010).
4.2. Développement du système digestif et du microbiote intestinal de S. salar
Bien que les juvéniles de Saumon atlantique entament la nutrition exogène plusieurs semaines après l’éclosion, la formation du tube digestif est déjà bien amorcée dès les premiers jours. Il est d’ailleurs possible de distinguer un tube digestif rectiligne chez les alevins vésiculés 7 jours suivant l’éclosion (Sahlmann et al., 2018). Il est important de
noter que le recrutement bactérien intestinal est également amorcé très tôt dans le développement (Lokesh et al., 2018). En effet, les bactéries pionnières sont recrutées dans
le tube digestif dès que ce dernier entre en contact avec l’environnement, durant les premiers jours de vie. Le microbiote se développe ensuite par les mêmes mécanismes proposés, soit par l’interaction entre le recrutement actif et par filtration environnementale. Lors de la maturation des juvéniles, il est également possible d’observer le développement du système digestif, où de nombreuses structures se forment de manière à segmenter le tractus digestif selon les fonctions qui y sont associées. Ces structures spécialisées sont visibles environ six semaines après l’éclosion, correspondant au moment où la résorption du sac vitellin est presque complète (Sahlmann et al., 2018).
En partant de la bouche, il est possible de distinguer l’œsophage, l’estomac, l’intestin proximal, l’intestin moyen et l’intestin distal (Sahlmann et al., 2018). Chacune des
sections détient un rôle spécifique dans la digestion et l’absorption des nutriments. Dans l’estomac, les glandes gastriques sécrètent les enzymes et les composés nécessaires à la digestion, soit l’acide hydrochlorique et les pepsines. La majorité de l’absorption des
9
nutriments se déroule dans l’intestin proximal, là où se trouve le caecum pylorique. Le caecum est caractérisé par de nombreuses extensions en forme de doigts qui augmentent la surface de contact avec les nutriments (Krogdahl et al., 2000). Où se termine le caecum
débute l’intestin moyen, suivi de l’intestin distal qui est marqué par une augmentation du diamètre du tractus digestif. La majorité de l’absorption des protéines se déroule dans l’intestin distal par endocytose.
Par ailleurs, chacune des sections du tractus gastrointestinal sont associées à des conditions spécifiques d’oxygène et de pH, se traduisant par un gradient le long du tube digestif. En effet, le pH, plus acide dans l’estomac, augmente graduellement le long du tube digestif, alors que les conditions anoxiques s’accentuent de l’œsophage jusqu’à l’intestin distal (Donaldson et al., 2015). En cartographiant les bactéries présentes dans le
tractus digestif du Saumon atlantique adulte, Gajardo (2016) a démontré que la
composition taxonomique du microbiote varie selon le segment intestinal, témoignant de la spécialisation du microbiote selon les conditions d’oxygène, de pH ainsi que l’apport en nutriments. De plus, le microbiote varie selon le type de communauté, soit la communauté adhérente (aussi appelée la communauté autochtone), constituée des bactéries colonisant la paroi intestinale, vs la communauté transitoire, constituée des bactéries non adhérentes à la paroi et associées à la diète (aussi appelée la communauté allochtone). En effet, il a été possible de noter une plus grande diversité bactérienne dans la communauté transitoire, en plus d’une abondance variable des phyla bactériens selon le type de communauté et le segment étudié. Les connaissances reliées au microbiote du Saumon atlantique sont toutefois limitées ; la cartographie du microbiote selon le segment intestinal se limite aux stades adultes, en conditions contrôlées, et visait à comparer l’effet de différentes diètes sur le microbiote. De plus, la résilience du microbiote des différents compartiments de l’intestin, potentiellement différente, se doit d’être caractérisée par une approche comparative, et notamment suite à un changement drastique de conditions environnementales (e.g. physicochimie, diète, etc.). C’est particulièrement le cas dans un contexte de restauration de populations sauvages avec l’ensemencement de poissons élevés en pisciculture. En effet, l’optimisation de la résilience du microbiote des
10
ensemencés est une avenue envisagée afin d’améliorer l’efficacité des méthodes d’ensemencement.
4.3. Adaptations locales relatives au cours d’eau
La survie jusqu’à l’âge adulte est déterminante pour la sélection des traits génétiques qui sont transmis à la progéniture de S. salar. Bien qu’il n’existe pas de sous-espèce de Saumon atlantique, plusieurs sous-populations ont développé des adaptations locales relatives au bassin versant ou une subdivision de celui-ci dans lequel les adultes effectuent la reproduction. Contrairement aux autres espèces migratrices, le flux de gène de S. salar est plutôt limité par le fait que les adultes sexuellement matures reviennent frayer dans leur rivière natale, contribuant au potentiel cumulatif des différences adaptatives des sous-populations (Garcia de Leaniz, 2006; Hendry, 2004). Par ailleurs, les études portant sur le microbiote du Saumon atlantique ont noté une adaptation de la flore microbienne relative à la géographie et à la population. En effet, il a été démontré que le microbiote varie selon le cours d’eau (Llewellyn et al., 2015; Webster et al., 2018), supportant la théorie que le microbiote est spécifique aux conditions environnementales. La répartition des populations du Québec a été divisée en seize unités désignables (UD), basées sur le cycle vital, les variables environnementales, la répartition géographique ainsi que des données génétiques (COSEPAC, 2010; Dionne et al., 2008; Garcia de Leaniz et al., 2006). La formation des sous-populations est également renforcée par la faible survie des migrants, « selection against immigrants », qui se reproduisent dans une rivière différente de leur rivière natale (Bolnik et Nosil, 2007; Hendry, 2004). Les traits génétiques, héritables, sont donc très importants chez les populations de Saumon atlantique, puisqu’ils sont associés au développement, la croissance ainsi qu’à la maturation sexuelle. Également, le succès reproducteur de l’espèce (fécondité, survie de la progéniture) ainsi que la survie en eau douce et en eau salée seraient dépendants de ces traits (Garcia de Leaniz et al., 2006). La structure génétique, par conséquent, s’avère être un facteur non négligeable pour les techniques de conservation telles que l’ensemencement (COSEPAC, 2010). En effet, des méthodes de rehaussement des stocks sont mises en œuvre afin de pallier la baisse démographique de l’espèce, dont l’aire de répartition, qui s’étend de l’Amérique du Nord jusqu’en Europe, a subi de nombreuses modifications sans précédent (COSEPAC, 2010).
11
4.4. Bilan de S. salar au Québec
Les populations de Saumon atlantique connaissent un déclin important depuis les 20 dernières années, qui leur confère le statut de « préoccupant » ou « en voie de disparition » dans les différentes régions du Québec (COSEPAC, 2010; FQSA, 2015). Son rôle économique considérable, qui intervient notamment dans le domaine de la pêche sportive, a poussé les instances gouvernementales à mettre en place plusieurs mesures de protection et de conservation afin d’assurer les activités de pêche et la pérennité de ses populations (FQSA, 2015). L’interdiction de la pêche commerciale depuis les années 2000 ainsi qu’un contrôle plus rigoureux de la pêche sportive n’ont toutefois pas permis la restauration des stocks de S. salar, qui continuent de diminuer (Cauchon, 2015; FSA, 2019). En effet, le nombre de prises déclarées en 2007 était 80 % inférieures aux vingt années précédentes. Alors que la situation semble se redresser dans certaines rivières du Québec, on note toujours une diminution globale des populations en date de 2018. En effet, le nombre de madeleineaux a connu le troisième niveau le plus bas jamais répertorié en 2018 dans le Sud du Golfe du Saint-Laurent. Au Québec, le nombre de rédibermarins a atteint 63% du seuil de conservation. Bien qu’il existe une variation du nombre de montaisons entre les madeleineaux et les rédibermarins, l’abondance pré-pêche du Saumon atlantique demeure néanmoins sous le seuil de conservation en Amérique du Nord (FSA, 2019). Puisque le contrôle de la pêche sportive ne permet pas à lui seul la restauration des stocks, l’ensemencement est également pratiqué afin d’aider à surmonter ce déclin.
4.5. La conservation de Salmo salar par l’ensemencement
Que ce soit pour la mise en valeur de la pêche sportive, la pêche de subsistance ou bien pour la restauration des populations en déclin, l'ensemencement est une méthode utilisée depuis de nombreuses années pour assurer la pérennité des espèces aquatiques. Cette méthode de conservation consiste à l’incubation d’œufs et l’élevage de juvéniles en pisciculture qui sont introduits en nature afin de compenser la baisse démographique des populations naturelles (FQSA, 2015). Puisque les individus provenant de la reproduction artificielle profitent d’un milieu stable et contrôlé, il est possible d'obtenir un nombre considérable de juvéniles pouvant être utilisés pour ensemencer un cours d'eau. Toutefois, cette méthode comporte de nombreuses limitations potentiellement responsables d’une forte mortalité des individus ensemencés par rapport aux individus sauvages. En effet, les facteurs tels que le génotype,
12
la densité, les paramètres physicochimiques de l’eau, la diète ainsi que le temps passé en pisciculture sont connus pour influencer le taux de survie en milieu naturel, et donc l'efficacité de l'ensemencement.
Tout d’abord, l’introduction de populations non locales a été reconnue pour diminuer la survie des individus ensemencés, leur succès reproducteur et affecter la structure génétique des populations (Araki et al., 2007). Ainsi, les adaptations locales très marquées de Salmo salar à son cours d’eau natal obligent les producteurs à respecter les unités de gestion. Toutefois, les individus ensemencés provenant de géniteurs sauvages locaux montraient tout de même une diminution du succès reproducteur de près de 50% par rapport aux individus sauvages, suite à leur introduction en milieu naturel (Milot et al., 2012). L’environnement lui-même induit de nombreuses modifications phénotypiques, telles que des variations dans la morphologie et le comportement des individus provenant du milieu artificiel. Les conditions environnementales en écloseries varient du milieu naturel à plusieurs niveaux, soit par une grande densité d’individus en pisciculture (Boutin et al., 2013; Hansen et Olafsen, 1999; Lavoie et al., 2018; Milot et al., 2012; Norrgad et al., 2014 Stringwell et al., 2014), l’absence de prédation et de compétition pour les ressources (Milot et al., 2012; Norrgad et al., 2014 Stringwell et al., 2014), une source d’eau qui diffère de celle de la rivière (Lavoie et al., 2018) ainsi que les mesures sanitaires telles que la décontamination des œufs et de l’eau et l’utilisation d’antibiotiques (Hansen et Olafsen, 1999). Ces différentes conditions ont donc pour effet de générer une progéniture qui n’aurait pas l’opportunité de développer une physiologie optimale pour le milieu naturel. L’effet de l’élevage en pisciculture peut être visible notamment en modifiant la morphométrie des individus captifs : au même stade de vie, les smolts nés en pisciculture montrent des différences morphologiques notables par rapport à leurs congénères sauvages, soit un indice corporel plus élevée (Poole et al., 2003), des nageoires érodées et asymétriques, un corps et une tête moins fuselés et une nageoire caudale moins épaisse (Stringwell et al., 2014). De plus, une diminution de la capacité osmorégulatoire, de même qu’un nombre plus élevé des cellules épithéliales et branchiales ont été mis en évidence chez les individus provenant de la pisciculture (Poole et al., 2003). Par conséquent, ces différences entre individus sauvages et ensemencés sont reconnues pour engendrer une plus haute mortalité des individus
13
ensemencés qui arborent des traits associés à la pisciculture (Stringwell et al., 2014). En plus des effets directement visibles de l’élevage sur la morphologie et la physiologie des individus ensemencés, les conditions de pisciculture aurait des effets à long terme sur le comportement alimentaire (Araki et al., 2008; Czerniawski et al., 2011; Jacobsen, 2001; Orlov et al., 2006), la réponse au stress, le succès reproducteur (Fleming et al., 1997), de même que sur le patron épigénétique des individus ensemencés (Le Luyer et al., 2017).
Les évidences recueillies témoignent de l’impact majeur de l’environnement associé aux premiers stades de vie sur le succès des méthodes d’ensemencement à long terme. Par exemple, le taux de mortalité des individus ensemencés est jusqu’à cinq fois plus élevé lors de la montaison (Piggins et Mills, 1995), mettant en lumière l’importance de mitiger les différences rencontrées entre les individus ensemencés et sauvages au moment de l’ensemencement. Les recommandations actuelles proposent de diminuer le temps passé en pisciculture et de se rapprocher le plus possible du milieu naturel afin d’atténuer le phénomène d’acclimatation à l’environnement d’élevage (Milot et al., 2012; Orlov et al., 2006). Parmi ces recommandations, il est proposé d’offrir de la nourriture vivante plutôt que de la moulée (Czerniawski et al., 2011), effectuer une période d’acclimatation en milieu naturel (Jonsson et al., 2001) ou incuber directement les œufs en rivière (Orlov et al., 2006), ainsi que d’encourager l’apprentissage social visant la formation des aptitudes anti prédateurs et la recherche de nourriture (Brown et Laland, 2001; Suboski et Templeton, 1989). Parallèlement, l’ensemencement d’individus au stade d’alevins vésiculés, c’est-à-dire avant leur première alimentation, pourrait également améliorer leur succès une fois introduits en nature (Milot et al., 2012; Orlov et al., 2006).
La possibilité que le faible succès soit également lié à la communauté de bactéries (le microbiote) qui vit en association avec ces derniers est également envisagée. En effet, les individus en voie d’être ensemencés montrent un microbiote très distinct de leurs congénères sauvages (Lavoie et al., 2018), différences qui sont soupçonnées d’amplifier la forte acclimatation des individus au aux conditions de pisciculture. Bien que le rôle du microbiote sur la physiologie de l'hôte soit bien connu, il importe également de comprendre dans quelle mesure la composition du microbiote des individus ensemencés peut s’adapter au
14
changement d’environnement en recrutant de nouvelles souches bactériennes suite à leur introduction en nature. En effet, plusieurs points sont à considérer lorsque des individus sont introduits en rivière. Premièrement, les études sur le microbiote de différentes populations naturelles de Saumon atlantique montrent que les différents niveaux de structuration génétique de ces populations sont corrélés à la composition taxonomique des communautés bactériennes, ces dernières étant relatives à la géographie et à l’environnement de l’hôte (Lavoie et al., 2018; Llewellyn et al., 2015; Webster et al., 2018). Or, les poissons ensemencés se retrouvent exposés à un nouvel environnement microbien tout à fait inconnu de leur système immunitaire et possèdent un microbiote qui ne possède pas nécessairement des fonctions indispensables à leur survie dans un nouveau milieu. En effet, l’ontogenèse précoce de leur microbiote s’est produite dans des conditions très différentes de celles du milieu naturel. Par ailleurs, les mesures de contrôle sanitaire en pisciculture sont reconnues pour affaiblir le microbiote des individus lors de l’élevage, favorisant l’établissement d’une dysbiose microbienne (Carlson et al., 2017; Nakayama et al., 2017), laquelle est connue pour affaiblir sa résistance à la colonisation par des souches environnementales opportunistes, voire pathogènes (Boutin et al., 2013; Iebba et al., 2016). En effet, le microbiote a la capacité de limiter l’établissement de bactéries non désirables en stimulant la production d’agents antimicrobiens et pro-inflammatoires (Buffie et Pamer, 2013). Toutefois, le stress associé à l’introduction des poissons dans un milieu très différent de la pisciculture entraine potentiellement une dysbiose du microbiote. L’exposition d’un microbiote perturbé à de nouvelles souches inconnues pourrait donc accentuer la difficulté des individus ensemencés à s’acclimater au nouvel environnement. Il n’est toutefois pas possible de déduire avec les connaissances acquises jusqu’à ce jour si le microbiote développé en pisciculture confère aux poissons ensemencés les capacités de défense suffisantes face à des souches environnementales opportunistes, ou pathogènes, du milieu naturel. De plus, la courte fenêtre de colonisation des bactéries pionnières chez les Vertébrés (Thompson et al., 2008), combinée à une résistance à la colonisation de nouvelles bactéries mis en évidence chez la souris domestique (Thompson et al., 2008; Yin et al., 2010; Zhou et al., 2019) supportent l’hypothèse selon laquelle les individus ensemencés n’auraient pas l’opportunité de recruter les bactéries potentiellement bénéfiques à leur survie suite à leur introduction en nature. Le microbiote de juvéniles de saumon a également été étudié lors de la période de
15
smoltification, lors du passage de l’eau douce à l’eau salée (Lokesh et Kiron, 2016). Les résultats ont démontré que le changement d’environnement induit une perturbation des communautés microbiennes en augmentant la diversité et l’entropie bactérienne. Néanmoins, les communautés microbiennes associées au mucus cutané ont montré une capacité d’acclimatation suite à un changement d’environnement, mais l’établissement de bactéries opportunistes était également favorisé aux dépens des bactéries commensales lors de la transition. Ces résultats suggèrent que le stress induit lors de l’évènement de l’ensemencement favoriserait l’établissement de bactéries opportunistes ou pathogènes, en plus de perturber l’équilibre du microbiote au moment de l’ensemencement, mais que les différents compartiments microbiens (mucus cutané vs intestins) seraient touchés à différents niveaux. Toutefois, les données recueillies jusqu’à présent ne permettent pas de prédire dans quelle proportion les individus ensemencés auront la capacité de recruter les bactéries provenant du milieu naturel suite à leur introduction. Il devient alors très pertinent d’évaluer en premier lieu si les conditions d’élevage associées aux premiers stades de vie auront un effet notable sur la composition du microbiote à long terme. Ainsi, une étude plus approfondie de ce dernier dans un contexte d’ensemencement s’avère très appropriée, considérant 1) que les conditions d’élevage sont très différentes du milieu naturel (Boutin et al., 2013; Hansen et Olafsen, 1999; Lavoie et al., 2018; Milot et al., 2012; Norrgad et al., 2014 Stringwell et al., 2014), 2) que le microbiote des juvéniles de S. salar élevés en pisciculture est très différent des individus sauvages (Lavoie et al., 2018) et 3) que les conditions associées aux premiers stades de vie sont déterminantes sur la physiologie et le microbiote de l’hôte jusqu’à l’âge adulte (Bhat et Kapila, 2017; Cortese et al., 2016; Indrio et al., 2017; Hooper et al., 2001; Miller et al., 2016; Mueller et al., 2017; Rossi et al., 2011).
5. Objectifs et hypothèses
Depuis 2015, deux populations de Saumon atlantique, provenant de la rivière Romaine et son affluent, la rivière Puyjalon, situées sur la Côte-Nord de Québec, font partie d’un programme de conservation afin de restaurer leur effectif (HQ, 2016). Des œufs sont produits au Laboratoire Régional en Sciences Aquatiques (LARSA) et élevés jusqu’au stade d’alevins vésiculés, qui sont ensuite introduits en milieu naturel. Au LARSA, les œufs verts sont traités à l’iode à des fins de désinfection, immédiatement après la fécondation artificielle. L’eau est
16
également traitée et désinfectée, dans un système fermé. Ce projet avait donc comme objectif de déterminer l’effet de cette méthode d’élevage sur le potentiel d’acclimatation du microbiote de S. salar, en utilisant comme population de référence des individus sauvages provenant de la rivière Puyjalon. En posant comme hypothèse que le microbiote cutané et le microbiote intestinal sont fortement liés aux conditions auxquelles le Saumon est soumis lors de ses premiers stades de vie, le projet avait pour objectif de mesurer le niveau de
différenciation entre le microbiote d’individus sauvages et ensemencés en milieu naturel, deux mois après l’ensemencement.
Plus précisément, cet objectif avait pour but de déterminer si les individus ensemencés sont en mesure de recruter les bactéries bénéfiques provenant du milieu naturel et de déterminer si l’environnement d’origine influence la composition bactérienne à long terme. Dans le but d’obtenir une caractérisation détaillée du microbiote, nous avons récolté des échantillons de mucus cutané et les différents segments intestinaux ont été décomposés selon la description de Sahlmann (2015) : intestin proximal (IP), intestin médian (IM) et intestin distal (ID). De plus, puisque le microbiote du saumon varie de manière significative selon le type de communauté (adhérente vs transitoire) (Gajardo et al., 2016), les fèces ont été séparées de leurs segments homologues. Cette méthode a permis de cartographier de manière approfondie le microbiote allochtone (communauté transitoire) et autochtone (communauté adhérente) provenant de populations sauvages et ensemencées, en plus d’évaluer la résilience du microbiote selon le compartiment biologique et la section intestinale (Sylvain et al., 2016). Afin de d’évaluer si des différences de composition du microbiote intestinal entre les individus ensemencés et sauvages pourraient provenir d’une diète différente, nous avons également caractérisé les contenus stomacaux. De cette manière, il a été possible de déterminer si les différences observées dans le microbiote intestinal seraient attribuables aux proies consommées ou bien à l’origine des tacons.
Sommairement, le microbiote et le contenu stomacal ont été caractérisés à la suite de l’amplification et du séquençage du biomarqueur bactérien de référence, la sous-unité 16S du gène de l’ARN ribosomique et d’un marqueur eucaryote, le gène mitochondrial de la cytochrome oxydase I (COI). L’approche statistique utilisée faisait intervenir les analyses
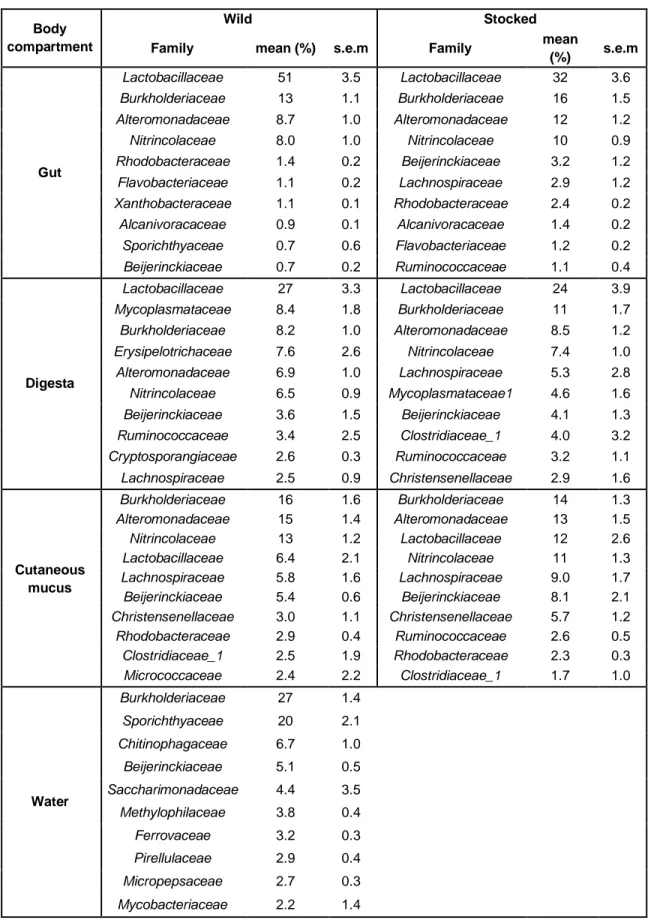
17
classiques en écologie microbienne dans le but d’offrir une vue détaillée sur la composition (diversité et structure) des microbiotes, incluant le cœur microbien, leur profil fonctionnel ainsi que l’état de stabilité de la communauté bactérienne des échantillons récoltés. La composition bactérienne a été décrite selon les 10 familles les plus abondantes de chaque groupe et en comparant la composition bactérienne selon les distances UniFrac pondérées et non pondérées. Les indices de Shannon et Chao1 furent privilégiés dans l’analyse de la diversité bactérienne. Également, le cœur microbien des individus ensemencés et sauvages a été comparé en effectuant une analyse de la variance (ANOVA) sur l’abondance des bactéries présentes chez les deux groupes. De plus, l’inférence fonctionnelle effectuée à l’aide de l’outil en ligne METAGENassist a permis d’évaluer le potentiel fonctionnel des communautés bactériennes à l’aide du profil taxonomique de chaque groupe à l’étude. Une approche d’analyse en réseaux fut également utilisée afin d’évaluer le potentiel de résilience des communautés bactériennes en calculant les indices de corrélation de Spearman pour les bactéries de chaque groupe. En effet, cette approche peut être utilisée pour comparer la capacité de résilience des communautés microbiennes des individus sauvages et ensemencés. Dans ce type d’analyse, une communauté plus résiliente est définie par un réseau d’interactions plus dense (plus de nœuds et une plus grande connectivité) qu’une communauté instable et immature (Ponisio et al., 2019).
En caractérisant le microbiote d’individus ensemencés et sauvages, ce projet a généré de nouvelles connaissances dans le domaine des méthodes de conservation actuelles. En effet, il a été possible d’identifier l’effet à long terme de l’élevage sur le microbiote intestinal par une différence de composition des individus ensemencés en comparaison aux individus sauvages. Ces résultats sont non négligeables pour les avancées des connaissances en écologie microbienne, puisqu’ils supportent l’hypothèse que l’environnement associé aux premiers stades de vie est déterminant pour la composition taxonomique et fonctionnelle du microbiote à long terme.
18
Chapitre 1 : Artificial rearing of Atlantic salmon
juveniles for supportive breeding programs induces
permanent effects on the microbiota after stocking
Camille Lavoie1,2, Aurélie Boilard1,2, Laurence Auger1,2, Kyle Wellband1,2, Alysse Perreault1,2, Louis Bernatchez1,2 et Nicolas Derome1,2
1
Institut de Biologie Intégrative et des Systèmes (IBIS), Laval University
2
Biology Department, Laval University
1.1 Résumé
Les bactéries pionnières, la physiologie de l’hôte et l’environnement initial affectent la colonisation des souches bactériennes à long terme. Notre hypothèse était que l’élevage du Saumon atlantique en milieu contrôlé aurait un effet visible suite à l’introduction en milieu naturel des juvéniles ensemencés pour les programmes de restauration du Saumon atlantique. La comparaison du microbiote d’individus ensemencés et sauvages, deux mois après l’ensemencement, a montré que la composition du microbiote dépend de l’origine (sauvage ou ensemencé). Les bactéries du genre Pediococcus prédominaient dans le microbiote des individus sauvages, alors que le microbiote des ensemencés était caractérisé par une plus grande diversité et une moindre connectivité. Nos résultats suggèrent une résistance à la colonisation de bactéries sauvages induite par l’élevage en pisciculture et supportent l’implémentation des notions d’écologie microbienne pour améliorer les méthodes de conservation actuelles.
1.2 Abstract
Pioneering bacterial communities, host physiology and initial environmental conditions affect the colonization of bacterial strains later in life. In this study, we hypothesized that the artificial rearing of Atlantic salmon had a permanent effect on the microbiota of artificially produced parrs introduced into the wild for supportive breeding programs. The comparison of the microbiota of stocked and wild parrs from the same genetic population indicated that the microbiota composition was dependent on the origin of the parrs. Stocked parrs’ microbiota was characterized by a diminution of the genus Pediococcus, a higher diversity and a lower connectivity compared to wild parrs. Altogether, our results suggest an impairment colonization of wild bacteria and a higher instability for stocked parrs’ microbiota associated with artificial rearing. This study is the first demonstrating the long-term effect of artificial rearing and support the implementation of microbial ecology of Atlantic salmon in rearing methods.
19
Introduction
It is now well established that host-associated microbes play an essential role for the development of immune, digestive and metabolic functions a substantial number, if not every living organism on earth. Moreover, early life associated bacteria particularly influence host physiology and gene expression through the epigenetic modification patterns and the first colonizing bacteria would have a tremendous long-term contribution on the metabolism of the host (1, 2, 3, 4). The first Bacteria and other microorganisms to colonize every body surfaces are either transmitted vertically, by the mother (5, 6, 7, 8, 9), or horizontally, by the environment (5, 10, 11, 12, 13). The latter is especially true for aquatic species hatching from eggs, since they are surrounded by water’s microbial communities. The microbiota ontogeny is influenced by biotic (host genotype [14, 15, 16, 17, 18], life stage cycle [19, 20], population density [13, 21, 23] and diet [9, 22, 24, 25, 26, 27]) and abiotic factors (water chemistry, temperature, and xenobiotics including antibiotics [13, 21, 23, 28, 29]). Given that pioneering microbiota exerts a significant impact on the host genetic expression regulation during the early life stages, it would be expected that exposure to different abiotic factors associated with rearing conditions would translate into distinct physiological phenotypes (22, 30). Therefore, microbial ecology studies are relevant in the context of supportive breeding programs for endangered population of species such as Atlantic salmon (Salmo salar), where stocked individuals are raised in captivity. For instance, the demographic decline of S. salar populations in the Province of Quebec, Canada, led to the implementation of governmental restoration programs such as artificial supplementation (31), which consists of incubating eggs and raising juveniles in a controlled environment and introducing them in nature, mostly at the parrs life stage (32). In order to preserve the genetic structure of the highly adapted salmon populations (33), introduced juveniles are generated from wild breeders caught in the targeted river. Nevertheless, acclimation to hatchery conditions causes an overall reduced fitness of stocked fishes compared to wild ones (34, 35, 36, 37). Noticeable discrepancies have been reported in gut microbiota composition between wild and hatchery raised juveniles destined for stocking (30). Captive juvenile microbiotas were enriched with lactic acid bacteria but lacking in key strains found in their wild counterparts. The extent of the alternative microbiota occurring in hatcheries suggests that the physiology of juveniles might be affected by their microbiota
20
prior to their introduction into the river (30), which in turn may confer a disadvantage after their release into the wild environment.
However, it is still unclear whether the microbiota of stocked fishes persists different and would affect the host physiology after stocking. Previous studies reported a modification of the microbiota following the introduction of a new diet in fishes (22, 38), but few studies have documented the fate of the microbiota when the host is exposed to a new environment. A study conducted on the microbiota during the smoltification process showed that microbial equilibrium is disrupted when the host undergoes a drastic change in environment (39). In fish, the reshaping of the microbiota composition also occurred after a stress induced disruption, indicating that microbiota can adapt to a new environment by modifying its functional and taxonomic profile to its new requirements (40). In addition, early bacterial communities, host physiology and environmental filtering have been reported to affect the colonization process later in life (41, 42, 43). This finding led to our hypothesis that stocked parrs microbiota would be maladapted due to irreversible priority effects during early ontogeny in hatchery, preventing them from recruiting key wild bacteria after stocking into the river.
Here, we report the first study assessing the long terms effects of the early life associated environment on microbiota composition by comparing the microbiota of stocked and wild parrs two months after stocking, where stocked parrs were introduced in nature as unfed fry (still with their yolk sac attached). Based on both neutral and deterministic processes that shape the sequential recruitment of bacterial community in fishes (10, 41) and on the partial plasticity of the gut microbiome following changes in diet or environment (22, 38, 39), we predicted that stocked parrs microbiota will show different patterns in terms of composition and structure compared to wild parrs, and changes would differ by body compartments (23, 40, 44). We characterized the microbiota taxonomic composition from cutaneous mucus, intestinal tract (i.e. the gut) and intestinal content (i.e. the digesta) samples of wild and stocked parrs. Three different intestinal segments (anterior, median and posterior segments) were targeted separately (26, 46). Overall, the most salient taxonomical and functional differences between stocked and wild parrs originating from the same genetic population
21
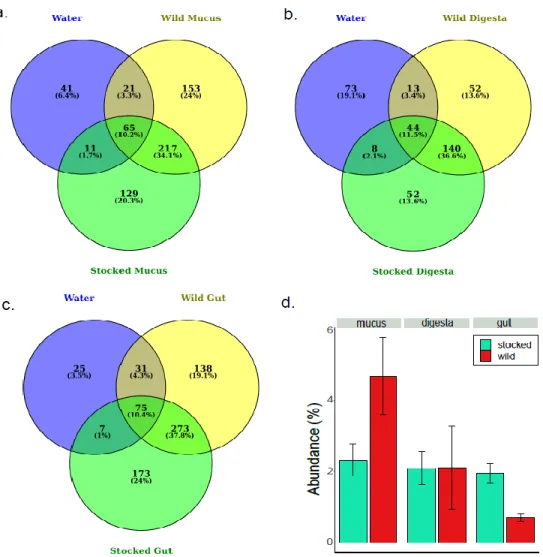
were identified in gut microbiota. Specific tissue responses were also identified, with cutaneous mucus tissue the least resilient compartment, as opposed to the adherent and transient gut communities that were significantly different between captive and wild parrs. Neither host genetic diversity nor stomach contents were found to be associated with microbiota differences between stocked and wild parrs.
Materials and methods
Sample collection and preparationStocked parrs originated from the artificial spawning of wild breeders that were captured in the Puyjalon river and kept in captivity in the LAboratoire Régional en Sciences Aquatiques (LARSA) of Laval University (Quebec, Canada) for a period ranging from 1 to 2 years before spawning. The spawning took place during the autumn of 2015. The progeny hatched between March 21 and May 30th, 2016, and unfed fry (still with their yolk sac attached) were kept in incubators until stocking in the Puyjalon river of unfed fry, between July 24th and 29th. Between September 23th and September 29th of 2016, 93 parrs were sampled in Puyjalon river (50.39 57 63, -63.42 52 22 to 50.41 67 66, -63.44 56 73), Quebec, Canada by electrofishing and dragnet fishing. Environmental bacterial community composition was characterized by sampling one liter of water collected using sterilizes Nalgene bottles from Puyjalon river. Samples were collected in triplicate, one meter below the surface. Water was filtered with peristaltic filtration equipment (Cole Parmer, ThermofisherScientific – Illinois USA) through a combination of 3.0 µm (to exclude suspended material and larger eukaryotic cells) and 0.22 µm (to collect bacteria community) sterile nitrocellulose membranes. Collection of fish tissue samples occurred as follow: Parrs were euthanized using the physical method called “flick” (35), cutaneous mucus was collected with sterile cell scrapper and stored in sterile Eppendorf microtube, caudal fin were clipped and conserved in 95% ethanol solution for genotyping and fishes were flash frozen in the field using flaked dried ice and stored in a -80 °C freezer until dissection. For each sample, stomach contents, gut and feces from anterior, median and posterior segments of the intestinal tract were aseptically collected (Supporting Informations, Fig. S1). The partition of the gut and the feces allowed the separated analysis of the bacteria associated with the intestinal mucosa (i.e. bacteria