Design, synthèse et étude-structure activité des
bactériocines synthétiques pour l’utilisation dans les
secteurs alimentaire, vétérinaire et médical
Thèse
François Bédard
Doctorat en sciences pharmaceutiques
Philosophiae doctor (Ph.D.)
Faculté de pharmacie
Faculté des sciences de l’agriculture et de l’alimentation
Québec, Canada
Design, synthèse et étude-structure activité des
bactériocines synthétiques pour l’utilisation dans les
secteurs alimentaire, vétérinaire et médical
Thèse
François Bédard
Sous la direction de :
Éric Biron, directeur de recherche
Ismail Fliss, codirecteur de recherche
Résumé
La résistance aux antibiotiques est devenue un problème majeur dans la prévention et le traitement des infections bactériennes. Comme elles démontrent des activités inhibitrices in vitro contre un grand nombre de bactéries pathogènes cliniquement importantes, les bactériocines sont de plus en plus considérées comme une alternative potentielle aux antibiotiques conventionnels. Malgré cet énorme potentiel, leur utilisation est grandement limitée par les coûts élevés associés à leur production par fermentation. La synthèse chimique de ces dernières a été envisagée, mais aucune approche n’a donné jusqu’à maintenant un rendement qui puisse faire diminuer significativement les coûts de production. Dans le but de développer une voie de synthèse efficace pour ces peptides antibactériens, nous avons utilisé comme modèle la pédiocine PA-1, une bactériocine de classe IIa avec une activité anti-Listeria. L’optimisation de l’approche synthétique nous a permis d’augmenter les rendements de 1% à 45% et de concevoir des analogues avec des propriétés pharmacologiques améliorées comme une plus grande résistance à l’oxydation et à la lyse enzymatique. Cette importante réalisation nous a non seulement permis de produire la bactériocine en grande quantité, mais aussi déterminer sa structure tridimensionnelle et d’évaluer son impact sur le microbiote au niveau du tractus gastro-intestinal humain. L’approche développée s’est également avérée efficace pour la production d’autres bactériocines de la classe II comme la bactofencine A et permet de cibler davantage de pathogènes qu’on retrouve dans les différents secteurs alimentaire, vétérinaire et médical. En plus de décrire la synthèse et les études structure-activité de la bactofencine A, cet ouvrage présente les stratégies utilisées pour produire et déterminer la structure de la pédiocine PA-1 ainsi que les études sur son activité antimicrobienne et ses effets sur le microbiote dans le tractus gastro-intestinal.
Abstract
Antibiotic resistance has become a major problem in the prevention and treatment of bacterial infections. As they demonstrate in vitro inhibitory activities against a large number of clinically important pathogenic bacteria, bacteriocins are increasingly seen as a potential alternative to conventional antibiotics. Despite this enormous potential, their use is greatly limited by the high costs associated with their production by fermentation. The chemical synthesis of the latter has been considered, but no approach has yielded so far a yield that can significantly reduce production costs. In order to develop an efficient synthetic route for these antibacterial peptides, we used as model the pediocin PA-1, a class IIa bacteriocin with anti-Listeria activity. Optimization of the synthetic approach allowed us to increase yields by 1% to 45% and to design analogues with improved pharmacological properties such as greater resistance to oxidation and enzymatic lysis. This important achievement allowed us to not only produce bacteriocin in large quantities but also to determine its three-dimensional structure and to evaluate its impact on the microbiota in the human gastrointestinal tract. The approach developed has also been shown to be effective for the production of other class II bacteriocins such as Bactofencin A and allows targeting more pathogens found in the different food, veterinary and medical sectors. In addition to describing the synthesis and structure-activity studies of Bactofencin A, this book presents the strategies used to produce and determine the structure of pediocin PA-1 as well as studies on its antimicrobial activity and its effects on microbiota. the gastrointestinal tract.
Table des matières
Résumé ...iii
Abstract... iv
Table des matières ... v
Liste des figures ... ix
Liste des tableaux ... xiv
Liste des abbréviations ... xv
Remerciements ... xviii
Avant-propos ... xx
Introduction ... 1
1. Les bactériocines et leur potentiel ... 3
2. La classe IIa et les pédiocines ... 6
3. Ingénierie des bactériocines ... 10
4. Cytotoxicité des bactériocines et processus réglementaire ... 10
Chapitre 1 : Récents progrès dans la synthèse chimique des bactériocines de classe II et S-glycosylées ... 13
Résumé ... 15
Abstract... 17
1. Introduction ... 18
2. General chemical synthesis strategies ... 20
3. Synthesis of Class II bacteriocins ... 23
3.1 Class IIa bacteriocins ... 24
3.2 Class IIb bacteriocins ... 30
3.3 Class IIc bacteriocins ... 30
3.4 Class IId bacteriocins ... 36
4. Synthesis of S-glycosylated bacteriocins ... 36
5. Conclusion and future perspectives ... 43
6. Conflict of Interest... 44
7. Acknowledgments... 44
8. References ... 44
Chapitre 2 : Hypothèse de travail et objectifs ... 53
2. Hypothèses de travail... 57
3. Objectifs ... 58
Chapitre 3 : Synthèse, activité antimicrobienne et analyse conformationnelle de la bactériocine de classe IIa Pédiocine PA-1 et de ses analogues... 61
Résumé ... 64
Abstract... 66
1. Introduction ... 67
2. Results ... 69
2.1 Total synthesis of pediocin PA-1 and analogues. ... 69
2.2 Antimicrobial activity of pediocin PA-1 and its analogues. ... 73
2.3 Spectrum of activity of pediocin PA-1 analog 4. ... 75
2.4 Conformational studies by circular dichroism. ... 76
2.5 NMR spectroscopy and structure analysis. ... 77
3. Discussion ... 81
4. Methods ... 85
4.1 Materials and methods. ... 85
4.2 Peptide synthesis. ... 86
4.3 Disulfide bond formation. ... 87
4.4 Selective methionine reduction. ... 87
4.5 Antimicrobial assays. ... 87
4.6 Phylogenetic analysis. ... 88
4.7 Circular dichroism. ... 88
4.8 NMR spectroscopy. ... 89
4.9 Modeling and structure simulations. ... 89
5. Acknowledgements ... 90
6. Additional information ... 90
7. Competing interests ... 90
8. References ... 91
9. Supporting Information ... 97
Chapitre 4 : Étude de la pédiocine PA-1 sur l’équilibre du microbiote dans le tractus gastro-intestinal humain ... 123
1. Introduction ... 125
2. Hypothèses et objectifs ... 126
2.2 Hypothèses de travail ... 126
2.3 Objectifs ... 127
3. Matériel et méthodes ... 127
3.1 Synthèse des bactériocines artificielles ... 127
3.2 Utilisation de la pédiocine PA-1 dans une matrice alimentaire ... 129
3.3 Expérience en polyfermenteurs ... 130
3.4 Traitement des échantillons et extractions d’ADN ... 133
3.5 Bio-informatique ... 136
4. Résultats et discussion ... 137
4.1 Synthèse des analogues ... 137
4.2 Activité antimicrobienne des analogues modifiés ... 138
4.3 Activité de la pédiocine PA-1 M31L dans une matrice alimentaire ... 139
4.4 Fermentation colique ... 140
4.5 Analyses génétiques ... 142
4.6 Analyses bio-informatiques du séquençage ... 143
5. Conclusion ... 150
Chapitre 5 : Études structure-activité de la bactériocine Bactofencine a et de son interaction avec la membrane bactérienne ... 151
Résumé ... 153
Abstract... 155
1. Introduction ... 156
2. Material and Methods ... 158
2.1 Peptide synthesis... 158
2.2 Antimicrobial assays ... 159
2.3 Molecular dynamics ... 160
3. Results ... 161
3.1 Synthesis of bactofencin A and analogues thereof ... 161
3.2 Antimicrobial Activity ... 163
3.3 Cross-resistance with antibiotic-resistant strains ... 164
3.4 Structure-Activity Relationships ... 165
3.5 Bioinformatic analysis and membrane interaction studies ... 166
4. Conclusion ... 172
6. Funding Sources ... 172
7. Acknowledgment ... 173
8. Abbreviations ... 173
9. References ... 173
10. Supporting Information ... 178
Chapitre 6 : Discussion générale et conclusion ... 203
Liste des figures
IntroductionFigure 1. L'alignement des séquences des bactériocines matures de la classe IIa. Les
cystéines soulignées forment des ponts disulfures.42 ... 6
Figure 2. Structure tridimensionnelle à l’intérieur de micelles déterminée par RMN de la
Sakacine P en bleu avec le pont disulfure en jaune. La partie N-terminale très conservée comportant la « pediocin box », un pont disulfure et un feuillet β, ainsi qu’une hélice α en C-terminal qui serait responsable de l’activité en s’insérant dans les membranes.3 PDB:1OG7
... 7
Figure 3. Schéma représentatif théorique de la structure des bactériocines de classe IIa dans la membrane lipidique.2 ... 8
Figure 4. Représentation schématique du mode d'action proposé pour la classe IIa des bactériocines. La bactériocine utilise les sous-unités IIC et IID de la mannose phosphotransférase comme récepteur sur les cellules cibles. Après la liaison, la bactériocine liée déclenche la perméabilisation de la membrane.1 ... 9
Chapitre 1
Figure 1. Solid-phase peptide synthesis strategies. (A) Stepwise synthesis using the Fmoc/tBu or Boc/Bzl strategy and (B) Convergent synthesis. ... 23
Figure 2. Synthesis of leucocin A using native chemical ligation. (A) Leucocin A sequence
showing the selected ligation site and identification of the fragments. (B) Assembly of the N- and C-terminal fragments by Fmoc-SPPS, native chemical ligation and oxidative cyclization (Bodapati et al., 2013). ... 28
Figure 3. Synthesis of circular bacteriocins using the butelase chemoenzymatic approach.
(A) Sequences and selected macrocyclization sites. (B) Preparation of the linear precursor and butelase-mediated macrocyclization (Hemu et al., 2016). ... 32
Figure 4. Synthesis of a homoserine-mutant of the circular bacteriocin AS-48 by sequential
KAHA ligation and macrocyclization. (A) Sequence of AS-48 showing the selected ligation and macrocyclization sites and composition of the fragments. (B) Preparation of the N- and C-terminal fragments and circular bacteriocin synthesis by KAHA ligation and macrocyclization (Rohrbacher et al., 2017). h* = homoserine ... 35
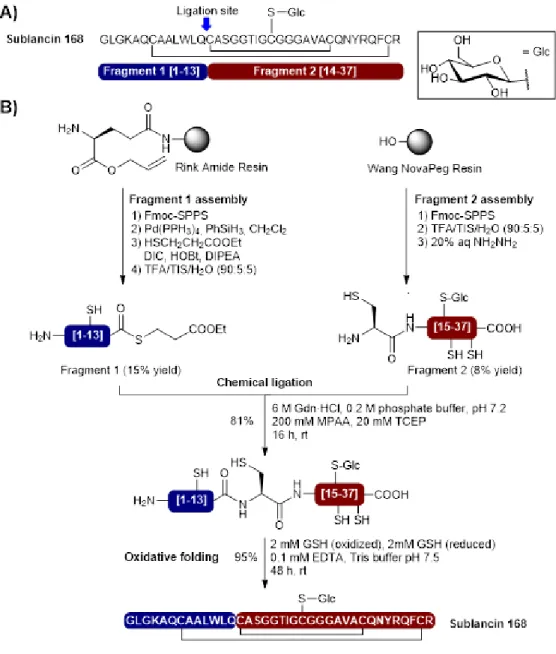
Figure 5. Synthesis of sublancin 168 by a convergent native chemical ligation approach. (A)
Sequence of sublancin 168 showing the selected ligation site and composition of the fragments. (B) Preparation of the N- and C-terminal fragments and bacteriocin synthesis by native chemical ligation and oxidative folding (Hsieh et al., 2012). ... 39
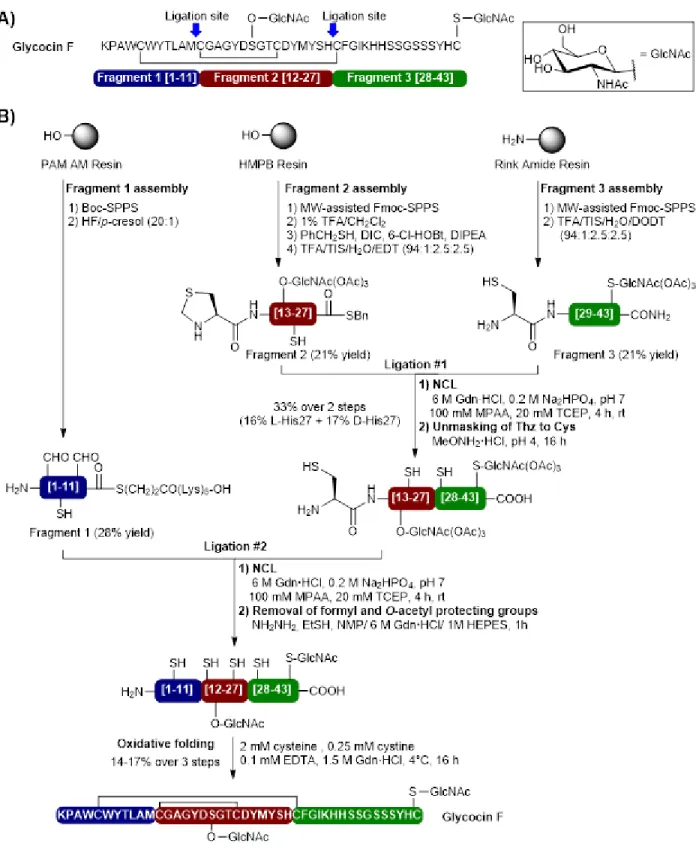
Figure 6. Synthesis of glycocin F by a convergent native chemical ligation approach. (A)
Sequence of glycocin F showing the selected ligation sites and composition of the fragments. (B) Preparation of the three fragments and bacteriocin synthesis by sequential native chemical ligation and oxidative folding (Brimble et al., 2015). ... 42
Chapitre 3
Figure 1. Synthesis of pediocin PA-1 and its analogues. ... 70
Figure 2. HPLC and ESI-MS profiles of (a) crude oxidized pediocin PA-1 2a-c (overlaid
HPLC traces of purified compounds are shown in the inset) and (b) purified pediocin PA-1
3c (overlaid HPLC traces of purified 3a, 3b and 3c are shown in the inset). (c) MALDI-TOF
MS spectrum of synthetic pediocin PA-1 3c. ... 72
Figure 3. Antimicrobial activity of natural pediocin PA-1 produced by P. acidilactici UL5 and
synthesized peptides 1, 2c, 3a-c, 4 and 5 against L. monocytogenes ATCC 19111 in soft agar TSBYE medium (a-e). Inhibition zone diameters (mm) were respectively 32, 14, 24, 27, 31, 31 and 34. Volume of UL5 culture supernatant or solution of synthetic compound (1 mg/mL) placed in agar wells was 75 µL. ... 73
Figure 4. Circular dichroism spectra of synthetic pediocin PA-1 3c and its analogues 1, 2c
and 6. (a) 3c (left) and 5 (right) in various percentages of TFE and (b) 1, 2c, 3c, and 6 in DMPC (left) and DMPG (right) vesicles with a peptide/lipid ratio of 1/100. ... 77
Figure 5. (a) and (b) NMR lowest relative energy structure (α-helix red, β-sheet yellow, loops
green and disulfide bridge orange) of synthetic pediocin PA-1 M31L analog 5 obtained from chemical shifts (H2O/TFE-d2 (1:1, v/v) at 313 K) and sequence with CS-Rosetta. (c) 10
lowest energy structures aligned with the helix (T23 to T35) in cross-eyed view. (d) Close-up of the interaction between the N-terminal β-turn and the C-terminal 310 helix. COHis38
-NHAsn41 2.0 Å; COHis12-NHGln39 2.4 Å; COLys11-NHGly40 2.6 Å. PDB entry: 5UKZ... 80
Figure S1. HPLC profiles (λ = 220 nm) and ESI-MS spectra of purified linear pediocin PA-1
1 and crude oxidized pediocin PA-1 2a-c. ... 98
Figure S2. HPLC profiles (λ = 220 nm) and ESI-MS spectra of purified oxidized pediocin
PA-1 analogs 2a, 2b and 2c. ... 99
Figure S3. HPLC profiles (λ = 220 nm) and ESI-MS spectra of purified pediocin PA-1 3c
and its analogues 3a and 3b. ... 99
Figure S4. MALDI TOF MS/MS spectra of fragments obtained after treatment of
S-acetamidomethylated synthetic pediocin-PA-1 3c with trypsin. ... 101
Figure S5. LC-MS/MS analysis of crude synthetic pediocin-PA-1 3. ... 103
Figure S6. HPLC profiles (λ = 220 nm) and ESI-MS spectra of purified pediocin PA-1
analogues 4, 5, and 6. ... 105
Figure S7. Agar diffusion assay of the linear pediocin PA-1 M31L analog 4 against sensitive
strains. Inhibition diameter for analog 4, supernatant of Pediococcus acidilactici UL5, and supernatant of Lactococcus lactis subsp. lactis ATCC 11454, respectively: A) 28 mm, 18 mm, 12 mm; B) 35 mm, 28 mm, 16 mm; C) 32 mm, 23 mm, 25 mm; D) 35 mm, 21 mm, 14 mm; E) 23 mm, 17 mm, 18 mm; F) 25 mm, 19 mm, 0 mm. ... 107
Figure S8. Circular dichroism spectra of analogs 1, 2c, 3a-c and 6 in water and aqueous
TFE solutions (% of TFE in water is shown). ... 108
Figure S9. 1H NMR spectrum of pediocin PA-1 M31L (analog 5) at 313 K in H
2O/TFE-d2
(1:1) containing 0.1% TFA. ... 109
Figure S10. Superposed 2D NMR TOCSY (black) and NOESY (blue) spectra of pediocin
PA-1 M31L (analog 5) at 313 K in H2O/TFE-d2 (1:1) containing 0.1% TFA. ... 110
Figure S11. Energy/RMSD plots showing the convergence of the 5000 lowest RMSD
structures of pediocin PA-1 M31L (analog 5). ... 111
Figure S12. Energy/RMSD plots obtained for the 5000 structures calculated using pediocin
PA-1 M31L (analog 5) chemical shifts and the two non-natural disulfide bond pairings A) Cys9-Cys24 and B) Cys14-Cys44. ... 112
Figure S13. Chemical shift deviation (CSD) of the Hα of pediocin PA-1 M31L (analog 5) in
H2O/TFE-d2 (1:1)... 113
Figure S14. Ramachadran plot (Molprobity) for 10 lowest energy structures of pediocin
PA-1 M3PA-1L (analog 5) obtained from CS-Rosetta. Structure verification showed 9PA-1.2% most favoured, 8.8% additionally allowed, 0.0% generously allowed, 0.0% disallowed regions. A) general, B) isoleucine and valine, C) glycine. ... 114
Figure S15. Cα RMSD per residue from α-helix aligned structures for pediocin PA-1 M31L
(analog 5). ... 115
Chapitre 4
Figure 1. Schéma de protection des N- et C-terminaux de peptides par acétylation et
amidation. ... 128
Figure 2. Structure des différents ancrages utilisés pour accrocher les analogues
peptidiques sur un support solide dans ce chapitre. ... 129
Figure 3. Représentation d’un dénombrement bactérien. ... 130 Figure 4. Model de polyfermenteur basé sur le PolyFermS.29... 131
Figure 5. Représentation schématique de l’expérience de fermentation en jours. IB =
immobilisation des billes, FM = fermenteur mère, FF = fermenteur fille. ... 132
Figure 6. Schéma de la liaison covalente du PMA à l’ADN sous l’effet de la lumière.30 .. 133
Figure 7. 1 µL d’un échantillon d’ADN pur est mesuré à 260/280 nm sur un
spectrophotomètre NanoDrop®. ... 136
Figure 8. Structures primaires des peptides testés dans ce chapitre. ... 137
Figure 9. Test d’activité des analogues de la pédiocine PA-1 M31L contre L.
monocytogenes ATCC 19111 pour les peptides 4, 7 et 8. A) Diffusion sur gélose de 75 µL d’une concentration de 1 mg/mL des peptides. B) Concentrations minimales inhibitrices (CMI) des peptides. ... 138
Figure 10. Dénombrement bactérien de Listeria monocytogenes ATCC 19111 dans le lait
écrémé (UFC/mL) toutes les deux heures pendant 12 h, puis à 24 et 48 h après l’ajout de la pédiocine PA-1 M31L (4).... 140
Figure 11. Adaptateurs en nylon (A) et en PETG (B) réalisés par impression 3D pour relier
le fermenteur mère aux fermenteurs filles, ainsi que le montage final des fermenteurs (C). ... 141
Figure 12. Graphique d’amplification par qPCR de l’ADN à l’aide des amorces pour
Bacteroides (A, B, C et D) et Enteroccocus (E, F, G et H) pour les échantillons de
stabilisation (A et E), et de T0-4h (B et F), T6-10h (C et G) et T12-48h (D et H) suite à l’ajout seul de la L. monocytogenes dans un fermenteur fille. Le CT est établi à 0,2. ... 143
Figure 13. Courbes de raréfaction basées sur le séquençage à haut débit Illumina MiSeq®
de tous les échantillons prélevés au cours de la fermentation colique. Les OTUs ont été définis par 3% de distance. ... 144
Figure 14. Diagramme de Venn montrant le chevauchement des OTUs pour les échantillons A) du fermenteur mère (FM) et des échantillons pour les expériences avec l’érythromycine
et la pédiocine PA-1 M31L (PA-1 M31L), ainsi que le blanc après l’ajout de la L.
monocytogenes ATCC 19111 à T0h. B) Comprend les mêmes échantillons que A, à la
différence que les échantillons ont été prélevés à T6h. ... 145
Figure 15. Dénombrement total Listeria provenant des échantillons en fermentation colique
pour T0-12, 24 et 48 h pour le blanc (gris), l’ajout seul de L. monocytogenes (bleu), l’ajout de L. monocytogenes ATCC 19111 et de l’érythromycine (orange) ou de la pédiocine PA-1 (rouge). ... 147
Figure 16. Compositions taxonomiques des communautés bactériennes des échantillons
extrait du séquençage Illumina-MiSeq contenant l’ajout de L. monocytogenes seul (bleu) et l’ajout d’érythromycine (rouge) ou de pédiocine PA-1 M31L (vert) à 0 (A), 2 (B), 6 (C), 12 (D) et 48 h (E). ... 149
Chapitre 5
Figure 1. Antimicrobial activity of the synthetic bactofencin A 2 and its analogs 1, 3-6 against
(A) S. aureus ATCC 6538 in soft agar MH medium and (B) L. monocytogenes ATCC 19111 in soft agar TSBYE medium with a 75 µL solution containing 1 mg/mL of peptide. Inhibition zone diameters (mm) were respectively 13, 13, 13, 13, 12 and 12 for S. aureus and 14, 14, 15, 15, 16 and 16 for L. monocytogenes. ... 163
Figure 2. Relative growth inhibition of bactofencin A analogs from the ala-scan against S.
aureus ATCC 6538 in MH broth. The MICs are compared to peptide 5 and reported as %
(peptide 5 = 100%). ... 166
Figure 3. Structure of the in silico generated cyclic bactofencin A analog 6. ... 167
Figure 4. Equilibrium properties of the generated S. aureus membrane. (A) Electron density
profile (black, total electron density; blue, water; grey, lipids; green, DPPG; red, DPPGK; yellow, PMCL2; pink, Lys-tail DPPGK; brown, phosphates; teal, CH3). (B) Area per chain for
(dashed) chains. (D) Top- and side-view snapshots of the generated membrane (DPPG, green; DPPGK, red; PMCL, blue). ... 169
Figure 5. In silico simulation of the interaction of bactofencin A analog 6 with S. aureus
membrane. (A) Snapshots of cyclic peptide 6 (blue) and 12c (orange) trajectory interacting with the S. aureus membrane model at 0, 0.5, 1.0, 2.0, 4.0, 6.0 and 8.0 ns (left to right). (B) Position of peptide 6 (blue), 12c (orange) and phosphates (black) against S. aureus membrane top leaflet. (C) Peptide-membrane interaction. Peptide 6 (light blue) with membrane bonding residues and potential receptor binding residues colored in cyan and red respectively. ... 171
Figure S1. HPLC profiles (λ = 220 nm) and ESI-MS spectra of synthesized peptides 1-18.
179
Figure S2. High-resolution ESI-MS spectra for synthesized peptides 1-6. ... 185
Figure S3. HPLC profiles (λ = 220 nm) and ESI-MS spectra of bactofencin A analogs for
the ala-scan. ... 187
Figure S4. Agar diffusion assay of the bactofencin A analogs 8-18 (75 µL solution containing
1 mg/mL of peptide) against S. aureus ATCC 6538 in TSBYE. ... 195
Figure S5. Agar diffusion assay of the linear bactofencin A amide (5) (75 µL solution
containing 1 mg/mL of peptide) against MRSA strains and S. aureus strains from mastitis isolates in TSBYE. ... 196
Figure S6. Agar diffusion assay of the linear bactofencin A C-terminal amide (5) and its
ala-scan analogs (75 µL solution containing 1 mg/mL of peptide) against S. aureus ATCC 6538 in A) TSBYE and B) MH culture medium. ... 197
Figure S7. Distance between SHCys7 and SHCys22 from linear trajectory of peptide 5 (blue) in
water and the 5.7 Å line representation of disulfide bond formation (orange). ... 198
Figure S8. Trajectory RMSD for linear peptide 5 (A), its cyclic counterpart 6 (B) and the
N-truncated cyclic peptide 12c (C) in water and in presence of the S. aureus model membrane (5 (D), 6 (E), 12c (F)). ... 199
Figure S9. Structure of the constructed L-lysyl-dipalmitoylphosphoglycerol (DPPGK) highlighting the names of the atoms in the head group region and the DPPG lipids chains. ... 200
Liste des tableaux
Chapitre 1Table 1. Reported synthetic class IIa bacteriocins and methods used for their synthesis. 25
Chapitre 3
Table 1. Peptides synthesized for antibacterial assays and conformational studies. ... 70
Table 2. Minimal inhibitory concentrations of synthetic pediocin PA-1 3c and its analogues
on Listeria strains and the producer P. acidilactici. ... 74
Table 3. Spectrum of activity of synthetic analog 4: minimal inhibitory concentration against
selected sensitive strains. ... 76
Table S1. Antimicrobial assays of synthetic analog 4 tested against strains that showed low
or very low sensitivity. ... 116
Table S2. Secondary structure distribution of pediocin PA-1 analogs 1, 2c, 3a-c and 6 in
different aqueous TFE solutions and in DMPC and DMPG vesicles based on CD spectroscopy. ... 117
Table S3. 1H chemical shiftsa of pediocin PA-1 M31L (analog 5) (600 MHz, 313 K, H
2
O/TFE-d2 (1:1) containing 0.1% TFA). ... 119
Table S4. 1H-1H NOEs observed for pediocin PA-1 M31L (analog 5) (600 MHz, 313 K
H2O/TFE-d2 (1:1) containing 0.1% TFA) that confirm the CS-Rosetta structure. ... 121
Chapitre 4
Tableau 1. Les amorces spécifiques utilisées pour la quantification du microbiote. ... 135
Chapitre 5
Table 1. Synthesized peptides and their minimal inhibitory concentrations on S. aureus
ATCC 6538. ... 162
Table 2. Antimicrobial activity of bactofencin A analog 5 against different bacterial stains.
... 164
Table S1. Synthesized peptides and their antimicrobial activity against S. aureus ATCC
Liste des abbréviations
Produits chimiques et solvantsACN acétonitrile
AcOH acide acétique
DCM dichlorométhane Dha didéshydroalanine Dhb didéshydrobutyrine DIPEA N,N-diisopropyléthylamine DMSO diméthylsulfoxyde DMF diméthylformamide Fmoc 9-fluorénylméthyloxycarbonyl HBTU N,N,N′,N′-tétraméthyl-O-(1H-benzotriazol-1-yl)uronium hexafluorophosphate HCTU N,N,N′,N′-tétraméthyl-O-(6-chloro-1H-benzotriazol-1-yl)uronium hexafluorophosphate HPro dihydroxyproline MeOH méthanol NAG N-acétylglucosamine NCS N-chlorosuccinimide OPr oxopropionyl OBu oxobutyryl
PEG polyéthylène glycol
Pip pipéridine
TFA acide trifluoroacétique
TFE 2,2,2-trifluoroéthanol
Unités °C degré Celsius K degré Kelvin g gramme h heure M molaire mg milligramme min minute mL millilitre μL microlitre mmol millimole mol mole
m/z masse sur charge
s seconde nm nanomètre μm micromètre Å Amstrong equiv équivalents Méthodes d’analyse
APCI «atmospheric pressure chemical ionization», ionization chimique à
pression atmosphérique
ESI «electrospray ionization», ionisation par électronébuliseur
FT-IR spectroscopie infrarouge à transformer de Fourier
HPLC chromatographie liquide à haute performance («high-performance
liquid chromatography»)
RMN résonance magnétique nucléaire
UV ultraviolet
LCMS chromatographie liquide couplée à un spectromètre de masse
Termes biologiques
ADN acide désoxyribonucléique
ARN acide ribonucléique
AMP «antimicrobial peptide», peptide antimicrobien
CMI concentration minimale inhibitrice
Da Dalton
Kb kilobases
LAB «lactic acid bacteria», bactérie lactique
MccJ25 microcine J25
CPK Corey, Pauling et Koltun
sec sécrétion
Remerciements
Tout d’abord, je tiens à remercier mon directeur de recherche, le Professeur Éric Biron, ainsi que mon codirecteur Ismail Fliss, pour m’avoir permis de réaliser mon doctorat dans leurs laboratoires et de m’avoir encouragé à poursuivre mes études. Ensuite, je voudrais remercier leurs équipes et tous ceux qui ont participé aux articles scientifiques présents dans cette thèse. Notamment, le Pr Sylvie Rebuffat du Muséum National d’Histoire Naturelle de Paris, qui m’a permis de réaliser un stage de trois mois à l’international en France
Je tiens aussi à remercier les organismes subventionnaires qui ont permis mes travaux, tels les Fonds de Recherche du Québec – Nature et Technologies, les Offices jeunesse internationaux du Québec – LOJIQ, bureau international de l'Université Laval, ainsi que l’Université Laval pour les bourses de recherche et de déplacement.
Et sans oublier ma famille, qui m’a encouragé et soutenu tout au long de mon parcours universitaire.
“Imagination is more important than knowledge. Knowledge is limited.
Imagination encircles the world.”
Avant-propos
Le projet principal de cet ouvrage est multidisciplinaire. Il a requis une certaine expertise dans les domaines de la chimie, biochimie, microbiologie et de la bio-informatique pour la publication des différents articles révisés par les pairs dans des journaux internationaux.
Le premier chapitre de cette thèse fait l’objet d’une revue de la littérature intitulée « Recent Progress in the Chemical Synthesis of Class II and S-Glycosylated
Bacteriocins » qui a été publié le 23 mai 2018 dans le journal Frontiers in Microbiology. Le travail de cette revue a été divisé en parties égales comprenant la
revue de littérature et de rédaction. Il est inclus dans cette thèse pour faire suite au premier chapitre d’introduction. http://doi.org/10.3389/fmicb.2018.01048
Le troisième chapitre de cette thèse fait l’objet d’un article intitulé « Synthesis,
antimicrobial activity and conformational analysis of the class IIa bacteriocin pediocin PA-1 and analogues thereof » qui a été publié en ligne le 13 juin 2018 dans le journal Scientific Reports. Il a été réalisé en collaboration avec l’équipe du Pr Sylvie Rebuffat
au Muséum national d’Histoire Naturelle, Sorbonne Universités, à Paris. Ma contribution à cet article est majoritaire, j’ai réalisé la première synthèse totale de la pédiocine PA-1 à grande échelle avec le Pr Biron, j’ai effectué les tests microbiologiques de niveau deux dans les laboratoires du Pr Ismail Fliss, j’ai réalisé l’étude génétique du spectre d’activité, j’ai effectué les acquisitions des spectres de dichroïsme circulaire avec le Pr Hammami, sans oublier la détermination de la structure tridimensionnelle de la pédiocine PA-1 M31L dans le laboratoire du Pr Rebuffat, ainsi qu’une très grande partie de la rédaction de l’article. J’évalue ma contribution à 80% pour cet article. http://doi.org/10.1038/s41598-018-27225-3
Le cinquième chapitre fait aussi l’objet d’un article intitulé « Structure-activity
relationships of the bacteriocin bactofencin A and its interaction with bacterial membrane » a été soumis le 10 août 2018 dans le journal ACS Infectious Diseases.
Ma collaboration pour cet article est le design des séquences, la synthèse des peptides, la détermination des activités biologiques et la réalisation des simulations
bio-informatiques dans les laboratoires des Prs Biron et Fliss, ainsi qu’une grande partie de la rédaction. J’évalue une fois de plus ma contribution à plus de 80% pour cet article.
Autres publications scientifiques ne faisant pas partie de la présente thèse :
Biron, E.; Bedard, F., Recent progress in the development of protein-protein interaction inhibitors targeting androgen receptor-coactivator binding in prostate
cancer. J Steroid Biochem Mol Biol 2016, 161, 36-44.
http://doi.org/10.1016/j.jsbmb.2015.07.006
Liang, X. Vezina-Dawod, S. Bedard, F. Porte, K. Biron, E., One-Pot Photochemical Ring-Opening/Cleavage Approach for the Synthesis and Decoding of Cyclic Peptide Libraries. Org Lett 2016, 18 (5), 1174-7. http://doi.org/10.1021/acs.orglett.6b00296
Ennaas, N. Hammami, R. Gomaa, A. Bedard, F. Biron, E. Subirade, M. Beaulieu, L. Fliss, I., Collagencin, an antibacterial peptide from fish collagen: Activity, structure and interaction dynamics with membrane. Biochem Biophys Res Commun 2016,
473 (2), 642-7. http://doi.org/10.1016/j.bbrc.2016.03.121
Chapitre de livre :
Biron, É.; Vézina-Dawod, S.; Bédard, F., Synthetic Strategies for Macrocyclic Peptides. In Practical Medicinal Chemistry with Macrocycles, Marsault, É.; Peterson, M. L., Eds. 2017. http://doi.org/10.1002/9781119092599.ch9
Brevet découlant du chapitre 4 :
International Patent Application Number PCT/CA2018/050598, filed 23 May 2018 entitled ‘Process for the linear synthesis of Gram-positive class IIa bacteriocins and
Introduction
1.
Les bactériocines et leur potentiel
L'augmentation fulgurante des cas de résistance bactérienne face aux antibiotiques constitue un problème majeur partout dans le monde.1-6 L'utilisation massive
d'antibiotiques à grande échelle est pointée du doigt pour avoir engendré l'apparition de résistances chez un grand nombre d'espèces bactériennes.7 Aux États-Unis
seulement, on estime qu'au moins deux millions de personnes sont infectées chaque année par des bactéries résistantes, et que, de ce nombre, au moins 23 000 en meurent. Une importance particulière a été accordée à Clostridium difficile, dont 250 000 personnes ont besoin de soins hospitaliers chaque année, Salmonella
typhimurium, qui infectent 21,7 millions de personnes dans le monde chaque année, Staphylococcus aureus MRSA, « Methicillin-resistant Staphylococcus aureus »,
provoquant 11 285 décès par an, et Listeria monocytogenes un pathogène impliqué dans des morts néonatales, pertes foetales, méningites sévères, septicémies et qui est fatale dans 20-30% des cas d’infection. Le contrôle de ces agents pathogènes est à la fois important pour la sécurité alimentaire, la santé animale et la santé humaine.8
Pour contrer ce phénomène de résistance, les chercheurs tentent d'identifier des failles encore inexploitées chez les bactéries qui évoluent et s'adaptent rapidement. Par exemple, plusieurs équipes de recherche étudient des agents antimicrobiens produits par des organismes tels que les insectes,9 les plantes,10 les champignons11
et les bactéries pour découvrir des molécules avec de nouveaux mécanismes d’action ou spectres d’activité.12 Parmi ces sources très riches en agents
antimicrobiens, les bactéries offrent des molécules très intéressantes et prometteuses. En effet, les bactéries mènent entre elles une lutte acharnée visant la conquête et le contrôle de leur environnement.13 Pour ce faire, elles utilisent
presque toutes un type de molécule bien particulier, les bactériocines.14 Ces petites
protéines aux propriétés antimicrobiennes sont produites par plus de 90% des bactéries, qui les utilisent pour prévenir ou limiter la croissance de leurs compétitrices.15-16 Ces molécules possèdent des modes d'action très variés;
que d'autres, plus précises, peuvent aller jusqu'à cibler des bactéries de la même espèce, mais de souche différente.18 La nature nous offre ainsi un éventail de
possibilités qui n'attendent qu'à être explorées. Le principal défi réside dans le fait que la production de ces molécules par des bactéries est un processus permettant d’obtenir souvent de très petites quantités.19 À titre d'exemple, une bactériocine, la
pédiocine PA-1 qui est produite à partir d’une bactérie du lait, se vend actuellement 341 dollars pour 50 microgrammes sur le marché,20 ce qui revient à plus de 6 millions
de dollars pour un seul gramme. Cette protéine antibactérienne est très efficace contre Listeria monocytogenes, une bactérie redoutable capable de se répliquer lors de la conservation de la viande au réfrigérateur.21 Cette bactérie est responsable de
la listériose, une maladie pouvant mener à une méningite sévère et une septicémie en plus de s'avérer fatale pour les fœtus des femmes enceintes.22 Les bactériocines
démontrent un énorme potentiel dans la prévention et le traitement des infections bactériennes et nous nous intéressons particulièrement à leur production par synthèse chimique et à leur utilisation dans différentes applications.23
Dans le domaine médical, les bactériocines sont de plus en plus considérées comme une alternative potentielle aux antibiotiques. Des bactériocines telles que la nisine, la planosporicine, Pep5 et l’épidermine ont déjà montré des activités inhibitrices in vitro contre des agents pathogènes cliniques tels que Listeria
monocytogenes, Streptococcus pneumoniae, Staphylococcus, Enterococcus, Escherichia coli et Clostridium difficile.24-27 Des bactériocines à Gram négatif comme
les microcines J25, B17, V36 et L37 ont aussi montré une activité inhibitrice importante contre une large gamme de bactéries pathogènes notamment
Escherichia coli, Salmonella, Shigella et Pseudomonas spp..24, 28-29 Les
bactériocines possèdent des caractéristiques structurales et d’activité biologique qui suggèrent un potentiel énorme d’application comme alternative aux antibiotiques telle qu'une forte résistance à la lyse enzymatique.30 Plusieurs applications ont été
rapportées pour les bactériocines et autres peptides antimicrobiens comme leur utilisation dans des produits de soins dentaires31 et pharmaceutiques tels que pour
naissances,33 dans une crème anti-VIH,34 et des activités anticancéreuses ont
même été démontrées.35-36
Même en 2018, les contaminations microbiologiques alimentaires sont fréquentes (60 à 80 rappels par an au Québec). Ceux-ci coûtent très cher aux transformateurs en frais pour rappeler ces produits (moyenne de 10M$ US), mais aussi en perte de revenus due à la perte de confiance du consommateur envers le produit (entre 30 et 90M $US).37 Les agents chimiques de conservation traditionnels
(sels, nitrate, sulfites et autres) ne suffisent et ne répondent pas à la demande du consommateur qui veut au contraire les retirer de son alimentation. Dans le secteur alimentaire, il y a donc une forte demande pour des alternatives non toxiques et sans impact sur la santé. Le défi pour le transformateur alimentaire est de répondre à cette demande tout en réduisant spécifiquement la charge bactérienne pathogène. Éviter des rappels est essentiel pour les entreprises et leurs consommateurs, mais aussi pour la conservation de leurs images de marque comme pour Maple Leaf qui en a beaucoup souffert avec l'éclosion de Listeria en 2008.
Le domaine vétérinaire a aussi démontré un grand l’intérêt envers les bactériocines. L'utilisation systématique d'antibiotiques pour protéger le bétail et améliorer les performances de croissance est critiquée de plus en plus avec l'émergence de la résistance aux antibiotiques et est considérée de plus en plus comme un risque inutile pour la santé humaine.38 Dans le monde, les souches
résistantes aux antibiotiques se répandent grâce à des industries animales. Par exemple, la perte économique dans l'industrie laitière, aux États-Unis, en raison de la mammite bovine, une infection des mamelles de mammifères, est d'environ deux milliards de dollars annuellement, où les bactériocines ont montré un niveau élevé d’activité bactérienne sur des souches causant la mammite.39 Les fermes d'élevage
peinent à combattre les infections de leurs vaches par Staphylococcus causant la mammite bovine et la perte de plusieurs milliards de dollars pour l’industrie bovine. 40-41 Santé Canada a pour mission de rendre les antibiotiques d’élevages prohibés au
antimicrobiens spécifiques permettant d’éliminer cette problématique sans avoir à passer par les antibiotiques qui sont à proscrire dans les industries d’élevages.
2.
La classe IIa et les pédiocines
La bactériocine modèle sélectionnée pour le début de cette étude est la pédiocine PA-1, un membre très important de la classe IIa des bactériocines. La classe IIa des bactériocines à Gram positif est généralement composée de peptides de petite taille (<5 kDa) et ne contient aucune autre modification autre que les ponts disulfures. Aussi appelées la classe des « pediocin-like », les bactériocines de cette classe sont produites par plusieurs bactéries lactiques (LAB) de la famille des Lactobacillacea et possèdent de 36 à 48 résidus avec des séquences possédant de 40 à 60% de similitudes (Figure 1).
Figure 1. L'alignement des séquences des bactériocines matures de la classe IIa. Les cystéines soulignées forment des ponts disulfures.42
Cette classe de bactériocines est synthétisée avec un peptide de tête qui est ensuite détaché par un processus protéolytique, généralement après la séquence glycine-glycine par exemple pour la pédiocine PA-1.43 La désignation de «pediocin-like»
pour la classe IIa réfère à la pédiocine PA-1/AcH qui a été la première de cette classe à être caractérisée.44 Il est à noter que la pédiocine AcH produite par
Pediococcus acidilactici H45 et la pédiocine PA-1 produite par P. acidilactici
PAC1.046 comportent des séquences identiques en acides aminés. Les pédiocines
sont reconnues pour être actives contre Listeria spp. et caractérisées par le N-terminal cationique appelé la boîte à pédiocine («pediocin box») comprenant la séquence consensus YGNGV(X)C(X)4C(X)V(X)4A où le X est un acide aminé
variable dont plusieurs portent des charges positives, ainsi qu’un pont disulfure entre les cystéines qui stabilise une structure en feuillet β (Figure 1.2).47-48 Le C-terminal
consiste en une structure d’hélice α hydrophobe.3 Dans cette dernière partie,
quelques bactériocines de la classe IIa comportent un deuxième pont disulfure, telles la sakacine G, plantaricine 423, pédiocine PA-1, divercine V41 et l’entérocine A, jouant un rôle structurel qui stabilise la structure tridimensionnelle.3, 49 À ce jour,
les structures de quelques membres de cette sous-classe comme la leucocine A,50
sakacine P (Figure 2),49 carnobacteriocine B251 et la curvacine A52 ont été
déterminées par résonance magnétique nucléaire (RMN).
Figure 2. Structure tridimensionnelle à l’intérieur de micelles déterminée par RMN de la Sakacine P en bleu avec le pont disulfure en jaune. La partie N-terminale très conservée comportant la « pediocin box », un pont disulfure et un feuillet β, ainsi qu’une hélice α en C-terminal qui serait responsable de l’activité en s’insérant dans
Cependant, la structure de la bactériocine qui porte le nom de cette classe, la pédiocine PA-1, n’a pas encore été déterminée. Une étude par simulation bio-informatique de la pédiocine PA-1 dans le trifluoroéthanol (TFE), un solvant qui a pour propriété de simuler la membrane bactérienne, a démontré une structure très similaire à la classe IIa.53 En effet, il a été démontré que cette classe est
désordonnée dans l’eau, mais structurée lorsqu’elle est en présence d’un milieu hydrophobe comme les membranes des parois bactériennes (Figure 3).49-50, 52, 54
Figure 3.Schéma représentatif théorique de la structure des bactériocines de classe IIa dans la membrane lipidique.2
La classe IIa utilise la protéine transmembranaire de perméase du mannose comme récepteur pour la reconnaissance cellulaire1, 55-56 pour ensuite pénétrer la membrane
et former un pore perméable aux ions potassiques, acides aminés et d’autres petites molécules de souches sensibles (Figure 4).57-58
Figure 4.Représentation schématique du mode d'action proposé pour la classe IIa des bactériocines. La bactériocine utilise les sous-unités IIC et IID de la mannose phosphotransférase comme récepteur sur les cellules cibles. Après la liaison, la bactériocine liée déclenche la perméabilisation de la membrane.1
3.
Ingénierie des bactériocines
La bio-ingénierie des bactériocines a été exploitée durant les dernières décennies pour améliorer leurs propriétés physico-chimiques comme la solubilité et la stabilité,59 élargir leur spectre d’activité et augmenter leur activité antimicrobienne. 60-61 Par exemple, une simple substitution de la méthionine à la position 21 de la nisine
Z par une lysine a permis d’obtenir une solubilité cinq fois supérieure à celle du peptide original à un pH de 8 et de fournir une extension de son spectre antimicrobien contre les bactéries à Gram négatif.62 Un autre exemple est la haute
sensibilité de la méthionine à la position 31 de la pédiocine PA-1 face à l’oxydation qui conduit à une perte presque complète de l'activité pendant les manipulations et le remisage au congélateur. La stabilité de la pédiocine PA-1 a été augmentée par la substitution de la méthionine à la position 31 par des résidus hydrophobes tels que les acides aminés alanine, isoleucine et norleucine. Tous les mutants ainsi préparés ont démontré une activité équivalente à celle du peptide natif.63 Un dernier
exemple est la microcine J25 (MccJ25) qui résiste fortement aux enzymes protéolytiques présentes dans l'estomac et l'intestin favorisant son utilisation dans le domaine médical, mais limitant sérieusement son utilisation comme agent de conservation alimentaire. La bio-ingénierie de la MccJ25 a permis de la rendre sensible à la chymotrypsine.64 Ces exemples démontrent qu’il est possible de
modifier et d’améliorer des propriétés ciblées pour une bactériocine par simple principe de design et des modifications chimiques appropriées.
4.
Cytotoxicité des bactériocines et processus réglementaire
Le développement de la résistance aux antibiotiques chez les bactéries est inévitable, et chaque antibiotique qui est introduit dans le marché à ce jour a une durée de vie limitée. En outre, il y a déjà plusieurs mécanismes de résistance contre les bactériocines de suggérés, car elles sont utilisées par les bactéries depuis des millions d’années.61 De plus, il a été démontré que les bactéries peuvent être
formées pour devenir résistantes.65 Cependant, contrairement aux petites molécules
mécanismes très efficaces pour résister aux peptides antimicrobiens naturels (AMPs), y compris les bactériocines, ce qui est probablement en raison de la multiplicité des modes d'action des AMPs.66 Une tendance générale dans la
littérature s'accorde pour dire que les bactériocines provenant des bactéries lactiques (LAB) sont sûres comme agents de biopréservation. Aucune toxicité n’a été observée à des concentrations antimicrobiennes dans la majorité des études. De plus, les mesures de poids corporel et les indices de tissus somatiques (STI) pour les bactériocines de bactéries lactiques (LAB) de classe IIa n’ont montré aucune différence avec le contrôle de quelques jours à plusieurs semaines.67-70 Pour
l'utilisation de probiotiques, les récentes recommandations incluent l'absence d'activité hémolytique, l’absence de détection de la résistance aux antibiotiques transférables de la souche sélectionnée et l’absence de production de toxines doivent être démontrées sur des modèles animaux comme mesure de confiance dans la sécurité des probiotiques étudiés.71-72 De nos jours, les anciennes
bactériocines qui ont déjà été utilisées comme antibiotiques, dont l’usage s’est arrêté à cause de leur toxicité, sont tout de même utilisées, car elles sont moins toxiques que les nouveaux agents antibactériens nécessaires et peuvent donc être utilisées comme dernière défense contre les bactéries multirésistantes telles Pseudomonas
aeruginosa, Klebsiella pneumoniae, Actinobacter et les bactéries porteuses de la
New Delhi métallo-bêta-lactamase-1 (NDM-1), contre lesquelles la colistine est effective.6, 73Il a aussi été démontré que la toxicité de certaines bactériocines peut
être modulée par d’autres bactériocines. Par exemple, l’ajout d’une concentration de nisine de 1,5 à 2 mg/mL est suffisant pour éliminer complètement les effets toxiques. Il existe donc une synergie entre les bactériocines qui est non négligeable dans le développement de celles-ci en vue d’en faire des antibiotiques.74
Les bactériocines peuvent être introduites dans l'alimentation en au moins trois manières différentes soit en ajoutant la bactériocine purifiée ou semi-purifiée directement à l'alimentation, par incorporation d'un ingrédient à base d'un produit de fermentation d'une souche produisant des bactériocines dans les aliments, ou en produisant la bactériocine in situ en utilisant les souches productrices comme démarreur ou des cultures de protection.14
L'application commerciale de bactériocines dans la conservation des produits alimentaires doit passer par une multitude de règlements qui dépendent de la région géographique, le pays, et même certains gouvernements locaux. Récemment au Canada, les deux premières bactériocines qui ont été approuvées soit la BacM35,75
une culture de Carnobacterium divergens M35 produisant la bactériocine sur l’aliment, et la nisine, peptide semi-purifié produit par Lactococcus lactis subsp. lacti.76 Les agents de préservations doivent être inclus dans les listes approuvées
d'additifs alimentaires, ainsi que des informations détaillées concernant le nom de l'additif alimentaire, les aliments auxquels l'additif alimentaire peut être ajoutée, les conditions en vertu de laquelle l'additif alimentaire peut être utilisée et le cas échéant, s’il y a des restrictions sur la vente de l'additif alimentaire directement au consommateur final.77
Il existe des centaines de bactériocines,78, mais seulement deux sont approuvées
au Canada. Malgré leur grand potentiel et leur efficacité attrayante, ce qui limite grandement l’utilisation des bactériocines dans les différents secteurs est leur coût de production élevé associé à de faibles rendements. De nouvelles approches seront nécessaires pour rendre l’utilisation à grande échelle des bactériocines en tant qu’agents antibactériens dans les secteurs alimentaire, production animale, vétérinaire et médical.79
Chapitre 1 : Récents progrès dans la synthèse chimique
des bactériocines de classe II et S-glycosylées
C
HAPITRE1
:
R
ÉCENTS PROGRÈS DANS LA SYNTHÈSE CHIMIQUE DESRésumé
Une grande variété de peptides antimicrobiens produits par les bactéries lactiques (LAB) ont été identifiés et étudiés au cours des dernières décennies. Connus sous le nom de bactériocines, ces peptides synthétisés ribosomiquement inhibent la croissance d'un large éventail d'espèces bactériennes à travers de nombreux mécanismes et montrent une grande variété de spectres d'activité. Avec leur grand potentiel en tant qu'additifs antimicrobiens et alternatives aux antibiotiques traditionnels dans la conservation et la manipulation des aliments, la production animale, en médecine vétérinaire et médicale, la demande de bactériocines augmentent rapidement. Les bactériocines sont le plus souvent produites par fermentation, mais dans plusieurs cas, les faibles rendements isolés et les difficultés liées à leur purification limitent sérieusement leur utilisation à grande échelle. La synthèse chimique a été proposée pour leur production et les progrès récents dans les méthodologies de synthèse de peptides ont permis la préparation de plusieurs bactériocines. De plus, la réduction significative des coûts des réactifs de synthèse peptidique et des blocs de construction a rendu la synthèse chimique des bactériocines plus attrayante et compétitive. Du point de vue de l'ingénierie des protéines, l'approche chimique offre de nombreux avantages tels que la substitution rapide des acides aminés, l'utilisation de résidus non naturels ou modifiés et la modification des chaînes latérales pour améliorer la puissance, modifier le spectre d'activité ou augmenter la stabilité de la bactériocine ciblée. Cette revue a résumé les approches synthétiques qui ont été développées et utilisées au cours des dernières années pour permettre la préparation de bactériocines de classe IIa et de glycopeptides S-liés de LAB. Des stratégies de synthèse telles que l'utilisation de pseudoprolines, des groupes protecteurs de squelette, des irradiations de micro-ondes, la formation de ponts disulfures sélectifs et des ligatures chimiques pour préparer des bactériocines de classe II et S-glycosylées sont discutées.
Frontiers in Microbiology 2018, 8, 9029
DOI : 10.1038/s41598-018-27225-3
Recent progress in the chemical synthesis of class II and
S-glycosylated bacteriocins
François Bédard1,2 and Eric Biron1,2,*
1Faculty of Pharmacy and Institute of Nutrition and Functional Foods, Université Laval, Québec, QC, Canada
2Laboratory of Medicinal Chemistry, CHU de Québec Research Centre, Québec, QC, Canada
Abstract
A wide variety of antimicrobial peptides produced by lactic acid bacteria have been identified and studied in the last decades. Known as bacteriocins, these ribosomally-synthesized peptides inhibit the growth of a wide range of bacterial species through numerous mechanisms and show a great variety of spectrum of activity. With their great potential as antimicrobial additives and alternatives to traditional antibiotics in food preservation and handling, animal production and in veterinary and medical medicine, the demand for bacteriocins is rapidly increasing. Bacteriocins are most often produced by fermentation but, in several cases, the low isolated yields and difficulties associated with their purification seriously limit their use on a large scale. Chemical synthesis has been proposed for their production and recent advances in peptide synthesis methodologies have allowed the preparation of several bacteriocins. Moreover, the significant cost reduction for peptide synthesis reagents and building blocks has made chemical synthesis of bacteriocins more attractive and competitive. From a protein engineering point of view, the chemical approach offers many advantages such as the possibility to rapidly perform amino acid substitution, use unnatural or modified residues, and make backbone and side chain modifications to improve potency, modify the activity spectrum or increase the stability of the targeted bacteriocin. This review summarized synthetic approaches that have been developed and used in recent years to allow the preparation of class IIa bacteriocins and S-linked glycopeptides from lactic acid bacteria. Synthetic strategies such as the use of pseudoprolines, backbone protecting groups, microwave irradiations, selective disulfide bridge formation and chemical ligations to prepare class II and S-glycosylsated bacteriocins are discussed.
1.
Introduction
Antimicrobial resistance to antibiotics has become a major challenge in the treatment of infectious diseases, chronic illnesses and immune disorders (Bush et al., 2011; Lewis, 2013; Michael et al., 2014; Ferri et al., 2017). This public health problem is very costly both in care and life and often faces limited treatment options. The unregulated use and misuse of antibiotics in the food and animal production industry as well as veterinary and human medicine led to the emergence of multi-resistant pathogenic strains (CDC, 2013; Cotter et al., 2013; Van Boeckel et al., 2015). In this context, new highly effective antimicrobial agents for which resistance cannot be readily acquired are sorely needed in order to maintain the ability of modern medicine to treat bacterial infections. Among the most promising alternatives to conventional antibiotics, bacteriocins show very attractive antimicrobial properties and their potential use as food preservatives, bio-controlling agents or therapeutics has been widely studied in the last decades (Papagianni, 2003; Bali et al., 2016; López-Cuellar et al., 2016; Ahmad et al., 2017; Mathur et al., 2017).
Produced by a wide variety of bacteria to fight other microorganisms in their competitive environments, bacteriocins form a heterogeneous group of peptides with great variations in size, structure and mode of action. Hundreds of these ribosomally-synthesized peptides have been identified and characterized over the years and are now described in detail in various databases (Hammami et al., 2007; van Heel et al., 2013). Several approaches have been developed to classify bacteriocins and the classification used in this review is based on the system used to classify the bacteriocins of lactic acid bacteria (LAB) (Cotter et al., 2005; Cotter et al., 2013) on their structural characteristics with respect to the nomenclature proposed for ribosomally-synthesized post-translationally modified peptides (RiPPs) (Arnison et al., 2013). Bacteriocins produced by Gram-positive bacteria, such as those from LAB, are divided into three major classes: the heat stable post-translationally modified peptides (class I), the low-molecular weight (< 10 kDa) heat stable unmodified peptides (class II) and the heat labile high-molecular-weight proteins (class III). In Gram-negative bacteria, most characterized bacteriocins have been
isolated from Escherichia coli and other enterobacteria, and they are often referred to as microcins (small peptides) or colicins (larger proteins).
The most important appeal of bacteriocins as antibacterial agents and antibiotic substitutes is their multiple advantages over other antimicrobial agents commonly used in food preservation and handling, animal production and in human and veterinary medicine. For example, bacteriocins have been shown to be: i) safe for consumption since they are completely digested in the gastrointestinal tract (Kheadr et al., 2010; Fernandez et al., 2016), ii) highly potent (103 to 106 times more than several other antimicrobials including conventional antibiotics); iii) resistant to common thermal treatments for pasteurization or even sterilization (De Vuyst and Leroy, 2007; Keymanesh et al., 2009; Abriouel et al., 2010). Moreover, several bacteriocins are recognized as GRAS (generally recognized as safe) substances by the United States Food and Drug Administration (FDA) and the European legislation for pharmaceutical and food industry uses. However, despite their great potential and attractive efficacy, the use of bacteriocins remains limited due largely to high production costs usually associated with low production yields and onerous technological requirements. More research and development as well as new approaches are needed in order to make the use of bacteriocins as antimicrobial agents feasible on a larger scale, whether in the food industry or in human health and veterinary medicine.
Chemical synthesis has been proposed for the large-scale production of active bacteriocins. However, very few bacteriocins have been successfully prepared in satisfying yields using such means. Several challenging features that are essential for their bioactivity, such as lasso structure, large macrocycles, and presence of long hydrophobic segments, lanthionines, glycosylated side chains or complicated peptide motifs can make the task very daunting. Beside their production on a large scale, access to bacteriocins by chemical synthesis would allow further molecular engineering to enhance the potency, improve pharmacological properties, increase the stability and modify the spectrum of activity. As a result, new approaches were urgently needed to overcome synthetic pitfalls and efficiently prepare bioactive
bacteriocins by chemical synthesis. Fortunately, several developments in peptide synthesis methodologies have been successfully used to prepare several bacteriocins. Because class III bacteriocins are complex large proteins currently inaccessible by chemical approaches and the synthesis of class I lanthibiotic bacteriocins has already been reviewed by Tabor et al. (Tabor, 2011), this review will focus on class I S-linked glycopeptides and class II bacteriocins produced by Gram-positive bacteria and discuss the recent advances made for their synthesis.
2.
General chemical synthesis strategies
A wide variety of technologies including chemical synthesis, recombinant DNA technology, cell-free expression systems, transgenic plants or enzymatic synthesis have been developed to produce peptide-based compounds. Generally, the choice of the most suitable technology to produce a peptide is based on its size and the chemical synthesis approach is more appropriate and efficient for low-molecular weight peptides (< 6 kDa). With the possibility to use unnatural amino acids, introduce pseudo-peptide bonds and perform side chain modifications, chemical synthesis offers access to a more important chemical diversity than peptides produced by recombinant methodologies. With the development of solid-phase peptide synthesis (SPPS), large-scale chemical synthesis has become a viable approach for the production of small- and medium-sized peptides ranging from approximately 5 to 50 residues, and the chemical way is now often a better option than the biotechnological methods of recombinant DNA or biocatalysis for the synthesis of medium-sized peptides. Compared to conventional synthesis in solution where a purification is required after each step, the SPPS approach is considerably more convenient and efficient since the growing peptide chain is attached to an insoluble polymeric support and allows the use of larger amount of reagents to favor reaction completion, simple removal of excess reagents by filtration and washing, and a single purification step once the peptide sequence is completed and removed from the solid support. In the SPPS methodology, N-protected amino acids are attached to the N-terminal amine of the growing peptide chain on the solid support followed by deprotection of the amino group (Figure 1A). This two-step cycle
(coupling and deprotection) is repeated until the peptide sequence is completed and the desired peptide can be obtained after its release from the solid support and removal of the side-chain protecting groups. The chemical synthesis of peptides has remarkably progressed since the first work of Bruce Merrifield on SPPS (Merrifield, 1963). A great number of synthetic improvements including more efficient coupling reagents (Valeur and Bradley, 2009; El-Faham and Albericio, 2011), solid supports (Kates et al., 1998; Rademann et al., 1999; García-Martín et al., 2006; Rapp, 2007), linkers (Boas et al., 2009; Góngora-Benítez et al., 2013), orthogonal protecting groups (Isidro-Llobet et al., 2009), and the use of microwave (MW) irradiations (Collins et al., 2014) have emerged to overcome difficulties associated with SPPS and access a wide variety of peptides (Guan et al., 2015; Behrendt et al., 2016; Paradis-Bas et al., 2016), including bacteriocins.
The two most important SPPS strategies are the linear and convergent synthesis. The linear (sequential) synthesis approach involves the stepwise addition of amino acids until the desired peptide is achieved (Figure 1A). Currently, peptides prepared by stepwise amino acid additions via standard SPPS are generally limited to approximately 50 residues (Chen et al., 2015; Guan et al., 2015). Convergent synthesis involves the independent solid-phase synthesis of peptide fragments that are then cleaved from the polymer and linked by condensation on solid support or in solution with standard coupling reagents or chemoselective reactions (chemical ligation) (Figure 1B). The convergent approach is often the most appropriate way to synthesize peptides that contain >50 amino acid residues and the development of several chemical ligation methods allowed the preparation of long peptide chains and small proteins (Harmand et al., 2014; Thapa et al., 2014; Chen et al., 2015; Bondalapati et al., 2016). While fragment condensation with standard coupling reagents requires N- or C-terminal and side-chain protected fragments, chemical ligation methods such as the native chemical ligation (NCL) (Dawson et al., 1994), α-ketoacid-hydroxylamine ligation (KAHA) (Bode et al., 2006; Pusterla and Bode, 2015; Bode, 2017), salicylaldehyde (SAL) ester-mediated ligation (Zhang et al., 2013) and traceless-Staudinger ligation (Nilsson et al., 2000; Saxon et al., 2000) are compatible with unprotected peptide fragments.
For both sequential and convergent synthesis approaches, the solid support plays a critical role in peptide assembly and should be mechanically stable, show good swelling properties in commonly used organic solvents, and be compatible with the selected synthetic methodology. The most frequently used solid supports for peptide synthesis are the classic cross-linked polystyrene (PS) resins, polyethylene glycol (PEG)-PS composite resins (e.g. TentalGelTM) (Rapp, 2007) and cross-linked PEG
resins (e.g. ChemMatrix®) (García-Martín et al., 2006). Compared to PS resins, PEG-containing resins are compatible with polar solvents and they were proposed to more suitable for the synthesis of large peptides as they are able to form aggregation-disrupting interactions with growing peptide chains (García-Martín et al., 2006). The Boc/Bzl and Fmoc/tBu synthetic methodologies are the two most common SPPS strategies, and the strategy utilized should be considered when choosing the appropriate type of resin linker (Sewald and Jakubke, 2009; Góngora-Benítez et al., 2013). Several systems for the automated synthesis of peptides covering scales ranging from 1.5 mg to 5 kg and compatible with Boc/Bzl (Boc-SPPS) and Fmoc/tBu SPPS (Fmoc-(Boc-SPPS) are now available from several companies. Based on the mild acidic conditions for final deprotection and the commercial availability of a wide variety of orthogonally protected amino acids, the Fmoc/tBu approach has been the most commonly used strategy to prepare bacteriocins by chemical synthesis. This review describes the different strategies that have been reported to overcome synthetic pitfalls and access bioactive bacteriocins.
Figure 1.Solid-phase peptide synthesis strategies. (A) Stepwise synthesis using the Fmoc/tBu or Boc/Bzl strategy and (B) Convergent synthesis.
3.
Synthesis of Class II bacteriocins
Class II bacteriocins are heat stable small peptides containing from 25 to 70 amino acid residues that are largely unmodified, with the exception of disulfide bridges, head-to-tail macrocyclization and N-terminus formylation. Lactic acid bacteria are frequently found as producers of class II bacteriocins and members of this class can be further divided into subgroups, including the class IIa, IIb, IIc and IId covered in this review. Showing variations in size and structure, a great variety of synthetic strategies have been used to overcome pitfalls and successfully prepare members of this class.