HAL Id: dumas-01927773
https://dumas.ccsd.cnrs.fr/dumas-01927773
Submitted on 20 Nov 2018
HAL is a multi-disciplinary open access
archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
État des lieux et perspectives de prise en charge des
thérapies ciblées en oncologie en France
Pierre Balard
To cite this version:
Pierre Balard. État des lieux et perspectives de prise en charge des thérapies ciblées en oncologie en France. Sciences pharmaceutiques. 2018. �dumas-01927773�
1
UNIVERSITE DE ROUEN NORMANDIE
UFR SANTE – Département PHARMACIE
Année 2018
THESE
pour le DIPLOME D’ETAT DE DOCTEUR EN PHARMACIE
Présentée et soutenue publiquement le 08/06/2018
par
Pierre Balard
Né le 23/09/1989
à
Rouen
État des lieux et perspectives de prise en charge
des thérapies ciblées en oncologie en France
Président du jury :
Concé-Chemtob Marie-Catherine, MCU
Membres du jury :
Lamoureux Fabien, PH
Latouche Jean-Baptiste, MCU-PH
Vérité Philippe, Professeur
2 Remerciements
Je tiens à remercier tout d’abord Fabien Lamoureux et Jean-Baptiste Latouche pour leur temps et leur aide précieuse tout au long de cette thèse, des discussions initiales de structure jusqu’aux commentaires finaux.
Aux professeurs de la faculté de Pharmacie de Rouen, notamment Philippe Vérité pour son aide et assistance tout au long de mon cursus universitaire, Marie-Catherine Concé-Chemtob pour son temps et sa contribution à codiriger cette thèse, Thierry Besson pour son partage de réseau m’ayant conduit à mon premier stage - décisif - à l’étranger.
A Jean-Christophe Sabourin, Pierre Michel et Anne-Bénédicte Duval-Modeste pour leur temps accordé lors d’entretiens réalisés en début de thèse.
A María Soledad Gómez et María Dolores Pujol pour leur accueil dans leurs laboratoires et leur bienveillance continue.
A ma famille, père, mère, frères, sœurs, oncle, tantes, beau-père, parrains, marraines, cousins, à ma grand-mère. A l’oral comme à l’écrit, trouver les mots est difficile pour exprimer leur immense importance. Je ne les verrai jamais assez.
A mes amis, tous ceux de pharmacie qui ont transformé six années d’études en une poignée de jours et infinité de souvenirs, les citer un à un serait le travail d’une nouvelle thèse ! A ceux d’avant : les irréductibles Gaulois / Terreros de Vernon ; à ceux d’après : de Paris, Londres, Madrid, Barcelone, Darmstadt, Berlin, ou Princeton, de toutes nationalités, qui m’ont ouvert l’esprit tant personnellement que professionnellement. Je ne les verrai jamais assez.
A mes amis non francophones, qui ne liront très probablement pas cette thèse mais qui, sans doute sans le savoir, ont eu et ont une contribution majeure dans ma vie…
A toutes celles et tous ceux qui n’ont pas désespéré malgré le temps que la rédaction de cette thèse a pris…
Merci !
… Et peut-être à toi, oui toi, l’étudiant(e) qui t’inspires aujourd’hui de cette thèse pour ta propre étude, bon courage à toi !
3 Mise en garde
L’Université de Rouen et l’UFR de Médecine et de Pharmacie de Rouen n’entendent donner aucune approbation ni improbation aux opinions émises dans
4 Liste actualisée des enseignants-chercheurs de l’UFR de Médecine et de Pharmacie de Rouen
ANNEE UNIVERSITAIRE 2017 - 2018 U.F.R. SANTÉ DE ROUEN
---
DOYEN : Professeur Pierre FREGER ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I - MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mr Frédéric ANSELME HCN Cardiologie Mme Gisèle APTER Havre Pédopsychiatrie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie plastique Mr Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et biologie moléculaire Mr Ygal BENHAMOU HCN Médecine interne
Mr Jacques BENICHOU HCN Bio statistiques et informatique médicale Mr Olivier BOYER UFR Immunologie
Mme Sophie CANDON HCN Immunologie
Mr François CARON HCN Maladies infectieuses et tropicales Mr Philippe CHASSAGNE (détachement) HCN Médecine interne (gériatrie) – Détachement Mr Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale Mr Jean-Nicolas CORNU HCN Urologie
Mr Antoine CUVELIER HB Pneumologie
Mr Pierre CZERNICHOW (surnombre) HCH Epidémiologie, économie de la santé Mr Jean-Nicolas DACHER HCN Radiologie et imagerie médicale
Mr Stéfan DARMONI HCN Informatique médicale et techniques de communication Mr Pierre DECHELOTTE HCN Nutrition
5
Mr Frédéric DI FIORE CB Cancérologie
Mr Fabien DOGUET HCN Chirurgie Cardio Vasculaire
Mr Jean DOUCET SJ Thérapeutique - Médecine interne et gériatrie
Mr Bernard DUBRAY CB Radiothérapie
Mr Philippe DUCROTTE HCN Hépato-gastro-entérologie
Mr Frank DUJARDIN HCN Chirurgie orthopédique - Traumatologique
Mr Fabrice DUPARC HCN Anatomie - Chirurgie orthopédique et traumatologique
Mr Eric DURAND HCN Cardiologie
Mr Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale
Mme Hélène ELTCHANINOFF HCN Cardiologie
Mr Manuel ETIENNE HCN Maladies infectieuses et tropicales
Mr Thierry FREBOURG UFR Génétique
Mr Pierre FREGER HCN Anatomie - Neurochirurgie
Mr Jean François GEHANNO HCN Médecine et santé au travail
Mr Emmanuel GERARDIN HCN Imagerie médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie
M. Guillaume GOURCEROL HCN Physiologie
Mr Dominique GUERROT HCN Néphrologie
Mr Olivier GUILLIN HCN Psychiatrie Adultes
Mr Didier HANNEQUIN HCN Neurologie
Mr Fabrice JARDIN CB Hématologie
Mr Luc-Marie JOLY HCN Médecine d’urgence
Mr Pascal JOLY HCN Dermato – Vénéréologie
Mme Bouchra LAMIA Havre Pneumologie
Mme Annie LAQUERRIERE HCN Anatomie et cytologie pathologiques
Mr Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale
Mr Joël LECHEVALLIER HCN Chirurgie infantile
Mr Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
Mr Thierry LEQUERRE HB Rhumatologie
Mme Anne-Marie LEROI HCN Physiologie
Mr Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile
Mr Pierre Yves LITZLER HCN Chirurgie cardiaque
Mr Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
Mr Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine interne
6
Mr Loïc MARPEAU HCN Gynécologie - Obstétrique
Mr Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
Mr Pierre MICHEL HCN Hépato-gastro-entérologie
M. Benoit MISSET HCN Réanimation Médicale
Mr Jean-François MUIR (surnombre) HB Pneumologie
Mr Marc MURAINE HCN Ophtalmologie
Mr Philippe MUSETTE HCN Dermatologie - Vénéréologie
Mr Christophe PEILLON HCN Chirurgie générale
Mr Christian PFISTER HCN Urologie
Mr Jean-Christophe PLANTIER HCN Bactériologie - Virologie
Mr Didier PLISSONNIER HCN Chirurgie vasculaire
Mr Gaëtan PREVOST HCN Endocrinologie
Mr Jean-Christophe RICHARD (détachement) HCN Réanimation médicale - Médecine d’urgence
Mr Vincent RICHARD UFR Pharmacologie
Mme Nathalie RIVES HCN Biologie du développement et de la reproduction
Mr Horace ROMAN HCN Gynécologie - Obstétrique
Mr Jean-Christophe SABOURIN HCN Anatomie - Pathologie
Mr Guillaume SAVOYE HCN Hépato-gastrologie
Mme Céline SAVOYE–COLLET HCN Imagerie médicale
Mme Pascale SCHNEIDER HCN Pédiatrie
Mr Michel SCOTTE HCN Chirurgie digestive
Mme Fabienne TAMION HCN Thérapeutique
Mr Luc THIBERVILLE HCN Pneumologie
Mr Christian THUILLEZ (surnombre) HB Pharmacologie
Mr Hervé TILLY CB Hématologie et transfusion
M. Gilles TOURNEL HCN Médecine Légale
Mr Olivier TROST HCN Chirurgie Maxillo-Faciale
Mr Jean-Jacques TUECH HCN Chirurgie digestive
Mr Jean-Pierre VANNIER (surnombre) HCN Pédiatrie génétique
Mr Benoît VEBER HCN Anesthésiologie - Réanimation chirurgicale
Mr Pierre VERA CB Biophysique et traitement de l’image
Mr Eric VERIN HB Service Santé Réadaptation
Mr Eric VERSPYCK HCN Gynécologie obstétrique
Mr Olivier VITTECOQ HB Rhumatologie
7
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie – Virologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
Mr Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie
Mme Nathalie CHASTAN HCN Neurophysiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
Mr Moïse COEFFIER HCN Nutrition
Mr Serge JACQUOT UFR Immunologie
Mr Joël LADNER HCN Epidémiologie, économie de la santé
Mr Jean-Baptiste LATOUCHE UFR Biologie cellulaire
Mr Thomas MOUREZ HCN Virologie
Mr Gaël NICOLAS HCN Génétique
Mme Muriel QUILLARD HCN Biochimie et biologie moléculaire
Mme Laëtitia ROLLIN HCN Médecine du Travail
Mr Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique
Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
Mr David WALLON HCN Neurologie
PROFESSEUR AGREGE OU CERTIFIE
Mr Thierry WABLE UFR Communication
8
II - PHARMACIE
PROFESSEURS
Mr Thierry BESSON Chimie Thérapeutique
Mr Roland CAPRON (PU-PH) Biophysique
Mr Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
Mr Loïc FAVENNEC (PU-PH) Parasitologie
Mr Jean Pierre GOULLE (Professeur émérite) Toxicologie
Mr Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie
Mme Christelle MONTEIL Toxicologie
Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mr Rémi VARIN (PU-PH) Pharmacie clinique
Mr Jean-Marie VAUGEOIS Pharmacologie
Mr Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale
Mr Jérémy BELLIEN (MCU-PH) Pharmacologie
Mr Frédéric BOUNOURE Pharmacie Galénique
Mr Abdeslam CHAGRAOUI Physiologie
Mme Camille CHARBONNIER (LE CLEZIO) Statistiques
Mme Elizabeth CHOSSON Botanique
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Cécile CORBIERE Biochimie
Mr Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
Mme Dominique DUTERTE- BOUCHER Pharmacologie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr François ESTOUR Chimie Organique
9
Mme Nejla EL GHARBI-HAMZA Chimie analytique
Mme Marie-Laure GROULT Botanique
Mr Hervé HUE Biophysique et mathématiques
Mme Laetitia LE GOFF Parasitologie – Immunologie
Mme Hong LU Biologie
M. Jérémie MARTINET (MCU-PH) Immunologie
Mme Marine MALLETER Toxicologie
Mme Sabine MENAGER Chimie organique
Mme Tiphaine ROGEZ-FLORENT Chimie analytique
Mr Mohamed SKIBA Pharmacie galénique
Mme Malika SKIBA Pharmacie galénique
Mme Christine THARASSE Chimie thérapeutique
Mr Frédéric ZIEGLER Biochimie
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale
Mr Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
Mme Anaïs SOARES Bactériologie
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
Mme Anne-Sophie CHAMPY Pharmacognosie
M. Jonathan HEDOUIN Chimie Organique
10
LISTE DES RESPONSABLES DES DISCIPLINES PHARMACEUTIQUES
Mme Cécile BARBOT Chimie Générale et minérale
Mr Thierry BESSON Chimie thérapeutique
Mr Roland CAPRON Biophysique
Mme Marie-Catherine CONCE-CHEMTOB Législation et économie de la santé
Mme Elisabeth CHOSSON Botanique
Mme Isabelle DUBUS Biochimie
Mr Abdelhakim ELOMRI Pharmacognosie
Mr Loïc FAVENNEC Parasitologie
Mr Michel GUERBET Toxicologie
Mr François ESTOUR Chimie organique
Mme Isabelle LEROUX-NICOLLET Physiologie
Mme Martine PESTEL-CARON Microbiologie
Mr Mohamed SKIBA Pharmacie galénique
Mr Rémi VARIN Pharmacie clinique
M. Jean-Marie VAUGEOIS Pharmacologie
11
III – MEDECINE GENERALE
PROFESSEUR
Mr Jean-Loup HERMIL (PH-PH) UFR Médecine générale
MAITRE DE CONFERENCE
Mr Matthieu SCHUERS (MCU-PH) UFR Médecine générale
PROFESSEURS ASSOCIES A MI-TEMPS – MEDECINS GENERALISTE
Mr Emmanuel LEFEBVRE UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine générale
Mr Philippe NGUYEN THANH UFR Médecine générale
Mme Marie Thérèse THUEUX UFR Médecine générale
MAITRE DE CONFERENCES ASSOCIE A MI-TEMPS – MEDECINS GENERALISTES
Mr Pascal BOULET UFR Médecine générale
Mr Emmanuel HAZARD UFR Médecine Générale
Mme Marianne LAINE UFR Médecine Générale
Mme Lucile PELLERIN UFR Médecine générale
12
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
Mr Serguei FETISSOV (med) Physiologie (ADEN)
Mr Paul MULDER (phar) Sciences du Médicament
Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
Mr Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905)
Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079)
Mme Carine CLEREN (med) Neurosciences (Néovasc)
M. Sylvain FRAINEAU (med) Physiologie (Inserm U 1096)
Mme Pascaline GAILDRAT (med) Génétique moléculaire humaine (UMR 1079)
Mr Nicolas GUEROUT (med) Chirurgie Expérimentale
Mme Rachel LETELLIER (med) Physiologie
Mme Christine RONDANINO (med) Physiologie de la reproduction
Mr Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076)
Mr Frédéric PASQUET Sciences du langage, orthophonie
Mme Isabelle TOURNIER (med) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de BOIS GUILLAUME CB - Centre Henri Becquerel CHS - Centre Hospitalier Spécialisé du Rouvray CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
13
Table des matières
Liste des tableaux ... 15
Liste des figures ... 16
Glossaire ... 17
Introduction ... 18
1. Première partie : État des lieux des thérapies ciblées en France ... 20
1.1. Chiffres clés du cancer en France ... 20
1.2. Cancers : les voies de l’oncogenèse ... 21
1.3. L’arsenal thérapeutique anticancéreux disponible en France en 2015 ... 22
1.3.1. La chirurgie ... 23
1.3.2. La radiothérapie ... 23
1.3.3. Les chimiothérapies ... 23
1.3.4. Classification des médicaments anticancéreux ... 23
1.4. Thérapies ciblées : des médicaments innovants ... 26
1.4.1. Généralités sur les anticorps monoclonaux et les petites molécules ... 26
1.4.1.1. Anticorps monoclonaux et mécanisme d’action... 26
1.4.1.2. Inhibiteurs de tyrosine kinase et mécanisme d’action ... 27
1.4.1.3. Liste des thérapies ciblées autorisées en France ... 28
1.4.2. Utilisation des thérapies ciblées... 31
1.4.2.1. Évolution des indications ... 31
1.4.2.2. Voies d’administration ... 32
1.4.2.3. Localisations tumorales ... 32
1.4.2.4. L’évaluation du caractère innovant ... 34
1.4.2.5. Modalités d’utilisation des thérapies ciblées ... 37
1.4.2.6. Stratégie thérapeutique et lignes de traitement ... 39
1.4.3. Plateformes de génétique moléculaire et identification des biomarqueurs ... 41
1.4.4. Toxicité des thérapies ciblées ... 46
2. Deuxième partie : Prise en charge, dépenses et accès aux thérapies ciblées ... 55
2.1. Résumé du parcours de soins en cancérologie ... 55
2.2. Activité hospitalière de cancérologie ... 57
2.2.1. Activité de soins en cancérologie générale ... 58
2.2.2. Activité de chimiothérapie ... 59
2.3. Coût du cancer en France et valorisation des thérapies ciblées ... 60
2.3.1. Dépenses générales de l’Assurance Maladie ... 60
2.3.2. Évaluations médico-économiques... 63
14
2.3.4. Coût des thérapies ciblées ... 68
2.3.4.1. Négociation du prix des thérapies ciblées ... 68
2.3.4.2. Données de ventes des thérapies ciblées ... 69
2.3.4.3. Données de remboursements à l’hôpital ... 71
2.3.4.4. Données de remboursements en ville ... 73
2.3.4.5. Tests génétiques moléculaires ... 74
2.4. Accès aux thérapies ciblées innovantes ... 77
2.4.1. Les essais cliniques ... 78
2.4.1.1. Les CLIP2 ... 79
2.4.1.2. Le programme AcSé ... 81
2.4.2. Les autorisations temporaires d’utilisation ... 83
2.4.3. Les recommandations temporaires d’utilisation ... 83
2.4.4. Les AMM conditionnelles ... 84
2.5. Les thérapies ciblées à l’international ... 85
2.5.1. Europe ... 85
2.5.2. États-Unis ... 85
2.5.3. Le consortium international de génomique du cancer ... 87
2.6. Perspectives des thérapies ciblées dans la lutte contre le cancer ... 88
2.6.1. Révolution de la génomique ... 88
2.6.2. Perspectives de prise en charge par l’Assurance Maladie ... 89
Discussion et Conclusion ... 91
Annexes ... 95
Bibliographie ... 132
Serment de Galien ... 137
15 Liste des tableaux
TABLEAU 1–LISTE DES THERAPIES CIBLEES AUTORISEES EN FRANCE A FIN 2015... 29 TABLEAU 2–LIGNE DE TRAITEMENT VISEE PAR LES INDICATIONS DES THERAPIES CIBLEES OCTROYEES EN 2012-2013 ... 40 TABLEAU 3–MECANISMES ONCOGENIQUES INHIBES PAR LES THERAPIES CIBLEES. ... 41 TABLEAU 4-NOMBRE DE RECHERCHES DE MARQUEURS PREDICTIFS DE LA REPONSE A UNE THERAPIE CIBLEE EN 2014 PAR
LES PLATEFORMES DE GENETIQUE MOLECULAIRE ... 44 TABLEAU 5-LISTE DES EFFETS SECONDAIRES DES THERAPIES CIBLEES ... 47 TABLEAU 6–PARAMETRES PHARMACOCINETIQUES DE QUELQUES INHIBITEURS DE TYROSINE KINASE ... 53 TABLEAU 7-REPARTITION DES PERSONNES ATTEINTES DE CANCER HOSPITALISEES EN MC0 PAR SEXE ET PAR AGE EN 2015
... 59 TABLEAU 8-REPARTITION DES DEPENSES REMBOURSEES PAR L’ASSURANCE MALADIE PAR GRANDS GROUPES DE
16 Liste des figures
FIGURE 1-LA DIVISION CELLULAIRE CANCEREUSE ... 22
FIGURE 2-CLASSIFICATION DES MEDICAMENTS ANTICANCEREUX ET PERIMETRE DE LA MEDECINE DE PRECISION ... 24
FIGURE 3-PART DES THERAPIES CIBLEES DANS L’ARSENAL THERAPEUTIQUE AUTORISE DANS LE CANCER... 25
FIGURE 4-MECANISMES D'ACTION SIMPLIFIES DES ANTICORPS MONOCLONAUX ET INHIBITEURS ENZYMATIQUES ... 26
FIGURE 5–INHIBITION DE LA TRANSDUCTION DU SIGNAL PAR LES ACM ET LES ITK ... 28
FIGURE 6-NOMBRE DE THERAPIES CIBLEES DIFFERENTES AYANT AU MOINS UNE INDICATION DANS CHAQUE LOCALISATION TUMORALE ... 33
FIGURE 7-THERAPIES CIBLEES UTILISEES DANS PLUSIEURS LOCALISATIONS TUMORALES ... 34
FIGURE 8-REPARTITION DES SMR ACCORDES AUX INDICATIONS DES THERAPIES CIBLEES DISPOSANT D’UN AVIS DE LA TRANSPARENCE PUBLIE ... 36
FIGURE 9-REPARTITION DES ASMR ACCORDES AUX INDICATIONS DES THERAPIES CIBLEES DISPOSANT D’UN AVIS DE LA TRANSPARENCE PUBLIE ... 37
FIGURE 10-MODALITES D’UTILISATION DES THERAPIES CIBLEES SELON LEURS INDICATIONS THERAPEUTIQUES ... 38
FIGURE 11-MOMENT D’UTILISATION DES THERAPIES CIBLEES, EN FONCTION DU STADE DE LA MALADIE, CONFORMEMENT À LEURS INDICATIONS THERAPEUTIQUES ... 39
FIGURE 12-SITUATION DES PLATEFORMES DE GENETIQUE MOLECULAIRE EN FRANCE ... 43
FIGURE 13–REPARTITION DES SEJOURS ET SEANCES PAR CATEGORIE D’ETABLISSEMENTS EN MCO EN 2015 ... 58
FIGURE 14–ÉVOLUTION DU NOMBRE DE SEJOURS ET SEANCES DE CHIMIOTHERAPIE EN MCO DEPUIS 2010... 60
FIGURE 15–REPARTITION DES SEJOURS ET SEANCES DE CHIMIOTHERAPIE PAR CATEGORIES D'ETABLISSEMENTS EN 2015 60 FIGURE 16-MODELE DE CALCUL DE L'ICER... 64
FIGURE 17-DESIGN ET HYPOTHESES TESTEES D'UNE ETUDE MEDICO-ECONOMIQUE DE L’ERLOTINIB EN 2ND LIGNE DE TRAITEMENT DES CBNPC ... 65
FIGURE 18-NOMBRE DE PATIENTS AYANT REÇU UNE THERAPIE CIBLEE DE LA LISTE EN SUS A L'HOPITAL EN 2014 ... 68
FIGURE 19-MONTANT DES VENTES ANNUELLES DE MEDICAMENTS ANTICANCEREUX EN VILLE ET A L'HOPITAL ... 70
FIGURE 20-ÉVOLUTION DE LA REPARTITION DES DEPENSES LIEES AUX MOLECULES ANTICANCEREUSES DE LA LISTE EN SUS, PAR CATEGORIES DE MOLECULES ET D’ETABLISSEMENTS, DEPUIS 2010 EN MCO ... 71
FIGURE 21-REPARTITION DES DEPENSES DE MOLECULES ANTICANCEREUSES DE LA LISTE EN SUS EN 2015 EN MCO... 72
FIGURE 22–DEPENSES LIEES AUX THERAPIES CIBLEES DE LA LISTE EN SUS EN 2014(MCO ET HAD) ... 72
FIGURE 23–REMBOURSEMENTS PAR L’ASSURANCE MALADIE DES MOLECULES ANTICANCEREUSES DELIVREES EN OFFICINE DEPUIS 2012 PAR CATEGORIES DE MOLECULES ... 73
FIGURE 24-DEPENSES LIEES AUX THERAPIES CIBLEES DISPENSEES EN OFFICINE EN 2014 ... 74
FIGURE 25-RECETTES DE L'INCA EN 2018 ... 75
FIGURE 26-DEPENSES DE L'INCA EN 2018 PAR NATURE DE DEPENSE ... 75
FIGURE 27-PRINCIPE DE L'ESSAI CLINIQUE BASKET ... 78
FIGURE 28-PRINCIPE DE L'ESSAI CLINIQUE UMBRELLA... 79
FIGURE 29-DISTRIBUTION GEOGRAPHIQUE DES CLIP2 ... 80
FIGURE 30-REPARTITION DES INCLUSIONS EN FONCTION DU TYPE DE TRAITEMENT DANS LES ESSAIS EN MONOTHERAPIE ENTRE 2009 ET 2012... 81
17 Glossaire
AcM Anticorps monoclonal
ADN Acide désoxyribonucléique
ALD Affection longue durée
AMM Autorisation de mise sur le marché
ANSM Agence nationale de sécurité du médicament et des produits de santé
ASMR Amélioration du service médical rendu
ATU Autorisation temporaire d’utilisation
CBNPC / CPNPC Cancer bronchique/pulmonaire non à petites cellules
CEPS Comité économique des produits de santé
CLIP2 Centres labellisés INCa de phase précoce
EGFR Epidermal Growth Factor Receptor
GIST Gastro Intestinal Stroma Tumor
HAD Hospitalisation à domicile
HAS Haute Autorité de santé
HER Human Epidermal Growth Factor Receptor
INCa Institut national du cancer
ITK Inhibiteur de tyrosine kinase
LEEM Les Entreprises du médicament
LMC Leucémie myéloïde chronique
MCO Médecine chirurgie obstétrique
NGS Next Generation Sequencing
QALY Quality-adjusted life year
RCP Réunion de concertation pluridisciplinaire
SMR Service médical rendu
18
Introduction
La médecine de précision, encore appelée médecine personnalisée ou médecine stratifiée, correspond à l’adaptation d’un traitement aux caractéristiques d’un patient pour une maladie donnée. Ainsi, des patients atteints d’une même maladie peuvent bénéficier d’un traitement différent selon leurs caractéristiques génétiques ou les résultats de leur bilan biologique.
La notion de médecine personnalisée n’est pas récente. En effet déjà durant l’Antiquité, le médecin Hippocrate – qui a donné le premier nom de « karkinoma » (carcinome) au cancer, en référence à l’aspect du prolongement de certaines tumeurs ressemblant étrangement aux pattes du crabe – établissait le diagnostic de ses patients en fonction de leurs quatre humeurs (sang, phlegme, bile jaune, bile noire) et adaptait le traitement de chacun en conséquence. Aujourd’hui, les progrès de la génomique et l’étude de l’ADN permettent une bien meilleure compréhension des maladies et l’on peut savoir à l’avance si une personne est susceptible de répondre ou non à un traitement (efficacité versus inefficacité thérapeutique et/ou effets indésirables importants). Ainsi, mesurer un marqueur biologique pour évaluer la susceptibilité du patient à répondre au traitement, ou pour déterminer la dose optimale du médicament à administrer, relève de la médecine personnalisée. La glycémie est un bon exemple de biomarqueur en médecine personnalisée puisqu’elle permet d’adapter la dose d’insuline à administrer chez le patient diabétique.
Depuis une dizaine d’années, les innovations en cancérologie constituent une réelle révolution dans la médecine de précision, notamment grâce aux thérapies dites ciblées. Ces traitements, oraux ou injectables, ont la particularité de ne s’attaquer qu’aux cellules cancéreuses, selon leurs caractéristiques génétiques, à la différence des chimiothérapies classiques généralement agressives pour l’ensemble des cellules de l’organisme (cytotoxiques).
L’arrivée de l’imatinib (Glivec®) en France en 2001, la première petite molécule de thérapie ciblée ayant bénéficié d’une autorisation de mise sur le marché (AMM) dans l’hexagone, a considérablement amélioré la prise en charge des patients atteints de leucémie myéloïde chronique (LMC), en faisant passer leur survie à dix ans de 20 % à
19 85 % (Kantarjian H, O'Brien S, 2012). Cette molécule reste actuellement prescrite en première intention dans le traitement de la LMC.
Cependant, les molécules de thérapies ciblées n’apportent pas toutes un gain de survie aussi important, ne sont pas toutes dénuées d’effets indésirables et sont d’un coût bien supérieur aux chimiothérapies conventionnelles (prix de vente, coût de tests diagnostiques). De plus, elles peuvent être associées à d’autres traitements (chirurgie, radiothérapie ou chimiothérapie) et ne sont pas toujours utilisées en première intention.
L’objectif de ce travail est tout d’abord de présenter les aspects scientifiques des thérapies moléculaires ciblées prescrites en France jusqu’à 2015, en se focalisant sur les inhibiteurs de tyrosine kinase et les anticorps monoclonaux, d’en détailler les avantages et les inconvénients et de définir leurs modalités d’accès pour la population en étudiant les aspects économiques.
20
1.
Première partie : État des lieux des thérapies ciblées en
France
1.1. Chiffres clés du cancer en France
D’après les données de l’Institut National du Cancer (INCa), publiées dans Les
cancers en France éditions 2014, 2015 et 2016, le cancer en France est responsable
chaque année de près de 150 000 décès (correspondant à la mortalité de 2015) et l’on estime à 385 000 le nombre de nouveaux cas (correspondant à l’incidence de 2015). Le nombre de personnes de 15 ans et plus en vie en 2008 et ayant eu un cancer au cours de leur vie est de l’ordre de 3 millions : 1 570 000 hommes et 1 412 000 femmes, ce qui correspond à 6,4 % de la population masculine de 15 ans et plus et 5,3 % de la population féminine correspondante.
On observe d’après les mêmes sources, depuis 2005, un taux d’incidence qui baisse chez les hommes (-1,3 % par an sur la période 2005 – 2012) et se stabilise chez les femmes (+0,2 % par an sur la même période), ainsi qu’un taux de mortalité en diminution depuis 1980 chez les hommes (-1,5 % par an sur la période 1980 – 2012) et les femmes (-1 % par an sur la même période). Cette diminution des taux d’incidence et de mortalité ne doit pas être confondue avec le nombre absolu de nouveaux cas et de décès par cancer annuels, qui ne sont que le reflet de la croissance continue de la population et de son vieillissement.
Chez les hommes, les cancers les plus fréquents sont respectivement celui qui touche la prostate, le poumon et le cancer colorectal. Le cancer pulmonaire est actuellement le plus meurtrier. Chez les femmes, les cancers les plus fréquents sont respectivement celui du sein, le cancer colorectal et le cancer pulmonaire. Le cancer du sein demeure le plus meurtrier chez la femme en 2015.
La survie varie considérablement selon la localisation du cancer. En effet la survie à dix ans (patients diagnostiqués entre 1989 et 2004) varie de 1 % pour le mésothéliome pleural à 93 % pour le cancer du testicule chez l’homme et respectivement de 6 % (foie) à 92 % (thyroïde) chez la femme. Bien sûr, des paramètres comme l’âge et les comorbidités, non liés au cancer au moment du diagnostic sont également à prendre
21 en compte. Par ailleurs, la précocité du diagnostic d’un cancer est un facteur de survie important.
Enfin, les cancers même guéris ne sont pas sans conséquences. L’enquête observationnelle VICAN 2 de 2012 (INCa, 2015) rapporte que trois personnes sur cinq déclarent avoir conservé des séquelles deux ans après un diagnostic et/ou traitement de cancer et 9 % des personnes interrogées disent avoir subi une discrimination liée directement à leur maladie. La situation socio-professionnelle des personnes atteintes d’un cancer s’est également dégradée considérablement deux ans après le diagnostic, avec un taux d’emploi passant de 75,3 % pour la population générale à 61,3 % pour les malades du cancer et un taux de chômage de 10 % à 11,1 %. Parmi les malades ayant perdu leur emploi, près de 92 % l’ont perdu dans les 15 mois suivant le diagnostic.
1.2. Cancers : les voies de l’oncogenèse
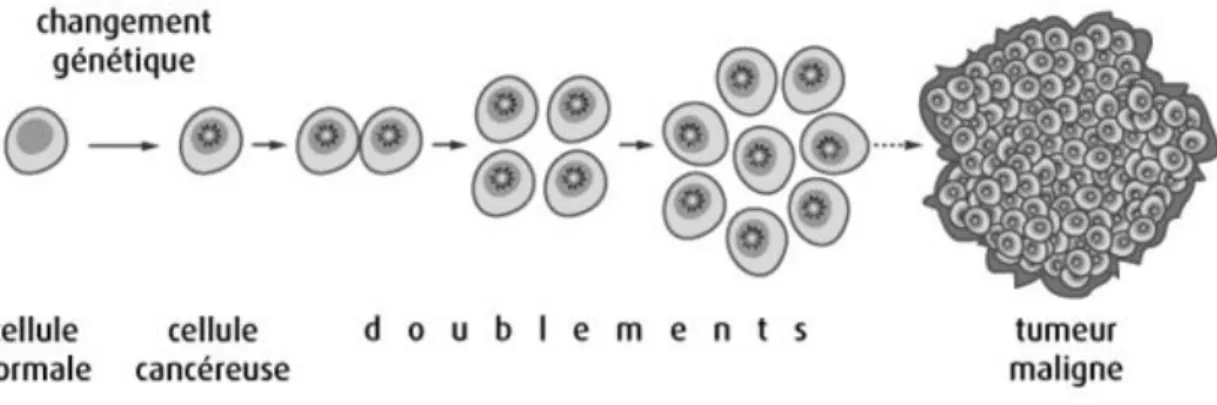
D’une manière générale, les cancers correspondent à un dysfonctionnement cellulaire entraînant la défaillance de l’organe touché. Ils résultent d’une anomalie de l’ADN transmissible d’une cellule mère à ses cellules filles. Lors de la division cellulaire normale, des erreurs se produisent en permanence (par des altérations spontanées telles la tautomérisation, désamination ou mésappariement des bases, ou par des dommages environnementaux comme les radiations ionisantes ou les agents chimiques) mais sont dans la grande majorité des cas réparées, soit par une correction de l’erreur (par exemple par excision de bases ou de nucléotides ou par ligature des coupures de simple brin d’ADN) soit par une destruction de la cellule devenue anormale (apoptose). Lorsque ces erreurs ne sont pas corrigées, elles peuvent s’accumuler et créer une cellule dite cancéreuse (Figure 1, d’après le site web Tpe radiothérapie).
22
Figure 1 - La division cellulaire cancéreuse
La transformation d’une cellule normale en cellule cancéreuse est un processus long qui peut durer jusqu’à des dizaines d'années de divisions cellulaires. Une fois transformée, la cellule cancéreuse comprend les caractéristiques suivantes : une indépendance vis-à-vis des signaux qui régulent habituellement la croissance et la division (favorisant ou freinant), une capacité à échapper au processus de mort cellulaire programmée, et une capacité à se diviser indéfiniment et avec une rapidité de division bien plus importante que celle des cellules saines.
La multiplication incontrôlable et anarchique de cellules cancéreuses va alors former la tumeur. Si des cellules cancéreuses se détachent de cet amas cellulaire et migrent, elles iront former des métastases au niveau d’autres organes.
Dans 90 % des cas les cancers sont acquis et résultent de facteurs externes ou du vieillissement cellulaire. Seulement 10 % des cancers sont d’origine héréditaire (prédispositions génétiques).
1.3. L’arsenal thérapeutique anticancéreux disponible en France en 2015
L’arsenal thérapeutique en oncologie comprend trois principaux outils : la chirurgie, la radiothérapie et la chimiothérapie (médicaments anticancéreux), à côté d’autres moyens que sont les soins palliatifs ou d’autres prises en charge.
23
1.3.1. La chirurgie
La chirurgie, couplée ou non à la radio ou la chimiothérapie, reste aujourd’hui le principal traitement du cancer avec environ 370 000 patients traités chaque année en France en secteur médecine chirurgie obstétrique (MCO) (INCa, 2015). Elle s’adresse pour la plupart des cas à des formes localisées de cancers, découverts à un stade précoce (75 % des traitements par chirurgie concernent les cancers du sein, de l’appareil digestif, des voies urinaires ou de la peau).
1.3.2. La radiothérapie
La radiothérapie utilise quant à elle des rayonnements afin de détruire les cellules cancéreuses en bloquant leur multiplication. Elle concernait plus de 194 000 cas en 2013 (INCa, 2015).
1.3.3. Les chimiothérapies
La chimiothérapie est un traitement médicamenteux du cancer visant à détruire les cellules cancéreuses par différents mécanismes pharmacologiques. Elle concernait un peu plus de 292 000 personnes atteintes d’un cancer en 2013 en secteur MCO, correspondant à une activité de chimiothérapie de 2 232 669 séances et 253 392 séjours (INCa, 2015).
1.3.4. Classification des médicaments anticancéreux
Bien qu’il n’existe pas de consensus sur la classification des médicaments anticancéreux, l’INCa propose depuis 2016 de les classer en quatre grandes catégories (figure 2, d’après INCa. 2016) en fonction de leur action pharmacologique : les chimiothérapies conventionnelles, les radiopharmaceutiques, les immunothérapies et les inhibiteurs de mécanismes oncogéniques (thérapies ciblées et hormonothérapies).
24
Figure 2 - Classification des médicaments anticancéreux et périmètre de la médecine de précision
Parmi ces médicaments, les thérapies ciblées anticancéreuses visent à bloquer la croissance et/ou la propagation des cellules tumorales en s’attaquant spécifiquement à certaines de leurs anomalies. Leur principal mode d’action correspond à une inhibition des mécanismes mêmes de l’oncogenèse, grâce à une spécificité importante pour les cellules cancéreuses ou leur microenvironnement. Ce sont soit des inhibiteurs intracellulaires (petites molécules, notamment des inhibiteurs de protéine kinase), soit des inhibiteurs extracellulaires (médicaments biologiques, notamment des anticorps monoclonaux). Tandis que les inhibiteurs de protéine kinase peuvent être multi-kinases et ainsi inhiber plusieurs voies, les anticorps sont toujours spécifiques d’une seule cible.
25 Les thérapies ciblées partagent des caractéristiques communes avec d’autres classes, notamment les hormonothérapies et les immunothérapies spécifiques de type anticorps. En effet, les hormonothérapies bloquent l’action pro-oncogénique des stéroïdes dans le cancer du sein et le cancer de la prostate et peuvent ainsi être rapprochées des thérapies ciblées dans la classification de l’INCa, tandis que les immunothérapies spécifiques se fixant à des antigènes de surface (par exemple le CD20) sont considérées par certains comme des thérapies ciblées. L’INCa estime qu’il n’y a pas lieu d’intégrer les immunothérapies spécifiques dans les thérapies ciblées de la présente classification, au motif qu’elles n’agissent pas en bloquant une voie de signalisation oncogénique, mais en activant un mécanisme immunitaire (Antibody-dependent cell-mediated cytotoxicity, ou ADCC).
Au sein de l’arsenal thérapeutique contre le cancer, environ un anticancéreux avec AMM sur quatre est une molécule de thérapie ciblée (figure 3, d’après INCa. 2016).
Figure 3 - Part des thérapies ciblées dans l’arsenal thérapeutique autorisé dans le cancer
Note : Cette thèse traite la catégorie des thérapies ciblées selon la dernière classification de l’INCa, et se concentre donc sur leurs deux sous-classes pharmacologiques majoritaires, à savoir les anticorps monoclonaux (suffixe « -mab », du terme « monoclonal antibody ») et les petites molécules (en particulier, les inhibiteurs de tyrosine kinase, suffixe « -nib » et apparentés).
26
1.4. Thérapies ciblées : des médicaments innovants
1.4.1. Généralités sur les anticorps monoclonaux et les petites molécules
1.4.1.1. Anticorps monoclonaux et mécanisme d’action
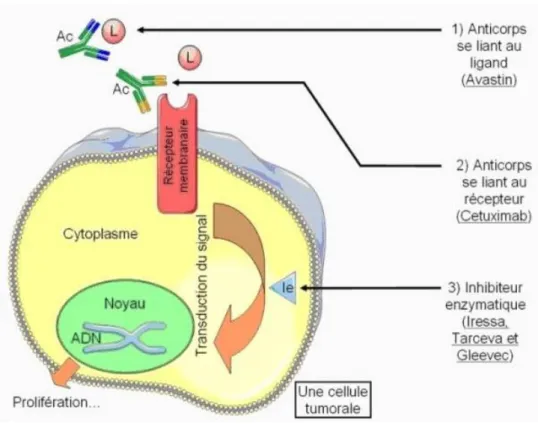
Les anticorps monoclonaux (AcM), dont le mécanisme d'action est similaire aux anticorps naturels produits par le système immunitaire, sont de grandes molécules (environ 150 kDa) produites en laboratoire. Ils reconnaissent certaines protéines présentes à l'extérieur ou à la surface des cellules cancéreuses (biomarqueurs), et se lient spécifiquement à celles-ci. Ils neutralisent ainsi ces protéines spécifiquement exprimées par les cellules tumorales, dont ils stoppent la croissance, grâce à la perturbation de la transduction des signaux intracellulaires. Le mécanisme sera différent selon le type d’anticorps monoclonal : il agira soit en se liant directement au récepteur membranaire, rendant inaccessible le récepteur au ligand, soit en se liant au ligand, empêchant ce dernier de venir se lier au récepteur (figure 4, d’après la Ligue Contre le Cancer). Ces anticorps sont administrés par voie intraveineuse.
27 La nomenclature des anticorps monoclonaux suit une terminologie internationale homologuée et comprend un préfixe et trois suffixes. Après un préfixe toujours variable, le premier suffixe indique la structure cible : côlon (« col »), mammaire (« ma »), testicule (« got »), prostate (« pr »/ « pro »), cardiovasculaire (« cir »), viral (« vir »), système immunitaire (« lim »/ « li »), infection associée (« les »), tumeurs mixtes/diverses (« tum »/ « tu ») ; le deuxième suffixe indique l’espèce d’origine : souris (« o »), rat (« a »), hamster (« e »), primate (« i »), chimérique (« xi ») humanisée (« zu »), humaine (« u ») ; le dernier suffixe est « mab » indiquant un anticorps monoclonal (monoclonal antibody) ou un fragment d’anticorps. Par exemple, l’alem-tu-zu-mab sera un anticorps humanisé dirigé contre un antigène exprimé par différentes tumeurs malignes.
1.4.1.2. Inhibiteurs de tyrosine kinase et mécanisme d’action
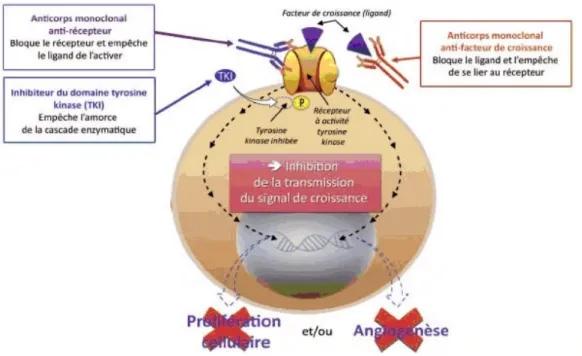
Les petites molécules, de taille inférieure à celle des anticorps monoclonaux, sont principalement représentées par les inhibiteurs d’une enzyme, la tyrosine kinase. En règle générale, la fixation d’un facteur de croissance cellulaire à un récepteur transmembranaire (par exemple HER, EGFR, Kit ou encore MET, récepteurs surexprimés dans la majorité des cancers) va pouvoir stimuler l'activité protéine kinase de ce dernier (correspondant à la phosphorylation du récepteur), transférant ainsi le signal mitotique vers l’intérieur de la cellule (il s’agit de la transduction du signal). L'activation de ce récepteur catalyse alors le transfert d'un phosphate de l'ATP intracellulaire vers un acide aminé (lorsqu’il s’agit de la tyrosine, on parle d'activité tyrosine kinase). Cette réaction est d’une grande importance dans le contrôle de la division cellulaire car elle correspond au démarrage de la cascade enzymatique conduisant à cette mitose.
Les inhibiteurs de tyrosine kinase (ITK) vont ainsi aider à arrêter la division cellulaire cancéreuse en bloquant des tyrosine kinases spécifiques qui indiquent à la cellule cancéreuse de se développer. Ces molécules pénètrent à l'intérieur des cellules cancéreuses et y neutralisent les cibles responsables de la croissance des cellules malignes (figure 5, d’après Dielenseger P. et al, 2014).
28
Figure 5 – Inhibition de la transduction du signal par les AcM et les ITK
Ces molécules de petite taille sont administrées par voie orale, ce qui constitue un réel avantage dans la prise en charge ambulatoire du cancer, et le nom des ITK se termine par le suffixe –nib, pour souligner leur caractère inhibiteur (exemple : imatinib, sorafenib).
1.4.1.3. Liste des thérapies ciblées autorisées en France
Les premières AMM européennes en cancérologie pour des thérapies ciblées datent du début des années 2000. Les deux premières thérapies ciblées à avoir bénéficié d’une AMM en France sont le trastuzumab (en 2000) et l’imatinib (en 2001).
Fin 2015, ce sont 43 molécules de thérapies ciblées qui sont autorisées en France (tableau 1, d’après INCa, 2016), dont 41 disposent d’une AMM (annexe I) et deux d’une Autorisation Temporaire d’Utilisation de cohorte (ATUc).
La présence des thérapies ciblées a été particulièrement importante sur les récentes années puisque 28 thérapies ciblées sur les 43 autorisées (65 %) l’ont été entre 2012 et 2015 (26 AMM et deux ATU de cohorte en cours fin 2015). Sur cette même période, plus de 60 % des AMM initiales pour des anticancéreux ont été octroyées à des thérapies ciblées (INCa, 2016).
29
Tableau 1 – Liste des thérapies ciblées autorisées en France à fin 2015
Inhibiteurs intracellulaire (petites
molécules) Inhibiteurs extracellulaires (biomédicaments)
DCI Nom de spécialité princeps Année d’AMM DCI Nom de spécialité princeps Année d’AMM
Inhibiteurs de protéine kinase Anticorps dirigés sur récepteurs de tyrosine kinase membranaires
ImatinibBM Glivec® 2001 trastuzumabBM Herceptin® 2000
ErlotinibBM Tarceva® 2005 cetuximabBM Erbitux® 2004
Sorafenib Nexavar® 2006 panitumumabBM Vectibix® 2007
Sunitinib Sutent® 2006 pertuzumabBM Perjeta® 2013
DasatinibBM Sprycel® 2006 trastuzumab
emtansineBM Kadcyla® 2013
NilotinibBM Tasigna® 2007 ramucirumab Cyramza® 2014
Temsirolimus1 Torisel® 2007
LapatinibBM Tyverb® 2008 Autres biomédicaments
GefitinibBM Iressa® 2009 bevacizumab Avastin® 2005
30
Everolimus2 Afinitor® 2009 aflibercept3 Zaltrap® 2013
Pazopanib Votrient® 2010 denosumab Xgeva® 2014
Vandetanib Caprelsa® 2012 VemurafenibBM Zelboraf® 2012 Axitinib Inlyta® 2012 CrizotinibBM Xalkori® 2012 Ruxolitinib Jakavi® 2012 BosutinibBM Bosulif® 2013 PonatinibBM Iclusig® 2013 AfatinibBM Giotrif® 2013 Regorafenib Stivarga® 2013 DabrafenibBM Tafinlar® 2013 Vismodegib Erivedge® 2013 Cabozantinib Cometriq® 2014 Ibrutinib Imbruvica® 2014 Idelalisib Zydelig® 2014
2 En cancérologie, utilisé comme agent antinéoplasique inhibiteur de protéine kinase (mTOR). 3 Protéine de fusion recombinante agissant comme un récepteur leurre soluble qui se lie au VEGF-A.
31 TrametinibBM Mekinist® 2014 Nintedanib Vargatef® 2014 CeritinibBM Zykadia® 2015 CobimetinibBM Cotellic® 2015 Lenvatinib Lenvima® 2015 Sonidegib Odomzo® 2015 OsimertinibBM - 2015 (ATUc) Palbociclib - 2015 (ATUc)
Autres Inhibiteurs Enzymatiques
OlaparibBM Lynparza® 2014
Les thérapies ciblées disposant d’un biomarqueur associé à leur prescription sont indiquées par le symbole BM
1.4.2. Utilisation des thérapies ciblées
1.4.2.1. Évolution des indications
Depuis la première thérapie ciblée autorisée en 2000 (le trastuzumab pour le cancer du sein métastatique HER2 positif), le nombre d’AMM octroyées pour ces thérapies est en constante augmentation ; deux thérapies ciblées autorisées entre 2000 et 2003, neuf entre 2004 et 2007, quatre entre 2008 et 2011, et 26 sur la période 2012-2015. Sur cette dernière période, 60 % des AMM initiales octroyées à des médicaments anticancéreux l’ont été à des thérapies ciblées (INCa, 2016). De plus, deux thérapies ciblées supplémentaires étaient disponibles fin 2015 en ATU de cohorte,
32 comptabilisant à cette date 43 thérapies ciblées autorisées (AMM et ATUc) pour 98 indications thérapeutiques enregistrées dans le traitement du cancer.
Les indications par molécule de thérapie ciblée (annexe I) sont variables et même si la majorité d’entre elles (22 sur 43 thérapies ciblées) n’ont qu’une seule indication thérapeutique, certaines en ont presque une dizaine (sept pour le panitumumab, neuf pour le trastuzumab, dix pour l’imatinib).
1.4.2.2. Voies d’administration
Les indications des thérapies ciblées concernent majoritairement, dans l’ordre, l’hématologie, l’appareil digestif et le sein. Les thérapies ciblées sont administrées principalement sous forme injectable pour le cancer du sein alors que pour les cancers hématologiques et digestifs elles le sont pour environ la moitié en formes orales et pour l’autre moitié sous forme injectable.
Sur les 43 thérapies ciblées autorisées à fin 2015, 33 sont administrables per os, soit 77 % de ces molécules.
1.4.2.3. Localisations tumorales
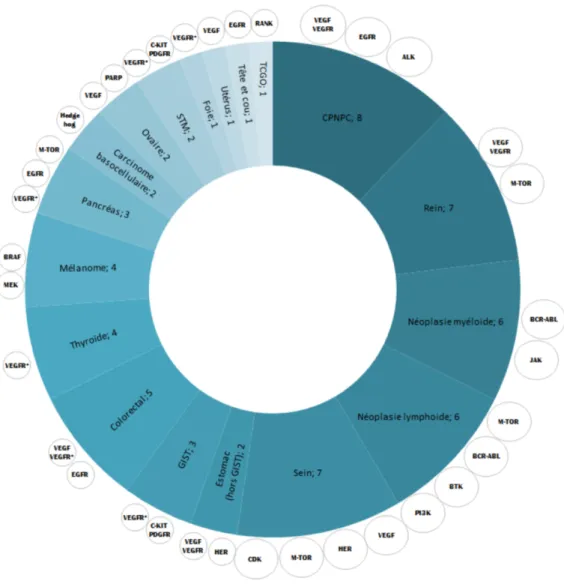
Ces 43 thérapies ciblées autorisées comprennent 16 localisations en oncologie solide (poumons, rein, sein, estomac hors GIST, GIST, colorectal, thyroïde, mélanome, pancréas, carcinome basocellulaire, ovaire, sarcome des tissus mous, foie, utérus, tête et cou, TCGC) ainsi que les hémopathies malignes myéloïdes et les hémopathies malignes lymphoïdes (Figure 6, d’après INCa, 2016). Le poumon (CPNPC), le rein, le sein et les hémopathies malignes (néoplasies myéloïdes et lymphoïdes) disposent du plus grand nombre de thérapies ciblées.
33
Figure 6 - Nombre de thérapies ciblées différentes ayant au moins une indication dans chaque localisation tumorale4
Bien que la majorité des thérapies ciblées (30 sur 43) soient autorisées dans un seul type de cancer (avec une ou plusieurs indications), différentes thérapies ciblées peuvent être autorisées pour le traitement d’un même type de cancer (Figure 7, d’après INCa, 2016). Ceci est dû à deux phénomènes : tout d’abord les thérapies ciblées peuvent inhiber des mécanismes oncogéniques communs à différentes pathologies cancéreuses (par exemple l’angiogenèse et donc la cible VEGF) ; de plus, une thérapie ciblée peut également agir sur différents mécanismes oncogéniques, comme par exemple l’imatinib inhibiteur de BCR-ABL (dans le traitement de la LMC) et inhibiteur de KIT et PDGFR (traitement du GIST).
4 Les cercles à l’extérieur du graphique indiquent les mécanismes oncogéniques visés par les thérapies
ciblées dans la localisation concernée. Le symbole * indique que la thérapie ciblée est un inhibiteur multikinase et que des mécanismes autres que VEGFR sont aussi bloqués.
Abréviations : CPNPC : cancer du poumon non à petites cellules ; GIST : tumeur stromale gasto-intestinale ; STM : sarcome des tissus mous ; TCGO : tumeur à cellules géantes de l’os.
34
Figure 7 - Thérapies ciblées utilisées dans plusieurs localisations tumorales5
Malgré une présence incontournable dans le traitement de nombre de cancers, les thérapies ciblées restent tout de même très limitées dans certaines localisations tumorales, notamment utérus, foie, et tête et cou. De plus, à fin 2015 quelques localisations tumorales ne disposent toujours pas de thérapie ciblée autorisée : tumeurs du système nerveux central, cancer du poumon à petites cellules, et cancer de la prostate (ce dernier étant cependant riche en alternatives thérapeutiques, grâce à de nouveaux cytotoxiques et hormonothérapies).
1.4.2.4. L’évaluation du caractère innovant
Deux indicateurs sont utilisés par la Commission de la transparence de la Haute Autorité de Santé (HAS) pour qualifier les médicaments dans les avis qu’elle rend au Comité Économique des Produits de Santé (CEPS) : le service médical rendu (SMR) qui, s’il est suffisant, permettra de faire inscrire le médicament sur la liste des
5 Abréviations : CCR : cancer colorectal ; CPNPC : cancer du poumon non à petites cellules ; DFSP :
dermatofibrosarcome protuberans ; GIST : tumeur stromale gastro-intestinale ; N Lymph : néoplasie lymphoïde ; N Myél : néoplasie myéloïde.
35 médicaments remboursables, et l’amélioration du service médical rendu (ASMR), qui donnera des indications sur le niveau de prix et de taux de remboursement pouvant être défendus par le CEPS lors de la négociation avec le laboratoire exploitant (les détails économiques des thérapies ciblées sont discutés en deuxième partie). Si la décision finale d’inscription au remboursement appartient au Ministère de la Santé, c’est l’UNCAM (Union Nationale des Caisses de l’Assurance Maladie) qui définit le champ des prestations admises au remboursement et fixe le taux de remboursement du médicament.
Le SMR prend en compte plusieurs aspects tels que la gravité de la pathologie pour laquelle le médicament est indiqué et les données propres au médicament lui-même dans une indication donnée (efficacité, effets indésirables, place dans la stratégie thérapeutique au regard des autres thérapies disponibles, caractère préventif/curatif/symptomatique, intérêt pour la sante publique) ; les niveaux de SMR définis sont les suivants : SMR majeur ou important ; SMR modéré ou faible, mais justifiant cependant le remboursement ; SMR insuffisant (SMRI ou Service médical rendu insuffisant) pour justifier une prise en charge par la collectivité. Le SMR d’un médicament peut évoluer dans le temps et se voir modifié, notamment lors de l’apparition de nouvelles données ou alternatives plus efficaces.
Comme le montre la figure 8 (d’après INCa, 2016), la grande majorité (95 %) des avis publiés par la Commission de Transparence fin 2015 sur les thérapies ciblées ont reçu un avis favorable à leur prise en charge (SMR important pour 87 %, modéré pour 6 % et faible pour 2 %). Seules cinq indications (5 % des avis sur les thérapies ciblées) ne peuvent pas bénéficier d’une prise en charge par la sécurité sociale à cause de leur SMR insuffisant. Il s’agit de l’erlotinib pour deux indications (en association avec la gemcitabine dans le cancer du pancréas et dans le traitement de maintenance des CBNPC sans restriction EGFR), du dasatinib dans la LMC chez patients naïfs de traitement, du nintedanib en association avec le docétaxel dans le CBNPC, et du ramucirumab dans le cancer gastrique en monothérapie.
36
Figure 8 - Répartition des SMR accordés aux indications des thérapies ciblées disposant d’un avis de la transparence publié
Comme le souligne l’INCa, les raisons conduisant à un SMR insuffisant peuvent être les suivantes : une démonstration d’efficacité manquant de fiabilité, une efficacité minime sans pertinence clinique au regard des effets indésirables (malgré une balance bénéfice/risque favorable), une efficacité démontrée uniquement dans une autre population que celle correspondant à l’AMM (ou dont la transposition à la population rencontrée est incertaine), un manque de pertinence dans la stratégie thérapeutique des affections visées par ses indications, l’existence d’alternatives thérapeutiques prouvant une efficacité plus fiable ou des effets indésirables plus faibles, ou bien des associations pour lesquelles l’intérêt n’a pas été prouvé.
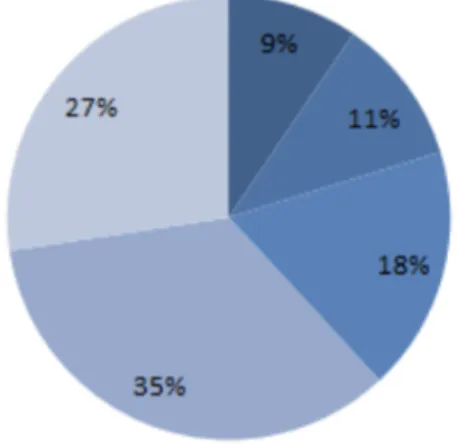
L’ASMR, fondé sur le progrès thérapeutique apporté par un médicament, peut être soit : ASMR I, majeure ; ASMR II, importante ; ASMR III, modérée ; ASMR IV, mineure ; ASMR V, inexistante (absence de progrès thérapeutique). Fin 2015, parmi les indications des thérapies ciblées ayant fait l’objet d’un avis de la transparence publié, 9 % ont obtenu une ASMR majeure, 11 % une ASMR importante, 18 % une ASMR modérée et 35 % une ASMR mineure (Figure 9, d’après INCa, 2016). Les ASMR inexistantes ont été délivrées dans 27 %6 des cas.
L’annexe II présente tous les SMR et ASMR des thérapies ciblées à fin 2015.
6 Le niveau d’ASMR a été qualifié de non évaluable pour trois indications du trastuzumab. Celles-ci
37
Figure 9 - Répartition des ASMR accordés aux indications des thérapies ciblées disposant d’un avis de la transparence publié
Depuis 2012, la Commission Évaluation Économique et de Santé Publique (CEESP, créée en 2008) va également émettre un avis d’efficience lorsqu’un produit de santé revendique une ASMR élevée (I, II ou III) et serait susceptible d’avoir un impact significatif sur les dépenses de l’Assurance Maladie (parmi les avis de la transparence publiés sur les thérapies ciblées, 38 % ont reçu une AMSR élevée). Cet avis d’efficience (efficacité/coût) a un impact possible sur la négociation du prix entre industriels et le CESP, bien qu’il soit informationnel et non décisionnel (annexe III).
1.4.2.5. Modalités d’utilisation des thérapies ciblées
La majorité des thérapies ciblées sont utilisées en monothérapie (62 % des indications fin 2015), notamment pour les inhibiteurs de tyrosine kinase (Figure 10, d’après INCa, 2016). Lorsqu’une thérapie ciblée a démontré une efficacité supérieure au traitement de référence seul, elle peut également être utilisée en association, dans l’un des cas suivants : en association avec une chimiothérapie cytotoxique ou immédiatement après une chimiothérapie cytotoxique, en association entre thérapies ciblées, en association avec une hormonothérapie, ou en association à une immunothérapie spécifique.
38
Figure 10 - Modalités d’utilisation des thérapies ciblées selon leurs indications thérapeutiques
En guise d’exemple pour l’utilisation en monothérapie, sur la période 2012-2013 trois thérapies ciblées ont démontré une efficacité supérieure à un protocole de chimiothérapie utilisant un ou plusieurs agents cytotoxiques (INCa, 2014). Ainsi, dans le mélanome avec mutation de BRAF, le vemurafenib (Zelboraf®) et le dabrafenib (Tafinlar®) ont été supérieurs à la dacarbazine (Deticene®) en termes de survie globale et/ou de survie sans progression. Dans le cancer pulmonaire non à petites cellules avec mutation activatrice de l’EGFR, l’afatinib (Giotrif®) a été supérieur à six cycles de pemetrexed-cisplatine (Alimta®-cisplatine). De plus, une thérapie ciblée utilisée en monothérapie, l’axitinib (Inlyta®), a démontré une efficacité supérieure à une autre thérapie ciblée, le sorafenib (Nexavar®), chez les patients ayant un cancer du rein avancé après échec d’un traitement antérieur.
Concernant les associations, sur la même période 2012-2013, trois types d’association ont obtenu une autorisation (INCa, 2014). L’association d’une thérapie ciblée antiangiogénique (aflibercept [Zaltrap®] ; bevacizumab [Avastin®]) à une chimiothérapie cytotoxique respectivement dans les cancers du côlon et de l’ovaire ; l’association de thérapies ciblées anti-HER2 (pertuzumab [Perjeta®] ; lapatinib [Tyverb®]) au trastuzumab (Herceptin®) dans les cancers du sein ; et l’association d’un inhibiteur mTOR (everolimus [Afinitor®]) à une hormonothérapie dans les cancers du sein.
39
1.4.2.6. Stratégie thérapeutique et lignes de traitement
Les thérapies ciblées sont utilisées chez des patients ayant une hémopathie ou une maladie métastatique ou localement avancée qui sont soit naïfs de traitement systémique, soit prétraités. Seulement 6 % des indications des thérapies ciblées, portées par trois molécules (trastuzumab et pertuzumab dans le cancer du sein, imatinib dans les GIST), sont utilisées en traitement adjuvant ou néoadjuvant, amenant la grande majorité (94 %) des indications des thérapies ciblées à une utilisation à un stade avancé de maladie cancéreuse (Figure 11, d’après INCa, 2016). Dans cette majorité d’indications, environ la moitié autorisent une utilisation chez le patient naïf de traitement (1ère ligne ou indication ne spécifiant pas la ligne de
traitement).
Figure 11 - Moment d’utilisation des thérapies ciblées, en fonction du stade de la maladie, conformément à̀ leurs indications thérapeutiques
A titre d’exemple, la majorité des nouvelles indications des thérapies ciblées entre 2012 et 2013 concernaient des patients ayant déjà reçu un traitement spécifique de leur cancer (tableau 2, d’après INCa, 2014) ; certaines sont indiquées après échec de plusieurs traitements.
40
Tableau 2 – Ligne de traitement visée par les indications des thérapies ciblées octroyées en 2012-2013
Indications chez les patients naïfs (1re ligne et plus)
Indications chez les patients prétraités (patients ayant reçu une 1re ligne en situation métastatique et/ou
patients en rechute précoce après un traitement adjuvant)
Caprelsa® Afinitor®
Erivedge® Avastin® (autorisation en 1re ligne octroyée
précédemment)
Giotrif® Bosulif® Glivec® (LAL φ+ nouvellement
diagnostiquée)
Iclusig® Perjeta® (1re ligne uniquement) Inlyta®
Tafinlar® Stivarga®
Zelboraf® Tyverb®
Votrient® Xalkori® Zaltrap®
En cas d’échec thérapeutique, l’INCa présente quatre types de stratégie (INCa, 2014) :
• En cas d’échec, poursuivre avec la même thérapie ciblée et associer à une chimiothérapie cytotoxique, ou utiliser une thérapie ciblée d’une autre classe mais agissant sur la même voie de signalisation (exemple : aflibercept en seconde ligne dans le cancer colorectal suivant l’échec d’un traitement par bevacizumab).
• Pour éviter une résistance, associer directement plusieurs thérapies ciblées agissant sur des voies de signalisation complémentaires (exemple : anti-BRAF et anti-MEK dans le mélanome).
• En cas de résistance avérée, associer plusieurs thérapies ciblées agissant sur la même voie de signalisation (exemple : ajout de lapatinib au trastuzumab en cas de résistance dans le traitement du cancer du sein).
• En cas de résistance, utiliser possiblement une thérapie ciblée dite de nouvelle génération également efficace contre les cellules résistantes de la tumeur
41 (exemple : ponatinib chez les patients ayant une LMC avec la mutation T351I).
1.4.3. Plateformes de génétique moléculaire et identification des biomarqueurs
De par leur mécanisme d’action, les thérapies ciblées visent un phénomène biologique ou un « motif protéique » présent seulement dans des sous-groupes de tumeurs. Pour plus de la moitié d’entre elles (22 sur 43, listées par le symbole BM dans le tableau 1), il existe un biomarqueur conditionnant leur prescription (en partie ou dans la totalité d’une indication autorisée) et il est ainsi nécessaire de réaliser des tests génétiques sur biopsies tumorales pour chaque patient afin d’analyser les caractères du génome tumoral ou l’expression de biomarqueurs (tissulaires ou circulants), avant de choisir la molécule appropriée. Il est possible de voir deux patients ayant le même cancer mais traités par deux thérapies ciblées différentes, ou de voir un même médicament traiter deux patients pour deux cancers différents (exemple : trastuzumab [Herceptin®] traitant les cancers du sein et les cancers gastriques ayant une amplification du gène HER2).
Actuellement, 20 mécanismes oncogéniques sont bloqués par une ou plusieurs thérapies ciblées (Tableau 3, d’après INCa, 2016).
Tableau 3 – Mécanismes oncogéniques inhibés par les thérapies ciblées7.
Mécanismes oncogéniques
Thérapies ciblées
Inhibiteurs intracellulaires Inhibiteurs extracellulaires
ALK crizotinib, ceritinib
BCR-ABL imatinib, bosutinib, dasatinib, nilotinib, ponatinib
BTK ibrutinib
CDK palbociclib
7 Les molécules entre parenthèses agissent sur le mécanisme oncogénique considéré́, mais cette
42
KIT imatinib, sunitinib, regorafenib (bosutinib, dasatinib, nilotinib, ponatinib, sorafenib, pazopanib, lenvatinib, cabozantinib)
EGFR erlotinib, gefitinib, afatinib, osimertinib (vandetanib) cetuximab, panitumumab HEDGEHOG vismodegib HER lapatinib (afatinib) trastuzumab, trastuzumab emtansine, pertuzumab JAK ruxolitinib
MEK trametinib, cobimetinib
m-TOR temsirolimus, everolimus
PARP olaparib
PDGFR
imatinib, bosutinib, dasatinib, nilotinib, ponatinib, sorafenib,
sunitinib, regorafenib,
pazopanib, lenvatinib,
nintedanib
PI3K idelalisib
BRAF vemurafenib, dabrafenib (sorafenib, regorafenib)
RANK denosumab
RET ponatinib, sunitinib,
regorafenib, lenvatinib, vandetanib, cabozantinib
VEGF/VEGFR axitinib, sorafenib, sunitinib,
pazopanib, nintedanib, regorafenib lenvatinib, vandetanib, cabozantinib, (ponatinib) bevacizumab, aflibercept, ramucirumab
43
MET cabozantinib
(crizotinib)
ROS1 crizotinib
En France, la réalisation de ces tests génétiques se fait grâce à 28 plateformes hospitalières de génétique moléculaire (laboratoires de génétique somatique des tumeurs), financées par l’INCa et l’Assurance Maladie via la Direction Générale de l’Offre de Soins (DGOS). Elles couvrent l’ensemble du territoire français et son généralement rattachées à des services d’Anatomopathologie (Figure 12, d’après INCa, 2016). Elles regroupent plusieurs laboratoires pouvant appartenir à des établissements différents (CHU, CLCC, CH ou établissements privés), permettant d’offrir aux patients l’ensemble des techniques de génétique moléculaire indispensables pour toutes les pathologies concernées.
44 Ces plateformes comprennent actuellement un catalogue de 60 tests différents, dont certains sont déterminants pour l’accès à des thérapies ciblées existantes ou en cours de développement. Ce catalogue évolue grâce à l’actualisation régulière du catalogue des biomarqueurs de l’INCa.
En 2014, les plateformes de génétique somatique des tumeurs ont réalisé 117 000 tests déterminants pour l’accès à une thérapie ciblée (à visée thérapeutique et diagnostique) pour un total de 70 000 patients (tableau 4, d’après INCa, 2016). Il faut noter que le nombre de tests réalisés sur une année ne correspond pas exactement au nombre absolu de personnes effectivement traitées par la ou les thérapie(s) ciblée(s) concernée(s).
Tableau 4 - Nombre de recherches de marqueurs prédictifs de la réponse à une thérapie ciblée en 2014 par les plateformes de génétique moléculaire
Pathologie Biomarqueur Nombre de patients testés Pourcentage de tests positifs Thérapies ciblées associées Cancer du sein Amplification d’HER2 8 866 18,4 % Trastuzumab Pertuzumab Lapatinib Cancer de l’estomac Amplification d’HER2 814 18,2 % Trastuzumab Cancer colorectal Mutations de KRAS 22 011 44,2 % Panitumumab Cetuximab Mutations de NRAS 18 085 4,7 % GIST Mutations de KIT 1 189 61,6 % Imatinib Mutations de PDGFRA 1 004 17,4 % Cancer du poumon Mutations d’EGFR 24 558 10,5 % Gefitinib Erlotinib Afatinib Osimertinib
45 Translocation d’ALK 21 183 3,2 % Crizotinib Ceritinib Translocation de ROS1 5 414 1,3 % Crizotinib Mélanome Mutation de BRAF V600 5 534 34,8 % Vemurafenib Dabrafenib Cobimetinib Trametinib Leucémies Détection de BCR-ABL 7 453 16,6 % Imatinib Dasatinib Nilotinib Bosutinib Ponatinib Mutations d’ABL 785 21,5 % Total 116 896
Malgré le caractère déterminant de ces tests compagnons pour la prescription de la majorité des thérapies ciblées uniquement aux populations présentant le biomarqueur correspondant, la HAS fait remarquer qu’à ce jour (HAS, 2014), dans plusieurs exemples, bien que le traitement par une thérapie ciblée conditionnée par un biomarqueur ait été initialement considéré comme a priori spécifique de sa cible et le biomarqueur comme central dans le mécanisme d’action du traitement, ce dernier s’est révélé actif chez des patients ne portant pas ce marqueur, pour diverses raisons. En effet une analyse des données de certains essais (HAS, 2014) a montré que jusqu’à 25 % des patients atteints d’un cancer colorectal métastatique identifié « EGFR négatif » (ne présentant pas le biomarqueur EGFR) par technique immunohistochimique (IHC) pourraient répondre au cetuximab (Erbitux®). Les explications avancées seraient le manque de spécificité de la technique IHC (faux négatifs) et/ou un phénomène d’« Antibody-dependent cell-mediated cytotoxicity » (ADCC) lié à la molécule envers les cellules tumorales. Cette cytotoxicité à médiation cellulaire dépendante des anticorps est une réaction par laquelle des cellules non immunocompétentes sont capables d’effectuer une cytolyse par l’intermédiaire d’anticorps qui vont désigner les cellules à détruire. Autre exemple, le trastuzumab