Caractérisation chez l’humain de l’expression de
différents gènes et fonctions biologiques associés à la
dépression et signatures transcriptionnelles spécifiques
au sexe à l’aide de différents modèles animaux
Mémoire
Théo Stéfan
Maîtrise en épidémiologie - avec mémoire
Maître ès sciences (M. Sc.)
Caractérisation chez l’humain de
l’expression de différents gènes et
fonctions biologiques associés à la
dépression et signatures
transcriptionnelles spécifiques au sexe à
l’aide de différents modèles animaux
Mémoire
Théo Stéfan
Maîtrise en épidémiologie - avec mémoire Maître ès sciences (M. Sc.)
Sous la direction de :
Benoit Labonté, directeur de recherche
Chantal Mérette, codirectrice de recherche
Résumé
Le trouble majeur de la dépression est un des troubles de santé mentale les plus fréquents dans la société d’aujourd’hui avec plus de 350 millions de personnes atteintes dans le monde. Malgré la présence de différents types de traitement, comme les antidépresseurs ou les thérapies comportementales, les causes de ce trouble ne sont pas encore complètement élucidées. Les lacunes concernant la compréhension de cette pathologie se trouve plus particulièrement au niveau de ses fondements génétiques. A partir d’un grand échantillon de 267 sujets atteints de la dépression, de 286 sujets témoins ainsi que de trois modèles animaux, la présente étude a pour objectif de mettre en évidence différents gènes et fonctions associés de façon significative à cette maladie et de caractériser les différences transcriptionnelles spécifiques au sexe. Pour ce faire, deux grandes étapes composent ce projet. Une analyse de gènes différentiellement exprimés ainsi qu’une de modules de gènes Eigengenes, toutes deux effectuées sur l’humain et sur les modèles animaux. Les résultats ont mis en exergue plusieurs gènes associés à la dépression et partagés entre l’humain et les modèles animaux. Il semblerait que le modèle animal qui reproduit le plus les observations chez l’humain soit celui de l’isolation sociale. De plus, plusieurs fonctions biologiques pertinentes avec la caractérisation du trouble étudié ont été identifiées. Par surcroît, les modules de gènes associés à la dépression chez les femelles étaient en plus grand nombre que chez les mâles et cette observation est bien reproduite dans le modèle du stress variable chronique de l’animal. Cette étude a donc permis une amélioration des connaissances concernant la génétique de la dépression. Il en ressort que les modèles animaux utilisés dans cette étude permettent de bien de reproduire un état dépressif chez l’animal.
Abstract
Major depressive disorder is one of the most common mental health disorder in modern society affecting more than 350 million people worldwide. While different types of treatment are available, such as antidepressants or behavioural therapies, causes of this disorder are not yet fully understood. A better comprehension of its genetic basis could fulfil the gaps. From a large sample of 267 subjects with depression, 286 control subjects and three animal models, this study aims to identify different genes and functions significantly associated with this disorder and to characterize sex-specific transcriptional differences. This project splits in two major steps: a differentially expressed genes analysis and a gene modules analysis using Eigengenes, both performed on humans and animal models. Results highlight several genes shared between humans and animal models. The animal model that seems to better reproduce the effects observed in humans is that of social isolation. In addition, several biological functions appear to be relevant to major depressive disorder characterization. Furthermore, gene modules associated with depression are more numerous in females than in males and this observation is reproduced in the animal’s chronic variable stress model. This study therefore enhanced knowledge about depression’s genetics and shows that animal models can be effectively used to reproduce a depressive state in animals.
Table des matières
Résumé………ii
Abstract………..iii
Table des matières ... iv
Liste des tableaux………..vi
Liste des figures……….vii
Liste des abréviations, sigles, acronymes………ix
Remerciements………...xi
Avant-propos………..xii
Introduction………..1
Chapitre 1 : Matériels et méthodes………...18
1.1 Description de l'étude cas-témoins………18
1.2 Prélèvement des tissus et régions cérébrales ciblées………19
1.2.1 La région Brodmann 25……….19
1.2.2 La région du Nucleus accumbens………..19
1.2.3 La région Subiculum………..20
1.3 Traitement des données de séquençage………20
1.3.1 Le mapping et assemblage des séquences alignées………..21
1.3.2 Séparation des reads mappés et non mappés………22
1.3.3 Identification des variants génétiques………..22
1.4 Explication des modèles animaux………..…23
1.4.1 Le modèle du Stress Variable Chronique (CVS)...23
1.4.2 Le modèle de l'Isolation Sociale (SI)………...23
1.4.3 Le modèle du Stress de la Défaite Social Chronique (CSDS)…..24
1.5 Conséquences fonctionnelles des changements génétiques observés chez l'humain en lien avec de nouveaux modèles animaux………..25
1.5.1 Diagrammes de Venn et HeatMaps………..26
1.5.2 Graphiques des fonctions biologiques communes entre l'humain et les différents modèles animaux...27
1.5.3 Analyses statistiques sur les valeurs Eigengenes……….28
1.5.4 Analyses de "Gene ontology" : recherche des fonctions des modules de gènes………...29
1.5.5 Représentations graphiques des valeurs de significativité des modules en fonction de leurs tailles et fonctions……….29
Chapitre 2: Analyse différentielle ... ..311
2.1 Analyse des gènes partagés entre l’humain et les différents modèles animaux………...……….31
2.2 Comparaison de la directionnalité d’expression des gènes associés à la dépression entre l’humain et les modèles animaux……….33
2.3 Analyse des fonctions ontologiques communes entre l’humain et les différents modèles animaux……….34
Chapitre 3 : Analyse de modules de gènes chez l’humain en comparaison à des modèles animaux de dépression.………...………....36
3.1 Association des modules de gènes en fonction de leurs tailles et de leurs rôles biologiques………..36
Discussion ... 39
Conclusion………43
Bibliographie………..46
Annexe I : Figures et tableaux en soutien à la méthode ... 533
Annexe II: Figures des résultats de l'analyse différentielle et des analyses d'association avec les modules de gènes……….57
Annexe III: Figures des résultats pour les deux autres régions du cerveau Brodmann 25 et Subiculum……….66
Liste des tableaux
Tableau 1. Résumé des gènes identifiés comme associés à la dépression dans la littérature………..51 Tableau 2. Statistiques descriptives des caractéristiques cliniques de l’échantillon de l’étude cas-témoins sur la dépression………52 Tableau 3. Principaux résultats obtenus dans les Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain et les modèles animaux………..………..81 Tableau 4. Principaux résultats obtenus dans les Heatmaps représentant la directionnalité de l’expression des gènes associés à la dépression entre l’humain et les modèles animaux……….………81 Tableau 5. : Principaux résultats obtenus dans les analyses des fonctions biologiques communes à l’humain et aux modèles animaux pour différents niveau de significativité ……….………..82 Tableau 6. Principaux résultats obtenus dans les analyses sur les modules de gènes significativement associés à la dépression en fonction de leur taille et de leur fonction biologiques………..………82
Liste des figures
Figure 1. Prévalence de la dépression majeure au cours de la vie chez des personnes âgées de 15 ans et plus, selon le sexe, Québec, 2012………5 Figure 2. Prévalence de la dépression majeure au cours de la vie en fonction de 4 catégories d’âge, selon le sexe , Québec, 2012………5 Figure 3. Prévalence à vie de la dépression dans différents pays en fonctions de leurs revenus………...7 Figure 4. Schéma démonstratif du processus de régulation de l’expression des gènes.……….13 Figure 5. Schéma démonstratif du traitement des données de séquençage ……….55 Figure6. Devis global du protocole de l’étude………56 Figure 7. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Région NAc) et les différents modèles animaux avec CSDS pour les souris Susceptibles……….57 Figure 8. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Région NAc) et les différents modèles animaux avec CSDS pour les souris Résilientes..……….58 Figure 9. Heatmaps représentant la directionnalité de l’expression des gènes associés à la dépression entre l’humain et les modèles animaux……59 Figure 10. Comparaison des fonctions communes à l’humain et aux modèles animaux pour différents niveaux de significativité……….60 Figure 11. Représentation des valeurs d’expression des modules Eigengene pour la région NAc en fonction du phénotype pour l’humain………61 Figure 12. Représentation graphique des modules de gènes significativement associés à la dépression en fonction de leur taille et de leur fonction biologique……….62
Figure 13. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Région BA25) et les différents modèles animaux avec CSDS pour les souris Susceptibles………..66 Figure 14. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Région BA25) et les différents modèles animaux avec CSDS pour les souris Résilientes………..67 Figures 15. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Subic) et le modèle du CSDS pour les souris Susceptibles……….68 Figure 16. Diagramme de Venn présentant les gènes associés à la dépression et partagés entre l’humain (Subic) et le modèle du CSDS pour les souris Résilientes……….69 Figure 17. Heatmaps représentant la directionnalité de l’expression des gènes associés à la dépression entre l’humain et les modèles animaux (Région BA25)……….……….70 Figure 18. Heatmaps représentant la directionnalité de l’expression des gènes associés à la dépression entre l’humain et le modèle du CSDS (Région Subic)……….………71 Figure 19. Comparaison des fonctions communes à l’humain et aux modèles animaux pour différents niveaux de significativité (Région BA25)……….72 Figure 20. Comparaison des fonctions communes à l’humain et aux modèles animaux pour différents niveaux de significativité (Région Subic)...73 Figure 21. Représentation graphique des modules de gènes significativement associés à la dépression en fonctions de leur taille et de leur fonction biologique (Région Ba25)………74 Figure 22. Représentation graphique des modules de gènes significativement associés à la dépression en fonctions de leur taille et de leur fonction biologique (Région Subic)………78
Liste des abréviations, sigles, acronymes
ADN Acide désoxyribonucléique ANOVA Analyse de variance ANTINS Insula antérieure
ATP Adenosine triphosphate
BA11 Aire de Brodmann 11
BA25 Aire de Brodmann 25
BA89 Aire de Brodmann 89
BDNF Facteur neurotrophique dérivé du cerveau
BET1 Bet1 Golgi Vesicular Membrane Trafficking Protein BWA Burrows Wheeller Aligner
CCDC19 Cilia And Flagella Associated Protein 45
CCK Cholecystokinin
CDC42EP1 CDC42 Effector Protein 1
CELF4 CUGBP Elav-Like Family Member 4 CHST8 Carbohydrate Sulfotransferase 8
CRF Facteur de libération de la corticotrophine CSDS Stress Chronique de la défaite sociale
CTRL Contrôle
CVS Stress Variable Chronique
DRD2 Dopamine Receptor D2
DUSP6 Dual Specificity Phosphatase 6 ECT Electroconvulsiothérapie
ELAVL2 ELAV Like RNA Binding Protein 2
FOXJ1 Forkhead Box J1
GALNT6 Polypeptide N-Acetylgalactosaminyltransferase 6 GATK4 Genome Analysis Toolkit 4
GM24148 Small Nucleolar RNA, C/D Box 20 (SNORD20) GTPases Enzymes guanosine triphosphate
GUF1 GUF1 Homolog, GTPase
HIST1H4H Histone Cluster 1 H4 Family Member H HSD11B1 Hydroxysteroid 11-Beta Dehydrogenase 1
HSPA13 Heat Shock Protein Family A (Hsp70) Member 13
MATR3 Matrin 3
MDD Major depressive desorder MEFC2C myocyte enhancer factor 2C
MOG Myelin Oligodendrocyte Glycoprotein
MTX3 Metaxin 3
MYRF Myelin Regulatory Factor
NEGR1 Neuronal Growth Regulator 1 NPTX2 Neuronal Pentraxin 2
NR4A3 Nuclear Receptor Subfamily 4 Group A Member 3
OLFM4 Olfactomedin 4
PMI Intervalles post-mortem
SI Isolation sociale
SNORD7 Small Nucleolar RNA, C/D Box 7
SORCS3 Sortilin Related VPS10 Domain Containing Receptor 3
SUBIC Subiculum
TMEM125 Transmembrane Protein 125 TMEM161B Transmembrane Protein 161B
WGCNA Weighted gene coexpression network analysis ZFP329 Zinc Finger Protein 329
ZMYM4 Zinc Finger MYM-Type Containing 4 ZRANB1 Zinc Finger RANBP2-Type Containing 1
Remerciements
Je remercie tout d’abord mon directeur de recherche Benoit Labonté pour sa très bonne supervision, ses enseignements ainsi que son soutien durant la réalisation de mes travaux de maîtrise. Je souhaite également chaleureusement remercier ma co-directrice de recherche Chantal Mérette pour son accompagnement et sa grande disponibilité durant la réalisation de ce mémoire. Mes remerciements vont également à Romaric et Ting-Huei pour leur aide et leur travail qui m’ont été précieux. Un grand merci à ma compagne Pauline pour son soutien sans faille et sa précieuse présence au quotidien qui a permis de rendre cette expérience rédactionnelle moins difficile. Je remercie chaudement ma famille et plus particulièrement mes parents pour leurs encouragements constants durant ce projet de maîtrise. Merci à mes amis Philippe et Antoine, pour les moments passés ensemble qui ont rendu la rédaction de ce mémoire plus facile. Je remercie aussi ma collègue et amie Elisabeth pour ses précieux conseils et sa compagnie au cours de ma maîtrise. Merci, votre soutien et votre présence ont contribué à la rédaction de ce mémoire qui concrétise une étape très importante de mon parcours académique.
Avant-propos
Cet avant-propos consiste à exposer les tâches que j’ai effectuées durant mes travaux de maîtrise. Il est important de prendre conscience que les résultats présentés dans ce mémoire s’inscrivent dans un projet de recherche beaucoup plus large et que ces derniers peuvent découler d’autres étapes réalisées au préalable au cours de ce grand projet.
Tout d’abord toutes les expérimentations animales et humaines effectuées en laboratoire ont été réalisées au préalable par d’autres professionnels ou étudiants de recherche. Suite à cela, la totalité du traitement des données de séquençage (traitement bio-informatique des données génomiques séquencées au préalable en laboratoire par d’autres membres de l’équipe de recherche) a été effectuée par mes soins au cours de ma maîtrise (Section 1.3; Chapitre 1)
Concernant les analyses des données d’études différentielles (Section 1.5.1/1.5.2/1.5.4 du Chapitre 1 et le Chapitre 2), j’ai effectué les réalisations et les interprétations des représentations graphiques
J’ai également effectué les analyses sur les modules de gènes (Section 1.5.3/1.5.5 du chapitre 1 et le chapitre 3) incluant les analyses statistiques, les mises en forme des données ainsi que les représentations graphiques.
Introduction
Histoire de la dépression
La dépression aussi appelée trouble majeur de la dépression est une maladie psychosomatique due à un dérèglement de l’humeur. La découverte de cette pathologie ne date pas d’hier, en effet, le médecin Hippocrate décrit dans ses ouvrages, un syndrome de mélancolie comme une maladie distincte avec symptômes mentaux et physiques particuliers. Des symptômes de tristesse, de découragement, de colère, de délires, d'obsessions et souvent de peur conduisant vers un dérèglement de la bile appelé la « bile noire ».1 Pour
éliminer cette bile noire, seuls des traitements comme des bains, potions à base de plantes, des laxatifs et autres vomitifs ont été utilisés durant des siècles. Le terme dépression est issu du latin « deprimere » et signifie « se décourager »1. Le sens exact du mot dépression qui nous intéresse fut utilisé
seulement dans les années 1800 au moment où la psychiatrie devient une discipline médicinale à part entière. Malheureusement suite à cette avancée dans la reconnaissance des maladies psychiatriques, les maladies de « l’esprit » furent longtemps mal acceptées et les personnes en soufrant étaient très souvent vouées à l’enfermement. Le trouble majeur de la dépression fit réellement un pas en avant grâce à l’arrivée de la psychanalyse apportée par Sigmund Freud fin des années 1890. Freud utilise alors un procédé d'investigation des processus psychiques permettant de traiter et de mieux connaître les troubles mentaux tels que la dépression. Par la suite les premiers traitements biologiques font leurs apparitions dans les années 30 notamment avec l’un des plus connu d’entre eux, l'électroconvulsivothérapie (ECT),1 qui consiste à envoyer des électrochocs
par le biais d’un courant électrique dans le corps du malade. Le but est de provoquer une crise d'épilepsie ce qui va stimuler les neurones et leurs permettre d’établir de nouvelles connexions entre eux. Ce procédé a été pendant longtemps extrêmement controversé puisqu’il était utilisé de façon
violente, forcée et très douloureuse. De nouvelles modalités de fonctionnement permettent maintenant d’utiliser l’ECT de façon sécuritaire et efficace.2 Plus tard, dans les années 70, l’industrie pharmaceutique met
sur le marché une molécule appelée la fluoxétine aussi connue sous le nom de Prozac.1 D’autres antidépresseurs se sont succédés depuis et malgré le
succès en dents de scie de ces médicaments, aucun traitement miracle n’existe à ce jour pour soigner la dépression.
Symptômes propres à la dépression
Aujourd’hui les symptômes de la dépression permettent d’identifier deux types de trouble dépressif. En effet, un trouble dépressif récurrent est caractérisé par des épisodes dépressifs répétés, rendant le patient d’une humeur morose. Il subit une grande perte d’énergie, d’intérêt et de plaisir entraînant une baisse de son activité pendant au moins deux semaines. Il est en effet possible d’identifier des symptômes physiques et psychologiques. Parmi les manifestations physiques, la fatigue, des troubles du sommeil, une diminution ou augmentation de l’appétit, une baisse de la libido, des maux de tête, à l’estomac ou dans d’autres parties du corps. 3 Un autre type
de dépression est aussi mis en avant, le trouble affectif bipolaire. Ce dernier est définit par des épisodes maniaco-dépressifs séparés par des périodes d’humeur normale. Les patients atteints de ce type de trouble dépressif peuvent êtres hyperactifs, irritables, prétentieux et sembler infatigables.4
Traitements utilisés pour lutter contre cette pathologie
Dans notre société moderne, la dépression a une importance grandissante. En effet, étant reconnue comme une maladie à part entière, les personnes en souffrant consultent plus aisément et spontanément. Il existe à ce jour deux grandes catégories de traitements, les traitements pharmacologiques et les traitements psychologiques. La pharmacologie est depuis longtemps utilisée pour traiter la dépression. Elle est principalement basée sur
l’utilisation d’antidépresseurs et est adaptée pour les cas de dépression modérée à sévère. Cette médication agit principalement sur la chimie du cerveau et est basée sur l’hypothèse très controversée5 qu’est la
monoaminergie de la dépression. Cette dernière met en avant que cette pathologie serait due à un déséquilibre des molécules chimiques présentes dans le cerveau appelées monoamines (dopamine, noradrénaline et sérotonine). Les antidépresseurs agissent via les neurotransmetteurs en augmentant ou diminuant les concentrations des monoamines présentes dans le cerveau des patients.6 Malheureusement les antidépresseurs ne
sont que très peu actifs chez 2/3 des patients et plusieurs études ont démontré que l’amélioration de l’humeur obtenue chez les patients sous antidépresseurs se retrouvait aussi à 80% à court terme chez les personnes qui prenaient un simple placebo.7 L’efficacité des antidépresseurs semble
malgré tout bien réelle à plus long terme mais reste tout de même assez modeste et variable.
Il existe alors d’autres alternatives de traitement, notamment les thérapies axées sur la psychologie de la dépression. Le traitement cognitivo-comportementale peut être utilisé lors de dépression résistante aux médicaments.8 Plusieurs études ont notamment démontré que ce traitement
diminuait le risque de rechute suite à un épisode dépressif.9 D’autres types
de traitement sont aussi utilisés, comme la psychothérapie d’activation comportementale10 ou la thérapie interpersonnelle11. Il est donc facile de
retenir qu’il n’y a pas de traitement miracle pour soigner la dépression. Cependant de plus en plus d’études démontrent qu’une amélioration de la qualité de vie via l’adoption de saines habitudes pourrait avoir un impact extrêmement important dans la prévention de ce trouble de santé majeur. Au vu des effets mitigés et variables des traitements utilisés à l’heure actuelle pour soigner la dépression, il est clair qu’une meilleure compréhension de ce trouble est primordiale pour mieux le traiter.
Épidémiologie de la dépression
La dépression est devenue une préoccupation majeure des services de santé et pour cause, elle touche plus de 350 millions de personnes dans le monde.4
La dépression peut entraîner une souffrance considérable et altérer la vie familiale et professionnelle. Chaque année près de 800 000 personnes se suicident suite à des épisodes dépressifs insoutenables. Malgré la mise en place des traitements évoqués plus haut, moins de 50% des personnes atteintes ont accès à des soins appropriés. En effet, le manque de ressources, la pénurie de soignant qualifié et l’important fardeau économique que représente la prise en charge de cette maladie font en sorte que de nombreux pays n’aient pas les capacités nécessaires pour gérer ce problème de santé majeur. 4
Au canada, 11,3% de la population (15 ans et plus) a déjà été atteints de dépression au cours de sa vie soit 3 184 422 personnes.4 Au Québec, cette
prévalence est de 12.2% hommes et femmes confondus. Or lorsqu’on regarde au niveau du sexe, on s’aperçoit que 15,0% des femmes et 9,3% des hommes ont déjà été dépressifs durant leur vie comme en témoigne la figure 1.12 On observe donc une prévalence plus importante de la dépression
majeure chez les femmes au cours de leur vie. En effectuant un rapport relatif grâce aux données démographiques du Québec13 on obtient RR=1,61
ce qui signifie qu’une femme a 1,61 fois plus de risque qu’un homme de subir un évènement dépressif dans sa vie. Il peut être aussi intéressant de regarder cette prévalence en fonction de l’âge (figure 2).12
0,00% 2,00% 4,00% 6,00% 8,00% 10,00% 12,00% 14,00% 16,00% 18,00% To tal femme s h o mmes To tal femme s h o mmes To tal femme s h o mmes To tal femme s h o mmes
15-24 ans 25-44 ans 45-64 ans 65 ans +
12,7% 17,1% 8,4% 12,1% 16,7% 7,7% 14,3% 16,5% 12,1% 8,0% 8,5% 7,3% PRÉ V A LE N C E D E L A DÉP R ES SIO N M A JE URE 0,0% 2,0% 4,0% 6,0% 8,0% 10,0% 12,0% 14,0% 16,0%
Total Femmes Hommes
12,2% 15,0% 9,3% PRÉ V A LE N C E D E L A DÉP R ES SIO N M A JE URE
Figure 1 : Prévalence de la dépression majeure au cours de la vie chez des personnes âgées de 15 ans et plus, selon le sexe, Québec, 2012
Figure 2 : Prévalence de la dépression majeure au cours de la vie en fonction de 4 catégories d’âge ; selon le sexe, Québec, 2012
Il est possible de remarquer qu’en fonction des différentes catégories d’âge, la prévalence de la dépression varie de façon importante. En effet, les 45-64 ans ont la plus grande prévalence des 4 catégories avec 14,3% contre 12,7% pour les 15-24 ans, 12,1% pour les 25-44 ans et 8,0% pour les 65 ans et plus. Cette figure démontre aussi encore une fois la prévalence plus élevée chez les femmes à tout âge.
Ces nombreux cas de dépression représentent également un important poids économique. En 2016, le Conference Board du Canada indique que la dépression coûte plus de 17,3 milliards de dollars au Canada.14 En plus des
mesures nécessaires aux traitements des maladies mentales, de nombreux coûts indirects sont engendrés. Tout d’abord les coûts des régimes d’assurances invalidités privés et publics mais aussi les coûts de l’employeur associés à l’absentéisme ou au présentéisme non rentabilisé ou encore les revenus fiscaux perdus en raison du chômage. En effet, au Canada, la santé mentale en milieu du travail coûtent aux entreprises près de 14% de leur chiffre d’affaire annuel net soit jusqu’à 16 milliards de dollars par an.15
Facteurs de risque influençant la dépression
Compte tenu de la place importante que la dépression prend dans notre société, il est judicieux de se demander quels sont les facteurs de risque qui influencent cette maladie. Il est ici possible d’identifier trois groupes de facteurs de risques, l’environnement et la santé, les antécédents personnels et la génétique.
Facteur de risques environnementaux
Quand on entend environnement, il est évident de penser aux conditions de vie dans lesquelles une personne se trouve. Ces dernières passent avant tout par les revenus perçus par les habitants qui eux-mêmes dépendent des ressources économiques du pays dans le lequel ils vivent. Une étude publiée
en 2013 démontre que la prévalence de la dépression durant la vie d’une personne est plus élevée dans les pays avec des revenus plus importants.16
(Figure3)
Cela pourrait sembler contre-intuitif de trouver que la prévalence de la dépression est en moyenne plus élevée dans les pays à haut revenus. En effet, de par les développements économiques plus importants de ces pays il serait logique de croire l’inverse. Or une première explication viendrait du fait que dans ces pays hautement développés, les niveaux de stress, notamment via les conditions de travail et la nécessité de faire partie d’un standard de réussite seraient plus élevés. La deuxième cause pourrait venir du fait que dans les pays à hautes ressources économiques, les inégalités
0 5 10 15 20 25 PRE V A LE N C E À V IE ( % )
Pays à haut Pays à bas et moyens
Figure 3 : Prévalence à vie de la dépression dans différents pays en fonction de leurs revenus
de revenus sont plus importantes entre les classes sociales que dans les pays à faibles revenus.16 De plus, il est logique d’imaginer que les habitants
de ces pays font faces à d’autres priorités sanitaires ou sécuritaires passant au premier plan en comparaison à leur santé mentale. Il est aussi difficile d’exclure le fait que la sensibilisation plus grande à l’importance de la santé mentale dans les pays à revenus élevés pourrait amener à plus facilement consulter en cas de problèmes mentaux.
Une étude effectuée sur des travailleurs australiens démontre bien que le milieu du travail peut être une source importante de survenue de dépression. Il a été démontré que le risque de dépression augmenterait significativement avec la diminution du niveau de responsabilité au travail.17 Un autre point qui est très souvent relié à des cas de dépression
est la consommation d’alcool ou de drogues. En effet il a été rapporté que le risque de dépression était 1,4 fois plus élevé (IC 95% [1.2-1.7] ) en cas de consommation d’alcool en quantité importante (plus de 3 verres par jour), tout comme la consommation de drogues engendrerait un risque 1.2 fois plus élevé (IC 95% [1.04-1.3] ) pour la prise de marijuana et 1.4 (IC 95% [1.2-1.7] )a pour la prise d’autres drogues dures. 18 Des études récentes ont
même démontrées que l’alimentation pouvait jouer un rôle important sur la dépression, notamment la consommation de fruits et légumes. Les personnes suivant les recommandations de l’organisation mondiale pour la santé c’est-à-dire consommer au moins 5 fruits et légumes par jour, auraient presque 2 fois moins de risque de développer des épisodes dépressifs que ceux n’en consomment que 1 ou 2. 19
aPuisque la dépression est rare dans la population, l’impact des facteurs de risques peut-être décrit
Facteurs de risque liés aux antécédents personnels
Selon le Journal of affective disorders, le développement de l’enfant durant son enfance et notamment la qualité de l’environnement dans lequel il vit est un point crucial prédicteur de la santé mentale d’un individu. L’attention parentale est un facteur important pouvant impacter de façon non négligeable le risque de développer un trouble de dépression durant la vie d’un individu. Le bon développement psychologique de l’enfant étant fortement influencé par l’attention parentale, il est aisé de comprendre qu’en cas de négligence, l’individu peut être fragilisé au niveau de sa santé mentale. En effet, une étude a démontré que le risque de développer un épisode dépressif durant la vie d’un individu serait plus important en cas de faible attention parentale durant l’enfance. L’attention parentale a été divisée en 3 catégories, faible attention parentale de la part de la mère, du père ou des deux parents. Les trois types d’attentions parentales se sont avérées avoir un effet d’augmentation du risque de dépression, en revanche dans l’étude ciblée, seule l’attention de la part du père s’est révélée avoir un effet statistiquement significatif (risque 1,6 fois plus important par rapport à une attention jugée bénéfique selon les critères de l’étude).20 Cela pourrait
paraître étonnant que l’attention de la part de la mère ne se soit pas révélée comme facteur influençant le risque de dépression dans cette étude. Cependant, une autre étude a par la suite contredit cette supposition en démontrant une diminution de la proportion de cas de dépression chez les enfants (entre 5 et 19 ans) ayant eu une mère affectueuse et stimulante durant leur enfance (risque 0.38 fois moins important (IC 95% [0.006-0.52])21. Cependant les résultats de ces deux études peuvent difficilement
être comparés puisque la première étude dispose d’une cohorte de patients âgés de 18 ans et plus (ils présentent même un groupe d’âge >65 ans) alors que la seconde étude traite avec des patients de 5 à 19 ans.
Le stress est un facteur extrêmement influenceur de l’état de la santé mentale et notamment le stress traumatique précoce. Les évènements stressants ou traumatiques durant la petite enfance ont des effets sur le cerveau et affectent la réponse au stress pouvant mener à des épisodes dépressifs récurrents durant la vie de la personne. Les changements résultants de stress traumatique durant l’enfance engendrent un hippocampe plus petit, une perturbation de la régulation du cortisol et une augmentation du facteur de libération de la corticotrophine (CRF).22 Le
cortisol est aussi appelé hormone du stress, une libération plus importante de CRF augmente alors le taux de cette hormone et cela résulte en un stress plus important dans la vie des personnes concernées. Être victime d’un stress précoce pourrait donc augmenter la vulnérabilité au stress plus tard dans la vie.
Approche génétique et moléculaire de la dépression
La dépression semble être alors une maladie extrêmement influencée par l’environnement. Cependant on ne peut ignorer la prédisposition génétique mise en évidence par les études familiales.23 Malgré un facteur génétique
indéniable, les études sur la génétique de la dépression n’ont pas pu encore identifier l’ensemble des gènes responsables. Tout de même, quelques constats en ressortent : Certaines analyses du transcriptome masculin ont mis en évidence des modifications des gènes liées aux systèmes glutamatergiques, GABAergiques, sérotoninergiques et polyaminergiques à travers différentes régions du cerveau,24,25 mais également au niveau la
réponse immunitaire, du métabolisme lipidique, de la synthèse d’ATP ou encore de la régulation de la transcription et traduction de L’ADN. 26–28 Une
faible proportion d’étude s’est attardée sur les potentiels changements génétiques spécifiques aux femmes. Une association entre l’augmentation de l’expression de plusieurs gènes régulant des récepteurs au glutamate du cortex préfrontal dorsolatréral et le trouble majeur de la dépression a été
démontrée. Ces anomalies spécifiques se produisent directement dans le système glutamatergique du cortex préfrontal dorsolatréral dans la dépression et sont bien plus sévères chez la femme. 29
Association entre gènes et dépression
La compréhension de la biologie de la dépression passe par la mise en évidence de gènes associés à cette pathologie. Par devis d’échantillonnage cas-témoins, l’analyse d’association consiste simplement à comparer les fréquences des allèles (différents variants d’un gène) d’un gène donné entre les sujets cas (avec dépression) et les témoins. Une méta-analyse récemment rapportée par Howard et al (2019)30 sur le génome entier impliquant
807 553 individus (246 363 cas et 561 190 témoins) a révélé 269 gènes associés à la dépression de façon significative. Le gène montrant l’association la plus significative (Valeur p = 2,27E-19) est SORCS3 (Sortilin related VSP10 domain containing receptor 3) sur le chromosome 10. Ce gène est exprimé dans le cerveau et a déjà été identifié comme influant dans la maladie d’Alzheimer.31 Un autre gène fortement significatif (Valeur p =
3,55E-15) et très important est NEGR1 (Neuronal Growth factor) joue un rôle dans la croissance des neurones. Plusieurs autres gènes importants ont été mis en évidence comme DRD2, CELF4 ou ELAVL2. Le gène récepteur à la dopamine D2 (DRD2) régie l’action de la dopamine qui agit comme un neurotransmetteur dans le cerveau30. Les variations génétiques qui ont été
démontrées concernant DRD2 sont liées aux différences de connectivité structurelle entre la structure de base des ganglions et les cortex frontaux.32
Il est donc judicieux de retenir l’association de ce gène avec la dépression puisque l’importance des régions corticales a été précédemment démontrée dans cette pathologie30. De plus, le gène DRD2 est connu pour être associé
à la schizophrénie33 et faire partie du processus de régulation de l’humeur
et des émotions.34 Le gène CUGBP Elav-like family member 4 (CELF4)
neurones excitateurs et jouer un rôle dans le trouble du spectre de l’autisme35 et dans la modification du comportement.36 Aussi, ELAV like
RNA binding protein 2 (ELAVL2) est connu pour soutenir la régulation de l’expression des gènes dans le neuro-développement humain.37
Une étude d'association pangénomique (GWAS) publiée dans la revue
Nature Genetics38 (75 607 cas et 231 747 témoins) a mis en évidence
d’autres gènes associés significativement à la dépression. Le gène OLFM4
(olfactomedin-4) ressort comme étant le plus fortement associé à ce trouble
(pValue=8,52E-13) et aurait un effet protecteur avec un risque 0.955 (IC 95%
[0.943-0.968] fois moins important de développer la dépression lorsqu’il est exprimé. Ce gène est connu pour être exprimé dans le cerveau dans l’amygdale et dans le lobe temporal médial. Deux autres gènes ont aussi été identifiés comme significativement associés à la dépression, MEFC2C (myocyte enhancer factor 2C) et TMEM161B (transmembrane protein 161B) (Valeur p=2.91E-12). En cas d’association de ces gènes, le risque de subir
un trouble dépressif est 1.051 (IC 95% [1.036-1.067] fois plus important. Les deux gènes identifiés sont exprimés dans le cerveau, le premier est associé au système nerveux central, notamment avec des phénotypes comme l’épilepsie, les déficiences intellectuelles et a déjà été révélé comme gène de vulnérabilité pour la maladie D’Alzheimer et la Schizophrénie33. Il
est possible de noter qu’à l’échelle individuelle, les gènes identifiés (résumés en Tableau 1 (Annexe I)) n’ont qu’un impact modéré sur le risque de dépression, mais c’est en les considérants comme un réseau de gènes qu’ils prennent toute leur importance.
Processus d’expression des gènes
L'expression génique est le processus par lequel le code génétique (la séquence de nucléotides) d'un gène est utilisé pour diriger la synthèse de protéines et produire les structures de la cellule. Les gènes qui codent pour les séquences d'acides aminés sont appelés «gènes structurels». Les
processus liés à l’expressionde ces gènes sont beaucoup plus complexes chez les eucaryotes que chez les procaryotes. En effet, les eucaryotes possèdent une membrane nucléaire qui empêche que la transcription et la traduction se fasse simultanément comme chez les procaryotes. L’expression d’un gène est composée de deux principales étapes. La première est la transcription qui consiste à la production de l’ARN messager (Acide Ribonucléique). Pour ce faire, les gènes possèdent des promoteurs auxquels viennent se lier des complexes enzymatiques (ARN polymérase) qui vont lire la séquence d’ADN et générer la molécule d’ARN correspondante (ARN messager). Plusieurs fragments d’ARN peuvent être synthétisés en fonction des besoins cellulaires, un plus grand nombre de fragments d’ARN pour un gène X représente un plus grand niveau d’expression de ce gène. Suite à ces étapes la traduction permet l'utilisation de l'ARNm pour diriger la synthèse des protéines et le traitement post-traductionnel de la molécule de protéine. La figure 4 résume de façon schématique le processus de régulation de l’expression des gènes.
Figure 4 : Schéma démonstratif du processus de régulation de l’expression des gènes.
Les modèles animaux de la dépression
Les nombreux gènes identifiés apportent de nouvelles connaissances concernant le fonctionnement de la dépression. Dans le but de mieux comprendre le rôle et le l’impact réel qu’ont ces gènes sur ce trouble, il est nécessaire de chercher à induire un état dépressif chez l’animal de manière à pouvoir étudier l’expression de ces gènes associés à un état dépressif. Pour faire face à ces problématiques, la dépression peut-être modélisée en laboratoire à l’aide d’animaux39. Le centre CERVO disposant d’une
animalerie, il est alors possible d’effectuer ces manipulations directement en laboratoire. Il semble en revanche assez complexe de retrouver ou d’engendrer un syndrome dépressif complet chez des animaux qui s’apparenterait en tout et pour tout à celui des humains. En effet, des symptômes comme une humeur triste, des pensées suicidaires ou encore la culpabilité semblent spécifiques à l’humain et peu probablement identifiables chez les animaux. En revanche, il est possible d’engendrer d’autres symptômes dépressifs chez les animaux comme des comportements de désespoir, d’anhédonie, de solitude, de résilience ou encore en apportant des changements au niveau des cycles du sommeil ou des habitudes alimentaires.39 La connaissance de la physiopathologie de la
dépression reste faible et les tests diagnostiques biologiques n’existent pas. Par conséquent, Les diagnostics reposent uniquement sur la phénoménologie, c’est-à-dire sur les symptômes, les signes et le cours de la maladie. Seules peu d’études ne se sont penchées sur les capacités de ces modèles à reproduire les mécanismes moléculaires et transcriptionnels observés chez l’humain en cas de maladie.
Différents modèles animaux, pour la plupart effectués sur des souris peuvent alors être mis en place dans le but d’induire certains états dépressifs. Parmi ces modèles il y a par exemple le test du stress chronique variable (CVS :Chronic variable stress) ou celui de la nage forcée (FST : Force
swim test), le premier consiste à appliquer trois types de stress différents de façon répétée sur une période prédéfinie sur les souris mâles et femelles.40
Le deuxième a pour but de placer une souris dans l’eau avec aucun autre choix que de nager. L’objectif est de voir au bout de combien de temps de l’animal atteint un état de résilience dans lequel il n’essaye plus de nager pour s’échapper de l’eau.41 Les états symptomatiques typiques de la
dépression induits par ces tests permettent par la suite d’analyser les effets moléculaires et transcriptionnelles spécifiques au sexe pour différentes régions du cerveau dans le but de mieux comprendre le trouble majeur de la dépression.
Différences transcriptionnelles au niveau du sexe
Les différences de réponse au stress spécifiques au sexe étant encore peu connues, une grande étude menée par le Dr Benoît Labonté s’est récemment attaquée à cette problématique et a mis en lumière des résultats prometteurs.42 La dépression chez les hommes et les femmes serait due à
l’action de modules de gènes partageant les mêmes caractéristiques cellulaires et biologiques mais ayant une expression et une organisation différentes à travers les différentes régions du cerveau dans les deux sexes.42
Le gène DUSP6 serait un gène clé dans le fonctionnement de la dépression chez la femme. En effet, une diminution de l’expression de DUSP6 entraînerait une augmentation de l’excitabilité d’une population de neurones pyramidaux glutaminergiques dans la région cérébrale du cortex préfrontal vendromédiale suite à l’activation de la cascade d’activation d’ERK (kinases régulatrices du signal extracellulaire) uniquement chez la femme.42 Un modèle animal de stress variable chronique a été réalisé dans
le but de comparer les changements transcriptionnels (modifications dans le codage des gènes portés par l’ADN) engendrés par la régulation à la baisse de DUSP6 avec ceux subit chez la souris durant la durée du stress appliquée. Il s’avère que ces changements reproduisent en large proportion
ceux induits par le stress sur les souris femelles.42 Cette étude amène donc
de nouvelles connaissances appuyant l’hypothèse du dimorphisme sexuel de la dépression.
Problématique et objectifs du projet de recherche
Le projet mené ici a pour but d’approfondir les résultats obtenus dans l’étude précédente sur les différences transcriptionnelles spécifiques au sexe dans la dépression. En effet, le projet décrit dans ce mémoire s’articule en deux parties distinctes :
Valider les résultats obtenus dans Labonté et al mais dans un échantillon plus grand, composé de 553 individus.
Ceci dans le but d’amener une puissance plus importante en étudiant une cohorte plus grande que dans les travaux publiés précédemment. Le travail effectué sur cette partie consiste à traiter, par le biais d’outils bio-informatiques, les données de séquençage obtenues au préalable et d’effectuer une vérification de leur validité.
Déterminer les conséquences fonctionnelles des changements génétiques observés chez l’humain en lien avec de nouveaux modèles animaux
Le modèle du stress variable chronique a démontré son efficacité pour reproduire certains états dépressifs au niveau psychologique mais aussi moléculaire.42 Il est donc judicieux d’utiliser d’autre modèles animaux tels
que l’isolation sociale (SI) ou le stress chronique de la défaite sociale (CSDS) dans le but d’induire d’autre types d’états dépressifs permettant ainsi de
mieux connaître les mécanismes moléculaire spécifiques au sexe sous-jacent au trouble majeur de la dépression.
Pour ce faire, durant ce projet, des analyses propres à 3 différentes régions du cerveau sont effectuées :
Analyse d’expression différentielle réalisée dans le but de mettre en évidence une liste de gènes en fonction du sexe et différentes régions du cerveau.
Une étude des gènes communs, différentiellement exprimés, entre les différents modèles animaux et l’humain est effectuée. La directionnalité de l’expressionc des gènes mis en évidence comme communs à tous les modèles
(Humain et animal) est également caractérisée. Cette directionnalité d’expression est aussi comparée sur la base de l’humain pour tous les gènes avec les différents modèles animaux. De plus, les fonctions des gènes différentiellement exprimés communes à l’humain et les modèles animaux sont déterminées.
Réalisation de test d’association statistiques permettant d’obtenir les modules de gènes les plus associés avec la dépression chez l’humain et chez les modèles animaux et caractérisation des différences au niveau du sexe.
Les modules significativement associés à la dépression sont identifiés à l’aide de tests statistiques en fonctions du phénotype et du sexe pour l’humain et les différents modèles animaux. En parallèle, une recherche ontologique des fonctions les plus représentatives de chaque module de gènes est réalisée dans le but d’évaluer l’importance des modules qui sortent du lot de par leur association significative avec la dépression.
Chapitre 1 : Matériels et méthodes
1.1 Description de l’étude cas-témoinsDans l’étude de Labonté et al42 précédemment publiée, à l’origine composée
de 49 sujets cas et témoins, les sujets étaient des personnes décédées subitement pour lesquels la famille avait accepté de donner le cerveau en don d’organe. Dans le but d’améliorer et d’approfondir les résultats de cette première étude, 504 individus supplémentaires ont été ajoutés. Parmi le total de 553 sujets, 267 faisaient partie du groupe MDD (major Depression disorder) et 286 dans le groupe CTRL (contrôle, sans dépression). Pour être inclus dans l’étude, une personne devait être d’ascendance européenne, d’origine franco-canadienne et être décédée subitement sans avoir subi de stade d’agonie prolongé.Le Tableau 2 (Annexe I) fourni les informations concernant le sexe, l’âge au moment du décès, la cause du décès, la consommation d’alcool, de drogue, le statut de fumeur, la médication, l’historique d’abus, le pH et les intervalles post mortem (PMI) des sujets cas et témoins recensés. Les caractéristiques concernant l’historique psychiatrique et sociodémographique ont été obtenues en effectuant des autopsies psychologiques. Les cas (MDD) et les témoins (CTRL) étaient caractérisés grâce à l’utilisation du DSM-IV1 par les mêmes méthodes
d'autopsie psychologique, évitant ainsi l'apparition de biais systématiques. Les cerveaux étaient obtenus grâce à la Banque de cerveau canadienne Douglas Bellbasée à l’institut universitaire en santé mentale Douglas affilié à l’Université Mc Gill. Pouvoir obtenir des cerveaux de personnes dépressives est une opportunité exceptionnelle pour cette étude.
1.2 Prélèvement des tissus et régions cérébrales cibées
Les tissus provenant de six régions cérébrales ont été disséqués à 4 °C après avoir été congelés dans de l’isopentane à -80 °C. Les six régions du cerveau ciblées ici sont le Cortex orbitofrontal (OFC, BA11), le Cortex prefrontal dorsolateral (dlPFC, BA89), le gyrus cingulaire 25 (cg25, BA25), l’insula antérieure (aINS, ANTINS), les noyaux accumbens (NAc) et le subiculum ventral (vSUB, SUBIC).
Parmi ces 6 régions, seules les 3 plus pertinentes ont été choisies pour la présente étude.
1.2.1 La région Brodmann 25
La région de l’aire de Brodmann 25 (BA25 ou PFC chez le rongeur), est localisée dans le cortex cérébral et est fortement activée lors de dépression résistante aux traitements. Il a été démontré qu’il était possible de moduler cette région et de réduire la résistance aux traitements pour la dépression en appliquant une stimulation profonde et chronique du cerveau au niveau de cette région.43
1.2.2 La région du Nucleus accumbens
La deuxième région mise à l’étude est le nucleus accumbens (NAC), cette dernière fait partie du prosencéphale basal frontale de l’aire pré-optique de l’hypothalamus.44 Elle est connue pour être associée avec la santé mentale
et notamment avec la capacité à ressentir du plaisir. Le NAC participe à la complétion du circuit de récompense en recevant la dopamine relâchée dans le cerveau.45 Il semblerait qu’une dysfonction de l’activité dopaminergique
baisse de cette activité aurait été également observée dans les modèles animaux de la dépression.46
1.2.3 La région Subiculum
Le Subiculum est la dernière région étudiée, elle correspond à la partie basse de la formation hippocampique.44 Plusieurs études ont démontré son
implication dans différentes fonctions cognitives incluant la peur, le stress et les comportements anxieux. Ces différentes fonctions sont connues pour être régulées par l’amygdale à travers l’activation de l’axe hypothalamo- pituitaire-adrénal or plusieurs modèles animaux ont démontré une grande projection du subiculum vers l’hypothalamus47. Ces découvertes pourraient
amener à penser que le subiculum joue en effet un rôle dans la modulation des fonctions amygdalaires et donc directement sur les fonctions comportementales telles que le stress. Ces connaissances permettent aisément de comprendre que cette région a un impact potentiellement important sur la dépression.
1.3 Traitement des données de séquençage
Le séquençage de l’ARN a été effectué à 50 paires de base par le système séquenceur Illumina HiSeq2500.
A la suite du séquençaged, 2 fichiers (correspondant aux 2 reads présents)
de données nucléotidiques de très grande taille sont produits par individu pour un total de 1182 fichiers. Ces données brutes doivent être traitées pour obtenir des variants génétiques (voir 2.4.1). Face à autant de données, on place cette analyse dans le contexte du "BigData", un domaine à
d Ici c’est un séquençage de l'ARN également appelé séquençage aléatoire du transcriptome entier. C’est une technologie qui utilise le séquençage à haut débit pour identifier et
l’importance grandissante au vu de la numérisation des données quasi systématiques dans notre société actuelle.
Devant une telle charge de données, il est nécessaire d’utiliser des serveurs de calculs très puissants. En effet, ces derniers permettent de lancer des tâches beaucoup trop prenantes en termes de ressources pour ordinateur de bureau habituel. Ces « super-ordinateurs » possèdent l’équivalent de plusieurs centaines d’ordinateurs qui travaillent ensembles pour mettre à disposition une très forte capacité de traitement, de calcul et de stockage. Ici, les serveurs de Calcul Canada sont utilisés et plus particulièrement les grappese de traitement de « Graham ». Grâce à ce serveur les capacités de
stockage et la puissance disponible pour les traitements des données sont fortement augmentées. La réalisation des différentes étapes du traitement de données se fait via la programmation de scripts. Le langage de programmation utilisé ici est C++ dans un environnement UNIX. Ce langage est un des plus rependus en bio-informatique.
Le traitement des données de séquençage s’effectue en plusieurs étapes : 1.3.1 Le mapping et assemblage des séquences alignées
En premier lieu, il a été nécessaire de créer les différents fichiers de références (par exemple la référence du génome humainf) sur lesquels
reposeront les étapes suivantes du traitement de données. Suite à cela, l’analyse de « mapping » est lancée et consiste à aligner chaque read (Séquence inférée de paires de bases correspondant à une partie ou à un fragment entier d’ADN ; chaque sujet a deux reads) avec la référence du génome humain à partir des fichiers bruts (Figure 5, Annexe I – Etape1).
e Terme technique informatique représentant un regroupement de plusieurs ordinateurs indépendants appelés nœuds, afin de permettre une gestion globale et de dépasser les limitations d'un ordinateur
Cette étape génère 1182 nouveaux fichiers, un pour chaque read contenant les séquences mappées, c’est-à-dire dont les deux reads sont alignés sur la référence du génome humain. A partir des fichiers nouvellement générés, l’objectif est d’assembler les fichiers alignés d’un même sujet. Ce qui réduit alors à 591 fichiers de très grande taille (environ 10 térabytes au total). Les étapes précédentes (Figure 5, Annexe I – Etape 2 et 3) ont été effectuées à l’aide du logiciel BWA (Burrows wheeler aligner)48.
1.3.2 Séparation des reads mappés et non mappés
La suite du traitement de données s’effectue avec le logiciel Samtools49
(Figure5, Annexe I – Etape 4). La première étape consiste à extraire des fichiers précédents uniquement les reads mappés correctement, c’est-à-dire en séparant les reads mappés de non mappés. Il est ensuite nécessaire de trierg et d’indexer les fichiers car de nombreux logiciels demandent par la
suite qu’ils soient triés par chromosomes, par position et qu’il soit indexés. 1.3.3 Identification des variants génétiques
L’étape qui suit est réalisée dans le but d’obtenir les variations génétiquesh
présentes dans les séquences utilisées et permet aussi de vérifier que les données ne contiennent pas d’erreur d’identification qui aurait pu se glisser lors de la réalisation des échantillons de séquençage (Figure 5, Annexe I – Etape 5). Pour chaque sujet, un fichier par chromosome et un index vont être créés soit 22 fichiers par individu. Chaque fichier contient l’information nécessaire concernant les variants présents dans leur génome. Au final, suite à cette étape on obtient 26004 fichiers (2 x (22 x 591)). Le logiciel GATK4 (Genome analysis toolkit 4) 50 est utilisé pour créer ces fichiers. Face
à l’ampleur de ces étapes ((26004 + (1182 x 2) + (591 x 3)) = 30141 fichiers
traités au total), il est aisé de comprendre le défi important que représentait ce traitement de données et pourquoi ces analyses sont intégrées dans un contexte de « big data ».
1.4 Explication des modèles animaux
Les étapes suivantes n’ont pas été effectuées durant le projet de maîtrise présenté dans ce mémoire, elles furent accomplies au préalable lors de la réalisation des travaux pour l’étude du Dr Benoit Labonté.42 Les animaux
utilisés sont des souris âgées de 8 semaines (C87BL/6J) mâles et femelles. Avant d’effectuer les modèles, les souris ont été habituées à leur environnement pendant 1 semaine. Elles sont restées à 23-25 °C sous une lumière cyclique en alternance de jour et nuit de 12h et avec un accès à l’eau et à la nourriture à volonté.
1.4.1 Le modèle du Stress Variable Chronique (CVS)
Le premier modèle animal qui a été mis en place est le stress variable chronique (CVS). Ce test consiste à appliquer 3 types de stress différents de façon répétée sur une période de 21 jours. Durant cette période les stress appliqués ont été les suivants : 100 chocs électriques a 0,45 mA au milieu de la patte pendant 1h, une suspension par la queue pendant 1h et un stress appliqué en plaçant la souris dans un espace clos et étroit (ici un tube à essai de 50mL).
1.4.2 Le modèle de l’isolation sociale (SI)
Le deuxième modèle animal est celui de l’isolation sociale. Les souris ont été isolées pendant 2 à 8 semaines dans une cage, seules ou groupées avec un maximum de 5 souris par cage. Suite à cet épisode, un premier test est mis en place, chaque souris est introduite dans une cage totalement noir
surveillée par une caméra infrarouge. Deux sessions de 2,5 min sont effectuées, durant lesquelles, les mouvements de la souris sont suivis et enregistrés. A l’intérieur de cette cage, est tout d’abord placée une petite cage vide. Durant la deuxième session, une autre souris non familière à la souris d’intérêt est placée dans la petite cage. Entre chaque session, la souris était remise dans sa cage « maison » pendant 1 minutes. Les vidéos enregistrées durant les deux sessions permettent de déterminer le temps passé par la souris d’étude dans la zone d’interaction, c’est-à-dire dans un rayon maximal de 8 cm autour de la cage contenant le la cible sociale non familière. La différence entre les souris groupées au départ et les souris isolées seules sont calculées à l’aide d’un test de Student’s bilatéral à un niveau de significativité de p<0,05.51
1.4.3 Le modèle du Stress chronique de la défaite sociale (CSDS)
Concernant le troisième et dernier modèle qui est celui du stress chronique de la défaite sociale, l’objectif est d’engendrer une défaite sociale répétée chez la souris expérimentale. Pour ce faire, une souris de type agresseur (CD-1) était sélectionnée pour son comportement agressif en fonction des résultats de tests d’agressivité. En effet, la souris agresseur était placée dans une cage avec une souris expérimentale pendant 180 secondes 3 jours d’affilée. Pour rencontrer les critères nécessaires pour être sélectionnée comme souris agresseur, cette dernière devait avoir attaqué au moins deux fois sur les trois sessions effectuées et la latence avant la première agression devait être de moins de 60 secondes. Suite à cette sélection les souris retenues comme agresseurs étaient utilisées pour le stress chronique de la défaite sociale.
Le test CSDS se déroule ensuite de la manière suivante : La souris agresseur est placée dans une cage « maison » qui est elle-même placée dans une plus grande cage. Une souris expérimentale est placée avec l’agresseur dans la
cage « maison » pendant 5 à 10 min, suite à cela la souris expérimentale est mise dans une cage seule en face de celle de son agresseur pendant 24h. Ces deux stress chronique sont répétés pendant 10 jours. Pour éviter une accommodation de l’agresseur à la souris expérimentale, celui-ci est changé tous les jours dans le but d’obtenir une reproductibilité plus importante.52
Ce test engendre une large proportion de souris dites « susceptibles » développant un comportement marqué d’évitement social et des symptômes dépressif pertinents menant à une bonne caractérisation de ce trouble chez la souris. A l’opposé, les souris ne développant pas les caractéristiques ci-dessus sont qualifiées de « résilientes ».Le but d’appliquer ces modèles de stress est d’observer les souris qui développeront un comportement de dépression (susceptibilité) Vs résilience pour pouvoir ensuite étudier les expressions de gènes qui s’associeront à ces comportements.
1.5 Conséquences fonctionnelles des changements génétiques observés chez l’humain en lien avec de nouveaux modèles animaux
Les analyses présentées dans les sections subséquentes suivent les étapes de traitement statistiques effectuées au préalable dans Labonté et al42. Ces
étapes ne seront que brièvement rapportées ici mais sont expliquées en détail dans l’article ci-dessus.
Les modèles linéaires implémentés à l’aide du paquet limma de Bioconductor furent utilisés pour calculer la variance de l’expression des gènes à travers tous les groupes. Cette expression fut également transformée et normalisée à l'aide de voom dans le paquet limma. Chez les humains, les modèles ont été ajustés en fonction de l'âge, du RIN, de l'abus d'alcool et du statut thérapeutique. Ces variables ont été sélectionnées parmi les nombreuses informations collectées auprès des individus de cette étude en fonction de leur pertinence dans le domaine d’étude et de l’analyse de
variance des données de séquençage d’ARN. Le paquet Eigen-R2 fut utilisé pour estimer la quantité de variance expliquée par chaque variable dans les données de séquençage d’ARN. L'estimation de variance (R2) pour chaque
variable est similaire à la moyenne des corrélations au carré entre la variable et les valeurs d'expression de chaque gène. Les moyennes de corrélation sont vulnérables aux artefacts techniques tels que le bruit stochastique pour les gènes peu ou pas exprimés. Le paquet Eigen-R2 utilise l'analyse de composantes principales pour réduire les impacts de ces gènes et d'autres gènes problématiques. Il a alors été mis en évidence que le phénotype, le sexe et la région du cerveau expliquaient la plus grande proportion de variance.
Les gènes différentiellement exprimés ont donc été évalués à l'aide d'un modèle linéaire général réalisé dans limma, avec le phénotype (MDD versus CTRL) et le sexe (homme et femme) comme principaux facteurs pour chaque région cérébrale. Ce modèle permet alors de générer une évaluation complète des modifications de l’expression des gènes chez les hommes et les femmes atteints de dépression (par rapport aux témoins), tout en contrôlant les effets des principales covariables et en prenant en compte les différences initiales d’expression génique entre les hommes et les femmes. Un gène est alors qualifié de différentiellement exprimé si la valeur p de sa statistique de T-test est inférieure ou égale à 0,05.
Les étapes de la méthode présentée dans les paragraphes suivants sont résumées et schématisées dans la figure 6 en Annexe I.
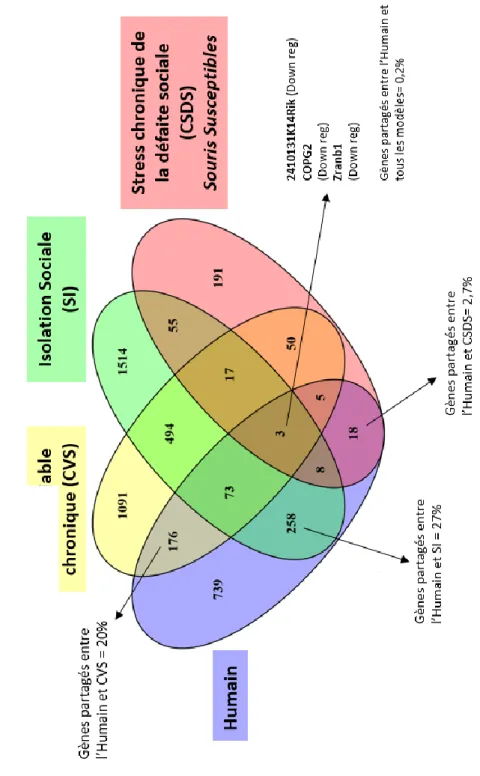
1.5.1 Diagrammes de Venn et Heat maps
Le logicel Venny 2.1 (http://bioinfogp.cnb.csic.es/tools/venny/) permet d’effectuer des diagrammes de Venn montrant toutes les relations logiques possibles entre différents ensembles. Un ensemble représente les gènes
différentiellement exprimési et donc associés à la dépression chez l’humain
et dans les différents modèles animaux. Cela permet d’observer les gènes qui sont partagés entre les modèles.
Une figure de type Heatmaps est effectuée dans l’objectif de comparer les variations de l’expression des gènes associés à la dépression entre l’humain et les modèles animaux. Dans cette figure, chaque bande verticale colorée représente un gène. Les directionnalités d’expression sont représentées par un gradient de couleur allant du bleu au jaune en passant par le noir. Le bleu représentant une baisse du niveau d’expression et le jaune une augmentation. Les valeurs d’expression des gènes sont ici comparées entre les modèles animaux et l’humain dans le but de caractériser leurs différences de directionnalité d’expression. Il est donc aisé de comprendre qu’un gène qui est représenté par une barre verticale bleue chez l’humain mais qui est représenté en jaune chez un des modèles animaux présente, en cas d’association avec la dépression, une expression diminuée chez l’humain mais augmentée chez le modèle animal en question.
Le Heatmaps est réalisé à l’aide du logiciel Morpheus (https://software.broadinstitute.org/morpheus/).
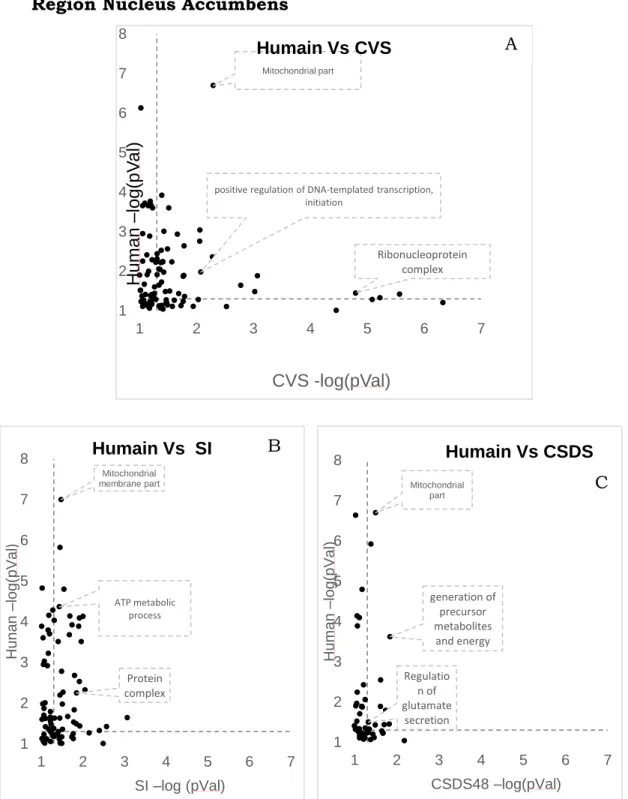
1.5.2 Graphiques des fonctions biologiques communes entre l’humain et les différents modèles animaux.
L’objectif de cette représentation graphique est de mettre en évidence les fonctions biologiques communes entre l’humain et les différents modèles animaux. Pour ce faire, un tri des fonctions communes a été effectué en classifiant leur significativité (Valeurp). Quatre groupes de fonctions communes ont été créés :
Le graphique est donc composé en abscisse du –log (valeurp) du modèle animal et en ordonnée du –log (valeurp) pour l’humain. Cette figure a été réalisée pour les 3 régions pour tous les différents modèles animaux.
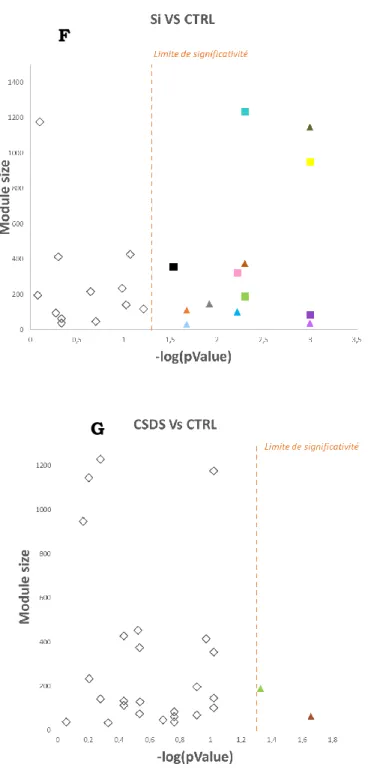
1.5.3 Analyses statistiques sur les valeurs Eigengene
Les données génomiques telles que celles provenant d’expression génique et celles issues de variants ont une très grande dimensionnalité. Il existe en effet un très grand nombre de variables pour peu de points de données. En présence d’un jeu de données d'expression génique, il peut être judicieux d'identifier des groupes de gènes présentant des profils d'expression similaires. Pour ce faire il existe une analyse par réseau de coexpression génique pondérée appelée WGCNA (Weighted gene coexpression network analysis).53 Ce procédé consiste à identifier les gènes qui présentent des
schémas d’expression génique similaires dans tous les échantillons et conditions. Ces groupes de gènes sont appelés des modules et sont identifiés par analyse de composantes principales. Chaque module est en réalité
G1 : Où p < 0,05 (-log
(p)>1,3010) chez l’humain et chez le modèle animal
G2 : Où p est entre 0,05 et 1
(-log (p) entre 1,3010 et 0) chez l’humain et chez le modèle animal
G3 : Où p <0,05 chez l’humain
et entre 0,05 et 1 chez le modèle animal
G4 : Où p est entre 0,05 et 1
chez l’humain et <0,05 chez le modèle animal