© Oupré Claude Dembélé, 2019
Dynamique de l’azote et du carbone lors de la
décomposition de trois légumineuses utilisées comme
cultures de couverture
Mémoire
Oupré Claude Dembélé
Maîtrise en biologie végétale - avec mémoire
Maître ès sciences (M. Sc.)
Dynamique de l’azote et du carbone
lors de la décomposition de trois légumineuses
utilisées comme cultures de couverture
Mémoire
Oupré Claude Dembélé
Sous la direction de :
iii
Résumé
Les couvertures de couverture (CC) sont des plantes utilisées périodiquement pour couvrir le sol et qui sont ensuite enfouies dans le sol pour enrichir celui-ci par l’augmentation de la quantité de matière organique à la suite d’un retour de résidus végétaux. Cette utilisation se fait généralement de deux façons : semées après ou avant la culture principale (en dérobée) ou semées en même temps que la culture principale (en intercalaire). Ce projet de recherche avait pour objectif général de déterminer l’effet des espèces de CC et des parties végétales (racines et parties aériennes) sur la décomposition de ces plantes enfouies dans le sol. Dans une expérience factorielle en tiroirs de 3 2 6 avec quatre blocs aléatoires complets, les parties aériennes et racinaires de trois espèces de CC dont le pois fourrager (Pisum sativum L.), le trèfle rouge (Trifolium pratense L.) et la vesce commune (Vicia sativa L.) ont été enfouies dans le sol, par la technique des sacs de résidus. Des sacs ont été prélevés à 0, 10, 20, 30, 60 et 90 jours après placement au champ. Initialement, la partie racinaire de la vesce commune était la plus riche en azote (N) tandis que la partie aérienne du trèfle rouge était la plus riche en N. Nos résultats démontrent que l’azote contenu dans les racines des CC se libère plus lentement que celui des parties aériennes. Le trèfle rouge est l’espèce qui s’est décomposée le plus rapidement. Après 90 jours de décomposition, il ne restait que 20 % et 11 % de la biomasse initiale pour le pois fourrager et la vesce commune, et le trèfle rouge, respectivement. La partie racinaire des CC était plus riche en N que leur partie aérienne. Nous n’avons pas trouvé de corrélation entre la biomasse et les paramètres de qualité des CC (N, carbone (C), C:N).
iv
Table des matières
Résumé ... iii
Liste des tableaux ... vi
Liste des figures ... vii
Remerciements ... ix
Introduction ... 1
1. Revue de littérature ... 3
1.1. Cultures de couverture ... 3
1.1.1. Avantages des cultures de couverture ... 3
1.1.2. Désavantages des cultures de couverture ... 4
1.2. Cultures de couverture de légumineuses ... 4
1.3. Matière organique ... 5
1.4. Minéralisation des cultures de couverture ... 6
1.4.1. Cycle de l’azote et sources ... 7
1.4.2. Cycle du carbone et sources ... 8
1.4.3. Rapport carbone:azote... 8
1.5. Choix des espèces de cultures de couverture ... 10
1.5.1. Pois fourrager ... 11
1.5.2. Trèfle rouge ... 11
1.5.3. Vesce commune ... 11
1.6. Parties des cultures de couverture ... 12
1.6.1. Partie aérienne ... 12 1.6.2. Partie souterraine ... 12 2. Objectifs et hypothèses ... 14 2.1. Objectif général ... 14 2.2. Objectifs spécifiques ... 14 2.3. Hypothèses ... 14 3. Matériel et méthodes ... 15
3.1. Production des cultures de couverture ... 15
3.2. Dispositif expérimental ... 16
3.3. Fabrication, placement et prélèvement des sacs de résidus ... 19
3.4. Analyse chimique des biomasses de cultures de couverture ... 19
3.5. Analyses statistiques ... 20
v
4.1. Caractérisation des sols ... 21
4.2. Cultures de couverture à l’étude ... 21
4.3. Analyse de la variance pour tous les paramètres étudiés ... 24
4.4. Biomasse ... 24 4.5. Concentration en azote ... 27 4.6. Contenu en azote ... 29 4.7. Concentration en carbone ... 30 4.8. Contenu en carbone ... 32 4.9. Rapport carbone:azote ... 34 5. Discussion ... 37
5.1. Décomposition et minéralisation des cultures de couverture ... 37
5.2. Composition chimique en éléments minéraux ... 41
5.3. Recommandations agronomiques ... 42
5.4. Impact de l’excès d’azote dans le sol ... 43
Conclusion ... 44
Bibliographie ... 45
vi
Liste des tableaux
Tableau 1 : Relation entre le rapport carbone:azote (C:N) des résidus organiques, le niveau de minéralisation et la disponibilité de l’N pour les plantes. ... 6
Tableau 2 : Valeurs de rapports carbone:azote (C:N) total, aérien et racinaire de quelques cultures de couverture issues de la littérature scientifique. ... 9 Tableau 3 : Caractéristiques de différentes cultures de couverture. ... 10
Tableau 4 : Caractéristiques des sols des sites de la Station agronomique de Saint-Augustin-de-Desmaures et de la ferme du campus de l’Université Laval utilisés comme substrat pour la croissance des cultures de couverture et comme lieu de réalisation de l’essai de décomposition, respectivement. ... 21
Tableau 5 : Caractéristiques initiales des cultures de couverture utilisées dans le projet de recherche. ... 23
Tableau 6 : Résumé de l’analyse de la variance (ANOVA) des effets fixes des espèces de cultures de couverture, des parties de la plante, du temps et de leurs interactions sur la biomasse des cultures de couverture, leurs concentrations en carbone (C) et en azote (N), leurs contenus en C et en N, ainsi que leur rapport C:N. ... 24 Tableau 7 : Corrélations entre les variables indépendantes (biomasses aériennes et racinaires) et les variables dépendantes (caractéristiques chimiques des cultures de couverture). ... 26
vii
Liste des figures
Figure 1 : Cycle de l’azote (N) (adapté de Tremblay et al., 2010). ... 7
Figure 2 : Cycles long et court du carbone organique (adapté de Kump et al., 1999). ... 8
Figure 3 : Production des plantes dans les chambres de croissance (Dembélé, 2017). ... 16
Figure 4 : Dispositif des sacs de résidus enfouis. ... 18
Figure 5 : Quelques tiges et les racines lavées (contenu total d’un pot) de trèfle rouge au moment de leur récolte au stade floraison (Dembélé, 2017). ... 22
Figure 6 : Une tige et les racines lavées (contenu total d’un pot) de pois fourrager au moment de leur récolte au stade début fructification (Dembélé, 2017). ... 22
Figure 7 : Quelques tiges et les racines lavées (contenu total d’un pot) de vesce commune au moment de leur récolte au stade début fructification (Dembélé, 2017). ... 23
Figure 8 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la biomasse des cultures de couverture. ... 25
Figure 9 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur la biomasse des cultures de couverture. ... 25
Figure 10 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la biomasse des cultures de couverture. ... 26
Figure 11 : Effet de l’interaction entre le temps de décomposition et la partie d’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture. ... 27
Figure 12 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture. ... 28
Figure 13 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture. ... 28
Figure 14 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur le contenu en azote (N) des cultures de couverture. ... 29
Figure 15 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur le contenu en azote (N) des cultures de couverture. ... 30
Figure 16 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur le contenu en azote (N) des cultures de couverture. ... 30
Figure 17 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la concentration en carbone (C) des cultures de couverture. ... 31
viii
Figure 18 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de
couverture sur la concentration en carbone (C) des cultures de couverture. ... 31
Figure 19 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la concentration en carbone (C) des cultures de couverture. ... 32 Figure 20 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de
couverture sur contenu en carbone (C) des cultures de couverture. ... 33 Figure 21 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de
couverture sur le contenu en carbone (C) des cultures de couverture. ... 33
Figure 22 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de
couverture sur le rapport carbone:azote (C:N) des cultures de couverture. ... 34 Figure 23 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de
couverture sur le rapport carbone:azote (C:N) des cultures de couverture. ... 35
Figure 24 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de
couverture sur le rapport carbone:azote (C:N) des cultures de couverture. ... 36
Figure 25 : Disposition des pots dans la chambre #16. ... 53 Figure 26 : Disposition des pots dans la chambre #18. ... 54
ix
Remerciements
Je remercie tout d’abord Caroline Halde. Merci de m’avoir accepté comme étudiant dans votre laboratoire. Durant toute ma formation de maîtrise vous avez été là avec rigueur. Je ne finirai pas de vous remercier.
Un merci particulier à l’équipe du Laboratoire d’agroécologie qui a toujours été disponible pour m’aider dans les travaux au champ. Je suis reconnaissant envers le projet FASAM grâce à qui j’ai eu l’opportunité de faire ce programme de maîtrise.
1
Introduction
L’agriculture canadienne est de nos jours dominée par la régie conventionnelle. Ce mode de production agricole, aussi appelé agriculture intensive, fait appel à l’utilisation des engrais azotés de synthèse et d’autres traitements de synthèse pour la phytoprotection (pesticides). Actuellement, plusieurs études ont souligné les conséquences de l’utilisation des engrais de synthèse et l’une d’elles est la contamination de la nappe phréatique par le lessivage de l’azote (N) (Organisation de la Coopération et de Développement Économique, 1989 cité par Madina, 1997). Une enquête de suivi du Ministère de l’Environnement du Québec (Giroux, 2002) a révélé que plusieurs rivières québécoises étaient contaminées par la forte utilisation des pesticides. La biodiversité est aussi menacée par ce mode de production, notamment les insectes qui ne sont pas forcément nuisibles aux cultures. Pour relever le défi d’une agriculture durable, de nouvelles techniques de production sont utilisées par les agriculteurs (Agriculture et Agroalimentaire Canada (AAC), 2018).
L’une de ces techniques est l’introduction des cultures de couverture (CC) dans les rotations culturales. Il s’agit de plantes (ou mélange de plantes) utilisées périodiquement pour couvrir le sol et dont le but final est de les enfouir dans le sol pour enrichir celui-ci (Weill et Duval, 2009). Les CC sont utilisées sur seulement 15 % des fermes canadiennes (Statistique Canada, 2014) et sur 23 % des fermes québécoises (Statistique Canada, 2011). Cette pratique culturale s’est avérée importante pour la fertilité des sols et la diversification des systèmes agricoles (Gilbert, 2004). Les CC contribuent à l’amélioration des propriétés biologiques du sol pendant leur minéralisation (Fageria, 2007). Malgré l’engouement autour de cette pratique, elle fait face à deux grandes problématiques qui sont : le maintien d’un bon rendement sans ou en diminuant l’apport d’engrais azoté de synthèse et aussi la synchronisation des besoins des cultures subséquentes avec la minéralisation des CC.
Malgré un bon nombre d’études faites sur la décomposition des CC, peu d’entre elles ont porté sur le rôle des racines dans la fertilité des sols agricoles (Bolinder et al., 2002; Halde et Entz, 2016). Ce constat amène à poser des questions telles que :
1) Quelle est la contribution des racines de cultures de couverture dans la fertilité des sols ? 2) Leur contribution est-elle inférieure à celle des parties aériennes ?
2
Pour trouver une réponse à ces deux questions, nous avons évalué la dynamique de la décomposition des biomasses racinaires et aériennes de CC, et nous avons quantifié la libération (dans le temps) de l’N provenant de la décomposition des racines et des parties aériennes de ces plantes. Un autre objectif était d’évaluer l'importance des paramètres de qualité de résidus (carbone (C), N, rapport C:N) sur leur décomposition. À travers cette étude, nous serons mieux outillés pour rendre plus efficace l’utilisation de l’N des espèces de CC étudiées, et tout cela dans la perspective de diminuer un jour l’utilisation des engrais de synthèse ou d’orienter les agriculteurs vers des pratiques plus écologiques.
3
1. Revue de littérature
1.1. Cultures de couverture
Les CC sont généralement utilisées pour améliorer la productivité des cultures commerciales subséquentes et les diverses propriétés physico-chimiques et biologiques des sols agricoles (Fageria et al., 2005; Fageria, 2007; Weill et Duval, 2009). Elles peuvent être des plantes qui ont la capacité de fixer l’N atmosphérique (légumineuses) par leur symbiose avec des bactéries ou des non fixatrices de l’N (autres familles botaniques). La dépendance envers les engrais azotés dans le cadre de l’agriculture conventionnelle ou intensive a un effet négatif sur l’assimilation de l’N par les plantes (Hardarson et Atkins, 2003), la fixation du C par les microorganismes ainsi que la production de matière organique du sol à long terme (Matson et al., 1997 cité par Tonitto et al., 2006). Cependant, une fertilisation organique aurait les effets contraires (Nyiraneza et al., 2009).
1.1.1. Avantages des cultures de couverture
La production des cultures commerciales est souvent affectée par divers problèmes, mais l’introduction des CC dans les rotations culturales apporte beaucoup de bénéfices agroenvironnementaux. Elles ont le potentiel de réduire l’attaque des ravageurs (Reeves, 1994). Elles améliorent la santé des sols par la rupture du cycle des maladies destructrices des cultures (Abawi et Widmer, 2000) et au même moment favorisent la formation des agrégats du sol (Bronick et Lal, 2004). Les CC peuvent aussi être utilisées pour diverses raisons, incluant la protection des sols agricoles contre les mauvaises herbes, les érosions hydrique et éolienne, le ruissellement (De Raïssac et al., 1998) et l’amélioration du sol (Youri, 1998). Les CC de légumineuses sont efficaces dans la fixation des nutriments et la gestion à long terme des systèmes agricoles (Tonitto et al., 2006). Blevins et al. (1990) ont pu démontrer l’augmentation du rendement du maïs (Zea mays L.) utilisé comme culture subséquente après l’utilisation de la vesce velue (Vicia villosa L.), comme CC en dérobée. Certaines variétés productives de vesce et de trèfle (Trifolium spp.) peuvent mobiliser 50-370 kg N ha-1 et les rendre disponibles pour
les cultures destinées à la vente (Peoples et al., 1995 cité par Tinitto et al., 2006). Au Burkina Fasso, Segda et al. (1998) ont conclu que le pois d’Angole (Cajanus cajan L.), et le pois mascate (Macuna pruriens L.) sont des CC potentielles pour palier le problème de fertilité des sols agricoles après une étude sur l’introduction de ces plantes au Burkina Fasso.
4
Les changements climatiques deviennent de plus en plus un fléau majeur et international. L’utilisation des CC dans les systèmes de production sans labour pourrait faire espérer la réduction de ce problème (Robertson et al., 2000). Elles fixent l’N pour les prochaines cultures (Destain et al., 2010) et ajoutent du C au sol (Dabney et al., 2001; Thorup-Kristensen et al., 2003). Un de leur avantage majeur est le recyclage de la majorité des nutriments (Angers et Carter, 1996
;
Dabney et al., 2001) en évitant la perte de l’N par lessivage (Thorup-Kristensen et al., 2003). De plus, un sol agricole qui n’est fertilisé que par les fumures organiques en plus des CC voit un effet synergique dans la minéralisation de l’N (Sanchez et al., 2001). Pour voir un meilleur accomplissement de ces avantages, il est important que les espèces de CC choisies soient adaptées aux conditions agronomiques des localités concernées (Bodner et al., 2010).1.1.2. Désavantages des cultures de couverture
Outre les nombreux avantages d’utiliser des CC, leur utilisation amène tout de même quelques désavantages. D’autant plus que l’utilisation des CC est perçue comme une dépense supplémentaire par certains agriculteurs, certaines espèces sont difficiles à incorporer au moment du travail du sol. Les CC peuvent aussi agir sur l’humidité du sol selon la façon où les conditions météorologiques sont gérées par les agriculteurs (Hoorman, 2009).
1.2. Cultures de couverture de légumineuses
Tel que défini précédemment, les légumineuses sont des plantes fixatrices d’N atmosphérique par symbiose avec les bactéries spécifiques au niveau de leurs racines et améliorant ainsi la fertilité du sol (Peoples et al., 1995; Hardarson et Atkins, 2003). Elles peuvent être utilisées de différentes manières soient comme des fourrages (prairies ou pâturages), soient comme des cultures de rente, soient comme des CC. Leur capacité fixatrice de l’N est appréciée pour contribuer à une agriculture durable. Cette capacité symbiotique a donné des moyens agronomiques pour améliorer l’apport d’N (Hardarson et Atkins, 2003).
Sachant que la fixation d’N résulte de la formation de nodules, il est à reconnaitre que 88 % des espèces de légumineuses étudiées jusqu’à nos jours ont la capacité de faire des nodules en symbiose
5
avec les rhizobiums (De Faria et al., 1989 cité par Graham et Vance, 2003). Le type de légumineuse utilisée comme précédent cultural est important puisque toutes ces plantes n’ont pas la même capacité de former des nodules. Le taux d’N restitué dépendra de la quantité de biomasse produite. Ceci est le premier facteur à prendre en compte pour une augmentation de rendement de la culture subséquente. La féverole d’hiver (Vicia faba L.) et le soya (Glycine max L.), utilisés comme précédents culturaux ont pu produire des biomasses restituées de 3,6 t MS ha-1 et 1,7 t MS ha-1 respectivement (Prieur et Justes,
2006). Cependant, la science a permis de découvrir des souches d’inoculant pour améliorer la capacité symbiotique des légumineuses moins efficaces (Dakora, 1985 cité par Bado, 2002).
1.3. Matière organique
On appelle matière organique tout composé animal ou végétal pouvant soit s’accumuler en résidus (Fortin, 1996 cité par Madina, 1997), soit se dégrader par compostage (Mustin, 1987 cité par Sall, 2014) ou encore des engrais organiques (Stevenson, 1994). Comme indiqué dans la section précédente, l’utilisation d’un précédent cultural de CC pour améliorer la fertilité du sol est une vieille pratique. Il serait donc pertinent de connaitre l’effet fertilisant de cette pratique agronomique. Cette information permettra de savoir le temps et le taux de minéralisation de la biomasse produite à travers le rapport C:N. En effet, la valeur du rapport C:N détermine la vitesse de minéralisation d’un composé organique et plus il est petit, plus le composé se minéralise vite (Fog, 1988 cité par Robin, 1997). Cependant, cette décomposition nécessite la contribution de la faune du sol (microfaune) après l’incorporation des résidus. Cette faune est composée de microorganismes et de vers de terre. Les microorganismes par leur activité dégradent la matière organique fraiche, en modifiant leur arrangement. Les particules obtenues se mélangent (se fixent) aux particules minuscules du sol. Le complexe ainsi formé est appelé agrégat stable (Le Guillou, 2011). Une expérience réalisée au Maroc sur la stabilité des agrégats des sols semi-arides a montré que plus la quantité de matière organique augmente, meilleure est la structure du sol. Cette étude encourage aussi les systèmes sans labour et l’utilisation d’engrais de ferme pour une bonne stabilité structurale des sols (Mrabet et al., 2004). Par ailleurs, l’obtention d’agrégats stables est plus complexe et plusieurs études ont tenté d’expliquer le processus de l’agrégation. L’un des modèles les plus connus de nos jours est celui de Tisdall et Oades (1982) qui explique l’agrégation en deux phases. Selon cette étude, l’agrégation commence pour la formation de macro-agrégats (> 250 µm) et qui sont liés par des racines et hyphes. À l’intérieur, ces macro-agrégats se fragmentent en microagrégats qui sont liés par des agents organiques.
6
La quantité et la durée de formation des agrégats dépendent fortement de la nature de la matière organique. Des études ont montré que l’utilisation des engrais de ferme apporte beaucoup d’éléments majeurs et mineurs lors de leur arrière-effet et par conséquent forme des agrégats stables qui perdurent (Tran et N’Dayegamiye, 1996) et que par contre les CC se décomposent plus facilement et l’augmentation de la fertilité est de courte durée (Le Guillou, 2011).
1.4. Minéralisation des cultures de couverture
Lorsque les CC sont détruites et enfouies dans le sol, une partie de la matière sèche en décomposition forme le complexe humique du sol. L’autre partie se minéralise pour libérer les nutriments nécessaires au bon développement des cultures principales, et Wagger (1989) lors de son expérience a mis un accent sur l’importance de la synchronisation de cette phase avec les besoins des cultures. Cependant, très peu de recherches se sont réellement intéressées à cette minéralisation au niveau des parties souterraines (racines) des CC (Hobbie et al., 2010). Habituellement, les dynamiques de l’N et du C permettent de prédire la décomposition des plantes, mais la forte concentration subéro-lignine des racines fait qu’elles ont tendance à contourner ou décliner souvent cette règle. Une étude réalisée sur le soya, le sorgho (Sorghum bicolor (L.) Moench), le brachiaria sp et le riz (Oryza sativa L.) a rapporté que les racines ont une minéralisation en C de 20 à 30 % inférieure à celle des parties aériennes (Abiven et al., 2005). Quemada et Cabrera en 1995 ont découvert chez certaines céréales [blé (Triticum aestivum L.), seigle (Secale cereale L.) et avoine (Avena sativa L.)] que les feuilles ont une concentration en N plus élevée et un rapport C:N le plus bas que les tiges. Collins et al. (1990) avaient démontré l’existence d’une interaction dans les résidus (feuilles et tiges) de blé lors de la décomposition. Les différents niveaux de minéralisation sont indiqués dans le tableau 1 ci-dessous. Tableau 1 : Relation entre le rapport carbone:azote (C:N) des résidus organiques, le niveau de minéralisation et la disponibilité de l’N pour les plantes.
C:N Niveau de minéralisation Disponibilité de l’azote
< 10 Forte minéralisation Élevée à très élevée
10 - 20 Bonne minéralisation Bonne à élevée
20 - 60 Faible minéralisation Faible à négative
60 - 100 Faible immobilisation Très faible à négative
> 100 Forte immobilisation Négative
7
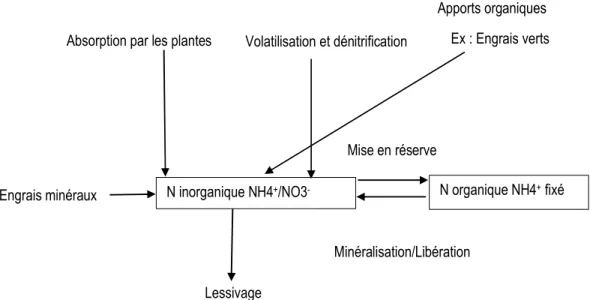
1.4.1. Cycle de l’azote et sources
L’atmosphère est un milieu composé de plusieurs éléments, mais le plus abondant est sans doute l’N (N2) qui représente environ 78 % de la composition totale (Galloway et al., 2004). L’N est aussi
l’élément nutritif majeur le plus recherché dans la production des plantes (Paul et Clark, 1989 cité par Verville, 2014). En agriculture, l’N peut provenir de deux sources distinctes : l’engrais de synthèse ou de ferme apporté par l’homme et la fixation biologique par certaines plantes en symbiose avec des bactéries du genre Rhizobium (Hellriegel et Wilfarth, 1888 cité par Dommergues et Mangenot, 1970). Pour que l’N organique soit utilisé par les plantes, il doit subir deux transformations qui sont : l’ammonification qui est le passage du N organique en ammonium (NH4+) et l’oxydation du NH4+ en
nitrate (NO3-) qui est la nitrification. Ces deux formes (ammonium et nitrate) sont utilisées par les
plantes selon l’espèce végétale (Layzell, 1990 cité Bado, 2002). L’ammonium peut être perdu par volatilisation et le nitrate par lessivage (Tremblay et al., 2010).
En dehors du lessivage, une autre étape pourrait survenir si le nitrate n’est pas utilisé par les plantes. Cette étape consiste à la dénitrification qui est la réduction du NO3- en N2O par des bactéries
spécifiques (dénitrifiantes) et l’N minéral redevient alors indisponible pour la plante, soit dans le sol, soit dans l’atmosphère (Simon, 1986; Awono, 1997 cité par Bado, 2002). Le cycle de l’N est illustré dans la figure 1 ci-dessous.
Figure 1 : Cycle de l’azote (N) (adapté de Tremblay et al., 2010).
N inorganique NH4+/NO3- N organique NH4+ fixé Engrais minéraux
Mise en réserve
Minéralisation/Libération
Lessivage
Absorption par les plantes Volatilisation et dénitrification
Apports organiques Ex : Engrais verts
8
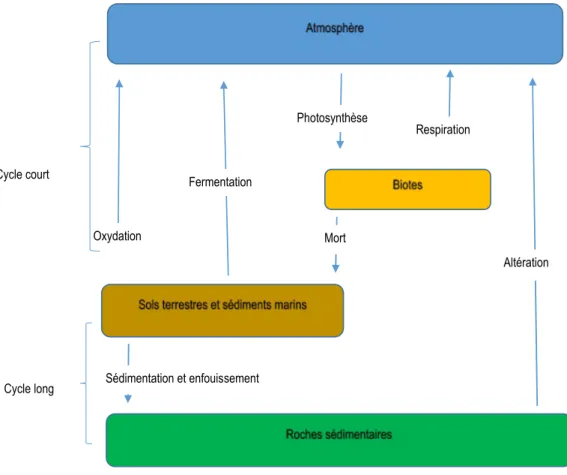
1.4.2. Cycle du carbone et sources
Contrairement à l’N, le C est le constituant principal de toutes les plantes et provient de l’absorption par celles-ci du dioxyde de carbone (CO2) qui est l’un des principaux gaz à effet de serre. Le plus grand
stock de C organique se trouve dans le sol et cette réserve est largement supérieure au C qui se trouve dans l’atmosphère (Sainju et al., 2008). La perte du C du sol est occasionnée par la minéralisation qui entraîne l’oxydation du C (Francou, 2003) et cette perte est progressivement compensée par les matières organiques provenant de la décomposition des êtres vivants qui meurent. La figure 2 ci-dessous présente le cycle du C.
Figure 2 : Cycles long et court du carbone organique (adapté de Kump et al., 1999).
1.4.3. Rapport carbone:azote
Le sigle (C:N) est communément appelé le rapport entre la concentration en C total et la concentration en N total d’un résidu ou amendement organique. Il joue un grand rôle dans la caractérisation de
Sédimentation et enfouissement Oxydation Fermentation Photosynthèse Respiration Mort Altération Cycle court Cycle long
9
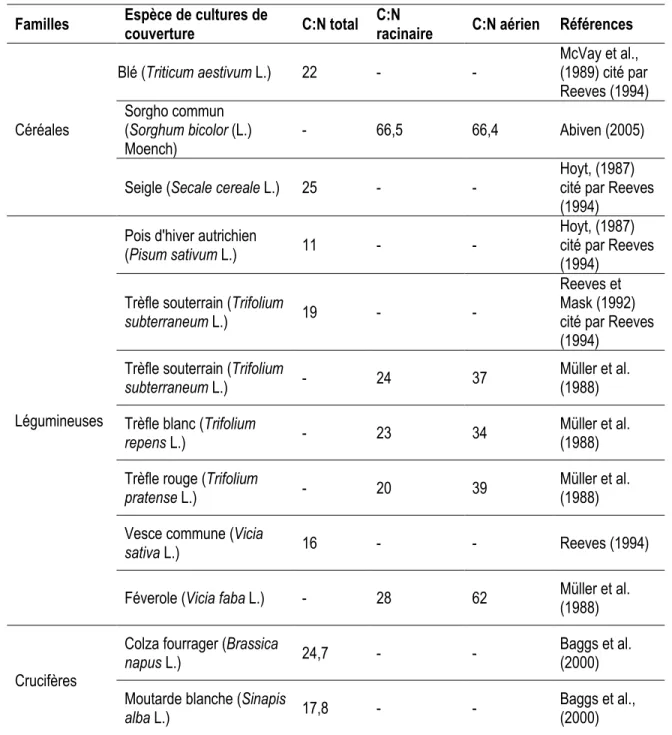
l’efficacité fertilisante d’un résidu organique (CRAAQ, 2003 cité par Giroux et Audesse, 2004) ainsi que dans la détermination de l’humus (Gloaguen et Touffet, 1982). Le rapport C:N et la valeur fertilisante peuvent varier selon le type d’engrais de ferme ou d’amendement organique (Hachicha et al., 2006). Les rapports C:N de certaines espèces issues de la littérature sont illustrés dans le tableau 2 ci-après.
Tableau 2 : Valeurs de rapports carbone:azote (C:N) total, aérien et racinaire de quelques cultures de couverture issues de la littérature scientifique.
Familles Espèce de cultures de
couverture C:N total
C:N
racinaire C:N aérien Références
Céréales Blé (Triticum aestivum L.) 22 - - McVay et al., (1989) cité par Reeves (1994) Sorgho commun (Sorghum bicolor (L.) Moench) - 66,5 66,4 Abiven (2005)
Seigle (Secale cereale L.) 25 - -
Hoyt, (1987) cité par Reeves (1994)
Légumineuses
Pois d'hiver autrichien
(Pisum sativum L.) 11 - -
Hoyt, (1987) cité par Reeves (1994)
Trèfle souterrain (Trifolium
subterraneum L.) 19 - -
Reeves et Mask (1992) cité par Reeves (1994)
Trèfle souterrain (Trifolium
subterraneum L.) - 24 37
Müller et al. (1988) Trèfle blanc (Trifolium
repens L.) - 23 34
Müller et al. (1988) Trèfle rouge (Trifolium
pratense L.) - 20 39
Müller et al. (1988) Vesce commune (Vicia
sativa L.) 16 - - Reeves (1994)
Féverole (Vicia faba L.) - 28 62 Müller et al.
(1988)
Crucifères
Colza fourrager (Brassica
napus L.) 24,7 - -
Baggs et al. (2000) Moutarde blanche (Sinapis
alba L.) 17,8 - -
Baggs et al., (2000)
10
1.5. Choix des espèces de cultures de couverture
Le choix de l’espèce de CC joue un rôle important dans la minéralisation. La décomposition est influencée par la qualité des résidus lorsque les conditions sont favorables (Couteaux et al., 1995) et le meilleur prédicteur de l’N résiduel est le rapport C:N (Quemada et Cabrera, 1995). Les études de Rasse et al. (2005) et Moore et al. (1999) ont conclu que le meilleur prédicteur de minéralisation était le rapport lignine:N.Certaines cultures de couverture et leurs caractéristiques sont disponibles dans le tableau 3 ci-dessous.
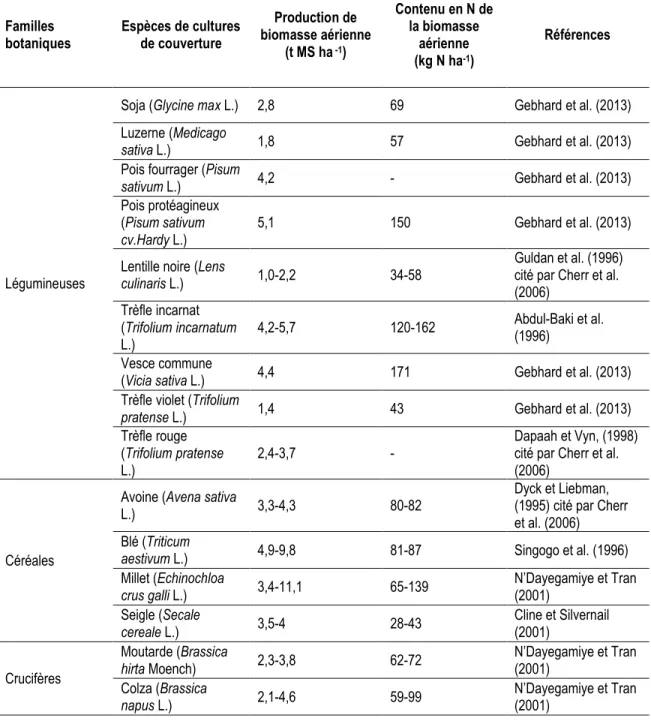
Tableau 3 : Caractéristiques de différentes cultures de couverture.
Familles botaniques Espèces de cultures de couverture Production de biomasse aérienne (t MS ha -1) Contenu en N de la biomasse aérienne (kg N ha-1) Références Légumineuses
Soja (Glycine max L.) 2,8 69 Gebhard et al. (2013) Luzerne (Medicago
sativa L.) 1,8 57 Gebhard et al. (2013)
Pois fourrager (Pisum
sativum L.) 4,2 - Gebhard et al. (2013)
Pois protéagineux (Pisum sativum
cv.Hardy L.)
5,1 150 Gebhard et al. (2013)
Lentille noire (Lens
culinaris L.) 1,0-2,2 34-58
Guldan et al. (1996) cité par Cherr et al. (2006) Trèfle incarnat (Trifolium incarnatum L.) 4,2-5,7 120-162 Abdul-Baki et al. (1996) Vesce commune
(Vicia sativa L.) 4,4 171 Gebhard et al. (2013) Trèfle violet (Trifolium
pratense L.) 1,4 43 Gebhard et al. (2013)
Trèfle rouge (Trifolium pratense L.)
2,4-3,7 -
Dapaah et Vyn, (1998) cité par Cherr et al. (2006)
Céréales
Avoine (Avena sativa
L.) 3,3-4,3 80-82
Dyck et Liebman, (1995) cité par Cherr et al. (2006) Blé (Triticum
aestivum L.) 4,9-9,8 81-87 Singogo et al. (1996)
Millet (Echinochloa crus galli L.) 3,4-11,1 65-139 N’Dayegamiye et Tran (2001) Seigle (Secale cereale L.) 3,5-4 28-43 Cline et Silvernail (2001) Crucifères Moutarde (Brassica hirta Moench) 2,3-3,8 62-72 N’Dayegamiye et Tran (2001) Colza (Brassica napus L.) 2,1-4,6 59-99 N’Dayegamiye et Tran (2001)
11 Polygonacées Sarrasin (Fagopyrum esculentum L. Moench) 2,1-3,6 52-65 N’Dayegamiye et Tran (2001) 1.5.1. Pois fourrager
Le pois fourrager (Pisum sativum L.) est une plante légumineuse annuelle pouvant atteindre une production de 4,2 t de MS ha-1 (Gebhard et al., 2013) et avec un contenu en N pouvant atteindre 200 kg
N ha-1 (Cherr et al., 2006).
1.5.2. Trèfle rouge
Le trèfle rouge (Trifolium pratense L.) est un engrais vert de la famille des légumineuses. Il serait originaire d’Europe et d’Asie. Sa production est actuellement possible sur tous les continents. Cette plante est bisannuelle et possède une tige droite avec des ramifications ayant chacune trois feuilles (Filières des plantes médicinales biologiques du Québec, 2004). Certaines recherches (Badaruddin et Meyer (1990); et Vyn et al., 2000 cité par Verville, 2014) ont eu des rendements supérieurs au témoin (aucune CC) allant jusqu’à 58 % et 40 %, respectivement, en utilisant du trèfle en intercalaire dans des cultures de blé et du maïs.
Il est un bon précédent cultural pour les cultures exigeantes en N et produit une biomasse aérienne de 2,4-3,7 t de MS ha-1 (Dapaah et Vyn, 1998 cité par Cherr et al., 2006) avec un rapport C:N des
parties aériennes de 39 (soit 11 pour les feuilles et 28 pour les tiges et pétioles), alors que celui des racines est de 20 (Müller et al., 1988).
1.5.3. Vesce commune
La vesce commune (Vicia sativa L.) est utilisée comme engrais vert et appartient à la famille des légumineuses. Elle est originaire d’Europe et peut aussi être produite dans les climats tempérés. C’est une plante rampante. La vesce commune est une culture généralement employée pour concurrencer les plantes nuisibles. Elle est efficace aussi contre l’érosion. Sa production peut atteindre 4,4 t MS ha -1 avec un contenu en N de 171 kg N ha-1 (Gebhard et al., 2013). Le rapport C:N est de 16 (Reeves,
12
1.6. Parties des cultures de couverture
1.6.1. Partie aérienneLa partie aérienne d’une plante est la partie visible constituée des tiges, des feuilles et des fruits (Charest, 2017). Cette partie est responsable de nombreux phénomènes physiologiques, dont le principal est la photosynthèse. La tige fait le pont entre les racines et les feuilles et contient des tissus conducteurs (xylème et phloème) des sèves brute et élaborée. La sève élaborée (sucres, lipides et autres composés) venant de la photosynthèse circule du haut vers le bas tandis que la sève brute (eau et nutriments) passe des racines vers les feuilles. La tige permet également à la plante d’être dressée ou rampante quand elle est moins rigide (peu de lignine). C’est au niveau de la feuille que se déroule le processus de photosynthèse, et plus précisément dans les chloroplastes (Charest, 2017). Selon l’espèce de plante ou le milieu d’habitat (disponibilité en eau), les feuilles peuvent prendre plusieurs formes (petites, grosses, épines et vrilles). L’estimation de la production de biomasse vient majoritairement des feuilles.
1.6.2. Partie souterraine
La partie souterraine d’une plante fait référence aux racines et constitue la zone invisible des plantes au cours de leur développement. Les racines peuvent avoir plusieurs fonctions, mais les principales sont l’absorption d’eau et de réserves nutritives au niveau des poils absorbants et le support qu’elles offrent aux plantes (Fitter, 1986). La synthèse de certains régulateurs de croissance et le stockage d’éléments nutritifs peuvent être considérés comme des fonctions secondaires. Il existe généralement deux types racinaires (Charest, 2017) :
Racines pivotantes : elles se caractérisent par une racine principale et dominante entourée par des racines latérales.
Racines fasciculées : elles se caractérisent par le remplacement de la racine séminale par des racines latérales de mêmes dimensions.
Les plantes à travers les racines sont en contact avec des organismes qui dépendent de source d’énergie externe pour leur croissance. Les racines dans leurs fonctions de défense (El Zahar Haichar et al., 2008) et de mobilisation de micronutriments métalliques (Fan et al., 2001) produisent des substances (ou composés organiques) pouvant être des acides carboniques, des acides aminés ou des sucres (Kumar et al., 2007). Ces substances ainsi produites sont appelées exsudats racinaires
13
(Rovira, 1969). Les exsudats sont des facteurs importants pour la communauté bactérienne du sol qui les utilisent pour produire de l’énergie et de la biomasse. Des études ont montré que presque 20 % des produits de photosynthèse sont libérés dans le sol créant ainsi une interaction bénéfique entre la plante et les microorganismes (El Zahar Haichar et al., 2008).
14
2. Objectifs et hypothèses
2.1. Objectif général
Ce projet de recherche avait pour objectif général de déterminer l’effet des espèces de CC et des parties de plante (racines et parties aériennes) sur la décomposition des CC enfouies dans le sol.
2.2. Objectifs spécifiques
Les objectifs spécifiques de cette étude étaient de :
Objectif 1 : comparer les caractéristiques (chimiques, morphologiques) des racines et des parties aériennes de trois CC de légumineuses.
Objectif 2 : évaluer la dynamique de la décomposition des biomasses racinaire et aérienne de trois CC de légumineuses.
Objectif 3 : quantifier la libération (dans le temps) de l’N provenant de la décomposition des racines et des parties aériennes de ces CC.
Objectif 4 : évaluer l'importance des paramètres de qualité de résidus (concentrations en C et en N, rapport C:N) sur leur décomposition.
2.3. Hypothèses
Les hypothèses du projet de recherche étaient les suivantes :
Hypothèse 1 : les racines de CC ont une concentration en N moindre que celles des parties aériennes.
Hypothèse 2 : le rapport C:N est un indicateur du taux de décomposition des racines et parties aériennes des CC.
Hypothèse 3 : le temps de décomposition des résidus racinaire est supérieur à celui de la décomposition aérienne.
Hypothèse 4 : le temps de libération d’N des racines est supérieur à celui des parties aériennes.
15
3. Matériel et méthodes
3.1. Production des cultures de couverture
Pour la réalisation de ce projet, trois espèces de CC ont été choisies selon leurs intérêts auprès des producteurs agricoles (Lépinard, 2016, rapport de fin de maîtrise) à la suite d’une enquête réalisée en 2016. Ces cultures étaient le pois fourrager, le trèfle rouge et la vesce commune. Ces CC ont été cultivées en chambre de croissance, récoltées, séchées, mis en sac, puis enfouies dans le sol pour étudier leur décomposition.
a. Semis
Les plantes ont été semées en raison de quatre graines par pot avec trois tuteurs pour la vesce et le pois fourrager. Le trèfle rouge a été inoculé avec Rhizobium leguminosarum bv. trifolii, et le pois fourrager et la vesce ont été inoculés avec Rhizobium leguminasorum bv. viciae. Les pots avaient une hauteur de 17,5 cm, un diamètre de haut de 19,0 cm, un diamètre de base 14,5 cm et le tout pour un volume 3,85 L. Les pots ont été placés dans deux chambres de croissance (numéro 16 et numéro 18) de type Conviron CMP3244 (Controlled Environments Ltd, Winnipeg, MB, Canada) du pavillon Envirotron de l’Université Laval dans la ville de Québec, QC, Canada (figure 3). Chaque chambre mesure 3,3 m2 et peut contenir 80 pots (annexe ). Dans chacune des deux chambres, 60 pots (20 pots
pour chacune des trois espèces de CC testées) étaient disposés dans un plan entièrement aléatoire. Des pots supplémentaires semés en raison de dix graines par pots ont été ajoutés pour fournir des plantules de remplacement aux pots qui fourniront moins de quatre plants. Le sol utilisé pour remplir ces pots venait de la parcelle A-23 (section nord) de la Station agronomique de recherche de Saint-Augustin-de-Desmaures. Des analyses chimiques ont été effectuées sur ce sol.
b. Croissance
Dans les chambres de croissance, les plantes étaient maintenues à une photopériode de 16 h par jour, une humidité relative de 70 % et à des températures de 22°C le jour et 17°C la nuit durant toute leur croissance (70 jours). Le désherbage manuel de plantules de mauvaises herbes et l’arrosage étaient faits à la demande. Aucune fertilisation n’a été effectuée lors du semis ou durant la croissance des plants.
16
c. Récolte
Au stade début fructification pour le pois fourrager et la vesce commune (stade 7 de l’échelle BBCH) et au stade floraison pour le trèfle rouge (stade 6 de l’échelle BBCH), (Weber et Bleiholder, 1990); les parties aériennes ont été fauchées à la surface du sol, récoltées, puis séchées à 55°C jusqu’à l’obtention d’un poids constant. Les parties racinaires ont été prélevées dans tout le volume de sol du pot (3,85 L). Les racines et le sol ont été trempés dans une solution d’hexamétaphosphate de sodium (100 g L-1) durant au moins 16 h, et réfrigérés à 4°C durant ce trempage. Les racines ont ensuite été
lavées à la main en utilisant un tamis, un boyau d’arrosage, des chaudières et un scalpel pour récupérer les racines, puis séchées à 55°C jusqu’à l’obtention d’un poids constant.
Figure 3 : Production des plantes dans les chambres de croissance (Dembélé, 2017).
3.2. Dispositif expérimental
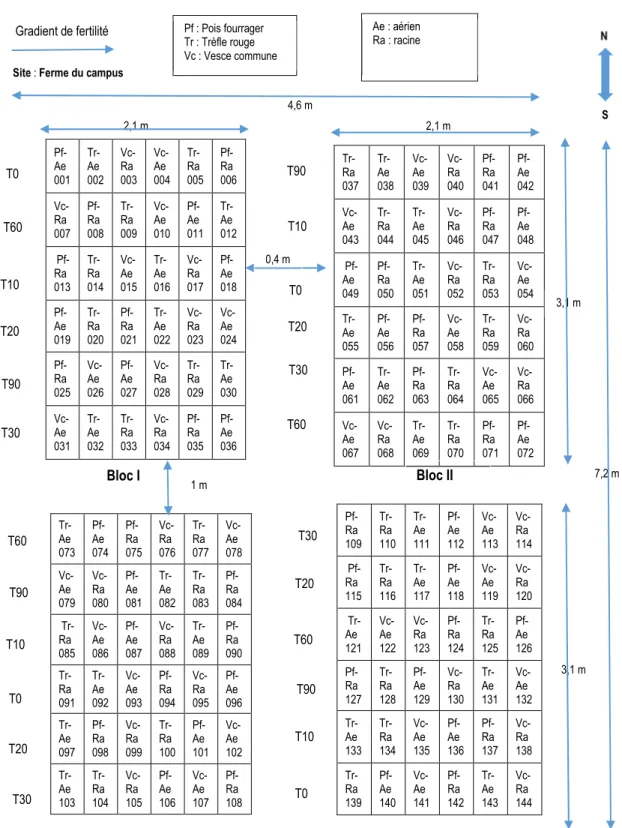
Après fauchage et séchage, les racines et parties aériennes des trois espèces de CC ont fait l’objet d’une étude de décomposition dans des sacs de résidus. À cet effet, le dispositif utilisé pour cette décomposition était un factoriel en tiroirs (3 2 6), avec quatre blocs (figure 4). Un total de 144 (3 2 6 4) sacs de résidus ont été fabriqués. Les trois espèces de CC sélectionnées étaient : le pois fourrager, le trèfle rougeet la vesce commune. Deux parties de ces plantes ont été étudiées : les racines et les parties aériennes. Une fois enfouis dans le sol, des sacs de résidus ont été prélevés à 10, 20, 30, 60 et 90 jours après le placement. Des sacs ont été aussi prélevés le jour du placement (jour 0), tout de suite après leur enfouissement dans le sol, pour déterminer la composition chimique
17
initiale des résidus et pour estimer la perte de biomasse liée au placement et au prélèvement des sacs de résidus. L’expérience a été réalisée à la ferme du campus de l’Université Laval dans la ville de Québec, QC, Canada.
18 Pf-Ae 001 Tr-Ae 002 Vc-Ra 003 Vc-Ae 004 Tr-Ra 005 Pf-Ra 006 Vc-Ra 007 Pf-Ra 008 Tr-Ra 009 Vc-Ae 010 Pf-Ae 011 Tr-Ae 012 Pf-Ra 013 Tr-Ra 014 Vc-Ae 015 Tr-Ae 016 Vc-Ra 017 Pf-Ae 018 Pf-Ae 019 Tr-Ra 020 Pf-Ra 021 Tr-Ae 022 Vc-Ra 023 Vc-Ae 024 Pf-Ra 025 Vc-Ae 026 Pf-Ae 027 Vc-Ra 028 Tr-Ra 029 Tr-Ae 030 Vc-Ae 031 Tr-Ae 032 Tr-Ra 033 Vc-Ra 034 Pf-Ra 035 Pf-Ae 036 Tr-Ae 073 Pf-Ae 074 Pf-Ra 075 Vc-Ra 076 Tr-Ra 077 Vc-Ae 078 Vc-Ae 079 Vc-Ra 080 Pf-Ae 081 Tr-Ae 082 Tr-Ra 083 Pf-Ra 084 Tr-Ra 085 Vc-Ae 086 Pf-Ae 087 Vc-Ra 088 Tr-Ae 089 Pf-Ra 090 Tr-Ra 091 Tr-Ae 092 Vc-Ae 093 Pf-Ra 094 Vc-Ra 095 Pf-Ae 096 Tr-Ae 097 Pf-Ra 098 Vc-Ra 099 Tr-Ra 100 Pf-Ae 101 Vc-Ae 102 Tr-Ae 103 Tr-Ra 104 Vc-Ra 105 Pf-Ae 106 Vc-Ae 107 Pf-Ra 108
Figure 4 : Dispositif des sacs de résidus enfouis.
Tr-Ra 037 Tr-Ae 038 Vc-Ae 039 Vc-Ra 040 Pf-Ra 041 Pf-Ae 042 Vc-Ae 043 Tr-Ra 044 Tr-Ae 045 Vc-Ra 046 Pf-Ra 047 Pf-Ae 048 Pf-Ae 049 Pf-Ra 050 Tr-Ae 051 Vc-Ra 052 Tr-Ra 053 Vc-Ae 054 Tr-Ae 055 Pf-Ae 056 Pf-Ra 057 Vc-Ae 058 Tr-Ra 059 Vc-Ra 060 Pf-Ae 061 Tr-Ae 062 Pf-Ra 063 Tr-Ra 064 Vc-Ae 065 Vc-Ra 066 Vc-Ae 067 Vc-Ra 068 Tr-Ae 069 Tr-Ra 070 Pf-Ra 071 Pf-Ae 072 Pf-Ra 109 Tr-Ra 110 Tr-Ae 111 Pf-Ae 112 Vc-Ae 113 Vc-Ra 114 Pf-Ra 115 Tr-Ra 116 Tr-Ae 117 Pf-Ae 118 Vc-Ae 119 Vc-Ra 120 Tr-Ae 121 Vc-Ae 122 Vc-Ra 123 Pf-Ra 124 Tr-Ra 125 Pf-Ae 126 Pf-Ra 127 Tr-Ra 128 Pf-Ae 129 Vc-Ra 130 Tr-Ae 131 Vc-Ae 132 Tr-Ae 133 Tr-Ra 134 Vc-Ae 135 Pf-Ae 136 Pf-Ra 137 Vc-Ra 138 Tr-Ra 139 Pf-Ae 140 Vc-Ae 141 Pf-Ra 142 Tr-Ae 143 Vc-Ra 144 2,1 m 3,1 m 2,1 m 4,6 m 0,4 m 7,2 m T90 T30 T60 T90 T10 T0 T20 T30 T90 T10 T0 T20 T30 T60 T30 T20 T60 T90 T10 T0 Bloc I Bloc II Pf : Pois fourrager Tr : Trèfle rouge Vc : Vesce commune
Gradient de fertilité Ae : aérien
Ra : racine N
S
1 m
3,1 m
Bloc III Bloc IV
Site : Ferme du campus
T0
T60
T10
19
3.3. Fabrication, placement et prélèvement des sacs de résidus
Des sacs de résidus (10 cm x 10 cm) ont été fabriqués avec du matériel moustiquaire en fibre de verre (RCR International Inc., Boucherville, QC, Canada) et des agrafes. Des biomasses sèches de 5,0 g de racines ou de parties aériennes ont été ajoutées dans chacun des sacs de résidus, équivalant à 0,5 kg m-2 ou 5 t ha-1 de biomasse. Les gousses (pois et vesce) et les fleurs (trèfle rouge) des parties Le 26
juillet 2017, la culture d’orge (Hordeum vulgare L.) implantée sur le site au printemps 2017 a été fauchée. Les biomasses aériennes d’orge ont été retirées du site, et un travail de sol a été fait à l’aide d’un rotoculteur. Le 4 août 2017, les sacs de résidus ont été enfouis à une profondeur de 5-10 cm dans le sol, pour une période allant jusqu’à 90 jours (jusqu’au 2 novembre 2017). La parcelle a été désherbée manuellement durant la période de placement.
À chacune des six dates d’échantillonnage, les sacs de résidus ont été prélevés délicatement du sol. Quelques sacs de résidus comprennaient des repousses d’orge qui occupent précédemment la parcelle de mai à juillet 2017. Ces repousses ont été enlevées manuellement des sacs. Les sacs de résidus ont été transportés au laboratoire dans des sacs de plastique identifiés, ensuite le contenu de chaque sac de résidus a été trempé cinq minutes dans l’eau pour éliminer les particules de sol des résidus. Les sacs ont ensuite été ouverts et la biomasse y a été extraite. La biomasse a été séchée à 55°C durant 48 heures jusqu’à poids constant, puis pesée individuellement. Une fois pesée, la biomasse a été moulue en poudre à l’aide d’un broyeur « Mini Wiley Mill » (Thomas Scientific, Swedesboro, NJ, U.S.A.) avec un tamis US std#10 (2 mm).
3.4. Analyse chimique des biomasses de cultures de couverture
Pour chacune des six dates d’échantillonnage, la biomasse sèche et la composition chimique ont été déterminées. Les analyses de composition chimique (concentration en C et en N) ont été déterminées à l’aide d’un analyseur CNS Trumac (LECO, St. Joseph, MI, U.S.A.), sur 0,5 g d’échantillon. Avec ces données, les rapports C:N ont été calculés pour chacun des échantillons. Le taux de cendres a été déterminé sur un échantillon composite (i.e. un échantillon par espèce et par bloc) de 2,0 g de racines à l’aide d’un four à moufle Isotemp (Thermo Fisher Scientific, Waltham, MA, U.S.A.). Toutes les données de biomasses ont été corrigées avec le taux de cendres et la perte due aux placements selon la méthodologie de Carter (1993). La correction du taux de cendres s’est fait par l’équation qui suit :
20
DMAFLt = DMLt – [DMLt x (ALt/100)]
où DMAFLt : Masse sèche sans cendre
DMLt :Masse sèche pesée
ALt :Taux de cendre (en pourcentage)
La perte de biomasse due à la manutention des sacs de résidus (placement et prélèvement) s’est calculée comme suit :
% Flic AFLt Flic DMA DM Mt DMA
où % Mt : Pourcentage de perte de masse sèche au temps t de prélèvement
DMAFlic : Masse sèche initiale corrigée sans cendre
Les contenus en C et N ont été déterminés comme suit : Cct = % C x Mpc Nct = % N x Mpc où Cct : Contenu en C % C : Concentration en C Nct : Contenu en N % N : Concentration en N
Mpc : Masse sèche en pourcentage corrigé
3.5. Analyses statistiques
L’analyse de la variance a été effectuée avec la procédure MIXED de SAS University. L’homogénéité de la variance a été déterminée suite à l’analyse des résidus et la normalité a été vérifiée par la procédure UNIVARIATE. Une vérification a été faite pour savoir si une transformation était nécessaire pour déterminer la normalité des résidus. Les transformations logarithmiques et par la racine carrée ont été faites pour l’analyse de la concentration en C et le rapport C:N, respectivement. Dans cette expérience, le temps, les espèces de CC, les parties et leurs interactions ont été considérées comme des facteurs fixes. Les blocs et les interactions avec les blocs ont été considérés comme des facteurs aléatoires. L’analyse des corrélations entre les caractéristiques chimiques des CC et les biomasses ont été effectuées avec la procédure CORR de SAS University.
21
4. Résultats
4.1. Caractérisation des sols
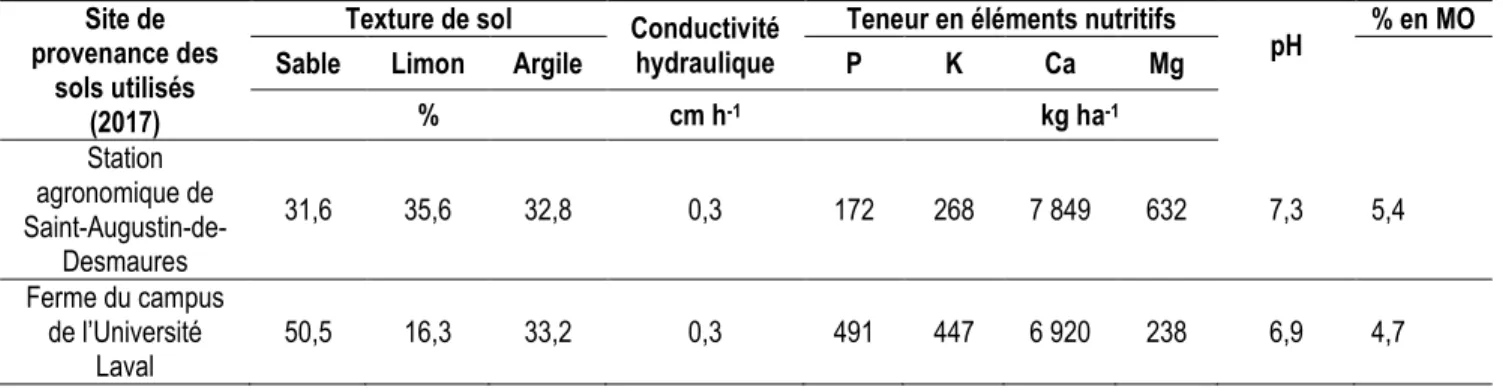
Les analyses des deux sols utilisées dans cette étude montrent une similarité entre ceux-ci quant à la fertilité et à leur faible conductivité hydraulique (tableau 4). Le sol de Saint-Augustin-de-Desmaures, utilisé pour la croissance des CC en pots, est légèrement plus alcalin que celui de la ferme de l’Université Laval, où l’essai de décomposition au champ s’est réalisé. À Saint-Augustin-de-Desmaures, le sol est de classe texturale loam argileux (L-A), c’est-à-dire un sol de type G1-lourd. Le sol de la ferme du campus appartient à la classe texturale loam sablo-argileux (L-S-A), donc un sol de type G3-léger.
Tableau 4 : Caractéristiques des sols des sites de la Station agronomique de Saint-Augustin-de-Desmaures et de la ferme du campus de l’Université Laval utilisés comme substrat pour la croissance des cultures de couverture et comme lieu de réalisation de l’essai de décomposition, respectivement.
Site de provenance des
sols utilisés (2017)
Texture de sol Conductivité hydraulique
Teneur en éléments nutritifs
pH % en MO Sable Limon Argile P K Ca Mg
% cm h-1 kg ha-1 Station agronomique de Saint-Augustin-de-Desmaures 31,6 35,6 32,8 0,3 172 268 7 849 632 7,3 5,4 Ferme du campus de l’Université Laval 50,5 16,3 33,2 0,3 491 447 6 920 238 6,9 4,7
4.2. Cultures de couverture à l’étude
Les CC ont été récoltées au cours de leur croissance pour la réalisation de l’essai de décomposition. Un aperçu visuel de chacune des espèces au moment de la récolte est présenté aux figures 5, 6 et 7. Le trèfle rouge (figure 5) porte une tige droite avec des feuilles rondes à trois folioles. Son système racinaire est pivotant avec beaucoup de racines latérales. Le pois fourrager (figure 6) et la vesce commune (figure 7) sont des plantes grimpantes avec des feuilles composées en folioles opposées. Leurs systèmes racinaires sont fasciculés. Au moment de leur récolte, le pois fourrager et la vesce commune avaient commencé à faire des fruits alors que le trèfle qui est une plante vivace n’avait pas encore fini sa floraison.
22
Trèfle rouge
Figure 5 : Quelques tiges et les racines lavées (contenu total d’un pot) de trèfle rouge au moment de leur récolte au stade floraison (Dembélé, 2017).
Pois fourrager
Figure 6 : Une tige et les racines lavées (contenu total d’un pot) de pois fourrager au moment de leur récolte au stade début fructification (Dembélé, 2017).
23
Vesce commune
Figure 7 : Quelques tiges et les racines lavées (contenu total d’un pot) de vesce commune au moment de leur récolte au stade début fructification (Dembélé, 2017).
Les caractéristiques chimiques initiales des trois espèces de CC étudiées diffèrent (tableau 5). Les parties aériennes du pois fourrager avaient la concentration initiale en N la plus petite et celles du trèfle rouge la plus élevée. Pour la partie racinaire, c’est la vesce commune qui a eu la concentration en N la plus élevée alors le trèfle rouge a eu la plus basse. Les concentrations initiales en C des parties aériennes étaient similaires pour toutes les espèces de CC testées (45,9-48,2%).
Tableau 5 : Caractéristiques initiales des cultures de couverture utilisées dans le projet de recherche.
Espèces Stade phénologique Concentration en azote (%) Concentration en carbone (%) Rapport C:N
Pois fourrager Début fructification Aérien 1,6 48,2 30,3
Racinaire 3,4 45,9 13,7
Vesce commune Début fructification Aérienne 1,8 46,5 24,6
Racinaire 3,5 46,9 13,7
Trèfle rouge Floraison Aérien 1,9 47,2 25,7
Racinaire 2,3 47,2 20,9
Pour ce qui est des parties aériennes des CC, le rapport C:N initial le plus élevé est obtenu par le pois fourrager tandis que le plus bas est enregistré par la vesce commune. Quant à la partie souterraine, le rapport C:N le plus élevé était celui du trèfle rouge.
24
4.3. Analyse de la variance pour tous les paramètres étudiés
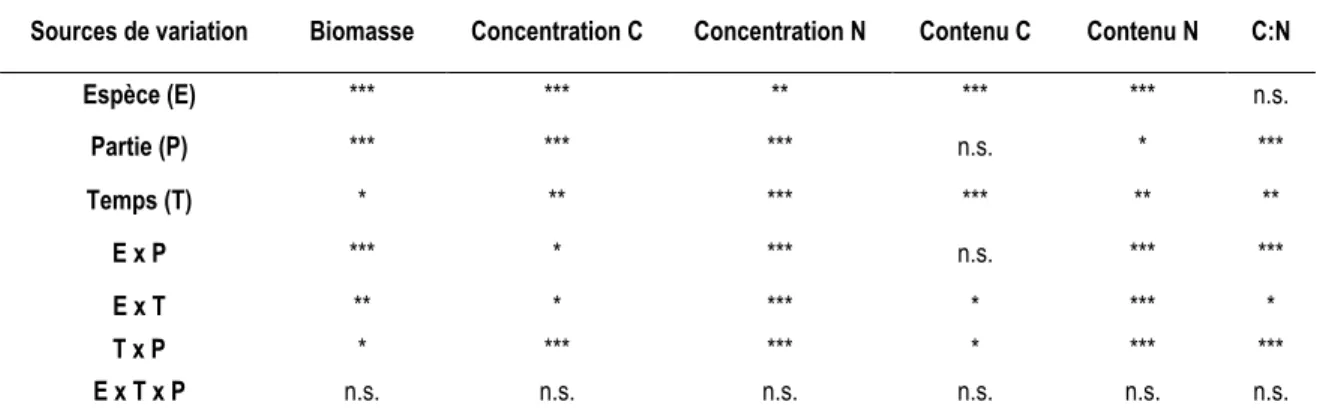
L’effet des espèces de CC, des parties de la plante et du temps de décomposition ont été testées sur la biomasse et des paramètres de qualité des CC (tableau 6). Pour chacun des paramètres, l’interaction triple est non significative. Les interactions Temps Partie et Espèce Temps sont significatives pour tous les paramètres. L’interaction double Espèce Partie est significative pour tous les paramètres sauf le contenu en C.
Tableau 6: Résumé de l’analyse de la variance (ANOVA) des effets fixes des espèces de cultures de couverture, des parties de la plante, du temps et de leurs interactions sur la biomasse des cultures de couverture, leurs concentrations en carbone (C) et en azote (N), leurs contenus en C et en N, ainsi que leur rapport C:N.
Sources de variation Biomasse Concentration C Concentration N Contenu C Contenu N C:N Espèce (E) *** *** ** *** *** n.s. Partie (P) *** *** *** n.s. * *** Temps (T) * ** *** *** ** ** E x P *** * *** n.s. *** *** E x T ** * *** * *** * T x P * *** *** * *** *** E x T x P n.s. n.s. n.s. n.s. n.s. n.s. *** P < 0,001, ** P < 0,01, * P < 0,05, n.s. = non significatif.
4.4. Biomasse
Après seulement 10 jours de décomposition, les trois espèces de CC avaient déjà perdu en moyenne 30 % de leur biomasse initiale (figure 8). Ensuite, à partir du 20e jour de décomposition, le trèfle rouge
s’est décomposé à un taux significativement plus rapide que les deux autres espèces, soit le pois fourrager et la vesce commune. Cette différence entre la vitesse de décomposition du trèfle rouge et celle des deux autres espèces testées s’est maintenue jusqu’à la fin de l’expérience (90e jour). À la fin
de l’expérience (90 jours), la biomasse du trèfle rouge ne représentait que 12 % de sa biomasse initiale, alors que celle du pois fourrager et de la vesce commune était de 20 % en moyenne. Aucune différence n’a été observée entre la décomposition de la vesce commune et celle du pois fourrager tout au long de l’expérience (figure 10).
25
Figure 8 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la biomasse des cultures de couverture.
À 10 jours de placement, le taux de décomposition était rapide et les parties aérienne et souterraine ont perdu en moyenne 30 % de leur biomasse initiale (figure 9). Au 20e et 30e jour de placement, la
partie aérienne était significativement plus décomposée que la partie souterraine. Au 20e jour, les
parties aériennes et souterraines représentaient respectivement 39 et 48 % de la biomasse initiale. Puis au 30e jour, elles représentaient 33 et 44 % de cette biomasse, respectivement. Ensuite, au
dernier jour de placement (90e jour), les parties aériennes et souterraines représentaient en moyenne
18 % de leur biomasse initiale.
Figure 9 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur la biomasse des cultures de couverture.
A C CD EF FG A B D E GH H A C C E FG 0 10 20 30 40 50 60 70 80 90 100 0 10 20 30 60 90 Bioma sse (% de la biom asse initiale ) Temps (jours)
Pois fourrager Trèfle rouge Vesce commune
A B D E F G A B C C F FG 0 10 20 30 40 50 60 70 80 90 100 0 10 20 30 60 90 Bioma sse ( % de la bi oma sse initiale) Temps (jours) Aérien Racinaire
26
L’évolution de la biomasse lors de la décomposition a été influencée par l’interaction entre l’espèce et la partie (tableau 6). Au cours de leur décomposition (0-90 jours), les parties aériennes du pois fourrager et de la vesce commune ont décomposé plus rapidement que leurs parties racinaires (figure 10). Aucune différence significative n’a été observée entre ces deux CC. En ce qui concerne le trèfle rouge, aucune différence n’a été observée entre la biomasse des parties aériennes et souterraines lors de leur décomposition (figure 10).
Figure 10 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la biomasse des cultures de couverture.
La corrélation des principaux paramètres chimiques des CC a été testée sur la biomasse en décomposition (tableau 7). La corrélation entre les biomasses aériennes ou souterraines et leur concentration respective en N, en C et leur rapport C:N n’est pas significative.
Tableau 7 : Corrélations entre les variables indépendantes (biomasses aériennes et racinaires) et les variables dépendantes (caractéristiques chimiques des cultures de couverture).
Biomasse aérienne
Caractéristiques chimiques des cultures de couverture Concentration en azote (%) Concentration en carbone (%) Rapport C:N n.s. r = -0,062 n.s. r = -0,298 n.s. r = -0,068 Biomasse racinaire n.s. r = 0,290 n.s. r = 0,297 n.s. r = -0,201
n.s. = non significatif, r = coefficient de corrélation, n (nombre d’échantillons) = 143, et la biomasse en pourcentage sans cendre corrigée a été utilisée pour effectuer les corrélations.
B B C A A C 0 10 20 30 40 50 60
Pois fourrager Vesce commune Trèfle rouge
Bioma sse (% de la biom asse initiale ) Espèce Aérien Racinaire
27
4.5. Concentration en azote
La concentration en N a été influencée par l’interaction entre le temps et la partie (tableau 6). La concentration en N de la partie racinaire est plus élevée que celle de la partie aérienne (figure 11). La concentration en N de la partie racinaire diminue progressivement entre le 30e jour et le 90e jour, tandis
que celle de la partie aérienne reste constante durant tout le processus de décomposition.
Figure 11 : Effet de l’interaction entre le temps de décomposition et la partie d’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture.
La concentration en N a varié sous l’effet de l’interaction entre l’espèce et la partie (tableau 6). Au cours de la décomposition, la concentration en N des parties racinaires des trois CC est statistiquement identique et les racines contiennent plus d’N que les parties aériennes (figure 12). La partie aérienne du trèfle est la plus riche en N (2,2 %), suivie de celle de la vesce commune (1,7 %) et ensuite vient celle du pois fourrager (1,2 %).
C C C C C C A B A A B B 0 0.5 1 1.5 2 2.5 3 3.5 0 10 20 30 60 90 Conce ntratio n N (%) Temps (jours) Aérien Racinaire
28
Figure 12 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture.
L’interaction entre le temps et l’espèce a eu une influence significative sur la concentration en N (tableau 6). Durant les premiers 10 jours de placement, les concentrations en N de la vesce commune et du pois fourrager ont brusquement diminué (figure 13). Ensuite, ces concentrations en N ont légèrement augmenté ou sont restés stables. Par contre, pour le trèfle rouge, la concentration en N a connu une augmentation progressive jusqu’au 30e jour avant une diminution à partir du 30e jour. À la
fin de l’expérience (90 jours), la concentration en N du trèfle rouge était supérieure à celles du pois fourrager et de la vesce commune (figure 13).
Figure 13 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la concentration en azote (N) des cultures de couverture.
D C B A A A 0 0.5 1 1.5 2 2.5 3 3.5
Pois fourrager Vesce commune Trèfle rouge
Conce ntratio n N (%) Espèce Aérien Racinaire BCDE
GHI FGHI FGHI HI
I FGHI DEFGH AB A CDEFG CDEF ABC EFGHI DEFGH BCD DEFGH GHI 0 0.5 1 1.5 2 2.5 3 3.5 0 10 20 30 60 90 Conce ntratio n N (%) Temps (jours)
29
4.6. Contenu en azote
Le contenu en N des plantes a été influencé significativement par l’interaction entre la partie et le temps (tableau 6). Après seulement 20 jours de placement, les parties aériennes et souterraines ont perdu une grande quantité de leur contenu en N, soit en moyenne 66 % et 50 % de leur contenu initial, respectivement (figure 14). Au début de l’expérience et jusqu’au 30e jour, le contenu en N de la partie
racinaire était significativement supérieur à celui de la partie aérienne, mais après 90 jours de placement, cette différence n’était plus significative.
Figure 14 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur le contenu en azote (N) des cultures de couverture.
Le contenu N a varié sous l’influence de l’interaction entre l’espèce et la partie (tableau 6). Les contenus en N des parties racinaires de la vesce commune et du pois fourrager étaient significativement supérieurs à celui du trèfle rouge, soit avec en moyenne 17 % plus d’N que le trèfle rouge (figure 15). Pour les parties aériennes, le trèfle rouge et la vesce commune contenaient le plus d’N, soit avec en moyenne 20 % plus d’N que le pois fourrager, et le pois fourrager avait le contenu en N le plus faible (figure 15). Pour chacune des CC, le contenu en N de la partie racinaire était supérieur à celui de la partie aérienne (figure 15).
B D E EF FGH H A C D D EFG GH 0 50 100 150 200 250 0 10 20 30 60 90 Quan tité N Temps (jours) Aérien Racinaire
30
Figure 15 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur le contenu en azote (N) des cultures de couverture.
Le contenu N a été significativement influencé par l’interaction entre le temps et l’espèce (tableau 6). Après seulement 20 jours de placement, les trois CC avaient perdu en moyenne 51 % de leur contenu en N initial (figure 16). Entre le 20e et le 90e jour, ils avaient perdu un 26 % additionnel. À la fin de
l’expérience, aucune différence significative n’a été observée entre les trois CC.
Figure 16 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur le contenu en azote (N) des cultures de couverture.
4.7. Concentration en carbone
La concentration en C a été significativement influencée par l’interaction entre le temps et l’espèce de CC (tableau 6). Pour la majorité de la durée de l’expérience, aucune différence significative n’a été
D C C A A B 0 20 40 60 80 100 120
Pois fourrager Vesce commune Trèfle rouge
Quan tité N Espèce Aérien Racinaire AB DE FG GH IJ B C EF FG J J A D F HI IJ 0 50 100 150 200 250 0 10 20 30 60 90 Quan tité N Temps (jours)
31
enregistrée entre la concentration en C des trois CC (figure 17). Au 10e et 20e jour de décomposition,
la concentration en C du pois fourrager était inférieure à celle de la vesce commune et du trèfle rouge.
Figure 17 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur la concentration en carbone (C) des cultures de couverture.
La concentration en C a été significativement influencée par l’interaction entre le temps et la partie (tableau 6). La concentration en C des parties aériennes des CC est supérieure à celle des parties racinaires, sauf pour les temps 0 et 10 (figure 18). Toutes les concentrations en C varient entre 40 et 50 %.
Figure 18 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur la concentration en carbone (C) des cultures de couverture.
E D BCD DE
AB BCD AB A ABCD
ABC CD ABC ABCD
DE 0 10 20 30 40 50 60 0 10 20 30 60 90 Conce ntratio n C (%) Temps (jours)
Pois fourrager Trèfle rouge Vesce commune
A BC A A AB A AB CD C BC D D 0 10 20 30 40 50 60 0 10 20 30 60 90 Conce ntratio n C (%) Temps (jours) Aérien Racinaire
32
L’interaction entre l’espèce et la partie a significativement influencé la concentration en C (tableau 6). La concentration en C des parties aériennes des trois espèces de CC était supérieure à celle des parties souterraines (figure 19). La concentration en C de la partie aérienne de la vesce commune était égale à celle du trèfle rouge, mais significativement supérieure à celle du pois fourrager. Au niveau de la partie racinaire, la concentration en C du trèfle rouge était la plus élevée, puis suivi de la vesce commune et enfin du pois fourrager (figure 19).
Figure 19 : Effet de l’interaction entre la partie de la culture de couverture et l’espèce de cultures de couverture sur la concentration en carbone (C) des cultures de couverture.
4.8. Contenu en carbone
Le contenu en C a été influencé par l’interaction entre le temps et la partie (tableau 6). Après 20 jours de placement, les parties racinaire et aérienne ont enregistré une diminution rapide de leur contenu initial en C, soit en moyenne 54 % et 61 %, respectivement (figure 20). Au 20e et au 30e jour de
décomposition, le contenu en C de la partie aérienne a diminué plus vite que celui de la partie racinaire. Au bout de 90 jours de placement, les parties aériennes et racinaires n’enregistraient aucune différence significative dans leur contenu en C (figure 20).
BC A AB E D C 0 10 20 30 40 50 60
Pois fourrager Vesce commune Trèfle rouge
Conce
ntratio
n C (%)
Espèce Aérien Racinaire
33
Figure 20 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur contenu en carbone (C) des cultures de couverture.
Le contenu en C a été influencé par l’interaction entre le temps et l’espèce (tableau 6). À seulement 10 jours de décomposition, toutes les espèces de CC avaient perdu en moyenne 35 % de leur contenu initial en C (figure 21). Puis, à partir du 20e jour de placement, le contenu en C du trèfle rouge a diminué
à un taux significativement plus rapide que celui de la vesce commune et du pois fourrager. Au terme de l’expérience (90e jour), le contenu en C du trèfle rouge représentait seulement 11 % de sa quantité
initiale, alors que celui de la vesce commune et du pois fourrager était similaire et de 20 % en moyenne. Il n’y avait pas de différence significative entre la quantité de C de la vesce commune et celle pois fourrager tout au cours de la décomposition (figure 21).
Figure 21 : Effet de l’interaction entre le temps de décomposition et l’espèce de cultures de couverture sur le contenu en carbone (C) des cultures de couverture.
A B D E E G C CD FG G 0 500 1000 1500 2000 2500 3000 3500 4000 4500 5000 0 10 20 30 60 90 Quan tité C Temps (jours) Aérien Racinaire A B C CD FG GH A DE EF HI I A C F 0 1000 2000 3000 4000 5000 0 10 20 30 60 90 Quan tité C Temps (jours)
34
4.9. Rapport carbone:azote
Le rapport C:N a été influencé par l’interaction entre la durée de décomposition et la partie de la plante étudiée (tableau 6). Au cours de la décomposition, le rapport C:N de la partie aérienne a varié entre 26,9 à 33,0 et il est supérieur au rapport C:N de la partie racinaire (figure 22). Il n’y a eu aucun changement dans le rapport C:N de la partie aérienne entre le jour de placement (jour 0) et le 90e jour.
Le rapport C:N des parties racinaires a varié de 13,8 (30e jour) à 18,4 (90e jour) (figure 22).
Figure 22 : Effet de l’interaction entre le temps de décomposition et la partie de la culture de couverture sur le rapport carbone:azote (C:N) des cultures de couverture.
Le rapport C:N a significativement varié sous l’influence de l’interaction entre l’espèce et la partie (tableau 6). Pour la partie aérienne, le rapport C:N le plus élevé est obtenu par le pois fourrager, soit 39,0 et le trèfle rouge a été le plus bas, soit 22,0 (figure 23). Quant à la partie racinaire, le trèfle rouge a eu le rapport C:N le plus élevé, soit 17,5. Aucune différence n’a été observée entre le rapport C:N racinaire du pois fourrager et celui de la vesce comme, soit 15,0. En somme, le rapport C:N aérien des CC était supérieur à celui de la partie racinaire (figure 23).
A A A A A A BCD BC CD D BC B 0 5 10 15 20 25 30 35 0 10 20 30 60 90 Rappo rt C:N Temps (jours) Aérien Racinaire