i
Évaluation de l’efficacité d’un biofiltre à macroalgues
marines pour la réduction des nitrates et phosphates
dans les bassins d’exposition du Biodôme de Montréal
Mémoire
Anne Tremblay-Gratton
Maîtrise en sciences animales
Maître ès sciences (M. Sc.)
Québec, Canada
ii
Évaluation de l’efficacité d’un biofiltre à macroalgues
marines pour la réduction des nitrates et phosphates
dans les bassins d’exposition du Biodôme de Montréal
Mémoire
Anne Tremblay-Gratton
Sous la direction de :
Grant Vandenberg, directeur de recherche
Nathalie R. Le François, codirectrice de recherche
iii
RÉSUMÉ
Au Biodôme de Montréal, la culture d’algues marines pourrait contribuer à l’amélioration de l’habitat aquatique et permettre à l’institution de combler ses exigences en termes de qualité de l’eau. En effet, les macroalgues peuvent diminuer les concentrations en nitrates et en phosphates générés par la décomposition des déchets métaboliques des animaux captifs puisqu’elles absorbent ses nutriments pour combler leurs besoins de croissance. L’objectif de ce projet est de contribuer au développement d’un biofiltre macroalgal adapté aux conditions d’opération de l’écosystème marin du Biodôme de Montréal. Les performances de bioremédiation de deux espèces d’algues marines indigènes, Palmaria palmata et Ulva
lactuca, ont été évaluées sous des conditions expérimentales similaires à celles des bassins
d’exposition, soit deux températures (5 et 10°C) et trois concentrations élevées en nitrate et phosphate (2 856:194 vs. 3 570:242 vs. 4 284:291 µM NO3-:PO43-). Après six jours de
culture, nos résultats démontrent 1) que les différentes concentrations en nutriments et la température n’influencent pas significativement la vitesse d’absorption des nutriments chez les deux espèces; 2) que la croissance de P. palmata n’est pas influencée par les traitements et 3) qu’U. lactuca démontre une croissance maximale à 10°C et à concentration intermédiaire. Le niveau élevé de saturation tissulaire en N, en lien avec les conditions environnementales nutritives du milieu de culture, limiterait l’absorption des nutriments et la croissance des macroalgues. Entre les deux espèces, U. lactuca semble une meilleure candidate que P. palmata dans nos conditions expérimentales, car elle démontre une vitesse d’absorption des nitrates trois fois supérieure (1,76 ± 0,59 vs. 0,65 ± 0,15 mg N MS-1 d-1),
une vitesse d'absorption des phosphates deux fois supérieure (0,32 ± 0,21 vs. 0,14 ± 0,11 mg P DW-1 d-1) et un taux de croissance trois fois supérieur à P. palmata (2,12 ± 0,89 vs. 0,64 ± 0,18 % MF d-1). Pour poursuivre le développement d’un biofiltre macroalgal efficace, l’accès à la lumière, le contrôle du pH et la disponibilité en microéléments devraient être optimisés.
iv
TABLE DES MATIÈRES
RÉSUMÉ ... iii
TABLE DES MATIÈRES ... iv
LISTE DES TABLEAUX ... vi
LISTE DES FIGURES ... viii
GLOSSAIRE ... xi
DÉDICACE ... xiii
REMERCIEMENTS ... xiv
AVANT-PROPOS ... xv
CHAPITRE 1 : INTRODUCTION GÉNÉRALE ... 1
1. Mise en contexte du mémoire ... 2
1.1. L’eutrophisation des milieux aquatiques………...5
1.1.1. Propriétés de l’azote et du phosphore ... 5
1.1.2. Cycle de l’azote ... 6
1.1.3. Cycle du phosphore ... 8
1.1.4. Intrant d’azote et de phosphore de source anthropique ... 9
1.1.5. Mécanisme d’eutrophisation ... 9
1.2. L’eutrophisation en milieu aquacole……….10
1.2.1. Besoin en azote et phosphore alimentaire ... 11
1.2.2. Rejet d’azote et de phosphore ... 11
1.2.3. Paramètres de la qualité du milieu de culture ... 12
1.2.4. Toxicité de l’azote inorganique dissous ... 14
1.2.5. Toxicité du phosphore inorganique dissous ... 16
1.3. Comment éviter l’accumulation des nitrates et phosphates en circuit recyclé 16 1.3.1. Méthodes prétraitements ... 17 1.3.2. Dénitrification hétérotrophe ... 19 1.3.3. Dénitrification autotrophe ... 21 1.3.4. Scories d’aciéries ... 23 1.3.5. Marais filtrants ... 24 1.3.6. Microalgues ... 25 1.3.7. Bioremédiation macroalgale ... 26
1.4. Aquaculture multitrophique intégrée (AMTI)……….. 27
1.4.1. Exemples de systèmes AMTI en eau froide ... 29
1.4.2. Sélection des espèces d’algues marines pour le projet de maîtrise ... 31
1.4.3. Exemples de culture en eau froide pour P. palmata et U. lactuca... 37
1.4.4. Mécanismes d’absorption de l’azote et du phosphore dissous ... 41
1.5. Facteurs influençant la capacité de bioremédiation des macroalgues………...42
1.5.1. Lumière ... 43
1.5.1.1. Lumière et photosynthèse ... 43
1.5.1.2. Hydrodynamisme ... 44
1.5.1.3. Luminosité et densité de culture ... 45
1.5.1.4. Besoin en CO2 ... 47
1.5.2. Température ... 47
v
1.5.2.2. Effet de la température sur l’absorption ... 49
1.5.3. Concentration de N et P inorganique ... 50
1.5.3.1. Besoin de base en NO3- et PO43- pour la croissance ... 51
1.5.3.2. Effet des concentrations en NO3- et PO43- sur la croissance ... 51
1.5.3.3. Effet de la présence de NH4+ sur l’absorption du NO3- ... 54
1.5.3.4. Effet des concentrations en NO3- et PO43- sur l’absorption ... 56
1.5.4. Ratio N:P ... 59
1.5.5. Morphologie ... 61
1.5.6. Âge ... 62
1.6. Les bassins d’exposition du Biodôme de Montréal……….. 62
1.6.1. Présentation du Grand Saint-Laurent Marin ... 62
1.6.2. Historique des moyens entrepris pour contrôler les NO3- et les PO43- ... 65
1.6.2.1. Méthodes de prétraitements ... 65 1.6.2.2. Scories d’aciéries ... 66 1.6.2.3. Dénitrification hétérotrophe ... 66 1.6.2.4. Dénitrification autotrophe ... 67 1.7. Objectifs et hypothèses………. 70 1.7.1. Objectifs ... 70 1.7.2. Hypothèses de recherche ... 70 Références ... 72 CHAPITRE 2 : ... 92
BIOREMEDIATION EFFICIENCY OF PALMARIA PALMATA AND ULVA LACTUCA FOR USE IN A FULLY RECIRCULATED COLD-SEAWATER NATURALISTIC EXHIBIT: EFFECT OF VERY HIGH NO3 AND PO4 CONCENTRATIONS AND TEMPERATURE ON GROWTH AND NUTRIENT UPTAKE. ... 92 2.1. Introduction………... 96 2.2. Methods………...100 2.2.1. Biological material ... 100 2.2.2. Experimental conditions ... 101 2.2.3. Experimental design ... 101 2.2.4. Measurements ... 102 2.2.5. Statistical analysis ... 105 2.3. Results……….105
2.3.1. Nitrate and phosphate uptake ... 105
2.3.2. Specific growth rate ... 105
2.3.3. Tissue nitrogen, phosphorus and carbon ... 108
2.3.4. Nutrient removal ... 109
2.4. Discussion………....……111
2.5. References……….…...118
CONCLUSIONS GÉNÉRALES ... 124
ANNEXE 1 : MATÉRIEL ET MÉTHODES HIVER 2015 ... 129
APPENDICE 1 : ÉTUDE PRÉLIMINAIRE ÉTÉ 2014 ... 142 APPENDICE 2 : IMPLANTATION D’UN SAVOIR-FAIRE SUR LA CULTURE DE L’ALGUE MARINE PALMARIA PALMATA AU BIODÔME DE MONTRÉAL . 164
vi
LISTE DES TABLEAUX
Tableau 1. Critères de la qualité de l’eau définis comme acceptables pour les différentes formes d’azote dissous (µM L-1) et du pH en pisciculture par le CCPA (Conseil
canadien de protection des animaux). ... 14
Tableau 2. Récapitulatif des différentes méthodes utilisées pour diminuer les concentrations en NO3- et PO43- des milieux d’aquaculture opérés en circuits recyclés. ... 17
Tableau 3. Critères de sélection des espèces d’algues marines pour le projet de maîtrise. . 32
Tableau 4. Valeurs optimales des paramètres de culture pour les espèces compatibles avec la culture au Biodôme de Montréal (température 5-10˚C et salinité de 24). ... 32
Tableau 5. Exemples de culture d’espèces appartenant au genre Palmaria sp., et autres espèces appariées dans les études, en eau froide (sous 20°C). ... 39
Tableau 6. Exemples de culture d’espèces appartenant au genre Ulva sp., et autres espèces appariées dans les études, en eau froide (sous 20°C). ... 40
Tableau 7. Densités de culture et luminosité utilisées pour cultiver P. palmata et U. lactuca, pour lesquels les auteurs ont obtenu le meilleur taux de croissance spécifique (TCS). ... 46
Table 8 Dried weight basis of percentage of tissue nitrogen, phosphorus and carbon, N/P ratio and C/N ratio of P. palmata and U. lactuca (means ± SD). Initial state, after the six days acclimation period (Post-acclimation) and after the six days experiment (Post-experiment). ... 109
Tableau 9. Moyennes et écarts type des concentrations de N-NO3 (mg L-1) et des quantités
de N-NO3 équivalentes en fonction du volume d’eau (L) pour une quantité initiale
N-NO3 :P-PO4de 40:4 mg L-1 ou 1000:100 mg, température de 9°C – Données
du spectrophotomètre... 149
Tableau 10. Suivi des quantités de N-NO3 (mg) (moyenne ± écart-type) sur six jours selon
les quantités initiales de N-NO3:P-PO4 (1 000 :100 mg, 1 250 :150 mg, et
1 500 :200 mg) à 9 et 13 °C, pour 225 g de P. palmata dans 25 L – Bloc 1. Données du spectrophotomètre. ... 151
vii
Tableau 11. Suivi des quantités de N-NO3 (mg) sur six jours selon les quantités initiales de
N-NO3:P-PO4 (1 000 :100 mg, 1 250 :150 mg, et 1 500 :200 mg) à 9 et 13 °C,
pour 225 g de P. palmata dans 25 L – Bloc 1. Données du chromatographe. . 152
Tableau 12. Moyenne et écart-type de la disponibilité en P-PO4 (mg), évalué sur une période
de six jours, pour 225 g de P. palmata dans 25 L et des quantités initiales N-NO3:P-PO4 de 1 000 :100 mg, 1 250 :150 mg, et 1 500 :200 mg à 9 et 13 °C –
Bloc 1. Données du spectrophotomètre. ... 154
Tableau 13. Disponibilité en P-PO4 (mg), évaluée sur une période de six jours, pour 225 g
de P. palmata dans 25 L et des quantités initiales N-NO3:P-PO4 de 1 000 :100 mg,
1 250 :150 mg, et 1 500 :200 mg à 9 et 13 °C – Bloc 1. Données du chromatographe. ... 155
Tableau 14. Suivis de biomasse, densité de culture et taux de croissance spécifique de P. palmata en culture libre (bassin A) entre le 24 juillet et le 14 novembre 2015. ... 173
Tableau 15. Pourcentage d’absorption (%) et taux d’absorption (mg kg MF-1 d-1) des micronutriments (fer, manganèse, cuivre, cobalt, zinc, molybdène) et macronutriments (nitrate et phosphate) consommés en 3 jours (du 3 au 6 août 2015). ... 177
Tableau 16. Pourcentage d’absorption (%) des micronutriments (fer, manganèse, cuivre, cobalt, zinc, molybdène) et macronutriments (nitrate et phosphate) consommés en 2 jours (du 3 au 5 août 2015). ... 177
viii
LISTE DES FIGURES
Figure 1. Cycle de l’azote : (1) fixation de l’azote gazeux; (2) oxydation de l’ammonium en conditions aérobies; (3) oxydation des nitrites en conditions aérobies; (4) dénitrification; (5) oxydation de l’ammonium en conditions anaérobies; (6) réduction dissimilatrice des nitrates et nitrites en ammonium (Jetten, 2008). ... 7
Figure 2. Cycle du phosphore (océan). Adapté de Paytan et McLaughlin (2007). ... 8
Figure 3. Schéma de base d’une boucle de traitement de l’eau opérée en circuit fermé dans les piscicultures (circuit parallèle). ... 13
Figure 4. Exemple de système AMTI en pleine mer ... 28
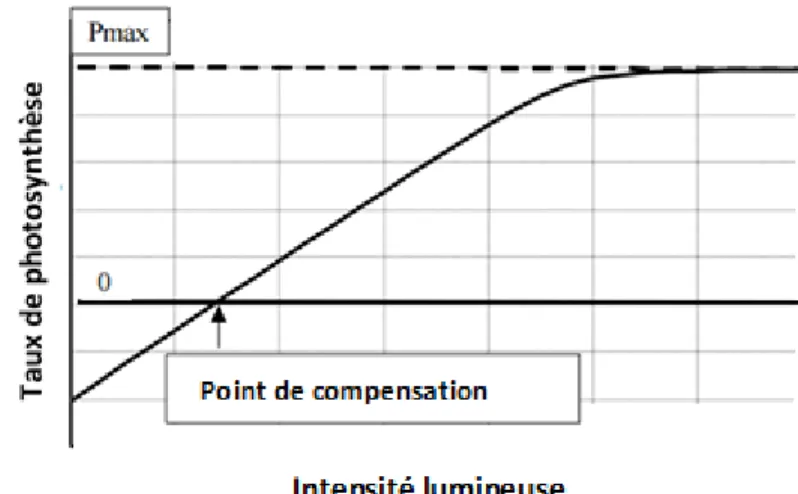
Figure 5. Relation entre l’intensité lumineuse et le taux de photosynthèse (Both et al., 2002). ... 44
Figure 6. Relation entre le taux de croissance (d-1) et les réserves tissulaires d’azote total chez Codium fragile, algue verte de l’Atlantique Nord. Tiré et traduit de Pedersen et Borum (1997). ... 53
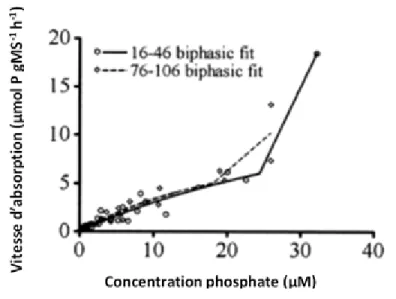
Figure 7. Exemple de relation biphasique entre la vitesse d’absorption des phosphates et les concentrations de phosphates dans le milieu, chez P. palmata. Tiré et traduit de Martínez et Rico (2004). ... 58 Figure 8. Plan de l’écosystème du Grand Saint-Laurent Marin au Biodôme de Montréal. En
ligne : http://espacepourlavie.ca/ecosystemes/golfe-du-saint-laurent... 63
Figure 9. Représentation des boucles de traitements de l’eau du Grand Saint-Laurent Marin (Parent et Morin, 2000).. ... 64
Figure 10. Suivis des concentrations en nitrate et phosphate entre mai 1992 et juin 1999 dans le Grand Saint-Laurent Marin. Modifié d’après Trépanier et al. (2002). .... 66
Figure 11. Schéma du système de dénitrification autotrophe sur soufre installé à l’échelle pilote sur le Littoral Rocheux. Tiré et traduit de Tremblay-Gratton et al. (2017). ... 67
Figure 12. Variations des concentrations de N-NO3- (mg L-1) dans La Baie et le Littoral
ix
dénitrification autotrophe sur soufre (DAS) sur le Littoral Rocheux (Tremblay-Gratton et al., 2017). ... 68
Figure 13. Specific growth rate (SGR) on a fresh weight basis of P. palmata (a) and U. lactuca (b) cultured at 5 and 10°C and 2 856:194, 3 570:242 and 4 284:291 µM of NO3
-:PO43- (means ± SD); bars with different letters are significantly different (p <
0.05). ... 107
Figure 14. Nitrogen removal on a dry weight basis of P. palmata (a) and U. lactuca (b) at three combinaisons of nutrient concentrations in the media (mean ± SD); bars with different letters are significantly different (p < 0.05). (Data from both temperatures were pooled). ... 110
Figure 15. Thalle mature de P. palmata vs. jeune thalle. ... 130
Figure 16. Dispositif expérimental. À l’arrière : les deux bassins cylindro-coniques pour les périodes d’acclimatation. ... 133 Figure 17. Disposition des bacs dans la salle de phytologie à l’ÉPAQ, Grande-Rivière. . 146
Figure 18. Différence des lectures de N-NO3 (mg) entre le spectrophotomètre (moyenne et
écart-type) et le chromatographe chez le témoin 1 000 :100 mg dans 25 litres à 9°C. ... 156
Figure 19. Différence des lectures de P-PO4 (mg) entre le spectrophotomètre (moyenne et
écart-type) et le chromatographe chez le témoin N-NO3:P-PO4 1000:100 mg dans
25 litres à 9°C. ... 156
Figure 20. Moyenne et écart-type (n=4) des quantités de N-NO3 (mg) mesurées sur une
période de 163,5 heures, à partir d’une quantité initiale connue de 20 mg dans 1 L, dans un ballon témoin de 1 L avec bouchon. Données du spectrophotomètre. . 157
Figure 21. Réception de P. palmata au Biodôme de Montréal le 16.07.2015 et bassin de culture sur la mezzanine. ... 169
Figure 22. P. palmata en culture libre (bassin A), culture sur corde avec deux gyres (bassin B) et culture sur corde avec bullage (bassin C). ... 169
Figure 23. Taux de croissance de P. palmata en fonction des différents modes de culture (bassin A : culture libre, bassin B : culture sur corde avec gyres, bassin C : culture sur corde avec bullage), obtenu sur 14 jours (du 4 au 18 août 2015). ... 174
x
Figure 24. P. palmata après cinq semaines en mode de culture libre (bassin A). ... 175
Figure 25. P. palmata après cinq semaines de culture sur corde avec deux gyres (bassin B). ... 175
Figure 26. P. palmata après cinq semaines de culture sur corde avec bullage (bassin C). 176
Figure 27. pH et concentration de protéines dans le milieu de culture (µg mL-1) en fonction du temps dans les trois bassins de P. palmata sur une période de 25 jours, soit du 6 août 2015 (temps 0 heure) au 31 août 2015 (temps 600 heures). ... 178
xi
GLOSSAIRE
AMTI : Aquaculture multi-trophique intégrée
ATP : Adénosine triphosphate
BDM : Biodôme de Montréal
CCPA : Conseil canadien de protection des animaux
COD : Carbone organique dissous
DAS : Dénitrification autotrophe sur soufre
DW : Dry weight
ÉPAQ : École des Pêches et de l’Aquaculture du Québec
FW : Fresh weight
MAAO : Musée d'Art d'Afrique et d'Océanie
MF: Masse fraiche
MS : Masse sèche
NADPH : Nicotinamide adénine dinucléotide phosphate
xii
« Mais quelle idée peut-on se faire de cette force puissante et toujours active, qui hâte incessamment les accroissements des êtres organisés, et qui reproduit la vie et la jeunesse, du sein même de la vieillesse et de la mort ».
- Jean-Pierre Étienne Vaucher
Histoire des conferves d’eau douce
xiii
DÉDICACE
Je dédie ce mémoire à mon père, à ma mère, qui ont toujours été là pour moi et qui sont encore aujourd’hui mes modèles numéro 1 de persévérance. Merci de m’avoir fait grandir dans un environnement magnifique qui a fait naître mon amour et mon respect pour la nature.
À mes sœurs, qui sont mes complices inconditionnels. À tous ceux qui m’ont soutenu durant ces trois années.
xiv
REMERCIEMENTS
Merci en premier lieu à mes directeurs de recherche, Dr. Grant Vandenberg, Dr. Nathalie Le François et Dr. Éric Tamigneaux, pour avoir mis en commun leur expertise et avoir rendu possible ce projet de maîtrise. J’ai pu bénéficier d’un soutien total, teinté de personnalités différentes et complémentaires.
Au cours de ma maîtrise, j’ai eu la chance de côtoyer trois belles équipes de travail. Merci à l’équipe de l’Université Laval et au soutien particulier d’Émilie Proulx et Marie-Hélène Deschamps, professionnelles de recherche, qui m’ont guidé lors de mes analyses de laboratoire et offert leurs commentaires constructifs et leur soutien. Merci à l’équipe du Biodôme de Montréal, à Jean-Christophe Boussin qui m’a guidé dans mes analyses de laboratoire et toute l’équipe des aquaristes pour avoir contribué à la mise en place de la culture de l’algue marine Palmaria palmata au Biodôme. Un énorme merci à l’équipe de l’ÉPAQ et MERINOV à Grande-Rivière pour leur accueil six mois durant, pour m’avoir transmis tout ce que je sais sur la culture des algues marines, mais aussi la patience et la joie dans le travail. Merci particulièrement à Isabelle Gendron-Lemieux, Daniel Bourdages, Elsido Alvarez, Marie-Pierre Turcotte, Jean-Gilles Lelièvre, Tony Grenier, Pauline Garnier et Pako Pérez. Ce projet a été rendu possible grâce au financement du programme MITACS accélération et la Société des amis du Biodôme de Montréal. Leur contribution m’a aussi permis de complémenter ma formation par des stages en collaboration avec l’entreprise OrganicOcean inc à Rimouski et le Jardin botanique de Montréal au sein de l’équipe du Dr. Michel Labrecque. Finalement, merci à ma famille et mes amis qui m’ont aidé à garder ma motivation et mon « pep » lors de ma période de rédaction, Sylvie, Roger, Chloé, Sophie, Aline, Chanel, Zoé, Sacha, Justine, Yanie, Hélène, Félix, la ligue des nuls de hockey, sans oublier la contribution majeure de l’auteure Dr. Geneviève Belleville.
xv
AVANT-PROPOS
Le présent mémoire a été rédigé par articles. Les résultats des essais expérimentaux qui se sont déroulés à l’École des Pêches et de l’Aquaculture du Québec au cours de l’hiver 2015 font l’objet d’un article présenté au chapitre 2 dont la version est celle qui a été acceptée pour publication dans la revue scientifique Journal of Applied Phycology (Elsevier) (JAPH-D-17-00157R2).
En tant que premier auteur, mon apport à cet article scientifique est primordial tant au niveau de l’élaboration de l’expérience, le travail sur le terrain, la récolte et l’analyse des données en laboratoire, l’analyse et l’interprétation statistique, la recension des écrits et la rédaction. Les corrections et révisions des versions préliminaires de l’article ont été faites avec la collaboration indispensable de Nathalie Rose Le François, Éric Tamigneaux, Grant Vandenberg et Jean-Christophe Boussin, coauteurs.
Pour terminer, ce travail de maîtrise est issu du fruit d’un long processus de recherche entamé dès janvier 2014. Tout au long de ce projet, mon implication a été au premier plan. Mon directeur, Grant Vandenberg et mes codirecteurs, Nathalie Rose Le François et Éric Tamigneaux, ont su me guider et m’encourager dans mes essais et erreurs, tout en me laissant une grande liberté.
1
2
1. Mise en contexte du mémoire
En avril 1992, en grande première mondiale, la Ville de Montréal inaugure dans l’ancien vélodrome olympique un grand musée zoologique : le Biodôme de Montréal. La conception originale des milieux naturels et de l’interaction entre la faune et la flore se retrouve dans quatre grands écosystèmes des Amériques, soit la forêt tropicale, la forêt laurentienne de l’Amérique du Nord, les cercles polaires et le Grand Saint-Laurent Marin. Basé sur l’étude biogéographique de Mahon et al. (1998), l’écosystème du Grand Saint-Laurent Marin est un éloge au fleuve Saint-Laurent (estuaire et golfe) et à la diversité de ses habitats. Avec sa capacité de 3 250 m3 d’eau de mer artificielle, cet écosystème comprend un marais salé et
deux bassins : l’un représentant le littoral rocheux (23 m3), et le second, La Baie, représentant
le golfe du Saint-Laurent (2 500 m3). Alors que le premier contient principalement des
invertébrés (anémones, oursins, étoiles, concombres de mer, etc.) dans une eau maintenue à 5-6°C, le second soutient une vingtaine d’espèces de poissons (esturgeons, morues, loup de mer, raies, etc.) et plusieurs espèces d’oiseaux nicheurs dans des conditions aquatiques de 9-10°C.
Déjà en 1995, la qualité de l’environnement aquatique de l’écosystème du Grand Saint-Laurent Marin démontre des signes de dégradation et des concentrations records en nitrate (NO3-) et phosphate (PO43-) de l’ordre de 10 700 µM NO3-(150 mg N-NO3- L-1) (Parent et
Morin, 2000) et 581 µM PO43- (18 mg P-PO43- L-1) (Trépanier et al., 2002) sont observées.
En effet, dans les systèmes aquatiques artificiels opérés en circuit recyclé comme les aquariums publics et certains bassins d’aquaculture commerciaux, les résidus de nourriture non consommés et les déchets métaboliques générés par les organismes (fèces, urée…) sont les causes principales de l’accumulation de ces nutriments (Spotte, 1979). Or, l’exposition chronique à des concentrations élevées en NO3- peut être toxique et causer des problèmes de
santé et même de survie chez la faune aquatique. La sensibilité au nitrate varie selon l’espèce, son stade de développement ou encore le type d’exposition (Pierce et al., 1993; Scott et Crunkilton, 2000; Morris et al., 2011). Les fortes concentrations en nitrates peuvent également favoriser l’apparition de signes liés à l’eutrophisation des cours d’eau, comme les
3
efflorescences de phytoplancton indésirables, lorsque combinées à de fortes concentrations en PO43- (Vidal et al., 2002).
Dans un souci de mieux contrôler l’accumulation de ces nutriments dans les bassins d’exposition, des recommandations ont été émises afin de proposer des changements dans les pratiques d’opération du système. C’est ainsi qu’en 1995, la colonie de fous de Bassan (Morus bassanus) nichant au-dessus de l’écosystème fut enlevée. Celle-ci était alors responsable de plus de 35% des entrées d’azote (Parent et Morin, 2000) et de 20% des entrées de phosphore (Trépanier et al., 2002) dans l’eau. Des changements d’eau partiels plus importants ainsi que l’instauration d’un système de dénitrification biologique hétérotrophe en 1998 marque le début d’une série d’essais qui auront pour but de réduire définitivement les concentrations en nitrate et phosphate. En 1998, les concentrations visées de nitrates étaient de 1 428 µM NO3- (20 mg N-NO3- L-1), soit un niveau non dommageable pour la santé
des populations aquatiques marines (Camargo et al., 2005) et 65 µM PO43- (2 mg P-PO43- L -1) pour les phosphates afin de conserver un ratio N:P de 10:1 (par poids) qui limite les
efflorescences algales (Trépanier et al., 2002). Depuis, les nouvelles cibles de nitrates établies en 2010 pour le Littoral Rocheux et La Baie ont été fixées respectivement à 714 et 2 142 µM NO3- (10 et 30 mg N-NO3- L-1).
Depuis 2012, le Biodôme de Montréal opère un système de dénitrification biologique autotrophe basé sur l’activité de la bactérie Thiobacillus denitrificans pour contrôler les concentrations en NO3- au niveau du littoral rocheux (voir Tremblay-Gratton et al. 2017).
Bien que ce projet pilote ainsi que les changements d’eau partiels permettent de maintenir les concentrations autour de 1 428 µM NO3- (20 mg N-NO3- L-1) depuis 2015, ce système n’a
aucun impact sur les teneurs en PO43-. De plus, la méthode est basée sur une approche
purement bio-ingénierie. Or, certaines algues marines ont la capacité d’absorber le NO3-, le
PO43- et le dioxyde de carbone (CO2) tout en produisant de l’oxygène (O2) (Kim et al., 2013).
La bioremédiation macroalguale pourrait donc offrir une méthode complémentaire de décontamination des eaux des bassins d’exposition quis’intègre bien à la nouvelle mission du Biodôme de Montréal mise de l’avant pour le 375e anniversaire de la ville de Montréal:
4
offrent également d’autres avantages puisqu’elles peuvent absorber les métaux lourds (He et Chen, 2014) et avoir un effet antibactérien contre les bactéries pathogènes (Bansemir et al., 2006). Leur culture pourraient également produire de la biomasse pouvant être revalorisée, soit en étant introduite dans les écosystèmes pour enrichir les collections aquatiques, en servant de nourriture pour les invertébrés marins comme l’oursin vert (Strongylocentrotus
droebachiensis) ou d’engrais pour les jardins d’Espace pour la vie. La culture de macroalgues
offre également la possibilité de sensibiliser le public sur les enjeux environnementaux et la conservation de la ressource Eau. Le but principal de ce travail de recherche est donc d’évaluer si la bioremédiation macroalgale peut être introduite comme méthode de décontamination des eaux des bassins d’exposition aquatiques marins du Biodôme de Montréal.
Le premier chapitre de ce mémoire sera consacré à une recension des écrits permettant de comprendre les mécanismes qui régissent l’eutrophisation de l’eau en milieu aquatique naturel et aquacole ainsi que les méthodes employées pour contrer ses effets. Le rôle des algues marines dans les systèmes d’aquaculture multitrophiques intégrés (AMTI) ainsi que les paramètres de culture pouvant influencer leur efficacité de bioremédiation seront ensuite abordés.
Le second chapitre abordera, sous la forme d’un article scientifique, la recherche principale menée à l’hiver 2015 dans les installations de l’École des pêches et de l’aquaculture du Québec (ÉPAQ) à Grande-Rivière. Le document se terminera sur les conclusions générales du mémoire, les recommandations et les perspectives de recherche.
Finalement, deux appendices sont mis à disposition. Ils permettent de mieux saisir l’ampleur des travaux qui ont été nécessaires pour mener à bien ce projet. L’appendice 1 fait état de l’expérience préliminaire menée à l'été 2014, dont les recommandations ont permis d’optimiser la structure de l’expérience. L’appendice 2 aborde plutôt les travaux d’insertion de la culture des algues marines au Biodôme de Montréal au cours de l’été 2015.
5
1.1. L’eutrophisation des milieux aquatiques
Les rejets d’eau polluée municipale, industrielle, agro-industrielle et autres engendrent une augmentation considérable des apports en nutriments dissous tels l’azote et le phosphore dans les écosystèmes aquatiques. Aujourd’hui, la détérioration accélérée des cours d’eau est la conséquence directe de ces pratiques qui ont des répercussions tant sur les communautés locales que sur la qualité même de l’environnement. Dans cette première section il sera question du rôle de l’azote et du phosphore dissous dans le phénomène d’eutrophisation des milieux aquatiques naturels pour ensuite mieux comprendre et finalement mieux contrôler l’apparition du phénomène dans les systèmes aquacoles opérés en circuit recyclé.
L’eutrophisation des cours d’eau réfère au processus d’accumulation des éléments nutritifs dans un environnement aquatique (Jones et Lee, 1982). Ce processus, qui s’échelonne normalement sur plus de cent mille ans, a été grandement chamboulé depuis le début de l’ère industrielle. En effet, l’augmentation de la population et de la demande alimentaire mondiale a contribué à augmenter les intrants d’azote et de phosphore dissous dans les écosystèmes aquatiques (Chambers et al., 2001) créant un déséquilibre au niveau des cycles biogéochimiques et une détérioration accélérée de ces écosystèmes (Jones et Lee, 1982; Chambers et al., 2001; Gaber, 2010). L’eutrophisation affectent tant les écosystèmes d’eau douce, comme les eaux souterraines et les eaux de surface (Gaber, 2010), que marins, plus spécifiquement les estuaires et les environnements côtiers (Smith, 2003; Camargo et Alonso, 2006).
1.1.1. Propriétés de l’azote et du phosphore
L’azote et le phosphore sont des éléments nutritifs essentiels à la vie. Les organismes photosynthétiques (microalgue, phytoplancton) ont d’ailleurs besoin de carbone (C), d’azote (N) et de phosphore (P) pour leur croissance (Capone et al., 2008). Le phytoplancton marin aurait tendance à absorber ces trois éléments du milieu sous la forme d’un ratio C:N:P de 106:16:1 (par atome) connu sous le nom de ratio de Redfield (De Angelis, 1992). Dans les
6
milieux naturels non perturbés par la présence humaine, la faible disponibilité du phosphore et de l’azote inorganique dissous assimilable par les organismes photosynthétiques limite la croissance de ces derniers. L’azote est généralement l’élément limitant pour la production primaire dans les milieux marins alors que le phosphore l’est davantage dans les milieux d’eau douce (Ackefors et Enell, 1994).
1.1.2. Cycle de l’azote
L’azote est présent sous plusieurs formes dans l’environnement. Sa principale forme est l’azote gazeux (N2), non assimilable par la grande majorité des organismes vivants (White,
1993). Le cycle de l’azote (Figure 1) est responsable de la transformation du N2 en molécules
d’azote inorganique tels l’azote ammoniacal (NH4+), les nitrites (NO2-) et les nitrates (NO3),
assimilables par les organismes photosynthétiques et certaines bactéries qui les utilise pour la synthèse de nouvelles molécules organiques. Le cycle de l’azote se complète lorsque les molécules inorganiques sont recyclées de nouveau en N2 via le processus de dénitrification
(Capone et al., 2008).
Dans les écosystèmes marins, la conversion du N2 en NH4+ est réalisée par un nombre
restreint de microorganismes fixateurs d’azote (White, 1993) comme Trichodesmium sp., une cyanobactérie filamenteuse libre dans la colonne d’eau, ou encore par des cyanobactéries unicellulaires libres ou en endosymbiose avec les diatomées. La nitrification, soit le processus responsable de la transformation du NH4+ en NO2- et NO3-, est ensuite réalisée en
deux étapes : l’oxydation du NH4+ en NO2- par Nitrosococcus sp. suivi de l’oxydation du
NO2- en NO3- par Nitrococcus sp. (Matlock et Morgan, 2011). Ces réactions
chimio-autotrophes nécessitent la présence d’oxygène dans le milieu et sont inhibées par la présence de lumière. Les molécules d’azote inorganique consommées par les organismes photosynthétiques sont ensuite intégrées dans la biomasse de ces derniers et dans la chaîne alimentaire sous forme d’azote organique (protéines). La mort des organismes et la lyse des cellules permettront aux bactéries hétérotrophes et au zooplancton de reconvertir les déchets protéiques en NH4+ par le processus d’ammonification (Ward, 1996; Capone et al., 2008).
7
Finalement, le retour des molécules d’azote inorganique dans l’atmosphère se fait via deux processus distincts. Le premier, la dénitrification, est réalisé principalement par les bactéries hétérotrophes anaérobies facultatives Thiobacillus et Pseudomonas. Lorsque les concentrations d’oxygène sont ≤ 5 µM (Codispoti et al., 2005), ces bactéries utilisent les molécules d’oxygène présentes dans les molécules de nitrates comme source finale d’accepteur d’électron afin d’oxyder la matière organique et en retirer l’énergie nécessaire à leurs activités métaboliques. Le NO3- passe alors à travers une série de formes intermédiaires,
dans l’ordre NO2-, NO, N2O et finalement N2. Un grand nombre de microorganismes du
groupe des protéobactéries peuvent compléter cette chaîne de transformation en totalité ou en partie (Capone et al., 2008). La formation du N2 peut également se réaliser via un
deuxième processus, celui de l’oxydation de l’ammonium (anammox). La voie métabolique des bactéries de l’ordre des Planctomycètes, reconnues comme des anaérobies strictes, a la particularité de former du N2 à partir de la combinaison du NH4+ et duNO2- (van Rijn et al.,
2006). Bien que l’importance de ce processus dans le milieu marin soit encore discutée, il demeure une voie métabolique pouvant expliquer le retour de l’azote vers l’atmosphère (Capone et al., 2008).
Figure 1. Cycle de l’azote : (1) fixation de l’azote gazeux; (2) oxydation de l’ammonium en conditions aérobies; (3) oxydation des nitrites en conditions aérobies; (4) dénitrification; (5) oxydation de l’ammonium en conditions anaérobies; (6) réduction dissimilatrice des nitrates et nitrites en ammonium (Jetten, 2008).
8
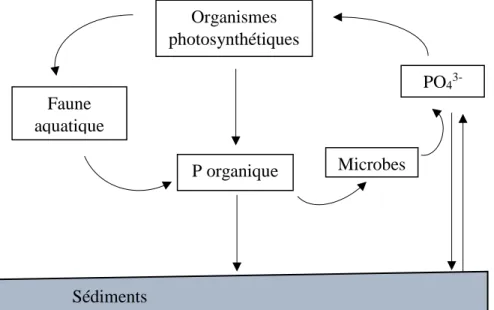
1.1.3. Cycle du phosphore
Contrairement à l’azote, le phosphore ne possède pas de forme gazeuse (Capone et al., 2008). À la base, le phosphore est un élément minéral présent à 95% sous forme d’apatite. L’érosion lente des roches permet de le rendre disponible aux organismes vivants sous forme soluble (Smil, 2000). Les différentes formes de phosphore inorganique dissous dans les écosystèmes sont présentes sous forme de molécules phosphatées : H3PO4, H2PO4-, HPO42- et PO4
3-(Chambers et al., 2001). Parmi celles-ci, le PO43- est la principale source de phosphore dissout
dans les systèmes aquatiques et la seule forme assimilable par les organismes photosynthétiques (Capone et al., 2008; Brient, 2012). Il migre ensuite dans les réseaux trophiques via l’alimentation des organismes hétérotrophes et retourne dans l’eau par les déjections et la décomposition des détritus où il augmente la charge en phosphore organique dissous et particulaire. Le phosphore dissous a également tendance à sédimenter suite à son adsorption sur la matière organique et sur les ions de fer, d’aluminium, de calcium et de manganèse. Seul le brassage des eaux peu profondes réussira à remettre ce phosphore en suspension dans la colonne d’eau (Smil, 2000; Paytan et McLaughlin, 2007) (Figure 2).
Figure 2. Cycle du phosphore (océan). Adapté de Paytan et McLaughlin (2007). Organismes photosynthétiques PO4 3-Microbes P organique Faune aquatique Sédiments
9
1.1.4. Intrant d’azote et de phosphore de source anthropique
Dans les estuaires et les milieux côtiers, les sources de contamination anthropiques sont passablement les mêmes que pour les milieux d’eau douce. Certaines sources sont ponctuelles et donc localisées et identifiables comme les rejets d’égouts municipaux (Constable et al., 2003) ou d’eaux usées industrielles (Carpenter et al., 1998). Les fuites ou déversements de déchets provenant de l’agriculture d’élevage et des fermes aquacoles en sont d’autres exemples (Chambers et al., 2001; Cho et Bureau, 2001). Les sources de contamination diffuses, relâchées régulièrement dans l’environnement à de plus petites doses, sont plus difficilement contrôlables, mais représentent tout de même la majorité des rejets; excès de pesticides ou de fertilisants azotés appliqués aux sols pour les productions végétales et qui, par lessivage, contaminent les eaux souterraines, les rivières et finalement les eaux côtières (Anderson et al., 2002; Capone et al., 2008). Les dépôts provenant de la pollution atmosphérique industrielle sont également une source non négligeable d’apport externe en azote vers les environnements marins (Chambers et al., 2001; Driscoll et al., 2001).
1.1.5. Mécanisme d’eutrophisation
La surabondance d’azote et de phosphore dissous en milieu aquatique stimule la croissance des organismes photosynthétiques (Anderson et al., 2002). Les eaux eutrophes sont donc caractérisées par une prolifération du phytoplancton qui augmente la turbidité de l’eau et limite éventuellement son propre accès à la lumière. Sans cette source d’énergie, les cellules planctoniques sénescentes sédimenteront, encourageant les activités de décomposition des bactéries hétérotrophes aérobies dont le métabolisme respiratoire engendrera un milieu dépourvu en oxygène et toxique (Camargo et Alonso, 2006). Les fortes concentrations en azote dissous ont également été reliées aux phénomènes de l’acidification des eaux (Baker et al., 1991) et aux problèmes de prolifération d’efflorescences d’algues toxiques (Anderson et al., 2002). Ces efflorescences ainsi que les concentrations élevées en azote peuvent directement causer des problèmes pour les communautés locales en limitant l’accès à l’eau
10
potable (Chambers et al., 2001; Svrcek et Smith, 2004), en réduisant les chances de survie, de croissance et de reproduction des animaux aquatiques et en causant des problèmes économiques sur l’industrie de la pêche en milieu côtier (Camargo et Alonso, 2006).
Des cas de plus en plus fréquents de prolifération et d’échouage de macroalgues un peu partout sur les plages du monde ont également été reliés au phénomène d’eutrophisation des eaux côtières. La prolifération des algues vertes opportunistes du genre Ulva sur les plages est telle que le phénomène crée littéralement des marées vertes (green tides). Cela a notamment été observé en Amérique, en Europe et particulièrement en Asie du Pacifique (Ye et al., 2011). D’autres espèces invasives, comme les algues vertes du genre Codium et brunes du genre Sargassum ont également envahi les eaux côtières des Caraïbes (Lapointe et al., 2005) et les plages un peu partout sur les côtes d’Europe (Tanniou et al., 2014). Ces échouages massifs ont des impacts écologiques (anoxie) et économiques considérables reliés à l’industrie de la pêche et du tourisme (Morand et Merceron, 2005).
1.2. L’eutrophisation en milieu aquacole
L’aquaculture se définit comme étant l’élevage d’organismes aquatiques, tels les poissons, mollusques, crustacés et plantes aquatiques, dans le but d’être récoltés pour la consommation (FAO, 2006). Elle peut se pratiquer en eau douce, en eau saumâtre ou en eau de mer selon les espèces. En Amérique du Nord, ainsi que dans d’autres pays industrialisés (Japon, Taïwan, Europe et Israël), l’aquaculture se pratique majoritairement sous forme de monoculture intensive (van Rijn, 1996; Hussenot, 2004). Le terme « intensif » réfère ici à la forte densité des organismes dans le système d’élevage, ce qui sous-tend une production non négligeable de divers déchets métaboliques pouvant s’accumuler dans le système de culture. L’alimentation, assurée par un apport de nourriture artificielle constitue la principale source d’entrée d’azote et de phosphore dans l’eau (Lucas et Southgate, 2012).
Les systèmes d’aquaculture opérés en circuit recyclé offrent un modèle de production écologiquement durable en limitant les renouvellements d’eau et donc en réduisant les rejets
11
de culture chargée en nutriments dans l’environnement (Wik et al., 2009). Ce modèle est également utilisé dans plusieurs grands aquariums publics où les changements d’eau sont coûteux (Hignette et al., 1997; Grguric et al., 2000a; Simard, 2010; Le François et al., 2015). Toutefois, l’accumulation des déchets métaboliques et des résidus de nourriture non consommés à l’intérieur même de ces systèmes provoque l’apparition de signes liés à l’eutrophisation si l’eau n’est pas traitée adéquatement (Lazzari et Baldisserotto, 2008).
1.2.1. Besoin en azote et phosphore alimentaire
Les intrants d’azote et de phosphore font leur entrée dans les systèmes à partir de l’alimentation puisque ce sont des éléments indispensables à la diète des organismes d’élevage (Cho et Bureau, 2001). L’azote est principalement intégré dans la diète sous forme de protéines puisque leur digestion fournit une grande source d’énergie pouvant être investie dans la formation de nouveaux tissus (Médale et Kaushik, 2009). Le phosphore, quant à lui, contribue à la formation et à l’entretien du squelette (os, dents, écailles) (Sugiura et al., 2004). Il se retrouve aussi dans les acides nucléiques (ADN, ARN) ou encore dans les fluides corporels où son rôle tampon aide à soutenir les processus métaboliques (Shearer, 1984; Lall, 1991) et physiologiques associés à la croissance et la reproduction (Sugiura et al., 2004).
1.2.2. Rejet d’azote et de phosphore
Toutefois, selon les espèces, environ seulement 25-30 % du contenu en azote (Hall et al., 1992; Hargreaves, 1998) et environ 13-25% (Holby et Hall, 1991) du contenu en phosphore ingéré par l’alimentation sont incorporés dans la biomasse des poissons. L’excédent retourne dans le milieu sous forme de déchets métaboliques dissous et particulaires. Les déchets azotés dissous sont excrétés principalement sous forme d’ammoniac non ionisé (NH3) à travers les
parois branchiales par diffusion et via l’urine dans une moindre mesure (Kaushik et Cowey, 1991). Le phosphore dissous est excrété sous forme de PO43- via les branchies, mais
particulièrement par l’urine (Bureau et Cho, 1999). Les particules de nourriture non consommées et les déchets métaboliques comme les fèces favorisent le retour du PO43- et de
12
l’azote organique sous forme particulaire dans l’eau (Ouellet, 1999). Ces particules peuvent rester en suspension ou s’accumuler dans le milieu de culture et participer elles aussi à l’augmentation de la charge en azote ammoniacal via l’oxydation des résidus protéiques lors du processus d’ammonification bactérien (van Rijn, 1996). Il est d’ailleurs démontré que cette accumulation de nutriments affecte la qualité de l’eau et favorise l’apparition de signes liés à l’eutrophisation (Lazzari et Baldisserotto, 2008).
1.2.3. Paramètres de la qualité du milieu de culture
Dans les systèmes aquatiques artificiels opérés en circuit recyclé, les renouvellements d’eau sont peu fréquents, entre < 1 % (Tal et al., 2009; Turcios et Papenbrock, 2014) et 10 % (Masser al. 1992) du volume d’eau total par jour. Afin de maintenir un milieu de qualité et éviter les effets liés à l’eutrophisation, l’eau passe en continu dans une boucle de traitement avant d’être réintroduite dans les bassins (Figure 3) (Timmons et Ebeling, 2007). Une boucle de traitement de base permet de contrôler divers paramètres comme la température, le pH, les concentrations de dioxyde de carbone (CO2) et d’oxygène (O2) (Masser et al., 1999). Les
boucles de traitements de l’eau comprennent également un système de désinfection à l’ozone (O3) ou aux UV afin de détruire les organismes pathogènes indésirables (virus, levures,
bactéries) (Spotte, 1979). Le contrôle des paramètres de pH, de CO2, d’O2, et des pathogènes
est habituellement combiné à certains procédés permettant d’enlever rapidement la matière organique (Cripps et Bergheim, 2000). En effet, celle-ci doit être évacuée rapidement puisque sa décomposition favorise l’augmentation des charges en ammoniac et phosphate. Divers procédés sont utilisés selon la grosseur des particules organiques; les solides sédimentables peuvent être prétraités dans les bassins par simple décantation ou par filtration mécanique (Cripps et Bergheim, 2000). Les solides en suspension peuvent être enlevés par filtration mécanique en utilisant divers types de filtres; filtres à tambours rotatifs, réacteurs à billes flottantes, filtres à sables ou autres. Les filtres à cartouche ainsi que les écumeurs de protéines sont également intéressants puisqu’ils permettent de capter les matières organiques de formes dissoutes (Cripps et Bergheim, 2000).
13
Figure 3. Schéma de base d’une boucle de traitement de l’eau opérée en circuit fermé dans les piscicultures (circuit parallèle).
Dans les systèmes d’élevage en recirculation intensive, le contrôle des concentrations d’ammoniac est d’une importance capitale puisque l’ammoniac est très toxique pour les organismes à faibles concentrations. Afin de maintenir leurs concentrations à des niveaux acceptables, la stratégie développée consiste à ajouter un filtre biologique nitrifiant dans la boucle de traitement de l’eau (Molleda et al., 2007). Ce type de biofiltre bactérien a surtout fait ses preuves dans les systèmes d’eau douce et serait plus difficile à acclimater en eau salée. En conditions aérobies, les biofiltres nitrifiants oxydent l’ammoniac en composés azotés de moins en moins toxiques (Randall et Tsui, 2002). La première phase de la réaction assure la conversion de l’ammoniac en NO2 à l’aide des bactéries Nitrosomanas alors que la
seconde phase convertit le NO2 enNO3- à l’aide des bactéries Nitrobacter (Masser et al.,
1992).
Ainsi, dans les systèmes en circuit recyclé qui utilisent les biofiltres nitrifiants, la diminution de l’ammoniac se traduit par une accumulation de nitrate dissous (van Rijn et al., 2006). Néanmoins, alors que les concentrations en nitrate ne dépassent généralement pas 71 µM
14
NO3- (1 mg N-NO3- L-1) dans les milieux naturels non perturbés (Yeats, 1990), des
concentrations chroniques de plus de 35 700 µM NO3- (500 mg N-NO3- L-1) ont déjà été
observées dans des systèmes d’élevage de poissons marins en circuit recyclé (Honda et al., 1993) ou dans certains aquariums publics d’eau salée, comme le Living Seas Aquarium en Floride (Pierce et al., 1993).
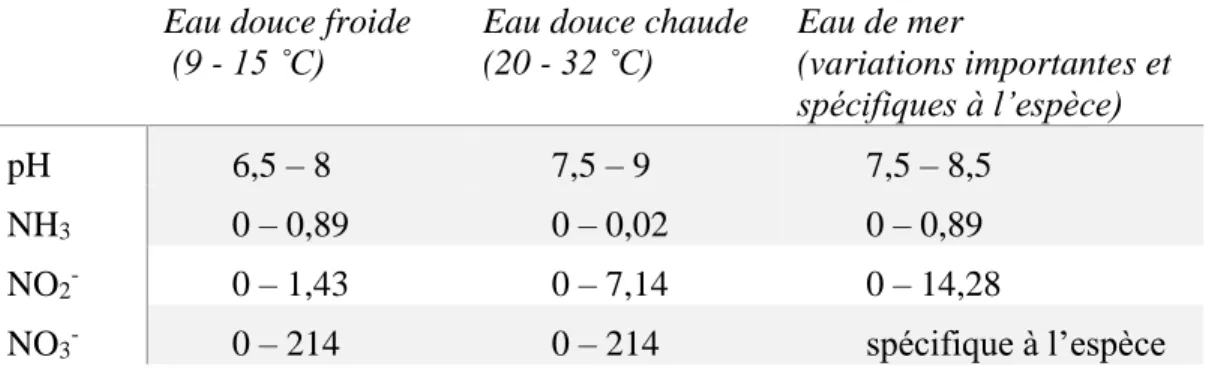
1.2.4. Toxicité de l’azote inorganique dissous
À concentration égale, l’ordre de toxicité des molécules d’azote inorganique est le NH3
(forme non ionisée du NH4+), le NO2- et ensuite le NO3-. Le CCPA (Conseil canadien de
protection des animaux) a d’ailleurs établi des normes de concentrations définies comme acceptables pour les piscicultures du pays (Tableau 1). Ces paramètres devraient être vérifiés tous les jours lors du démarrage des systèmes en circuit recyclé et deux fois par semaine en opération courante (CCPA, 2005).
Tableau 1. Critères de la qualité de l’eau définis comme acceptables pour les différentes formes d’azote dissous (µM L-1) et du pH en pisciculture par le CCPA (Conseil
canadien de protection des animaux).
La toxicité du NH3 se manifesterait au niveau du système nerveux central (Randall et Tsui,
2002). À titre indicatif, un critère de toxicité chronique (concentration sur quatre jours à ne pas dépasser plus d’une fois aux trois ans) de 5,8 µM NH3 a été fixé suite à une étude réalisée
sur des mollusques, des crevettes et des poissons (Boardman et al., 2004). Les nitrites
Eau douce froide (9 - 15 ˚C)
Eau douce chaude (20 - 32 ˚C) Eau de mer (variations importantes et spécifiques à l’espèce) pH 6,5 – 8 7,5 – 9 7,5 – 8,5 NH3 0 – 0,89 0 – 0,02 0 – 0,89 NO2- 0 – 1,43 0 – 7,14 0 – 14,28 NO3- 0 – 214 0 – 214 spécifique à l’espèce
15
s’accumulent rarement dans les systèmes d’élevage puisque rapidement convertis en nitrate, pourvu que la réaction de nitrification soit complète. Le NO3- ne représente pas de danger
pour les populations aquatiques lorsqu’il est en faibles concentrations, sa LC50 serait
d’ailleurs de 1 000 à 10 000 fois plus élevée que celle de l’ammoniac (Grommen et al., 2006). Toutefois, à fortes concentrations, les nitrates peuvent être toxiques pour la faune aquatique. (Cheng et Chen, 2002; van Rijn et al., 2006).
Des concentrations élevées en nitrate ont directement été corrélées à la maladie du sang brun (brown blood disease) (Hrubec et al., 1996). Les nitrates ne sont toutefois qu’indirectement responsables puisqu’ils sont rapidement réduits en nitrite dans le système digestif. L’action toxique des nitrites s’exprime par leur capacité à oxyder l’ion de fer lié à l’hémoglobine (Fe2+
→ Fe3+). Ceci mène à la formation de méthémoglobine, protéine inapte à transporter
l’oxygène dans le sang. (Cheng et Chen, 2002). La présence de méthémoglobine induit ultimement le développement de l’anémie, l’asphyxie et finalement la mort de l’organisme (Arillo et al., 1984).
Un excès en nitrates dans le milieu de culture peut ralentir la croissance et le développement, augmenter la susceptibilité aux maladies, réduire la fertilité et les chances de survie des organismes aquatiques (Gutierrez-Wing et Malone, 2006). La toxicité des nitrates est influencée par plusieurs facteurs comme la salinité de l’eau, les espèces d’eau salée étant généralement moins sensibles aux nitrates (Camargo et al., 2005), l’augmentation des concentrations et du temps d’exposition (Tsai et Chen, 2002). Cette toxicité serait également inversement proportionnelle à la taille (Russo et al., 1974) et au stade de développement (Kincheloe et al., 1979; Scott et Crunkilton, 2000), en plus de différer selon l’espèce étudiée. Par exemple, le bar noir de stade adulte (Centropristis striata) serait capable de survivre à des concentrations très élevées en nitrate et sa LC50 ne serait atteinte qu’à des concentrations
de 171 347 ± 28 558 µM NO3- pour un temps d’exposition de 96 heures (Pierce et al., 1993).
Toutefois, des concentrations sous les 714 µM NO3- pourraient limiter la survie des
salmonidés de stade juvénile et altérer le développement des œufs (Kincheloe et al., 1979). Dans un souci de réduire les impacts sur la santé de la faune marine, une limite acceptable
16
pour les expositions chroniques de 1 428 µM NO3- (20 mg N-NO3- L-1) a d’abord été
proposée par Spotte (1979) et appuyée de nouveau par Camargo et al. (2005).
1.2.5. Toxicité du phosphore inorganique dissous
Les fortes concentrations en phosphore inorganique dissous n’auraient pas de répercussions directes sur la santé des populations aquatiques (poissons et invertébrés) (Epifanio et Srna, 1975). Toutefois, un faible ratio N:P favoriserait l’apparition des signes liés à l’eutrophisation, en stimulant les efflorescences phytoplanctoniques et l’apparition d’algues toxiques (Ekman-Ekebom et al., 1992; Anderson et al., 2002). L’ajustement des concentrations de phosphore dissous et l’atteinte d’un ratio N:P de 16 (M) ou plus limiterait la croissance des algues indésirables (Trépanier et al., 2002).
1.3. Comment éviter l’accumulation des nitrates et phosphates en circuit recyclé
Il existe plusieurs méthodes pour diminuer les concentrations en NO3- et PO43- des milieux
d’aquaculture opérés en circuits recyclés (Tableau 2). Les méthodes prétraitements agissent à la source et incluent la limitation des apports de nourriture, l’amélioration de l’efficacité alimentaire et la réalisation de changements d’eau plus fréquents. Pour l’élimination des nitrates spécifiquement, les systèmes de traitement biologique qui s’inspirent du cycle des nutriments en milieu naturel inclus les systèmes de dénitrification hétérotrophes et autotrophes. Pour l’élimination des phosphates, l’utilisation des scories d’aciérie sera décrite. Finalement, l’utilisation des producteurs primaires sous la forme de biofiltre végétal permet de cibler simultanément le NO3- et le PO43- et inclus : 1) les plantes supérieures utilisées en
marais filtrants, 2) les microalgues et 3) les macroalgues. Cette section se penchera sur le fonctionnement de ces méthodes ainsi que sur leurs avantages et inconvénients.
17
Tableau 2. Récapitulatif des différentes méthodes utilisées pour diminuer les concentrations en NO3- et PO43- des milieux d’aquaculture opérés en circuits recyclés.
NO3- PO4
3-1) Pré-traitements
a. Apport de nourriture b. Efficacité alimentaire
c. Fréquence changement d’eau 2) Bioréacteur bactérien a. Dénitrification hétérotrophe b. Dénitrification autotrophe 3) Biofiltre végétal a. Marais filtrant b. Microalgue c. Macroalgue 1) Pré-traitements a. Apport de nourriture b. Efficacité alimentaire
c. Fréquence changement d’eau
2) Scorie d’aciérie 3) Biofiltre végétal a. Marais filtrant b. Microalgue c. Macroalgue 1.3.1. Méthodes prétraitements
Bien que l’utilisation de filtres mécaniques et d’écumeurs de protéine puisse indirectement minimiser l’accumulation des nitrates et phosphate en permettant le captage des composés organiques avant qu’ils ne se dégradent dans le milieu de culture (Cripps et Bergheim, 2000), des stratégies additionnelles doivent souvent être mises en place pour maintenir une eau de qualité. Contrôler le problème à la source, c’est-à-dire, optimiser l’apport de nourriture fournie aux organismes d’élevage, devrait être une des premières méthodes à envisager pour limiter l’accumulation d’azote et de phosphore dissous (Cho, 1992). En effet, il est important de connaître les besoins métaboliques des espèces cultivées et de leur fournir la quantité adéquate de nourriture en évitant de les suralimenter (Cho et Bureau, 2001). Réduire l’apport de nourriture peut également être une stratégie envisageable, bien que pouvant éventuellement être limitée par les besoins de croissance et de reproduction des espèces (Ali et al., 2003). Néanmoins, une étude réalisée par Savoie et al. (2015) dévoile que l’Omble de
18
fontaine (Salvelinus fontinalis) peut tolérer un jeûne d’un mois sans enregistrer de différences au niveau de son poids après avoir retrouvé une diète normale. L’insertion de périodes de privation alimentaire en lien avec la qualité de l’eau dans les systèmes d’élevage en circuits recyclés a d’ailleurs déjà été évaluée chez d’autres espèces d’eau douce (Turano et al., 2008; Känkänen et Pirhonen, 2009) et d’eau salée (Wang et al., 2000).
Une autre stratégie consiste à améliorer l’efficacité alimentaire des ingrédients dont se compose la diète afin de diminuer la production de déchets métaboliques favorisant le retour des éléments nutritifs dans l’eau (Houlihan et al., 2001). Pour ce faire, les ingrédients hautement digestibles, à contenu élevé en protéines et en lipides, devraient être favorisés au détriment des ingrédients faiblement digestibles riches en amidon et en fibres (Cho et Bureau, 2001). Le contenu en phosphore des déchets métaboliques peut ainsi être réduit en améliorant la digestibilité des ingrédients (Vandenberg et al., 2011) ou en sélectionnant ceux qui possèdent déjà un contenu élevé en phosphore digestible comme certains composés organiques (phospholipides et acides nucléiques) et inorganiques. Pour finir, les déchets riches en azote peuvent aussi être réduits en diminuant le ratio Protéine digestible : Énergie digestible de la diète (Cho et Bureau, 2001).
Dans les systèmes d’élevage en circuit recyclé, des changements d’eau plus fréquents ou plus importants (~5-10 % du volume total de l’eau du système d’élevage par jour) peuvent être effectués afin de diluer les concentrations en nitrates, phosphates et autres composés. Il est même suggéré de réaliser un changement complet du volume de l’eau de culture entre chaque cycle de production et d’avoir une réserve d’eau neuve équivalente au volume entier du système en cas d’urgence (Masser et al., 1992). Dans le cas des aquariums publics en eau salée, des changements d’eau réguliers peuvent être envisagés selon la dimension des aquariums et la disponibilité de la ressource en eau. Toutefois, la fabrication d’eau de mer artificielle est coûteuse et un large volume d’eau est parfois nécessaire pour abaisser significativement les concentrations en nutriments dissous. Des restrictions législatives concernant le rejet des effluents peuvent être un frein à la réalisation de telles pratiques (Morris et al., 2011).
19
Finalement, des systèmes de traitement biologiques sont souvent combinés avec les méthodes de prétraitements pour réduire les concentrations en nitrates spécifiquement. Ces systèmes utilisent la stratégie de dénitrification bactérienne hétérotrophe ou autotrophe, et prennent la forme de bioréacteurs pouvant être directement reliés à la boucle de traitement de l’eau, souvent à la suite des filtres biologiques nitrifiants.
1.3.2. Dénitrification hétérotrophe
Dans les bioréacteurs destinés à favoriser la dénitrification hétérotrophe, l’utilisation de biobilles (carrier) libres dans l’eau forme un environnement propice à l’établissement du biofilm bactérien. Il existe différents types de réacteurs : à lits fixes, mobiles ou fluidisés (Mihaltz et al., 2001). Dans le cas des réacteurs à lits mobiles (mélange mécanique), les biobilles sont maintenues en suspension entre deux grilles de maintien. Les collisions entre les biobilles provoquées par le mouvement de l’eau ont comme effet de limiter la croissance du biofilm (Tal et al., 2003). Cette technique permet entre autres une meilleure homogénéisation des conditions d’opération du système, contrairement à un bioréacteur à lit fluidisé opéré par injection de bulles à l’intérieur ou sous le module (Matsumura et al., 1997).
La dénitrification bactérienne hétérotrophe est une forme de respiration réalisée par des bactéries anaérobies facultatives, les plus communes étant Pseudomonas et Bacillus (Pan, 2007). Dans les bioréacteurs, le maintien des conditions anoxiques est primordial pour assurer l’efficacité de la réaction de réduction des nitrates en nitrite et finalement en azote gazeux, à travers l’oxydation de la matière organique (Équation 1). Cette matière organique, si elle ne provient pas de source endogène au système, peut être ajoutée sous diverses formes : méthanol, éthanol, acétone, acide acétique, acétate, sucrose, glucose ou amidon (Tam et al., 1992; Gómez et al., 2000; van Rijn et al., 2006). Le méthanol est la source de carbone la plus utilisée en raison de son faible coût (St. Amant et McCarty, 1969; Vidal et al., 2002). Le ratio C:N nécessaire pour accomplir la transformation complète du nitrate en azote gazeux dépend de la source de carbone et de l’espèce bactérienne (Payne, 1973). Par exemple, pour
20
Pseudomonas, la réduction d’une mole de nitrate nécessite l’ajout de six moles de méthanol
(CH3OH) (St. Amant et McCarty, 1969) :
Équation 1. 6 𝑁𝑂3−+ 5 𝐶𝐻
3𝑂𝐻 → 3 𝑁2+ 5 𝐶𝑂2+ 7 𝐻2𝑂 + 6 𝑂𝐻−
Cette technique nécessite malgré tout un suivi très rigoureux. Elle implique non seulement la réinjection d’oxygène dans l’eau avant que celle-ci ne soit réintroduite dans les bassins, mais aussi un apport continu de substrat organique, ce qui aura comme effet d’augmenter le contenu en carbone organique dissous (COD) dans l’eau (Grguric et al., 2000b). Réduire la quantité de méthanol pour ralentir l’accumulation de COD n’est toutefois pas suggéré puisque la réaction de dénitrification risque d’être incomplète, engendrant une accumulation de nitrite. De plus, 30% de la demande en méthanol est vouée à la croissance seule de
Pseudomonas et cette biomasse bactérienne excédentaire ne peut être convertie en
sous-produit réutilisable (St. Amant et McCarty, 1969; Vidal et al., 2002).
Les systèmes de dénitrification hétérotrophe ont d’abord été utilisés dans le traitement de l’eau potable (St. Amant et McCarty, 1969; Gregory et Sheiham, 1981; Gómez et al., 2000), des eaux souterraines (Mateju et al., 1992) et des eaux usées (Hofmann et Hammer, 1999). La technologie a été introduite dans les systèmes d’aquaculture d’eau douce opérés en circuit recyclé dans les années 1970, d’abord en Allemagne (Meske, 1976). En eau salée, les premiers essais ont été effectués par Meade (1973) chez des salmonidés d’élevage. Plus récemment, les bioréacteurs à lit fluidisé alimentés au méthanol ont été utilisés dans quelques aquariums publics, dont le Living Seas artificial seawater aquarium de Disney aux États-Unis, en 1991 (Grguric et Coston, 1998) le New Jersey State Aquarium aux États-Unis en 1998 (Grguric et al., 2000a; Grguric et al., 2000b) ou encore le Biodôme de Montréal de 1998 à 2013 (Labbé et al. 2003; Martineau et Villeneuve et al., 2014).
21
1.3.3. Dénitrification autotrophe
La dénitrification autotrophe est réalisée par des bactéries anaérobies facultatives, les plus communes étant Thiobacillus denitrificans et Thiomicrospira denitrificans (Lampe et Zhang, 1996). Ces bactéries sont capables de réaliser la réduction des nitrates en nitrites puis en azote gazeux via l’oxydation de substrats inorganiques donneurs d’électrons, comme le soufre (S) le manganèse (Mn2+), le fer (Fe2+) ou l’hydrogène (H2) (van Rijn et al., 2006). La méthode
la plus couramment utilisée est la dénitrification via l’oxydation du soufre, qui se base sur l’activité de Thiobacillus denitrificans (Sant’Anna et al., 1996) (Équation 2). Dans ce cas, la conversion de dix moles de nitrate nécessite l’oxydation de 11 moles de soufre et engendre en contrepartie la libération de 11 moles d’ions sulfate (SO42-), ce qui mène à une
acidification progressive de l’eau de culture. Par conséquent, le système doit être muni d’une colonne contenant un substrat calcaire pour réajuster le pH de l’eau avant son retour dans les bassins (Vidal et al., 2002). Il est également possible de minimiser les fluctuations de pH en alternant les substrats de soufre et de calcaire dans les différentes colonnes (Lampe et Zhang, 1996; Tremblay-Gratton et al. 2017).
Équation 2.
11 𝑆0+ 10 𝑁𝑂3−+ 4.1 𝐻𝐶𝑂3−+ 0.5 𝐶𝑂2+ 1.71 𝑁𝐻4++ 2.5 𝐻2𝑂 → 0.92 𝐶5𝐻7𝑂2𝑁 + 11 𝑆𝑂42−+ 5.4 𝑁2+ 9.62 𝐻+
Dans le cas de la dénitrification autotrophe, les réacteurs peuvent être opérés en lit fluidisé (Christianson et al., 2015), compact, statique ou fixe (Koenig et Liu, 1996; Hignette et al., 1997). Ces derniers possèdent généralement plusieurs colonnes remplies des différents substrats nécessaires à la réaction de dénitrification. L’eau est d’abord acheminée à faible débit dans les colonnes afin de faciliter la colonisation des granules de soufre par les bactéries et le démarrage du système. Des injections d’air à la base des colonnes sont aussi parfois nécessaires afin de minimiser leur colmatage qui provoquerait la formation de zones anoxiques (Delaporte et Hignette, 2001). Les réacteurs à lit fluidisé ont toutefois l’avantage de réduire les risques de colmatage au maximum par rapport aux autres types de réacteurs
22
puisque les granules de soufre sont maintenues en constante suspension dans l’eau grâce à l’injection d’air à la base du système (Kim et al., 2004; Christianson et al., 2015).
La dénitrification autotrophe possède certains avantages par rapport à la dénitrification hétérotrophe. Premièrement, des tests de comparaisons en eau salée effectués par Vidal et al. (2002) ont démontré qu’à concentration égale (630 µM NO3-), les performances de
dénitrification étaient plus élevées avec le système de dénitrification autotrophe sur soufre (20,6 7,3 M NO3- d-1 avec ajustement du pH) qu’avec le système hétérotrophe alimenté
au méthanol (9,9 1,3 M NO3- d-1). L’espace nécessaire au système est relativement
restreint, la production de biomasse bactérienne est plus limitée et le système serait moins souvent colmaté (van Rijn et al., 2006). Finalement, le système possède une plus grande autonomie d’opération en ce sens qu’aucun enrichissement en carbone organique n’est nécessaire. En effet, la dénitrification sur soufre s’alimente de carbone inorganique, comme du dioxyde de carbone ou des ions carbonate (Sliekers et al., 2002).
Toutefois, un suivi de la qualité du substrat calcaire est nécessaire. En effet, celui-ci doit être remplacé après une certaine période d’utilisation puisque l’acidité de l’eau peut provoquer sa dissolution (Delaporte et Hignette, 2001). Le débit de l’eau doit aussi être ajusté adéquatement puisqu’un débit trop élevé diminue l’efficacité de dénitrification alors qu’un débit trop faible crée une odeur d’œufs pourris, attribuable à la présence de sulfure d’hydrogène (H2S). Tout comme pour la dénitrification hétérotrophe, des conditions
anoxiques sont nécessaires à la croissance bactérienne qui n’est pas valorisable par la suite.
La dénitrification sur soufre a d’abord fait ses preuves dans le domaine du traitement des eaux usées (Batchelor et Lawrence, 1978) pour ensuite être adoptée pour le traitement des eaux souterraines (Soares, 2002) et de l’eau potable (Furumai et al., 1996; Kimura et al., 2002). En général, la dénitrification sur soufre est plus facile à opérer en eau douce. En effet, l’efficacité de la méthode semble diminuer lorsque la salinité augmente (Koenig et Liu, 2004). Néanmoins, la méthode a été utilisée pour le traitement des eaux usées salées (Gu et al., 2004; Koenig et Liu, 2004) et de bassins d’eau salée dans certains aquariums
23
publics comme l’Aquarium du MAAO, le Grand Aquarium de Saint-Malo en France (Hignette et al., 1997) l’Aquarium du Québec au Canada (Simard et al., 2015) à l’aide de bioréacteurs à lit fixe, le National Aquarium de Baltimore aux États-Unis avec un bioréacteur à lit fluidisé (Aiken, 2012) ou encore le Biodôme de Montréal depuis 2012 (Tremblay-Gratton et al., 2017).
1.3.4. Scories d’aciéries
Les scories d’aciéries sont des sous-produits ou résidus de la fabrication du fer et de l’acier. En aquaculture ils sont utilisés pour réduire les concentrations en phosphore dissous (Bash, 2010). Dans les aciéries, les scories prennent forme au cours de l’étape de la fusion, durant laquelle des produits riches en calcium tels que le calcaire ou la chaux (CaO) sont ajoutés afin de maintenir la stabilité du procédé par contrôle du pH. Dans les fours, d’autres composés sont susceptibles de se retrouver dans la composition des scories, comme la silice (SiO2), l'hydroxyde de fer (Fe(OH)3), les oxydes de fer (FeO et Fe2O3), d’aluminium (Al2O3),
de magnésium MgO, de manganèse (MnO) et de phosphore (P2O5) (Motz et Geiseler, 2001;
Yi et al., 2012). Après l’étape de la fusion, les résidus non fusionnés sont tamisés, concassés et classés selon leur grosseur. Selon le procédé de fabrication employé, différents types de scories peuvent être produites, soit le laitier de haut fourneau (Blast Furnace iron slag) avec le fer et les scories de four à oxygène (Basic Oxygen Furnace steel slag) et de four à arc électrique (Electric Arc Furnace) avec l’acier (Proctor et al., 2000).
Un réacteur à scorie d’aciérie peut prendre la forme de colonnes ou de contenant circulaire, pourvu que l’eau à traiter puisse s’écouler verticalement (Bellier et al., 2006). L’enlèvement du phosphore soluble par les scories se passe comme suit : les phosphates sont d’abord adsorbés par les oxydes de métal se trouvant à la surface des scories et la dissolution de ces oxydes engendre la libération d’ions calcium. L’augmentation du pH qui en résulte facilite finalement la précipitation du phosphore sous forme de phosphate de calcium (Barca et al., 2014).