HAL Id: dumas-01110143
https://dumas.ccsd.cnrs.fr/dumas-01110143
Submitted on 27 Jan 2015HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Évaluation de l’intérêt d’un test au cinacalcet pour le
diagnostic positif de l’hyperparathyroïdie primaire
Émilie Pinon
To cite this version:
Émilie Pinon. Évaluation de l’intérêt d’un test au cinacalcet pour le diagnostic positif de l’hyperparathyroïdie primaire. Médecine humaine et pathologie. 2014. �dumas-01110143�
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE 2014
THESE POUR LE
DOCTORAT EN MEDECINE
(Diplôme d’état)
Par
Emilie PINON
Née le 28 Novembre 1985 à Rouen
Présentée et soutenue publiquement le 03 décembre 2014
EVALUATION DE L’INTERET D’UN
TEST AU CINACALCET POUR LE
DIAGNOSTIC POSITIF DE
L’HYPERPARATHYROIDIE PRIMAIRE
Président du jury : Monsieur le Professeur Jacques WEBER Directeur de thèse : Monsieur le Professeur Jean-Marc KUHN Membres du jury : Monsieur le Professeur Hervé LEFEBVRE
Monsieur le Docteur Frédéric ZIEGLER
FACULTE MIXTE DE MEDECINE ET DE PHARMACIE DE ROUEN
ANNEE 2014
THESE POUR LE
DOCTORAT EN MEDECINE
(Diplôme d’état)
Par
Emilie PINON
Née le 28 Novembre 1985 à Rouen
Présentée et soutenue publiquement le 03 décembre 2014
EVALUATION DE L’INTERET D’UN
TEST AU CINACALCET POUR LE
DIAGNOSTIC POSITIF DE
L’HYPERPARATHYROIDIE PRIMAIRE
Président du jury : Monsieur le Professeur Jacques WEBER Directeur de thèse : Monsieur le Professeur Jean-Marc KUHN Membres du jury : Monsieur le Professeur Hervé LEFEBVRE
Monsieur le Docteur Frédéric ZIEGLER
ANNEE UNIVERSITAIRE 2014-2015
U.F.R DE MEDECINE ET DE PHARMACIE DE ROUEN
---
DOYEN : Professeur Pierre FREGER ASSESSEURS : Professeur Michel GUERBET
Professeur Benoit VEBER Professeur Pascal JOLY Professeur Stéphane MARRET
I – MEDECINE
PROFESSEURS DES UNIVERSITES – PRATICIENS HOSPITALIERS
M. Frédéric ANSELME HCN Cardiologie Mme Isabelle AUQUIT AUCKBUR HCN Chirurgie Plastique M. Bruno BACHY (Surnombre) HCN Chirurgie pédiatrique
M. Fabrice BAUER HCN Cardiologie
Mme Soumeya BEKRI HCN Biochimie et Biologie Moléculaire M. Jacques BENICHOU HCN Biostatistiques et informatique médicale M. Jean-Paul BESSOU HCN Chirurgie thoracique et cardio-vasculaire Mme Françoise BEURET-BLANQUART CRMPR Médecine physique et de réadaptation (Surnombre)
M. Guy BONMARCHAND (Surnombre) HCN Réanimation médicale
M. Olivier BOYER UFR Immunologie
M. Jean-François CAILLARD HCN Médecine et santé au Travail (Surnombre)
M. François CARON HCN Maladies infectieuses et tropicales M. Philippe CHASSAGNE HB Médecine interne (Gériatrie)
M. Vincent COMPERE HCN Anesthésiologie et réanimation chirurgicale
M. Antoine CUVELIER HB Pneumologie
M. Pierre CZERNICHOW HCH Epidémiologie, économie de la santé M. Jean-Nicolas DACHER HCN Radiologie et Imagerie Médicale M. Stéfan DARMONI HCN Informatique Médicale/Techniques
de communication M. Pierre DECHELOTTE HCN Nutrition
Mme Danièle DEHESDIN (Surnombre) HCN Oto-Rhino-Laryngologie M. Frédéric DI FIORE CB Cancérologie
M. Fabien DOGUET HCN Chirurgie Cardiovasculaire
M. Jean DOUCET SJ Thérapeutique. Médecine Interne et Gériatrie
M. Philippe DUCROTTE HCN Hépato - Gastro - Entérologie
M. Frank DUJARDIN HCN Chirurgie Orthopédique - Traumatologie M. Fabrice DUPARC HCN Anatomie - Chirurgie Orthopédique et
Traumatologique
M. Eric DURAND HCN Cardiologie
M. Bertrand DUREUIL HCN Anesthésiologie et réanimation chirurgicale Mme Hélène ELTCHANINOFF HCN Cardiologie
M. Thierry FREBOURG UFR Génétique
M. Pierre FREGER HCN Anatomie/Neurochirurgie M. Jean François GEHANNO HCN Médecine et Santé au Travail M. Emmanuel GERARDIN HCN Imagerie Médicale
Mme Priscille GERARDIN HCN Pédopsychiatrie M. Michel GODIN (Surnombre) HB Néphrologie M. Guillaume GOURCEROL HCN Physiologie M. Philippe GRISE (Surnombre) HCN Urologie
M. Olivier GUILLIN HCN Psychiatrie Adultes
M. Didier HANNEQUIN HCN Neurologie
M. Fabrice JARDIN CB Hématologie
M. Luc-Marie JOLY HCN Médecine d’urgence
M. Pascal JOLY HCN Dermato - vénéréologie
Mme Annie LAQUERRIERE HCN Anatomie cytologie pathologiques M. Vincent LAUDENBACH HCN Anesthésie et réanimation chirurgicale
M. Xavier LE LOET HCN Rhumatologie
M. Joël LECHEVALLIER HCN Chirurgie infantile
M. Hervé LEFEBVRE HB Endocrinologie et maladies métaboliques
M. Thierry LEQUERRE HB Rhumatologie
M. Eric LEREBOURS HCN Nutrition
Mme Anne-Marie LEROI HCN Physiologie
M. Hervé LEVESQUE HB Médecine interne
Mme Agnès LIARD-ZMUDA HCN Chirurgie Infantile M. Pierre Yves LITZLER HCN Chirurgie Cardiaque
M. Bertrand MACE HCN Histologie, embryologie, cytogénétique
M. David MALTETE HCN Neurologie
M. Christophe MARGUET HCN Pédiatrie
Mme Isabelle MARIE HB Médecine Interne M. Jean-Paul MARIE HCN Oto-Rhino-Laryngologie M. Loïc MARPEAU HCN Gynécologie - obstétrique
M. Stéphane MARRET HCN Pédiatrie
Mme Véronique MERLE HCN Epidémiologie
M. Pierre MICHEL HCN Hépato - Gastro - Entérologie M. Francis MICHOT HCN Chirurgie digestive
M. Bruno MIHOUT (Surnombre) HCN Neurologie
M. Jean-François MUIR HB Pneumologie
M. Marc MURAINE HCN Ophtalmologie
M. Philippe MUSETTE HCN Dermatologie - Vénéréologie M. Christophe PEILLON HCN Chirurgie générale
M. Jean-Marc PERON (Surnombre) HCN Stomatologie et chirurgie maxillo-faciale M. Christian PFISTER HCN Urologie
M. Jean-Christophe PLANTIER HCN Bactériologie - Virologie M. Didier PLISSONNIER HCN Chirurgie vasculaire M. Bernard PROUST HCN Médecine légale M. François PROUST HCN Neurochirurgie
Mme Nathalie RIVES HCN Biologie et méd. du dévelop. et de la reprod. M. Jean-Christophe RICHARD HCN Réanimation Médicale, Médecine d’urgence (Détachement)
M. Horace ROMAN HCN Gynécologie Obstétrique M. Jean-Christophe SABOURIN HCN Anatomie - Pathologie M. Guillaume SAVOYE HCN Hépato - Gastrologie
Mme Céline SAVOYE –COLLET HCN Imagerie Médicale Mme Pascale SCHNEIDER HCN Pédiatrie
M. Michel SCOTTE HCN Chirurgie digestive Mme Fabienne TAMION HCN Thérapeutique
M. Luc THIBERVILLE HCN Pneumologie
M. Christian THUILLEZ HB Pharmacologie
M. Hervé TILLY CB Hématologie et transfusion M. Jean-Jacques TUECH HCN Chirurgie digestive M. Jean-Pierre VANNIER HCN Pédiatrie génétique
M. Benoît VEBER HCN Anesthésiologie Réanimation chirurgicale M. Pierre VERA CB Biophysique et traitement de l’image M. Eric VERIN CRMPR Médecine physique et de réadaptation M. Eric VERSPYCK HCN Gynécologie obstétrique
M. Olivier VITTECOQ HB Rhumatologie
MAITRES DE CONFERENCES DES UNIVERSITES – PRATICIENS HOSPITALIERS
Mme Noëlle BARBIER-FREBOURG HCN Bactériologie –Virologie
M. Jeremy BELLIEN HCN Pharmacologie
Mme Carole BRASSE LAGNEL HCN Biochimie
Mme Valérie BRIDOUX HUYBRECHTS HCN Chirurgie Vasculaire
M. Gérard BUCHONNET HCN Hématologie
Mme Mireille CASTANET HCN Pédiatrie Mme Nathalie CHASTAN HCN Physiologie
Mme Sophie CLAEYSSENS HCN Biochimie et biologie moléculaire
M. Moïse COEFFIER HCN Nutrition
M. Stéphane DERREY HCN Neurochirurgie
M. Manuel ETIENNE HCN Maladies infectieuses et tropicales
M. Serge JACQUOT UFR Immunologie
M. Joël LADNER HCN Epidémiologie, économie de la santé M. Jean-Baptiste LATOUCHE UFR Biologie Cellulaire
M. Thomas MOUREZ HCN Bactériologie
M. Jean-François MENARD HCN Biophysique
Mme Muriel QUILLARD HCN Biochimie et Biologie moléculaire
M. Vincent RICHARD UFR Pharmacologie
M. Mathieu SALAUN HCN Pneumologie
Mme Pascale SAUGIER-VEBER HCN Génétique Mme Anne-Claire TOBENAS-DUJARDIN HCN Anatomie
M. Pierre Hugues VIVIER HCN Imagerie Médicale
PROFESSEUR AGREGE OU CERTIFIE
Mme Dominique LANIEZ UFR Anglais
II- PHARMACIE PROFESSEURS
M. Thierry BESSON Chimie Thérapeutique M. Jean-Jacques BONNET Pharmacologie M. Roland CAPRON (PU-PH) Biophysique M. Jean COSTENTIN (Professeur émérite) Pharmacologie
Mme Isabelle DUBUS Biochimie
M. Loïc FAVENNEC (PU-PH) Parasitologie M. Jean Pierre GOULLE Toxicologie
M. Michel GUERBET Toxicologie
Mme Isabelle LEROUX - NICOLLET Physiologie Mme Christelle MONTEIL Toxicologie Mme Martine PESTEL-CARON (PU-PH) Microbiologie
Mme Elisabeth SEGUIN Pharmacognosie
M. Rémi VARIN (PU-PH) Pharmacie Clinique M Jean-Marie VAUGEOIS Pharmacologie
M. Philippe VERITE Chimie analytique
MAITRES DE CONFERENCES
Mme Cécile BARBOT Chimie Générale et Minérale Mme Dominique BOUCHER Pharmacologie
M. Frédéric BOUNOURE Pharmacie Galénique
M. Abdeslam CHAGRAOUI Physiologie
M. Jean CHASTANG Biomathématiques
Mme Marie Catherine CONCE-CHEMTOB Législation pharmaceutique et économie de la santé
Mme Elizabeth CHOSSON Botanique
Mme Cécile CORBIERE Biochimie
M. Eric DITTMAR Biophysique
Mme Nathalie DOURMAP Pharmacologie
Mme Isabelle DUBUC Pharmacologie
M. Abdelhakim ELOMRI Pharmacognosie
M. François ESTOUR Chimie Organique
M. Gilles GARGALA (MCU-PH) Parasitologie
Mme Najla GHARBI Chimie analytique
Mme Marie-Laure GROULT Botanique
M. Hervé HUE Biophysique et Mathématiques
Mme Laetitia LE GOFF Parasitologie Immunologie
Mme Hong LU Biologie
Mme Sabine MENAGER Chimie organique
M. Mohamed SKIBA Pharmacie Galénique
Mme Malika SKIBA Pharmacie Galénique
Mme Christine THARASSE Chimie thérapeutique
PROFESSEURS ASSOCIES
Mme Cécile GUERARD-DETUNCQ Pharmacie officinale M. Jean-François HOUIVET Pharmacie officinale
PROFESSEUR CERTIFIE
Mme Mathilde GUERIN Anglais
ASSISTANT HOSPITALO-UNIVERSITAIRE
M. Jérémie MARTINET Immunologie
ATTACHES TEMPORAIRES D’ENSEIGNEMENT ET DE RECHERCHE
M. Romy RAZAKANDRAINIBE Parasitologie
III- MEDECINE GENERALE
PROFESSEUR
M. Jean-Loup HERMIL UFR Médecine Générale
PROFESSEURS ASSOCIES A MI-TEMPS
M. Emmanuel LEFEBVRE UFR Médecine Générale
M. Alain MERCIER UFR Médecine Générale
M. Philippe NGUYEN THANH UFR Médecine Générale
MAITRES DE CONFERENCES ASSOCIES A MI-TEMPS
M. Pascal BOULET UFR Médecine Générale
Mme Elisabeth MAUVIARD UFR Médecine Générale
Mme Yveline SEVRIN UFR Médecine Générale
ENSEIGNANTS MONO-APPARTENANTS
PROFESSEURS
M. Serguei FETISSOV (med) Physiologie
M. Paul MULDER (phar) Sciences du Médicament Mme Su RUAN (med) Génie Informatique
MAITRES DE CONFERENCES
M. Sahil ADRIOUCH (med) Biochimie et biologie moléculaire (Unité Inserm 905) Mme Gaëlle BOUGEARD-DENOYELLE (med) Biochimie et biologie moléculaire (UMR 1079) Mme Carine CLEREN (phar) Neurosciences (Néovasc)
Mme Pascaline GAILDRAT (phar) Génétique moléculaire humaine (UMR 1079) M. Nicolas GUEROULT (phar) Neurophysiologie
M. Antoine OUVRARD-PASCAUD (med) Physiologie (Unité Inserm 1076) M. Frédéric PASQUET Sciences du langage, orthophonie Mme Isabelle TOURNIER (phar) Biochimie (UMR 1079)
CHEF DES SERVICES ADMINISTRATIFS : Mme Véronique DELAFONTAINE
HCN - Hôpital Charles Nicolle HB - Hôpital de Bois Guillaume CB - Centre Henri Becquerel
CHS - Centre Hospitalier Spécialisé du Rouvray
CRMPR - Centre Régional de Médecine Physique et de Réadaptation SJ – Saint Julien Rouen
Par délibération en date du 3 mars 1967, la faculté a arrêté que les
options émises dans les dissertations qui lui seront présentées doivent
être considérées comme propres à leurs auteurs et qu’elle n’entend
leur donner aucune approbation ni improbation.
REMERCIEMENTS
A Monsieur le Professeur Jacques WEBER, Qui m’a fait l’honneur de présider ce jury,
Veuillez trouver ici l’expression de mon respect et de ma reconnaissance pour m’avoir permis de réaliser ce travail.
A Monsieur le Professeur Jean-Marc KUHN,
Pour avoir accepté de diriger ce travail, de m’orienter et de m’aider dans la réalisation de celui-ci.
Je vous remercie pour votre disponibilité, votre aide, votre soutien tout au long de cette expérience.
Veuillez trouver en ces mots l’expression de mon respect et de ma reconnaissance.
A Monsieur le Professeur Hervé LEFEBVRE,
Vous me faites l’honneur de juger ce travail, veuillez trouver ici l’expression de mon respect et de ma reconnaissance.
A Monsieur le Docteur Frédéric ZIEGLER,
Vous me faites l’honneur de juger ce travail, veuillez trouver ici l’expression de mon respect et de ma reconnaissance.
A Madame le Docteur Anne CAILLEUX-BOUNACER,
Vous me faites l’honneur de juger ce travail, veuillez trouver ici l’expression de mon respect et de ma reconnaissance.
A Monsieur le Docteur QUIBEL, qui m’a permis de rencontrer le Professeur KUHN. Je vous remercie également pour votre patience.
A tous les membres du cabinet médical d’Offranville qui m’ont accueillie pour me permettre d’exercer la médecine générale dans de si bonnes conditions. Merci pour vos conseils dans ma découverte de la région Dieppoise.
A mes différents maitres de stages, qui m’on fait découvrir toutes les facettes de ce métier, m’ont permis de comprendre quel médecin je souhaitais devenir. Merci pour leur accueil, leur disponibilité et leurs précieux conseils.
A tous les médecins qui ont contribué à ma formation tout au long de mes études autant dans la théorie que dans la pratique de la médecine.
A tous mes compagnons de stage avec qui j’ai pu travailler. Nos échanges quotidiens nous ont tous enrichis et fait progresser.
A mes parents qui m’ont toujours soutenue, entourée et m’ont permis de me consacrer pleinement à mes études. Merci pour m’avoir permis de devenir ce que je suis et m’avoir accompagnée dans toutes les étapes de ma vie.
A Guillaume, pour son soutien, sa patience, son humour. Tu m’as toujours aidée et encouragée à aller de l’avant. Malgré mes propres doutes, tu n’as jamais cessé de croire en moi.
A mes co-internes et amis Chane, Thomas, Nicolas, Ophélie ainsi qu’à Delphine, Laurent, Ivan. En espérant continuer à partager de bons moments malgré l’éloignement. Et bienvenue à Mai-Lan que j’ai bien hâte de rencontrer.
PLAN
I. INTRODUCTION ... 18
II. L’EQUILIBRE PHOSPHOCALCIQUE ... 19
1. La parathormone ... 19
2. Le calcium ... 19
3. La vitamine D ... 21
4. Les apports alimentaires ... 22
III. L’HYPERPARATHYROIDIE PRIMAIRE (HPP) ... 23
1. Définition ... 23
2. Epidémiologie ... 25
3. Circonstances de découvertes ... 26
4. Symptômes ... 26
5. Complications en l’absence de traitement ... 28
a. La lithiase rénale ... 28
b. Les complications osseuses ... 29
6. Eléments du diagnostic biologique... 30
7. Eléments du diagnostic topographique ... 31
a. L’échographie cervicale... 33
b. La scintigraphie au MIBI ... 33
c. Le scanner et l’IRM ... 34
d. Le cathétérisme veineux étagé ... 35
8. Contexte génétique a. Les Néoplasies endocriniennes multiples ... 36
c. L’HPP-JT ... 37
d. L’hypercalcémie hypocalciurique familiale ... 38
IV. DIAGNOSTIC DIFFERENTIEL ... 38
1. Hyperparathyroïdie secondaire aux médicaments ... 38
2. Hypercalcémie familiale hypocalciurique ... 38
3. Hyperparathyroïdie dans l’insuffisance rénale chronique ... 39
4. Carence en vitamine D ... 39
V. LES DIFFICULTES DIAGNOSTIQUES ... 40
1. L’hyperparathyroïdie primaire normocalcémique ... 40
2. L’hyperparathyroïdie primaire sans augmentation de la PTH ... 41
VI. TEST AU CINACALCET ... 42
1. Objectifs de l’étude ... 42
2. Méthodes ... 45
a. Populations étudiées ... 45
v Taille de l’échantillon ... 45
v Lieu de réalisation de l’étude ... 47
b. Critères d’évaluation ... 47
c. Déroulement de l’essai ... 47
v Visite de pré-inclusion ... 47
v Produits utilisés ... 48
v Organisation pratique ... 48
Ø Charge calcique intraveineuse... 48
Ø Test au cinacalcet ... 49
d. Méthodes de dosages ... 50
v Paramètres biologiques standards ... 51 e. Critères de jugement ... 51 f. Analyse statistique ... 51 g. Sortie d’essai ... 51 h. Ethique et confidentialité ... 51 3. Résultats ... 52 a. Utilisation de 30 mg de cinacalcet ... 55 b.Utilisation de 60 mg de cinacalcet ... 56
c. Test de charge calcique intraveineuse ... 57
4. Analyse statistique ... 58
5. Discussion ... 60
6. Conclusion ... 64
BIBLIOGRAPHIE ... 65
ANNEXES ... 69
Annexe 1 : Critères d’indication opératoire chez les patients asymptomatiques ... 70
Annexe 2 : Critères d’inclusion et d’exclusion des témoins ... 71
Annexe 3 : Critères d’inclusion et d’exclusion des patients atteints d’hyperparathyroïdie primaire ... 72
Annexe 4A : Taux de PTH plasmatique mesuré chez les témoins selon les 3 tests... 73
Annexe 4B : Calcémie totale chez les témoins selon les 3 tests ... 74
Annexe 5A : Taux plasmatique de PTH chez les patients présentant une HPP ... 75
Annexe 5B : Calcémie totale chez les patients présentant une HPP selon la prise de ... 76 cinacalcet
I. INTRODUCTION
L’hyperparathyroïdie primaire (HPP) se définit comme une hypersécrétion inappropriée de parathormone en regard de la calcémie.
Bien qu’asymptomatique dans 80% des cas aujourd’hui, elle représente actuellement la troisième endocrinopathie en France.
Son étiologie principale est l’adénome parathyroïdien retrouvé dans 85 % des cas.
Son diagnostic est biologique, associant une hypercalcémie, une élévation du taux plasmatique d’hormone parathyroïdienne (PTH), inadaptée à l’augmentation de la calcémie et s’associe à une hypercalciurie. Il est important d’éliminer toute cause d’hyperparathyroïdie secondaire. Ainsi, la vitamine D plasmatique, la clairance de la créatinine et l’albumine doivent être normales.
Dans un certain nombre de cas, le tableau biologique est atypique : l’hyperparathyroïdie peut être normocalcémique ou le taux plasmatique de la parathormone peut être normal.
Cependant, celle-ci ne doit pas être ignorée du fait des complications de la maladie qui sont observées dans environ un tiers des cas. Elles peuvent devenir sévères, avec au premier plan atteintes rénale et osseuse.
Ces tableaux « limites » posent donc le problème du diagnostic biologique de l’hyperparathyroïdie primaire.
Ainsi, divers tests dynamiques utilisant une charge calcique ont été étudiés pour objectiver un freinage insuffisant de la sécrétion de la parathormone sous l’influence du calcium. Ceux-ci ont démontré leur efficacité mais restent contraignants et exposent aux risques de l’hypercalcémie.
L’objectif de ce travail est d’étudier le cinacalcet, calcimimétique, comme simulant une élévation de la calcémie, en tant que test dynamique du diagnostic positif de l’hyperparathyroïdie primaire.
II. L’EQUILIBRE PHOSPHOCALCIQUE
La régulation du métabolisme phosphocalcique est sous la dépendance d’un double système hormonal composé d’une part de la parathormone et d’autre part de la vitamine D. Ces deux systèmes assurent l’homéostasie calcique en jouant sur l’absorption digestive du calcium, sur l’excrétion urinaire du calcium et sur la mobilisation - à la demande - à partir de l’os.
1. La Parathormone (PTH)
La PTH, synthétisée dans les corpuscules épithéliaux des glandes parathyroïdes, est une hormone peptidique de 84 acides aminés. Sa forme bioactive est la PTH 1-84.
Sa synthèse et sa libération sont régulées par la concentration plasmatique de calcium ionisé : une hypocalcémie entrainant une augmentation de la libération de la PTH et inversement. Elle agit principalement sur trois organes cibles grâce à un récepteur à sept domaines transmembranaires couplé à une protéine G. Sa fixation déclenche une double signalisation intra-cellulaire : la voie de l’adénylate cyclase aboutissant à la formation d’AMP cyclique qui stimule la protéine kinase A, et la voie de la phospholipase C qui aboutit à la formation d’inositol triphosphate et de diacyl glycérol qui stimule la protéine kinase C. Ces kinases régulent à leur tour l’activité d’autres protéines qui donneront l’effet biologique final de la PTH (13):
Ø Au niveau osseux : activation des ostéoclastes de laquelle résulte une
résorption osseuse avec libération de calcium ionisé et de phosphate
Ø Au niveau rénal : augmentation de la réabsorption tubulaire du
calcium et inhibition de la réabsorption de phosphate ; stimulation de l’activité 1alpha hydroxylase rénale permettant la production de calcitriol (1,25 OH D2)
Ø Au niveau intestinal : augmentation de l’absorption du calcium
indirectement favorisée par la synthèse de calcitriol Ces mécanismes contribuent à relever le niveau de la calcémie.
2. Le Calcium
Il joue un rôle essentiel dans la régulation des fonctions cellulaires. 99% du calcium est osseux, sous forme de cristaux d’hydroxyapatite.
1% du calcium est plasmatique. Dans cette portion, il est pour 40 % lié aux protéines plasmatiques, pour 10% complexé et pour 50 % sous forme ionisée.
La calcémie totale normale est de 2,2 – 2,6 mmol/l (88 – 104 mg/l) La calcémie peut être corrigée par l’équation :
Ca (mmol/l) = Ca total (mmol/l) – 0,02 x (40 g - albumine g/l)
C’est cette forme ionisée qui est physiologiquement active et soumise à une régulation hormonale, essentiellement celles de la PTH et du calcitriol.
La régulation de la calcémie par les parathyroïdes se fait grâce à la présence du récepteur sensible au calcium (CaR) présent notamment sur la membrane des cellules parathyroïdiennes. Le set point représente la sensibilité au calcium des cellules parathyroïdiennes. (16)
Ainsi, l’élévation de la calcémie aboutit à la stimulation du CaR. Ce set point décrit par Brown en 1979 correspond à la valeur de la calcémie pour laquelle la freination de la sécrétion de PTH correspond à la moitié de la freination maximale. (6)
En réponse à celle-ci, la sécrétion de PTH est freinée, ce qui aboutit au retour à un taux de calcium ionisé à la normale; et inversement.
3. La vitamine D
Plusieurs organes sont impliqués dans la synthèse de cette hormone lipophile dont la forme active est le calcitriol (1,25 OH D2)
Au niveau de la peau, sous l’influence des rayons UV, le 7 déhydrocholestérol est transformé en provitamine D puis en cholécalciférol.
Celui-ci est transformé (première hydroxylation), par la 25 hydroxylase, dans le foie en 25-OH-cholécalciférol (= calcidiol), qui est la principale forme de stockage, avec des concentrations plasmatiques de 25 µg/L.
Elle subit au niveau rénal sa deuxième hydroxylation grâce à la 1-alpha hydroxylase, aboutissant ainsi à la forme active de la vitamine D : le calcitriol. C’est cette étape qui est
soumise à la régulation par la PTH.
L’organe cible de la vitamine D active est l’intestin : elle accroit l’absorption intestinale du calcium.
Ainsi, une hypocalcémie entraine une stimulation de la sécrétion de PTH par l’intermédiaire du CaR, de laquelle résulte une augmentation de la synthèse de vitamine D permettant l’absorption intestinale du calcium.
Au niveau osseux, elle accroit la minéralisation osseuse et la résorption ostéoclastique de l’os ancien.
4. Les apports alimentaires
Apports alimentaires en calcium
Ø Sources :
§ Les produits laitiers en majorité. Par exemple, les fromages à pâte cuite apportent 1g de calcium / 100 g ; le lait 0,1 g / 100 g.
§ Certaines eaux minérales peuvent apporter 0,5 g/ L.
Ø Les besoins chez l’adulte de 18 à 55 ans sont de 1000 mg/ jour ; chez l’enfant, l’adolescent et les personnes âgées : 1200 mg/jour
Apports alimentaires en vitamine D
Ø Sources : principalement les poissons gras : l’huile de foie de morue (200µg/100 mg), saumon, sardines et maquereaux (10-20 µg/100 g)
III. L’HYPERPARATHYROIDIE PRIMAIRE (HPP) 1. Définition
L’hyperparathyroïdie primitive est liée à une sécrétion de parathormone inadaptée à la
valeur de la calcémie ce qui a pour conséquences une augmentation de l’absorption
intestinale du calcium, une augmentation de la réabsorption tubulaire rénale du calcium, une diminution de la réabsorption tubulaire rénale des phosphates et une augmentation de la résorption osseuse.
L’erreur de set point au cours de l’hyperparathyroïdie primaire a été démontrée in vitro par Brown (6) sur des cellules d’adénome parathyroïdien (il s’élève de 1,1 à 1,5 mmol/L contre 1.1 mmol/L dans les cellules normales). Cependant, il reste à déterminer ce qui engendre ce trouble de la régulation. Il n’a en effet pas été mis en évidence de mutation du CaR dans l’HPP, mais certains auteurs ont montré une diminution de l’expression du CaR dans les cellules parathyroïdiennes tumorales, qui rendrait ainsi compte de leur moins grande sensibilité à une variation de la calcémie (14)
Ainsi, la courbe explicitant la relation entre calcémie et sécrétion de PTH est déplacée vers des valeurs plus élevées : il existe une diminution de la sensibilité de la sécrétion de PTH au rétrocontrôle exercé par la calcémie. (27)
Il existe donc une augmentation de la PTH, une élévation de la calcémie, en l’absence
d’hypocalciurie. L'effet de l'hypocalcémie dépasse en effet les possibilités de réabsorption
tubulaire du calcium placé sous la dépendance de la PTH. (4)
L’HPP est le plus souvent en rapport avec un adénome parathyroïdien (85% des cas). Elle est due à une hyperplasie diffuse des quatre glandes dans 15 % des cas. Enfin, un
carcinome parathyroïdien est très rarement en cause.
Les adénomes parathyroïdiens sont des tumeurs monoclonales bénignes (1), deux gènes ont été formellement identifiés comme jouant un rôle dans le développement tumoral des adénomes parathyroïdiens : l’oncogène Cyclin D1/PRAD 1 et le gène responsable des NEM 1. (16)
2. Epidémiologie
L’HPP est une endocrinopathie fréquente. L’incidence annuelle de la maladie est d’environ 30
cas pour 100 000 personnes, avec une prédominance féminine (sex-ratio femmes/hommes de
2 à 3) et un âge moyen de 58 ans lors du diagnostic (18)
Une augmentation de l’incidence de l’hyperparathyroïdie a été notée au début des années 70, notamment du fait de la systématisation du dosage de la calcémie.
Ainsi que cela a été démontré dans une étude menée à Rochester, l’incidence annuelle de l’hyperparathyroïdie primaire a quintuplé entre 1965-1974 (15.8/100 000 habitants) et 1974-1982 (82.5/100 000 habitants) (39)
Son incidence serait actuellement en diminution ; plusieurs hypothèses sont avancées : - L’oestrogénothérapie qui tendrait à masquer certaines hypercalcémies.
- L’augmentation des apports alimentaires en calcium dans les pays développés. - Une diminution de l’irradiation cervicale (notamment du fait du risque de
cancer thyroïdien)
Sa prévalence instantanée actuelle est de 1 cas sur 1000 et peut atteindre 1/500 chez les femmes de plus de 45 ans.
3. Circonstances de découverte
Selon la société française d’endocrinologie, les circonstances de découvertes d’une hyperparathyroïdie primaire étaient en 1992 :
- Pour 36 % des cas : découverte fortuite lors d’une biologie systématique - Dans le bilan de lithiases rénales récidivantes pour 29,2 %
- Du fait d’une symptomatologie osseuse dans 15,5 % des cas - Lors de l’exploration de symptômes généraux tels qu’une asthénie - Au décours d’une hypercalcémie aigue 2,9 %
- Après thyroïdectomie pour 2,5 % - Symptômes digestifs 2,4 %
- Symptômes neuropsychiatriques 1,9 %
Depuis lors, le nombre de patients asymptomatiques non opérés, dont l’affection a été révélée par un dosage systématique s’est encore accru. La proportion excède 50 % dans la majorité des séries actuelles. (38)
4. Symptômes
Comme précédemment mentionné, l’avènement des dosages systématiques de la calcémie a fait évoluer la maladie hyper parathyroïdienne classique vers une forme le plus souvent asymptomatique.
Les critères définissant cette dernière sont (38) : - L’absence de lithiase
- L’absence d’atteinte osseuse - L’absence de chondrocalcinose
L’évolution du profil clinique de l’hyperparathyroïdie primaire est décrite dans le tableau suivant :
Modifications de la présentation clinique de l’hyperparathyroïdie primaire (adapté de Silverberg SJ et Bilezikian JP) (31) Lithiase Rénale Hypercalciurie franche Maladie osseuse Asymptomatique 1930-1965 ( Cope) 57% - 23 % 0,6 % 1965-1974 (Heath) 51 % 36 % 10 % 18 % 1965-1974 (Malette) 37 % 40 % 14 % 22 % 1986-2006 (Silverberg) 17 % 39 % 1.4 % 80 %
La forme « classique » était notamment associée à ses complications osseuses et rénales. Au niveau osseux, la maladie squelettique classique était l’ostéite fibro-kystique, qui concerne actuellement moins de 5 % des patients.
Au niveau rénal, l’incidence des lithiases a considérablement diminué passant de 50 % dans les années 60 à 15- 20 % actuellement.
Cependant, il s’agit de la complication clinique de l’hyperparathyroïdie primaire qui reste aujourd’hui la plus fréquente. Elle atteint notamment les sujets les plus jeunes. Il peut exister de plus une néphrocalcinose.
Il existait classiquement une myopathie hyperparathyroïdienne aujourd’hui remplacée par un syndrome plus vague d’asthénie, de fatigabilité musculaire, de faiblesse généralisée.
Ainsi, en anglais les manifestations cliniques de l’hyperparathyroïdie primaire sont décrites de manière pertinente par « stones (lithiases), bones (douleurs osseuses, abdominal moans
Manifestations cliniques de l’hyperparathyroïdie primaire Rénales Hypercalciurie. Néphrocalcinose. Lithiase rénale (20%)
Squelettiques Accélération du remaniement osseux avec un effet de catabolisme qui touche d’abord l’os cortical. La baisse de la densité osseuse la plus fréquente est observée au niveau du tiers distal du radius avec augmentation de l’incidence des fractures du poignet. La densité osseuse est très peu diminuée au niveau des vertèbres lombaires.
Gastro-intestinales Douleurs abdominales et constipation sont fréquentes. Ulcère gastro-duodénal.
En cas d’ulcères peptiques retrouvés, exclure un syndrome de Zollinger Ellison (dans le cadre des NEM1).
Neurologiques, neuropsychiatriques
Faiblesse neuromusculaire et fatigabilité. Paresthésies et douleurs musculaires aspécifiques.
Etats dépressifs, insomnies et dysfonctions cognitives fréquentes. Cardiovasculaires Raccourcissement de l’intervalle QT. Hypertrophie du VG.
Calcifications valvulaires et myocardiques. Diminution de l’élasticité vasculaire par dépôts de calcium dans la paroi des vaisseaux. Ainsi la mortalité cardiovasculaire est augmentée. Cependant, dans l’hyperparathyroïdie primaire asymptomatique, la fréquence des manifestations cardiovasculaires est inconnue. (33)
5. Complications en l’absence de traitement
a. La lithiase rénale
Elle reste la complication la plus fréquente. Elle touche actuellement 20 % des patients. Il s’agit le plus souvent d’une lithiase phosphocalcique dont la formation est favorisée par
l’hypercalciurie fréquemment retrouvée au cours de l’HPP. La prise en charge chirurgicale
de l’hyperparathyroïdie primaire permet une amélioration nette et durable des symptômes lithiasiques et une diminution de la fréquence de formation de nouveaux calculs. C’est pour cette raison que lithiase rénale et hypercalciurie font partie des critères de prise en charge chirurgicale de l’HPP. (cf. Annexe 1)
b. Complications osseuses
L’ « osteitis fibrosa cystica » décrite par Von Reclinkhausen désignait l’atteinte osseuse de la maladie. Les patients se plaignent de douleurs osseuses et des fractures pathologiques peuvent survenir. Elle se caractérise par une augmentation de la résorption osseuse sous-périostée
notamment au niveau des phalanges distales (particulièrement des deuxièmes phalanges),
des extrémités distales des clavicules qui ont alors un aspect effilé, un aspect poivre et sel de la voute crânienne du fait de sa déminéralisation, des kystes osseux et des tumeurs brunes des os longs.
Cette forme est désormais très rare puisqu’elle concerne aujourd’hui moins de 5 % des
patients (32).
L’atteinte osseuse est aujourd’hui représentée par une ostéopénie. L’os cortical est
préférentiellement fragilisé. La masse osseuse va être diminuée au niveau du radius distal,
conservée au niveau vertébral et avoir des valeurs intermédiaires au niveau de la hanche. La connectivité entre trabécules et microarchitecture osseuse est conservée, ce qui la différencie de l’ostéoporose ménopausique.
Après cure chirurgicale, la densité minérale osseuse augmente significativement. (29)
Pour ces différentes raisons, l’ostéoporose doit être recherchée systématiquement par une mesure de la densité minérale osseuse.
Ainsi, après 10 ans, en l’absence de chirurgie, un quart des patients initialement
asymptomatiques présentent une progression de la maladie, définie par l’apparition d’au
moins 1 indication au traitement chirurgical. (35) Cette proportion atteint un tiers après 15 ans. (29)
6. Eléments du diagnostic biologique
Le diagnostic de l’hyperparathyroïdie primaire est biologique. On retrouve classiquement :
- Une augmentation du taux plasmatique de la PTH (90%) - Une élévation de la calcémie, habituellement modérée et stable - Une hypophosphorémie (25-40%)
- Une hypercalciurie (40-50%)
Les mesures à réaliser de façon systématique et de façon contemporaine sont celles du taux plasmatiques de la PTH, de la calcémie (ionisée, ou totale avec calcul de la calcémie corrigée), de la Vitamine D et la calciurie des 24 heures. Il apparait également important de réaliser une détermination de la créatininémie avec mesure du débit de filtration glomérulaire (DFG) grâce au MDRD pour ne pas méconnaitre une insuffisance rénale chronique.
En effet, la détermination de la seule calcémie amènerait à méconnaitre les hyperparathyroïdies à calcémie normale et les hyperparathyroïdies avec carence sévère en vitamine D.
Enfin, la mesure de la calciurie des 24 heures (examen de valeur à la condition que la fonction rénale soit normale) est nécessaire dans le bilan pour exclure une hypercalcémie hypocalciurique familiale bénigne.
Dosages de la parathormone :
Il est important de noter que les nouveaux dosages permettent de distinguer la 1-84 PTH (PTH bioactive) de la PTH tronquée 7-84 grand fragment C-terminal (PTH inactive), qui pourraient apporter un éclairage nouveau sur la régulation fine de la PTH au niveau de ses récepteurs. En effet, l’équilibre entre la PTH bioactive et les fragments antagonistes de la PTH inactive pourraient caractériser les différentes présentations cliniques de l’HPP : les formes agressives auraient une prépondérance de PTH active. (9)
7. Eléments du diagnostic topographique
Il représente 2 intérêts majeurs pour la prise en charge chirurgicale et le diagnostic étiologique.
- Pour la prise en charge chirurgicale
Ce repérage des parathyroïdes est essentiel pour la prise en charge chirurgicale, permettant ainsi un gain de temps opératoire, une chirurgie moins invasive, diminue le risque de complications (ré-intervention, atteinte du nerf laryngé récurrent).
Il existe dans la majorité des cas quatre glandes parathyroïdes, provenant embryologiquement des troisième et quatrième poches branchiales.
§ Les parathyroïdes inférieures (P3) ont une position plus antérieure, au
pôle inférieur des lobes thyroïdien.
§ Les parathyroïdes supérieures (P4) ont une position plus postérieure,
en arrière de la partie moyenne des lobes thyroïdiens.
- Pour le diagnostic étiologique.
L’intérêt de l’imagerie dans l’hyperparathyroïdie primaire est le diagnostic topographique permettant la localisation de l’adénome parathyroïdien qui représente 80 à 90% des étiologies de l’HPP. Dans 2% des cas, il s’agit d’adénomes multiples et dans 5 à 20%,
une hyperplasie des parathyroïdes qui doit faire rechercher une cause génétique (Néoplasies endocriniennes multiples).
Les examens d’imagerie incluent :
a. L’échographie cervicale (28)
A l’échographie, un adénome parathyroïdien apparait comme une lésion hypo échogène, de forme allongée ou aplatie, séparée du parenchyme thyroïdien par une cloison, mobile à la déglutition et bien vascularisée.
Avantages :
Il s’agit de l’examen de diagnostic topographique de première intention du fait de son caractère non invasif, non irradiant, de faible coût, et de son efficacité.
Elle permet une bonne résolution spatiale, dans l’exploration thyroïdienne et l’exploration cervicale, permettant ainsi de rechercher la majorité des parathyroïdes en position atypique. Apport du doppler dans l’étude de la vascularisation des adénomes parathyroïdiens.
Inconvénients :
L’exploration du médiastin y est difficile, elle est peu spécifique, difficulté en cas de goitre multi nodulaire et d’atteinte parathyroïdienne multiple.
b. La scintigraphie au MIBI (28)
Elle utilise le sestaMIBI marqué au technétium99 métastable, traceur utilisé pour les parathyroïdes.
Il s’agit d’un complexe lipophile formé d’un atome de Technetium99 lié à six molécules de Methoxy-Iso-Butyl-Isonitrile.
Mais il n’est pas spécifique du tissu parathyroïdien et s’accumule par diffusion passive également dans les thyrocytes. Ainsi, deux méthodes sont utilisées pour éliminer l’image thyroïdienne parasite.
- Méthode de soustraction : Il s’agit de soustraire l’image thyroïdienne grâce à
un traceur thyroïdien spécifique, l’iode 123 ou le pertechnétate de technétium.
- Méthode en double phase qui utilise un seul isotope. Elle profite de la rétention
différentielle du traceur entre le tissu thyroïdien et le tissu parathyroïdien : L’image parathyroïdienne est encore visible sur les images tardives alors que celle de la thyroïde disparait avec le temps.
Quelque soit la méthode utilisée, l’exploration doit être complète, de l’angle de la mâchoire jusqu’à la crosse aortique, pour ne pas méconnaitre certaines localisations atypiques.
Les acquisitions peuvent être obliques ou tomoscintigraphiques, permettant de préciser le caractère antérieur ou postérieur des glandes hyperfonctionnelles.
La technique SPECT/CT permet une acquisition tomoscintigraphique tridimensionnelle couplée au scanner apportant une information fonctionnelle et anatomique.
Sensibilité :
La sensibilité de l’examen varie de 50 à 96 % selon les études. Elle est de l’ordre de 80-90 % dans le cadre des adénomes parathyroïdiens, quelque soit la méthode d’acquisition utilisée. Elle est fonction de la taille de l’adénome, du taux de parathormone. Elle est inférieure à 50% dans les hyperplasies parathyroïdiennes. Un examen négatif ne remet pas en cause le diagnostic d’hyperparathyroïdie primaire.
Spécificité :
Elle est proche de 100 %. Les seuls faux positifs sont les nodules thyroïdiens et certaines tumeurs neuroendocriniennes thoraciques.
c. Scanner et IRM (12)
Ils ne sont pas des examens de première intention. Ils peuvent être utilisés à la recherche de certaines localisations ectopiques, avant reprise chirurgicale. Le scanner cervico-mediastinal triphasique permet une localisation plus précise des adénomes, et est plus fiable que l’IRM dans la détection de ces derniers.
d. Cathétérisme veineux étagé avec dosage immédiat de PTH (13)
Le cathétérisme veineux étagé est proposé comme un examen d’aide à la localisation par cartographie de PTH dans les cas suivants :
· Imageries en faveur d’un foyer ectopique médiastinal, avec gradient retrouvé souvent
dans la veine cave supérieure ou foyer ectopique cervical profond, avec gradient latéralisé dans une veine jugulaire interne droite ou gauche, en supérieur ou en inférieur, ou mieux dans une veine thyroïdienne.
· Persistance ou récidive après échec chirurgical, avec cervicotomie blanche ou
inefficace, en raison de la présence d’adénomes multiples.
· HPP avérée avec imageries discordantes : une cartographie de PTH pourrait apporter
un complément d’information à l’imagerie.
· HPP persistante symptomatique à PTH normale, avec imageries négatives : la mise en
évidence d’un gradient important apporterait un argument et une aide à la chirurgie. Il permet d’effectuer 15 à 20 prélèvements dans les veines jugulaires internes droite et gauche, les troncs brachiocéphaliques droits et gauches, les veines sous-clavières droite et gauche, et la veine cave supérieure et inférieure jusqu’au niveau hépatique. À la fin de l’examen, la PTH est dosée immédiatement dans le plasma et les résultats portés sur un schéma veineux ou sur le veinogramme du patient réalisé pendant le cathétérisme.
C’est un examen peu invasif, présentant de rares complications: réactions mineures aux produits de contraste, risques de thrombose veineuse dans les 48 heures, douleurs thoraciques, risque exceptionnel d’embolie pulmonaire.
C’est un examen de localisation de moindre précision spatiale, mais plus fonctionnel et plus performant globalement, pouvant être utile au chirurgien.
8. Contexte génétique
Dans 5 à 10 % des situations, l’HPP primaire est familiale.
Certaines circonstances justifient la recherche de ces formes familiales : - Hyperplasie parathyroïdienne
- Atteinte pluri glandulaire - Patient de moins de 40 ans - Adénome kystique
- Carcinome parathyroïdien
- Hyperparathyroïdie persistante ou récidivante après chirurgie (38)
a. Les NEM
Les syndromes de néoplasie endocrinienne multiple (NEM) sont des maladies héréditaires, caractérisées par le développement de tumeurs et d'hyperplasies dans plusieurs organes endocriniens.
Ce sont des maladies monogéniques. Les mutations sont germinales. La transmission de toutes les formes est autosomique dominante.
Dans les NEM1, ou syndrome de Werner, la fréquence de l’ hyperparathyroïdie primaire est de 90 à 100 %. L’HPP y est précoce, souvent révélatrice de la maladie. Elle est liée à la mutation du gène de la ménine, présent en 11q13, conduisant à la production d’une ménine tronquée inactive, de laquelle résulte une hyperplasie parathyroïdienne diffuse, qui récidive fréquemment après résection partielle. La maladie est également marquée par la survenue de
tumeurs duodénopancréatiques et d'adénomes hypophysaires. En outre, il peut exister des
carcinoïdes localisés au niveau des bronches ou du thymus, des tumeurs du cortex surrénalien (principalement non fonctionnelles), des lésions cutanées (angiofibromes du visage, lipomes), ainsi que des tumeurs du système nerveux central (méningiomes, épendymomes). Les manifestations les plus sévères, qui conduisent à la mortalité la plus élevée, sont observées avec les tumeurs duodénopancréatiques, et principalement avec les gastrinomes (syndrome de Zollinger-Ellison).
Ainsi, la définition clinique de NEM1 repose sur la présence de tumeurs dans deux des trois organes principalement affectés (glandes parathyroïdiennes, pancréas endocrine, anté-hypophyse) par NEM1. Le syndrome de NEM1 est familial si un patient atteint de NEM1 a un parent de premier degré qui présente une tumeur dans les trois organes principalement affectés. L’âge moyen du diagnostic est de 20 ans.
Dans les NEM2A ou syndrome de Sipple, qui représentent 75 % des NEM2,
l’hyperparathyroïdie primaire est plus rare (20-30%), s’exprimant souvent sous forme d’adénome, auquel s’associent un carcinome médullaire de la thyroïde (CMT) et un
phéochromocytome. La maladie est liée à des anomalies du gène RET, en 10q21.
Dans les NEM2b, ou syndrome de Gorlin (5%des NEM2), l’hyperparathyroïdie est
Dans les NEM 4, le gène responsable est le gène CDKN1B, présent sur le chromosome 12,
inhibiteur kinase dépendant de la cycline p27kip. Outre des adénomes parathyroïdiens peuvent se développer, dans ce rare cadre pathologique, des adénomes hypophysaires.
b. Hyperparathyroïdie familiale isolée : FIHP
Si l’hyperparathyroïdie primaire est familiale mais survient en l’absence de caractéristiques suggestives de NEM, on est amené à évoquer une situation d’HPP familiale isolée (FIHP : Familial Isolated Hyperparathyroidism). La moitié d’entre elles sont liées à des anomalies du gène HRPT1 porté par le chromosome 1 en position q23-32.
c. L’HPP-JT
Dans ces situations est soulignée la prévalence plus grande d’adénomes kystiques et de carcinomes parathyroïdiens (2 à 5 % des cas), la coïncidence possible de tumeurs associées, notamment mandibulaire (« jaw tumor ») ou rénale. Elle est liée à une mutation du gène HRPT2 cloné en 2002, responsable de la production de parafibromine. La prévalence de l’HPP y est de 80 %.
d. L’hypercalcémie hypocalciurique familiale ou syndrome de Marx et Aurbach.
Elle est liée à des mutations monoalléliques du gène codant pour le récepteur sensible au calcium (en situation 3q13-21), provoquant sa sous expression. De transmission autosomique dominante, elle se traduit par une hyperplasie parathyroïdienne avec hypercalcémie et hypocalciurie.
IV. DIAGNOSTIC DIFFERENTIEL
Devant une hypercalcémie associée à un taux mesurable de PTH plasmatique, il faut donc évoquer en premier lieu le diagnostic d'hyperparathyroïdie primaire. L'indétectabilité du taux de PTH plasmatique orienterait en effet vers une forme paranéoplasique d'hypercalcémie par sécrétion de PTH- related protein (PTHrp).
Dans la première situation, hypercalcémie et taux de PTH plasmatique s'inscrivant dans ou au dessus de la norme, le diagnostic différentiel doit permettre d'écarter les pathologies suivantes :
1. Hyperparathyroïdie secondaire aux médicaments :
a. La résorption rénale du calcium dans les tubes distaux augmente sous thiazidiques et l’hypercalcémie qui en résulte supprime normalement la sécrétion de PTH. Le lithium se lie au CaR et diminue son feed-back au niveau des parathyroïdes et des reins. Cette perturbation du mécanisme du rétrocontrôle fait s’élever la sécrétion de PTH et consécutivement la calcémie. L’hypercalcémie peut se prolonger longtemps après l’arrêt du lithium.
b. Il est recommandé, autant que faire se peut, de stopper les diurétiques thiazidiques et le lithium chez les patients hypercalcémiques, et réévaluer la situation après 3 mois.
2. Hypercalcémie familiale hypocalciurique
Le diagnostic de celle-ci, décrite précédemment, est assuré par l’identification de la mutation inactivatrice du gène du récepteur sensible au calcium. Elle est importante à reconnaître car il s’agit d’une contre-indication à la chirurgie.
3. Hyperparathyroïdie dans l’insuffisance rénale (8)
Lorsqu’au cours de l’évolution de l’insuffisance rénale chronique (IRC), la clairance de la créatinine s’abaisse au dessous de 60 mL/min, on observe, en raison de la réduction de l’excrétion du phosphore, une tendance hyperphosphatémique. Celle-ci va induire une augmentation de la sécrétion de FGF23 (Fibroblast Growth Factor 23) par les ostéoblastes et les ostéocytes. Cette augmentation de FGF23 est responsable d’une diminution de la
réabsorption proximale des phosphates, d’une diminution de la synthèse rénale de calcitriol par inhibition de la 1-alpha-hydroxylase et par une stimulation de la
25-hydroxyvitamine D 24-hydroxylase (qui inactive la synthèse de calcitriol). La diminution de la synthèse rénale de calcitriol aboutit à une diminution de l’absorption digestive de phosphate, mais aussi à une diminution de l’absorption intestinale de calcium. Il y a alors une tendance hypocalcémique avec hyperparathyroïdie secondaire.
L’élévation de la sécrétion de la PTH (permettant une augmentation de la réabsorption tubulaire de calcium et une stimulation de la 1-alpha-hydroxylase qui normalise la calcémie) devient de moins en moins efficace quand la fonction rénale se dégrade. Le set point du
calcium pour la PTH (valeur de calcémie requise pour induire 50% de la PTH maximale) est augmenté dans l’hyperparathyroïdie secondaire de l’IRC. Il existe de plus une hyperplasie
des glandes parathyroïdiennes. On explique ainsi l’augmentation de la PTH alors que la calcémie est élevée.
On parle également d’hyperparathyroïdie tertiaire, observée notamment chez des patients souffrant d’une hyperparathyroïdie secondaire après transplantation rénale : les parathyroïdes hypertrophiées ne peuvent retrouver leur état d’origine et gardent une activité autonome et hyperfonctionnelle source d’une production excessive de PTH en dépit d’une calcémie normale ou élevée. (2)
4. Carence en vitamine D
Le statut vitaminique D est essentiel à connaitre dans le diagnostic et la prise en charge de l’hyperparathyroïdie.
D’une part car la carence en vitamine D, par défaut d’apport et d’ensoleillement, est très fréquente dans la population générale (22) et d’autre part parce qu’elle induit une augmentation de la sécrétion de parathormone (car elle conduit à un défaut de l’absorption intestinale du calcium)
La carence en vitamine D modifie donc la présentation diagnostique de la maladie, mais également son évolution.
En effet, elle augmente le risque d’hypocalcémie postopératoire, de « hungry bone syndrome » et de persistance d’une parathormonémie élevée après la cure chirurgicale.
De plus, le calcitriol fixé à son récepteur, le VDR, a un effet de répression de synthèse sur la transcription du gène de la PTH (10). Il a été démontré que certains haplotypes, notamment l’haplotype b, étaient à l’origine d’une diminution de l’expression du récepteur de la vitamine D. Or, les patients ayant une HPP non familiale ont une plus grande prévalence du génotype bb. Ainsi, la diminution de l’expression de VDR pourrait atténuer l’effet antiprolifératif du calcitriol sur les cellules parathyroïdiennes, et rendre compte d’une plus grande susceptibilité de certains patients à des variations même modestes du taux de calcitriol. (16)
V. LES DIFFICULTES DIAGNOSTIQUES
1. L’hyperparathyroïdie primaire normocalcémique
Depuis une dizaine d’années, une nouvelle entité clinique de l’hyperparathyroïdie primaire a été décrite. Elle est caractérisée par une calcémie normale associée à une valeur de PTH élevée, en l’absence de cause d’hyperparathyroïdie secondaire. Le risque est donc celui de méconnaitre une hyperparathyroïdie primaire, avec les complications, décrites ci-dessus, qu’elle comporte.
Elle représente 15 % des cas d’HPP, lorsque des patients sont explorés pour une déminéralisation osseuse, une maladie lithiasique rénale, ou encore une hypercalcémie transitoire constatée lors d’un dosage antérieur.
Pour le diagnostic positif de ces formes particulières peut être réalisé un test de charge au
calcium : le freinage de la sécrétion de la PTH est alors insuffisant alors que le patient est
rendu hypercalcémique. Le principe de ce test repose sur la moindre sensibilité des cellules adénomateuses parathyroïdiennes au rétrocontrôle négatif du calcium liée à une diminution du nombre de CaR.
Plusieurs tests de charge calcique ont ainsi été proposés, utilisant différents marqueurs tels que la clairance du phosphate, l’AMPc urinaire, ou te taux de PTH immunoréactive. Cependant chacun de ces tests est de réalisation complexe ou contraignante et pour certains d’entre eux imparfaitement standardisés.
Une étude menée en 2005 au CHU de Rouen a évalué l'intérêt d'un test de charge calcique intraveineuse, parfaitement standardisé et de durée limitée à quelques heures (14). Lors de ce test de charge calcique, les patients reçoivent une perfusion de gluconate de calcium pendant
6 heures après le début de la perfusion. Ce test a permis de déterminer une valeur seuil de PTH plasmatique optimal qui permet de différencier un patient atteint d'hyperparathyroïdie primaire d'un témoin sain. Le seuil de PTH retenu est de 14 ng/L 3 heures avec une
sensibilité et une spécificité de 92 %.
Une limite relative concerne les patients atteints d’une NEM1, qui étaient moins aisément séparés des témoins sains. Ceci est probablement dû à une sensibilité inférieure des cellules adénomateuses au rétrocontrôle du calcium par rapport à celle des cellules hyperplasiques de la NEM1.
Ce test s'est avéré bien toléré, performant, avec un coût modéré. Cependant il nécessite une surveillance hospitalière des patients 3 à 6 heures après la fin de la perfusion, en raison de l’exposition aux risques de l’hypercalcémie.
2. L’hyperparathyroïdie primaire sans augmentation de la PTH
Elle est caractérisée par une élévation de la calcémie associée à un taux de PTH plasmatique situé dans la fourchette de la normale. Plusieurs hypothèses ont été avancées pour expliquer une telle situation : la présence d’anticorps antiPTH, d’anticorps antihétérophiles, et surtout la production d’une PTH tronquée.
Les principaux pièges diagnostiques de l’hyperparathyroïdie primaire sont résumés ici (38) :
· Formes sans hypercalcémie
o Pancréatite aigue (par fixation du calcium sur des plaques de cyto-stéato-nécrose)
o Insuffisance rénale
o Carences sévères en vitamine D o Iatrogénie
o HPP normocalcémique · Formes sans hypercalciurie
o Insuffisance rénale o Carence en vitamine D o Iatrogénie
· Formes sans élévation de PTH
o PTH invisible: anticorps anti PTH? Anticorps hétérophiles?
L’existence de ces différentes formes particulières, de ces situations atypiques ou « limites » justifient le recours à des tests dynamiques, pour affirmer ou au contraire écarter le diagnostic d’hyperparathyroïdie primaire.
VI. Test au CINACALCET 1. Objectifs de l’étude
Antérieurement révélée par ses complications, rénales ou osseuses, l'hyperparathyroïdie primaire a vu sa présentation considérablement évoluer.
Les lithiases rénales ne sont retrouvées aujourd'hui que dans 17 % des cas et l'ostéite fibro-kystique dans moins de 5% des cas. Plus de 80% des patients atteints
d'hyperparathyroïdie primaire sont asymptomatiques au moment du diagnostic.
Cette absence de symptomatologie clinique ne doit pas faire occulter la possibilité de
survenue de complications si l'hyperparathyroïdie n'est pas traitée. Ainsi, dans une étude
publiée en 2008 par Rubin et al. (29), une cohorte incluant 116 patients atteints d’une HPP a été suivie durant 15 ans (de 1984 à 1999). 57 patients n’ont pas eu de parathyroïdectomie, tandis que 59 ont été pris en charge chirurgicalement sur la base des critères NIH définis en 1990 (NIH Conference-Consensus, 1991). Après 15 ans de surveillance, 37 % des patients non opérés avaient au moins un critère opératoire, preuve de la progression de la maladie, et 59 % des patients une détérioration de la densité minérale osseuse de plus de 10 % (prédominant sur l’os cortical). A l'inverse, chez les patients opérés, l'intervention parathyroïdienne a été constamment suivie d'une normalisation des marqueurs biochimiques de surveillance et d'une augmentation de la masse osseuse.
L’ensemble des études qui ont été menées a permis de démontrer que l'ensemble des patients ayant une hyperparathyroïdie primaire asymptomatique et possédant un ou plusieurs critères d'indication opératoire avaient une maladie évolutive s'ils n'étaient pas opérés. La chirurgie permet de stopper l'évolutivité de la maladie d'une part et d'augmenter significativement
la masse osseuse d'autre part.
Nous ne possédons cependant pas à l'heure actuelle de critères prédictifs de la progression ou non de la maladie, parmi les sujets n'ayant pas les critères d'indication opératoire du NIH. Les
données sont donc en faveur d'une prise en charge attentive des patients atteints d'hyperparathyroïdie primaire, soit par un acte chirurgical, soit par un suivi rapproché.
Le diagnostic d'hyperparathyroïdie primaire est en théorie assez simple, par mesures combinées de la calcémie et du taux d'hormone parathyroïdienne intacte. Cette dernière mesure utilise une technique immuno-radiométrique ou par immuno-chimiluminescence. L'hyperparathyroïdie primaire associe une hypercalcémie, une hypercalciurie et une
élévation inadaptée du taux d'hormone parathyroïdienne. Néanmoins, dans un certain
nombre de situations particulières, le diagnostic est beaucoup plus difficile. Les paramètres classiques énumérés précédemment peuvent se trouver modifiés par l'émergence d'une insuffisance rénale, complication par elle-même de l'hyperparathyroïdie primaire. La symptomatologie biologique classique peut être absente. Il existe des formes normo-calcémiques (30) et des formes où le taux d'hormone parathyroïdienne s'inscrit dans la limite de la normale (17). Enfin, la calciurie des 24 heures ne peut pas toujours être mesurée pour des raisons pratiques ou en raison de la présence d'une insuffisance rénale, circonstance où elle perd sa valeur de critère diagnostique.
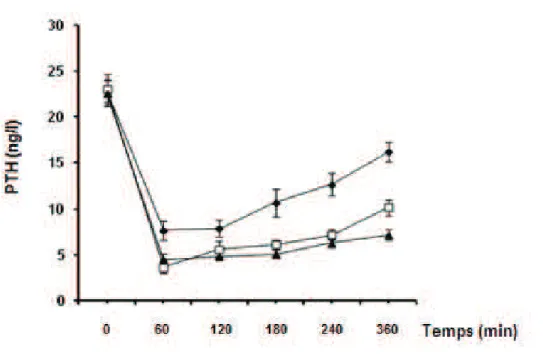
L’évaluation d’un test de charge calcique standardisé par voie intra-veineuse dans un groupe de patients atteints d’hyperparathyroïdie primaire comparés à un groupe de témoins sains a permis de montrer qu'un abaissement du taux de PTH plasmatique au dessous de 14 ng/l mesuré 3 heures après le début du test, permettait d'écarter le diagnostic d'hyperparathyroïdie primaire (37).
Dans la présente étude, il a été recherché si un test de freinage de la sécrétion d'hormone
parathyroïdienne par un calcimimétique (cinacalcet) pris oralement fournit des informations similaires et dans un temps aussi court que le test de charge calcique intraveineux.
Une molécule calcimimétique est reconnue par le récepteur membranaire exprimé par les cellules sensibles au calcium, notamment les cellules parathyroïdiennes. Après fixation à ce récepteur, le calcimimétique l'active, mimant ainsi l'action du calcium, entrainant un freinage de la sécrétion de PTH.
Le cinacalcet est commercialisé sous le nom de Mimpara® et possède une autorisation de mise sur le marché (AMM) pour le traitement de l'hyperparathyroïdie secondaire de l'hémodialysé. En 2004, Block GA et al. (5) ont en effet étudié dans un essai randomisé en double aveugle, contrôlé par placebo, l’efficacité et la sécurité d’emploi du cinacalcet chez des patients hémodialysés ayant une hyperparathyroïdie secondaire insuffisamment contrôlée par les traitements standards. Il a été démontré que le cinacalcet diminuait efficacement et de
façon significative le taux plasmatique de PTH, indépendamment de la sévérité de la maladie rénale. Il peut être également utilisé dans le traitement du cancer parathyroïdien (36).
Après prise orale d'un comprimé de cinacalcet, le pic du taux plasmatique est atteint entre 2 et 4 heures tel que l’a montré Dong BJ en 1995 dans une revue de littérature concernant ce calcimimétique (11). Cette revue a également rapporté que le cinacalcet est bien toléré, nausées et vomissements étaient les effets secondaires les plus fréquents. Une hypocalcémie transitoire a été observée chez 5 % des patients, habituellement asymptomatique elle a été corrigée par la réduction des doses quotidiennes de cinacalcet.
Dans les études menées par le laboratoire AMGEN qui commercialise ce médicament, le taux plasmatique de PTH (mesuré chez l'homme sain et chez l'insuffisant rénal hémodialysé) est le plus bas au moment du pic plasmatique de cinacalcet (11,20,23). A métabolisme hépatique préférentiel, les concentrations plasmatiques de cinacalcet ne sont pas influencées par la fonction rénale ou l'hémodialyse (23,24). Les posologies quotidiennes proposées chez l'insuffisant rénal atteignent 180 mg (15) et peuvent être élevées jusqu'à 300 mg chez le
patient atteint de carcinome parathyroïdien (35,36). Comme précédemment mentionné,
l'intérêt d'un traitement par cinacalcet a été démontré chez le patient atteint d'hyperparathyroïdie primaire (25,26). Dans une de ces publications, Peacock et al ont évalué l’efficacité du cinacalcet dans l’hyperparathyroïdie primaire, selon les degrés de sévérité de la maladie (définis biochimiquement et selon les résultats d’ostéodensitométrie osseuse). A contrario, aucune étude, à ce jour, n'a évalué la possibilité d'utiliser le cinacalcet en prise
unique comme outil d'évaluation de la sécrétion parathyroïdienne.
Pour répondre à la question posée, les objectifs ont été :
- d'évaluer l'effet d'une prise orale unique de cinacalcet (test au cinacalcet) chez des témoins,
- de comparer chez ces mêmes témoins les résultats obtenus avec ceux du test de charge calcique intraveineux selon les modalités mises au point dans cette
précédente étude (37),
- de comparer les résultats du test au cinacalcet obtenus dans ce groupe de
témoins à ceux d'un groupe de patients atteints d'hyperparathyroïdie
primaire soumis à ce même test.
Le but de l’étude a donc été d'établir les variations du taux d'hormone parathyroïdienne avant et après la prise orale unique de cinacalcet chez le volontaires sain et dans un groupe de patients atteints d'hyperparathyroïdie primaire.