UNIVERSITE MOHAMMED V-AGDAL
FACULTE DES SCIENCES
RABAT
THESE DE DOCTORAT ES-SCIENCES
(DOCTORAT D’ETAT)
Présentée par
Abdelkarim Guédira
Discipline: Physiologie végétale
Spécialité: Biotechnologie végétale
MISE EN ŒUVRE DES BIOTECHNOLOGIES: SUSPENSIONS
CELLULAIRES, PROTOPLASTES, EN VUE DE L’AMELIORATION
DES BANANIERS A LA RESISTANCE AUX NEMATODES AU MAROC
Soutenue le 31 Mars 2006, devant le jury
H. CHLYAH
PrésidentProfesseur à la Faculté des Sciences de Rabat-Agdal
R. HAICOUR
ExaminateurMaître de conférences à l’Université de Paris-Sud XI et Paris VI
B. CHLYAH
ExaminateurProfesseur à la Faculté des Sciences de Rabat-Agdal
A. FILALI-MALTOUF
ExaminateurProfesseur à la Faculté des Sciences de Rabat-Agdal
N. BENDAOU
ExaminateurProfesseur à la Faculté des Sciences de Rabat-Agdal
D. WALALI-LOUDIYI
ExaminateurProfesseur à l’I.A.V. Hassan II, Rabat
Dédicaces
Dédicaces
Dédicaces
Dédicaces
Je dédie ce travail à la mémoire de mon père
A ma chère mère que dieu lui accorde longue vie
A ma femme pour son soutien constant
A mes deux filles Amina et Soukaïna
A mes frères et sœurs
A toute ma famille
A tous mes amis.
AVANT PROPOS
Ce travail a été réalisé au Laboratoire de Physiologie Végétale de la Faculté des Sciences de Rabat sous la co-direction de Monsieur le professeur H. CHLYAH et de Monsieur le professeur R. HAICOUR du Laboratoire de Morphogenèse Végétale Expérimentale de l’Université de Paris-Sud.
Je voudrais exprimer ma profonde reconnaissance à Monsieur H. CHLYAH professeur à la Faculté des Sciences de Rabat, pour l’accueil qu’il m’a réservé dans son laboratoire et l’intérêt constant qu’il a apporté à ce travail. Sa compétence et ses conseils judicieux ont été pour moi un grand réconfort. Qu’il soit vivement remercié d’avoir accepté de présider ce jury de thèse.
J’exprime ma sincère gratitude à Monsieur R. HAICOUR professeur à l’Université de Paris-Sud XI et Paris VI, pour m’avoir encadré durant les stages que j’ai effectués dans son laboratoire. Ses compétences scientifiques, ses qualités humaines et sa disponibilité ont été très précieuses dans l’accomplissement de cette thèse. Il m’est aussi agréable de lui témoigner ma grande gratitude pour avoir accepté de juger ce travail et faire partie de ce jury.
J’exprime ma profonde reconnaissance à Madame B. CHLYAH professeur à la Faculté des Sciences de Rabat, pour les discussions fructueuses dont elle m’a fait bénéficier, pour le soutien inconditionnel qu’elle m’a toujours apporté et pour le temps qu’elle a consacré à la correction de ce manuscrit. Qu’elle soit vivement remerciée d’avoir accepté de faire partie de ce jury de thèse.
Je suis très honoré que Monsieur A. FILALI-MALTOUF professeur à la Faculté des Sciences de Rabat, ait accepté de faire partie du jury de cette thèse. Je le prie de croire à ma profonde reconnaissance.
Je tiens à remercier Monsieur N. BENDAOU professeur à la Faculté des Sciences de Rabat, d’avoir bien voulu honorer cette thèse par sa présence et ce malgré ses nombreuses occupations.
Je tiens à remercier très vivement Monsieur D. WALALI-LOUDIYI professeur à l’Institut Agronomique et Vétérinaire Hassan II, pour l’intérêt qu’il a manifesté à ce travail. Il m’est aussi agréable de lui témoigner ma grande gratitude pour avoir accepté de juger ce travail et faire partie de ce jury.
J’exprime ma vive reconnaissance et mes sincères remerciements à Monsieur A. RAMMAH professeur à l’Institut Agronomique et Vétérinaire Hassan II, pour le temps qu’il m’a consacré pour la réalisation de nos essais sur la résistance aux nématodes effectués au laboratoire de phytopathologie à l’Institut Agronomique et Vétérinaire Hassan II.
Ma chaleureuse reconnaissance va également à Monsieur F. VEDEL professeur à l’Université de Paris-Sud, pour le temps qu’il m’a consacré pour la réalisation et l’analyse de la partie biologie moléculaire de cette thèse.
J’exprime ma vive reconnaissance et mes sincères remerciements à mon ami Monsieur Z. TRIQUI, Professeur-assistant à la Faculté des Sciences de Rabat, pour sa grande participation dans toutes les étapes de la réalisation de cette thèse. L’ampleur de ses connaissances et ses grandes qualités humaines resteront pour moi un exemple. Je tiens à l’assurer de ma grande admiration.
Je voudrais remercier tous mes collègues du Laboratoire de Physiologie Végétale de la Faculté des Sciences de Rabat auprès desquels j’ai constamment trouvé un esprit d’équipe et de bonne camaraderie.
Je tiens à exprimer ma gratitude à l’ensemble des membres du Laboratoire d’Orsay en particulier Monsieur D. SIHACHAKER professeur à l’Université de Paris-Sud Monsieur ASSANI, Madame AMBROISE, Madame SERVAES et Madame FORCHIONI pour l’aide précieuse qu’elles m’ont apportée lors de mes stages à Paris.
Mes remerciements vont également aux CIRAD de Montpellier, CIRAD de Guadeloupe, à INIBAP situé en Belgique et à Messieurs HAKAM et ZEBDI pour la fourniture du matériel végétal nécessaire pour la réalisation de ce travail.
Ce travail n’aurait pu être mené à bien sans l’appui financier de l’action intégrée Maroco-Française AI n° 230/SVS/2000.
Abréviations
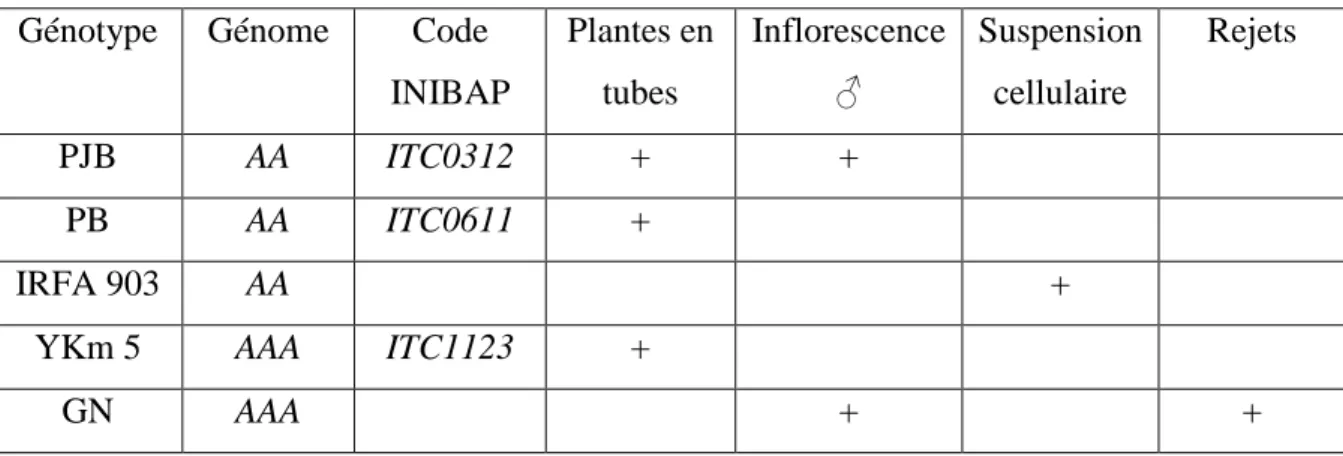
A: Génome haploïde de Musa acuminata AAAh: Bananiers d’altitude
B: Génome haploïde de Musa balbisiana GN: Grande naine
PB: Pisang berlin PJB: Pisang jari buaya Ykm 5: Yangambi km 5
CHP: Cultures hautement proliférantes
CIRAD: Centre de coopération internationale en recherche agronomique pour le développement
FAO: Organisation des Nations unies pour l’alimentation et l’agriculture (Food and Agriculture Organization)
INIBAP: Réseau International pour l’amélioration de la Banane et de la Banane Plantain
1/2MS: Milieu de Murashige et Skoog avec macro-éléments dilués de moitié 2,4 D: Acide 2,4 dichlorophénoxyacétique
2iP: N6 (2-isopentyl) adénine AIA: Acide indole-3- acétique ANA: Acide 1-naphtalène acétique BAP: 6-benzylaminopurine
Dicamba: Acide 3,6-dichloro-2-méthoxybenzoïque Kinétine: 6-furfurylaminopurine ou N6-furfuryladénine m/V: Masse par volume.
MS: Milieu de Murashige et Skoog (1962)
NS: Effet non significatif du ou des facteurs au seuil de 5% PEG: Polyéthylène glycol
Picloram: Acide 4-amino-3, 5, 6-trichloro-2-pyridinecarboxylique PVP: Polyvinylpyrrolidone
Thidiazuron : 1-phényl-3-(1, 2, 3 thiadiazol-5-yl) Zéatine: 4-hydroxy-3-méthyl-trans-2 buténylaminopurine
AFLP : polymorphisme de longueur des fragments amplifiés RAPD : amplification aléatoire de l’ADN polymorphe
INTRODUCTION GENERALE ... 12
SYNTHESE BIBLIOGRAPHIQUE... 17
1. Présentation de la plante... 17
1.1. Le bananier dans le monde... 17
1.2. Le bananier au Maroc... 18
1.3. Position taxonomique... 18
1.4. Morphologie et mode de reproduction ... 21
2. Problèmes phytosanitaires... 21
2.1. Les maladies fongiques ... 22
2.1.1. La fusariose ou maladie de Panama ... 22
2.1.2. Les cercosporioses... 22 2.2. Maladies bactériennes ... 22 2.3. Maladies virales... 23 2.4. Les ravageurs... 23 2.4.1. Les charançons ... 23 2.4.2. Les nématodes ... 23 2.4.2.1. Radopholus similis ... 24 a. Répartition géographique ... 24 b. Biologie ... 24 c. Symptomes et dégâts ... 25 2.4.2.2. Meloidogyne spp. ... 25 a. Répartition géographique ... 25 b. Biologie ... 26 c. Symptômes et dégâts ... 26
2.4.2.3. Méthodes de lutte contre les nématodes du bananier ... 27
3. Amélioration génétique des bananiers par croisement interpecifique et intergénérique ... 28
3.1. Obtention de variétés tétraploïdes ... 28
3.2. Obtention de variétés triploïdes... 28
4. Multiplication in vitro par culture d’apex et d’embryons ... 29
4.1. Culture d’apex ... 29
4.2. Culture d’embryons zygotiques ... 31
5. Embryogenèse somatique et suspensions cellulaires chez le bananier ... 31
5.1. Définition ... 31
5.2. Ontogenèse de l’embryon somatique ... 32
5.3. Origine de l’embryon somatique... 32
5.4. Embryogenèse sur cal... 33
5.5. Suspensions cellulaires chez le bananier... 34
5.5.1. Suspensions cellulaires provenant d’embryons immatures... 35
5.5.2. Suspensions cellulaires provenant de tissus végétatifs ... 35
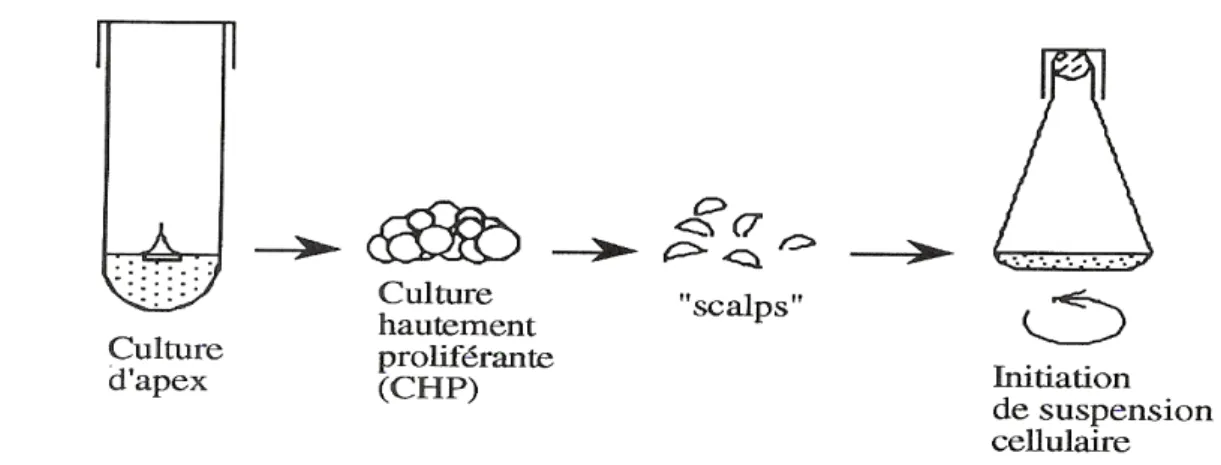
5.5.3. Suspensions cellulaires provenant de ‘scalps’ de massifs méristèmatiques ... 36
5.5.4. Suspensions cellulaires provenant de fleurs immatures ... 38
5.6. Objectifs des techniques d’embryogenèse somatique chez le bananier ... 42
5.7. Variation somaclonale... 42
6. Les protoplastes... 43
6.1. L’obtention et la culture de protoplastes chez le bananier ... 44
6.2. La fusion des protoplastes ... 47
6.2.1. La fusion au polyéthylène glycol (PEG) ... 47
6.2.2. La fusion électrique ... 48
6.5. Application aux bananiers ... 50
MATERIEL ET METHODES... 53
1. Matériel végétal... 53
1.1. Les rejets ... 53
1.2. Les inflorescences mâles ... 54
1.3. Plantes en tube... 54
1.4. Suspensions cellulaires... 54
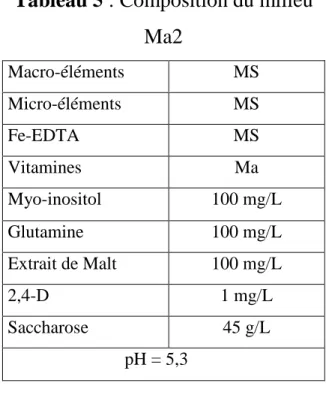
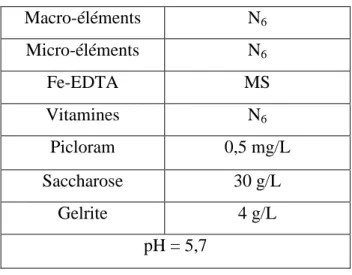
2. Obtention et utilisation des suspensions cellulaires ... 54
2.1. Etablissement de suspensions cellulaires et essais de régénération ... 55
2.1.1. Réalisation de suspensions cellulaires partir des fleurs mâles immatures ... 55
2.1.1.1. Initiation de cals ... 55
2.1.1.2. Initiation des suspensions cellulaires ... 59
2.1.1.3. Dynamique de croissance... 59
2.1.1.4. Obtention des embryons somatiques... 60
2.1.2. Réalisation de suspensions cellulaires partir de cultures hautement proliférantes (CHP) ... 61
2.1.2.1. Formation des CHP ... 61
2.1.2.2. Initiation de la suspension cellulaire à partir de CHP ... 61
2.1.2.3. Evaluation des capacités de régénération de plantes à partir des suspensions cellulaires… ... 62
3. Obtention et utilisation des protoplastes ... 67
3.1. Isolement et culture des protoplastes ... 67
3.1.1. Isolement des protoplastes ... 67
3.1.1.1. A partir des feuilles ... 67
3.1.1.2. A partir des suspensions cellulaires ... 67
3.1.2. Récupération des protoplastes ... 70
3.1.3. Dénombrement des protoplastes ... 71
3.2. Mesure de la taille des protoplastes... 71
3.3. Culture des protoplastes ... 71
3.3.1. Etalement de la suspension des protoplastes... 71
3.3.2. Essai de régénération de plantes à partir des protoplastes ... 72
3.4. Observation des cultures ... 72
3.5. Essais d’hybridation somatique par fusion chimique au PEG ... 75
3.5.1. Préparation de la solution du PEG 6000 à 50% (M/V) ... 75
3.5.2. Fusion de protoplastes ... 75
3.5.3. Culture des protoplastes fusionnés ... 76
4. Identification moléculaire de cinq génotypes de bananier ... 77
4.1. Identification moléculaire ... 77
4.2. Extraction de l’ADN total ... 77
4.3. Analyse de l’ADN avec des marqueurs SSR ... 78
4.4. Nature des amorces nucléaires ... 78
4.5. Nature des amorces chloroplastiques ... 79
4.6. Composition du milieu réactionnel ... 80
4.7. Amplification de l’ADN... 80
4.8. Analyse des produits d’amplification :... 80
5. Evaluation de la résistance aux nématodes chez cinq génotypes de bananiers... 81
5.1. Préparation des plants... 81
5.2. Préparation de l’inoculum ... 82
5.3. Inoculation des plants... 82
5.4. Observations et expression des résultats ... 83
IETABLISSEMENT DE SUSPENSIONS CELLULAIRES A PARTIR DES MAINS
DES INFLORESCENCES MALES ... 86
1. Phase de callogenèse ... 86
1.1. Effet de l’agent gélifiant... 88
1.2. Effet de la fraîcheur des explants ... 89
2. Initiation des suspensions cellulaires ... 97
2.1. Initiation de suspensions cellulaires à partir de cals embryogènes et friables du cultivar GN ... 97
2.2. Initiation de suspensions cellulaires à partir de cals de PJB ... 99
2.2.1. Explant de départ : cals blancs friables ... 99
2.2.2. Explant de départ : cals jaunes porteurs d’embryons ... 99
3. Description de la suspension cellulaire du cultivar IRFA 903... 102
4. Dynamique de croissance... 104
4.1. Dynamique de croissance: évolution du volume cellulaire... 104
4.2. Dynamique de croissance de la suspension cellulaire du génotype PJB... 104
4.3. Dynamique de croissance du cultivar IRFA 903 ... 106
5. Régénération à partir de suspensions cellulaires... 106
5.1. Régénération à partir de la suspension IRFA 903... 106
5.2. Régénération à partir de la suspension du génotype PJB... 107
5.3. Conclusion... 112
6. Discussion ... 113
6.1. Phase de callogenèse ... 113
6.2. Initiation de suspensions cellulaires ... 116
6.3. Essais de régénération ... 118
II ETABLISSEMENT DE SUSPENSIONS CELLULAIRES A PARTIR DE CHP... 120
1. Formation des CHP ... 120
1.1. Effet des subcultures sur la capacité de formation de CHP ... 120
1.2. Effet de la concentration de la BAP et du génotype sur la capacité de formation de CHP ... 124
1.3. Nombre de bourgeons par explant ... 124
1.4. Aspect des bourgeons... 127
2. Initiation de suspensions cellulaires à partir de CHP ... 127
2.1. Description macroscopique et microscopique des suspensions cellulaires au moment de l’initiation ... 127
2.2. Nombre de globules méristèmatiques ... 130
2.3. Description des suspensions cellulaires après neuf mois de culture ... 131
3. Evaluation des capacités de régénération de plantes à partir des suspensions cellulaires ... 135
4. Discussion ... 138
4.1. Production des CHP ... 138
4.2. Essais d’initiation des suspensions cellulaires ... 139
4.3. Essais de régénération ... 139
III ISOLEMENT ET CULTURE DES PROTOPLASTES ... 141
1. Isolement des protoplastes ... 141
1.1. Rendements en protoplastes ... 141
1.1.1. A partir des feuilles ... 141
1.1.2. A partir de suspensions cellulaires ... 143
1.2. Variabilité morphologie des protoplastes... 145
2.2. Culture de protoplastes issus de suspensions cellulaires... 147
2.2.1. Protoplastes de IRFA 903 ... 147
2.2.2. Protoplastes de PJB ... 148
3. Essai d’hybridation somatique par fusion chimique au PEG ... 152
3.1. Description du phénomène de fusion ... 152
3.2. Culture des protoplastes après traitement de fusion... 152
3.2.1. Auto-fusion des protoplastes du cultivar IRFA 903... 152
3.2.2. Hétéro-fusion entre le génotype PJB et le cultivar IRFA 903... 153
4. Discussion ... 156
VI IDENTIFICATION MOLECULAIRE DE CINQ GENOTYPES DE BANANIER 158 1. Amplification de marqueurs SSR nucléaires ... 158
2. Marqueurs de l’ADN chloroplastique ... 162
3. Conclusion... 162
V EVALUATION DE LA RESISTANCE AUX NEMATODES : RADOPHOLUS SIMILIS ET MELOIDOGYNE SPP... 163
1. Résultats du premier essai ... 163
1.1. Meloidogyne spp. ... 163
1.2. Radopholus similis ... 163
2. Résultats du deuxième essai ... 167
3. Discussion et conclusion ... 169
CONCLUSION GENERALE ET PERSPECTIVES... 172
REFERENCES BIBLIOGRAPHIQUES ... 179
INTRODUCTION GENERALE
INTRODUCTION GENERALE
Le bananier et le bananier plantain (Musa spp.), monocotylédones de la famille des Musacées, présentent une grande importance alimentaire et économique dans de nombreux pays tropicaux et subtropicaux. A l’échelle mondiale, les bananiers occupent le quatrième rang des productions agricoles et la deuxième place en ce qui concerne le commerce des fruits (Loeillet, 1999 ; Arias et al., 2004). Au Maroc, le bananier est cultivé en conditions de serre depuis 1978 et couvre actuellement environ 4470 hectares (FAO, 2004). Bien que nécessitant de gros investissements, dans un conteste économique difficile avec la mondialisation et les accords de libre échange, la culture du bananier a connu une extension d’environ 400 hectares par an durant les années 2000/01 et 2002/03 (Ministère de l’agriculture, 2004). Pour continuer son extension et résister à la concurrence internationale, ce secteur doit impérativement viser l’augmentation du rendement de cette culture, obtenir des variétés agronomiques performantes, adaptées aux conditions marocaines, et développer des méthodes rentables et efficaces pour les multiplier en masse.
Les bananiers sont des herbes géantes, pérennes et à multiplication exclusivement végétative. Ce mode de propagation permet la transmission des maladies ce qui agit négativement sur la production. De plus, la production monoclonale due à l’industrialisation de la culture bananière renforce la vulnérabilité de cette production par l’apparition de nouvelles races de pathogènes suite à une diminution considérable de la variabilité génétique des bananiers. En effet, la majorité de la production de la banane dessert provient uniquement du sous-groupe Cavendish (AAA) qui représente 80 % de la production mondiale de la banane type dessert et dont environ un tiers est exporté (Annual Report INIBAP, 1999 ; Guyomard et al. 1999). Il ne s’agit au total que d’une dizaine de cultivars (Grande naine, Petite naine, Williams, Poyo, etc.) qui ne différent entre eux que par des mutations importantes pour les agronomes, mais sans signification d’un point de vue génétique (Haïcour et al., 1998). Grâce à leur rendement important, et leur saveur largement acceptée, les cultivars Cavendish ont dominé le marché d’exportation depuis l’abandon de Gros Michel il y a plus de cinquante ans (Daniells, 2002). Leur principal désavantage est leur sensibilité à une large gamme de ravageurs et de maladies, en particulier la maladie des raies noires et la maladie de Panama (Ploetz, 2004).
Au Maroc, seuls les cultivars du sous groupe Cavendish sont cultivés. Cette culture se heurte alors principalement aux dégâts causés par les nématodes (Rammah, 1990).
Les espèces de nématodes les plus associées à la culture de bananier au Maroc sont :
Radopholus similis et Meloidogyne spp. Ces derniers causent des chutes de rendement allant
de 30 à 50 % et peuvent même compromettre la survie des bananeraies (Chahidi, 1985 ; Traore, 1989; Rammah, 1990).
La lutte chimique, principalement utilisée, ne donne pas entière satisfaction. De plus, les nématicides sont coûteux et très nocifs pour l’environnement (Yamashita et Viglierchio, 1987). D’autre part, la fumigation du sol par le traitement du bromure de méthyle, le produit le plus efficace contre les nématodes est en voie d’interdiction. Le recours à d’autres méthodes de lutte telle que l’inondation des terrains durant deux à six semaines par an ou la rotation culturale (Gowen et Quénéhervé, 1990) ne peuvent être mises en œuvre au Maroc puisque l’essentiel de la production bananière est issu de cultures pluriannuelles, en continu, sous serre.
Devant la gravité des attaques parasitaires qui affectent fortement la production bananière, l’amélioration des variétés existantes et la création de nouveaux cultivars résistants aux maladies permettraient d’éviter une baisse de productivité.
Les travaux d’amélioration des bananiers par les méthodes classiques de croisements se heurtent souvent aux problèmes de stérilité qui caractérisent la plupart des génotypes (Stover et Buddenhagen, 1986 ; Tomekpe et al., 2004). En effet, la majorité des cultivars des bananiers sont triploïdes (2n=3x=33). Cette triploïdie conduit à la production de fruits parthénocarpiques aspermes consommables. De plus, elle améliore la vigueur des plants (Bakry, 2001 ; Tomekpe et al., 2004). Le schéma d’amélioration classique repose essentiellement sur l’utilisation de tétraploïdes (4x) qui, croisés avec des diploïdes (2x), aboutit à la réalisation de plants triploïdes (3x). Malgré les succès obtenus dans la création de nouvelles variétés par hybridations classiques (Bakry et Horry, 1992 ; Tomekpe et al., 2004), la plupart des génotypes d’importance économique ne sont que des produits issus d’une simple sélection.
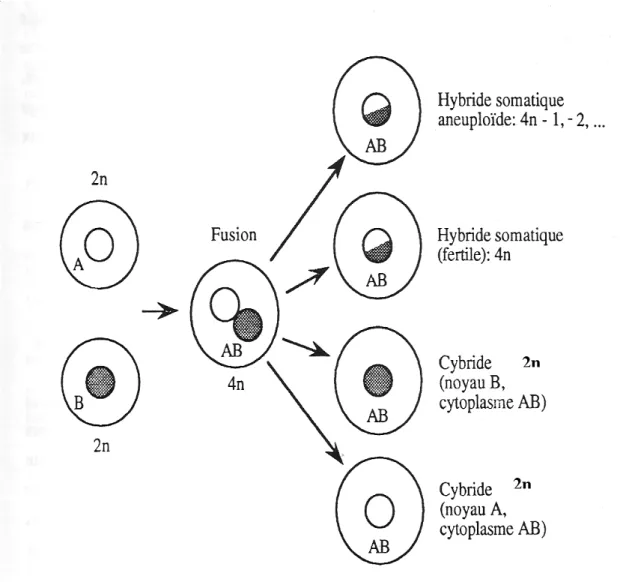
Parmi les stratégies d’amélioration des plantes par voie non conventionnelle, l’hybridation somatique c'est-à-dire la fusion des protoplastes apparaît comme une méthode qui devrait permettre de contourner les barrières de stérilité et d’élargir la variabilité génétique chez les bananiers.
La fusion de protoplastes a déjà été utilisée avec succès chez de nombreuses dicotylédones appartenant à la famille des Solanacées telles que la pomme de terre (Debnath et Wenzel, 1987) et l’aubergine (Sihachakr et al., 1994) et aussi chez les Citrus (Crosser
protoplastes s’avère plus difficile. Cependant, des embryons issus d’hybridation somatique ont été obtenus chez la canne à sucre et le millet mais leur évolution en plantes n’a pas été signalée (Tabaiezadeh et al., 1986). Plus récemment, des hybrides somatiques ont été obtenus chez le riz et l’orge (Kisaka et al., 1998). Chez les bananiers, les premiers hybrides somatiques ont été obtenus par Matsumoto et al. (2002) puis par Assani et al. (2005).
La fusion somatique nécessite la maîtrise du comportement des protoplastes depuis leur isolement jusqu’à leur régénération en plantes. Chez les monocotylédones dont font partie les bananiers, les suspensions cellulaires constituent le matériel de choix pour l’isolement des protoplastes. Les suspensions cellulaires des bananiers peuvent être obtenues à partir de cals issus du rhizome et du pseudo-tronc (Novak et al., 1989), de jeunes fleurs mâles ( Ma, 1991; Grapin et al., 1996), des embryons zygotiques immatures (Marroquin et al., 1993) et d’apex en prolifération (Dhed’a et al., 1991).
Notre travail vise à terme la création, par fusion des protoplastes, d’hybrides hétérozygotes réunissant les caractéristiques organoleptiques du cultivar diploïde IRFA 903 rustique et productif (CIRAD-FLHOR, 1994) et la résistance aux nématodes détectée chez le génotype diploïde Pisang jari buaya (Speijer et De Waele, 1997 ).
Dans la première partie, nous avons tenté, en fonction de la disponibilité du matériel végétal, d’obtenir des suspensions cellulaires à partir des inflorescences mâles immatures du génotype Pisang jari buaya et du cultivar triploïde Grande naine (GN) exploité au Maroc, et également à partir d’apex en prolifération des génotypes diploïdes résistants au nématodes Pisang jari buaya (PJB), Pisang berlin (PB) et aussi du génotype triploïde Yangambi km 5 (Ykm 5).
Une attention particulière a été portée à l’étude des suspensions cellulaires initiéeschez les différents génotypes testés ainsi qu’à la suspension cellulaire obtenue à partir du cultivar IRFA 903 établie par le CIRAD de Montpellier. Cette étude comporte les aspects morphologiques et cytologiques, la dynamique de croissance et la capacité de régénération des suspensions cellulaires.
Dans la seconde partie de ce travail, l’isolement des protoplastes à partir des feuilles et/ ou des suspensions cellulaires des génotypes PJB, PB et IRFA 903 a été réalisée. La culture des protoplastes a été effectuée à partir des protoplastes issus des feuilles et des suspensions cellulaires des génotypes PJB et PB et uniquement à partir de suspensions cellulaires chez le cultivar IRFA 903.
Pour terminer cette partie, nous avons réalisé la fusion chimique à l’aide polyéthylène glycol (PEG) puis la culture des protoplastes fusionnés, issus des suspensions cellulaires de PJB et la IRFA 903.
Dans la troisième partie, nous avons essayé de mettre en évidence un polymorphisme de marqueurs moléculaires entre cinq génotypes de bananier en utilisant la technique SSR-PCR (amplification de séquence microsatellites). L’analyse nucléaire a été effectuée en utilisant cinq couples de microsatellites du bananier décrits par Lagoda et al. (1998). Nous avons choisi en plus douze couples de microsatellites du tabac décrits par Bryan et al. (1999) pour l’analyse de l’ADN chloroplastique.
Enfin, nous avons testé la résistance en pots, de cinq génotypes de bananier vis-à-vis de deux nématodes: Radopholus similis et Meloidogyne spp. Les critères de croissance agronomique et le nombre de nématodes par 10 gramme de racines ont été déterminés pour évaluer la résistance des bananiers à ces deux nématodes, dans lesconditions marocaines.
SYNTHESE BIBLIOGRAPHIQUE
1. Présentation de la plante
1.1. Le bananier dans le monde
La production mondiale annuelle de bananes estimée à 100 millions de tonnes en 2002, occupe le quatrième rang des productions agricoles après le riz, le blé et le maïs (FAO, 2004). La banane est aussi le deuxième fruit le plus consommé au monde derrière les agrumes (Loeillet, 1999).
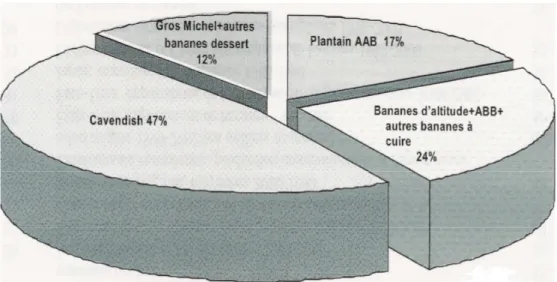
Les bananiers sont cultivés dans plus de 120 pays situés dans les régions tropicales et subtropicales. La production se répartit en deux types d’exploitations (Fig. 1): la culture de bananes dessert (59 % de la production totale) et celle de bananes à cuire dont les plantains (Frison et Sharrock, 1999; Arias et al., 2004). La grande majorité de la production est autoconsommée puisque l’exportation ne touche qu’environ 13% de la récolte dont presque uniquement des bananes dessert (Loeillet, 2001). Le sous-groupe variétal Cavendish, qui regroupe des bananes dessert, est prépondérant puisqu’il représente à lui seul 47 % de production globale de bananes. Presque toutes les bananes commercialisées dans le monde sont des Cavendish (Guyomard et al., 1999).
Les deux premiers producteurs de bananes douces, qui sont l’Inde et le Brésil, consomment presque la totalité de leur production. Les principaux pays exportateurs se situent en Amérique latine: Equateur, Costa Rica, Colombie. Le Cameroun et la Côte d’Ivoire sont les premiers pays exportateurs du bananier en Afrique (Lescot, 1999; Loeillet, 2001).
Les bananes offrent de multiples usages. Elles sont consommées principalement sous forme de fruits frais, mais aussi comme légumes cuits ou frits. Elles font l’objet de nombreuses transformations : chips, purées, productions d’alcool, vin et bière (Champion, 1967; Tezénas, 1985; Frison et Sharrock, 1999; INIBAP, 2001; Gaidashova et al., 2005).
D’autres parties de la plante sont aussi utilisées : extraction des fibres de textile de la gaine foliaire d’une espèce particulière : Musa textilis, consommation des bourgeons floraux en salade ou cuits, utilisation des feuilles pour la nourriture des animaux (Champion, 1963; Mante et Tepper, 1983). De plus, les cendres issues de la peau de banane brûlée servent à la fabrication de savon et les fibres de rejets séchés (hampe) sont utilisées pour la fabrication
Fig. 1:
Production mondiale de bananes par variété (moyenne 1998-2000) (d’après Arias et al., 2004).1.2. Le bananier au Maroc
Au Maroc, le secteur du bananier contribue à l’économie nationale pour un chiffre d’affaires de plus de 1,32 milliard de Dirhams, soit approximativement l’équivalent de celui de la tomate (Zouini, 2001). La culture du bananier a été introduite au Maroc pour la première fois en 1940. Cette culture en plein champ a été limitée à quelques sites à microclimats particuliers dans la région d’Agadir comme la vallée Tamri (INRA, 1989).
L’extension de cette culture est devenue possible grâce à l’interdiction de l’importation de la banane en 1978 et à la réussite de cette culture sous abri serre au début des années quatre vingt. Bien que nécessitant de gros investissements, ce nouveau type de culture a connu une extension rapide allant de 2 ha en 1980 à plus de 4470 ha en 2002 avec une production de 162 300 tonnes (FAO, 2004). La contribution des différents régions en matière de production durant la campagne 2000/2001 est de 63 % pour la région du Souss-Massa, de 24 % pour la région du Gharb et de 13 % pour les autres régions (APEFEL, 2001).
1.3. Position taxonomique
Les bananiers sont des monocotylédones appartenant : - à l’ordre des Zingibérales
- au genre Musa - à la section Eumusa
La section Eumusa comprend 11 espèces dont Musa acuminata et Musa balbisiana sont reconnues comme étant à l’origine de la grande majorité des bananiers cultivés. Ces deux espèces sont diploïdes, sauvages, et séminifères, ont un nombre haploïde de chromosomes n=11. Leur génome est représenté par les lettres AA pour Musa acuminata et BB pour Musa
balbisiana (Simmonds et Shepherd, 1955; Stover et Simmonds, 1987).
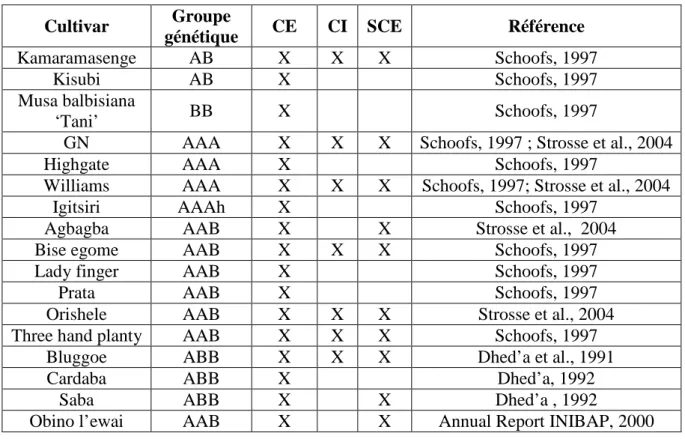
Les variétés actuellement consommées (tableau 1) sont pour la plupart, des clones triploïdes stériles et aspermes (groupes AAA, AAB et ABB). Il existe plus rarement des variétés diploïdes (AA et AB) et des clones tétraploïdes (Lescot, 2000; Bakry, 2001).
Parmi les groupes de bananiers les plus importants sur le plan économique (tableau 1) on note :
- les cultivars à génome Acuminata uniquement: AAA
Les principaux sous-groupes de ces cultivars sont les suivant : Cavendish, Gros Michel, Figue rose. Le sous-groupe Cavendish est le plus apprécié pour l’exportation. Les cultivars de ce sous-groupe, les plus cultivés au monde sont : GN, Poyo et Williams. Elles ne différent entre eux que par des mutations somatiques portant sur la hauteur de la plante ou la formation des régimes et des fruits (Bakry, 2001).
- les cultivars à génome Acuminata prédominant: AAB
Le sous-groupe le plus important est celui des plantains. Les bananiers le constituant, produisent des bananes à chair farineuse consommées cuites.
- les cultivars à génome Balbisiana prédominant: ABB
Ce groupe, d’importance moindre, comprend essentiellement des génotypes produisant des bananes à cuire.
Tableau 1 : Classification et répartition géographique des principales variétés de bananiers
(d’après Bakry, 2001). Groupe Sous-groupe Cultivars Type de fruit Distribution Pisang Mas Frayssinette Figue sucréedessert-sucré Tous continents Pisang Lilin dessert Indonésie/Malaisie AA Sucrier
Pisang Berangan/Lakatan
dessert Indonésie/Malaisie/Philippines Cavendish Lacatan/Poyo/Williams
Grande naine/Petite naine dessert
Tous continents, pays exportateurs Gros
Michel Gros Michel/Hightate/Cocos dessert Tous continents Figue-
Rose
Figue-Rose rose
Figure-Rose verte dessert Tous continents lujugira Intuntu/Mujuba à bière/
à cuire
Afrique de l’Est et centrale, Colombie
AAA
Ibota Yangambi km5 dessert Indonésie/Afrique
AB Ney
Poovan
Safet Velchi/Sukari
dessert-acidulé Inde/Afrique de l’Est
Figue-Pomme Maça/Silk
dessert-
acidulé Tous continents
Pomme Prata
dessert-acidulé
Inde/Malaisie/Australie/ Afrique de l’Ouest/Brésil
Mysore Pisang Ceylan
dessert-acidulé Inde
Pisang Pisang Kelat dessert Inde/Malaisie
Pisang
Rajah Pisang Rajah Bulu à cuire Malaisie/Indonésie Plantain French Come/Faux Come à cuire Afrique centrale et de l’Ouest/
Amérique latine/ Caraïbes
Popoulou Popoulou à cuire Pacifique
Laknao Laknao à cuire Philippines
AAB Pisang Nangka Pisang Nangka à cuire Malaisie Bluggoe Bluggoe/Matavia/Poteau/
Cacambou à cuire Tous continents
Pelipita Pelipita à cuire Philippines/Amérique latine
Pisang Fougamou dessert Inde/ Thaïlande/Philippines
Afrique de l’Est
Peyan - à cuire Philippines/Thaïlande
ABB
Saba Saba à cuire Philippines/Indonésie
1.4. Morphologie et mode de reproduction
Mis à part les diploïdes sauvages qui possèdent une reproduction sexuée et végétative, le mode de propagation des bananiers et essentiellement de type végétatif (Simmonds, 1976).
Le bananier est une herbe géante, dont le pseudo-tronc, formé par l’emboîtement des gaines foliaires, mesure de 1 à 8 mètres (Champion, 1963). Les feuilles sont émises par le méristème terminal de la tige vraie, improprement appelée bulbe caulinaire ou corme. Le corme, donne des ramifications latérales, désignées sous le nom de rejets situés à l’opposé des gaines foliaires, qui leur sont associées d’un point de vue phyllotaxie. Ils permettent la propagation végétative de la plante; plusieurs bourgeons végétatifs se développent sur le corme. Cependant, peu d’entre eux évoluent en tiges (Stover et Simmonds, 1987).
A la fin du cycle végétatif, le changement de fonction du méristème central induit la croissance et l’allongement de la tige vraie au cœur du pseudo-tronc, puis l’émergence de l’inflorescence portant des bractées à l’aisselle desquelles émergent les rangées simples ou doubles de fleurs appelées mains qui forment le régime. Ces premières mains contiennent des fleurs femelles constituées d’un ovaire en position infère et d’étamines non fonctionnelles réduites à l’état de staminodes. Les ovaires des fleurs femelles des variétés comestibles se remplissent de pulpe pour former le fruit, sans pollinisation ni formation de graines. Chez les espèces sauvages, séminifères la pulpe est très réduite et le fruit est rempli de graines.
Après les fleurs femelles, apparaissent deux à trois mains de fleurs hermaphrodites avec toutes les pièces florales avortées.
L’inflorescence mature porte souvent à son extrémité un ‘bourgeon mâle’ appelé ‘ popotte ’ composé du méristème inflorescentiel enveloppé de bractées non ouvertes abritant des cymes de fleurs mâles constituées d’ovaires réduits avortés et d’étamines bien développées (Champion, 1967; Harran, 1991; Bakry, 2001).
2. Problèmes phytosanitaires
Chez le bananier, la monoculture, l’absence de rotation culturale et le mode de propagation végétatif favorisent la transmission des maladies d’un cycle cultural à l’autre. Les principaux problèmes phytosanitaires du bananier sont présentés ci-après.
2.1. Les maladies fongiques
2.1.1. La fusariose ou maladie de Panama
La fusariose, causée par Fusarium oxysporum f. sp. Cubense (Foc), est considérée comme l’une des maladies les plus destructrices chez le bananier (Ploetz et Pegg, 2000; Ploetz, 2004). Le champignon causant cette maladie, vivant dans le sol, colonise le xylème de la plante et provoque des occlusions au niveau des vaisseaux conducteurs de la sève puis des gaines foliaires. Les feuilles tournent au jaune vif, flétrissent et s’affaissent sur le pseudo-tronc (Ploelz, 1994; Moore et al., 1995). Cette maladie a été responsable de la destruction des plantations de Gros Michel entre les années 1940 à 1950 ce qui a entraîné l’adoption de cultivars du sous groupe Cavendish (dont GN) qui sont devenus le principaux types de bananes d’exportation. Cependant, des pertes récentes de Cavendish dans plusieurs régions du monde montrent que la race 4 de Fusarium oxysporum est capable d’infecter des cultivars tels que la GN (Moore et al., 1995; Carlier et al., 2002; Carlier et al., 2003). Actuellement, aucun fongicide n’agit contre ce pathogène et quand un champ est infecté, il est impossible d’y cultiver des génotypes sensibles pendant une période pouvant aller jusqu'à 30 ans (Stoffelen et al., 2000).
2.1.2. Les cercosporioses
Les cercosporioses des bananiers ont pour origine deux champignons :
Mycosphaerella fijiensis (maladie des rais noires ou cercosporiose noire) et Mycosphaerella musicola (maladie de Sigatoka ou cercosporiose jaune) (Jones, 2000; Jacome et al., 2003).
Les cercosporioses détruisent les tissus foliaires et entraînent une réduction de 50 % de la production (Carlier et al., 2002; Carlier et al., 2003).
Des fongicides systémiques permettent de lutter efficacement contre les cercosporioses, mais leurs effets sur l’environnement sont préoccupants (Mourichon et al., 1997; Tirado et Zapata, 2003).
2.2. Maladies bactériennes
Les bactéries sont la cause de plusieurs maladies, la principale maladie bactérienne chez le bananier est la maladie de Moko, causée par Ralstonia solanacearum. Elle provoque le flétrissement des feuilles en commençant par les plus jeunes ainsi que la nécrose du cigare.
Cette maladie se diffuse sous l’action des insectes, par l’intermédiaire d'un sol infecté ou par le contact des racines (Thwaites et al., 2000).
La seule solution actuelle contre cette maladie est l’éradication des plants contaminés (Silva et al., 2000; Ploetz, 2004).
2.3. Maladies virales
Le Bunchy top est la virose la plus grave des bananiers. Le virus responsable de cette maladie est transmis par le puceron Pentalonia nigronervosa. Les plantes infectées par le Bunchy top prennent l’apparence de la rosette avec des stries vert foncées sur la nervure centrale des feuilles (Thomas et al., 1994; Ploetz et al., 2003).
Le virus de la mosaïque du concombre est transmis mécaniquement et par les pucerons. Il provoque une sénescence accélérée des feuilles ainsi qu’une malformation des régimes avec cependant des conséquences économiques moins importants que le Bunchy top (Thomas et al., 1994; Ploetz, 2004).
2.4. Les ravageurs
2.4.1. Les charançons
Le charançon noir (Cosmopolites sordidus) et le charançon du pseudo-tronc (Odoiporus longillis) figurent parmi les plus importants insectes ravageurs des bananiers. Les larves du charançon noir se développent à l’intérieur des cormes alors que celles du charançon du pseudo-tronc se nourrissent des tissus succulents des gaines, dans lesquelles elles creusent des galeries. Il arrive qu’elles dévorent le bourgeon floral en ascension et la hampe florale à l’intérieur du pseudo-tronc (Padmanaban et Sathiamoorthy, 2001).
L’attaque par les charançons entrave le transport des éléments nutritifs et de l’eau et entraîne une baisse importante du rendement (Gold et Messiaen, 2000; Gold et al., 2001; Padmanban et Sathiamoorthy, 2001).
2.4.2. Les nématodes
Plusieurs espèces de nématodes sont associées à la culture du bananier. Mais d’après Kashaija et al. (1999), cinq seulement sont considérés comme les plus destructeurs des bananiers: Radopholus similis, Pratylenchus goodeyi, Pratylenchus coffeae, Helicotylenchus
Des études prospectives ont montré que les nématodes trouvés dans les bananeraies marocaines ont été représentés par plusieurs genres dont les plus importants sont Meloidogyne
spp., Radopholus similis, Helicotylenchus multicinctus, Pratylenchus spp. (Rammah, 1990;
Ferji et Geraert, 1996; Ferji et De Waele, 1998). Cependant d’après Sarah (1989) et Rammah (1990) Radopholus similis et Meloidogyne spp. sont les nématodes les dominants dans les bananeraies marocaines.
2.4.2.1. Radopholus similis a. Répartition géographique
Il est répandu dans les zones de basse altitude d’Afrique centrale et orientale ainsi que dans les Caraïbes. Il est absent dans les zones d’Afrique de l’ouest et en Amérique centrale (Kashaija et al., 1999). Il est également absent des zones d’altitude d’Afrique centrale et orientale et dans les zones subtropicales à climat plus tempéré comme le bassin méditerranéen et les îles Canaries (Sarah et al., 1996). Au Maroc, Radopholus similis est présent dans 50 % des serres (Rammah, 1990). Cette distribution est essentiellement due aux préférences thermiques de cette espère qui se situe entre 24 à 32°C (Sarah et al., 1996).
b. Biologie
Radopholus similis est un endoparasite migrateur qui pond des œufs séparés à
l’intérieur ou à l’extérieur des plants (Speijer et De Waele, 1997). Le cycle biologique se
déroule en 20 à 25 jours (Sarah et al., 1996). Il comprend un oeuf, 4 stades juvéniles et l’adulte (Gowen et Quénéhervé, 1990). Les formes juvéniles et les femelles restent toujours
mobiles et peuvent quitter les racines dès que les conditions ne sont plus favorables. Ces formes vermiformes et migratrices peuvent coloniser de nouvelles souches (Sarah et al., 1996).
Le dimorphisme sexuel est prononcé: chez les mâles la région de la tête est haute en forme de capuchon, plus nettement démarquée du corps, tandis que la sclérotisation céphalique est faible et le stylet est atrophié. Les mâles sont considérés inaptes à parasiter les racines. Chez les femelles la région de la tête est basse, hémisphérique, continue ou légèrement démarquée du corps avec une forte sclérotisation céphalique et, on note, la présence d’un stylet (Sarah et al., 1996; Speijer et De Waele, 1997).
Chaque femelle pond 4 à 5 œufs par jour pendant deux semaines, les œufs éclosent après 8 à 10 jours et les stades juvéniles arrivent au stade adulte en 10 à 13 jours (Gowen et al., 1991).
c. Symptomes et dégâts
Les symptômes aériens sont caractérisés par la chlorose des feuilles et le nanisme des plants (Gowen et Quénéhervé, 1990). Au niveau des racines, ce nématode cause des nécroses profondes qui apparaissent au début sous forme d’un tiret brun rougeâtre. En effet, la pénétration de Radopholus similis se produit à proximité de l’apex des racines. Au fur et à mesure de sa progression inter et intracellulaire, Radopholus similis se nourrit aux dépens du cytoplasme des cellules du parenchyme cortical et provoque la formation de tunnels évoluant en nécroses qui peuvent s’étendre à l’ensemble du bulbe (Sarah et al., 1996).
La destruction des tissus souterrains affecte la croissance des plantes et les rendements ainsi que la chute des plantes suite à la réduction des fonctions mécaniques et physiologiques du système racinaire (Speijer et De Waele, 1997). Les pertes de production dues à
Radopholus similis peuvent atteindre 75 % en associant la réduction du poids des régimes
et la chute des plants (Sarah et al., 1996)
Le pouvoir pathogène est fortement lié à la capacité reproductive dans les tissus. Certaines populations africaines se sont révélées beaucoup plus pathogènes que d’autres originaires des Antilles et du Sri Lanka ou de l’Australie (Speijer et Fogain, 1999; Kashaija et al., 1999).
2.4.2.2. Meloidogyne spp. a. Répartition géographique
Les espèces Meloidogyne incognita et Meloidogyne javanica sont les nématodes à galle les plus associées à la culture du bananier dans la plupart des régions du monde. Ces nématodes sont en très grand nombre lorsque le climat est froid pour que Radopholus similis s’y développe ou lorsque Radopholus similis n’a pas été introduit (De Waele et Davide, 1998). Au Maroc, Ferji et De Waele (1998) ont signalé la présence de Meloidogyne incognita et Meloidogyne javanica dans la totalité des serres prospectées.
b. Biologie
Meloidogyne spp. sont des endoparasites sédentaires. Leur cycle évolutif comprend
deux phases : une phase exophyte qui va de la ponte à la pénétration des larves (J2) dans les racines, et une phase endophyte qui comprend la suite du développement et la reproduction à l’intérieur des tissus de la plante. Les femelles adultes de Meloidogyne spp. pondent les œufs dans une gangue gélatineuse qui les maintient rassemblés. A l’intérieur de cette ponte, on trouve des œufs à divers stades de développement, y compris les larves du premier stade. Ces larves sont vermiformes, d’une longueur de 0.3 à 0.5 mm et d’environ 10 µm de diamètre (De Guiran et Netscher, 1970).
Les larves infectieuses (J2), libres dans le sol, s’orientent vers les extrémités en croissance de la plante hôte, pénètrent au niveau de la zone de différenciation et d’élongation cellulaire des racines. Les larves se déplacent entre et dans les cellules jusqu’au cylindre central le long duquel elles s’immobilisent. Les J2 provoquent des modifications anatomiques avec déformation du tissu vasculaire et l’apparition de cellules géantes polynucléées. La formation de ces cellules géantes perturbe ou bloque les vaisseaux du xylème et la multiplication des cellules corticales entraînant la formation de galles caractéristiques (De Waele et Davide, 1998).
Les juvéniles J2 se nourrissent de ces cellules géantes et muent trois fois pour passer au stade de femelles adultes. A maturité, les femelles sont sacculiformes et la reproduction est parthénogénétique (De Guiran et Netscher, 1970; De Waele et Davide, 1998).
Les femelles sont sphériques à cou étroit tandis que les mâles sont vermiformes; la
région de la tête est haute, conique non démarquée du corps; la queue est courte et hémisphérique. Les juvéniles ont une tête de forme similaire à celle des mâles avec une
faible sclérotisation céphalique et une queue s’amincissant à l’extrémité (Carlier et al., 2002). La durée du cycle de reproduction de Meloidogyne spp. est d’environ 4 semaines à une température de 21 à 27°C (Moumane, 1980).
c. Symptômes et dégâts
Le symptôme primaire, typique d’une infection par Meloidogyne spp. est la présence de galles et le renflement des racines primaires et secondaires (Speijer et De Waele, 1997). Sur la partie aérienne, il n’existe pas de symptômes spécifiques traduisant l’infection par
Meloidogyne spp. ; Il s’agit plutôt d’une déficience générale consécutive à l’infection, la
partie aérienne présente un aspect chétif (De Waele et Davide, 1998).
Le genre Meloidogyne est considéré comme ayant un pouvoir pathogène moins important que celui de Radopholus similis chez le bananier (De Waele et Davide, 1998). Cependant, au Maroc, Sarah (1989) a attribué des pertes importantes de production dues à
Meloidogyne spp.. Concernant les dégâts, aux Philippines une inoculation de 20000 J2 de Meloidogyne incognita a entraîné 57 % de pertes par rapport au témoin (De Waele et Davide,
1998).
2.4.2.3. Méthodes de lutte contre les nématodes du bananier
Les principales méthodes de lutte contre les nématodes consistent à pratiquer l’inondation des terrains durant cinq à sept semaines, des rotations culturales et l’application de nématicides (Gowen et Quénéhervé, 1990).
Au Maroc, les rotations culturales et l’inondation ne peuvent être pratiquées puisque l’essentiel de la production bananière est issue de cultures pluriannuelles en continu sous serres (Guédira et al., 2004). Quant aux nématicides, ils sont coûteux et très nocifs pour l’environnement (Yamashita et Viglierchio, 1987). La nocivité des nématicides est plus dangereuse avec l’emploi du bromure de méthyle (nématicide fumigant) qui est considéré comme un redoutable destructeur de la couche d’ozone d’où la décision de l’interdiction de son utilisation à partir de 2015 (Ouaouichi, 2000). Face à ces menaces, la sélection et la création de variétés résistantes aux nématodes constitue alors une alternative prometteuse.
Chez le bananier, deux sources de résistance à Radopholus similis ont été identifiées principalement chez deux génotype: PJB et Ykm 5 (Wehnt et al., 1978; Speijer et De Waele, 1997; Guédira et al., 2004). Le génotype PJB se compose de variétés diploïdes AA (Wehnt et al., 1978; Sarah et al., 1996) et Ykm 5 est un cultivar du sous groupe Ibota AAA (Binks et Gowen, 1996; Stoffelen, 2000; Bakry, 2001; Vargas et Sandoval, 2005). Cependant ce dernier cultivar qui possède la résistance au nématode Radopholus similis, aux charançons et à la cercosporiose noire ne produit pas de fruits répondant aux critères de qualité indispensables (Pavis et Minost, 1993).
3. Amélioration génétique des bananiers par croisement interpecifique et intergénérique
Le marché international du bananier est trop souvent réduit au seul sous-groupe Cavendish et plus spécialement au cultivar GN (95%) (Loeillet, 1999). De plus, la production bananière est sujette à de très lourdes menaces parasitaires et dont l’unique solution, pour lutter contre certaines maladies, est l’éradication des plantes. Il est donc indispensable, pour éviter une réduction de la production, d’améliorer génétiquement les bananiers. De plus, la parthénocarpie et la stérilité femelle doivent être maintenues et associées à une bonne productivité et une bonne qualité des fruits.
Deux stratégies radicalement différentes ont été mises en œuvre pour améliorer les bananiers: la première vise la création de variétés tétraploïdes; la seconde l’obtention des variétés triploïdes (Bakry et al., 1997; Bakry, 2001; Tomekpe et al., 2004).
3.1. Obtention de variétés tétraploïdes
En dépit de leur forte stérilité, certaines variétés triploïdes produisent de rares gamètes maternels non réduits (n=3x=33) qui, après fécondation avec du pollen d’un géniteur diploïde possédant des caractères de résistance, seront à l’origine de graines contenant des embryons tétraploïdes (Bakry et Horry, 1992; Tomekpe et al., 2004 ).
Cette stratégie a permis d’obtenir au Honduras le clone tétraploïde FHIA-01 de type dessert présentant de bonnes caractéristiques de résistance à la cercosporiose noire, aux nématodes et à la maladie de Panama (Rowe et Rosales, 1993). En dépit de ce succès, Bakry (2001) signale que cette stratégie présente divers inconvénients :
- elle n’est pas applicable au sous groupe Cavendish qui est totalement femelle stérile. - le parent mâle, porteur de la résistance, ne contribue que pour un quart au génome final, seuls les gènes dominants peuvent être exprimés.
- les tétraploïdes obtenus présentent des caractères agronomiques moins intéressants que ceux des triploïdes et le risque de formation de graines dans ses fruits est non négligeable.
3.2. Obtention de variétés triploïdes
Pour l’obtention de nouvelles variétés triploïdes, l’Institut de Recherche sur les Fruits et Agrumes, département du CIRAD, a développé une stratégie basée sur la création de
tétraploïdes à partir du matériel végétal diploïde naturel ou amélioré (Bakry et al., 1990; Bakry, 2001). Ce schéma prévoit, en premier lieu, l’amélioration d’une population de diploïdes par l’apport de gènes de résistance et/ou de caractères agronomiques intéressants. Après sélection, les meilleurs diploïdes sont traités à la colchicine pour induire la formation de tétraploïdes. Le croisement des tétraploïdes avec d’autres clones diploïdes débouche sur la création de nombreux hydrides triploïdes. Grâce à cette stratégie, de nouvelles variétés triploïdes sont obtenues et font l’objet actuellement d’une caractérisation agronomique et physiologique (Bakry, 2001; Tomekpe et al., 2004).
Cette stratégie utilisée par le CIRAD présente des avantages tels que la nature triploïde des hybrides qui leur confère la stérilité souhaitée. Cependant, elle est longue et passe par plusieurs étapes et ne permet pas l’utilisation des variétés stériles.
4. Multiplication in vitro par culture d’apex et d’embryons
Afin de résoudre certains problèmes difficilement contournables par la voie d’amélioration classique des bananiers, il a été envisagé d’introduire dans les programmes de sélection et de multiplication par des techniques de culture in vitro toutes les fois qu’elles s’avéraient être efficaces (Stover et Buddenhagen, 1986; Haïcour et al., 1993; Haïcour et al., 1998).
L’utilisation des techniques in vitro chez le bananier a débuté en 1959 par la multiplication d’apex végétatifs (Barker, 1959) puis en 1960 par la culture d’embryons zygotiques (Cox et al., 1960).
4.1. Culture d’apex
La production de bananiers à partir d’apex isolés a été décrite par Ma et Shii en 1972. Elle s’est ensuite beaucoup développée, permettant d’obtenir la micropropagation de plantes saines dans un laps de temps plus court que la multiplication classique (Berg et Bustamante, 1974; Gupta, 1986; Guédira, 1992; Escalona et al., 2003).
La multiplication de jeunes pousses à partir d’apex est attribuée au démarrage des bourgeons situés à la base des feuilles des explants (Cronauer-Mitra et Krikorian, 1984; Gupta, 1986). Cependant, d’après Bakry (1984a) et Domergue (1990), elle résulterait de la reprise de l’activité du méristème terminal qui se divise pour donner plusieurs pousses et de la
La multiplication des pousses peut aussi être obtenue soit à partir d’apex floraux (Bakry et Rossignol, 1985; Guedira, 1992; Krikoran et al., 1993), soit à partir de micro-sections (400 µm) du corme (bulbe) de vitroplants à partir desquelles des pousses néoformées apparaissent (Okole et Schulz, 1996).
Actuellement, la technique de multiplication in vitro chez le bananier est considérée comme assez bien maîtrisée. Pour réduire le coût de production de la multiplication des pousses de bananier, cette culture peut être réalisée avec l’utilisation de système d’immersion temporaire (Daquinta et al., 2001; Escalona et al., 2003) et aussi en bioréacteur avec immersion permanente (Matsumoto et Brandao, 2002).
Avec un marché annuel proche de 40 millions de vitroplants, le bananier est l’une des plantes de grande culture les plus multipliées in vitro (Haïcour et al., 1998).
Une technique simple de conservation in vitro au froid (15°C) a été mise au point permettant de maintenir les cultures d’apex sur le même milieu pendant 12 à 18 mois (Banerjee et De Langhe, 1985; Dhed’a, 1992). Plus récemment, des protocoles de cryoconservation des méristèmes de bananier ont été mis au point pour assurer le stockage à long terme de cultures de méristèmes (Surga et al., 1999; Panis et al., 2001; Panis et al., 2004). Signalons aussi que, du point de vue agronomique, les vitroplants se distinguent par un développement à la fois plus rapide et plus homogène et par une productivité généralement supérieure à celle obtenue avec du matériel de plantation classique (Robinson et al., 1993; Vuylsteke et Ortiz, 1996).
Plusieurs travaux ont signalé la présence de nombreuses variations morphologiques qui sont obtenues sur des plantes issues de proliférations in vitro (Vuylsteke et al., 1988; Vuylsteke et al., 1991; Israeli et al., 1996; Jambhale et al., 2001). Vuylsteke et al. (1991) ont montré chez le plantain que les variants phénotypiques issus de la multiplication d’apex se révèlent stables aux cours de plusieurs cycles de propagation.
Le taux des variants issus de la culture d’apex est très dépendant du génotype, et du nombre de repiquages sur le milieu de multiplication (Jambhale et al., 2001).
Khayat et al. (1999) ont signalé que la plupart des variations somaclonales des Cavendish entrent dans trois catégories : un type de variants manifeste une hypersensibilité à l’acide gibbérellique (mutant géant), un autre type a une sensibilité réduite au GA (mutant nain) et le troisième type a des feuilles panachées.
Le développement de la micropropagation du bananier nécessite donc une maîtrise de la cause de la non-conformité des vitroplants, ou d’une procédure de tri très performante lors de l’endurcissement des vitroplants.
4.2. Culture d’embryons zygotiques
Les graines de bananiers qui résultent des pollinisations manuelles sont souvent mal formées et parfois immatures.
En pépinière, leur taux de germination est de l’ordre de 0 à 25 % selon les croisements. Le sauvetage d’embryons in vitro a permis d’améliorer ce taux jusqu’à 95 % (Bakry et Horry, 1992). Dans le programme d’amélioration des bananiers, le recours à cette technique a permis d’obtenir de nombreux hybrides (Silva et al., 1999).
5. Embryogenèse somatique et suspensions cellulaires chez le bananier
L’initiation de cals et la mise en place de suspensions cellulaires embryogènes a fait l’objet de beaucoup de travaux ces dernières années. Ces méthodes présentent de nombreux avantages dans la micropropagation et la formation de nouveaux génotypes par sélection de variants ainsi que la culture et la fusion de protoplastes et la transgenèse. Ces techniques sont détaillées dans le paragraphe suivant.
5.1. Définition
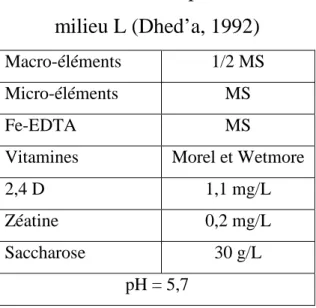
L’embryogenèse somatique est définie comme le processus par lequel une ou des cellules somatiques, dites embryogènes, en conditions expérimentales (actions hormonale, …) peuvent entrer en divisions ordonnées en suivant un modèle identique, ou presque, à celui de l’embryogenèse zygotique (Zrÿd, 1988; Dhed’a, 1992).
Les embryons somatiques sont donc en principe génétiquement identiques aux cellules dont ils proviennent et contiennent le même nombre de chromosomes.
Les embryons somatiques peuvent être distingués des bourgeons adventifs par l’absence de connexions vasculaires avec les tissus mères adjacents. L’embryon somatique est une structure bipolaire présentant simultanément, dès les premières phases de son développement, un pôle racinaire et un pôle caulinaire en continuité montrant ainsi une très
classique, le développement de l’embryon somatique conduit directement à un système racinaire et à une caulogenèse alors que dans le cas du développement d’un méristème, les deux processus sont décalés dans le temps et obéissent à une balance hormonale souvent opposée. Habituellement, les embryons somatiques sont issus de couches superficielles du cal et sont facilement détachables dès le stade globulaire (Ducreux et al., 1998).
5.2. Ontogenèse de l’embryon somatique
L’embryogenèse somatique suppose la possibilité d’induire des embryons à partir d’un génotype sélectionné (induction), de les multiplier (multiplication), de les faire mûrir (maturation), puis de les faire germer en plantules (germination) qui pourront se développer en plantules (conversion) (Paques et Bercetche, 1995) .
5.3. Origine de l’embryon somatique
Les embryons somatiques sont produits à partir de cellules qui ont les caractéristiques des cellules méristèmatiques et non pas à partir des cellules parenchymateuses trouvées dans les cals et les populations cellulaires en suspension. Ces cellules dites embryogènes sont de petite taille, avec un rapport nucléoplasmique élevé (présence d’un ou deux nucléoles volumineux), un cytoplasme dense (réserves protéiques solubles importantes), et un peu de réserves amylacées. La présence de paroi fine ainsi que de nombreuses figures de mitose témoignent de l’activité mitotique importante de ces foyers embryogènes (D’hed’a et al., 1991; D’hed’a, 1992; Georget et al., 2000).
L’embryon somatique peut avoir une origine unicellulaire. Dans ce cas, à partir de cals, de suspensions de cellules ou de protoplastes, le changement de plans de divisions est une première indication d’une formation d’un tissu embryogène (Hepher et al., 1988). Quand l’embryon est d’origine unicellulaire, une division inégale se produit, il en résulte une cellule terminale dont le cytoplasme est riche et une cellule basale très vacuolisée et large. La cellule basale peut ne pas subir de divisions, comme elle peut subir des divisions et être à l’origine du suspenseur (Hepher et al., 1988).
L’embryon somatique peut avoir aussi une origine multicellulaire. Chez le cocotier, Verdeil et al. (1994) ont conclu que l’initiation des embryons est d’origine pluricellulaire et que cette voie est le plus souvent à l’origine de structures embryonnaires incomplètes sans méristème caulinaire.
Chez le bananier, Lee et al. (1997) ont montré que l’embryon somatique issu de sections du corme (bulbe) peut être d’origine unicellulaire à partir de tissu vasculaire ou d’origine multicellulaire à partir de tissus périvasculaires.
5.4. Embryogenèse sur cal
Plusieurs auteurs ont publié des travaux effectués afin de produire des embryons somatiques à partir de tissus végétatifs (Cronauer-Mitra et Krikorian, 1983; Bakry, 1984a; Bakry et Rossignol, 1985; Jarret et al., 1985; Cronauer-Mitra et Krikorian, 1987 ); et de tissus inflorescentiels du bananier (Bakry et Rossignol, 1985; Harran, 1991). Dans certains cas, des néoformations racinaires ou caulinaires à partir de cals ont été obtenues, dans d’autres cas des structures sphériques ressemblant à des embryons somatiques ont été obtenues mais la régénération à partir de ces structures a été obtenues par organogenèse (Cronauer-Mitra et Krikorian, 1987). Les premiers plants régénérés par embryogenèse somatique ont été obtenus par Escalant (1987). Les cultures ont été initiées à partir d’embryons zygotiques immatures âgés de 45 jours après la pollinisation de variétés diploïdes sur milieu contenant 7,5 µM de picloram. Ce résultat est confirmé par les travaux de Escalant et Teisson (1988; 1989).
En Belgique, une équipe de chercheurs (Banerjee et al., 1987; Sannasgala, 1989) a réussi la production d’embryons somatiques chez un cultivar de bananier à triploïde (ABB). Chez ce cultivar, des explants prélevés sur des bourgeons méristèmatiques et cultivés sur milieu liquide agité contenant le 2,4 D, peuvent conduire à la formation de globules méristèmatiques ressemblant à des proembryons, capables d’évoluer en plantes. Plus récemment, Srangsam et Kanchanapoom (2003) ont obtenu à partir de la culture d’apex chez le cultivar Gros Michel un cal friable en présence 1,5 mg/L de 2,4 D. Le repiquage de ce cal sur milieu contenant 2 mg/L de thidiazuron induit la formation d’un cal embryogène dont le développement des embryons évolue selon la voie de l’embryogenèse somatique.
Des cals embryogènes chez le bananier peuvent aussi être obtenus à partir de feuilles ou de tissus de corme (Novac et al., 1989; Lee et al., 1997) et aussi à partir des mains des inflorescences mâles (Chatelet, 1992; Escalant et al., 1994; Côte et al., 1996; Grapin et al., 1996) ou de fleurs femelles (Grapin et al., 1998). Au cours des dernières années, l’attention s’est de plus en plus tournée vers l’établissement de suspensions cellulaires chez le bananier, et la régénération des plants via l’embryogenèse somatique. Les intérêts de cette voie seront
5.5. Suspensions cellulaires chez le bananier
Les suspensions cellulaires sont généralement établies en milieu liquide agité à partir d’un cal friable. Il a été montré qu’il n’existe pas de suspensions cellulaires constituées entièrement de cellules isolées, mais d’un mélange de cellules isolées et d’agrégats cellulaires de dimension variables (D’hed’a et al.,1991; Grapin,1995). Georget et al. (2000) ont montré que la suspension cellulaire embryogène du cultivar GN issue de fleurs mâles est caractérisée par la présence de cinq types de cellules :
- type I : cellules isolées ou petits agrégats (quelques cellules) dont les cellules sont non jointives.
- type II : dit ‘en grappe de raisin’ ce sont des agrégats cellulaires denses et cohérents. - type III : dit ‘agrégat bourgeonnants’ ce sont des agrégats dont le centre est plus au moins dense, et qui bourgeonnent à la périphérie de petits agrégats de couleur claire.
- type IV : dit ‘proembryons’ ce sont des massifs cellulaires denses, prodermisés de forme plus au moins globulaire.
- type V : dit ‘nodules’ de forme sphérique à allongée. Le centre des nodules est constitué de cellules à caractère méristèmatique, alors que les cellules de la couronne externe présentent de nombreux méats. En périphérie les cellules sont totalement vacuolisées et elles n’ont plus du tout de cohésion entre elles. Elles desquament alors et sont libérées dans le milieu.
Les premiers essais pour obtenir des suspensions cellulaires chez le bananier ont été réalisés par Mohan et Steward (1964) qui ont obtenu une culture cellulaire à faible croissance à partir d’un cal produit par les tissus immatures du fruit. D’hed’a (1992) rapporte que des cellules palissadiques avaient été également isolées enzymatiquement par Cronauer-Mitra et Krikorian (1986) à partir de feuilles de bananier. Cependant, dans les deux cas précités, les cultures cellulaires étaient non morphogènes. Ce n’est qu’à partir de 1987 que la première suspension cellulaire embryogène a été établie par Escalant (1987). Actuellement, quatre explants différents sont utilisés pour l’établissement des suspensions cellulaires et la
régénération des plants s’effectue par embryogenèse somatique. Ces méthodes sont indiquées ci-après.