HELENE BARIBAULT
iV
V
UL
/926
,B25Z
REGULATION HORMONALE DE LA PROLIFERATION, DE LA MATURATION ET DE L'EXPRESSION DES CYTOKERATINES DES CULTURES D'HEPATOCYTES EN VOIE DE DIFFERENCIATION.
Thèse présentée
à l'école des gradués de l'Université Laval
pour l'obtention
du grade de Philosophiae Doctor (Ph.D.)
FACULTE DE MEDECINE UNIVERSITE LAVAL
QUEBEC
OCTOBRE 1986
L'élaboration d'un système de culture d'hépatocytes en voie de différenciation a permis d'identifier des combinaisons simples de facteurs de croissance et de différenciation capables de stimuler la prolifération ou la maturation des hépatocytes de façon indépendante ou coordonnée. En réponse à une stimulation mitogénique du EGF, une phosphorylation de la cytokératine A sur le groupement tyrosine est induite rapidement et est associée à une réorganisation des filaments. D'autre part, la dexaméthasone, capable d'induire la maturation des hépatocytes "in vitro", induit une synthèse préférentielle des deux cytokératines majeures, A et D. Par conséquent, les cytokératines semblent impliquées dans les réponses cellulaires induites par l'EGF et sont associées au programme de différenciation des hépatocytes.
Hélène Baribault
La régulation hormonale de la prolifération et de la différenciation cellulaire peut varier selon les types cellulaires ainsi que leur degré de transformation. Le but principal de ce travail était d'élaborer un système de cellules épithéliales en culture primaire et d'étudier les mécanismes de la régulation hormonale de leur croissance en fonction de leur capacité à exprimer certaines fonctions foetales et différenciées.
L'élaboration d'un système de culture d'hépatocytes de rat nouveau-né, en voie de différenciation a permis d'étudier la régulation hormonale de la prolifération et de la différenciation des hépatocytes. Les hépatocytes de rat de 14 jours représentent une population de cellules diploïdes, qui sont synchronisées dans la phase Gi du cycle cellulaire au moment de l'isolement et qui expriment encore des fonctions immatures telle la production d' a-foetoprotéine. Suite à une stimulation par l'EGF et l'insuline ou l'EGF et le glucagon, les hépatocytes de rat de 14 jours ont une plus grande capacité à proliférer que les hépatocytes de rat adulte. Les seuls critères qui distinguent les populations d'hépatocytes de rats nouveau-né et adulte sont leur niveau de ploidie et leur degré de maturation. L'addition de dexaméthasone en présence de ces facteurs de croissance amènent une inhibition sélective de la production d'AFP par rapport à l'albumine, un changement généralement associé à une maturation des hépatocytes. De plus, la dexaméthasone induit une inhibition de la prolifération des hépatocytes en présence de EGF et de glucagon et non en présence d'EGF et d'insuline. Ces résultats mettent en évidence qu'il existe deux sentiers distincts par lesquels l'EGF peut être complémenté pour induire la prolifération des hépatocytes et que la dexaméthasone n'exerce un effet que sur celui utilisé par le glucagon. De plus, la prolifération et la maturation des hépatocytes peuvent être régulées de façon indépendante ou coordonnée. La dexaméthasone est le seul facteur parmi les facteurs testés capable d'induire une maturation des hépatocytes "in vitro". L'addition de DM50 ou de phénobarbital inhibe la prolifération des hépatocytes et permet de maintenir la production d ' -foetoprotéine ainsi que d'albumine.
Parmi les événements induits précocement dans la phase préréplicative suite à une stimulation hormonale, plusieurs changements s'effectuent dans la synthèse, l'organisation et la phosphorylation des cytokératines. En effet,
cytokératine A sur le groupement tyrosine. Des analyses en immunofluorescence à l'aide d'anticorps monoclonaux dirigés spécifiquement contre les cytokératines A et D, anti-CK55 et anti-CK49 respectivement montrent que ce changement dans l'état de phosphorylation de la cytokératine A est associée à une réorganisation des filaments de cytokératines constituées de ces deux cytokératines A et D. D'autre part, la dexaméthasone induit une synthèse préférentielle des deux cytokératines majeures des hépatocytes, les cytokératines A et D. L'EGF n'influence pas cette réponse induite par la dexaméthasone. Cette néosynthèse préférentielle est associée à une inhibition sélective de la production d'a-foetoprotéine par rapport à l'albumine. Ces résultats montrent que les cytokératines sont vraisemblablement impliquées dans les réponses cellulaires induites par l'EGF et la néosynthèse de ces protéines est associée au programme de différenciation des hépatocytes.
Hélène Baribault
Ce travail a été effectué au centre de recherche en cancérologie de 1'Hôtel-Dieu de Québec dans le cadre du programme de doctorat en médecine expérimentale de 11 université Laval, sous la direction du docteur Normand Marceau.
Je remercie en tout premier lieu le docteur N. Marceau pour son soutien constant et ses nombreux conseils au cours de ces années de formation, ainsi que pour son souci permanent d'une stimulation scientifique par des discussions, son incitation à participer à plusieurs congrès scientifiques et les possibilités offertes d1 interagir avec d'autres laboratoires pour compléter les besoins techniques du projet. J'aimerais également mentionner sa disponibilité, son dynamisme et sa célérité, fortement appréciés, pour superviser et reviser 1'ensemble de cette thèse.
Je dois également un grand merci aux docteurs J. Landry et W.Waithe pour le travail souvent ingrat mais combien utile de la relecture des articles et pour avoir régulièrement discuté de 1'avancement des travaux. Leurs conseils m'ont été plus qu'utiles. Je suis de plus reconnaissante au docteur W. Waithe pour avoir accepté le rôle de pré-lecteur de cette thèse.
Je remercie également les correcteurs de cette thèse, les docteur(e)s Francine Denizeau, Christiane Guguen-Guillouzo, Marcel Lalanne et William Waithe, pour le temps qu'ils ont consacré à la lecture critique de ces travaux.
Je remercie également Messieurs D. Mailhot et R. Goyette ainsi que Madame H. Noël qui m'ont initiée à plusieurs techniques utilisées dans le laboratoire ainsi que pour tous les conseils subséquents, leur attention constante à répondre aux questions et à apporter leur aide. Il m'a été très agréable de travailler avec eux et elle ainsi qu'avec les autres étudiant(e)s de ce laboratoire avec qui les échanges scientifiques réguliers ont été indispensables à la bonne marche de ces travaux, je tiens à les nommer : R. Blouin, A.-F. Desrosiers, L. Germain, H. Gourdeau, I. Leroux-Nicollet et S. Samson.
Je tiens également à remercier tous les autres membres du centre de recherche qui m'ont fait profiter de leur expérience et à qui je dois de nombreux encouragements ainsi que de judicieux conseils, tout particulièrement les docteurs L. Bélanger et G. Poirier.
permis de réaliser des expériences en microscopie électronique ainsi qu'à madame L. Bourget qui m'a permis de réaliser des expériences de cytométrie en flux.
Je remercie mesdames E. Lemay et Michelle Gagnon pour leur souci méticuleux et leur célérité dans le travail secrétariat des articles contenus dans cette thèse. Je remercie également les photographes messieurs G. Langlois et P. Paquet pour leur travail de photographie pour les articles et les diverses présentations.
J'aimerais également exprimer ma gratitude à la Société de recherche sur le cancer pour son appui financier, sous forme de bourse de formation, obtenu pendant ces années de travail.
J'aimerais souligner à la suite de ces remerciements, combien il m'a été agréable et enrichissant de participer à la naissance et au développement du centre de recherche en cancérologie de L'Hôtel-Dieu de Québec (On voit déjà l'AFP du bébé diminuer et la ploidie du nombre de chercheurs par laboratoire augmenter). Bien que la formation scientifique soit le but premier du programme de doctorat, l'opportunité supplémentaire de faire partie d'un tel groupe en expansion fut pour moi une expérience unique ainsi qu'une leçon d'initiative, d'entreprise et de dynamisme. La liste des gens que je remercie ici inclurait tous les membres du centre de recherche.
page
RESUME... i
AVANT-PROPOS... iü TABLE DES MATIERES... v
LISTE DES ABREVIATIONS... vii
LISTE DES FIGURES ET TABLEAUX... viii
INTRODUCTION... 1
CHAPITRE I : INTRODUCTION GENERALE 3 1. Croissance et activité fonctionnelle des hépatocytes "in vivo"... 4
2. Hépatocytes de rat en culture primaire... 8
3. Internalisation et traitement des signaux hormonaux... 16
4. Les cytokératines: éléments plausibles d'intégration cytoplasmique... 22
3. Références... 28
CHAPITRE II : REPONSE DIFFERENTIELLE DES HEPATOCYTES DE RATS NOUVEAU-NE ET ADULTE AUX FACTEURS DE CROISSANCE. J. Cell. Physiol. (1985)... 42
CHAPITRE III : EFFETS DISTINCTS DE LA DEXAMETHASONE ET DU DIMETHYL SULFOXYDE SUR LA PROLIFERATION ET LA DIFFERENCIATION DES HEPATOCYTES. J. Cell. Physiol. (1986)... 51
CHAPITRE IV : EFFET DE LA DEXAMETHASONE SUR LA SYNTHESE DES CYTOKERATINES: CORRELATIONS AVEC L'EFFET DE LA DEXAMETHASONE SUR LA DIFFERENCIATION DES HEPATOCYTES. 1. Biochem. Biophys. Res. Comm. (1983)... 60
2. Can. J. Biochem. Cell. Biol. (1985)... 69
CHAPITRE V : EFFET DU EGF SUR LA PHOSPHORYLATION ET L'ORGANISATION DES CYTOKERATINES. CORRELATIONS AVEC L'EFFET DU EGF SUR L'ENTREE EN S DES HEPATOCYTES. J. Cell. Biol, (soumis)... 80
Références... 129
ANNEXES
A. Effet de la dexaméthasone sur la prolifération et la ploidie des
hépatocytes de rat nouveau-né "in vivo"... 130 B. Rôle de l'acide arachidonique et de ses dérivés dans la
prolifération des hépatocytes de rat nouveau-né... 133 C. Effet du phorbol 12-myristate 13-acetate et du phénobarbital sur
la production d'a-foetoprotéine et d'albumine dans les cultures
d'hépatocytes... 139 Références... 141
AFP BSA CK49 CK55 DAG Dex DM50 EGF GGT Glu GRPs HSPs IEF
ig
Ins kD Mr Met PAGE P BS PDGF Pi PMA SDS TAT TGF a -foetoprotéinealbumine sérique de boeuf
cytokératine de 49 000 de poids moléculaire cytokératine de 55 000 de poids moléculaire diacylglycérol
dexaméthasone diméthyl sulfoxyde
facteur de croissance épidermique y-glutamyl-transpeptidase
glucagon
protéines régulées par le glucose
protéines induites par un choc thermique focalisation isoélectrique
immunoglobuline insuline
kilodalton
poids moléculaire apparent méthionine
électrophorèse sur gel de polyacrylamide salin tamponné avec du phosphate
facteur de croissance dérivé des plaquettes point isoélectrique
phorbol 12-myristate 13-acétate sodium dodécyl sulfate
tyrosine aminotransférase facteur de croissance tumoral
page
Chapitre II
Figure 1 Contenu en ADN des hépatocytes de rat nouveau-né et adulte
au moment de l'isolement, mesuré par cytométrie en flux... 44 Figure 2 Cinétique d'entrée en S et en mitose des hépatocytes de rat
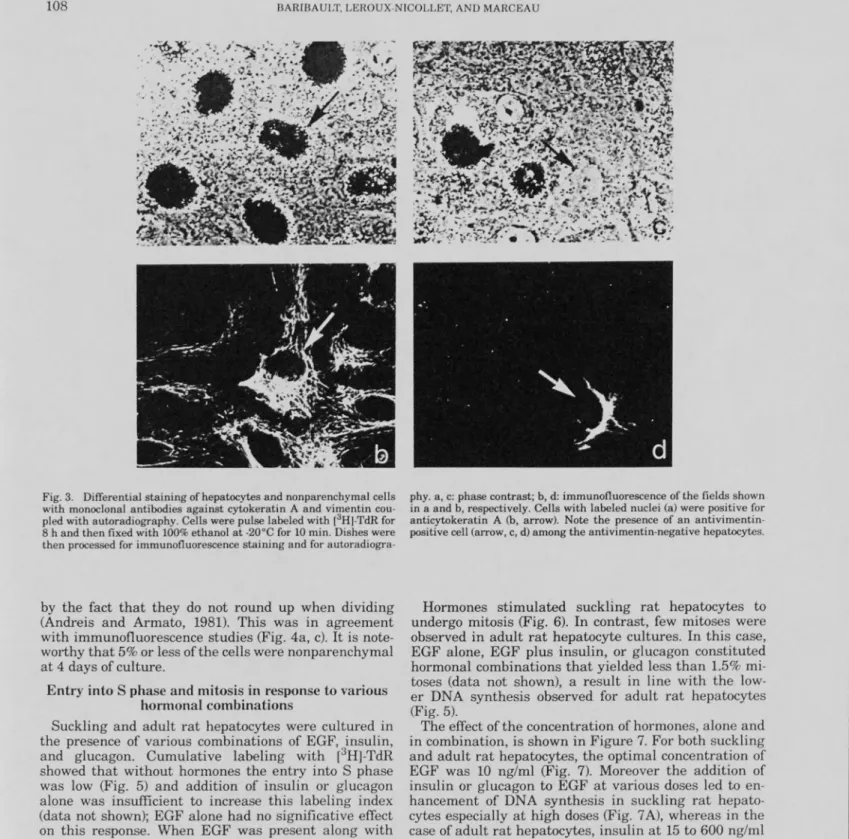
nouveau-né en réponse à une stimulation hormonale... 45 Figure 3 Autoradiographie couplée à une coloration différentielle des
hépatocytes et des cellules non-parenchymateuses avec des
anticorps dirigés contre la cytokératine A et la vimentine... 46 Figure 4 Coloration au Hoescht couplée à une coloration différentielle
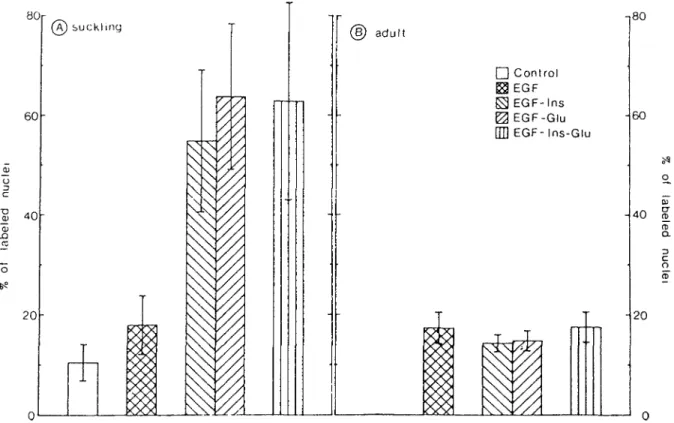
des hépatocytes et des cellules non-parenchymateuses avec des anticorps dirigés contre la cytokératine A et la vimentine... 47 Figure 5 Effets comparés de différentes combinaisons d'EGF, d'insuline
et de glucagon sur 1'entrée en S des hépatocytes de rat
nouveau-né et adulte... 48 Figure 6 Effet de différentes combinaisons d'EGF, d'insuline et de
glucagon sur 1'indice mitotique des hépatocytes de rat
nouveau-né... ... 49 Figure 7 Effet des concentrations de EGF, d'insuline et de glucagon
Chapitre III
Figure 1 Effet de la dexaméthasone sur l'entrée en S des hépatocytes
en présence de différentes combinaisons hormonales... 54 Figure 2 Effet de la concentration de dexaméthasone sur l'entrée en S
et en mitose des hépatocytes en présence d'EGF et d'insuline ou de glucagon... 55 Figure 3 Effet de la dexaméthasone sur la production d'albumine et
d' a-foeto-protéine en présence de différentes conditions de
croissance... 56 Figure 4 Coloration en immunoperoxydase de l'albumine et de
1' a-foeto-protéine dans les hépatocytes de rat nouveau-né
cultivés en présence de dexamethasone ou de DMSO... 56 Figure 5 Induction de la tyrosine amino-transferase par la
dexaméthasone en présence de différentes conditions de
croissance... 57 Figure 6 Effet de la concentration de DMSO sur la synthèse d'ADN des
hépatocytes de rat nouveau-né... 5 7 Figure 7 Effet de la concentration de DMSO sur la production
Chapitre IV.1
Figure 1 Autoradiographie d'un gel d1électrophorèse-SDS de protéines extraites d'hépatocytes de rat adulte cultivés en présence ou
en absence d'EGF, d'insuline et de dexaméthasone... 64 Figure 2 Autoradiographie d'un gel d'électrophorèse-SDS de protéines
totales ou de la fraction résistante au Triton X-100 extraites d'hépatocytes de rat adulte cultivés en présence d'EGF,
d ' insuline et de dexaméthasone... 64 Figure 3 Gels d'électrophorèse SDS et immunodétection après transfert
sur papier de nitrocellulose avec des anticorps dirigés
contre la cytokératine A et D séparément... 65 Figure 4 Autoradiographie d'un gel d'électrophorèse SDS des protéines
marquées à la [35S]-Met d'hépatocytes de rat nouveau-né en présence de difféentes combinaisons d'EGF, d'insuline et de
dexaméthasone... 66 Tableau 1 Effet de différentes combinaisons d'EGF, d'insuline et de
dexaméthasone sur la survie en culture des hépatocytes de rat adulte... 63 Tableau 2 Effet de différentes combinaisons d'EGF, d'insuline et de
dexaméthasone sur la production d'albumine des hépatocytes de rat adulte "in vitro"... 67
Chapitr Figure Figure Figure Figure Figure Figure Figure Figure Tableau Tableau ; IV.2
1 Effet de la concentration d1 insuline et de dexaméthasone sur la synthèse protéique des hépatocytes de rat en culture... 2 Effet de la densité cellulaire et de l'addition d'EGF sur
l'induction par la dexaméthasone de la synthèse des
cytokératines... 3 Effet de la concentration du EGF, sur la synthèse protéique
des hépatocytes de rat nouveau-né... 4 Gels d'électrophorèse SDS de protéines totales ou résistantes
au Triton, extraites d'hépatocytes de rat nouveau-né cultivés en présence de'EGF, d'insuline et d'une forte concentration de dexaméthasone... 3 Analyse en électrophorèse à deux dimensions des protéines
décrites en fig 4... 6 Synthèse des cytokératines après trois jours de culture en
présence d'EGF, d1 insuline et d'une forte concentration de dexaméthasone... 7 Effet de différentes combinaisons d'EGF, d'insuline et de
dexaméthasone sur la morphologie des hépatocytes et sur 1'organisation des cytokératines... 8 Effet de différentes combinaisons hormonales de la densité
cellulaire et de la concentration de dexaméthasone sur la production d1 albumine et d' a-foeto-protéine dans les
hépatocytes de rat en culture... 1 Effet de différentes combinaisons hormonales, de la
concentration de dexaméthasone et de la densité cellulaire sur la synthèse des cytokératines dans les hépatocytes de rat en culture... 2 Effet de la densité cellulaire en présence de différentes
combinaisons hormonales sur 11 entrée en S des hépatocytes en culture... 72 73 75 75 76 76 77 78 74 76
Chapitre V
Figure 1 Effet de 1'EGF sur la synthèse d'ADN des hépatocytes de rat
nouveau-né en culture... 112 Figure 2 Effet de l'EGF sur l'organisation des filaments de
cytokératines... 113 Figure 3 Organisation des filaments de cytokératines dans la phase S
et en mitose... 114 Figure 4 Immunolocalisation des filaments de cytokératines en
microscopie électronique... 115 Figure 5 Effet de l'EGF sur la synthèse et la dégradation des
cytokératines... 116 Figure 6 Marquage des protéines avec du [32p] -orthophosphate. Effet
du EGF et cinétique de phosphorylation... 118 Figure 7 Analyse par électrophorèse en deux dimensions des
phosphoprotéines... 120 Figure 8 Immunoprécipitation de protéines marquées avec de la
[35s]-met et du [32p]-orthophosphate avec anti-CK55... 121 Figure 9 Effet de différentes combinaisons hormonales sur la
phosphorylation de la cytokératine de 55 kD... 122 Figure 10 Analyse des acides aminés marqués avec du
[32p]-orthophosphate de la cytokératine de 55 kD... 123
Annexe A
Figure 1 Analyse par cytométrie en flux du contenu en ADN des
hépatocytes après une injection de dexaméthasone... 131 Tableau 1 Pourcentage du contenu en ADN des noyaux d'hépatocytes
analysé par cytométrie en flux et présenté en Fig. 1... 132 Tableau 2 Poids des rats nouveau-né injectés ou non avec de la
Annexe B
Figure 1 Effet de la dexaméthasone et de 11indométhacine sur la réponse mitogénique des hépatocytes de rat nouveau-né en
culture... 136 Figure 2 Effet de l'acide archidonique sur 1'inhibition de la
prolifération induite par la dexaméthasone et 1'indométhacine 137 Figure 3 Effet de la dexaméthasone sur le relargage de l'acide
arachidonique par les hépatocytes de rat nouveau-né... 138 Tableau 1 Métabolisme de l'acide arachidonique dans des hépatocytes de
rats nouveau-né et adulte en culture... 135
Annexe C
Tableau 1 Effet du PMA et du phénobarbital sur la production d'AFP et d'albumine par des hépatocytes de rat nouveau-né en
Les mécanismes de la régulation hormonale de la prolifération et de la différenciation sont un problème fondamental en physiologie cellulaire. Les cultures d1 hépatocytes constituent un système de choix pour cette étude. En plus de constituer un système de cellules qui à partir d'un état de repos Go, peuvent être réactivées "in vivo" à proliférer d'une façon massive, suite à une hépatectomie partielle, ces cellules peuvent être facilement isolées pour obtenir des populations homogènes de cellules parenchymateuses . Leur mise en culture permet alors d'isoler les différents paramètres qui constituent la complexe interaction des facteurs sériques. De plus, les hépatocytes en culture primaire constituent une population de cellules normales qui n'ont pas été immortalisées en culture suite à une pression sélective induite par des passages successifs .
Les hépatocytes de rat adulte sont très bien caractérisés au point de vue de leur activité fonctionnelle et plusieurs études ont été effectuées sur la nature des facteurs pouvant induire leur prolifération "in vitro". Toutefois peu d'études ont été effectuées sur le mécanisme d'action de ces facteurs dans les hépatocytes en fonction de leur état de maturation.
Les travaux présentés dans cette thèse portent sur la régulation hormonale de la prolifération et de la maturation des hépatocytes de rat en voie de différenciation. Ces hépatocytes, isolés de rat de 14 jours sont diploïdes, synchronisés dans une phase non-réplicative du cycle cellulaire, Gi, au moment de 1'isolement et expriment des fonctions immatures telle la production d1 a-foetoprotéine. Cette protéine est considérée comme un marqueur de la différenciation des hépatocytes et sa production peut être mesurée en culture.
Ces travaux ont permis d'élaborer un système capable de mimer une régulation hormonale de la maturation des hépatocytes "in vitro". De plus, ces travaux suggèrent que les filaments de cytokératines, structure cytosquelettique retrouvée uniquement dans les cellules épithéliales, sont impliqués dans le programme de différenciation des hépatocytes et dans leur réponse à une stimulation mitogénique. Ces travaux dressent le tableau de la régulation des cytokératines en réponse à des facteurs de croissance et de différenciation dans des cellules épithéliales normales en culture.
(chapitres 2, 3 et 4) ou soumis pour publication (chapitre 5). Le chapitre 1 fera état de la littérature et des connaissances entourant ce projet.
CHAPITRE I
INTRODUCTION GENERALE
1.1 Croissance et activité fonctionnelle des hépatocytes "in vivo" -changements au cours du développement hépatique
-modèle expérimental de la croissance cellulaire -modèle expérimental de la maturation
1.2 Hépatocytes de rat en culture primaire
-isolement et organisation des hépatocytes en unités fonctionnelles -facteurs promoteurs de la prolifération
-facteurs promoteurs de la différenciation
1.3 Internalisation et traitement des signaux hormonaux. -induction d1 événements membranaires précoces
-activation sélective d'événements cytoplasmiques.
-intégration cytoplasmique et transmission au noyau des signaux hormonaux.
1.4 Les cytokératines: éléments plausibles d'intégration cytoplasmique -structure et organisation des filaments de cytokératines
-expression des cytokératines
-cytokératines versus différenciation et prolifération
1.1 Croissance et activité fonctionnelle des hépatocytes "in vivo" -changements au cours du développement hépatique
-modèle expérimental de la croissance cellulaire -modèle expérimental de la maturation
Croissance et activité fonctionnelle des hépatocytes "in vivo"
Changements au cours du développement hépatique
Les hépatocytes apparaissent dans le diverticule hépatique comme un type cellulaire distinct vers le 12e jour de gestation chez 1 ' embryon de rat (Greengard et coll., 1972). Pendant la période foetale les hépatocytes produisent de 11 a-foetoprotéine "AFP" (Bélanger et coll., 1983) et expriment plusieurs activités enzymatiques typiques du stade foetal, telle la gamma-glutamyl transpeptidase "GGT". Après la naissance, les hépatocytes s'engagent dans un processus de maturation, qui se caractérise par la perte de ces enzymes foetales et de production d1 AFP d'une part et par l'acquisition d'un phénotype mature qui sera conservé dans les hépatocytes du foie de rat adulte d'autre part. La production d'albumine et l'activité de la tyrosine aminotransférase sont des fonctions typiques de cet état mature. De plus, cette maturation est accompagnée d'un phénomène de ploïdisation associé à une diminution de la prolifération.
Chez l'adulte, les hépatocytes constituent 60 % des cellules hépatiques, cependant à eux seuls, ils représentent 90% du volume du foie (McGowan, 1986). Les hépatocytes exercent un rôle central dans le métabolisme hépatique. Ils
sont responsables des activités enzymatiques de la glycolyse, la gluconéogénèse, la glycogénogénèse et la glycogénolyse ainsi que du métabolisme et la détoxication des drogues (pour revue: Hue et Girard, 1986; Guillouzo, 1986a; Kremers, 1986). De plus, les hépatocytes ont une fonction endocrine importante et produisent 90% des protéines sériques. Cette production est constituée principalement d'albumine mais également de plusieurs facteurs de croissance et hormones (pour revue: Guillouzo, 1986b; Yeoh, 1986).
Une reprise de la prolifération des hépatocytes "in vivo", soit durant la régénération du foie suite à une hépatectomie partielle (Van Noorden et coll. 1985), ou pendant la formation de foyers prénéoplasiques, peut amener les hépatocytes à réexprimer des fonctions foetales, la fraction la plus active dans ces processus étant les cellules diploïdes (Schwarze et coll., 1986)
Modèle expérimental de la croissance cellulaire
Une des propriétés les plus spectaculaires du foie de rat adulte est certainement sa capacité de sa regénérer entièrement, suite à une hépatectomie
partielle pouvant aller jusqu'à 90% de la résection du foie (Gaub et Iversen, 1984). Quoique les mécanismes et les facteurs régulant cette prolifération massive ne soient pas encore identifiés, une expérience de perfusion réciproque d'un rat hépatectomisé avec un rat non-traité, a montré que le signal induisant cette prolifération est un facteur sérique (Moolton et Bucher, 1967). Bien que 1'action de ce facteur s'exerce de façon presque exclusive sur le foie, une induction de la prolifération des tissus extrahépatiques est observée également après 1'hépatectomie (Bûcher et coll., 1971) L'EGF, l'insuline et le glucagon sont parmi les facteurs pouvant induire la prolifération des hépatocytes "in vivo" et "in vitro" (Bûcher et coll., 1978, 1979; Richman et coll., 1976; Friedman et coll., 1981; Mc Gowan et coll., 1981, 1983; Tomita et coll., 1981). De ce fait, il est probable que ces facteurs soient impliqués dans la régulation de la régénération du foie. Les différentes approches utilisées pour essayer d'identifier ce facteur seront présentées dans la section 1-2: facteurs promoteurs de prolifération
La régénération du foie est souvent considérée comme un des modèles "in vivo" le plus représentatif de 1'activation dans le cycle cellulaire à partir d'un état Gq ou de repos (pour revue: Baserga, 1985). En effet, à l'état normal, la proportion des hépatocytes actifs dans le cycle cellulaire est de l'ordre de 2%. Suite à une hépatectomie partielle, tous les hépatocytes font au moins un cycle cellulaire, et une fraction d'entre eux en effectue un deuxième. Il faut noter cependant que le temps nécessaire pour réactiver les hépatocytes dans le cycle cellulaire, i.e. la période préréplicative, augmente en fonction de l'âge du rat et la fraction des hépatocytes qui seront activés diminue avec le veillissement de l'animal. La ploïdisation est un phénomène qui se poursuit tout au long du vieillissement et la fraction des cellules diploïdes assurent toujours la plus grande partie de 1'activité de prolifération (pour revue : Brodsky et Uryvaeva, 1978).
Modèle expérimental de la maturation
Autour de la deuxième semaine après la naissance, s'effectue une grande partie du processus de maturation des hépatocytes. Pendant cette période, la prolifération diminue et est suivie d'un phénomène de polyploïdisation. Vers le 17G ou 18e jour des cellules binucléées sont présentes et plus tard, les cellules mononucléées tétraploïdes. L'AFP diminue graduellement à partir de la
deuxième semaine, pour atteindre un niveau résiduel à 11 âge adulte (pour revue Bélanger et coll., 1983).
Des injections "in vivo" de dexaméthasone à des rats nouveau-nés inhibent rapidement l'expression d'AFP et induisent selon ce critère une maturation précoce des hépatocytes (Bélanger et coll., 1981). Ces résultats suggèrent gue les glucocorticoïdes sont impligués dans la régulation de la maturation des hépatocytes. Suite à ces injections, les hépatocytes sont arrêtés dans la phase Gi du cycle cellulaire. Ces observations seront présentées en annexe A.
Bien que plusieurs études sur la prolifération des hépatocytes de rat adulte aient été effectuées, la relation qui existe entre la capacité des hépatocytes à proliférer en fonction de leur maturation est peu documentée. De plus, peu d'études ont été effectuées sur la maturation des hépatocytes "in vitro". Le chapitre 2 présente l'élaboration d'un système de culture d'hépatocytes diploïdes en voie de différenciation et maintenus dans des conditions identiques à celles utilisées pour les hépatocytes de rat adulte. La capacité de ces cellules à proliférer en réponse à différentes stimulations hormonales a été comparée à celle des hépatocytes de rat adulte. Les seuls critères distinguant ces deux populations étant leur état de maturation et leur niveau de ploïdie.
1.2 Hépatocytes de rat en culture primaire
-isolement et organisation des hépatocytes en unités fonctionnelles -facteurs promoteurs de la prolifération
Hépatocytes de rat en culture primaire
Le terme "culture primaire" désigne généralement la culture "in vitro" de cellules fraîchement isolées, sans passage successif après trypsine. La reconstitution d'un environnement physiologique adéquat permet à ces cellules d'exprimer à long terme des fonctions différenciées typiques ou d'effectuer quelques divisions cellulaires et même dans certains cas, quelques passages successifs préalablement à l'apparition d'un phénomène de sénescence cellulaire. Contrairement aux cellules établies en lignées, ces cellules n'ont pas subi le processus d'immortalisation en culture.
Cependant, bien que les systèmes de culture primaire s'approchent plus d'une situation physiologique que les lignées établies, ils requièrent également des conditions plus élaborées pour leur maintien en culture (pour revue: Reid et Jefferson, 1984). Ce n'est que récemment que les conditions permettant leur maintien en culture ont été mieux définies. Par exemple, le besoin en fibroblastes des kératinocytes a été remplacé par une matrice extracellulaire secrétée par les fibroblastes, le besoin en macrophages des lymphocytes T est médiée par une stimulation paracrine et des facteurs tels le phénobarbital (Miyazaki et coll., 1985) et le DMSO (Isom et coll., 1985) sont capables de mimer l'effet d'une co-culture pour les hépatocytes.
Isolement et organisation des hépatocytes en culture en unités fonctionnelles.
La mise au point de la perfusion du foie à la collagénase en deux étapes par Seglen (1976) a ouvert la possibilité d'isoler et de mettre en culture une population homogène d'hépatocytes, ayant un haut taux de viabilité après 1'isolement (90%). L'élaboration subséquente de systèmes de culture a permis de reproduire ou de mimer de mieux en mieux une situation physiologique. L'élaboration de milieux définis, 1'identification, la purification et la caractérisation de facteurs solubles (McGowan, 1986) ainsi que la reconstitution des matrices extracellulaires pour la culture en monocouche (Reid et coll., 1936), la co-culture des hépatocytes avec une lignée de cellules épithéliales hépatiques peu différenciées (Guguen-Guillouzo, 1986) et la culture en sphéroïdes (Landry et coll., 1985) ont permis d'induire soit une prolifération des hépatocytes ou le maintien des
activités fonctionnelles. Ces conditions de culture sont capables de reproduire en peu de temps 11 organisation observée "in vivo". Ainsi la culture en monocouche rappelle les feuillets dont le foie est constitué et les coupes d'hépatocytes en sphéroïdes permettent d'observer des structures hépatiques qui se sont reformées en culture.
Récemment, des études ont montré que 1'addition d'agents chimiques tels le DMSO (Isom et coll., 1985) et le phénobarbital (Miyazaki et coll., 1985) à des hépatocytes en culture permettait un maintien de durée et de qualité équivalentes à celles typiques de la co-culture et de la culture en sphéroïdes. Bien que ces agents exercent un effet bénéfique, leur équivalent physiologique n'est pas encore connu.
Facteurs promoteurs de la prolifération
Moolton et Bucher (1967) ont montré par une expérience de perfusion réciproque d'un rat hépatectomisé et d'un rat non-traité que le ou les facteur(s) responsable(s) de la régénération du foie est(sont) de nature humorale. Depuis, trois différentes approches ont été utilisées pour essayer d'identifier le principe actif de la régénération: doser les concentrations sériques avant et après hépatectomie des différents facteurs de croissance connus, fractionner des sérums de rat prélevés avant et après hépatectomie pour isoler un facteur capable de stimuler la prolifération des hépatocytes "in vitro" et enfin, tester la capacité des hépatocytes à proliférer en réponse à différents facteurs déjà connus pour leur action mitogénique sur d'autres types cellulaires (pour revue : McGowan, 1986).
Facteur de croissance épidermique (EGF)
L'EGF est un facteur de croissance isolé des glandes sous-maxillaires. Il a été baptisé du nom de EGF, "Epidermal Growth Factor", pour avoir été découvert par son action sur la couche épithéliale des yeux de souris (pour revue, Carpenter et Zendegui, 1986). Plus tard, un facteur homologue a été isolé de l'urine humaine (EGF-urogastrone). L'EGF exerce un effet mitogénique sur les hépatocytes (Richman et coll., 1976) et sur plusieurs autres types cellulaires (faketani et Oka, 1983a et 1983b; Westermark et Westermark, 1982; Wharton et coll., 1983). Son récepteur est une glycoprotéine membranaire de 170 kD qui a une activité tyrosine kinase (Ushiro et Cohen, 1980). Le premier
substrat du récepteur est lui-même, i.e. sous 11 action du facteur de croissance, le récepteur s1 autophosphoryle. Il existe une homologie entre le produit de 11 oncogène erb-b et le récepteur du EGF (Ullrich et coil., 1984). De plus, le TGF-a, un facteur secrété par certaines cellules tumorales a une activité similaire à celle du EGF (Lee et coll., 1985).
L'insuline et le glucagon
Ces deux hormones pancréatiques sont généralement considérées comme antagonistes, quant à leur action sur la glycolyse et la gluconéogénèse. Toutefois, elles induisent de façon équivalente la prolifération des hépatocytes (Friedman et coll., 1981). Le récepteur de 11 insuline est une glycoprotéine de 190 kD qui, comme le récepteur du EGF, a une activité tyrosine kinase dont il est lui-même le principal substrat. Le récepteur du glucagon est une glycoprotéine de 65 kD (Herberg et coll., 1984; Iyengar et Herberg, 1984). Des résultats récents ont montré que la liaison du glucagon à son récepteur activait deux sentiers distincts, l'un lié à 1'activation de 1'adénylate cyclase et l'autre lié à 1'activation du métabolisme des phospho inositols (Wakelarn et coll., 1986). Il est intéressant de noter qu'au cours du développement le rapport entre la concentration sérique de ces deux hormones se modifie (Beaudry et coll., 1977). Une forte concentration de glucagon est notée pendant la période qui précède le sevrage de l'animal. Ce rapport s'inverse lorsque l'animal devient adulte. Il s'inverse à nouveau lors de la régénération du foie suite à une hépatectomie partielle, reprenant ainsi des concentrations s'approchant de ce qui est observé chez le rat nouveau-né.
Norépinéphrine
La norépinéphrine peut complémenter l'effet de l'EGF pour stimuler la synthèse d'ADN dans des hépatocytes de rat adulte en culture (Cruise et Michalopoulos, 1985; Cruise et coll., 1985 et 1986). Cet effet de la norépinéphrine est médié par les récepteurs ^-adrénergiques. Le nombre de récepteurs a l'EGF diminue lors de cette stimulation par la norépinéphrine. Une augmentation dans le niveau de calcium intracellulaire libre ainsi qu'une activation du métabolisme des phosphoinositides sont également observées en réponse à la norépinéphrine.
Facteur plaquettaire
Russell, McGowan et Bûcher (1984a, 1984b) ont récemment purifié un facteur de 65 kD, isolé des plaquettes, capable d'induire la prolifération des hépatocytes de rat adulte, en culture. Ce facteur est différent du PDGF (facteur de croissance dérivé des plaquettes) bien qu'ayant certaines propriétés biologiques semblables. Ce facteur plaquettaire de 65 kD semble assez spécifique d'espèce puisque seul le sérum de rat permet cet effet mitogénique pour les hépatocytes de rat. Il faudra attendre une plus grande caractérisation de ce facteur pour comprendre son mécanisme d'action.
Facteur de croissance tumoral-8 (TGF-3)
Le TGF-3 est un facteur produit par des cellules tumorales mais qui se retrouve aussi normalement dans les plaquettes. Ce facteur induit la stimulation autocrine des cellules tumorales, ce qui le classe parmi les facteurs de croissance (pour revue: Sporn et coil., 1986). Cependant, ce même facteur inhibe complètement la synthèse d'ADN dans les hépatocytes en culture primaire (Hayashi et Carr, 1985). Comme nous le verrons également avec le PMA, certains facteurs stimulent ou inhibent la prolifération selon le type cellulaire, et induisent ou non une différenciation plutôt qu'un comportement de cellules transformées. Aucune étude n'a été effectuée pour connaître l'effet du TGF-3 sur la maturation des hépatocytes lorsque leur prolifération est inhibée.
Facteurs promoteurs de la différenciation
Les facteurs impliqués dans le développement et dans le maintien de l'activité fonctionnelle des hépatocytes sont beaucoup moins bien caractérisés que les facteurs de croissance. Bien que la co-culture des hépatocytes avec des cellules épithéliales peu différenciées ou la culture en sphéroïdes permettent le maintien à long terme des hépatocytes en culture, le principe actif n'est pas encore connu. D'autre part, l'injection "in vivo" de dexaméthasone est capable d'induire une inhibition rapide de la production d'AFP (Bélanger et call., 1981), la synthèse d'ADN est alors complètement inhibée et les hépatocytes restent dans un état Gq (Baribault, non-publié, cf. annexe A).
Glucocorticoïdes
Des injections de dexaméthasone "in vivo" inhibent la croissance des hépatocytes de rat nouveau-né et induisent une maturation précoce du foie (Bélanger et coll., 1983). "In vitro", la dexaméthasone favorise l'attachement des hépatocytes au substrat et ainsi que la production de fibronectine (Marceau et coll., 1978). Cette hormone n'exerce aucun effet sur la prolifération des hépatocytes de rat adulte en culture (McGowan, 1986).
La dexaméthasone, un analogue synthétique de 11 hydrocortisone, est environ 1000 fois plus effectif. Le récepteur des glucocorticoïdes est cytoplasmique et semble être transporté au noyau après la liaison de l'hormone à son récepteur. Le modèle le plus accepté aujourd'hui est que ce complexe hormone-récepteur va se lier de façon spécifique dans les régions régulatrices de certains gènes comme celui de l'AFP (Turcotte et coll., 1985) et de la TAT (tyrosine aminotransferase) (pour revue: Duval et coll., 1983). Il faut cependant souligner que la dexaméthasone peut exercer des effets génomiques et non-génomiques et ce de façon indépendante. La nature des événements conduisant à l'inhibition de la synthèse d'ADN par la dexaméthasone n'est pas connue. L'étude de l'effet de la dexaméthasone sur la prolifération des hépatocytes en voie de différenciation ainsi que de son mécanisme d'action seront présentés dans le chapitre 3 et complétés par l'annexe 3.
Diméthyl sulfoxyde (DMSO)
Des concentrations aussi élevées que 2%(v/v) (0.28 M) sont utilisées pour induire la différenciation des tératocarcinomes (McBurney et coll., 1982), et des lignées de cellules érythroleucémiques HL-60 (Yen, 1985). Récemment, Isom et coll., (1985) ont montré que 2%(v/v) (0.28 M) de DM50 permet la survie des hépatocytes de rat adulte pendant une période de deux mois. Bien que les mécanismes d'action du DMSO soient inconnus, des concentrations aussi élevées que 15% (v/v) (2.1 M) de DMSO induisent une phosphorylation importante du récepteur au EGF (Rubin et Earp, 1983). Le DMSO est principalement connu comme solvant organique et semble également induire une plus grande fluidité membranaire.
Phénobarbital
Le phénobarbital est bien connu pour son action promotrice dans 11hépatocarcinogénèse (Hanigan et Pitot, 1985). Guillouzo et coll., (1978) avaient déjà rapporté un effet bénéfique du phénobarbital sur le maintien des hépatocytes en culture dans un système de culture d'organe, d'une fraction de foie de rat naissant (12 et 36 h). Cependant, ce n'est que récemment que le phénobarbital a été utilisé dans les cultures d'hépatocytes en monocouche. Sa présence permet le maintien en culture des hépatocytes ainsi que leur activité fonctionnelle pendant environ 60 jours (Miyazaki et coll., 1985). Les mécanismes par lesquels le phénobarbital induit un tel effet sont encore inconnus.
Le phorbol 12-myristate 13-acétate (PMA)
Le phorbol-myristate acétate, PMA, est appelé également TPA (12-0-tetradecanoyl phorbol 13-acétate). Ce facteur est capable d'agir comme un facteur promoteur de la carcinogénèse (Slaga et coll., 1982). "In vitro", le PMA peut agir comme facteur de différenciation lorsqu'il est ajouté à des lignées érythroleucémiques, et stimuler la croissance pour certains autres types cellulaires (Taketani et Oka, 1983). Son action sur les hépatocytes est encore mal définie. Le récepteur du PMA est aussi une protéine kinase, la kinase C, dont l'activité est dépendante du calcium et des phospholipides et spécifique à la thréonine et à la sérine (Cochet et coll., 1984). L'équivalent physiologique du PMA pourrait être le diacylglycérol relargué lors d'une stimulation avec des facteurs de croissance et capable d'activer la même kinase C (Castegna et coll., 1982). Bien que la présence de la kinase C ait été observée dans le foie, bien qu'en faible quantité (Girard et coll., 1986) peu ou pas d'études de la kinase C sur une population homogène d'hépatocytes isolés ont été rapportées.
La classification de ces facteurs en facteurs de croissance et de différenciation est ici quelque peu arbitaire, car certains facteurs tels le PMA et le TGF-6 peuvent agir comme facteur promoteur et inhibiteur de prolifération ainsi que comme facteur de différenciation dependant du type cellulaire utilisé, de son caractère de normalité, ainsi que de l'interaction avec d'autres facteurs du milieu défini. IL faut également distinguer les facteurs capables de maintenir un état différencié tels le DMSO et le
phénobarbital des facteurs capables d'induire une maturation cellulaire comme la dexaméthasone.
Les hépatocytes de rat nouveau-né représentent une population de cellules épithéliales normales et en voie de différenciation. Les travaux présentés dans le chapitre 2 et en annexe III portent sur l'effet de différentes combinaisons de facteurs de croissance et de différenciation sur la prolifération et sur la maturation de ces cellules en culture.
1.3 Internalisation et traitement des signaux hormonaux. -induction d'événements membranaires précoces
-activation sélective d'événements cytoplasmiques.
Internalisation et traitement des signaux hormonaux
L1 addition de facteurs de croissance ou d1 hormones stimule les hépatocytes fraîchement isolés au repos à dupliquer leur ADN et à subir une division cellulaire subséquente. De la même façon, l'addition de certains facteurs peut amener des changements transcriptionnels associés à un phénomène de différenciation.
Plusieurs approches ont été utilisées pour déterminer la séquence d'événements qui permet à un facteur hormonal d'induire des changements au noyau soit en vue de la réplication de 1'ADN, soit pour amener des changements transcriptionnels. Il faut déjà distinguer à ce stade, les facteurs de croissance peptidiques qui ont un récepteur membranaire, souvent de nature glycoprotéique, comme 11 EGF, 1'insuline et le glucagon, des hormones stéroïdiennes qui ont des récepteurs cytoplasmiques. Dans ce dernier cas, le complexe hormone-récepteur est directement transporté au noyau où il se lie de façon spécifique à des régions régulatrices du génome.
Induction d'événements membranaires précoces
La liaison d'un facteur de croissance à son récepteur membranaire active en quelques minutes toute une série d'événements membranaires. Parmi ces événements, il y a 1'agglomération et 1'internalisation rapide des complexes hormones-récepteurs, 1'induction d'une phosphorylation du récepteur et de certains substrats p81 et p36, deux protéines de poids moléculaire de 81-k et 36-k respectivement, 11 activation du métabolisme des phosphoinositols, des changements dans les niveaux intracellulaires de calcium, d'AMPc et de protons (pour revue: Nishizuka, 1986). Principalement à cause de leur rapidité, ces changements sont possiblement impliqués dans la cascade d'événements conduisant à la synthèse d'ADN. Il faut noter également que les changements induits diffèrent selon le facteur de croissance utilisé. Ainsi 1'addition d'EGF à des hépatocytes, induira rapidement une phosphorylation de son propre récepteur (Ehrhart et coll., 1983) ainsi qu'une augmentation dans la concentration intracellulaire de calcium libre (Woods et coll., 1986). Par contre, le glucagon permettra 1'activation de 1'adénylate cyclase (Wakelam et coll., 1986). Les changements induits varient également selon le type de cellules
Figure 1
utilisées. Par exemple le récepteur du EGF peut être couplé à la kinase C en une régulation réciproque chez certains types cellulaires, alors qu'il peut être régulé de façon tout à fait indépendante pour d'autres types cellulaires (Hunter 1986).
Le modèle qui a retenu le plus d'attention au cours des dernières années est le modèle proposé par Nishizuka (1983). Selon ce modèle un facteur de croissance agit en induisant le métabolisme des phosphoinositides, qui induit à son tour le relargage du diacylglycérol (DAG). Le DAG se lierait à la kinase G de laquelle découlerait une cascade de phosphorylation conduisant à la synthèse d'ADN, cf. fig 1 (figure tirée de Bell, 1986; pour revue Nishizuka, 1986). La nature même des événements membranaires peut varier quelque peu d'un type cellulaire à l'autre. Exton (1986 et Cbarest et coll., 1983) est certainement celui qui a le mieux caractérisé les particularités des cellules du foie à ce niveau. Toutefois ce modèle n'identifie pas encore de second messager au-delà de la membrane plasmique et il est difficile de dissocier parmi les différents effets induits par une stimulation hormonale, lesquels sont directement impliqués dans l'initiation de la synthèse d'ADN. La kinase C n'est retrouvée qu'en très faible quantité dans le foie et il faudra attendre
des études sur 11 abondance relative et de 11 activité de la kinase C sur des populations homogènes d1 hépatocytes pour évaluer si ce modèle peut s'appliquer à leur croissance.
Activation sélective d'événements cytoplasmiques
Les événements membranaires induits suite à la liaison d'un facteur de croissance sont relativement bien caractérisés, toutefois la signification physiologique de ces changements et leur relation à la réponse cellulaire induite sont encore obscures. Les intermédiaires cytoplasmiques de l'action hormonale sont encore moins bien connus. Cependant l'analyse des facteurs peptidiques dont la transcription ou la synthèse est induite suite à une stimulation hormonale a permis de cerner certaines familles de protéines plus susceptibles de jouer un rôle important dans la réponse cellulaire aux signaux mitogéniques. Pledger et coll. (1981) ont mis en évidence plusieurs protéines dont la synthèse était stimulée par le PDGF. Les protéines du choc thermique qu'on appelle aussi protéines de stress ainsi que les protéines régulées par le glucose "GRPs" sont induites par des glucocorticoïdes et certaines hormones de croissance (Kasambalides et Lanks, 1983; pour revue Lanks, 1986). Des résultats semblables ont été observés lors d'une stimulation des hépatocytes en culture par la dexaméthasone (résultats non-publiés). L'observation qu'une des protéines du choc thermique soit un catalyseur normal de la formation du complexe stéroïde-récepteur (Sanchez et coll., 1985) renforce 1'hypothèse que les HSPs et les GRPs ne sont pas seulement des protéines impliquées dans la réponse cellulaire au stress mais sont aussi impliquées dans la performance normale de fonctions reliées à la prolifération et à la différenciation cellulaire.
Parmi les événements cellulaires rapidement induits par une stimulation hormonale se retrouve également 1'activation des oncogènes cellulaires (Goyette et coll., 1984; Greenberg et Ziff, 1984). Ces "gènes du cancer", ont vraisemblablement un rôle à jouer dans la régulation normale de la prolifération et de la différenciation. Non seulement ces gènes sont capables d'induire la tumorigénicité chez des cellules non-tumorigéniques en lignées établies, mais de plus des découvertes récentes montrent que le produit de certains oncogènes cellulaires correspond à des protéines essentielles à la__. prolifération et différenciation cellulaires: les produits de erb-a, erb-djet ..
sis sont le récepteur des oestrogènes (Krust et coll., 1986) , le récepteur du EGF (Ullrich et coll., 1984) et le facteur de croissance PDGF (Doolittle et coll., 1983; Waterfield et coll., 1983) respectivement. L'équivalent cellulaire de plusieurs autres oncogènes n'ont pas encore été identifiés. Cependant, l'hypothèse la plus probable est que les produits de ces gènes sont des protéines ayant des rôles clés dans la cascade d'événements menant à la prolifération cellulaire et la différenciation (pour revue: Weinberg, 1985; Baserga, 1985).
Les oncogènes ont été découverts en premier comme les gènes viraux responsables de la transformation induite par les virus à ARN ou rétrovirus. Des séquences homologues mais non identiques ont été trouvées dans le génome normal des cellules de mammifères. On les dénomme les oncogènes cellulaires ou proto-oncogènes. Lorsqu'ils sont introduits dans le génome de cellules normales comme les NIH 3T3 par exemple, ils sont aussi capables d'induire une transformation néoplasique. Ces proto-oncogènes sont également exprimés au cours du développement tôt dans l'embryogénèse, pendant la régénération du foie (Goyette et coll., 1984) et en culture au cours de l'activation de plusieurs cellules de mammifères dans le cycle cellulaire.
Il est aussi intéressant de noter que certains oncogènes (e.g. fos) lorsqu'ils sont introduits dans des cellules en culture peuvent induire une différenciation de ces cellules (Müller et Wagner, 1984). Ces résultats suggèrent un rôle non seulement dans la régulation de la prolifération mais aussi dans la régulation de la différenciation cellulaire.
L'étude des protéines dont la synthèse est induite spécifiquement en réponse à une stimulation hormonale et l'étude des oncogènes ont permis d'identifier certaines molécules plus susceptibles de jouer un rôle dans la séquence d'événements menant à des changements au niveau de l'ADN: GRPs et HSPs, protéines induites par le PDGF et oncogènes. Toutes ces molécules n'ont peut-être pas un rôle essentiel à jouer dans cette séquence mais cette approche permet d'en cerner de mieux en mieux les éléments essentiels.
Dans les hépatocytes, la synthèse des cytokératines est grandement modulée par une stimulation hormonale. Ces résultats et leur signification seront présentés dans le chapitre 4.
Intégration cytoplasmique et transmission au noyau des signaux hormonaux.
Bien que les événements membranaires induits par une stimulation hormonale et plusieurs éléments cytoplasmiques soient assez bien caractérisés, la nature du signal transmis au noyau et la régulation de son acheminement sont encore inconnues. Parmi les événements rapides induits par une stimulation hormonale, s'effectuent des changements importants dans la forme cellulaire et une réorganisation complète des éléments du cytosquelette. Plusieurs des protéines ayant des rôles-clés dans la régulation de la prolifération (récepteur du EGF ainsi que le principal substrat de son activité kinase), sont associées au cytosquelette. Les filaments de cytokératines s'étendent de la membrane plasmique à l'enveloppe nucléaire et sont souvent considérés potentiellement comme des éléments intégrateurs de 1'activité cytoplasmique. La prochaine section présentera de façon plus détaillée l'expression, la structure et l'organisation des cytokératines ainsi que leur relation à la prolifération et à la différenciation des cellules épithéliales.
1.4 Les cytokératines : éléments plausibles d'intégration cytoplasmique -structure et organisation des filaments de cytokératines
-expression des cytokératines
Les cytokératines: éléments plausibles d'intégration cytoplasmique.
Structure et organisation des filaments de cytokératines.
Les filaments intermédiaires constituent une structure cytoplasmique fibrillaire dont la composition est extrêmement variable selon le type de tissu analysé. Ceci contraste avec ce qui est observé pour les autres structures du cytosquelette. En effet, alors que les sous-unités protéiques des microtubules, la tubuline, et des microfilaments, l'actine, sont communes aux cellules des différents tissus, les sous-unités protéiques des filaments intermédiaires sont biochimiquement et immunologiquement très variables. P. Traub (1985) dans sa revue dit de ces filaments:
"Intermediate filaments are at first sight a paradox ; whereas they appear to be a homogenous class of morphologically similar filaments, they also constitute a chemically heterogenous class of subunit proteins." p.2
Les filaments intermédiaires se regroupent en cinq classes selon une spécificité tissulaire : les filaments de vimentine retrouvés dans les cellules mésenchymateuses, les filaments de cytokératines des cellules épithéliales, les filaments de desmine dans les cellules musculaires, les neurofilaments dans les neurones et les filaments gliaux dans les cellules neuro-gliales.
De ces cinq classes, la plus diversifiée est certainement les filaments de cytokératines. Il existe une vingtaine de cytokératines différentes chez 11 humain regroupées selon deux types : le type I regroupe les cytokératines plus acides et de plus faible poids moléculaire, tandis que le type II regroupe les cytokératines plus basiques et de plus haut poids moléculaire (Fuchs et coll., 1981; Moll et coll., 1982). Les filaments de cytokératines sont formés d'une cytokératine de chacun des types (Quinlan et coll., 1984).
Des analyses par immunofluorescence et par microscopie électronique à haut voltage sur des cellules entières ont permis de résoudre la structure tridimensionnelle de ces filaments (Fey et Penman, 1985). Ces travaux ont permis de montrer que les cytokératines forment un réseau fibrillaire qui comprend des points d'attache au noyau, au voisinage des pores nucléaires ainsi que des points d1 attache à la membrane plasmique, associés aux hémidesmosomes. Les filaments de cytokératines semblent même se prolonger en une même fibre de part et d'autre du desmosome (Fey et Penman, 1985). Ces filaments sont facilement reconnaissables par leur diamètre de 10 nm, par leur
insolubilité en présence de détergents non-ioniques ainsi qu'à de fortes concentrations de sel. Une grande concentration du réseau se retrouve également sous-jacente à la membrane plasmique. A l'opposé, les microfilaments se retrouvent exclusivement sous la membrane plasmique. Cette distribution des filaments de cytokératines de la membrane plasmique au noyau suggèrent qu'ils ont un rôle à jouer dans le positionnement des organites et en particulier du noyau ainsi qu'un rôle plus général d'intégration et de coordination de l'activité cytoplasmique (pour revue: Marceau et coll., 1986).
Expression des cytokératines
L'hétérogénéité des cytokératines est d'origine génomique. Chez les mammifères, une vingtaine de cytokératines différentes exprimées par ensemble de deux à six se retrouvent dans les différents tissus épithéliaux dépendant du type d'épithélium, simple, squameux ou stratifié, ainsi que du stade de différenciation de ces cellules épithéliales (Eichner et coll., 1986). Pour cette raison, les filaments de cytokératines sont souvent considérés comme éléments différenciateurs du cytoplasme.
Les deux cytokératines majeures des hépatocytes sont les cytokératines A et D de 55 kD et 49 kD respectivement. L'extraction de la fraction du cytosquelette enrichie en filaments intermédiaires apporte également cinq autres polypeptides mineurs ayant des poids moléculaires de 40 à 55 kD et nommés de A à G selon la nomenclature de Franke et coll. (1981a). Ces polypeptides mineurs sont possiblement des produits de dégradation des 2 polypeptides majeurs de 49 kD (CK49) et 55 kD (CK55). Cependant ces conclusions ont été tirées à partir de 1'analyse de digestion tryptique partielle (Schiller et Franke, 1983) et vu la très forte homologie entre les diverses cytokératines une homologie de ces patrons de digestion ne signifie pas une identité des différentes protéines.
CK55 forme un doublet lors d'une migration en électrophorèse en deux dimensions, ce qui suggère soit une microhétérogénéité au niveau de la protéine ou une modification au niveau de la charge de la protéine. La CK49 peut ou non former un doublet selon les conditions dans lesquelles se trouvaient les hépatocytes au moment de 1'isolement (Kinjo et coll., 1984; Baffet et coll., 1985). Toutefois la signification de cette variation n'est pas connue.
les hépatocytes de rat en culture (Franke, 1981b; 8affet et coll., 1985). Cependant, dans nos conditions de culture nous n1 avons jamais observé un tel phénomène, ni par la localisation de la vimentine par immunofluorescence, ni par séparation de protéines par électrophorèse et coloration en bleu de Coomassie, ni par incorporation de °35s§--néthionine. La présence de vimentine est cependant observée dans le faible pourcentage (3-4%) de cellules non-parenchymateuses présentes même après l'isolement des hépatocytes. Il se peut néammoins que des conditions hormonales différentes, e.g. l'utilisation de sérum au lieu d'un milieu défini, amènent les hépatocytes à exprimer en culture des sous-unités de filaments intermédiaires non-typiques. Un tel phénomène est souvent observé lors de l'établissement de lignées stables de cellules épithéliales en culture.
Les cytokératines A et D des hépatocytes de rat correspondent aux gènes Endo A (Duprey et coll., 1985) et Endo 8 (Slouin et Marceau, non-publié) respectivement et exprimés chez l'embryon de souris. Cependant aucune étude n'a été effectuée sur la régulation de la transcription de ces gènes dans les hépatocytes et peu d'études, sur la synthèse et la phosphorylation de ces cytokératines.
Cytokératines versus différenciation et prolifération
Les tentatives pour déterminer un rôle précis des filaments de cytokératines ont été limitées par le fait qu'il n'existe aucune drogue spécifique pouvant perturber ce réseau de filaments. Cependant, plusieurs expériences sur la régulation de l'expression des cytokératines ont suggéré que ces filaments pourraient exercer un rôle dans la différenciation cellulaire ou dans la régulation de la prolifération.
L'étude de la régulation de la transcription et de la synthèse des cytokératines a montré des corrélations entre l'acquisition d'un phénotype différencié et des changements quantitatifs ou qualitatifs des cytokératines induits par la dexaméthasone (Leroux-Nicollet et coll., 1983; Marceau et coll., 1985) ou l'acide rétinoïque (Gilfix et Eckert, 1985) respectivement. L'hétérogénéité des cytokératines selon le type de tissu épithélial ainsi que leur état de différenciation suggère que ces filaments ont un rôle à jouer dans l'expression des fonctions différenciées. De plus, des lignées d'népatomes ayant perdu leur réponse aux glucocorticoïdes ont également perdu
leurs filaments de cytokératines (Venetianer et coll. , 1983). La transformation néoplasique de kératinocytes par SV40, amenant le retour à un phénotype peu différencié, induit chez ces cellules un retour à l'expression de cytokératines caractéristiques de ce stade de différenciation (Steinberg et Defendi, 1985). Bien que les mécanismes biochimiques par lesquels les cytokératines pourraient exercer une régulation de l'activité fonctionnelle soient encore obscurs, 1'expression de ces filaments est étroitement liée au programme de différenciation cellulaire.
D'autre part, plusieurs observations permettent de suggérer un rôle aux filaments de cytokératines dans la régulation de la prolifération cellulaire. Le récepteur du EGF, son activité kinase, ainsi que la p39 (Keski-Oja et Alitalo, 1985), principal substrat de cette activité kinase sont associés à la fraction résistante au Triton X-100, à des éléments qui ne semblent être ni les microfilaments ni les microtubules (Landreth et coll., 1985; Wiegant et coll., 1986). De plus, la localisation des filaments de cytokératines de la membrane plasmique à 1'enveloppe nucléaire rend plausible un rôle de support directif de ces filaments dans le "processing" du signal hormonal.
Toutefois, il faut mentionner que plusieurs types cellulaires prolifèrent même en l'absence de filaments intermédiaires, e.g. lors de l'embryogénèse jusqu'au début de la polarisation embryonnaire et de la spécialisation cellulaire, et dans certaines lignées établies transformées (Hedberg et Chen, 1986) . Ces résultats suggèrent que si les filaments de cytokératines ont un rôle à jouer dans la prolifération, ils agissent comme éléments régulateurs plutôt que comme éléments essentiels à une prolifération. En ce sens, la perturbation des cytokératines, dans leur composition, dans leur organisation dans leur présence même a souvent été associée à une prolifération cancéreuse (Ben-Ze'ev et coll., 1986; Banks-Schlegel et Rhim, 1986; Morris et coll., 1985). La très grande stabilité des filaments de cytokératines observée dans les hépatocytes de rat normaux fraîchement isolés, par rapport à la modulation rapide observée dans plusieurs lignées de cellules épithéliales (Connell et Rheinwald, 1983; Ben Ze'ev, 1984) pourrait bien refléter la régulation normale de leur prolifération.
Bien que les cytokératines constituent le produit protéique majeur des hépatocytes après l'actine, aucune fonction n'a été clairement associée à ces filaments. Les travaux présentés aux chapitres 4 et 5 montrent les changements
induits dans la synthèse, l'organisation, la phosphorylation et la stabilité des cytokératines dans des conditions hormonales qui induisent une réponse mitogénique des hépatocytes ou une maturation des hépatocytes en culture.
Références
Baffet, G., Ruelland, A., Clement, B., Le Rumeur, E., and Fischer, S. (1985) Synthesis and phosphorylation of cytoskeleton components in foetal, regenerating and adult normal rat hepatocytes during culture. Molec. Cell. Biochem., 68:97-105.
Banks-Schlegel, S.P., and Rhim, J.S. (1986) Keratin expression of both chemically and virally transformed human epidermal kératinocytes during the process of neoplastic conversion. Carcinogenesis, 7:153-157.
Baserga, R. (1985) Chap. 2 Non dividing cells. In: The biology of cell reproduction. Harvard University Press, Cambridge, pp. 22-33.
Beaudry, M.A., Chiasson, J.L., and Exton, J.H. (1977) Gluconeogenesis in the suckling rat. Am. J. Physiol., 233:E175-E180.
Bélanger, L., Baril, P., Guertin, M., Gingras, M.C., Gourdeau, H., Anderson, A., Hamel, D., and Boucher, J.M. (1983) Oncodevelopmental and hormonal regulation of a ^-fetoprotein gene expression. Advances in Enzyme Regulation (G. Weber, ed.) Pergamon Press, New York, Vol. 21:73-99.
Bélanger, L. Train, M., Baril, P., Gingras, M.C., Bartkowiak, J., and Sala-Trépat, J.M. (1981) Glucocorticosteroid-suppression of cr-fetoprotein synthesis in developing rat liver. Evidence for selective gene repression at the transcriptionnal level. Biochemistry, 20:6665-6672.
Bell, R.M. (1986) protein kinase C activation by diacylglycérol second messengers. Cell, 45:631-632.
Ben-Ze'ev, A. (1984) Differential control of cytokeratins and vimentin synthesis by cell-cell contact and cell spreading in cultured epithelial cells. J. Cell Biol., 99:1424-1433.
Ben-Ze'ev, A., Zoller, M., and Raz, A. (1986) Differential expression of intermediate filament proteins in metastatic and nonmetastatic variants of the BSp73 tumor. Cancer Res., 46:785-790.
Brodsky, W.Y., and Uryvaeva, I.V. (1978) Cell polyploidy: Its relation to tissue growth and function. Int. Rev. Cytol., 50:275-332.
Bucher, N.L.R., and Malt, R.A. (1971) Dans: Regeneration of the Liver and Kidney. Little, Brown & Co., New York, pp. 1-278.
Bucher, N.L.R., and Weir, G.C. (1976) Insulin, glucagon, liver regeneration and DNA synthesis. Metabolism, 25:1423-1425.
Bucher, N.L.R., Patel, U., and Cohen, S. (1978) Hormonal factors concerned with liver regeneration. In: Ciba Foundation Symposium No. 55 Hepatotrophic factors. Elsevier/Excerpta Medica/North-Holland, New York, pp. 95-107.
Bucher, N.L.R., and McGowan, J.A. (1979) Regulatory mechanisms in liver regeneration. In: Liver and Biliary Disease: A pathophysiological approach. R. Wright, G.G.M.M. Alberti, S. Karsan, and H. Millward-Sadler, eds. W.B. Saunders, London, pp. 210-227.
Carpenter, G., and Zendegui, J.G. (1986) Epidermal growth factor, its receptor, and related proteins. Exp. Cell Res., 164:1-10.
Castagna, M., Takai, Y., Kaibuchi, K., Sano, K., Kikkawa, U., and Nishizuka, Y. (1982) Direct activation of calcium-activated, phospholipid-dependent protein kinase by tumor-promoting phorbol esters. J. Biol. Chem., 257:7847-7851.
Cbarest, R., Blackmore, P.F., Berthon, B. and Exton, J.H. (1983) Changes in free cytosolic Ca2+ in hepatocytes following a ^-adrenergic stimulation. J. Biol. Chem., 258:8769-8773.
Cochet, C., Gill, G.N., Meisenhelder, J., Cooper, J.A., and Hunter, T. (1984) C-kinase phosphorylâtes the epidermal growth factor receptor and reduces its epidermal growth factor—stimulated tyrosine protein kinase activity. J. Biol. Chem., 259:2553-2558.
Connell, N.D., and Rheinwald, J.G. (1983) Regulation of the cytoskeleton in mesothelia! cells: reversible loss of keratin and increase in vimentin during rapid growth in culture. Cell, 34:245-253.
Cruise, J.L., Cotecchia, S., and Michalopoulos, G. (1986) Norepinephrine decreases EGF binding in primary rat hepatocyte cultures. J. Cell. Physiol., 127:39-44.
Cruise, J.L., Houck, K.A., and Michalopoulos, G.K. (1985) Induction of DNA synthesis in cultured rat hepatocytes through stimulation of adrenoreceptor by norepinephrine. Science, 227:749-751.
Cruise, J.L., and Michalopoulos, G. (1985) Norepinephrine and epidermal growth factor: dynamics of their interaction in the stimulation of hepatocyte DNA synthesis. J. Cell. Physiol., 125:45-50.
Doolittle, R.F., Hunkapiller, M.W., Hood, L.E., Devare, S.G., Robbins, K.C. Aaronson, S.A. and Antoniades, H.N. (1983) Simian sarcoma virus one gene, v-sis, is derived from the gene (or genes) encoding a platelet-derived growth factor. Science, 221:275-277.
Duprey, P., Morello, D., Vasseur, M., Babinet, C., Condamine, H., Brûlet, P., and Jacob, F. (1985) Expression of the cytokeratin endo A gene during early mouse embryogenesis. Proc. Natl. Acad. Sci. U.S.A., 82:8535-8539.
Duval, D., Durant, S., and Homo-Delarche, F. (1983) Non-genomic effects of steroids. Interactions of steroid molecules with membrane structures and functions. Biochim. Biophys. Acts, 737:409-442.
Ehrhart, J.C., Rollet, E., Komano, 0., Creuzet, C., and Loeb, J. (1983) Characterization of the epidermal-growth-factor-dependent phosphorylation system from normal mouse-liver sinusoidal plasma membranes. Eur. J. Biochem., 136:31-39.
Eichner, R., Sun, T.T., and Aebi, U. (1986) The role of keratin subfamilies and keratin pairs in the formation of human epidermal intermediate filaments. J. Cell Biol., 102:1767-1777.
Exton, J.H. (1986) Role of calcium and inositol derivatives in hormone action. 29e congrès annuel de la fédération canadienne des sociétés de biologie, Guelph, Ontario., p.26
Fey, E.G., Penman, S. (1985) New views of cell and tissue cytoarchitecture: embedment-free electron microscopy and biochemical analysis. Hepatology, 5:152-158.
Franks, W.W., Denk, H., Kalt, R., and Schmid, E. (1981a) Biochemical and immunological identification of cytokeratin proteins present in hepatocytes of mammalian liver tissue. Exp. Cell. Res., 131:299-318.
Franks, W.W., Mayer, D., Schmid, E., Denk, H., and Borenfreund, E. (1981b) Differences of expression of cytoskeletal proteins in cultured rat hepatocytes and hepatoma cells. Exp. Cell Res., 134:345-365.
Friedman, D.L., Claus, T.H., Pilkis, S.J., and Pine, G.E. (1981) Hormonal regulation of DNA synthesis in primary cultures of adult rat hepatocytes. Exp. Cell Res., 135:283-290.
Fuchs, E., Coppock, S.M., Green, H., and Cleveland, D.W. (1981) Two distinct classes of keratin genes and their evolutionary significance. Cell, 27:75-84.
Gaub, J., and Iversen, J. (1984) Rat liver regeneration after 90% partial hepatectomy. Hepatology, 4:902-904.
Gil fix, B.M., and Eckert, R.L. (1985) Coordinate control by vitamin A of keratin gene expression in human kératinocytes. J. Biol. Chem., 26:14026-14029.
Girard, P.R., Mazzei, G.J., and Kuo, J.F. (1986) Immunological quantitation of phospholipid/Ca^+-dependent protein kinase and its fragments. J. Biol. Chem., 261:370-375.
Goyette, M., Petropoulos, C.J., Shank, P.R., and Fausto, N. (1984) Regulated transcription of c-Ki-ras and c-myc during compensatory growth of rat liver. Molec. Cell. Biol., 4:1493-1498.
Greenberg, M.E., and Ziff, E.B. (1984) Stimulation of 3T3 cells induces transcription of the c-fos proto-oncogene. Nature, 311:433-437.
Greengard, 0., Federman, M., Knox, W.E. (1972) Cytomorphometry of developing rat liver and its application to enzymic differentiation. J. Cell Biol., 52:261-282.
Guguen-Guillouzo, C. (1986) Role of homotypic and heterotypic cell interactions in expression of specific functions by cultured hepatocytes. In: Research in isolated and cultured hepatocytes, A.Guillouzo and C. Guguen-Guillouzo, eds., pp. 259-284.
Guillouzo, A. (1986a) Plasma protein production by cultured adult hepatocytes. In: Research in isolated and cultured hepatocytes. A. Guillouzo and C. Guguen-Guillouzo eds. pp. 155-170.
Guillouzo, A. (1986b) Use of isolated and cultured hepatocytes for xenobiotic metabolism and cytotoxicity studies. In: Research in isolated and cultured hepatocytes. A. Guillouzo and C. Guguen-Guillouzo, eds., pp. 313-332.