T
T
H
H
È
È
S
S
E
E
En vue de l'obtention du
D
D
O
O
C
C
T
T
O
O
R
R
A
A
T
T
D
D
E
E
L
L
’
’
U
U
N
N
I
I
V
V
E
E
R
R
S
S
I
I
T
T
É
É
D
D
E
E
T
T
O
O
U
U
L
L
O
O
U
U
S
S
E
E
Délivré par l'Université Toulouse III - Paul Sabatier
Discipline ou spécialité : Chimie Organométallique et de Coordination
JURY
Régis REAU, Professeur, Université de Rennes 1, Rennes, Rapporteur Marc TAILLEFER, Directeur de Recherche, ENSCM, Montpellier, Rapporteur Paul-Louis FABRE, Professeur, Université de Toulouse III, Toulouse, Président Catherine HEMMERT, Chargée de Recherche, LCC, Toulouse, Directeur de Thèse
Bernard MEUNIER, Président de la société PALUMED, Invité
Ecole doctorale : Sciences de la matière
Unité de recherche : Laboratoire de Chimie de Coordination du CNRS Directeur(s) de Thèse : Catherine HEMMERT
Rapporteurs : Régis REAU, Marc TAILLEFER
Présentée et soutenue par François JEAN-BAPTISTE dit DOMINIQUE
Le 24 octobre 2008
Titre :
SYNTHÈSE ET CARACTÉRISATIONS PHYSICO-CHIMIQUES DE COMPLEXES MÉTALLIQUES COMPORTANT DES LIGANDS MULTIDENTES BIS(CARBÈNE N-HÉTÉROCYCLIQUE)
FONCTIONALISÉS.
Le travail présenté dans ce mémoire a été réalisé au laboratoire de Chimie de Coordination du CNRS de Toulouse dirigé par Monsieur Jean-Jacques Bonnet, Professeur à l’Université Paul Sabatier de Toulouse, puis par Monsieur Bruno Chaudret, Directeur de Recherche au CNRS. Je les remercie de m’avoir accueilli au sein de cet établissement.
Je tiens à remercier tout particulièrement Monsieur Régis Réau, Professeur de l’Université de Rennes 1, et Monsieur Marc Taillefer, Directeur de Recherche au CNRS, pour avoir accepté de juger ce travail en tant que rapporteurs. Leur présence à ce jury est un honneur et je leur en suis très reconnaissant.
Monsieur Paul-Louis Fabre, Professeur à l’Université Paul Sabatier de Toulouse, a présidé ce jury. Je le remercie pour sa présence et pour son implication dans l’évaluation de ce travail.
Monsieur Bernard Meunier, PDG de la société PALUMED, m’a accueilli au sein de son équipe. Je lui suis très reconnaissant de m’avoir accordé sa confiance. Ses compétences, sa grande motivation et ses conseils ont été précieux.
Je tiens à remercier Monsieur Jean Bernadou, Professeur à l’Université Paul Sabatier de Toulouse. Sa grande culture, son optimisme, et ces encouragements ont permis l’avancement de mes recherches.
Je tiens enfin à exprimer ma profonde gratitude à Catherine Hemmert, Chargée de Recherche au CNRS, qui a assuré la direction scientifique de ce travail. Sa détermination, sa rigueur scientifique ainsi que sa disponibilité ont été indispensables au bon déroulement de mes recherches.
J’adresse aussi mes remerciements aux différents services du LCC grâce auxquels ce travail a pu être réalisé dans de très bonnes conditions : le service RMN et en particulier Yannick Coppel et Francis Lacassin, le service de spectrométrie de masse, le service de microanalyse, Heinz Gornitzka pour les structures aux rayons X et Alix Sournia-Saquet au service d’électrochimie.
Je souhaite également adresser de chaleureux remerciements à ceux que j’ai côtoyés pendant ces trois années au laboratoire et avec qui j’ai passé des moments inoubliables :
Geneviève, Marguerite, Christophe L., Jean-luc, Vania et Peter, merci à vous pour vos conseils avisés et pour votre gentillesse.
Un énorme merci aux « non-permanents » de l’équipe K avec qui j’ai partagé beaucoup, que ce soit au labo comme à l’extérieur : les anciens (Céline, Christophe B., Tamara et Romain), Fatima, Carmen, François, Jérôme, Laurent, Julie, et les stagiaires (Joris, Adeline, Carine). Je n’oublie pas non plus les anciens thésards de l’équipe F (Vanessa et Luc), Marie-Pierre et Christelle.
Merci aussi à Martine et à Michel et Philippe au magasin, ainsi qu’à Madame Lecouls pour leur gentillesse.
Je voudrais remercier les copains de lycée et de chimie Rennes, Xavier, Odile et Guillaume (pour les soirées, les randos, la garde de mon chat, la kilkenny et tout le reste…) qui m’ont permis de « décompresser » dans les moments de stress.
Enfin et surtout, mes remerciements les plus forts reviennent à mes parents qui m’ont encouragé et soutenu pendant toutes ces années d’études et sans qui je n’aurais pu aller au bout de mes projets. J’y associe également ma sœur Vanessa, Fréderic, et mes petites nièces Inès et Anaïs, mes grands-parents et l’ensemble de ma famille, ainsi que Renée, Rémi et Marianne.
Pour terminer, merci à Charline qui a été à mes côtés pour partager les meilleurs comme les plus durs moments de ces trois années de thèse.
LISTE DES ABREVIATIONS ...9
INTRODUCTION GENERALE ...12
CHAPITRE I : REVUE BIBLIOGRAPHIQUE SUR LES LIGANDS CARBENES N-HETEROCYCLIQUES POLYDENTES...15
I.GENERALITESSURLESCARBENESN-HETEROCYCLIQUES ... 16
1.-DEFINITION... 16
1.-Propriétés électroniques ...16
2.-Synthèses ...18
2.-LES CNHS EN CHIMIE DE COORDINATION... 19
1.-Historique...19
2.-Complexes CNH en catalyse homogène ...20
II.COMPLEXESALIGANDSBIS(CARBENEN-HETEROCYCLIQUE)ABRASDEJONCTIONFLEXIBLE ... 22
1.-SYNTHÈSE DES PRÉCURSEURS DE LIGANDS... 22
2.-VOIES DE SYNTHÈSE DES COMPLEXES À LIGAND CNH... 23
3.-PROPRIÉTÉS DES COMPLEXES BIS(CARBÈNE N-HÉTÉROCYCLIQUE) ... 26
1.-Complexes d’AgI-bis(CNH) ...26
2.-Complexes d’AuI-bis(CNH) ...32
3.-Complexes à géométrie plan-carré de bis(CNH) de palladium(II) et de Nickel(II)...36
III.COMPLEXESALIGANDSBIS(CARBENEN-HETEROCYCLIQUE)ABRASDEJONCTIONRIGIDE . 42 1.-SYNTHÈSE DES PRÉCURSEURS ET DES LIGANDS C-N-C, C-C-C, C^N^C, ET BzC^N^ BzC... 42
2.-PROPRIÉTÉS DES COMPLEXES BIS(CARBÈNE N-HÉTÉROCYCLIQUE) ... 43
1.-Complexes d’AgI-bis(CNH) ...43
2.-Complexes à géométrie plan-carré bis(CNH) de palladium(II) et de Nickel(II)...47
IV.COMPLEXESALIGANDCYCLOPHANE ... 51
1.-Complexes d’AgI-bis(CNH) ...51
2.-Complexes d’AuI-bis(CNH) ...55
3.-Complexes à géométrie plan-carré de palladium(II) et de nickel(II) ...57
V.COMPLEXESALIGANDSMIXTESCARBENESN-HETEROCYCLIQUESCOMPORTANTUNBRAS ANIONIQUE ... 58
1.-COMPLEXES À LIGANDS ALKOXY-, ARYOXY-, PHÉNOXY- OU ÉNOLATE-CARBÈNE... 58
1.-Complexes à ligands phénoxy- ou alkoxy-bis(carbène), et à ligands enolate-carbène bidentes ...58
2.-Complexes à ligands phénoxy- et alkoxy-bis(carbène) et bis(aryloxy)-carbène tridentes ...61
2.-COMPLEXES À LIGANDS AMIDURE OU AMIDO-CARBÈNE... 62
3.-COMPLEXES À LIGANDS PYRAZOLATE-BIS(CARBÈNE) ... 64
VI.PRESENTATIONDESSYSTEMESETUDIES ... 66
CHAPITRE II : SYNTHESE ET CARACTERISATION PHYSICO-CHIMIQUE DE PROLIGANDS BIS(HYDROXY-IMIDAZOLIUM) ET DE COMPLEXES D’AGI, AUI, ET AUIII COMPORTANT DES LIGANDS BIS(HYDROXY-CNH)...68
I. SYNTHESE DES SELS DE BIS(HYDROXY-IMIDAZOLIUM)... 69
1.-STRATEGIES DE SYNTHESE... 69
2.-SYNTHESE ET CARACTERISATION DES SELS DE BIS(HYDROXY-IMIDAZOLIUM) A PONT ALKYLE... 70
1.-Synthèse des hydroxy-imidazoles de type B ...70
2.-Synthèse des sels de bis(hydroxy-imidazolium) à partir des réactifs de type B...72
3.-SYNTHESE ET CARACTERISATION DES SELS DE BIS(HYDROXY-IMIDAZOLIUM) A PONT RIGIDE... 75
1.-Synthèse des réactifs de type B’ ...75
2.-Synthèse des bis(hydroxy-imidazolium) à partir des réactifs de type B’...76
4.-CONCLUSION... 80
II. SYNTHESE ET CARACTERISATION DE COMPLEXE D’AGI COMPORTANT DES LIGANDS BIS(HYDROXY-CNH) ... 81
1.-SYNTHESE ET CARACTERISATION DE COMPLEXES D’ARGENT CONTENANT DES LIGANDS BIS(HYDROXY-CARBENE) A BRAS DE JONCTION ALKYLE... 81
1.-Complexation du sel de bis(hydroxy-imidazolium) achiral 5apar de l’ AgI...82
2.-SYNTHESE ET CARACTERISATION DE COMPLEXES D’AgI-BIS(HYDROXY-CNH) COMPORTANT UNE CHIRALITE SUR LA
CHAINE LATERALE HYDROXYLE... 90
3.-SYNTHESE ET CARACTERISATION D’UN COMPLEXE D’AgI-BIS(HYDROXY-CNH) COMPORTANT UN PONT PYRIDINE... 92
4.-CONCLUSION... 93
III.SYNTHESEETCARACTERISATIONDECOMPLEXESD’ORCONTENANTDESLIGANDS BIS(HYDROXY-CARBENE) ... 94
1.-SYNTHESE DE COMPLEXES D’AuI COMPORTANT DES LIGANDS BIS(HYDROXY-CNH) PAR TRANSMETALLATION A PARTIR DE COMPLEXES D’AgI PRECURSEURS... 95
2.-SYNTHESE DIRECTE DES COMPLEXES D’AuI PAR DEPROTONATION IN SITU DES PROLIGANDS... 97
3.-CARACTERISATIONS STRUCTURALES PAR DIFFRACTION DES RAYONS X DES COMPLEXES D’AuI... 99
4.-SYNTHESE ET CARACTERISATION DE COMPLEXES D’AuIII CONTENANT DES LIGANDS BIS(HYDROXY-CARBENE). ... 103
5.-ETUDES ELECTROCHIMIQUES DES COMPLEXES D’AuI ET D’AuIII ... 107
6.-TENTATIVES DE SYNTHÈSE DE COMPLEXES DE CoII ET DE CoIII COMPORTANT DES LIGANDS BIS(ALKOXY-CNH)... 113
7.-CONCLUSION... 117
CHAPITRE III : SYNTHESE ET CARACTERISATION DE COMPLEXES D’AUI COMPORTANT DES LIGANDS BIS(AMIDE-CNH) ET DE COMPLEXES DE PDII ET DE NIII COMPORTANT DES LIGANDS BIS(AMIDO-CNH) ...119
I.SYNTHESEETCARACTERISATIONDESSELSDEBIS(AMIDE-IMIDAZOLIUM)APONTALKYLE. 120 1.-STRATEGIE DE SYNTHESE... 120
2.-SYNTHESE ET CARACTERISATION... 120
1.-Synthèse des réactifs de type B... 120
2.-Synthèse des bis(amide-imidazolium) à partir des réactifs de type B... 122
3.-CONCLUSION... 125
II.SYNTHESEETCARACTERISATIONDECOMPLEXESD’ORCONTENANTDESLIGANDS BIS(AMIDE-CARBENE) ... 125
1.-SYNTHESE DE COMPLEXES D’AuI PAR METALLATION DIRECTE... 125
2.-ETUDES STRUCTURALES... 127
III.SYNTHESEETCARACTERISATIONDECOMPLEXESDEPDIICONTENANTDESLIGANDS BIS(AMIDO-CARBENE)... 128
1.-INTRODUCTION... 129
2.-SYNTHESE DE COMPLEXES DE PdII PAR METALLATION DIRECTE... 129
IV.SYNTHESEETCARACTERISATIONDECOMPLEXESDENIIICONTENANTDESLIGANDS BIS(AMIDO-CARBENE)... 130
1.-INTRODUCTION... 130
2.-SYNTHESE DE COMPLEXES DE NiII ACHIRAUX PAR METALLATION DIRECTE... 131
1.-Synthèse et caractérisation de complexes de NiII achiraux... 131
2.-Etudes structurales ... 132
3.-SYNTHESE DE COMPLEXES DE NiII COMPORTANT DES LIGANDS BIS(AMIDO-CNH) CHIRAUX PAR METALLATION DIRECTE... 135
1.-Introduction ... 135
2.-Synthèse, caractérisation et étude structurale de complexes de NiII chiraux ... 135
V.CONCLUSION ... 139
CHAPITRE IV : PROPRIETES PHOTOPHYSIQUES DES COMPLEXES D’AGI, AUI, ET AUIII ET CATALYTIQUES DES COMPLEXES D’AUI, NIII ET PDII...141
I.PROPRIÉTES DE LUMINESCENCE DES COMPLEXES D’AGI, D’AUI ETD’AUIII... 142
1.-PROPRIÉTÉS DE LUMINESCENCE DES PROLIGANDS, DES COMPLEXES D’AgI, AuI ET AuIII COMPORTANT DES LIGANDS BIS(HYDROXY-CNH)... 146
2.-PROPRIÉTÉS DE LUMINESCENCE DES PROLIGANDS ET DES COMPLEXES D’AuI COMPORTANT DES LIGANDS BIS(AMIDE-CNH) ... 151
II.PROPRIETESCATALYTIQUESDESCOMPLEXESD’AUI,PDIIETNIII... 153
1.-RÉACTION D’AZIRIDINATION CATALYSÉE PAR DES COMPLEXES D’AuI COMPORTANT DES LIGANDS BIS(HYDROXY -CNH) ... 153
1.-Rappels bibliographiques ... 153
2.-REACTIONS DE COUPLAGE C-C DE TYPE SUZUKI-MIYAURA CATALYSEES PAR LES COMPLEXES DE NiII ET DE PdII
COMPORTANT DES LIGANDS BIS(AMIDO-CNH)... 157
1.-Rappels bibliographiques ... 157
2.-Application des complexes bis(amido-CNH) de PdII et de NiII en couplage de Suzuki-Miyaura... 163
III.CONCLUSION ... 170
CONCLUSION GENERALE ET PERSPECTIVES...171
CHAPITRE V : PARTIE EXPERIMENTALE ...175
LISTE DES ABREVIATIONS
Å : angström Ac : acétyle
Acac : acétylacétonate
APCI+ : ionisation chimique à pression atmosphérique Ar : aromatique Bimy : benzimidazolin-2-ylidène BINAM : 2,2-Diamino-1,1’-binaphthyl Bn : benzyle Bu : butyle t-Bu : tert-butyle
CCM : chromatographie sur couche mince CNH : carbène N-hétérocyclique
COD : cyclooctadiène
COSY : COrrelation SpectroscopY Cy : cyclohexyle DBA : dibenzylideneacetone DCM : dichlorométhane DMF : diméthylformamide DiPP : 1,3-Diisopropyl-phényle DMAC : N,N-diméthylacétamide DME : 1,2-diméthoxyéthane DMSO : diméthylsulfoxyde
EDC : chlorhydrate de 1-(3-diméthylaminopropyl)-3-éthylcarbodiimine ee : excès énantiomérique
Eq. : équivalent
ES+ : ionisation par électronébuliseur (electrospray ionization) Et : éthyle
FAB+ : bombardement par atomes rapides (fast atom bombardment)
h : heure
HMBC : Heteronuclear Multiple-Bond Correlation HMDS : héxaméthyldisiloxane
HOBT: 1-hydroxybenzotriazole
HSAB :acides et bases durs et mous (Hard and Soft Acids and Bases)
HSQC : Heteronuclear Single Quantum Correlation
n
J : constante de couplage nucléaire spin-spin Hz : hertz
IMes : 1,3-dimésitylimidazol-2-ylidènes K : Kelvin
L : litre
L : ligand donneur en général M : mole par litre
Me : méthyle MeCN : acétonitrile MeOH : méthanol
Mes : mésityle (2,4,6-triméthylbenzène) MHz : mégahertz
min : minute mmol : millimole
MS : spectrométrie de masse (Mass Spectrometry) m/z : rapport masse-sur-charge
NaBArF : sodium tetrakis[(3,5-trifluoromethyl)phenyl]borate NMM : N-méthylmorpholine
OTf : triflate OTs : tosylate
ppm : partie par million Ph : phényle
Pr : propyle i-Pr : iso-propyle Py :pyridine
R : groupement organique
RMN : résonance magnétique nucléaire
ROESY : Rotating frame Overhause Effect SpectroscopY RX : rayons X
TBAB : bromure de tétrabutylammonium TsCl : chlorure de paratoluènesulfonyle
SIMes : 1,3-dimésityl-4,5-dihydroimidazol-2-ylidène SIPr : N,N′-bis(2,6-diisopropylphényl)imidazol-2-ylidène t.a. : température ambiante
THF : tétrahydrofurane X : halogénure
Le recours à des complexes métalliques relevant de la chimie de coordination ou organométallique a été largement exploré. Dans le domaine de la catalyse chimique, la recherche de nouveaux catalyseurs toujours plus efficaces est l'un des principaux axes de recherche tant du point de vue académique qu'industriel. Une grande partie des recherches s'est concentrée sur les ligands phosphinés et a déjà conduit à l'élaboration de systèmes extrêmement efficaces pour de
nombreuses réactions.1Cependant, ces ligands requièrent une synthèse généralement élaborée et
sont souvent sensibles à l'air. Ainsi, la recherche s'est axée sur l'élaboration de nouveaux ligands ne contenant pas de phosphines, parmi lesquels la famille des ligands azotés tient une place prépondérante.2
Plus récemment, la classe des ligands carbènes N-hétérocycliques (abrégés par CNH) s'est rapidement développée depuis la première synthèse d'un carbène N-hétérocyclique libre isolé par Arduengo en 1991.3 Ces ligands peuvent constituer une alternative intéressante aux ligands phosphinés et ont acquis leur lettre de noblesse dans des réactions de métathèse d’oléfines (travaux de Grubbs, Schrock et Chauvin récompensés par l’attribution du prix Nobel en 2005) et dans des réactions de couplage C-C. De plus, la facilité de fonctionalisation des proligands, de type sel d'imidazolium, a mené à l'incorporation de ces carbènes N-hétérocycliques donneurs au sein de structures de ligands polydentes, comportant habituellement des donneurs plus classiques tels que des phosphines ou des amines. Le premier complexe comportant un ligand carbène N-hétérocyclique fonctionalisé par des donneurs classiques (groupement imidazolin-2-ylidène saturé relié à un alcène ou à une phosphine par un bras en C3) a été décrit, en 1988, par Lappert.4
Dès lors, de nombreux complexes comportant des ligands mixtes CNH-(donneur anionique) multidentes ont été synthétisés et appliqués avec succès dans de nombreuses transformations catalytiques.5
Enfin, l'utilisation de ligands multi(CNH) a permis la préparation de nouveaux complexes dont la stabilité est augmentée par effet chélate. Les propriétés topologiques modifiables de ces ligands multi(CNH) (encombrement stérique, angle dièdre, chiralité et comportement dynamique
1 (a) I. Ojima (Ed.), Catalytic Asymmetric Synthesis, Wiley-VCH, New York, 2000 ; (b) W. Tang, X. Zhang, Chem.
Rev. 2003, 103, 3029 ; (c) P. W. N. M. van Leeuwen, P. C. J. Kamer, J. N. H. Reek, P. Dierkes, Chem. Rev. 2000, 100, 2741.
2
Articles de revues : (a) A. Togni, L. M. Venanzi, Angew. Chem. Int. Ed. Engl. 1994, 33, 497 ; (b) F. Fache, E. Schulz, M. Lorraine-Tommasino, M. Lemaire, Chem. Rev., 2000, 100, 2159.
3 (a) A. J. Arduengo, R. L. Harlow, M. Kline, J. Am. Chem. Soc. 1991, 113, 361 ; (b) A. J. Arduengo, Acc. Chem.
Res. 1999, 32, 913.
4 M. F. Lappert, J. Organomet. Chem. 1988, 358, 185. 5
en solution) les rendent particulièrement attractifs en chimie organométallique et catalyse. Dans ce manuscrit, nous focaliserons notre attention sur les ligands bis(CNH) mutidentes et mixtes CNH-(donneur anionique) multidentes. Une attention particulière sera portée à leurs propriétés structurales et catalytiques ainsi qu’à quelques applications biomédicales et photophysiques.
CHAPITRE I :
Revue bibliographique sur les ligands carbènes
N-hétérocycliques polydentes
I. GENERALITES SUR LES CARBENES N-HETEROCYCLIQUES
Il ne s'agit pas ici de faire un bilan complet de la chimie de ces composés car il existe detrès bonnes revues couvrant ce sujet.1 Nous expliquerons brièvement ce que sont ces composés,
puis leur chimie de coordination et enfin, nous présenterons quelques applications biomédicales, photophysiques, et catalytiques de certains de leurs complexes avec les métaux de transition.
1.-
DEFINITIONLes carbènes N-hétérocycliques, que l’on notera CNHs, sont des composés neutres cycliques comportant un carbone divalent à six électrons de valence compris dans un hétérocycle contenant au moins un atome d’azote. Ils peuvent être classés en quatre grandes familles qui sont représentées sur la Figure 1.
N N R3 R4 R2 R1 N N R3 R4 R2 R1 R1 N N R2 N N N R3 R2 R1 Imidazolylidène A Imidazolinylidène B Benzimidazolylidène C Triazolylidène D
Figure 1 : les quatre grandes familles des ligands carbènes N-hétérocycliques.
1.-Propriétés électroniques
Il a été montré que, contrairement aux carbènes "simples" tels que le méthylène (état fondamental triplet, réactivité radicalaire), les carbènes N-hétérocycliques à l'état fondamental sont à l'état singulet (présence d'un doublet électronique et d'une orbitale vacante), du fait de la présence des deux atomes d'azote électrodonneurs de part et d'autre du carbone porteur des deux électrons (Figure 2). Cette configuration électronique, liée au fait que l'électronégativité de l'atome de carbone soit plus faible que celle des atomes d'azote et de phosphore fait des CNHs de meilleurs donneurs σ que les amines et la plupart des phosphines, et ils conduisent par conséquent à des complexes métalliques remarquablement stables. Cette caractéristique classe ces carbènes parmi les bases de Lewis neutres les plus fortes. Des études sur le
1 Articles de revue : (a) W. A. Herrmann, Angew. Chem. Int. Ed. 2002, 41, 1290 ; (b) D. Bourissou, O. Guerret, F. Gabbaï, G. Bertrand, Chem. Rev. 2000, 100, 39 ; (c) W. A. Herrmann, C. Köcher, Angew. Chem. Int. Ed. Engl. 1997,
36, 2162 ; (d) V. César, S. Bellemin-Laponnaz, L. H. Gade, Chem. Soc. Rev. 2004, 33, 619 ; (e) F. Glorius,
N-Heterocyclic Carbenes in catalysis in Topics in organometallic chemistry (F. Glorius, Ed.) ; Springer : Berlin, 2007,
4,5-diméthyl-2,3-dihydro-1H-imidazol-2-ylidène ont montré que ce composé possédait un pKa = 24 (DMSO d6).2 Cependant, le caractère basique des CNHs est souvent masqué par un fort caractère nucléophile. Selon la théorie HSAB de Pearson,3 les CNHs peuvent se classer parmi les bases molles. N N R R R R
état triplet état singulet réactivité
radicalaire
réactivité nucléophile
Figure 2 : configuration électronique des carbènes.
Les carbènes N-hétérocycliques présentent une stabilité exceptionnelle qui, d'après des études théoriques4 approfondies effectuées sur des carbènes, silylènes et germylènes, tient son origine des trois facteurs suivants, par ordre décroissant d’importance au niveau de la stabilisation :
1) la délocalisation des paires libres des deux atomes d'azote vers l'orbitale p vacante du centre carbénique (particulièrement efficace ici du fait de la structure cyclique rigide), ainsi que, dans une moindre mesure, l'effet inductif de ces mêmes deux atomes d'azote, contribuant à diminuer la densité électronique sur le carbone central. Cette conjugaison explique également le caractère électrophile peu marqué des CNHs.
2) l'aromaticité de la structure à 6 électrons π (structure de type A), bien que celle-ci soit beaucoup plus faible que celle des sels d'imidazolium correspondants (Figure 3). La présence ou non d'insaturation joue également sur la basicité des CNHs : ainsi les composés saturés de type B sont plus basiques que leurs analogues insaturés de type A.
N N R R R N NR R N N R R R
H H -87 kcal/mol -6 kcal/mol -20 kcal/mol
augmentation de la stabilité
B A
Figure 3 : effet stabilisant des atomes d'azote et de l'aromaticité sur les carbènes.
2 R. W. Alder, P. R. Allen, S. J. Williams, J. Chem. Soc., Chem. Commun. 1995, 1267.
3 (a) R. G. Pearson, J. Chem. Educ. 1968, 45, 581 ; (b) R. G. Pearson, J. Chem. Educ. 1968, 45, 643 ; (c) R. G. Pearson, J. Chem. Educ. 1987, 64, 561 ; (d) R. G. Pearson, Coord. Chem. Rev. 1990, 100, 403.
4
(a) C. Heinemann, T. Müller, Y. Apeloig, H. Schwarz, J. Am. Chem. Soc. 1996, 118, 2023 ; (b) C. Boehme, G. Frenking, J. Am. Chem. Soc. 1996, 118, 2039.
3) la présence de substituants volumineux au niveau des atomes d'azote qui empêchent les réactions de dimérisation des CNHs produisant des ènetétramines (Figure 4).
N N N N R R R R N N R R
Figure 4 : dimérisation des carbènes.
Cette remarquable stabilisation électronique et stérique des CNHs entraîne la possibilité, pour certains, de les isoler et de les manipuler à température ambiante. Ils sont en revanche modérément stables en solution (notamment en cas de chauffage) et très facilement hydrolysables. Leur sensibilité à l'air est en réalité due à l'humidité ambiante.
2.-Synthèses
Le premier CNH libre fut isolé en 1991 par le groupe d'Arduengo3 par déprotonation du
sel d'imidazolium correspondant (Schéma 1). Les analyses menées sur ce carbène particulièrement stable (Tfusion = 240-241 °C, sans décomposition), par spectroscopie de RMN et
diffraction RX, montrent clairement la diminution d'aromaticité dans la structure carbénique.
N N N N I δH = 6,9 ppm δC = 136 ppm δC = 211 ppm lC-N = 1,32 Å θNCN = 109° lC-N = 1,39 Å θNCN = 102° δH = 7,2 ppm
aromaticité faible délocalisation π
THF NaH DMSO (cat.)
Schéma 1 : synthèse et caractérisation du premier carbène N-hétérocyclique libre isolé.
Depuis ces travaux précurseurs, de nombreux autres carbènes N-hétérocycliques libres ou sous forme de complexes métalliques ont été décrits. Les CNHs sont facilement préparés à grande échelle à partir des sels d'imidazolium dont il existe plusieurs voies de synthèse (Schéma 2). Il est par exemple possible de réaliser la synthèse « one pot » d'imidazoliums symétriques en
partant de glyoxal, d'une amine primaire et de formaldéhyde (voie a).5 Il existe également une version de cette synthèse permettant la préparation de sels d'imidazolium dissymétriques (voie b).6 Cette dernière voie passe par la synthèse intermédiaire d'un imidazole N-substitué également accessible par alkylation de l'anion imidazolide (voie c).7, 8
O O H H O N N R R N N R1 R2 N N NH4Cl N N R1 O O H H O HN N K + 2 + + HX - 3 H2O X + + + - 3 H2O - H2 - KX R-NH2 R1-NH2 R2-X R1-X X voie a) voie b) voie c) K
Schéma 2 : voies de synthèse des sels d'imidazolium.
2.-
LES CNHS EN CHIMIE DE COORDINATION1.-Historique
Depuis la découverte des premiers complexes métal-carbènes N-hétérocycliques, en 1968, par les groupes d'Öfele9 et de Wanzlick10 (Figure 5), ces composés ont soulevé un grand intérêt dans le domaine de la chimie de coordination, intérêt redoublé depuis la mise au point, en 1991, par Arduengo3 d'une voie d'accès générale vers des CNHs stables et isolables. Comme il fut souligné par Herrmann, dès 1993,11 les propriétés similaires des phosphines basiques et de ces
5 (a) W. A. Herrmann, C. Köcher, L. J. Gooβen, G. R. J. Artus, Chem. Eur. J. 1996, 2, 1627 ; (b) A. J. Arduengo III, Preparation of 1,3-disubstituted imidazolium salts. US Patent 5077414, 1991 ; (c) W. A. Herrmann, L. J. Gooβen, M. Spiegler, J. Organomet. Chem. 1997, 547, 357.
6 A. A. Gridnev, I. M. Mihaltseva, Synth. Commun. 1994, 24, 1547. 7
(a) B. K. M. Chan, N. H. Chan, M. R. Grimmett, Aust. J. Chem. 1977, 30, 2005 ; (b) M. R. Haque, M. Rasmussen,
Tetrahedron 1994, 50, 5535 ; (c) M. R. Grimmett, Imidazole and Benzimidazole Synthesis; Academic Press, London,
1997.
8 (a) T. Weskamp, V. P. W. Bohm, W. A. Herrmann, J. Organomet. Chem. 2000, 600, 12 ; (b) A. J. Arduengo, R. Krafczyk, R. Schmutzler, Tetrahedron 1999, 55, 14523 ; (c) W. A. Herrmann, L. J. Goossen, G. R. J. Artus, C. Kocher, Organometallics 1997, 16, 2472 ; (d) A. J. Arduengo III US6,177, 575 2001-01-23 process for manucfacture of imidazoles.
9 K. Öfele, J. Organomet. Chem. 1968, 12, 42.
10 H.-W. Wanzlick, H.-J. Schönherr, Angew. Chem., Int. Ed. Engl. 1968, 7, 141. 11
K. Öfele, W. A. Herrmann, D. Mihalios, M. Elison, E. Herdtweck, W. Scherer, J. Mink, J. Organomet. Chem.
carbènes font de ces derniers, des ligands particulièrement intéressants pour des applications en catalyse. N N Hg N N Ph Ph Ph Ph N N Cr(CO)5 Me Me 2 ClO4 2 (Öfele) (Wanzlick)
Figure 5 : premiers complexes métal-carbènes N-hétérocycliques isolés.
2.-Complexes CNH en catalyse homogène
Les complexes carbéniques étant particulièrement stables, ils furent employés très rapidement en tant que catalyseurs moléculaires. En effet, ces complexes présentent plusieurs caractéristiques qui les rendent très intéressants en catalyse homogène. Tout d’abord, les sels d'imidazolium (ou équivalents) sont facilement synthétisés et stables à l'air. De plus, les catalyseurs sont très stables thermiquement et sont peu sensibles à l'hydrolyse et envers les oxydants. Ceci est dû à la remarquable stabilité de la liaison métal-carbène.
Les deux principaux métaux dont les complexes ont été employés en catalyse sont le palladium et le ruthénium. Les complexes Ru-CNH ont principalement été développés pour les réactions de métathèse d'oléfines,12 et de très bons résultats ont été obtenus par substitution d'une phosphine PCy3 (catalyseur de Grubbs de première géneration) par un carbène de type
1,3-bis(mésityl)imidazolinylidène (SIMes) pour aboutir au catalyseur dit de seconde génération de Grubbs (Figure 6).13De nombreux complexes Pd-CNH, isolés et caractérisés, ont fait l'objet de plusieurs applications dans des réactions de couplage C-C (réactions de Heck, de Stille, de Suzuki-Miyaura et de Sonogashira)1a, 14 et des réactions d'arylamination.15
12 (a) M. Scholl, S. Ding, C. W. Lee, R. H. Grubbs, Org. Lett. 1999, 1, 953 ; (b) M. S. Sanford, J. A. Love, R. H. Grubbs, J. Am. Chem. Soc. 2001, 123, 6543 ; (c) T. M. Trnka, J. P. Morgan, M. S. Sanford, T. E. Wilhelm, M. Scholl, T. Choi, S. Ding, M. W. Day, R. H. Grubbs, J. Am. Chem. Soc. 2003, 125, 2546 ; (d) J. A. Love, M. S. Sanford, M. W. Day, R. H. Grubbs, J. Am. Chem. Soc. 2003, 125, 10103; (e) T. J. Seiders, D. W. Williams, R. H. Grubbs, Org. Lett. 2001, 3, 3225.
13
(a) M. Scholl, T. M. Trnka, J. P. Morgan, R. H. Grubbs, Tetrahedron Lett. 1999, 40, 2247 ; (b) T. Weskamp, W. C. Schattenmann, M. Spiegler, W. A. Herrmann, Angew. Chem. Int. Ed. 1998, 37, 2490 ; (c) J. Huang, E. D. Stevens, S. P. Nolan, J. L. Pedersen, J. Am. Chem. Soc. 1999, 121, 2674 ; (d) L. Ackermann, A. Fürstner, T. Weskamp, F. J. Kohl, W. A. Herrmann, Tetrahedron Lett. 1999, 572, 239.
14 (a) T. Weskamp, F. J. Kohl, W. Hieringer, D. Gleich, W. A. Herrmann, Angew. Chem. Int. Ed. 1999, 38, 2416 ; (b) L. Ackermann, A. Fürstner, T. Weskamp, F. J. Kohl, W. A. Herrmann, Tetrahedron Lett. 1999, 40, 4787 ; (c) W. A. Herrmann, M. Elison, J. Fischer, C. Kocher, G. R. J. Artus, Angew. Chem. Int. Ed. Engl. 1995, 34, 2371 ; (d) W. A. Herrmann, K. Öfele, D. v. Preysing, S. K. Schneider, J. Organomet. Chem. 2003, 687, 229 ; (e) W. A. Herrmann, C.-P. Reisinger, M. Spiegler, J. Organomet. Chem. 1998, 557, 93 ; (f) C. W. K. Gstöttmayr, V. C.-P. W. Böhm, E. Herdtweck, M. Grosche, W. A. Herrmann, Angew. Chem. Int. Ed. 2002, 41, 1363.
De plus, de nombreux systèmes catalytiques impliquant des ligands CNHs ont été utilisés avec succès dans des réactions catalytiques énantiosélectives.
N N Mes Mes Ru Ph Cl Cl PCy3 Ru Ph Cl Cl PCy3 PCy3 A B
Figure 6: catalyseur de Grubbs de première (A) et de seconde (B) génération pour la métathèse des oléfines.
Les revues de Herrmann1a et de Gade1d couvrent les systèmes catalytiques utilisant des CNHs jusqu'à 2004 ; mais depuis, de nombreuses autres catalyses ont été développées, illustrant l'explosion de ce domaine ces dernières années.16 De plus, l'utilisation de ligands multi(CNH) a permis la préparation de nouveaux complexes dont la stabilité est augmentée par effet chélate. Les propriétés topologiques modifiables de ces ligands CNHs (encombrement stérique, angle dièdre, chiralité et comportement dynamique) les rendent particulièrement attractifs en chimie organométallique et catalyse.
Dans la suite de ce chapitre, nous récapitulerons les exemples les plus appropriés des complexes d’AgI, AuI, PdII et NiII comportant des ligands bis(carbène N-hétérocyclique), décrits dans la littérature jusqu'à maintenant, et nous discuterons des caractéristiques principales concernant leurs propriétés synthétiques, topologiques, et catalytiques et leurs applications biomédicales et photophysiques.
Les complexes décrits seront classés selon la nature du ligand bis(carbène N-hétérocyclique) impliqué : ouvert, comportant un bras de jonction flexible ou rigide, ou cyclophane. Enfin, le dernier paragraphe de ce chapitre sera consacré aux propriétés synthétiques et catalytiques de complexes comportant des ligands mixtes CNH-(donneur anionique).
15 (a) A. C. Hillier, G. A. Grasa, M. S. Viciu, H. M. Lee, C. Yang, S. P. Nolan, J. Organomet. Chem. 2002, 653, 69 ; (b) A. F. Littke, G. C. Fu, Angew. Chem. Int. Ed. 2002, 41, 4176.
16
Exemples sélectionnés : (a) G. Zuo, J. Louie, Angew. Chem. Int. Ed. 2004, 43, 2277 ; (b) F. Hanasaka, K.-I. Fujita, R. Yamaguchi, Organometallics 2004, 23, 1490 ; (c) D. Martin, S. Kehrli, M. D’augustin, H. Clavier, M. Mauduit, A. Alexakis, J.Am. Chem. Soc. 2006, 128, 8416 ; (d) H. Clavier, L. Coutable, L. Toupet, J. C. Guillemin, M. Mauduit, J. Organomet. Chem. 2005, 690, 5237 ; (e) M. R. Fructos, T. R. Belderrain, P. de Frémont, N. M. Scott, S. P. Nolan, M. M. Díaz-Requejo, P. J. Pérez, Angew. Chem. Int. Ed. 2005, 44, 5284 ; (f) N. Marion, R. Gealageas, S. P. Nolan, Org. Lett. 2007, 9, 2653 ; (g) N. Marion, P. Carlqvist, R. Gealageas, P. de Frémont, F. Maseras, S. P. Nolan, Chem. Eur. J. 2007, 13, 6437 ; (h) L. Ray, V. Katiyar, M. J. Raihan, H. Nanavati, M. M. Shaikh, P. Ghosh,
Eur. J. Inorg. Chem. 2006, 3724 ; (i) L. Ray, V. Katiyar, S. Barman, M. J. Raihan, H. Nanavati, M. M. Shaikh, P.
Ghosh, J. Organomet. Chem. 2007, 692, 4259 ; (j) S. M. Kim, J. H. Park, S. Y. Choi, Y. K. Chung, Angew. Chem.
II.
COMPLEXES
A
LIGANDS
BIS(CARBENE
N-HETEROCYCLIQUE) A BRAS DE JONCTION FLEXIBLE
1.-
SYNTHÈSE DES PRÉCURSEURS DE LIGANDSLes ligands bis(carbène) ont souvent été préparés à partir de sels de N-alkyle ou N- aryle imidazolium. La synthèse des précurseurs des sels d'imidazolium est habituellement réalisée à partir de produits commerciaux. L’une des méthodes communes de préparation des sels de bis(imidazolium), est une réaction directe entre deux équivalents du N-alkylimidazole et d’un équivalent de dihalogénure d’alkyle (Schéma 3).17,18, 19 Cette méthodologie apparaît comme une synthèse facile et modulable (par variation de la longueur du bras de jonction entre les deux unités N-alkyle ou N-aryle imidazole, ainsi que par modification de la nature des N-substituants) pour la préparation d'une grande gamme de précurseurs de ligands CNHs bidentes.
N N R N N R linker N N R linker X X + 2X
-Schéma 3 : méthode commune de préparation des sels de bis(imidazolium).
Tandis que les propriétés des phosphines sont bien établies par la carte des effets stériques et électroniques de Tolman,20 une telle étude systématique pour les ligands CNHs n’est pas encore disponible. En général, il est difficile de moduler et de prévoir les effets stériques et électroniques des ligands bis(carbène) ; cependant, plusieurs paramètres peuvent être considérés.
Le bras latéral (R1) permet de moduler principalement les propriétés stériques du ligand,
avec une faible influence sur le caractère électrodonneur du carbène.21 Le bras de jonction (R2)
établit une relation entre l'orientation du noyau imidazole et le plan équatorial du complexe métallique, ce qui permet ainsi de moduler l’angle de chélation carbène-métal-carbène.22 Les substituants éventuels en positon 4 et 5 de l’imidazole (R3) contribuent principalement à la
modification des propriétés électroniques du ligand (Figure 7).23
17 M. Albrecht, R. H. Crabtree, J. Mata, E. Peris, Chem. Commun. 2002, 32.
18 M. Albrecht, J. R. Miecznikowski, A. Samuel, J. W. Faller, R. H. Crabtree, Organometallics 2002, 21, 3596. 19 C. Kocher, W. A. Herrmann, J. Organomet. Chem. 1997, 532, 261.
20 C. A. Tolman, Chem. Rev. 1977, 77, 313.
21 R. Dorta, E. D. Stevens, N. M. Scott, C. Costabile, L. Cavallo, C. D. Hoff, S. P. Nolan, J. Am. Chem. Soc. 2005,
127, 2485.
22 J. A. Mata, A. R. Chianese, J. R. Miecznikowski, M. Poyatos, E. Peris, J. W. Faller, R. H. Crabtree,
Organometallics 2004, 23, 1253.
23
- Bras latéraux R1 : optimisation des propriétés stériques - Linker R2 : détermination de l'orientation des cycles CNH - Substituants dorsaux R3 : modulation des propriétés électroniques
N N R1 R2 N N R1 R3 R3 R3 R3
Figure 7 : paramètres influençant les effets géométriques, stériques et électroniques d’un ligand
bis(imidazolylidène).
2.-
VOIES DE SYNTHÈSE DES COMPLEXES À LIGAND CNHPlusieurs méthodes de préparation de complexes à ligand bis(CNH), se sont avérées être efficaces.7a, 24, 25 Les plus largement utilisées sont les suivantes : i) arrachement d’un proton par une base forte pour générer le CNH libre;1a ii) insertion d'un centre métallique dans une liaison C=C d'oléfines riches en électrons (ènetétramines, méthode de Lappert25); iii) déprotonation in situ des sels de bis(imidazolium) par une base forte ou faible, suivi de la métallation par un sel métallique neutre ou basique7a,26 iv) transmétallation à partir d’un complexe d’AgI-CNH préparé par métallation d’un sel d’imidazolium par un dérivé d’argent basique, v) addition oxydante de la liaison Ccarbènique-H d'un cation imidazolium à des précurseurs de métaux de transition de basse
valence.
Dans cette section, nous décrirons brièvement, de manière non exhaustive, les procédures synthétiques appliquées à l’obtention de bis(CNH), en incluant quelques exemples.
(i) Isolement du bis(carbène) libre : Herrmann et coll. ont synthétisé le premier ligand bidente bis(imidazolylidène) avec un bon rendement (95%), via une méthode de déprotonation par l'ammoniac liquide (Schéma 4). Malheureusement, ce carbène libre se révèle être très sensible à la chaleur et l'humidité.27 D’autres voies de synthèse, comme par exemple la déprotonation d’un bromure d’imidazolium par K[N(SiMe3)2] dans le THF, ont été utilisées pour préparer
des ligands semblables, mais avec des rendements inférieurs.28, 29, 30 Les ligands bis(carbène) libres sont moins stables que leurs analogues mono(carbène) et sont, en général, "extrêmement sensibles" à l'air.
24 D. Enders, H. Gielen, J. Organomet. Chem. 2001, 617, 70.
25 D. J. Cardin, B. Cetinkaya, M. F. Lappert, Chem. Rev. 1972, 72, 545. 26 E. Peris, R. H. Crabtree, C. R. Chimie 2003, 6, 33.
27 W. A. Herrmann, M. Elison, J. Fischer, C. Kocher, G. R. J. Artus, Chem.-Eur. J. 1996, 2, 772.
28 R. E. Douthwaite, D. Haussinger, M. L. H. Green, P. J. Silcock, P. T. Gomes, A. M. Martins, A. A. Danopoulos,
Organometallics 1999, 18, 4584.
29
G. T. S. Andavan, E. B. Bauer, C. S. Letko, T. K. Hollis, F. S. Tham, J. Organomet. Chem. 2005, 690, 5938. 30
N N N 2X- N N N N N NH3, 2 Eq. NaH THF, -50°C
Schéma 4 : isolement d’un bis(carbène) libre.
(ii) La déprotonation in situ d'un sel d’azolium par une base pour produire le CNH désiré a l'avantage d’éviter les étapes de purification du carbène libre, qui sont généralement, relativement difficiles à effectuer à cause de leur sensibilité à l'air et l'humidité. La déprotonation peut être effectuée au moyen d'une base forte (NaH, n-BuLi, t-BuOK,
KHMDS, NaHMDS, etc).31 Dans le cas de carbènes possédant un bras de jonction entre les
cycles azoles, quelques complications peuvent apparaître puisque le bras de jonction contient souvent des protons acides qui peuvent être déprotonés, entraînant ainsi la rupture du ligand bis(carbène). Pour contourner ce problème, des bases faibles telles que (NaOAc, Cs2CO3 ou
NEt3) ou des précurseurs de métaux contenant des ligands basiques comme des acétates,
hydrures ou alcoxydes peuvent être utilisées (Schéma 5).7
N N N N N N Pd O O H N N I I 2I -Pd(OAc)2 Pd I I N N N N
Schéma 5 : déprotonation in situ et métallation d'un sel d’azolium par du Pd(OAc)2.
(iii) Transmétallation d'un complexe AgI-CNH : Wang et Lin ont décrit en 1998 cette procédure pour générer un complexe de PdII-CNH.32 Le sel d’imidazolium est traité par un dérivé d’AgI basique, généralement de l'oxyde d'argent, de l’Ag2CO3 (Danopoulous),33 ou de
l’AcOAg (Bertrand),34 pour fournir le complexe mono- ou bis(CNH) d'argent(I), comme l’indique le Schéma 6. Les avantages de cette méthode sont qu’elle ne requiert pas de conditions drastiques : généralement le milieu réactionnel est à température ambiante, le sel d’argent est une base douce et la réaction peut s’effectuer dans de nombreux solvants et
31 D. S. Clyne, J. Jin, E. Genest, J. C. Gallucci, T. V. Rajanbabu, Org. Lett. 2000, 2, 1125. 32 H. M. J. Wang, I. J. B. Lin, Organometallics 1998, 17, 972.
33 A. A. D. Tulloch, A. A. Danopoulos, S. Winston, S. Kleinhenz, G. Eastham, J. Chem. Soc., Dalton Trans. 2000, 4499.
34
notamment l’eau. Le complexe de CNH d'argent est assez stable pour être isolé, ou peut être utilisé in situ pour former le nouveau complexe CNH-métal, après addition du précurseur métallique correspondant. Dans la plupart des cas, la réaction de transmétallation peut être effectuée dans des conditions aérobiques. Grâce à la labilité de la liaison AgI-CNH, ce procédé a été appliqué avec succès pour une variété de métaux comme l’Au, Cu, Ni, Pd, Pt, Rh, Ir et Ru.35 N N N N Ag X Ag2O n X- N N MLn - AgX MLn
Schéma 6 : méthode de complexation d’un sel d’azolium par transmétallation d’un complexe AgI-CNH intermédiaire.
(iv) L’addition oxydante de la liaison Ccarbènique-H de sels de mono(imidazolium), sur des
composés métalliques de bas degré d’oxydation, constitue une méthode relativement récente de synthèse de complexes CNHs.36, 37 Dans le cas des bis(carbène), seulement deux exemples d’activation de la liaison Ccarbènique-H ont été décrits sans ambigüité (Schéma 7).38, 39
X N N N N N N Ir H N N Cl Ir Cl H N N N N X 2PF6 -[IrCl(COD)]2
NEt3, CH3CN COD COD
PF6- PF6
-X
X = ferrocényle, H
Schéma 7 : complexation d’un sel d’azolium par addition oxydante de la liaison Ccarbènique-H sur un composé métallique de bas degré d’oxydation.
35 (a) P. L. Arnold, Heteroatom Chemistry 2002, 13, 534 ; (b) I. J. B. Lin, C. S. Vasam, Comments Inorganic Chem.
2004, 25, 75.
36 (a) D. S. McGuinness, K. J. Cavell, B. F. Yates, Chem. Commun. 2001, 355 ; (b) N. D. Clement, K. J. Cavell, C. Jones, C. J. Elsevier, Angew. Chem. Int. Ed. 2004, 43, 1277.
37 D. S. McGuinness, K. J. Cavell, B. F. Yates, B. W. Skelton, A. H. White, J. Am. Chem. Soc. 2001, 123, 8317. 38
M. Viciano, E. Mas-Marza, M. Poyatos, M. Sanau, R. H. Crabtree, E. Peris, Angew. Chem. Int. Ed. 2005, 44, 444. 39
3.-
PROPRIÉTÉS DES COMPLEXES BIS(
CARBÈNE N-
HÉTÉROCYCLIQUE)
1.-Complexes d’AgI-bis(CNH)
Même si les complexes d’AgI-bis(CNH) ont été principalement utilisés comme agent de
transfert de carbènes pour la conception de complexes métalliques, ils ont cependant joué un rôle majeur dans le développement de la chimie de coordination des CNHs. Ainsi, de nombreuses revues sur la synthèse, la caractérisation et les applications récentes, notamment biomédicales, de ces complexes sont parues dans la littérature.40 L’étude structurale des complexes de bis(carbène
N-hétérocyclique) d’AgI a révélé une grande diversité de structures (nucléarité, mode de liaison,
sphère de coordination) à l’état solide, particulièrement dans les complexes comportant des anions coordinants halogénures. Les complexes d’argent comportant des anions non-coordinants
sont généralement des complexes possédant un cation Ag+ coordiné par deux CNHs et un anion
non-coordinant équilibrant la charge.
Les contraintes stériques et la flexibilité des ligands sont des facteurs majeurs de la diversité structurale. Les interactions d10-d10 doivent être également considérées. En effet, certains complexes d’AuI ont montré des interactions aurophiles particulièrement fortes dues à des effets relativistes.41 La force des interactions d10-d10 pour des systèmes métal(I)-métal(I) est plus faible que les liaisons covalentes, mais plus forte que les forces de dispersion de London. D’après des évaluations qualitatives, la force de ces interactions métal(I)-métal(I) est approximativement égale à celle des liaisons hydrogène. Par analogie, il n'est donc pas étonnant que des interactions argentophile AgI-AgI jouent également un rôle primordial dans la formation de diverses structures de complexes d’AgI à l’état solide. Pour discuter des diverses structures de complexes AgI-bis(CNH) décrites, les notions d’interaction AgI-AgI significative et de simple contact doivent être définies. La distance métal-métal dans l’argent métallique est de 2.88 Å,42 tandis que la somme des rayons de Van der Waals pour l'Ag0 est de 3.44 Å43: ces deux valeurs peuvent donc être utilisées comme extrémités sur une échelle de détermination de la force des interactions argentophiles. Les interactions fortes sont généralement inférieures à 3.0 Å tandis que les interactions faibles sont supérieures à 3.3 Å. Les distances métal-métal inférieures à 3.3 Å
40 (a) J. C. Garrison, W. J. Youngs, Chem. Rev. 2005, 105, 3978 ; (b) I. J. B. Lin, C. S. Vasam, Coord. Chem.
Rev. 2007, 251, 642 ; (c) A. Kascatan-Nebioglu, M. J. Panzner, C. A. Tessier, C. L. Cannon, W. J. Youngs, Coord. Chem. Rev. 2007, 251, 884.
41 P. Pyykko, Chem. Rev. 1997, 97, 597. 42
J. Emsley, The Elements, 3rd ed.; Oxford University Press: New York, 1998. 43
sont donc considérées comme des interactions relativement fortes et seront représentées sur les schémas comme de véritables liaisons.
Complexes d’AgI-bis(CNH) à anions non-coordinants
Toutes les structures des complexes d’AgI-bis(CNH) (1, 2, 3 et 4) comportant un pont méthylène et un anion non-coordinant sont illustrées sur la Figure 8. Dans ces complexes dinucléaires dimériques, chaque centre métallique d'AgI adopte une géométrie proche de la linéarité et est coordiné par deux carbones carbéniques appartenant à deux ligands distincts.
N N N N Ag Ag N N N N 2PF6 -N N N N Bun nBu Ag Ag N N N N Bun nBu 2PF6 -N N N N Mes Mes Ag Ag N N N N Mes Mes 2BF4 -1: X = PF6-,dAg-Ag = 3.2258(7) Å 3: X = Cl-,dAg-Ag = 3.3179(11) Å 2 4: dAg-Ag = 3.2039(3) Å
Figure 8 : représentation des complexes 1-4 et structures moléculaires de 1 et 4.
Dans les complexes 1,44 3,45 446 (Figure 8), les distances Ag-Ag de l’ordre de 3.2-3.3 Å autorisent une interaction Ag…Ag. Les angles C-Ag-C (169.4(2) pour 1, 164.79(19), 168.65(18)° pour 3, et 173.50(9), 171.93(10)° pour 4) s’éloignant de la linéarité et les distances Ag-Ag courtes sont une conséquence d’un ligand contraint.
Des complexes comportant des ligands bis(CNH) à pont flexible plus long ont été synthétisés et structuralement caractérisés. Suivant la longueur de la chaîne et l’encombrement
44 C. A. Quezada, J. C. Garrison, M. J. Panzner, C. A. Tessier, W. J. Youngs, Organometallics 2004, 23, 4846. 45
D.-Q. Wang, Acta Cryst. 2006, E62, m1565. 46
généré par les N-substituants, les complexes d’AgI-bis(CNH) peuvent être dinucléaires dimériques (5a et 5b,47 et 648) ou mononucléaires monomériques (7a et 7b,49 et 850).
O N N N N R R Ag Ag O N N N N R R 5a: R = 1-naphthylméthylène, X- = PF6 dAg-Ag = 3.3651(1) Å 5b: R = 9-anthracenylméthylène, X- = PF6 dAg-Ag = 7.340(2) Å
6: R = Me, X = TfO-, dAg-Ag = 3.5402(8) et
4.2927(9) Å N N R O N N R Ag n 7a : R = 1-naphthylméthylène, n = 2 7b : R = 1-naphthylméthylène, n = 3 N N R N N R Ag O O 8 PF6 -PF6 -2X
-Figure 9 : représentation des complexes 5-8 et structures moléculaires de 5a, 5b et 7a.
Dans le complexe 5a, en raison de la flexibilité des ligands bis(CNH) bidentes et de l'existence d'une interaction faible Ag…Ag (3.3651(12) Å), les deux entités Ccarbène-Ag-Ccarbène
linéaires adoptent une conformation croisée. Par contre, dans le complexe 5b, les deux entités Ccarbène-Ag-Ccarbène linéaires adoptent une conformation parallèle, impliquant l’absence
d’interaction Ag…Ag (dAg-Ag = 7.340(2) Å), ce qui est attribué par les auteurs, à une interaction
intermoléculaire plus forte de π-stacking entre les substituants anthracényles dans le complexe
5b. Le complexe 6 cristallise, quant à lui, sous la forme de deux cations distincts de type
[AgI2L2]2+, et de formulation globale 6.2/3MeCN. Les deux cations, présents dans le réseau
47 J.-W. Wang, H.-B. Song, Q.-S. Li; F.-B. Xu, Z.-Z. Zhang, Inorg. Chim. Acta 2005, 358, 3653. 48 D. J. Nielsen, K. J. Cavell, B. W. Skelton, A. H. White, Organometallics 2006, 25, 4850. 49
J. Wang, Q. S. Li, F. B. Xu, H. B. Song, Z.-Z. Zhang, Eur. J. Org. Chem. 2006, 1310. 50
X.-J. Wan, F.-B. Xu, Q.-S. Li, H.-B. Song, Z.-Z. Zhang, Inorg. Chem. Com. 2005, 8, 1053.
cristallin dans un rapport 2:1, se distinguent par des conformations différentes, «croisée» stabilisée par une interaction Ag…Ag faible (dAg-Ag=3.5402(8) Å), et «parallèle» (dAg-Ag =
4.2927(9) Å).
La complexation de sels de bis(imidazolium) comportant un bras éther plus long conduit à la formation de complexes monomériques monucléaires 7a et 7b, et 8 dans lesquels le centre métallique central adopte une géométrie linéaire bicoordinée. Lorsque les complexes possèdent des chaînes plus longues et donc plus flexibles, la géométrie autour du centre d’AgI tend à être linéaire (178.3(3)° dans 7b, 174.48° dans 8, et 170.63(12)° dans 7a).
Complexes d’AgI-bis(CNH) comportant des anions halogénures coordinants
N N N N Ag Ag N N N N 9 AgBr2 Br2Ag R N N N N R 10 : R = benzyle Ag AgBr Br n N N N N 11 Ag AgCl Cl n
Figure 10 : représentation des complexes 9-11 et (a) structure moléculaire de 9 (b) structure moléculaire de 10 (c)
« crystal packing » du complexe 11 révélant sa structure polymérique.
L’analogue du complexe 6 à pont pentane 9 a également été étudié (Figure 10).48 La substitution de l'atome d'oxygène dans 6 par un groupement méthylène ne devrait avoir qu’un faible impact sur la structure du complexe. Cependant la structure obtenue est intéressante, car elle démontre l'influence d'un anion coordinant, dans le cas-présent [AgBr2], sur la géométrie du
complexe [AgI2L2] (Figure 10), avec les entités Br(1)-Ag(2)-Br(2) et C(2)-Ag(1)-C(2’) quasiment
perpendiculaire l’une par rapport à l’autre.
La métallation d’un sel de bis(imidazolium) à pont éthylène par de l’Ag2O conduit à la
formation du complexe 10,51 où les deux noyaux imidazoles du ligand bis(CNH) se positionnent
l’un par rapport à l’autre suivant une conformation anti et sont coordinés à deux centres métalliques d’AgI distincts. Chaque centre métallique d’AgI possède également une liaison avec un bromure qui est coordiné à un autre centre d’AgI appartenant à la plus proche molécule, générant ainsi un polymère unidimensionnel de type [Ag2LBr2]n. Chaque centre métallique d’AgI
adopte une géométrie planaire trigonale déformée. La distance Ag-Ag de 3.605 Å implique une absence d’interaction argentophile intramoléculaire, mais les centres métalliques d’AgI dans la chaîne polymérique s’empilent au niveau des centres de symétrie, de fait de l’existence d’interactions argentophiles intermoléculaires faibles (dAg-Ag intermoléculaire = 3.429 Å), pour
former une chaîne en zigzag. En revanche, une structure polymérique semblable de complexe de chlorure d’AgI-bis(CNH) avec des N-substituants méthyle 11 a été décrite et aucune interaction argentophile n’a été observée (dAg-Ag = 3.725 Å).52
Complexes d’AgI polynucléaires stabilisés par des ligands bis(CNH)
Les clusters d’AgI impliquant des ligands mixtes neutres bis(pyridine-carbène) à pont aliphatique sont représentés sur les Figures 11 et 12.
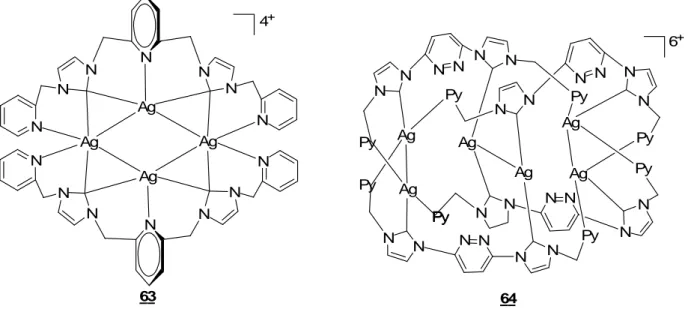
Le complexe 12 est un complexe tétranucléaire linéaire (Figure 11).53 Les deux centres
métalliques d’AgI internes sont bicoordinés par deux carbènes avec une géométrie coudée
(C-Ag-C = 166.32(14)°), due à une contrainte stérique imposée par le pont méthylène et par les interactions AgI…AgI (dAg-Ag = 3.288(1) et 2.911(1) Å). Les deux centres métalliques d’AgI
terminaux adoptent une géométrie tétraédrique déformée et sont tétracoordinés par deux pyridines, un carbène, et une molécule d’acétonitrile. Le premier CNH du ligand bis(CNH) agit comme un ligand pontant qui relie deux centres métalliques d’AgI, formant ainsi un triangle Ag-Ag-C, tandis que le second CNH est quant à lui monodente. Ce mode de coordination pontant a été rarement observé pour ce type de ligands CNHs.
Le composé 13 est également un complexe tétranucléaire.53 Les quatre centres métalliques d’AgI forment un cœur plan-carré par interaction argentophile (dAg-Ag latérale = 2.790(1)-2.791(2)
Å et dAg-Ag diagonale= 3.316(2) Å) et sont entourés par deux ligands. Chaque carbène interagit
de façon symétrique avec deux Ag formant des cycles à trois chaînons. Deux pyridines de deux
51 P. L. Chiu, C. Y. Chen, J. Y. Zeng, C. Y. Lu, H. M. Lee, J. Organomet. Chem. 2005, 690, 1682. 52
K. M. Lee, H. M. J. Wang, I. J. B. Lin, J. Chem. Soc., Dalton Trans. 2002, 2852. 53
ligands différents interagissent faiblement avec deux des quatre AgI. Par contre, l’interaction Ag…O est négligeable (Ag…O = 2.674(6) Å).
Ces deux composés ont révélé des propriétés intéressantes de photoluminescence à l’état solide et à température ambiante : le complexe 12 comportant un agencement Ag4 linéaire révèle
une bande d’émission intense localisée à 443 nm (excitation à 326 nm) tandis que le complexe 13
comportant un agencement Ag4 orthogonal possède une bande d’émission intense localisée à 475
nm (excitation à 304 nm). N N N N Ag Ag Ag Ag N N N N N N N N H3CCN NCCH3 4+ N N O N N N N N N O N N N N Ag Ag Ag Ag 4+ 12 13
Figure 11 : représentation des complexes 12 et 13 et structures moléculaires de 12 et 13.
Le composé 14 est un complexe d’argent tétranucléaire possédant une chaîne Ag4 en
zigzag (Figure 12),54 avec des distances Ag-Ag courtes (3.043(1)-3.121(1) Å). Les deux centres métalliques d’argent internes sont coordinés par deux CNHs dans une géométrie linéaire légèrement coudée (C-Ag-C de 173.0(4), 169.2(4)°). Les deux centres métalliques d’argent terminaux sont coordinés par une pyridine, un carbène, et une molécule d'acétonitrile. Enfin, le cluster 15 est un complexe d’argent trinucléaire.54 La structure moléculaire se compose de trois centres métalliques d’Ag différents entourés par deux ligands (Figure 12). Dans le noyau Ag3
triangulaire, deux ions Ag+ sont coordinés par deux CNHs de deux ligands différents, dans une
54
géométrie presque linéaire (C-Ag-C=176.5(4) et 170.5(4)°), tandis que le troisième est coordiné par deux molécules d'acétonitrile et deux pyridines de deux ligands différents. Les interactions
Ag…Ag sont relativement faibles dans le noyau Ag3, avec des distances Ag…Ag d’environ 3.0
Å. N N N N N N N N N N N N Ag Ag Ag H3CCN H3CCN N N N N N N Ag Ag Ag N N N N N N Ag NCCH3 H3CCN 4+ 3+ 14 15
Figure 12 : représentation des complexes 14 et 15 et structures moléculaires de 14 et 15.
2.-Complexes d’AuI-bis(CNH)
Les complexes de carbène d’AuI sont connus depuis plus d'un quart de siècle mais leurs
propriétes structurales et catalytiques n’ont été que très récemment étudiées, contrairement à leur analogues à ligand phosphine.55 En effet, l’or était considéré comme un métal noble très onéreux et faiblement actif en catalyse. Cependant, un nombre croissant de nouvelles applications de ces complexes d’AuI,56 et notamment d’AuI-CNH, ont été décrites ces dernières années. Ainsi, une
gamme variée de transformations chimiques catalysées par des complexes d’AuI-CNH
55 (a) I. J. B. Lin, C. S. Vasam, Can. J. Chem. 2005, 83, 812 ; (b) H. Schmidbaur, in: Gmelin Handbook of Inorganic
Chemistry: Organogold Compounds A. Slawish (ed), Springer-Verlag, New York 1980 ; (c) J. E. Parks, A. L. Balch, J. Organomet. Chem. 1973, 57, C103 ; (d) G. Minghetti, F. Bonati, Gazz. Chim. Ital. 1972, 102, 205 ; (e) B.
Çetinkaya, M. F. Lappert, T. Turner, J. Chem. Soc., Chem. Commun. 1972, 851 ; (f) R. Aumann, E. O. Fischer,
Chem. Ber. 1981, 114, 1853.
56
mononucléaires a émergé ces cinq dernières années.16e-k Des applications biomédicales de ces complexes commencent également à être explorées.57 Seuls quelques exemples de complexes d’AuI comportant des ligands bis(CNH) ont été structuralement caractérisés et aucun d’entre eux n’a été utilisé avec succès en catalyse jusqu’à présent. En revanche, certains de ces complexes d’AuI-bis(CNH) polynucléaires ont montré d’excellentes propriétés de luminescence.
Plusieurs stratégies de synthèse de complexes d’AuI-CNH ont été décrites dans la littérature : (i) insertion d'un métal dans une liaison C=C d'oléfines riches en électron (Lappert25, 58), (ii) protonation ou alkylation de composés d'AuI-azolyle,59 (iii) transfert de carbène à partir de complexes carbonyl-métal du groupe 6,60 (iv) métallation directe des sels d'azolium en présence d'une base douce ou de CNH libre avec des précurseurs appropriés d'AuI,61 (v) transmétallation entre un complexe d’AgI-CNH et un sel d’AuI.32, 35b, 62
Dans la suite de ce sous-chapitre, des structures moléculaires de complexes d’AuI vont être discutées et il est donc nécessaire de définir là encore la notion d’interaction aurophile AuI…AuI. La distance métal-métal dans l’or métallique est 2.884 Å tandis que la somme des rayons de Van der Waals pour l'Au0 est de 3.32 Å : ces deux valeurs peuvent donc être utilisées comme extrémités sur une échelle de détermination de la force des interactions aurophiles. Cependant, des interactions aurophiles ne peuvent être exclues si la distance AuI-AuI est inférieure à 3.6 Å.43,63
Complexes d’AuI-bis(CNH) obtenus par complexation d’un sel de bis(imidazolium) en présence
d’une base ou d’un bis(CNH) libre
Le premier complexe dinucléaire d'AuI, 16, structuralement caractérisé possède un ligand bis(3-éthylimidazolin-2-ylidène) borate61b. La réaction du bis(carbène) libre avec une quantité
57 (a) I. Özdemir, A. Denizci, H. T. Öztürk, B. Çetinkaya, Appl. Organometal. Chem. 2004, 18, 318. ; (b) S. Ray, R. Mohan, J. K. Singh, M. K. Samantaray, M. M. Shaikh, D. Panda, P. Ghosh, J. Am. Chem. Soc. 2007, 129, 15042 ; (c) P. J. Barnard, S. J. Berners-Price, Coord. Chem. Rev. 2007, 251, 1889 ; (d) P. J. Barnard, L. E. Wedlock, M. V. Baker, S. J. Berners-Price, D. A. Joyce, B. W. Skelton, J. H. Steer, Angew. Chem. Int. Ed. 2006, 45, 5966.
58 B. Çetinkaya, P. Dixneuf, M. F. Lappert, J. Chem. Soc., Dalton Trans. 1974, 1827.
59 B. Bovio, S. Calogero, E. F. E. Wagner, A. Burini, B. R. Pietroni, J. Organomet. Chem. 1994, 470, 274.
60 (a) S. T. Liu, K. R. Reddy, Chem. Soc. Rev. 1999, 28, 315 ; (b) R. Z. Ku, J. C. Huang, J. Y. Cho, F. M. Kiang, K. R. Reddy, Y. C. Chen, K. J. Lee, J.-H. Lee, G. H. Lee, S. M. Peng, S. T. Liu, Organometallics 1999, 18, 2145. 61 (a) K. M. Lee, C. K. Lee, I. J. B. Lin, Angew. Chem. Int. Ed. 1997, 36, 1850 ; (b) R. Fränkel, J. Kniczek, W. Ponivkar, H. Nöth, K. Polborn, W. P. Fehlhammer, Inorg. Chim. Acta 2001, 312, 23.
62
M. J. Wang, C. Y. L. Chen, I. J. B. Lin, Organometallics 1999, 18, 1216. 63
équimolaire de [Au(PPh3)Cl] conduit à la formation d’un complexe neutre et dinucléaire, dans
lequel, le ligand est dans un mode de coordination µ2-η1 : η1 non chélatant (Figure 13).
N N N N N N N N Au 2I- Au N N B H2 N N N N H2 B N N Au Au 17 16
Figure 13 : représentation des complexes 16 et 17 et structures moléculaires de 16 et 17.
La flexibilité du ligand favorise une interaction faible Au…Au (dAu-Au = 3.3610(7) Å). Le
complexe d’AuI 17 à pont méthylène64 a été préparé par réaction stœchiométrique du sel d’imidazolium et de [Au(SMe2)Cl], en présence de butyrate de lithium. Ce composé est un
complexe dicationique dinucléaire de type (AuL)2, chaque atome d'AuI étant lié à deux carbènes
provenant de deux ligands différents (Figure 13). Le pont méthylène entre les deux hétérocycles dans ce ligand impose une disposition quasi-parallèle des deux entités C-Au-C, et une interaction Au…Au (dAu-Au = 3.5425(6) Å) est tout à fait plausible. Malgré cette interaction aurophile
possible, ce complexe n’est pas luminescent en solution aqueuse et à température ambiante.
Transmétallation
Des complexes d’AuI-bis(CNH) à bras de jonction polyéther plus long ont été synthétisés par transmétallation de précurseurs d’AgI. Les complexes structuralement caractérisés sont répertoriés sur la Figure 14. Un complexe d’AuI dimérique dinucléaire 18, a été préparé par transmétallation de son analogue d'AgI, en présence de [Au(SMe2)Cl].47 La structure moléculaire
64
du complexe 18 (Figure 14) est semblable à celle de son précurseur d’AgI 5a, avec une conformation croisée, conduisant à une distance Au-Au de 3.506(1) Å, impliquant une interaction
aurophile faible. Des analogues d'AuI monomériques mononucléaires 19a et 19b ont également
été synthétisés par transmétallation à partir des carbènes d’AgI mononucléaires 7a et 7b respectivement.49 O N N N N R R Au Au O N N N N R R 18 : R= 1-naphthylméthylène N N R O N N R Au n 19a : R = 1-naphthylméthylène, n = 2 19b : R = 1-naphthylméthylène, n = 3 N N N Au N N N Au O 2+ 20 2PF6 -2PF6 -PF6
-Figure 14. représentation des complexes 18- 20 et structures moléculaires de 18, 19a et 20.
Contrairement aux trois exemples précédents, les réactions de transmétallation ne conduisent pas toujours à des complexes d’AuI possédant la même structure, à l’état solide, que leurs précurseurs d’AgI. En effet, la réaction de transfert de carbène à partir du complexe tétranucléaire d’AgI impliquant deux ligands bis(pyridine-carbène), 13, en présence de [Au(SEt2)Cl] génère un complexe dinucléaire 20.53 Les deux centres métalliques d'or adoptent
une géométrie linéaire et sont liés par un CNH et une pyridine (Figure 14). Les ligands CNHs sont arrangés selon un mode de coordination tête-bêche. Les deux angles de torsion C-Au-Au-C et N-Au-Au-N sont de 132.4(8)° et 131.1(8)° et reflètent le fait que les deux entités C-Au-N sont légèrement « twistées » l'une par rapport à l'autre d’un angle d’environ 50°. La distance intramoléculaire Au-Au est de 3.267(1) Å, et la distance intermoléculaire Au…Au est supérieur à 5.043 Å, ce qui exclue tout type d’interaction aurophile entre les molécules de dimères. L’interaction aurophile intramoléculaire pourrait être à l’origine des propriétés de