HAL Id: dumas-03019922
https://dumas.ccsd.cnrs.fr/dumas-03019922
Submitted on 23 Nov 2020HAL is a multi-disciplinary open access archive for the deposit and dissemination of sci-entific research documents, whether they are pub-lished or not. The documents may come from teaching and research institutions in France or abroad, or from public or private research centers.
L’archive ouverte pluridisciplinaire HAL, est destinée au dépôt et à la diffusion de documents scientifiques de niveau recherche, publiés ou non, émanant des établissements d’enseignement et de recherche français ou étrangers, des laboratoires publics ou privés.
Impact du strain atrial sur le pronostic d’une
hypertension pulmonaire
Lolita Jaunay
To cite this version:
Lolita Jaunay. Impact du strain atrial sur le pronostic d’une hypertension pulmonaire. Médecine humaine et pathologie. 2020. �dumas-03019922�
UNIVERSITE DE NICE SOPHIA-ANTIPOLIS
FACULTE DE MEDECINE DE NICE
ANNEE UNIVERSITAIRE 2019-2020
**********************
IMPACT DU STRAIN ATRIAL SUR LE PRONOSTIC D’UNE HYPERTENSION PULMONAIRE
THESE POUR LE DIPLOME D’ETAT DE DOCTEUR EN MEDECINE
Présentée et soutenue le 06.10.2020 à la faculté de Médecine de Nice par :
JAUNAY Lolita
Née le 26.02.1993 à Aix-en-Provence (13)
DIRECTEURS DE THESE:
Dr Aude MISSANA
CHU de Nice, Cardiologie
Dr Pamela MOCERI CHU de Nice, Cardiologie
MEMBRES DU JURY:
Pr Emile FERRARI
CHU de Nice, Cardiologie
Président du jury
Dr Fabien SQUARA
CHU de Nice, Cardiologie
Assesseur
1
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
DOYEN Pr. BAQUÉ Patrick
VICE-DOYENS
Pédagogie Pr. ALUNNI Véronique
Recherche Pr. DELLAMONICA Jean
Etudiants M. JOUAN Robin
Chargé de mission projet Campus Pr. PAQUIS Philippe
CONSERVATEUR DE LA BIBLIOTHEQUE Mme AMSELLE Danièle
DIRECTRICE ADMINISTRATIVE DES SERVICES Mme CALLEA Isabelle
DOYENS HONORAIRES M. RAMPAL Patrick M. BENCHIMOL Daniel
2
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
PROFESSEURS CLASSE EXCEPTIONNELLE
M. BAQUÉ Patrick Anatomie ‐ Chirurgie Générale (42.01) M. BERNARDIN Gilles Réanimation Médicale (48.02)
Mme BLANC‐PEDEUTOUR Florence Cancérologie – Génétique (47.02)
M. BOILEAU Pascal Chirurgie Orthopédique et Traumatologique (50.02) M. DARCOURT Jacques Biophysique et Médecine Nucléaire (43.01)
M. DRICI Milou‐Daniel Pharmacologie Clinique (48.03) M. ESNAULT Vincent Néphrologie (52‐03)
M. FUZIBET Jean‐Gabriel Médecine Interne (53.01) M. GILSON Éric Biologie Cellulaire (44.03) M. GUGENHEIM Jean Chirurgie Digestive (52.02) M. HASSEN KHODJA Reda Chirurgie Vasculaire (51.04) M. HÉBUTERNE Xavier Nutrition (44.04)
M. HOFMAN Paul Anatomie et Cytologie Pathologiques (42.03) Mme ICHAI Carole Anesthésiologie et Réanimation Chirurgicale (48.01) M. LACOUR Jean‐Philippe Dermato‐Vénéréologie (50.03)
M. LEFTHERIOTIS Georges Chirurgie vasculaire ; médecine vasculaire (51.04) M. MARQUETTE Charles‐Hugo Pneumologie (51.01)
M. MARTY Pierre Parasitologie et Mycologie (45.02) M.
M.
MICHIELS Jean‐François MOUNIER Nicolas
Anatomie et Cytologie Pathologiques (42.03) Cancérologie, Radiothérapie (47.02)
M. M.
MOUROUX Jérôme PADOVANI Bernard
Chirurgie Thoracique et Cardiovasculaire (51.03) Radiologie et Imagerie Médicale (43.02)
Mme PAQUIS Véronique Génétique (47.04) M. PAQUIS Philippe Neurochirurgie (49.02)
M. PRADIER Christian Épidémio., Économie de la Santé et Prévention (46.01) M. QUATREHOMME Gérald Médecine Légale et Droit de la Santé (46.03)
M. RAUCOULES‐AIMÉ Marc Anesthésie et Réanimation Chirurgicale (48.01) M. ROBERT Philippe Psychiatrie d’Adultes (49.03)
M. SCHNEIDER Stéphane Nutrition (44.04)
3
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
PROFESSEURS PREMIERE CLASSE
Mme ASKENAZY‐GITTARD Florence Pédopsychiatrie (49.04)
M. BARRANGER Emmanuel Gynécologie Obstétrique (54.03) M. BÉRARD Étienne Pédiatrie (54.01)
M. BONGAIN André Gynécologie‐Obstétrique (54.03) Mme BREUIL Véronique Rhumatologie (50.01)
M. CASTILLO Laurent O.R.L. (55.01)
M. CHEVALLIER Patrick Radiologie et Imagerie Médicale (43.02) M. DE PERETTI Fernand Anatomie‐Chirurgie Orthopédique (42.01) M. FERRARI Émile Cardiologie (51.02)
M. FERRERO Jean‐Marc Cancérologie ; Radiothérapie (47.02) M. FONTAINE Denys Neurochirurgie (49.02)
M. GUERIN Olivier Méd. In ; Gériatrie (53.01)
M. HANNOUN‐LEVI Jean‐Michel Cancérologie ; Radiothérapie (47.02) M. JEAN BAPTISTE Elixène Chirurgie vasculaire (51.04)
M. LEVRAUT Jacques Médecine d'urgence (49.02) M. LONJON Michel Neurochirurgie (49.02)
M. PASSERON Thierry Dermato‐Vénéréologie (50‐03) M. PICHE Thierry Gastro‐entérologie (52.01) Mme RAYNAUD Dominique Hématologie (47.01) M. M. ROUX Christian ROSENTHAL Eric Rhumatologie (50.01) Médecine, interne (53.01)
M. STACCINI Pascal Biostat. et Informatique Médicale (46.04) M. THOMAS Pierre Neurologie (49.01)
4
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
PROFESSEURS DEUXIEME CLASSE
Mme ALUNNI Véronique Médecine Légale et Droit de la Santé (46.03) M. ANTY Rodolphe Gastro‐entérologie (52.01)
M. BAHADORAN Philippe Cytologie et Histologie (42.02) Mme BAILLIF Stéphanie Ophtalmologie (55.02) Mme BANNWARTH Sylvie Génétique (47.04)
M. BENIZRI Emmanuel Chirurgie Générale (53.02) M. BENOIT Michel Psychiatrie (49.03)
M. BERTHET Jean‐Philippe Chirurgie Thoracique (51‐03) M. BOZEC Alexandre ORL‐ Cancérologie (47.02) M.
M.
BREAUD Jean BRONSARD Nicolas
Chirurgie Infantile (54‐02)
Anatomie, Chir. Ortho. et Traumatologique (42.01) Mme BUREL‐VANDENBOS Fanny Anatomie et Cytologie pathologiques (42.03)
M. CHEVALIER Nicolas Endocrino., Diabète et Maladies Métaboliques (54.04) Mme CHINETTI Giulia Biochimie‐Biologie Moléculaire (44.01)
M. CLUZEAU Thomas Hématologie (47.01)
M. DELLAMONICA Jean Réanimation médicale (48.02) M. DELOTTE Jérôme Gynécologie‐obstétrique (54.03) M FAVRE Guillaume Néphrologie (44‐02)
M. FOURNIER Jean‐Paul Thérapeutique (48‐04)
Mme GIORDANENGO Valérie Bactériologie‐Virologie (45.01) Mme GIOVANNINI‐CHAMI Lisa Pédiatrie (54.01)
M. IANNELLI Antonio Chirurgie Digestive (52.02)
M. ILIE Marius Anatomie et Cytologie pathologiques (42.03) M. ORBAN Jean-Christophe Anesthésie-réa ; Méd. D’urgence (48.01) M. ROHRLICH Pierre Pédiatrie (54.01)
M. RUIMY Raymond Bactériologie‐virologie (45.01) Mme SACCONI Sabrina Neurologie (49.01)
Mme SEITZ- POLSKI Barbara Immunologie (47.03) M. VANBIERVLIET Geoffroy Gastro‐entérologie (52.01)
5
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
MAITRES DE CONFÉRENCES DES UNIVERSITÉS ‐ PRATICIENS HOSPITALIERS
M. Mme AMBROSETTI Damien BERNARD‐POMIER Ghislaine Cytologie et Histologie (42.02) Immunologie (47.03)
M. CAMUZARD Olivier Chirurgie Plastique (50‐04) Mme CONTENTI‐LIPRANDI Julie Médecine d'urgence (48‐04) M. DOGLIO Alain Bactériologie‐Virologie (45.01) M. DOYEN Jérôme Radiothérapie (47.02)
M. FOSSE Thierry Bactériologie‐Virologie‐Hygiène (45.01) M. GARRAFFO Rodolphe Pharmacologie Fondamentale (48.03) Mme HINAULT Charlotte Biochimie et biologie moléculaire (44.01) M. HUMBERT Olivier Biophysique et Médecine Nucléaire (43.01) Mme LAMY Brigitte Bactériologie‐virologie (45.01)
Mme M.
LONG‐MIRA Elodie LOTTE Romain
Cytologie et Histologie (42.02)
Bactério-virologie ; Hygiène hospitalière (45.01) Mme MAGNIÉ Marie‐Noëlle Physiologie (44.02)
M. MASSALOU Damien Chirurgie Viscérale (52‐02) Mme MOCERI Pamela Cardiologie (51.02) M. MONTAUDIE Henri Dermatologie (50.03)
Mme MUSSO‐LASSALLE Sandra Anatomie et Cytologie pathologiques (42.03) M. NAÏMI Mourad Biochimie et Biologie moléculaire (44.01) Mme POMARES Christelle Parasitologie et mycologie (45.02)
M. SAVOLDELLI Charles Chirurgie maxillo‐faciale et stomatologie (55.03) M. SQUARA Fabien Cardiologie (51.02)
M. TESTA Jean Épidémiologie Économie de la Santé et Prévention (46.01) Mme THUMMLER Susanne Pédopsychiatrie (49‐04)
M. M. TOULON Pierre TRAN Antoine Hématologie et Transfusion (47.01) Pédiatrie (54.01)
6
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
PROFESSEUR DES UNIVERSITES
M. DARMON David Médecine Générale (53.03)
MAITRE DE CONFÉRENCES DES UNIVERSITÉS
Mme GROS Auriane Orthophonie (69)
PROFESSEURS AGRÉGÉS
Mme LANDI Rebecca Anglais
PRATICIENS HOSPITALIERS UNIVERSITAIRES
M. DURAND Matthieu Urologie (52.04) M. SICARD Antoine Néphrologie (52‐03)
PROFESSEURS ASSOCIÉS
M. GARDON Gilles Médecine Générale (53.03) Mme MONNIER Brigitte Médecine Générale (53.03)
MAITRES DE CONFÉRENCES ASSOCIÉS
Mme CASTA Céline Médecine Générale (53.03) M. GASPERINI Fabrice Médecine Générale (53.03) M. HOGU Nicolas Médecine Générale (53.03)
7
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
Constitution du jury en qualité de 4ème membre
PROFESSEURS HONORAIRES
M. AMIEL Jean M. GÉRARD Jean‐Pierre
M. ALBERTINI Marc M. GIBELIN Pierre
M. BALAS Daniel M. GILLET Jean‐Yves
M. BATT Michel M. GRELLIER Patrick
M. BLAIVE Bruno M. GRIMAUD Dominique
M. BOQUET Patrice M. HOFLIGER Philippe
M. BOURGEON André M. JOURDAN Jacques
M. BOUTTÉ Patrick M. LAMBERT Jean‐Claude
M. BRUNETON Jean‐Noël M. LAZDUNSKI Michel
Mme BUSSIERE Françoise M. LEFEBVRE Jean‐Claude
M. CAMOUS Jean‐Pierre M. LE FICHOUX Yves
M. CANIVET Bertrand Mme LEBRETON Elisabeth
M. CASSUTO Jill‐Patrice M. MARIANI Roger
M. CHATEL Marcel M. MASSEYEFF René
M. COUSSEMENT Alain M. MATTEI Mathieu
Mme CRENESSE Dominique M. MOUIEL Jean
M. DARCOURT Guy Mme MYQUEL Martine
M. DELLAMONICA Pierre M. ORTONNE Jean‐Paul
M. DELMONT Jean M. PRINGUEY Dominique
M. DEMARD François M. SANTINI Joseph
M. DESNUELLE Claude M. SAUTRON Jean Baptiste
M. DOLISI Claude M. SCHNEIDER Maurice
Mme EULLER‐ZIEGLER Liana M. THYSS Antoine M. FENICHEL Patrick M. TOUBOL Jacques
M. FUZIBET Jean-Gabriel M. TRAN Dinh Khiem
M. FRANCO Alain M. VAN OBBERGHEN Emmanuel
M. FREYCHET Pierre M. GASTAUD Pierre
M.C.U. HONORAIRES
M. ARNOLD Jacques M. GIUDICELLI Jean
M. BASTERIS Bernard M. MAGNÉ Jacques
M. BENOLIEL José Mme MEMRAN Nadine
Mlle CHICHMANIAN Rose‐Marie M. MENGUAL Raymond
Mme DONZEAU Michèle M. PHILIP Patrick
M. EMILIOZZI Roméo M. POIRÉE Jean‐Claude
M. FRANKEN Philippe Mme ROURE Marie‐Claire
8
Liste des enseignants au 1er septembre 2020 à la Faculté de Médecine de Nice
PROFESSEURS CONVENTIONNES DE L’UNIVERSITE
M. BERTRAND François Médecine Interne
M. BROCKER Patrice Médecine interne Option Gériatrie M. CHEVALLIER Daniel Urologie
Mme FOURNIER-MEHOUAS Manuella Médecine Physique et Réadaptation M. JAMBOU Patrick Coordination prélèvements d’organes M. LEBOEUF Mathieu Gynécologie-Obstétrique
Mme NADEAU Geneviève Uro-Gynécologie M. ODIN Guillaume Chirurgie maxilo-faciale M. PEYRADE Frédéric Onco-Hématologie M. PICCARD Bertrand Psychiatrie
9
R
EMERCIEMENTS
Aux membres du jury :
Pr FERRARI Emile, vous me faites l’honneur de présider le jury de ma thèse, vous avez participé de façon bienveillante à ma progression au cours de mon internat, je vous remercie pour les cours et conseils que vous avez pu me donner tout au long de ma formation.
Dr MOCERI Pamela, tu m’as fait l’honneur de diriger ce travail, je te remercie pour le temps que tu y as consacré, mais aussi pour m’avoir fait progresser en échographie et en physiopathologie au cours mon stage de pédiatrie et pendant des gardes parfois difficiles.
Dr MISSANA Aude, je te suis très reconnaissante pour l’aide que tu m’as apportée dans mes travaux de fin d’internat, j’ai passé d’excellents moments avec toi à l’hôpital comme en dehors (notamment à Paris, Toulouse et Montpellier pour ce DIU qui m’aura appris à mieux te connaître) et je vous souhaite beaucoup de bonheur avec Medhi et l’heureux événement que vous attendez.
Dr BERKANE Nathalie, ta simplicité, ton calme et ton sourire à toute épreuve m’ont permis de passer un excellent semestre dans ton service, j’ai particulièrement apprécié ta disponibilité et ton aide les fins de journées où mes cheveux se dressaient sur la tête.
Dr SQUARA Fabien, tu as encadré mes premiers pas au CHU, telle une boussole dans le secteur B, ta bonne humeur et tes avis toujours éclairés ont été d’un grand réconfort tout au long de mon internat. Je suis heureuse que tu fasses partie de mon jury de thèse.
10
Au CHU de Nice :
Dr BAUDOUY Delphine, tu as toujours gardé ton calme dans les situations qui m’angoissaient. En partageant tes cheminements de pensée, tu m’as permis de progresser au cours des gardes que nous avons passées ensemble.
Dr BERTORA David, je te remercie pour m’avoir ouvert la porte de ta salle d’écho au cours de mon semestre au A, toujours disponible, toujours bienveillant, ç’a été un bonheur de travailler avec toi.
Dr BUN Sithi, tu as toujours trouvé le temps de répondre à mes questions, tu fais attention au moral des troupes et c’est un plaisir de travailler avec toi.
Dr CHICHE Olivier, même si je n’ai jamais été interne dans ton unité, tu t’es toujours rendu disponible dans les situations difficiles.
Dr DAVID Charlotte, merci pour les nuits calmes (même si je doute encore de leur effet) et ton aide pendant les gardes.
Dr REDJIMI Nassim, je te remercie de m’avoir laissé mettre des mots pendant les visites même si ça te faisait bouillir, ton rire inimitable va me manquer.
Dr SARTRE Benjamin, merci pour tout, pour ces visites aux soins, toujours dans la bonne humeur, pour ces défilés de chaussettes, pour les débriefings dans ton bureau, pour les ETO sans échec, pour les avis illustrés par des graphiques d’une précision mathématique. Pitié, viens me voir à Toulon !
Dr SCARLATTI Didier, merci pour tous ces sushis engloutis en garde, pour les petits cours dans ton bureau, pour ta bonne humeur et pour ta classe en toute circonstance.
Dr SCHOUVER Dan, tu m’as initiée aux échographies de stress en partageant les dernières rumeurs ce qui était toujours très plaisant.
Dr THEODORE Guillaume, merci pour tes avis éclairés et ton humour caustique.
Dr THIRY Michel, merci pour ta bonne humeur inégalable, même la nuit où on n’avait jamais l’impression de te déranger.
Dr WEHRLIN Camille, tu es toujours disponible, pour des coro, des petites pauses nécessaires, ou Uber-Merco, je te souhaite beaucoup de bonheur avec ta petite famille.
Dr LEPORATI Julien, tu m’as permis de me familiariser à la cardiologie pédiatrique avec beaucoup de patience et ta gentillesse est un exemple à suivre.
11
Au CH de Cannes :
Dr BALI Laurent, merci pour toutes les connaissances et théories que tu as partagées avec moi, pour ta bonne humeur même la nuit (même si mon étude reste incomplète, RDV à 4h !)
Dr ESSAYAGH Benjamin, c’est très facile de travailler avec toi, tu te rends toujours disponible pour donner les dernières nouvelles de la littérature.
Dr GARRET Gauthier, toujours agréable, c’est tellement bien d’avoir un paratonnerre sur les gardes !
Dr LAMMENS Edouard, merci pour ta bonne humeur et tes conseils.
Dr LIPRANDI Laurent, ton humeur constante, ton intérêt pour les cas difficiles et pour le café font que c’est un plaisir de travailler avec toi.
Dr LOZBA Andrei, merci pour toute l’aide que tu m’as apportée au cours de mon semestre à Cannes.
Dr TALBODEC Anne, merci pour toutes les ETO que tu m’as faites faire.
Dr ZEMOUR Gilles, merci pour ta disponibilité et pour m’avoir fait suivre cette saison de foot avec humour (il faudra que je te donne les résultats de la cartographie de la terrasse de Cannes).
12
A l’équipe du CH de Fréjus :
Dr Lamit, Dr Alary, Dr Dancea, Dr Ray, Dr Zettelmaier, mon premier semestre passé dans votre service m’a permis d’acquérir les bases de la cardiologie et d’arriver au CHU avec les connaissances nécessaires à ma survie (et à celle de mes patients).
A l’équipe de réanimation de Cannes :
Dr Bertrand, Dr Chambon, Dr Clement, Dr Soler, Dr Winter, merci pour l’infinie patience dont vous avez fait preuve face à l’étendue de mon ignorance de votre spécialité. Je garde un excellent souvenir de mon semestre chez vous (pas que pour les cafés et les M&M’s) car j’ai pu en ressortir avec un bagage précieux pour les situations délicates.
A l’institut Arnault Tzanck :
Je remercie l’équipe d’anesthésie-réanimation : Dr Cady, Dr Camarasa, Dr Causeret, Dr Delachapelle, Dr Lena, Dr Maccario, pour m’avoir initiée aux spécificités de la réanimation cardiaque.
Dr Elbeze et Dr Mihoubi, merci pour tout ce que vous m’avez appris en salle d’échographie.
Dr Drogoul, Dr Durand, Dr Mariottini, Dr Meyer, vous m’avez permis d’assister à de nombreuses procédures et d’étoffer mon bagage cardiologique.
Dr Lopez, Dr Tapia, Dr Teboul, merci pour votre accueil au bloc opératoire.
Aux équipes paramédicales,
vous avez été d’une aide précieuse dans mes premiers pas d’interne, vous restez indispensables au quotidien. J’ai toujours travaillé avec vous dans la bonne ambiance de jour comme de nuit et je garde beaucoup de bons souvenirs dans tous les centres où je suis passée.13
A mes co – internes :
Alexandre, de notre premier semestre ensemble où tu m’as aidée sans compter ton temps jusqu’à mon dernier semestre à Cannes où on a plutôt bu des cafés, je garde d’excellents souvenirs avec toi.
Mohamed, le Sang, notre modèle à tous pour les avis téléphoniques, c’est tellement agréable de travailler avec quelqu’un d’aussi jovial (et de sortir boire des Gin To !)
Maria, j’admire la facilité avec laquelle tu as concilié cet internat et ta vie de famille, j’ai passé un excellent semestre avec toi avec plein de bons moments.
Etienne, tu as rendu mon semestre aux soins intensifs plus facile avec toutes ces petites pauses café dans mon bureau.
Clara, belle Boubouline marseillaise, avec tes montages photos, ton sens aiguisé du jeu de mots (et les capucc’ à la française bien sûr !) tu m’as permis d’atteindre mon objectif de ne faire que rire !
Stéphane, on a fait nos premiers pas d’internes ensemble au CHU et les derniers à Cannes, toujours dans la rigolade, ç’a été un plaisir de travailler, boire des cafés, des Perrier… avec toi.
Julie, te voir devenir un « gros chat » en cardiologie a été un plaisir, j’apprécie toujours une oreille pour les discussions girly au CHU !
Jules, on s’est pas trop vus pendant le travail, mais je garde de bons souvenirs avec toi, aux Chineurs et ailleurs.
Baptiste, ta bonne humeur constante en dépit de cet enchainement de CHU force l’admiration, je te souhaite un rythme un peu plus cool à La Réunion. Les pauses électro au CCT vont me manquer.
Marie, nos internats ont fait qu’on ne s’est pas beaucoup croisées, je te souhaite le meilleur.
Nathan, toujours enthousiaste, tu m’as fait profiter de ton karma de chat blanc pendant quelques gardes et c’était non négligeable !
14
Alexandre Rodiere, tu t’es bien adapté à la cardio et c’était toujours une bonne surprise de te voir arriver en avance aux trans.
Marine, merci pour l’ambiance et les sonorités belges que tu as instillées à l’USIC pendant ton petit passage.
François, toujours prêt à aider, tu as rendu mon premier semestre à Fréjus plus facile.
Léonore, intournable copine de capuccino puis de café noisette, tu as rendu la réanimation plus fun !
Audrey, toutes ces punch lines géniales me resteront en mémoire, je te souhaite beaucoup de bonheur avec ta petite famille.
Julia, avec toutes tes « névroses », on aura bien rigolé ce semestre passé ensemble.
Jimmy, « ninja de néphrologie », j’ai passé un bon semestre avec toi, mais calme toi avec les iono U !
A mes amis :
Juliette, sans qui cette thèse n’aurait probablement jamais existé, tu as toujours été de bon conseil et d’un soutien sans faille. On a partagé tellement de choses pendant ces études, des soirées improbables, des sous-colles infernales, et même un gros chat pendant tes vacances ! Je te souhaite énormément de bonheur avec Fabien.
Adri et Seb, mes alcolocs à mi-temps, et Alexia, merci pour votre accueil toujours chaleureux à Marseille comme à Toulon et pour avoir su faire descendre la pression au cours de ces 10 années d’études. J’ai hâte d’être votre nouvelle voisine !
15
A ma famille :
Natacha, ma sœur, du plus loin que je me souvienne, tu as toujours rendu ma vie plus facile. Je me suis beaucoup reposée sur toi et ton incroyable cerveau, tu m’as souvent manqué pendant ces quelques années à Nice, j’espère que tu viendras plus souvent dans le Var (j’essaierai de t’appâter avec une piscine !)
Maman, je te remercie de m’avoir poussée dans ces études qui me faisaient peur. Merci aussi pour les corrections que tu as apportées à ce travail. Tes conseils sont toujours justes et tu sais trouver les mots pour dédramatiser toutes les situations, tu es un exemple pour moi.
Papa, je te remercie pour la confiance que tu m’as toujours portée, ton soutien pendant ces longues études a été très précieux pour moi.
A mes grands-parents, vous avez porté un regard encourageant à tous mes projets, j’ai passé de merveilleux moment chez vous, et vous voir fiers m’a toujours incitée à travailler plus.
Cédric, tu m’as supportée pendant toutes ces années d’études avec bienveillance et tendresse, tu as toujours été là pour moi, tu m’as soutenue pendant les moments difficiles, tu as participé au développement de mes « super pouvoirs ». Je te remercie pour tout ce que tu m’as apporté et je suis impatiente de continuer l’aventure avec toi à Toulon. Je t’aime.
16
T
ABLE DES MATIERES
RÉSUMÉ ... 17
TABLE DES ILLUSTRATIONS ... 19
TABLE DES ABREVIATIONS ... 20
INTRODUCTION ... 21
I. Hypertension pulmonaire ... 22
II. Ventricule droit ... 27
III. Strain ... 28
IV. Oreillette droite ... 29
OBJECTIFS ... 31
MATÉRIEL ET MÉTHODES ... 33
I. Design et population de l’étude ... 34
II. Echocardiographie 2D : acquisitions et mesures ... 34
III. Analyse statistique ... 35
RÉSULTATS ... 37
I. Caractéristiques démographiques et cliniques de la population ... 38
II. Critère de jugement principal : décès ou transplantation ... 40
III. Critère de jugement secondaire : décès, transplantation ou hospitalisation pour insuffisance cardiaque droite ... 48
IV. Variabilité inter-observateurs ... 51
DISCUSSION ... 52
I. Fonction réservoir de l’OD ... 54
II. Fonction conduit de l’OD ... 55
III. Fonction contractile de l’OD ... 55
IV. Limites ... 56
CONCLUSION ... 57
BIBLIOGRAPHIE ... 59
17
R
ÉSUMÉ
INTRODUCTION : L'hypertension pulmonaire (HTP) est une pathologie mortelle. On sait que la dilatation de l'oreillette droite (OD) est un paramètre prédictif d’évolution défavorable. Nous proposons d’étudier le lien entre la fonction atriale et la survie des patients.
METHODES ET RESULTATS : 81 patients présentant une HTP pré-capillaire suivis au centre de compétence pour l’HTP du CHU de Nice ont été inclus dans notre cohorte pour une étude prospective. Ils ont bénéficié d’un examen clinique, d’une mesure du taux de Brain Natriuretic Peptid (BNP), d’un test de marche de 6 minutes (6MWT) et d’une échocardiographie transthoracique (ETT). A l’aide de l’imagerie par speckle-tracking 2D, nous avons mesuré le strain longitudinal de l’OD (RALS) incluant l’analyse des phases réservoir (RArLS), conduit (RAcLS) et contractile (RActLS) de l’OD, le strain longitudinal de l’OG ainsi que les volumes et les surfaces de l’OD et de l’OG. L'âge médian des patients était de 70,4 ans [66,7 - 72,0] et 57 % étaient des femmes. Après un suivi médian de 19 mois, 25 patients (31 %) sont décédés ou ont été transplantés. Les RArLS, et RActLS étaient réduits dans ce groupe de patients (respectivement p=0,003 ; et 0,008). Après ajustement sur l'âge, la classe de dyspnée NYHA et le taux de BNP, la surface de l’OD (HR=1.15 ; [IC95% 1.07 à 1.23]), la surface de l’OG (HR=1.07 ; [IC95% 1.04 à 1.11]), le RActLS (HR=1.10 ; [IC95% 1.02 à 1.18]), le RArLS (HR=0.9545 ; [IC95% 0.91 à 0.97]), le volume de l’OD (HR= 1.01 ; [IC95% 1.01 à 1.02]) et le volume de l’OG (HR= 1.02 ; [IC95% 1.01 à 1.03]) étaient des facteurs prédictifs indépendants de survie sans transplantation.
CONCLUSION : Dans notre cohorte, la surface, le volume et les fonctions réservoir et contractile de l’OD apparaissent comme des facteurs prédictifs indépendants de la mortalité. L'altération de la fonction réservoir de l’OD représente probablement un indicateur précoce de l’insuffisance ventriculaire droite qui grève le pronostic de l’HTP.
18
A
BSTRACT
INTRODUCTION: Pulmonary Hypertension (PH) is a life-threatening condition. Right atrium (RA) dilatation is a significant prognostic parameter. The aim of our study was to assess atrial function and its relationship with the population’s outcomes.
METHODS AND RESULTS: 81 precapillary PH patients followed in our centre were prospectively enrolled into this cohort study. In addition to clinical assessment, Brain Natriuretic Peptid (BNP) level and 6-minute walk test (6MWT), all patients underwent transthoracic echocardiography. Using 2D speckle-tracking, we assessed right atrial longitudinal strain (RALS) including reservoir (RArLS), conduit (RAcLS) and contractile (RActLS) phases analysis, LA longitudinal strain as well as RA and LA volumes and areas. Patients’s median age was 70.4 [66.7 – 72.0] years and 57% were female. After a median follow-up of 19 months, 25 patients (31%) died or were transplanted. RArLS, and RActLS were reduced in PH patients compared to patients who survived (respectively p=0,003 and 0,008). After adjustment for age, WHO functional class and BNP; RA area (HR=1.15 ; [IC95% 1.07 à 1.23]), LA area (HR=1.07 ; [IC95% 1.04 à 1.11]), RActLS (HR=1.10 ; [IC95% 1.02 à 1.18]), RArLS (HR=0.9545 ; [IC95% 0.91 à 0.97]), RA volume (HR= 1.01 ; [IC95% 1.01 à 1.02]) and LA volume (HR= 1.02 ; [IC95% 1.01 à 1.03]) were independent predictors of outcomes.
CONCLUSION: In our cohort, RA area, volume, reservoir and contraction functions appear as independent predictors of death. The impairment of RA reservoir function likely represents an early indicator of RV failure which affects PH prognosis.
19
T
ABLE DES ILLUSTRATIONS
Tableau 1 : Evaluation du risque chez un patient ayant une HTP pré-capillaire selon les recommandations ESC 2015
Tableau 2 : Probabilité échographique d’HTP chez des patients symptomatiques avec suspicion d’HTP Tableau 3 : Signes échographiques complémentaires suggérant une HTP
Tableau 4 : Caractéristiques de la population à l’inclusion
Tableau 5 : Caractéristiques des patients en fonction du décès ou d’une transplantation ou de la survie
Tableau 6 : Caractéristiques des patients selon le critère de jugement secondaire
Figure 1 : Mesure des diamètres VD
Figure 2 : Déformation d’un objet par rapport à sa forme d’origine décrit par 4 composantes différentes
Figure 3 : Les 3 phases de l’oreillette
Figure 4 : Illustration des acquisitions de strain atrial gauche et droit chez un patient témoin Figure 5 : Risque de décès ou transplantation en analyse univariée
Figure 6 : Risque de décès ou transplantation en analyse multivariée
Figure 7 : Courbes ROC et Kaplan Meier – seuil de BNP pronostique pour la survie sans transplantation
Figure 8 : Courbe ROC – seuil de FEVG pronostique pour la survie sans transplantation
Figure 9 : Courbe ROC – seuil de stade de dyspnée pronostique pour la survie sans transplantation Figure 10 : Courbes ROC et Kaplan Meier – seuil de surface de l’OD pronostique pour la survie sans transplantation
Figure 11 : Courbes ROC et Kaplan Meier – seuil de surface de l’OG pronostique pour la survie sans transplantation
Figure 12 : Courbes ROC et Kaplan Meier – seuil de strain de la fonction contractile de l’OD pronostique pour la survie sans transplantation
Figure 13 : Courbes ROC et Kaplan Meier – seuil de strain de la fonction réservoir de l’OD pronostique pour la survie sans transplantation
Figure 14 : Courbes ROC et Kaplan Meier – seuil de volume de l’OD pronostique pour la survie sans transplantation
20
T
ABLE DES ABREVIATIONS
ASE American Society of Echocardiography AUC Area Under Curve
BNP Brain Natriuretic Peptid
DTDVD Diamètre télé diastolique du ventricule droit EACVI European Association for CardioVascular Imaging ESC European Society of Cardiology
ETT Echocardiographie transthoracique FEOD Fraction d’éjection de l’oreillette droite FEOG Fraction d’éjection de l’oreillette gauche FEVD Fraction d’éjection du ventricule droit FEVG Fraction d’éjection du ventricule gauche HTAP Hypertension artérielle pulmonaire HTP Hypertension pulmonaire
NYHA New York Heart Association OD Oreillette droite
OG Oreillette gauche
PAPm Pression artérielle pulmonaire moyenne PAPS Pression artérielle pulmonaire systolique RALS Right Atrial Longitudinal Strain
ROC Receiver Operating Characteristic SOD Surface de l’oreillette droite SOG Surface de l’oreillette gauche
TAPSE Tricuspid Annular Plane Systolic Excursion VCI Veine cave inférieure
VD Ventricule droit VG Ventricule gauche
VOD Volume de l’oreillette droite VOG Volume de l’oreillette gauche WHO World Health Organization (OMS)
2D 2 dimensions
3D 3 dimensions
21
22
I. Hypertension pulmonaire
L’hypertension pulmonaire (HTP) est une maladie grave et complexe se définissant par l’augmentation de la pression artérielle pulmonaire moyenne mesurée au cathétérisme cardiaque droit au-delà de 20mmHg 1. L’augmentation des résistances vasculaires pulmonaires conduit à une
majoration de la post-charge du ventricule droit, qui va répondre par une dilatation et une hypertrophie ventriculaire droite avec une augmentation des pressions intra-cavitaires. Cette insuffisance cardiaque droite grève le pronostic.
Les symptômes d’HTP sont aspécifiques. Ils incluent une dyspnée, une asthénie, des douleurs thoraciques, une toux sèche et des syncopes.
L’incidence et la prévalence de l’HTP varient en fonction de son étiologie. Elle toucherait jusqu’à 10% de la population des plus de 65 ans2.
L’absence de signe spécifique de l’HTP rend son diagnostic difficile et explique que 85% des patients atteints de cette pathologie soient diagnostiqués aux stades III à IV de la NYHA (New York Heart Association)3 ou de l’OMS, ces stades de dyspnée étant corrélés à la mortalité4’5. Bien que le
diagnostic d’HTP soit établi sur un cathétérisme cardiaque, l’échocardiographie transthoracique (ETT) est l’examen de première intention pour permettre son dépistage ainsi que son suivi6.
Classiquement, l’HTP est classée en 5 groupes en fonction de son étiologie :
- Groupe 1 : hypertension artérielle pulmonaire (HTAP), maladie rare comprenant plusieurs étiologies : idiopathique, héréditaire7, iatrogène, associée aux connectivites, infection par le
VIH, hypertension portale, cardiopathies congénitales, schistosomiase, maladies veino-occlusives ou hémangiomatose capillaire pulmonaire, et l’HTP persistante du nouveau-né. Sa prévalence est estimée, en Europe, entre 15 et 50 personnes par million d’habitants et son incidence entre 2 et 7 personnes par million d’habitants et par an9,10.
- Groupe 2 : HTP associée aux cardiopathies gauches 8, forme la plus fréquente d’HTP, de
pronostic moins sévère, pouvant être due à l’insuffisance cardiaque diastolique ou systolique, aux valvulopathies ou aux cardiopathies congénitales. Sa prévalence dépend de la sévérité de la cardiopathie, allant jusqu’à 60% des patients ayant une insuffisance cardiaque sévère ou un rétrécissement aortique serré et symptomatique.
- Groupe 3 : HTP due à une insuffisance respiratoire, comme la bronchopneumopathie chronique obstructive, les pathologies interstitielles ou autres insuffisances respiratoires obstructives ou restrictives. On retrouve une HTP du groupe 3 chez 47% des patients ayant
23
un diagnostic de syndrome emphysème-fibrose9. Chez les insuffisants respiratoires, la
présence d’une HTP est un facteur déterminant critique pour le pronostic10.
- Groupe 4 : HTP d’origine thrombo-embolique se développant après une obstruction de l’artère pulmonaire suite à une embolie pulmonaire dans la quasi-totalité des cas (sinon, très rarement, HTP d’origine tumorale, congénitale ou parasitaire). L’incidence de l’HTP post embolique est autour de 3% des patients ayant survécu à une embolie pulmonaire11.
Cependant, 25% des patients présentant ce type d’HTP n’avaient pas d’antécédent d’embolie pulmonaire identifié avant la découverte de l’HTP12.
- Groupe 5 : HTP d’étiologie multifactorielle, dont le mécanisme physiopathologique est indéterminé, comme dans les pathologies hématologiques, systémiques (par exemple la sarcoïdose) ou métaboliques.
On distingue l’HTP pré-capillaire (groupes 1, 3, 4 et 5) de l’HTP post-capillaire (groupe 2).
Malgré le développement des traitements de l’HTP, cette pathologie est grevée d’un pronostic sombre. Ainsi, dans le cadre de l’HTP idiopathique, associée aux anorexigènes ou héréditaire, la mortalité à 1 an est estimée entre 9 et 14%13’4 ; elle peut aller jusqu’à 30% pour les HTP associées à la
sclérodermie14. Alors que l’HTP touche plus fréquemment les femmes, le sexe masculin est associé à
un pronostic plus péjoratif15. Elle est un facteur de risque de mortalité indépendant chez les patients
ayant une cardiopathie gauche16.
L’évaluation de la sévérité de l’HTP repose sur plusieurs paramètres : cliniques, échographiques et biologiques. Ces paramètres, détaillés dans le tableau 1, peuvent être difficiles à interpréter lors de pathologies intercurrentes et une approche multimodale de ces patients doit être favorisée.
24
Tableau 1 :
Evaluation du risque chez un patient ayant une HTP précapillaire
selon les recommandations ESC 20156
Déterminants du pronostic (estimation de la mortalité à 1 an)
Risque bas (< 5%) Risque intermédiaire (5-10%)
Risque élevé (> 10%)
Signes cliniques d’insuffisance ventriculaire droite
Absents Absents Présents
Progression des symptômes
Non Lente Rapide
Syncopes Non Occasionnelles (effort
important, orthostatique chez
patient stable par ailleurs) Répétées Classe fonctionnelle de l’OMS I, II III IV Distance parcourue pendant le test de marche de 6 min > 440 m 165 à 440 m < 165 m Epreuve d’effort cardiopulmonaire VO2 max > 15mL/kg/min (>65% de la valeur théorique) Pente VE/VCO2 < 36 VO2 max 11 à 15mL/kg/min (35 à 65% de la valeur théorique) Pente VE/VCO2 entre
36 et 44.9 VO2 max < 11mL/kg/min (<35% de la valeur théorique) Pente VE/VCO2 > 45 Taux sanguin de BNP/NT-proBNP BNP < 50 ng/L NT-proBNP < 300 ng/L BNP 50 – 300 ng/L NT-proBNP 300-1400 ng/L BNP > 300 ng/L NT-proBNP > 1400 ng/L Imagerie (ETT, IRM) Surface OD < 18 cm²
Pas d’épanchement péricardique Surface OD 18-26 cm² Epanchement péricardique absent ou minime Surface OD > 26 cm² Epanchement péricardique Hémodynamique POD < 8 mmHg Index cardiaque > 2.5 L/min/m² SVO2 > 65% POD 8 – 14 mmHg Index cardiaque 2.0-2.4 L/min/m² SVO2 60-65% POD >14 mmHg Index cardiaque < 2.0 L/min/m² SVO2 < 60%
La prise en charge de l’HTP dépend de son étiologie17.
Un traitement diurétique ou une oxygénothérapie peuvent être proposés en cas de surcharge hydrosodée ou d’hypoxémie significative.
25
Une anticoagulation curative est indiquée dans l’HTP post embolique ; ce traitement a également montré un bénéfice sur la survie des HTP idiopathiques, héréditaires et iatrogènes18.
Concernant les HTP du groupe 2, le traitement principal est celui de la cardiopathie sous-jacente19.
Pour les HTP pré-capillaires, il existe différentes classes de traitements spécifiques :
Les anticalciques sont utilisés chez les patients dits « répondeurs »20. Ces patients doivent être
identifiés par un test de vasoréactivité pulmonaire (par monoxyde d’azote inhalé ou prostacyclines en intraveineuse) au cathétérisme cardiaque droit qui montrera une diminution des pressions artérielles pulmonaires moyennes (PAPm) sous le seuil de 40 mmHg (et de plus de 10 mmHg) sans diminution du débit cardiaque1.
Les prostacyclines sont des hormones naturellement produites par les cellules endothéliales qui ont une action anti-agrégant plaquettaire mais aussi cytoprotectrice et antiproliférative21. On
observe chez les patients atteints d’HTP une diminution des taux de prostacyclines dans la circulation pulmonaire22. Il existe des analogues des prostacyclines et des agonistes de leurs récepteurs.
Les antagonistes des récepteurs de l’endothéline ont des propriétés vasodilatatrices et antiproliférantes. En effet, l’endothéline est un puissant vasoconstricteur et un facteur favorisant la prolifération des cellules musculaires lisses, ce qui contribue à l’augmentation du tonus vasculaire pulmonaire et à l’hypertrophie des parois artérielles pulmonaires23.
Les inhibiteurs des phosphodiestérases 5 ont également un effet vasodilatateur sur les artères pulmonaires avec une bonne tolérance par les patients24.
L’endarteriectomie pulmonaire est recommandée en première intention, pour les patients atteints d’HTP d’origine thrombo-embolique et éligibles à la chirurgie25’26. Chez les patients inéligibles,
une angioplastie pulmonaire peut être proposée27.
L’avènement de ces thérapies a permis de diminuer les indications de transplantation pulmonaire. Cependant, elle reste indiquée chez les patients ne répondant pas aux traitements. Du fait d’une pénurie de donneurs d’organes, les délais sur liste d’attente de greffe sont longs et la sévérité de l’HTP souvent augmentée au moment de la transplantation.
L’ETT occupe une place de choix dans les recommandations actuelles de l’European Society of Cardiology (ESC) pour le dépistage et le suivi des patients atteints d’HTP25. Ce rôle central est justifié
par sa disponibilité et le fait que ce soit un examen non invasif, facilement utilisable en pratique courante, bien accepté par les patients. Elle permet d’observer les effets de l’HTP sur le cœur mais aussi d’estimer la pression artérielle pulmonaire. Le principal paramètre étudié est la vélocité du flux
26
d’insuffisance tricuspide (IT) qui permet de déterminer, grâce à l’équation simplifiée de Bernoulli et avec une estimation de la pression de l’OD, la pression artérielle pulmonaire systolique. D’autres signes échographiques sont utilisés en complément pour évaluer la probabilité de l’HTP. Ils sont recherchés au niveau des ventricules, de l’artère pulmonaire et de la veine cave inférieure (VCI)
Les tableaux 2 et 3 illustrent les paramètres permettant d’établir en ETT la probabilité d’HTP selon les recommandations de l’ESC6. En dépit d’un suivi nécessaire en échographie tous les 6 mois, la
place de l’échographie dans l’évaluation pronostique est limitée puisque seuls la présence d’un épanchement péricardique et la surface de l’oreillette droite figurent dans le tableau des cibles thérapeutiques / pronostiques de l’HTAP.
Tableau 2 :
Probabilité échographique d’HTP chez des patients symptomatiques avec suspicion d’HTP
Vélocité du flux d’IT (m/s) Présence d’autres signes échographiques d’HTP
Probabilité échographique d’HTP
< 2.8 ou non mesurable Non Basse
< 2.8 ou non mesurable Oui Intermédiaire
2.9 à 3.4 Non
2.9 à 3.4 Oui Elevée
> 3.4 Non nécessaire
Tableau 3 :
Signes échographiques complémentaires suggérant une HTP
Ventricules Artère pulmonaire Veine cave inférieure (VCI) et OD
Rapport des diamètres de base VD/VG > 1.0
Temps d’accélération dans la chambre de chasse VD < 105
m/s et/ou encoche mésosystolique
Diamètre de la VCI > 21 mm avec diminution du collapsus
inspiratoire <50% lors d’un reniflement ou < 20% lors
d’une inspiration calme Aplatissement du septum
interventriculaire (index d’excentricité VG > 1.1 en systole et/ou en diastole)
Vitesse de régurgitation pulmonaire diastolique
précoce > 2.2 m/s
Surface atriale droite (télésystole) > 18 cm²
Diamètre de l’artère pulmonaire > 25 mm
Des signes échographiques d’au moins deux colonnes différentes doivent être présents pour modifier le niveau de probabilité échographique d’HTP
27
II. Ventricule droit
Le VD est une cavité cardiaque adaptée à un système basse pression : la circulation pulmonaire. Il a une forme triangulaire, en croissant, influencée par les conditions de charge et la forme du septum interventriculaire. Le septum est en théorie concave vers le ventricule gauche mais sa courbure peut s’inverser en cas de surcharge barométrique sur le VD.
Par sa structure complexe, le VD est difficile à évaluer en échographie 2 dimensions (2D). Les diamètres ventriculaires droits sont mesurés de manière courante en ETT. Cette mesure se fait en télédiastole, sur différentes coupes :
- en parasternale grand axe, le diamètre doit être inférieur ou égal à 33 mm28.
- en coupe petit axe, on mesure de nouveau le diamètre de la chambre de chasse proximale mais aussi de la chambre de chasse distale qui doivent être respectivement inférieurs à 35 et 27 mm.
- en coupe 4 cavités, on mesure le ventricule droit au niveau de sa base (normale ≤ 42 mm), au niveau de sa partie moyenne (normale ≤ 35 mm) et dans son grand axe (normale ≤ 86 mm). On peut également mesurer le rapport entre les diamètres ventriculaires droit et gauche qui doit être inférieur à 0,6 en coupe quatre cavités.
28
On estime la fonction longitudinale du ventricule droit via la mesure du TAPSE (tricuspid annular plane systolic excursion) et du pic de l’onde S à l’anneau tricuspide. On mesure le TAPSE en réalisant un tir temps mouvement (TM) sur l’anneau tricuspide en coupe apicale et en mesurant l’excursion de l’anneau tricuspide entre le pic systolique et la télé-diastole. On parle de dysfonction VD en cas de TAPSE inférieur à 16 mm29. Malgré sa réalisation relativement simple il persiste une variation
inter-observateurs avec notamment des valeurs angle-dépendant. La mesure du pic de l’onde S à l’anneau tricuspide en doppler tissulaire est très fréquemment utilisée. Une valeur inférieure à 10 cm/s oriente vers une dysfonction de la paroi libre ventriculaire droite29. Les inconvénients sont le fait qu’il
s’agisse d’une mesure angle dépendant (effet Doppler) et qu’elle ne représente pas la fonction globale ventriculaire mais régionale à l’anneau. Sa valeur, tout comme celle du TAPSE est limitée, en particulier après thoracotomie, endarteriectomie pulmonaire ou transplantation cardiaque.
III. Strain
Figure 2 :
Déformation d’un objet par rapport à sa forme d’origine décrit par 4 composantes
29
Le strain est une technique d’imagerie basée sur le suivi des déplacements de points de référence qui permet d’analyser la déformation d’un objet par rapport à sa forme originelle, comme illustré sur la figure 2. On l’exprime en pourcentage de modification par rapport à la forme initiale : S= ∆L/L0= (L-L0/L0) avec L représentant la longueur de l’objet après déformation et L0 la longueur initiale
de l’objet. Sa mesure peut s’effectuer grâce à différentes méthodes, notamment le 2D Strain se basant sur l’analyse des marqueurs acoustiques en 2D. Elle est réalisable si les conditions d’échogénicité sont suffisantes.
Le strain de l’OD est corrélé à la taille de l’OD, de la VCI et à la fonction ventriculaire droite. Il semble être un facteur prédictif dans les différentes études réalisées chez les patients ayant une HTP du groupe 131.
L’altération du strain de l’OD32 est corrélée avec la dysfonction et la dilatation du VD ainsi
qu’avec l’augmentation du taux de BNP, mais aussi avec la longueur parcourue au TM633. Différentes
études 34
’31 ont montré que l’altération du strain de l’OD est associée à un moins bon pronostic dans
l’HTP du groupe 1.
Bien que l’HTP soit une pathologie du cœur droit, on observe chez les patients HTP ayant une fraction d’éjection du ventricule gauche (FEVG) normale, une altération du strain du VG corrélée à la mortalité35.
IV. Oreillette droite
L’OD se comporte comme un réservoir pendant la systole ventriculaire, comme un conduit en début de diastole et comme une pompe contractile en fin de diastole36. La phase de réservoir
commence après la fermeture de la valve tricuspide et l’OD va s’étirer pour accueillir le sang en provenance des veines caves. La phase de conduit commence à l’ouverture de la valve tricuspide et s’achève juste avant la contraction active de l’OD. Au cours de cette phase, le VD se remplit passivement sans dépense énergétique active de l’OD. La phase contractile contribue ensuite à 15 à 30% du volume de sang du VD en fin de diastole37. La déformation en volume de l’OD est illustrée par
la figure 3. L’étude du strain de l’OD peut être réalisée au cours de ces différentes phases. On mesure la déformation longitudinale de l’OD ou Right Atrial Longitudinal Strain et ses composantes en phase de réservoir, en phase de conduit et en phase contractile.
30
Figure 3 : Les 3 phases de l’oreillette
La surface de l’OD est un facteur pronostique chez les patients atteints d’HTP 29’6. Elle peut
être évaluée par planimétrie à partir d’une coupe 4 cavités, en fin de systole ventriculaire, en commençant par la portion latérale de l’anneau tricuspide jusqu’à la face septale. On considère que l’OD est dilatée au-delà de 18 cm² 29.
La pression de l’OD reflète la fonction diastolique du VD. Elle est donc un facteur pronostique dans l’hypertension pulmonaire. Elle peut être mesurée par cathétérisme cardiaque38 mais également
estimée de façon non invasive par l’échographie cardiaque, classiquement par l’évaluation de la dilatation et de la compliance respiratoire de la VCI39. La coupe sous-costale permet de voir la VCI dans
31
32
L’hypertension pulmonaire est une pathologie complexe au pronostic sombre. De nombreux paramètres sont utilisés pour comprendre précocement les mécanismes aboutissant à l’insuffisance cardiaque. D’autres pathologies intercurrentes peuvent parfois rendre difficile leur interprétation.
Le strain est une technique échographique récente angle-indépendante et le strain de l’OD est corrélé à la surface de l’OD, à la taille de la VCI et à la fonction ventriculaire droite40.
L’objectif principal de notre étude est d’évaluer le strain atrial droit et gauche chez des patients porteurs d’une hypertension pulmonaire pré-capillaire par rapport à une population témoin et d’étudier sa relation avec la survenue d’un décès ou d’une transplantation pulmonaire dans notre population de patients avec hypertension pulmonaire pré-capillaire.
L’objectif secondaire est d’évaluer le rôle pronostique du strain atrial en terme de survenue d’un décès, d’une transplantation pulmonaire ou d’une hospitalisation pour insuffisance cardiaque droite.
33
34
I. Design et population de l’étude
Il s’agit d’une étude monocentrique prospective.
Nous avons inclus de façon consécutive des patients suivis pour HTP pré-capillaire dans le centre de référence au CHU de Nice.
Tous les patients inclus bénéficiaient d’une évaluation clinique avec un examen clinique et détermination du score NYHA, d’une mesure du taux de Brain Natriuretic Peptid (BNP) et d’une ETT.
Entre 2011 et 2020, 81 patients porteurs d’HTP pré-capillaire ont été recrutés dans le centre de référence de l’hypertension pulmonaire au CHU de Nice.
L’hypertension pulmonaire pré-capillaire est définie par cathétérisme cardiaque quand la pression pulmonaire moyenne de repos est ≥ 25 mmHg et la pression capillaire ≤ 15 mmHg.
Les patients étaient éligibles si l’HTP avait été diagnostiquée par cathétérisme cardiaque et si leur échogénicité était suffisante pour réaliser une étude du strain atrial.
Les patients porteurs d’une HTP du groupe 2 (post capillaire) ou ayant une mauvaise échogénicité étaient exclus.
Une évaluation démographique et clinique (âge, sexe, étiologie de l’HTP, traitement spécifique de l’HTP, classification NYHA, BNP) a été réalisée au début de l’étude.
20 volontaires sains ont également été recrutés au CHU de Nice pour réalisation d’une ETT.
II. Echocardiographie 2D : acquisitions et mesures
Echocardiographie conventionnelle : nous avons réalisé les échocardiographies sur un échographe EPIQ-7 avec une sonde X5-1 (Philips Medical system, Andover, MA). Cette analyse comprenait une échocardiographie 2D complète associée à du doppler tissulaire en accord avec les recommandations de l’American Society of Echocardiography (ASE) et de l’European Association for Cardiovascular Imaging (EACVI)29’41.
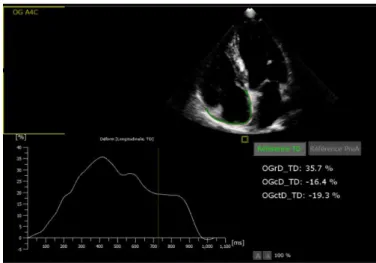
Echocardiographie Speckle Tracking : les échocardiographies 2D ont également été utilisées pour l’analyse du 2D strain des oreillettes grâce au logiciel spécialisé dédié Qlab® de Philips®. Nous avons utilisé le même logiciel pour l’analyse de l’OD et de l’OG. Les coupes 4 cavités avec images centrées sur les oreillettes et enregistrement de l’ECG ont été utilisées. Les fréquences d’images
35
étaient comprises entre 43 et 67 Hz. Les contours des oreillettes ont été tracés manuellement. Le strain longitudinal a été étudié au cours des différentes phases du cycle atrial.
Figure 4 : Illustration des acquisitions de strain atrial gauche et droit chez un patient témoin
III. Analyse statistique
L’analyse statistique a été réalisée à l’aide du Logiciel MedCalc Statistical Software version 19.4.0 (MedCalc Software Ltd, Ostend, Belgium).
Les variables continues distribuées suivant la loi normale ont été exprimées en moyenne ± écart-type, les autres variables quantitatives en médiane [intervalle de confiance 95%]. Les variables qualitatives ont été exprimées en nombre de sujets (pourcentage). Les différences entre les variables continues ont été analysées par le test t de Student dans le cas d’une distribution normale ou par le test de Wilcoxon dans les autres cas. Les données qualitatives ont été comparées à l’aide du test de Fisher.
Le lien statistique entre les différents paramètres étudiés et la survie sans transplantation a été évalué en univarié et multivarié selon la régression à risque proportionnel de COX, en considérant la date de l’ETT comme date initiale. Les patients décédés ou transplantés pour l’analyse du critère de jugement principal, plus les patients hospitalisés pour insuffisance cardiaque pour l’analyse du critère
36
de jugement secondaire, ont été censurés lors de la survenue de l’événement où à la fin du suivi défini par les dernières nouvelles téléphoniques du patient ou sa dernière consultation à l’hôpital s’il n’a pas pu être contacté.
Des courbes ROC ont été construites afin de déterminer les seuils prédictifs des paramètres d’intérêt lors de l’analyse de COX.
La répétabilité des mesures de strain a été vérifiée par comparaison inter-opérateurs en utilisant le coefficient de corrélation intra-classe.
37
38
I. Caractéristiques démographiques et cliniques de la population
Au total, 81 patients suivis en cardiologie pour HTP ont été inclus. 63% avaient une HTP du groupe 1, 7% une HTP du groupe 3 et 26% une HTP du groupe 4. Les caractéristiques des patients à l’inclusion sont résumées dans le tableau 4.
57% étaient des femmes. L’âge médian était de 70 ans [66.7 ; 72.0] et la moyenne d’âge était de 64 ± 17 ans.
Sur le plan clinique, 50% des patients présentaient une dyspnée NHYA II et 41% une dyspnée NYHA III. 42% des patients présentaient des signes cliniques d’insuffisance cardiaque droite au moment de l’ETT.
Sur le plan biologique, le taux de BNP médian au moment de l’ETT était de 143 [108 – 179] pg/mL.
D’un point de vue échographique, les cavités cardiaques droites étaient dilatées avec une surface de l’OD médiane de 25.0 [23 -27] cm², un diamètre du VD moyen de 45 ± 8,8mm avec un TAPSE moyen à 19.5 ± 5,9 mm et une vitesse de l’onde S moyenne à 11.2 ± 2,9 cm/s. Le volume de l’OD médian était de 80 [69 – 94] mL en systole ventriculaire, en diastole, il était mesuré à 47.5 [37 – 59] mL, dont résultait une fraction d’éjection moyenne de l’OD (FEOD) à 38 ± 13,9 %. Les pressions artérielles pulmonaires systoliques (PAPS) médianes ont été estimées par le flux d’insuffisance tricuspide à 69 [65,2 – 76,5] mmHg. La fraction d’éjection du ventricule gauche (FEVG) était supérieure ou égale à 55% chez tous les patients étudiés.
Les valeurs de strain atrial ont été comparées à celles de 20 patients témoins, volontaires sains, d’un âge médian de 30.7 [27,2 ; 41,2] ans. Nous avons observé des valeurs de pic de strain significativement plus basses chez les patients porteurs d’HTP autant dans l’analyse de la fonction réservoir (23.3 ± 11.1 vs 40.1 ± 13.5 % ; p<0.0001) que dans la fonction conduit (-12.7 ± 8.2 vs -10.9 ± 8.26% ; p<0.001) de l’OD. Il n’y avait pas de différence significative de fonction contractile de l’OD entre les patients ayant une HTP et les témoins (-11,9 [-14,5 ; -10,1] vs -9,0 [-12,2 ; -6,0] % ; p=0.39).
Concernant l’analyse du strain de l’OG, nous avons observé une altération significative du pic de strain OG chez les patients atteints d’HTP par rapport aux témoins qui concerne toutes les phases (réservoir, 21.7 [19.8 ; 24.4] vs 52.3 [43.0 – 59.0] % p<0.001 ; conduit, -12.5 [-15.2 ; -9.3] vs -36.3 [-38.1 ; -29.9] % p<0.0001 et contraction, -9.0 [-11.5 ; -7.4] vs -14.4 [-17.7 ; 12.6] % p=0.004).
La durée moyenne de suivi était de 19 mois (la durée de suivi la plus courte était de 2 mois et la plus longue de 100 mois).
39
Tableau 4: Caractéristiques de la population à l’inclusion
Caractéristiques des patients Patients HTP
(n=81) Témoins (n=20) p Age (années) 70,4 [66,7 ; 72,0] 30,7 [27,2 ; 41,2] < 0.0001 Sexe n (%) Femme Homme 46 (57%) 35 (43%) 8 (40%) 12 (60%) 0.22 Groupe HTP n (%) Groupe 1 Groupe 2 Groupe 3 Groupe 4 Groupe 5 51 (63%) 3 (4%) 6 (7%) 21 (26%) 0 NYHA n (%) I II III IV 1 (1%) 38 (50%) 31 (41%) 6 (8%) IVD clinique n (%) 33 (42%) BNP (pg/mL) 143,0 [108,0 ; 179.3] DTDVD (mm) 45,0 ± 8,8 Onde S (cm/s) 11,2 ± 2,9 TAPSE (mm) 19,5 ± 5,9 SOD (cm²) 25,0 [23,0 ; 27,0] VOD systole (mL) 80,0 [69,0 ; 94,0] VOD diastole (mL) 47,5 [37,0 ; 59,0] FEOD (%) 38,4 ± 13,9 PAPS par IT (mmHg) 69,0 [65,2 ; 76,5] FEVG (%) 60,0 [60,0 ; 60,0] E/e’ 6,4 [5,5 ; 7,8] SOG (cm²) 18,0 [16,0 ; 21,0] VOG systole (mL) 42,5 [36,0 ; 53,0] VOG diastole (mL) 17,5 [15,0 ; 23,0] FEOG (%) 52,3 ± 14,1 Strain OD TD (%) Réservoir Conduit Contraction 23,3 ± 11,1 -12,7 ± 8,2 -11,9 [-14,5 ; -10,1] 40,1 ± 13,5 -10,9 ± 8,26 -9,0 [-12,2 ; -6,0] < 0.0001 < 0.0001 0.39 Strain OG TD (%) Réservoir Conduit Contraction 21,7 [19,8 ; 24,4] -12,5 [-15,2 ; -9,3] -9,0 [-11,5 ; -7,4] 52,3 [43,0 – 59,0] -36,3 [-38,1 ; -29,9] -14,4 [-17,7 ; 12,6] < 0.0001 < 0.0001 0.004
40
II. Critère de jugement principal : décès ou transplantation
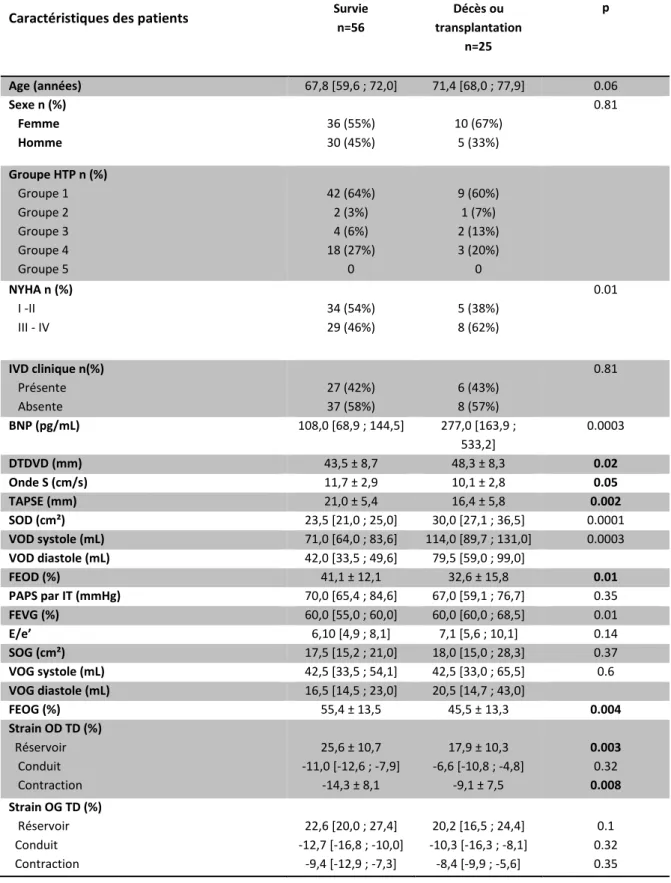
Tableau 5 : Caractéristiques des patients en fonction du décès et de la survie sans transplantation
Caractéristiques des patients Survie
n=56 Décès ou transplantation n=25 p Age (années) 67,8 [59,6 ; 72,0] 71,4 [68,0 ; 77,9] 0.06 Sexe n (%) Femme Homme 36 (55%) 30 (45%) 10 (67%) 5 (33%) 0.81 Groupe HTP n (%) Groupe 1 Groupe 2 Groupe 3 Groupe 4 Groupe 5 42 (64%) 2 (3%) 4 (6%) 18 (27%) 0 9 (60%) 1 (7%) 2 (13%) 3 (20%) 0 NYHA n (%) I -II III - IV 34 (54%) 29 (46%) 5 (38%) 8 (62%) 0.01 IVD clinique n(%) Présente Absente 27 (42%) 37 (58%) 6 (43%) 8 (57%) 0.81 BNP (pg/mL) 108,0 [68,9 ; 144,5] 277,0 [163,9 ; 533,2] 0.0003 DTDVD (mm) 43,5 ± 8,7 48,3 ± 8,3 0.02 Onde S (cm/s) 11,7 ± 2,9 10,1 ± 2,8 0.05 TAPSE (mm) 21,0 ± 5,4 16,4 ± 5,8 0.002 SOD (cm²) 23,5 [21,0 ; 25,0] 30,0 [27,1 ; 36,5] 0.0001 VOD systole (mL) 71,0 [64,0 ; 83,6] 114,0 [89,7 ; 131,0] 0.0003 VOD diastole (mL) 42,0 [33,5 ; 49,6] 79,5 [59,0 ; 99,0] FEOD (%) 41,1 ± 12,1 32,6 ± 15,8 0.01 PAPS par IT (mmHg) 70,0 [65,4 ; 84,6] 67,0 [59,1 ; 76,7] 0.35 FEVG (%) 60,0 [55,0 ; 60,0] 60,0 [60,0 ; 68,5] 0.01 E/e’ 6,10 [4,9 ; 8,1] 7,1 [5,6 ; 10,1] 0.14 SOG (cm²) 17,5 [15,2 ; 21,0] 18,0 [15,0 ; 28,3] 0.37 VOG systole (mL) 42,5 [33,5 ; 54,1] 42,5 [33,0 ; 65,5] 0.6 VOG diastole (mL) 16,5 [14,5 ; 23,0] 20,5 [14,7 ; 43,0] FEOG (%) 55,4 ± 13,5 45,5 ±13,3 0.004 Strain OD TD (%) Réservoir Conduit Contraction 25,6 ± 10,7 -11,0 [-12,6 ; -7,9] -14,3 ± 8,1 17,9 ± 10,3 -6,6 [-10,8 ; -4,8] -9,1 ± 7,5 0.003 0.32 0.008 Strain OG TD (%) Réservoir Conduit Contraction 22,6 [20,0 ; 27,4] -12,7 [-16,8 ; -10,0] -9,4 [-12,9 ; -7,3] 20,2 [16,5 ; 24,4] -10,3 [-16,3 ; -8,1] -8,4 [-9,9 ; -5,6] 0.1 0.32 0.35
41
Le tableau 5 représente les caractéristiques de la population, selon la survenue d’un décès ou d’une transplantation, comparées à celles des patients ayant survécu sans transplantation.
On peut observer, que les patients décédés ou transplantés avaient une dyspnée plus importante puisque 62% (vs 46% chez les survivants, p = 0.01) avaient une dyspnée NYHA supérieure ou égale à III.
Sur le plan biologique, le taux de BNP était significativement plus élevé chez les patients décédés (277,0 [163,9 ; 533,2] pg/mL) que chez les survivants (108,0 [68,9 ; 144,5] pg/mL, p=0.0003).
En échographie, nous avons mis en évidence une dilatation du VD plus importante chez les patients décédés ou transplantés par rapport aux survivants (48,3 ± 8,3 mm vs 43,5 ± 8,7 mm, p=0.02) avec une dysfonction VD significative sur le TAPSE (16,4 ± 5,8 mm vs 21,0 ± 5,4 mm ; p=0.002) et une tendance à la diminution de la vitesse de l’onde S (10,1 ± 2,8 cm/s vs 11,7 ± 2,9 cm/s ; p = 0.05).
L’OD était moins dilatée chez les patients survivants avec une surface médiane de 23,5 cm² [21,0 ; 25,0] (vs 30,0 [27,1 ; 36,5] ; p= 0.0001), un volume en systole de 71,0 [64,0 ; 83,6]mL (vs 114,0 [89,7 ; 131,0] ; p=0.0003). Elle avait également une meilleure fraction d’éjection (41,1 ± 12,1 vs 32,6 ± 15,8 % ; p=0.01).
Nous n’avons pas observé de différence significative sur les PAPs (p=0.35), ni sur le rapport E/e’ (p=0.14) ou les dimensions de l’OG, que ce soit sa surface (p=0.37) ou son volume en systole ventriculaire (p=0.6). En revanche, la fraction d’éjection de l’OG était plus altérée chez les patients décédés (45,5 ± 13,3 vs 55,4 ± 13,5 % ; p=0.004). Inversement, la FEVG était significativement plus élevée chez les patients décédés (60 [60 ; 69] vs 60 [55 ; 60] % ; p=0.01).
En ce qui concerne l’analyse du strain atrial droit, nous avons mis en évidence, chez les patients décédés une altération significative des pics de strain pour les phases de réservoir et de contraction (respectivement 17,9 ± 10,3 vs 25,6 ± 10,7 % ; p=0.003 et -9,1 ± 7,5 vs -14,3 ± 8,1 % ; p=0.008). Cette différence de strain OD n’était pas significative pour la fonction conduit (p=0.32).
L’analyse du strain atrial gauche n’a pas montré de différence significative entre les deux groupes de patients, quelle que soit la phase étudiée (réservoir : p=0,1, conduit : p=0,32 et contraction : p=0,35).
Principaux résultats :
Le taux de BNP et la surface de l’OD étaient significativement plus élevés et le strain des fonctions réservoir et contractile de l’OD étaient significativement altérés chez les patients au pronostic défavorable.
42
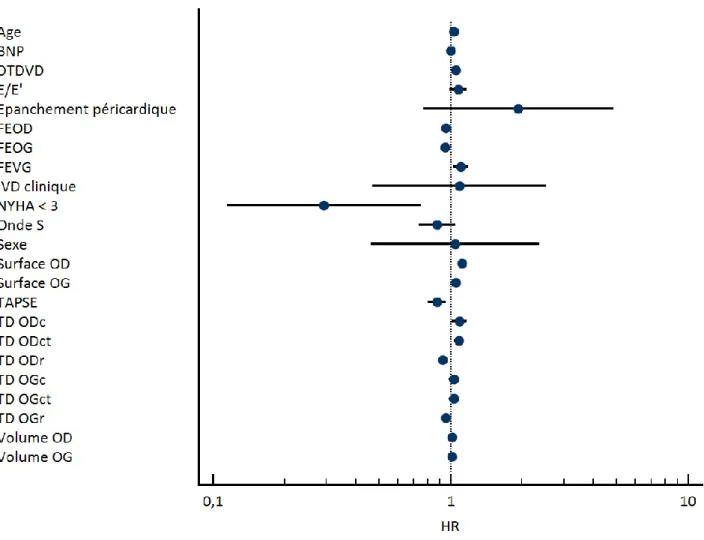
En analyse de survie univariée de COX, illustrée par le forest plot de la figure 5, l’âge (HR=1,0327 [1,0037-1,0624]), la classe NYHA (HR=0,2932 [0,1146-0,7502]), le taux de BNP initial (HR=1,0023 [1,0012-1,0034]), le diamètre télédiastolique du VD (DTDVD, HR=1,0542 [1,0046-1,1062]), le TAPSE (HR=0,8758 [0,8030-0,9553]), le rapport E/e’ (HR=1,0777 [0,9881-1,1755]) la FEOD (HR=0,9556 [0,9227-0,9896]), la surface de l’OD (HR=1,1170 [1,0718-1,1642]) et de l’OG (HR=1,0520 [1,0219-1,0831]), la fraction d’éjection de l’OG (HR=0,9516 [0,9206-0,9837]), la FEVG (HR=1,1047 [1,0287-1,1864]), le strain longitudinal de l’OD aux phases de réservoir, conduit et contraction (respectivement HR=0,9289 [0,8907-0,9688], HR=1,0882 [1,0105-1,1719] et HR=1,0847 [1,0320-1,1400]), le strain longitudinal de l’OG en phase de réservoir (HR=0.9549 [0.9149-0.9966]), le volume maximal de l’OD (HR=1,0140 [1,0076-1,0204]) et celui de OG (HR=1,0129 [1,0014-1,0245]) sont apparus comme des indicateurs prédictifs de décès ou transplantation.
43
En analyse de survie multivariée, illustrée par le forest plot de la figure 6, ajustée sur l’âge, la classe NYHA et le BNP, les paramètres péjoratifs sont :
- L’augmentation de la surface de l’OD (HR=1,1506 [1,0747-1,2318]) et de l’OG (HR=1,0726 [1,0370-1,1094])
- L’altération du strain longitudinal des phases de réservoir (HR=0,9545 [0,9077-0,9732]) et de contraction (HR=1,0975 [1,0222-1,1784]) de l’OD
- L’augmentation du volume de l’OD (HR=1,0139 [1,0057-1,0220]) et de l’OG (HR=1,0178 [1,0054-1,0304]).
-
Figure 6 : Risque de décès ou transplantation en analyse multivariée
-
-
En réalisant des courbes ROC, nous avons pu identifier qu’un taux de BNP supérieur à 150 pg/mL est prédictif d’une issue défavorable (transplantation ou décès) avec une sensibilité de 73.9% et une spécificité de 69.2% (AUC 0.764).
44
Figure 7 : Courbes ROC et Kaplan Meier – seuil de BNP pronostique pour la survie sans transplantation
Une FEVG supérieure à 65% permettrait de prédire le décès avec une sensibilité de 32% et une spécificité de 94.6% (AUC 0.669). Elle est surtout le témoin de l’altération de la FEVD.
Figure 8 : Courbe ROC – seuil de FEVG pronostique pour la survie sans transplantation
La dyspnée stade III ou IV NYHA prédit une issue fatale avec une sensibilité de 72.7% et une spécificité de 61.1% (AUC 0.669).
45
Figure 9 : Courbe ROC – seuil de stade de dyspnée pronostique pour la survie sans transplantation
Une surface de l’OD supérieure à 29 cm² est un indicateur pronostic défavorable avec une sensibilité de 60% et une spécificité de 87.5 % (AUC 0.773). Pour une surface de l’OG supérieure à 28 cm², on a une sensibilité de 30.4% et une spécificité de 90.4% (AUC 0.565).
Figure 10 : Courbes ROC et Kaplan Meier – seuil de surface de l’OD pronostique pour la survie sans transplantation
46
Figure 11 : Courbes ROC et Kaplan Meier – seuil de surface de l’OG pronostique pour la survie sans transplantation
Dans notre étude, un strain longitudinal de la fonction contractile de l’OD supérieur à -14.5% est prédictif de décès avec une sensibilité de 84% et une spécificité de 51.8% (AUC 0.703).
Figure 12 : Courbes ROC et Kaplan Meier – seuil de strain de la fonction contractile de l’OD pronostique pour la survie sans transplantation