Effet de la vitesse de filage sur la structure moléculaire
et étude de la dynamique de différents acides aminés de
soie d’araignée native et supercontractée
Mémoire
Jane Gagné
Maîtrise en chimie - avec mémoire
Maître ès sciences (M. Sc.)
Effet de la vitesse de filage sur la structure moléculaire
et étude de la dynamique de différents acides aminés de
soie d’araignée native et supercontractée
Mémoire
Jane Gagné
Sous la direction de :
Michèle Auger
Normand Voyer
Résumé
La soie d’araignée, notamment la soie produite par la glande ampullacée majeure (Am), est reconnue comme ayant une ténacité élevée, une bonne résistance mécanique tout en demeurant extensible. Sa structure moléculaire et ses propriétés sont influencées par des facteurs externes comme l’humidité relative et la vitesse de filage. La fibre, par exemple, se contracte de près de la moitié de sa longueur lorsqu’elle est exposée à une humidité élevée, un phénomène nommé supercontraction. Cette étude vise à mieux connaître les propriétés de la soie naturelle et à développer éventuellement une fibre synthétique équivalente.
Nous avons caractérisé les fibres de soie Am par spectromicroscopie Raman en lumière polarisée et par résonance magnétique nucléaire (RMN) à l’état solide. La première technique permet de quantifier l’orientation des protéines de soie et de caractériser leur structure secondaire. La RMN permet de déterminer la structure secondaire et la dynamique de relaxation des acides aminés. Les fibres Am de deux espèces d’araignées,
Nephila clavipes et Araneus diadematus, ont été obtenues par filage forcé à différentes vitesses (de 0,3 à 2,0
cm/s) et soumises à des taux d’humidité relative supérieurs à 90%. Deux groupes d’araignées ont été marqués isotopiquement avec des solutions de 1-13C-Gly et 1-13C-Ala afin d’analyser la structure et la
dynamique d’acides aminés particulièrement importants.
Les résultats montrent que l’amplitude de la supercontraction augmente avec la vitesse de filage. Les données indiquent qu’à 1,0 cm/s, l’orientation moléculaire est maximale et qu’elle diminue au-dessus et au-dessous de cette vitesse. Ceci suggère qu’il existe une vitesse de filage pour laquelle les propriétés sont optimales. Les temps de relaxation T1 et T1r des échantillons marqués concordent avec les résultats de spectromicroscopie
Raman et suggèrent que les microcristaux de feuillets b de la soie subissent une contraction qui renforce les liaisons intermoléculaires en présence d’eau.
Abstract
Spider silk, especially the silk produced by the major ampullate glands (Am), is known to have high tenacity, good resistance, and yet remains extensible. Its molecular structure and properties are influenced by external factors such as relative humidity and spinning speed. Fibers, for example, shrink by almost half their length when exposed to high humidity, a phenomenon called supercontraction. This study is intended to better understand the properties of natural spider silk and therefore aid the development of an equivalent synthetic fiber.
We characterized Am silk fibers by polarized-light Raman spectromicroscopy and solid-state nuclear magnetic resonance (NMR). The first technique allows for quantification of the orientation of the protein chains and characterization of their secondary structure. Solid-state NMR is used to determine the secondary structure and dynamics of amino acids. The silk of two spider species, Nephila clavipes and Araneus diadematus, was obtained by forced spinning at different speeds (from 0.3 to 2.0 cm/s) and subjected to relative humidity levels greater than 90%. Two groups of spiders were isotopically labeled with 1-13C-Gly and 1-13C-Ala solutions in
order to analyze the structure and dynamics of particularly important amino acids.
The supercontraction results show that the amplitude of the supercontraction increases with the reeling speed. The data show that at a reeling speed of 1.0 cm/s, the molecular orientation is maximum and decreases above and below this value. This suggests that there is a spinning speed where the properties are optimal. The measurements of the relaxation times T1 and T1r of the labelled samples are consistent with Raman
spectromicroscopy results and suggest that b-sheet microcrystals of silk undergo a contraction which strengthens the intermolecular bonds in the presence of water.
Table des matières
Résumé ... ii
Abstract ... iii
Table des matières ... iv
Liste des figures ... vi
Liste des tableaux ... viii
Liste des abréviations ... ix
Liste des symboles ... x
Remerciements ... xii
Introduction ... 1
Propriétés de la soie ... 1
Structure de la soie ... 2
Supercontraction ... 4
Processus de filage naturel des araignées ... 5
Objectifs du projet ... 7
Chapitre 1 Techniques utilisées ... 9
1.1 Spectromicroscopie Raman ... 9
1.1.1 Effet Raman ... 9
1.1.2 Spectromicroscopie Raman ... 11
1.1.3 Déterminant moléculaire ... 13
1.1.4 Fonction de distribution d’orientation ... 14
1.2 Résonance magnétique nucléaire des solides ... 16
1.2.1 Principes de base : Nucléaire ... 17
1.2.2 Principes de base : Magnétique ... 18
1.2.3 Principes de base : Résonance ... 20
1.2.4 Sensibilité ... 20
1.2.5 Résonance magnétique nucléaire à l’état solide ... 20
1.2.6 Transformée de Fourier et étude de la dynamique ... 21
Chapitre 2 Matériels et méthodes ... 27
2.1 Soie de Nephila clavipes (NC) et d’Araneus diadematus (AD) ... 27
2.2 Préparation des échantillons ... 28
2.2.1 Échantillon pour la spectromicroscopie Raman ... 28
2.2.2 Échantillon pour la RMN à l’état solide ... 29
2.3 Spectromètre Raman ... 31
2.4 RMN à l’état solide ... 32
2.4.1 Mesure de spectres en polarisation croisée à l’angle magique (CPMAS) ... 32
2.4.2 Mesure des temps de relaxation ... 32
Chapitre 3 Effet de la vitesse de filage sur l’orientation moléculaire ... 33
3.1 Effet de la vitesse de filage ... 33
3.2 Paramètre pour caractériser l’orientation moléculaire ... 33
3.3 Résultats ... 34
3.3.1 Effet de la vitesse de filage sur la supercontraction ... 34
3.3.2 Analyse des spectres Raman à différentes vitesses de filage ... 35
3.3.3 Comparaison des spectres Raman de la soie native et supercontractée ... 39
Chapitre 4 Étude de la dynamique des chaînes latérales de la soie ... 42
4.1 Choix des acides aminés à l’étude ... 42
4.2 Résultats ... 43
4.2.1 Mesure en CPMAS de la soie native marquée isotopiquement ... 43
4.2.2 Temps de corrélation et variations des temps de relaxation ... 43
4.2.3 Relaxation et dynamique moléculaire ... 45
Conclusion ... 49
Conclusions ... 49
Perspectives ... 49
Liste des figures
Figure 1 Graphique schématisé de la contrainte en fonction de la déformation de quelques matériaux naturels et synthétiques (Figure modifiée à partir de Gosline et coll2.). ... 1
Figure 2 Effet de la vitesse de filage sur les propriétés mécaniques de la soie de l’araignée
Nephila pilipes de la glande ampullacée majeure (Am)3. ... 2
Figure 3 Schéma d’une fibre de soie d'araignée native où les régions cristallines sont en rouge et les régions amorphes en vert. ... 3 Figure 4 Courbes de contrainte-déformation représentatives des soies de la glande ampullacée majeure d’une gamme d’espèces d’araignées testées à l’état natif (trait plein) et à l’état supercontracté (trait pointillé). Le pourcentage de résidus proline dans la séquence des protéines est indiqué. Chaque espèce est identifiée par une couleur distincte, comme suit: gris, Cyrtophora citricola; rouge, Latrodectus hesperus; noir,
Nephila edulis; brun, Nephila senegalensis; vert, Nuctenea sclopetaria; mauve, Argiope lobata; vert pâle, Argiope argentata; bleu, Araneus diadematus31. ... 5
Figure 5 Illustration de la glande ampullacée majeure et ses diverses sections pour l’araignée Nephila clavipes37. ... 6
Figure 6 A.A à l'étude, à gauche l'Gly et à droite Ala ... 8 Figure 7 Diagramme d’énergie des transitions impliquées durant la diffusion Rayleigh et Raman (Stokes et anti-Stokes), où hu0 est l’énergie incidente, huvib l’énergie
vibrationnelle et Du le déplacement Raman (Figure modifiée à partir de Baker et coll56.). ... 9
Figure 8 Montage optique du spectromicroscope Raman confocal HR800. ... 12 Figure 9 Illustration de la rotation du squelette peptidique selon les angles de rotations dièdres y et f1. ... 13
Figure 10 Déplacement Raman (cm-1) en fonction des différentes structures secondaires
des protéines pour la bande amide I et la bande amide III (Figure adaptée de Tu1.). 14
Figure 11 Systèmes de coordonnées xyz (référentiel de l’unité structurale) et XYZ (référentiel du laboratoire), et angles d’Euler (Figure adaptée de Lefèvre et coll.)62. .. 15
Figure 12 Orientation d’une fibre de soie d’araignée, d’un feuillet b, d’un groupement carbonyle et du tenseur Raman dans le système d’axes référentiel pour l’analyse en spectroscopie Raman. ... 16 Figure 13 Effet de l’application d’un champ magnétique externe sur la dégénérescence des niveaux d’énergie de spin. ... 18 Figure 14 Schématisation d’un noyau de spin non nul, du moment cinétique de la masse et du moment magnétique de la charge. ... 18 Figure 15 Particules sans champ magnétique extérieur (à gauche) et avec champ magnétique extérieur (à droite) où la précession de Larmor est représentée. ... 19 Figure 16 Application de la transformée de Fourier. ... 22 Figure 17 Orientation et précession d’un noyau de spin ½ dans un champ magnétique constant B0 qui définit l’axe z. ... 23
Figure 19 Filière et soie de la glande ampullacée majeure (fil de survie) vue sous binoculaire ... 27 Figure 20 Montage pour le filage forcé des araignées ... 27 Figure 21 Préparation d'échantillon pour la spectromicroscopie Raman. En A, nous observons l’éprouvette avec une bobine de soie d’araignée Araneus diadematus où un papier collant permet d’avoir une fibre tendue. En B, nous voyons comment la soie est transférée sur une éprouvette pour les études en spectromicroscopie Raman. En C, nous observons une lamelle sur laquelle une fibre de soie d’araignée est déposée et fixée pour limiter les mouvements. ... 28 Figure 22 Tube à hydrolyse utilisé pour la soie d’araignée ... 30 Figure 23 Spectres Raman polarisés typiques en xx et zz d'une fibre de soie ampullacée majeure d’Araneus diadematus. ... 34 Figure 24 Effet de la vitesse de filage sur l’amplitude de la supercontraction d’une fibre de soie d’araignée (AD) ... 35 Figure 25 Spectres polarisée xx et zz de la soie de la glande ampullacée majeure native et supercontractée de l'araignée Araneus diadematus obtenue par filage forcé à une vitesse de 1,0 cm/s. Les spectres sont normalisés de sorte que le maximum du pic en Ixx soit égal pour la bande amide I. ... 36 Figure 26 Effet de la vitesse de filage sur la largeur de la bande amide I et sur sa position pour les fibres de soie ampullacée majeure native et supercontractée de l’araignée
Araneus diadematus. Les spectres sont normalisés de sorte que le maximum du pic
en Ixx soit égal pour la bande amide I. ... 38 Figure 27 Graphique de la largeur à mi-hauteur de la bande amide I en fonction de la vitesse de filage et de la supercontraction pour la soie ampullacée majeure d’Araneus
diadematus. ... 40
Figure 28 Spectre RMN 13C d’une fibre de soie ampullacée majeure native de l’araignée
Nephila clavipes sans marquage isotopique. En bleu, nous pouvons voir la
décomposition spectrale. ... 42 Figure 29 Dépendances des différents temps de relaxation au temps de corrélation tc
(Figure adaptée de Baughman65.). ... 44
Figure 30 A, Spectre 13C CPMAS de la soie marquée 1-13C-Ala native en bleu et
supercontractée en rouge. B, schéma représentatif de la contraction des feuillets b suite à la supercontraction dans une fibre de soie d’araignée. ... 47
Liste des tableaux
Tableau 1 Nombres quantiques de l’électron dans le modèle de Hund-Mulliken ... 17 Tableau 2 Paramètres d'orientation R'' en fonction de la vitesse de filage pour la soie de la glande ampullacée majeure native et supercontractée de l’araignée Araneus
diadematus déterminés à partir de l’intensité de la bande amide I. ... 37
Tableau 3 Effet de la vitesse de filage sur le déplacement Raman et la largeur à mi-hauteur de la bande amide I pour la soie de la glande ampullacée majeure de l'araignée Araneus diadematus. ... 39 Tableau 4 Déplacements chimique observés dans la littérature pour diverses structures secondaires pour 1-13C-Ala et 1-13C-Gly ainsi que les déplacements chimiques
expérimentaux de la présente étude pour la soie ampullacée majeure de l’araignée
Nephila clavipes78, 79. ... 43
Tableau 5 Temps de relaxation 13C T
1r (Gly) en fonction de la température pour la soie de
la glande ampullacée majeure de l’araignée Nephila clavipes à l’état natif. ... 45 Tableau 6 Temps de relaxation 1H T
1 pour la soie native et supercontractée des deux
acides aminés marqués dans la soie ampullacée majeure de Nephila clavipes. ... 46 Tableau 7 Temps de relaxation 13C T
1r pour la soie native et supercontractée des deux
Liste des abréviations
2D Deux dimensions
A ou Ala Alanine
AA Acide aminé
AD Araneus diadematus
ADF Fibroïne d’Araneus diadematus
Am Ampullacée majeure
FID Free Induction Decay G ou Gly Glycine
L ou Leu Leucine
MaSpI Spidroïne I de la glande ampullacée majeure de Nephila clavipes MaSpII Spidroïne II de la glande ampullacée majeure de Nephila clavipes
NC Nephila clavipes
P ou Pro Proline
PC Polarisation croisée Q ou Gln Glutamine
RF Radio fréquence
RMN Résonance magnétique nucléaire S ou Ser Sérine
SC Supercontractée ou supercontraction TI Fonction d’impulsion d'inversion TF Transformée de Fourier Y ou Tyr Tyrosine
Liste des symboles
𝛼" Tenseur de polarisabilité
𝛼"# Tenseur de polarisabilité à l’état d’équilibre Bz Champ magnétique externe appliqué
B1 Champ magnétique appliqué
B0 Champ magnétique externe
Beff Champ magnétique effectif
Bd Champ magnétique dipolaire
σ Contrainte à la rupture
E Module de Young
𝐸%⃗ Champ électrique incident du laser
𝐸%⃗# Champ électrique incident à l’état d’équilibre 𝜀 Déformation à la rupture
ℎ Constante de Planck
J Moment cinétique
k Constante de Boltzmann
l Nombre quantique azimutal
M0 Magnétisation provenant de l’échantillon
Mx Vecteur du moment magnétique dans l’axe x
My Vecteur du moment magnétique dans l’axe y
Mz Vecteur du moment magnétique dans l’axe z
m Masse atomique
ml Nombre quantique magnétique
ms Nombre quantique magnétique de spins
n Nombre quantique principale
N(q, f, y) Fonction de distribution d’orientation (dépendant des angles d’Euler q, f et y)
𝑃%⃗ Dipôle induit
q Charge électrique atomique
𝑄%⃗ Coordonnées du mode normal de vibration
𝑄%⃗# Coordonnées à l’équilibre du mode normal de vibration t Durée d’application du champ B1
tc Temps de corrélation
𝜇 Moment magnétique de spin
n Fréquence (Hz)
𝜔 Pulsation (rad/s)
𝛾 Rapport gyromagnétique / Angle d’inclinaison
f Angle azimutal
Y Angle de la rotation de précession
xyz Référentiel de l’unité structurale d’une molécule XYZ Référentiel du laboratoire
Remerciements
J’aimerais tout d’abord remercier ma directrice de recherche Michèle Auger. J’ai eu la chance d’étudier dans un laboratoire de recherche où nous sommes bien plus que des collègues de travail et où des amitiés se forment. J’ai eu l’honneur de côtoyer une grande scientifique, une femme exceptionnelle, attentionnée et passionnée. Je suis certaine qu’elle veille sur nous tous les jours.
« Une grande âme sert tout le monde tout le temps. Une grande âme ne meurt jamais. Elle nous rassemble encore et encore. »
-Maya Angelou
Un gros merci à Normand Voyer et ses étudiants de nous avoir accueillis dans leur laboratoire à bras ouverts. Je tiens également à remercier notre professionnel de recherche Thierry Lefèvre. Tout ce travail est en partie grâce à toi. Tu as su prendre les rênes du laboratoire et assurer son bon fonctionnement. Tous tes conseils autant sur les araignées que sur la spectroscopie m’ont été extrêmement utiles. J’ai très hâte de continuer de travailler avec toi sur notre livre sur la soie d’araignée.
J’ai créé de belles amitiés dans le groupe Auger notamment avec Benji, Gab et Koral. Je vous remercie des beaux moments que vous m’avez fait vivre à vos côtés. Les apéros au bureau vont me manquer ainsi que le fameux Caps. J’ai le regret de vous annoncer qu’il faut maintenant payer notre tricount. J’espère que cette amitié saura survive aux années et à la distance et que Benji nous invitera à NY l’année prochaine (même si je préfèrerais la Cali…).
J’aimerais également remercier la grande famille du Rouge et Or et plus particulièrement la famille du Rouge et Or Basketball. Le sport universitaire m’a fait vivre de merveilleux moments et m’a fait grandir en tant que joueuse et en tant qu’adulte. J’ai eu la chance de rencontrer des personnes exceptionnelles et de tisser de forts liens d’amitié.
Je tiens finalement à remercier ma famille qui m’a toujours soutenue et encouragée dans le sport ainsi que dans mes études. Je suis choyée d’avoir une si belle et grande famille. Merci Papa, Maman, Stef, Mymi et mon fiancé Marco.
Introduction
Propriétés de la soie
La soie d’araignée est un ensemble de matériaux exceptionnels produits par la nature. Les propriétés mécaniques de la soie ampullacée majeure (Am), ou fil de survie, sont supérieurs à de nombreux matériaux, autant naturels que synthétiques. La soie d’araignée Am est reconnue comme étant une fibre avec une ténacité élevée, une bonne résistance mécanique tout en demeurant extensible.
Figure 1 Graphique schématisé de la contrainte en fonction de la déformation de quelques matériaux naturels et synthétiques (Figure modifiée à partir de Gosline et coll2.).
Pour caractériser les propriétés mécaniques d’étirement, on mesure la contrainte en fonction de l’élongation. Quelques matériaux sont représentés schématiquement à la Figure 1. La force nécessaire pour briser un matériau, plus précisément la tension nécessaire, se nomme la contrainte à la rupture (σ). C’est une mesure de force par unité de surface exprimée en N/m2. Ainsi, la force à appliquer pour briser la soie d’araignée est du
même ordre que celle nécessaire pour briser l’acier2. La Figure 1 montre également la déformation à la
rupture (𝜀), soit le pourcentage d’élongation par rapport à la longueur initiale. Pour la soie Am, elle est d’environ 37 % tandis que celle de l’acier s’approche de 1 %. L’aire sous la courbe représente l’énergie nécessaire pour briser le matériau, que l’on appelle résistance. Celle de la soie Am surpasse la plupart des matériaux synthétiques, dont le Kevlar, une fibre bien connue dans le domaine du textile pour ses propriétés mécaniques remarquables, et l’acier.
Kevlar
Acier Cellulose Tendon
Soie B. mori
Soie d’araignée (fil de survie) Déformation (%) C ont ra int e GP a
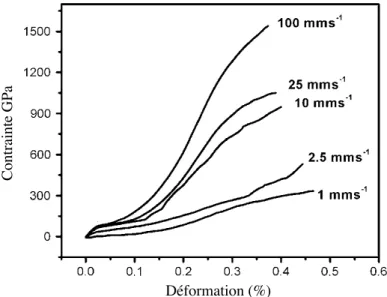
La soie étant produite au cours d’un processus complexe impliquant une traction exercée par l’araignée (voir section Processus de filage), les propriétés mécaniques de la soie sont influencées par la vitesse de filage (Figure 2). Plus la vitesse de filage est élevée, plus la contrainte à la rupture est grande, ce qui indique une fibre plus solide. La déformation à la rupture tend, elle, à diminuer, montrant que la soie devient plus cassante. Le module de Young, qui correspond à la pente initiale de la courbe tension-élongation, augmente avec la vitesse de filage, ce qui indique que la soie devient de plus en plus rigide. Finalement, la limite d’élasticité augmente également avec la vitesse de filage dénotant une fibre plus dure.
Figure 2 Effet de la vitesse de filage sur les propriétés mécaniques de la soie de l’araignée Nephila pilipes de la glande ampullacée majeure (Am)3.
La supercontraction (SC) est un phénomène qui influence aussi les propriétés mécaniques de la soie, entre autres, en diminuant la rigidité et en augmentant l’extensibilité2, 4, 5. Plus amples détails seront donnés sur
cette contraction provoquée par l’eau.
Structure de la soie
Toutes les araignées sont capables de produire et d’utiliser une variété de soies différentes. Cependant, les araignées orbitèles, qui produisent des toiles circulaires planes, sont celles qui en utilisent le plus. Ces araignées peuvent produire jusqu’à sept types de soies, toutes ayant des fonctions biologiques diverses. Chaque soie provient d’une glande précise située dans les filières, qui se trouvent sur l’abdomen de l’araignée2, 6. La soie est constituée de protéines fibreuses nommées spidroïnes. La structure primaire des
spidroïnes, c’est-à-dire leur séquence d’acide aminé (AA), contrôle en partie l’arrangement moléculaire dans la fibre. Le processus de filage est l’autre facteur intervenant dans la structure tridimensionnelle de la soie.
merging of the silk fibril segments was observed with AFM
(Fig. 7,a–c). Comparison of Fig. 7 a with Fig. 7, b and c,
clearly shows the difference of ‘‘particle size’’ due to the mergence of the silk fibril segments at higher reeling speed. A model for describing the corresponding nanostructure change with increasing reeling speed is illustrated in Fig. 7, d–f. An alternative explanation for the decrease of the
intercrystallite distance above 10 mms!1 may be obtained
from the relation between the nucleation rate and reeling speed. According to Eq. 4, the crystallite density within the silk rises with the increasing reeling speed. Accordingly, the intercrystallite distance becomes shorter as the reeling speed increases.
The above results on the size measurement of silk fibril segments using AFM (40–80 nm), together with the results of the crystallite size (2–7 nm) and intercrystallite distance
(13–18 nm) measured with x-ray diffraction confirm the correctness of the relationship between crystallite and silk fibril segments proposed in Fig. 1, i.e., that each silk fibril segment consists of several crystallites connected by non-b-structures. This feature of the nanostructure of spider dragline silk may play an important role in contributing to its high mechanical performance.
The relation between the nanostructure and mechanical property
The mechanical properties of spider dragline silk vary considerably with the reeling speed (Fig. 8). The stress-strain curves start to deviate from the first linear part at the yield point. The stress and strain at the yield point are called ‘‘yield stress’’ and ‘‘yield strain’’, respectively, and the slope of the stress-strain curve between the origin and the yield point is Young’s modulus (31). These parameters can be calculated from stress-strain curve and the results are
shown in Figs. 8 b and 9. The physical properties of silk
should be determined at the molecular level by a number of structural factors, such as crystallite size and orientation, and
FIGURE 8 Comparison of silks drawn at different speeds from spider N. pilipes. (a) Stress-strain curve. The curves start to deviate from the first linear part at the yield point. The stress and strain at the yield point are called ‘‘yield stress’’ and ‘‘yield strain’’. respectively. (b) The slope of the stress-strain curve ina versus strain at low strain showing the yield point. (Inset)
Design of Superior Spider Silk 4533
Déformation (%) C ont ra int e GP a Contrainte à la rupture
Le poids moléculaire des spidroïnes Am est d’environ 350 kDa7. La structure secondaire des protéines
influence les propriétés mécaniques et biologiques de la soie. La soie Am est reconnue comme étant un biomatériau des plus résistants. L’araignée utilise ce type de soie pour le cadre et les rayons de sa toile, en plus de fil de survie pour échapper aux prédateurs. Il s’agit ainsi d’un matériau ayant une très bonne résistance à la traction et une excellente extensibilité8. La glande Am exprime en fait deux spidroïnes, MaSpI
(Major ampullate spidroin I) et MaSpII (Major ampullate spidroin II) 9, qui constituent respectivement 81 % et
19 % de la soie de Nephila clavipes (NC)10. Le ratio entre MaSpI et MaSpII varie selon l’espèce d’araignée, ce
qui influence les propriétés de la soie10, 11.
Les deux spidroïnes possèdent de fortes ressemblances. Les régions situées aux extrémités, soit les séquences non répétitives N-terminale et C-terminale, sont hautement conservées pour les différents types de soie et les espèces d’araignées7, 12, 13. De plus, les deux protéines comportent un long domaine central répétitif
de type copolymère bloc qui alterne des régions riches en glycine (Gly) et des régions riches en alanine (Ala)14. La spidroïne 1 (MaSpI) contient des motifs polyalanine (poly-A), GA et GGX où X peut-être Y (Tyr), L
(leu) ou Q (Gln)12. Les séquences de poly-A peuvent enchainer de 3 à 7 résidus Ala et se trouvent à chaque
bout de chaine12. Ainsi l’empilement des chaînes protéiques est favorable et il y a formation de nanocristaux
de feuillets β. Ces feuillets b sont alignés dans l’axe de la fibre. Ils sont responsables de la rigidité de la fibre9, 15, la quantité de feuillets β dictant la cristallinité de la soie. Les motifs GGX ne permettent pas un repliement
aussi efficace que pour les séquences poly-A16. Ainsi, on obtient une phase amorphe désordonnée, qui
constitue la majeure partie de la soie, et qui disperse la phase cristalline (Figure 3)9. Les motifs GGX se
retrouvent sous forme d’hélices 31, de coudes et de segments désordonnés dans la matrice amorphe.
La plus grande différence entre MaSpI et MaSpII est la quantité de résidus proline (Pro). Pour NC, MaSpI ne contient pas de résidus Pro tandis que MaSpII en contient 15 %. On retrouve généralement la Pro dans les motifs GPGXX17. Celui-ci se replie sous forme de coudes β contribuant au domaine semi-amorphe et
désordonné et procure de l’extensibilité et de la mobilité aux chaines polypeptidiques18, 19. Une importante
corrélation existe entre l’abondance de résidus Pro dans la spidroïne MaSpII, l’extensibilité de la soie Am et l’amplitude de la SC5, 9 (voir section suivante).
Figure 3 Schéma d’une fibre de soie d'araignée native où les régions cristallines sont en rouge et les régions amorphes en vert.
Guerette et coll.20 ont répertorié quatre fibroïnes (ADF-1, ADF-2, ADF-3, ADF-4) différentes pour l’espèce
Araneus diadematus (AD). Dans le cas de la glande Am, les protéines qui la composent sont 3 et
l’ADF-4 selon un ratio de 3:2. Contrairement à NC, ces deux spidroïnes sont riches en Pro. L’ADF-3 contient un bloc cristallin riche en Ala (ASAAAAAA) et plusieurs blocs riches en Gly et en Pro (GPGGQGPYGPG, GGYGPGS et GPGQQ) pour la phase amorphe. En ce qui concerne l’ADF-4, le bloc donnant lieu à un milieu cristallin est SSAAAAAAAA et ceux donnant lieu à des domaines amorphes sont GPGSQGPS et GPGGY20. En général,
les deux spidroïnes ont une composition en Ala, Pro et Gly similaire tandis que leur composition en serine (Ser) et en Gln varient, ce qui influence des propriétés comme l’hydrophobicité et la solubilité21. Dans la
plupart des cas, la composition en feuillets β constitue 29 % de la structure secondaire du fil de survie d’AD. On retrouve des coudes β à 12-15 % et des hélices 31 à 19 %22.
Supercontraction
Lorsque la soie est soumise à une humidité élevée ou est mouillée par l’eau, la fibre se contracte longitudinalement tandis que son diamètre augmente4. La contraction peut aller jusqu’à 50 % de la longueur
initiale de la fibre4. Ce phénomène est connu sous le nom de supercontraction (SC). Son amplitude dépend de
l’espèce d’araignée, du type de soie et de la vitesse de filage23, 24.
Lors de ce phénomène, les molécules d’eau s’infiltrent dans la microstructure de la soie, perturbant ainsi le réseau de liaisons hydrogène, ce qui entraine une augmentation de la mobilité des chaines polypeptidiques. De ce fait, celles-ci se replient spontanément, amenant l’entropie à son maximum et cause la contraction et le gonflement de la fibre25. Les liaisons hydrogène dans la phase amorphe sont perturbées par l’insertion des
molécules d’eau, car celles-ci ont un effet plastifiant, alors que les feuillets β ne semblent pas affectés26-30.
Il a été démontré que l’amplitude de la SC est influencée par la composition chimique de la soie. En effet, la quantité de résidus Pro dans la structure affecte la contraction de la soie (Figure 4)23, 31, 32. La Pro se distingue
des autres AA par sa chaîne latérale qui forme un cycle remontant sur son squelette. Cette structure affecte les angles de torsions et empêche l’adoption d’une configuration stable comme les feuillets b ou les hélices a.
Figure 4 Courbes de contrainte-déformation représentatives des soies de la glande ampullacée majeure d’une gamme d’espèces d’araignées testées à l’état natif (trait plein) et à l’état supercontracté (trait pointillé). Le pourcentage de résidus proline dans la séquence des protéines est indiqué. Chaque espèce est identifiée par une couleur distincte, comme suit: gris, Cyrtophora citricola; rouge, Latrodectus hesperus; noir, Nephila edulis; brun, Nephila senegalensis; vert, Nuctenea sclopetaria; mauve, Argiope lobata; vert pâle, Argiope argentata; bleu, Araneus diadematus31.
De plus, la Pro n’a pas de groupes amide pour établir des liaisons hydrogène et stabiliser les structures dans lesquelles elle est impliquée. Pour NC, chaque Pro est associée à quatre autres groupes peptidiques dans la séquence GPGXX, de sorte que ces quatre groupes sont intrinsèquement « désordonnés » par la Pro33, 34. Par
conséquent, cet AA désavantage la formation de structures en hélice α et feuillet β, mais tend à induire des coudes β et γ dans le squelette. Le motif GPGXX perturbe ainsi la structure cristalline de la soie d’araignée34
et augmente l’élasticité de la fibre35. Cependant, certaines espèces d’araignées qui ne possèdent pas de Pro
ou en ont très peu subissent la SC23. Par conséquent, celle-ci ne s’explique pas uniquement par la présence
de Pro23. Goseline et al ont proposé une hypothèse selon laquelle la SC pouvait également être provoquée
par la présence d’AA polaires et chargés36.
Processus de filage naturel des araignées
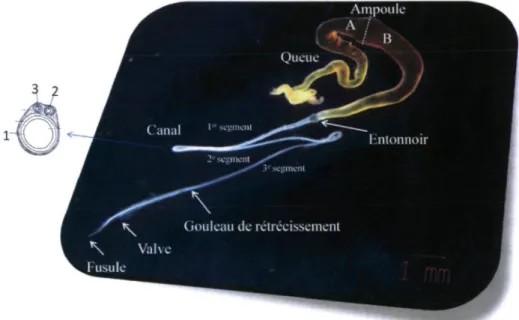
Comme pour toutes les soies, la formation de la fibre Am a lieu dans une glande spécifique. La Figure 5 montre cette glande et ses différentes subdivisions anatomiques. Initialement, la soie est un liquide très
Soie SC Soie native Soie SC Déformation (%) C ont ra int e ( G pa )
visqueux. C’est seulement après avoir traversé la glande Am que la soie se retrouve sous forme de fibre insoluble. Cette transformation est générée par la traction mécanique que l’araignée exerce lorsqu’elle file, que ce soit lors de la construction de sa toile ou la production d’un fil de survie lorsqu’elle se déplace ou qu’elle chute.
Figure 5 Illustration de la glande ampullacée majeure et ses diverses sections pour l’araignée Nephila
clavipes37.
À la Figure 5, on peut voir plusieurs parties de la glande Am, dont la queue, l’ampoule, le goulot de rétrécissement (ou entonnoir), le canal et la valve11. L’ampoule est séparée en deux sections, la section A et la
section B tandis que le canal se divise en trois segments. Le filage commence au moment où les cellules épithéliales de la queue de l’ampoule (zone A) sécrètent les protéines MaSpI et MaSpII. Au départ, les protéines sont solubles dans l’eau et constituées de structures désordonnées et partiellement hélicoïdales empêchant ainsi la soie de se replier prématurément38. La solubilisation des protéines de soie à l’état liquide
est critique, car elle doit à la fois empêcher la précipitation prématurée des protéines tout en permettant une formation rapide d’un fil solide insoluble à la fin du conduit39. En solution, les protéines sont sous forme de
dimères et sont stabilisées par des ponts disulfures.
Les protéines seront transformées en fibre composée de feuillets β et de domaines amorphes au fil de leur parcours dans la glande. Lorsque l’araignée a besoin de soie, les protéines emmagasinées dans l’ampoule se dirigent vers les autres sections de la glande. Les conditions du milieu évoluent au sein de la glande. Le pH varie ainsi de 6,7 dans l’entonnoir à 6,3 quand on se rapproche du canal. Tout au long de ce dernier, le pH
17
feuillets-P ce qui la met aussi du côté des fibres de type p lui conférant des propriétés mécaniques uniques combinant force et élasticité.
1.6 Processus de filage
La fibre de la soie ampullacée majeure est produite par la glande ampullacée majeure présentée à la Figure 1.18. Cette glande se divise en plusieurs parties: la queue, l'ampoule, le canal, l'entonnoir, le gouleau de rétrécissement et la valve.42"44 L'ampoule est divisée en 2 zones, la zone A et la zone B et le canal, lui, se divise en 3 segments. Les protéines MaSpI et MaSpII sont sécrétées dans la queue et la zone A de l'ampoule et sont entreposées dans la zone A et B de l'ampoule où la concentration protéique atteint au moins
Ampoule A / . / B Queue Canal Ic v seemenl 2e segment Entonnoir Gouleau de rétrécissement Valve Fusule
Figure 1.18 : Photo de la glande ampullacée majeure de l'araignée Nephila clavipes avec les différentes régions de la glande et une coupe transversale des 3 segments du canal pour montrer la différence de largeur du canal. Photo de Lefèvre et al.45
passe de 6,3 à 5,7 et la concentration en sel diminue40, 41. Le gradient de pH est maintenu grâce à la présence
d’anhydrase carbonique. Des forces de cisaillements deviennent de plus en plus intenses au fur et à mesure que le diamètre du canal diminue, ce qui provoque l’alignement des chaines de protéine parallèlement à l’axe de la fibre27, 42, 43. Le domaine C-Terminal est alors déstabilisé ce qui permet aux séquences répétitives
d’adopter une structure riche en feuillets β. À un pH d’environ 6, les groupements N-terminal favorisent la formation de la fibre. Cela peut être lié au développement de dimère stables44. C’est également à ce niveau
que le NaCl a le plus grand impact, en effet, le sel influence la structure tertiaire45. Le pH diminue
progressivement dans le canal, ce qui provoque la dimérisation du groupement N-terminal et la synthèse d’homodimères (pH<6) de plus en plus stables46. Finalement, on retrouve quelques sels importants à la
formation de la soie ; CaCl2, NaCl et KCl47, 48. Plus la soie se rapproche de la sortie de la glande, appelée
fusule (spigot en anglais), plus la concentration en ions Na+ et Cl- diminue et plus celle de K+ augmente.
L’absorption de Na+ et la sécrétion de K+ aident au repliement des protéines. Aussi, la sécrétion de H+ aide
dans le processus de repliement en réduisant les charges répulsives sur les molécules. Ainsi, les molécules peuvent se rapprocher favorisant la cristallisation. De ce fait, les molécules peuvent se rapprocher davantage, et établir un réseau de liaisons hydrogène interchaines et former des domaines cristallins48. L’absorption de
Na+ favorise la formation de feuillet b en renforçant les contacts intramoléculaires et en diminuant la solubilité
macromoléculaire. Cela suggère qu'une déshydratation progressive de la protéine favorise la séparation des phases, ce qui se produit lors de la formation de feuillet b. Les liaisons d'ions spécifiques tels que K+
correspondent aux forces prédominantes impliquées dans le changement de conformation49.
Objectifs du projet
La soie d’araignée est un matériau suscitant un grand intérêt pour diverses applications, comme les gilets pare-balles, les fils de parachute et la régénération tissulaire50. Pour utiliser cette protéine dans le futur, il est
primordial de bien connaître son organisation structurale et sa dynamique moléculaire sous différents facteurs externes comme la vitesse de filage et la SC. Quelques études ont déjà fait le point sur l’orientation moléculaire de la soie d’araignée native et SC par spectromiscroscopie Raman, mais jamais l’effet de la vitesse de filage n’a été analysé par cette technique51. L’effet de la vitesse de filage a déjà été analysé par
quelques techniques, dont la diffusion des rayons X, la RMN à l’état solide et par biréfringence52,3, 24.
Cependant, aucune étude n’a analysé l’effet combiné de la vitesse de filage et de la SC sur l’orientation moléculaire. Pour obtenir de l’information sur la dynamique des chaînes polypeptidiques les chercheurs utilisent beaucoup la RMN à l’état solide29, 53, 54. Un nombre restreint d’études ont porté sur la dynamique, plus
précisément sur les temps de relaxation, des groupements carbonyle de différents AA tels que Ala et Gly. L’objectif général de ce projet est de caractériser l’impact de la vitesse de filage sur la SC et sur la structure moléculaire de fibres Am, notamment la structure secondaire et l’orientation des protéines.
De ce fait, la première partie de ce manuscrit porte sur l’effet de la vitesse de filage et de la SC sur l’orientation moléculaire de fibres de soie d’araignée, une étude réalisée par spectromicroscopie Raman. La seconde partie porte sur l’étude de la dynamique des chaînes polypeptidiques via deux AA marqués isotopiquement,
1-13C-Ala et 1-13C-Gly (Figure 6). Le choix de ces deux AA repose sur deux facteurs. Premièrement, la Gly et
Ala sont deux AA présents en grande quantité dans la soie d’araignée. Deuxièmement, ces deux AA se retrouvent dans deux environnements différents au sein d’une fibre de soie d’araignée. La Gly est située principalement dans les régions amorphes de la soie. Quant à Ala, elle se retrouve majoritairement dans les feuillets b qui sont dans les régions cristallines de la soie. La mesure des temps de relaxation T1 et T1r par
RMN à l’état solide sur les protons et les carbones respectivement, nous informent sur la rigidité et la mobilité des AA présents dans deux structures secondaires distinctes au sein de la soie.
Figure 6 A.A à l'étude, à gauche l'Gly et à droite Ala
Chapitre 1 Techniques utilisées
1.1 Spectromicroscopie Raman
1.1.1 Effet Raman
La spectroscopie Raman permet l’analyse des différents modes vibrationnels d’une molécule donnée. La diffusion Raman, ou l’effet Raman implique une diffusion inélastique de la lumière visible, impliquant un échange d’énergie entre le photon incident et la molécule analysée. Ce phénomène optique a été découvert en 1928 simultanément par les physiciens Chandrashekhara Raman et Leonid Mandelstam55. La Figure 7
schématise les transitions vibrationnelles en spectroscopie Raman.
Figure 7 Diagramme d’énergie des transitions impliquées durant la diffusion Rayleigh et Raman (Stokes et anti-Stokes), où hu0 est l’énergie incidente, huvib l’énergie vibrationnelle et Du le déplacement Raman (Figure
modifiée à partir de Baker et coll56.).
Lorsqu’un échantillon est irradié par une source de lumière monochromatique dans le visible, une grande partie de la lumière est diffusée à la même longueur d’onde que celle correspondant au photon incident. Il n’y a dès lors pas d’échange d’énergie entre la molécule et le photon. On parle donc de diffusion élastique, aussi connue sous le nom de diffusion Rayleigh. À l’inverse, la diffusion Raman se produit lorsqu’il y a diffusion inélastique. Ceci implique un échange d’énergie entre le photon incident et la molécule étudiée. Un complexe photon-molécule est alors formé dans un niveau d’énergie virtuel. Étant donné que l’énergie d’excitation n’est pas suffisamment élevée pour atteindre un niveau électronique excité, un photon est réémis et retombe dans un niveau d’énergie plus faible ou plus élevé que le niveau fondamental. Ainsi, la lumière diffusée n’a pas la même longueur d’onde que la lumière incidente. Deux scénarios sont possibles lorsqu’on parle de diffusion Raman. Le premier se produit lorsque la lumière est décalée vers de plus grandes longueurs d’onde, donc à plus faible énergie, et se nomme la diffusion Raman Stokes. Le second se produit lorsque la lumière est
décalée vers de plus courtes longueurs d’onde, donc à plus forte énergie, et se nomme la diffusion Raman anti-Stokes. La différence d’énergie entre le photon incident et celui diffusé est reliée à la composition chimique de l’échantillon et à la structure moléculaire. De ce fait, il est possible d’analyser la composition chimique de l’échantillon selon sa capacité à diffuser la lumière.
Puisque l’intensité du signal en Raman est directement liée au nombre de molécules dans les différents modes vibrationnels, les raies Stokes sont étudiées davantage. En effet, à température ambiante, les modes vibrationnels de basse énergie sont plus peuplés, ainsi les raies Stokes sont plus intenses que les raies anti-Stokes57. La répartition des deux états énergétiques suit la distribution de Boltzmann :
./
.0= 𝑒
3∆567, (1)
où N2/N1 est le rapport entre la population du premier niveau excité par rapport au niveau fondamental, DE est
la différence d’énergie entre chaque niveau du système (J), T est la température en Kelvin (K) et k est la constante de Boltzmann (1,38×10-23 J.K-1).
La variation de la polarisabilité électronique est très importante en spectroscopie Raman. Toutes les molécules possèdent une polarisabilité électronique a, qui peut être exprimée par une faible distorsion du nuage électronique. Au moment où l’échantillon est irradié par le laser, le champ électrique (𝐸%⃗) incident interagit avec les électrons du nuage électronique de la molécule et induit un dipôle (𝑃%⃗), ce qui se traduit par l’équation suivante :
𝑃%⃗ = 𝛼" ∙ 𝐸%⃗, (2)
où 𝛼" est un tenseur de rang 2 décrivant la polarisabilité électronique de la liaison étudiée. L’équation du champ électrique incident à un temps donné est représentée ci-dessous :
𝐸%⃗ = 𝐸%⃗#cos(2𝜋𝜈#𝑡), (3)
où 𝐸%⃗# décrit le champ électrique à l’état d’équilibre et 𝜈# la fréquence de la radiation incidente.
Lorsque l’amplitude de vibration est petite, la polarisabilité est une fonction linéaire du mode normal de vibration 𝑄%⃗ et peut s’exprimer comme :
𝛼" = 𝛼"#+ E
𝜕𝛼"
𝜕𝑄%⃗G#𝑄%⃗#+ ⋯ ,
où 𝛼"# est la polarisabilité de la liaison à la position d’équilibre, IJKL
JM%⃗N#est le taux de variation de 𝛼" par rapport
à la variation de 𝑄%⃗ et 𝑄%⃗# est le vecteur représentant les coordonnées à l’équilibre du monde normal de vibration. Si la liaison étudiée vibre à une fréquence 𝜈, 𝑄%⃗ décrit le déplacement moléculaire et s’écrit :
𝑄%⃗ = 𝑄%⃗#cos (2𝜋𝜐PQR𝑡) (5)
Une vibration sera active en Raman si la vibration entraîne un changement de polarisabilité électronique de la liaison tel que :
E𝜕𝛼"
𝜕𝑄%⃗G# ≠ 0
(6)
Lorsqu’on remplace, dans l’équation du dipôle induit 𝑃%⃗, les paramètres de 𝛼" et 𝐸%⃗ on obtient :
𝑃%⃗ = 𝛼"#∙ 𝐸%⃗#𝑐𝑜𝑠(2𝜋𝜈#𝑡) + E𝜕𝛼"
𝜕𝑄%⃗G#𝑄%⃗#∙ 𝐸%⃗#cos (2𝜋𝜐#𝑡) ∙ cos (2𝜋𝜐PQR𝑡)
(7)
À l’aide de l’identité trigonométrique
cos 𝑥 cos 𝑦 =cos(𝑥 + 𝑦) + cos (𝑥 − 𝑦)
2 , (8) on trouve : 𝑃%⃗ = 𝛼"#∙ 𝐸%⃗#𝑐𝑜𝑠(2𝜋𝜈#𝑡) +] ^I JKL JM%⃗N#𝑄%⃗#∙ 𝐸%⃗#cos(2𝜋(𝜐#− 𝜐PQR)𝑡) +1 2E 𝜕𝛼" 𝜕𝑄%⃗G#𝑄%⃗#∙ 𝐸%⃗#cos (2𝜋(𝜐#+ 𝜐PQR)𝑡) (9)
Les trois termes observés dans la dernière équation correspondent respectivement à la diffusion Rayleigh, la diffusion Raman Stokes et la diffusion Raman anti-Stokes.
1.1.2 Spectromicroscopie Raman
Le spectromètre Raman utilisé dans cette étude est couplé à un microscope optique ce qui permet de focaliser le faisceau laser sur une petite surface et d’atteindre une résolution latérale d’environ 2-3 µm. Ainsi, cette technique est très efficace pour sonder des échantillons comme la soie d’araignée qui possèdent un diamètre pouvant varier entre quelques centaines de nanomètres et 10 µm58. Cette technique est très utile pour obtenir
rectilignement. De plus, il s’agit d’une méthode non destructive où peu de matériel est requis et où il est possible d’analyser une fibre unique de soie. Le faisceau d’un laser vert à argon (514 nm) est utilisé comme raie excitatrice pour les analyses. L’intensité du signal Raman étant proportionnel à `]a, où l est la longueur d’onde, le laser vert permet d’obtenir un rapport signal sur bruit élevé et un faible fond de fluorescence.
Figure 8 Montage optique du spectromicroscope Raman confocal HR800.
Le parcours optique du laser dans le spectromètre Raman est illustré à la Figure 8. La lumière incidente est polarisée selon x ou z (z étant l’axe de la fibre) grâce à une lame demi-onde. Ensuite, le faisceau passe par le filtre holographique Notch. Ce dernier achemine le laser à l’échantillon en passant par le microscope, puis sépare la diffusion Rayleigh de la diffusion Raman issue de l’échantillon. En effet, la lumière transmise qui possède la même longueur d’onde que la lumière incidente est réfléchie sur le filtre Notch, alors que la lumière possédant une fréquence différente de la lumière incidente est transmise par le filtre. Par la suite, la lumière diffusée est sélectionnée selon sa polarisation x ou z grâce à l’analyseur placé devant la fente d’entrée du monochromateur. Pour un échantillon anisotrope, l’intensité de la lumière polarisée diffusée dépendra de l’axe d’orientation privilégié de l’échantillon ainsi que du niveau d’orientation. Avant de se rendre au détecteur, la lumière passe par un trou confocal, augmentant ainsi la résolution en profondeur et réduisant la fluorescence par la même occasion. La lumière atteint ensuite le monochromateur composé d’un réseau holographique qui permet la décomposition de la lumière. Finalement, un miroir focalise la lumière décomposée sur le détecteur. Le détecteur est une caméra CCD (Charge-Coupled Device) qui est sensible sur un grand domaine de longueur d’onde et qui diminue considérablement le bruit de fond lors des analyses.
La configuration du spectromètre Raman permet d’obtenir quatre spectres polarisés linéairement (Ixx, Ixz, Izx,
Izz). Le premier indice correspond à l’axe de polarisation du faisceau incident tandis que le deuxième indique
l’axe de polarisation de la lumière diffusée. Cette technique de caractérisation permet d’étudier divers types d’échantillons comme des solides, des liquides, des gaz, etc. Nous pouvons donc analyser une fibre de soie.
1.1.3 Déterminant moléculaire
L’analyse de la structure secondaire est réalisable en Raman par l’étude des modes de vibration du squelette peptidique. La Figure 9 montre l’orientation spatiale dictée par les angles dièdres y et f des liens peptidiques qui, ultimement, affectent les différents modes de vibration. En effet, le lien peptidique -CONH- est composé d’atomes tous situés dans le même plan. Cela vient du fait que les électrons p du groupe carbonyle entre en résonance avec le doublet d’électrons libres de l’azote. Les liens peptidiques ont ainsi deux degrés de liberté. Le premier correspond à l’angle de rotation C-Ca identifié comme y et le second correspond à l’angle de
rotation autour de la liaison Ca-N identifié comme f.
Figure 9 Illustration de la rotation du squelette peptidique selon les angles de rotations dièdres y et f1.
Un lien peptidique donne lieu à plusieurs types de bandes vibrationnelles dites « amide ». En Raman, les plus étudiées sont les bandes amide I et III, car elles sont sensibles aux structures secondaires. Leur position notamment est affectée par le type de structure secondaire (Figure 10). La bande amide I a majoritairement pour origine l’élongation des groupements carbonyle du squelette et dans une moindre mesure la vibration de déformation du lien N-H dans le plan. La bande amide III, quant à elle, est due à différentes contributions, mais relève particulièrement des vibrations de déformation N-H et d’élongation C-N.
Le projet de recherche consiste en partie à évaluer la conformation et l’alignement des protéines de soie d’araignée. Ainsi, un déterminant moléculaire doit être sélectionné. Dans ce projet de recherche, nous avons opté pour la bande amide I, notamment parce que cette bande donne de l’information sur la structure secondaire et qu’elle est bien définie dans les spectres polarisés. De plus, ce mode de vibration a largement été utilisé dans le passé pour la caractérisation des protéines il est, de la sorte, bien documenté dans la littérature59-61.
Figure 10 Déplacement Raman (cm-1) en fonction des différentes structures secondaires des protéines pour la
bande amide I et la bande amide III (Figure adaptée de Tu1.).
1.1.4 Fonction de distribution d’orientation
La spectroscopie Raman en lumière polarisée linéairement procure de l’information sur l’orientation moléculaire et permet de la quantifier. Pour ce faire, on considère généralement l’orientation dans l’espace de l’unité structurale d’une molécule dans un système d’axes orthogonaux (x, y, z) se retrouvant dans un référentiel XYZ avec les angles d’Euler (q, j, y), (Figure 11). L’angle d’inclinaison g corresponds à l’angle formé par l’unité structurale considérée et l’axe Z. L’angle azimutal f représente la projection du plan XY par rapport à l’axe x. L’angle y corresponds à l’angle de rotation de précession décrivant la rotation de la
AMIDE I
AMIDE III
1680 1660 1640 1300 1260 1220
Hélice α
Feuillet β
Coude β
molécule autour de l’axe z (Figure 11). Ainsi, la distribution d’orientation N(q, j, y) correspond à la probabilité de retrouver l’unité structurale de la molécule avec les angles d’Euler q, j et j. C’est un nombre sans dimension compris entre 0 et 1.
Il est possible de faire quelques hypothèses et ainsi de simplifier N(q, j, j) dans le cas d’une fibre de soie. En effet, les fibres présentent une symétrie uniaxe, de ce fait, le système est anisotrope par rapport à l’axe z, mais est isotrope dans le plan xy. Ainsi, l’angle azimutal j n’est plus nécessaire. De plus, la chaîne polypeptidique possède une symétrie cylindrique autour de son axe z. Ce qui implique que l’angle de torsion y peut également être négligé. Alors, le système peut simplement être décrit en fonction de l’angle q (Figure 11).
Figure 11 Systèmes de coordonnées xyz (référentiel de l’unité structurale) et XYZ (référentiel du laboratoire), et angles d’Euler (Figure adaptée de Lefèvre et coll.)62.
Dans le cas de la soie, on utilise la bande amide I. Le tenseur Raman de ce mode de vibration correspond essentiellement au groupement carbonyle des liens peptidiques qui représente ainsi notre unité structurale (Figure 12). La bande amide I étant dominée par le signal dû aux feuillets b (section 3.2), la caractérisation de l’orientation moléculaire l’est également.
18 2.4.1 Fonction de distribution d’orientation
Considérons un groupement chimique, décrit par un système de coordonnées xyz, aligné dans un référentiel XYZ lié au laboratoire (Figure 2.3). L’orientation moléculaire de ce groupement peut être définie par une fonction de distribution d’orientation & ), M, N . Cette distribution d’orientation représente la probabilité de retrouver cette unité structurale aux angles d’Euler (), M, N). L’angle ), nommé angle d’inclinaison, correspond à l’angle que forme l’unité structurale par rapport à l’axe Z, l’angle azimutal M correspond à la projection du plan XY par rapport à l’axe X et N est l’angle décrivant la rotation de l’unité structurale autour de l’axe z.
Figure 2.3 Systèmes de coordonnées xyz (référentiel de l’unité structurale) et XYZ (référentiel du laboratoire) et les angles d'Euler (figure adaptée de Lefèvre et coll.77).
Dans ce référentiel, la fibre est orientée selon l’axe Z (Figure 2.4). Rappelons que les feuillets β s’alignent préférentiellement dans l’axe de la fibre.78,79 Ainsi, dans une structure majoritairement en feuillets β comme la soie d’araignée, les C=O du squelette polypeptidique se trouvent principalement orientés à 90° par rapport à l’axe de la chaîne peptidique (feuillet β). Le tenseur Raman forme un angle ) avec l’axe de la fibre (Z). Dans ce mémoire, on suppose initialement que l’orientation du
Unité& structurale ! " # $
Figure 12 Orientation d’une fibre de soie d’araignée, d’un feuillet b, d’un groupement carbonyle et du tenseur Raman dans le système d’axes référentiel pour l’analyse en spectroscopie Raman.
Afin de déterminer qualitativement l’orientation moléculaire, on utilise deux rapports d’intensité de la bande amide I calculés à partir des quatre spectres polarisés linéairement. À partir de ces deux rapports, il est possible d’estimer la fonction de distribution d’orientation moléculaire N(q, j, y). On peut également caractériser l’orientation moléculaire plus simplement grâce à un paramètre R’’ calculé à partir du rapport d’intensité des spectres polarisés zz et xx :
𝑅′d = 1 −𝐼ff
𝐼gg
(10)
Lorsque la valeur de R’’ est de 0, on se retrouve en présence d’un matériau isotrope où aucune orientation n’est privilégiée par les molécules. Si les groupements carbonyle sont principalement perpendiculaires à l’axe z (axe de la fibre) alors, les feuillets b sont principalement parallèles à l’axe de la fibre (Figure 12). Plus les feuillets b sont orientés dans l’axe de la fibre, plus R’’ est négatif. À l’inverse, R’’ sera positif lorsque les groupements carbonyle se retrouvent majoritairement parallèles à l’axe z.
1.2 Résonance magnétique nucléaire des solides
La RMN est très pertinente pour l’étude des fibres. Cette technique permet d’obtenir de l’information sur la structure de la soie et d’examiner les interactions, la cinétique et la dynamique de relaxation de divers atomes, donc de différentes régions moléculaires. La taille des molécules étudiées peut aller d’une simple molécule organique à une protéine de plusieurs dizaines de kDa. L’avantage de la RMN tient dans la capacité unique du
19
groupement carbonyle est identique à celle du tenseur amide I, et donc, qu’elle est également décrite par l’angle ). Bien que cette approximation soit plutôt bonne, elle n’en demeure pas moins inexacte en toute rigueur. Ainsi, à la section 4.5.4, l’angle existant entre le tenseur et le C=O est pris en considération et les mesures d’orientation sont corrigées conformément à la procédure décrite à la section 4.7 (Electronic Supplementary Information). Finalement, l’orientation du feuillet β par rapport à l’axe Z est décrite par l’angle 4.
Figure 2.4 Orientation de la fibre, d’un feuillet β, d’un groupement carbonyle et du tenseur Raman dans le système d’axes du laboratoire.
Comme la bande amide I est le déterminant moléculaire choisi pour cette étude, l’unité structurale dont l’orientation est caractérisée est le groupement carbonyle. La soie d’araignée possède une symétrie uniaxiale. Ainsi, si l’on considère une fibre orientée selon l’axe Z, la distribution d’orientation du groupement carbonyle ne dépend alors plus que de l’angle ). La fonction & ) peut alors être développée en une série infinie des polynômes de Legendre :77
&% = P +1 2 . "P$ . "P cos% l Pm3 ! "
spectromètre nucléaire à permettre à la fois l’analyse non destructrice et quantitative des molécules en solution et à l’état solide.
1.2.1 Principes de base : Nucléaire
La spectroscopie RMN est active dans la région des ondes radio. Ce sont les interactions entre le spin (non nul) des noyaux atomiques et le champ magnétique qui sont à la base de cette technique. Les noyaux ont la capacité d’absorber les radiations de radiofréquence (RF), ainsi ils s’orientent lorsqu’ils sont en présence d’un champ magnétique. Lorsque le spin est orienté dans le même axe que le champ appliqué, les noyaux sont plus stables. Ainsi, il s’agit d’une technique de spectroscopie d’absorption.
Le comportement des électrons dans les atomes peut être décrit par le modèle quantique de Hund-Mulliken. Les quatre chiffres quantiques traçant le portrait de ce modèle se trouvent dans le Tableau 1.
Tableau 1 Nombres quantiques de l’électron dans le modèle de Hund-Mulliken
Symbole Nom Analogie
n Nombre quantique principal Niveau d’énergie de l’électron dans l’atome
l Nombre quantique azimutal Moment angulaire orbital de l’électron
ml Nombre quantique magnétique Projection du moment angulaire orbital sur un
axe
ms Nombre quantique magnétique de spins Projection du moment angulaire intrinsèque de
l’électron Grâce à l’équation 11, on peut définir le nombre d’états de spins distincts.
2I + 1, (11)
où l est le spin du noyau.
En l’absence de champ magnétique, toutes les orientations des moments angulaires de spins ont la même énergie et les moments magnétiques nucléaires prennent n’importe quelle orientation dans l’espace. Il s’agit de la dégénérescence (Figure 13).
L’ajout d’un champ externe Bz provoque la subdivision des niveaux d’énergie. Ce phénomène est connu sous
le nom d’effet Zeeman. Plus le champ magnétique est puissant, plus la différence d’énergie entre les états de spin est grande.
Figure 13 Effet de l’application d’un champ magnétique externe sur la dégénérescence des niveaux d’énergie de spin.
1.2.2 Principes de base : Magnétique
On considère un noyau chargé en rotation autour d’un axe de référence z. Ainsi, on doit prendre en considération le moment magnétique dipolaire et le moment cinétique provoqué par la rotation du noyau (Figure 14) :
𝜇 = 𝛾 ∙ 𝐽 , (12)
où 𝛾 est le rapport gyromagnétique (propre à chaque noyau), 𝜇 les moments magnétiques du noyau et J est le moment cinétique.
Figure 14 Schématisation d’un noyau de spin non nul, du moment cinétique de la masse et du moment magnétique de la charge. Charge Moment magnétique µ Masse Moment cinétique J Spin du noyau Masse Moment cinétique (J) Charge Moment magnétique (µ) Masse Moment cinétique (⃗") Charge Moment magnétique ( ⃗#)
Le rapport gyromagnétique est propre à chaque noyau et est donné par :
𝛾 = 𝑞
2𝑚 , (13)
où q est la charge de l’atome et m sa masse.
Quand un champ magnétique externe Bz est appliqué, l’énergie d’interaction entre en jeu. Celle-ci est donnée
par l’équation ci-dessous :
𝐸 = −𝜇f∙ 𝐵f = −𝛾 ∙ ℎ ∙ 𝐼f∙ 𝐵f = −𝛾 ∙ ℎ ∙ 𝐼f∙ 𝐵f
(14)
De plus, le système est entraîné dans un mouvement de précession dite précession de Larmor à une fréquence n et une pulsation 𝜔 telles que :
𝜈(𝐻𝑧) = 𝛾
2𝜋𝐵f (15)
𝜔(𝑟𝑎𝑑 𝑠r ) = 𝛾 ∙ 𝐵f (16)
Quand le rapport gyromagnétique est positif (majorité des cas), alors le sens de la précession a lieu dans le sens des aiguilles d’une montre. On parle alors de précession négative (Figure 15).
Figure 15 Particules sans champ magnétique extérieur (à gauche) et avec champ magnétique extérieur (à droite) où la précession de Larmor est représentée.
1.2.3 Principes de base : Résonance
Les noyaux atomiques peuvent absorber l’énergie d’un rayonnement électromagnétique pourvu que ce dernier corresponde à la différence entre deux niveaux d’énergie. L’énergie d’une onde électromagnétique est définie par l’équation suivante :
∆𝐸 = ℎ𝜈 = 𝛾 ∙ ℎ ∙ 𝐵f∙ ∆𝐼s (17)
Lorsque les noyaux retournent à leur état d’équilibre, une relaxation magnétique longitudinale, c’est-à-dire une résonance, a lieu. Cependant, seules les transitions où Iz = ±1 sont permises selon la règle de sélection. Pour
un champ magnétique constant, des noyaux différents (ex : 1H et 13C) auront des fréquences de précession
différentes. Ainsi, la RMN permet l’excitation sélective des noyaux selon la radiation électromagnétique.
1.2.4 Sensibilité
La RMN est une technique ayant une faible sensibilité. Pendant plusieurs années, il n’était pas envisageable d’analyse d’autres noyaux que celui du proton qui offre une grande abondance naturelle. En effet, la sensibilité d’un noyau dépend de son abondance naturelle, de son rapport gyromagnétique et du nombre de noyaux d’intérêt dans l’échantillon analysé. Le rayonnement électromagnétique fournit une énergie qui induit des transitions d’absorption vers les niveaux excités, conduisant ainsi à un équilibre thermodynamique de spin. Il y a par la suite relaxation des noyaux, ceux-ci retournant à l’état fondamental. Dans le cas où il n’y a pas de relaxation, il y a saturation (population égale) des niveaux d’énergie. Ainsi, l’absorption de la radiation électromagnétique n’est pas possible. La relaxation permet au niveau fondamental de demeurer plus peuplé. Avec la relaxation il est possible de faire plusieurs acquisitions avec l’appareil dans un court laps de temps. L’équation de Boltzmann (Équation 1), vue plus haut dans la section 1.2.1 concernant l’effet Raman, permet de définir pour un noyau donné la sensibilité relative de ce dernier.
1.2.5 Résonance magnétique nucléaire à l’état solide
La majorité des analyses en RMN s’effectue avec des échantillons liquides. Toutefois, depuis les dernières décennies la RMN est devenue une méthode de choix pour l’étude des solides. Cette technique permet de caractériser la structure et la dynamique moléculaire que ce soit pour des verres, des polymères ou encore des protéines. En effet, les échantillons solides peuvent être des poudres, des cristaux, des molécules de haut poids moléculaire en solution, des arrangements supramoléculaires, etc. Le succès de cette technique repose sur les diverses approches permettant l’analyse des distances intermoléculaires, de l’anisotropie, des angles de torsions, de l’orientation atomique, de la diffusion des spins, de la dynamique moléculaire et des processus d’échanges63. Les noyaux les plus souvent employés pour la RMN solide sont ceux possédant un spin de ½ et
Comparativement à la RMN liquide, nous n’obtenons pas de série de transitions très nettes (déplacement chimique isotrope) en RMN solide, car les signaux sont dépendants de l’orientation des molécules par rapport au champ magnétique. De plus, les molécules ne tournant pas rapidement sur elles-mêmes du fait qu’elles sont à l’état solide, nous obtenons un déplacement chimique anisotrope qui représente la somme des orientations des cristallites et qui reflète la probabilité d’orientation avec une dépendance orientationnelle en
3 𝑐𝑜𝑠^𝜃 − 1 (Équation 18).
𝜐(𝜃) = 𝛿Qwx+ 𝛿(3 𝑐𝑜𝑠^𝜃 − 1) 2
(18)
L'anisotropie de déplacement chimique (CSA) est définie comme la différence de déplacement chimique entre les états isotrope (𝛿Qwx) et anisotrope. Ainsi, les déplacements chimiques peuvent fournir des informations
structurelles utiles en raison de leur anisotropie. Les noyaux faisant partie d'un groupe fonctionnel spécifique résonnent à des fréquences différentes en fonction du blindage de l'environnement électronique local et de leur orientation.
La rotation de l’échantillon à une fréquence se situant normalement entre 1 et 130 kHz et à un angle de 54,74° (angle magique) permet d’augmenter la résolution et procure une meilleure analyse des spectres, car la composante dépendante de l’orientation en 3 𝑐𝑜𝑠^𝜃 − 1 s’annule. En effet les bandes normalement larges
deviennent plus étroites (pics isotropes) et les déplacements chimiques donnent de l’information sur la composition de l’échantillon et sur sa structure secondaire.
La séquence CPMAS (cross polarization magic angle spinning) permet d’augmenter le signal et d’améliorer la résolution des spectres. Le signal est augmenté grâce à la polarisation croisée (PC). Celle-ci augmente le signal d'un noyau de faible rapport gyromagnétique (g), et ce, par le transfert de magnétisation d'un noyau de haut g à un de plus faible g. Ainsi, cette technique est très utile pour améliorer le signal des noyaux légèrement couplés tels que l’isotope 13C. L’hydrogène possède un rapport gyromagnétique élevé et transfert donc sa
magnétisation sur les atomes de carbone. Cependant, pour que le transfert soit efficace, il faut respecter la condition de Hartmann-Hahn qui se définit selon l’équation suivante :
𝛾y(𝐵])y= 𝛾z(𝐵])z , (19)
où les indices H et C désignent respectivement les atomes d’hydrogène et 13C.
1.2.6 Transformée de Fourier et étude de la dynamique
La première expérience RMN à transformée de Fourier (TF) remonte au milieu des années soixante, pas loin de 20 ans après la toute première expérience RMN. Initialement, le mode à balayage continu était utilisé. Ce